-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKlinický přínos stanovení zbytkové choroby u nemocných s B-chronickou lymfocytární leukemií
Autoři: V. Procházka
; T. Papajík
Působiště autorů: Hemato-onkologická klinika Fakultní nemocnice Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 4, p. 195-196.
Kategorie: Úvodník
Chronická B-lymfocytární leukemie (B-CLL) byla dlouhá léta považována za konvenčně nevyléčitelné, opakovaně relabující a většinou indolentní onemocnění. Během poslední dekády však došlo k rychlému pokroku v poznání původu a genetických změn nádorového lymfocytu (1). Nově B-CLL chápeme jako geneticky a klinicky velmi heterogenní onemocnění. Ruku v ruce s poznatky základního výzkumu se objevily nové léčebné modality, které umožňují dosáhnout hlubších a déletrvajících remisí. Terapeutický cíl se u většiny nemocných s B-CLL přesouvá od paliativní léčby ke snaze o navození co nejdelší kompletní remise (2).
Donedávna platná kritéria hodnocení léčebné odpovědi National Cancer Institute–Working Group (NCI-WG) z roku 1996 definovala kompletní remisi (CR) pouze na základě klinického vyšetření, hodnot krevního obrazu a morfologického hodnocení kostní dřeně (3). Bylo přesvědčivě prokázáno, že nemocní, kteří dosáhli kvalitní léčebné odpovědi (kompletní remise) mají delší přežití než pacienti s parciální léčebnou odpovědí. Pomocí metod vícebarevné průtokové cytometrie a molekulární genetiky (PCR) však bylo zjištěno, že významná část nemocných, kteří dosáhli kompletní remise dle NCI-WG kritérií měla prokazatelnou minimální reziduální nemoc (minimal residual disease, MRD).
Zavedení imunoterapie a kombinovaných fludarabinových léčebných režimů přineslo zásadní zvýšení účinnosti terapie. Vysoké procento nemocných nyní dosahuje kompletních remisí a objevila se potřeba zpřesnit hodnocení léčebné odpovědi. Revidovaná NCI-WG kritéria z roku 2008 (4) proto doplňují hodnocení remise o možnost stanovení zbytkové nemoci. Za remisi s negativní MRD se považuje stav, kdy je dosaženo redukce nádorového klonu pod 1 buňku B-CLL na 10 000 leukocytů (10-4 ).
V klinické praxi se prosadily dvě metody stanovení zbytkové nemoci: vícebarevná průtoková cytometrie a kvantitativní alelově specifická PCR (ASO-PCR). Čtyřbarevná multiparametrická průtoková cytometrie je rychlá, cenově dostupná a díky publikovaným standardům i reprodukovatelná metoda. Díky kombinací protilátek (nejčastěji CD5/CD19/CD20/CD38 nebo CD5/CD19/CD23/CD45) dosahuje citlivosti 10-4 až 10-5. V případě zastoupení zbytkové populace buněk nad 0,01 % dosahuje cytometrie až 95% konkordance s výsledky ASO-PCR (5, 6). Alelově specifická PCR využívá identifikace maligního klonu pomocí unikátní VH-D-JH přestavbě variabilní části genu těžkého imunoglobulinového řetězce (IgVH). Metoda je technicky náročná a vyžaduje stanovení pořadí bází úseků DNA (sekvenování) a syntézu pro konkrétního pacienta specifických primerů. Citlivost se pohybuje v rozmezí 10-5 až 10-6 a díky metodě „real time PCR“ umožňuje i kvantifikaci a sledování dynamiky nádorového klonu (6).
Významem dosažení MRD negativity se zabývala řada prospektivních studií. Často citovaná studie Moretona (7) analyzovala 91 předléčených nemocných u nichž byla podán alemtuzumab. MRD byla detekována průtokovou cytometrií z periferní krve. Osmnáct nemocných (20 %) dosáhlo MRD negativní kompletní remise, 4 z nich byli dále transplantováni (2 autologně, 2 alogenně). Pacienti s MRD negativní kompletní remisí měli signifikantně delší interval bez léčby než pacienti s MRD pozitivní kompletní remisí (medián nedosažen vs. 20 měsíců, P < 0,0001). Nemocní s negativitou MRD přežívali déle než nemocní s MRD+ kompletní remisí (medián nedosažen vs. 60 měsíců, P = 0,0007). Závažným problémem byl výskyt infekcí včetně invazivních mykóz a těžkých sepsí.
Přínos přidání rituximabu režimu fludarabin+cyklofosfamid (FCR) analyzovala prospektivní randomizovaná studie CLL8 (8). Na základě analýzy 471 nemocných byl prokázán výrazný přínos rituximabu pro dosažení MRD negativní kompletní remise. Počet nemocných, kteří dosáhli eradikace MRD byl v rameni FCR téměř dvojnásobný (periferní krev 66,4 % vs. 34,2 %, P < 0,0001; kostní dřeň 47,6 % vs. 27,3 %). Dosažení co možná největší deplece nádorového klonu mělo významný vliv na dobu do progrese nemoci (obr. 1), a to bez ohledu na léčebné rameno.
Obr. 1. Studie CLL8: křivky přežití do progrese nemoci (PFS). Stratifikace dle kvality dosažené léčebné odpovědi (8). 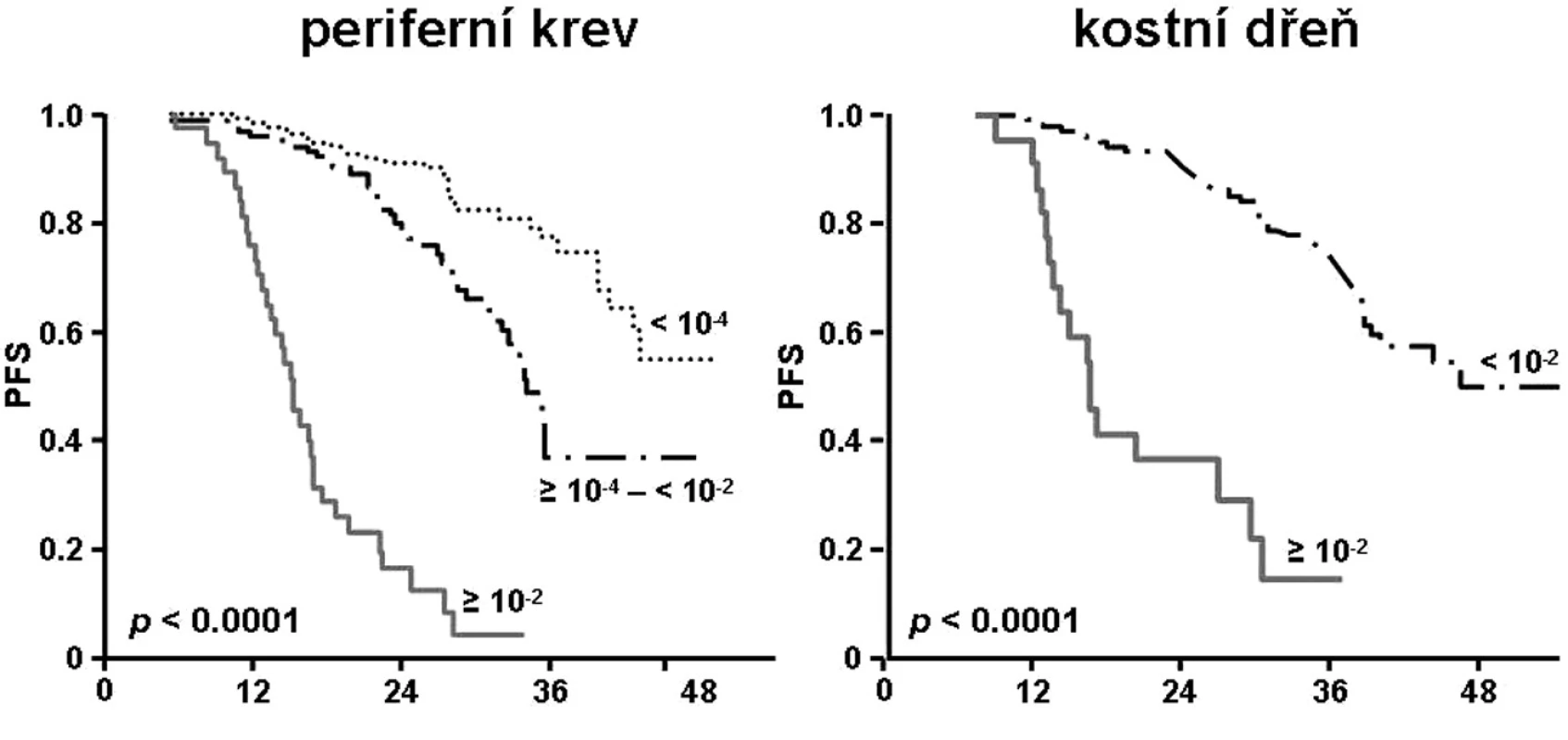
Italská studie (9) prokázala přínos rituximabu v udržovací léčbě MRD+ pacientů. Skupina Giovanni del Poety studovala soubor 75 nemocných, kteří byli po indukční léčbě 6 cykly fludarabinu (25 mg/m2 i.v.) konsolidováni 4 cykly rituximabu (375 mg/m2 á 1 měsíc). Po indukční léčbě 81 % nemocných dosáhlo CR a 13 % PR. MRD byla hodnocena průtokovou cytometrií z kostní dřeně: 25 nemocných dosáhlo MRD negativity, 46 pacientů bylo MRD+. Nemocní s pozitivní zbytkovou nemocí byli buď sledováni (18 pacientů), nebo léčeni udržovací terapií rituximabem (28 nemocných). Udržovací léčba byla podávána 14 měsíců v měsíčních intervalech (4 cykly 375 mg/m2, poté 12 cyklů 150 mg/m2). MRD + nemocní, kteří absolvovali udržovací léčbu měli delší trvání léčebné odpovědi (87 % vs. 32 % v 5 letech, P = 0,0001). Nebyl rozdíl v přežití do progrese mezi nemocnými, kteří dosáhli MRD negativity po indukci a těmi, kteří byli léčeni pro MRD pozitivitu udržovací léčbou.
Sledování kinetiky reziduální nemoci se jeví jako velmi užitečné u nemocných po alogenní transplantaci krvetvorných buněk (allo-SCT). Prospektivní studie 30 nemocných po allo-SCT provedené redukovaným přípravným režimem demonstrovala úzký vztah mezi reakcí štěpu proti leukemii (GVL) a přítomností MRD (10). Ve skupině nemocných, kteří nedosáhli MRD negativity ani po redukci imunosupresivní léčby bylo pozorováno 5 z celkových 6 relapsů.
Minimální zbytková nemoc je robustní a nezávislý faktor přežití u nemocných s B-CLL. Pro rutinní klinickou praxi se nabízí dvě zásadní otázky: u koho MRD vyšetřovat, případně zda je dosažení eradikace zbytkové nemoci terapeutickým cílem?
Považujeme za účelné vyšetřovat MRD z kostní dřeně u nemocných v CR po léčbě první linie neredukovanou imunochemoterapií. Sledování dynamiky nádorového klonu z periferní krve má u konvečně léčených nemocných smysl jen po podání další konsolidační léčby. Pacienti po alogenní transplantaci krvetvorných buněk naproti tomu profitují z pravidelného citlivého monitorování zbytkové nemoci pomocí ASO-PCR (12).
Otázka, zda dosažení vymizení minimální zbytkové nemoci je léčebným cílem u všech nemocných léčených moderní imunochemoterapií, zůstává kontroverzní. Snaha eliminovat zbytkovou populaci buněk alemtuzumabem bohužel vede k častým a závažným infekčním komplikacím a měla by být vyhrazena pro nemocné s rizikovou genetickou změnou (delece 17p, delece 11q) a dobrým stavem tělesné kondice (11).
Současná konvenční schémata indukční léčby (FCR) pravděpodobně dosáhla svého maxima co do účinnosti a tolerovatelné toxicity. Další zlepšení léčebných výsledků se neobejde bez dlouhodobého potlačení zbytkového nádorového klonu. Budoucnost bezpečné a efektivní léčby pravděpodobně leží v průsečíku dostatečně účinné indukce a nízce toxické následné (udržovací) terapie. Zda a v jaké podskupině nemocných bude monitorování zbytkové nemoci považováno za standard, ukáží probíhající klinické studie.
MUDr. Vít Procházka
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
I. P. Pavlova – 6
775 20 Olomouc
e-mail: vit.prochazka@fnol.cz
Zdroje
1. Papajík T, Jarošová M, Plachý R, et al. Chronická B-lymfocytární leukemie. Část I: Pohled na původ, biologii a genetické změny leukemických buněk. Trans Hemat dnes 2006; 12 : 53-61.
2. Montserrat E. Treatment of chronic lymphocytic leukemia: achieving minimal residual disease-negative status as a goal. J Clin Oncol 2005; 23 : 2884-2885.
3. Cheson BD, Bennett JM, Grever M, et al. National Cancer Institute-sponsored Working Group guidelines for chronic lymphocytic leukemia: revised guidelines for diagnosis and treatment. Blood 1996; 87 : 4990-4997.
4. Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008; 111 : 5446-5456.
5. Rawstron AC, Villamor N, Ritgen M, et al. International standardized approach for flow cytometric residual disease monitoring in chronic lymphocytic leukaemia. Leukemia 2007; 21 : 956-964.
6. Sayala HA, Rawstron AC, Hillmen P. Minimal residual disease assessment in chronic lymphocytic leukaemia. Best Pract Res Clin Haematol 2007; 20 : 499-512.
7. Moreton P, Kennedy B, Lucas G, et al. Eradication of minimal residual disease in B-cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005; 23 : 2971-2979.
8. Boettcher S, Fischer K, Stilgenbauer S, et al. Quantitative MRD Assessments Predict Progression Free Survival in CLL Patients Treated with Fludarabine and Cyclophosphamide with or without Rituximab – a Prospective Analysis in 471 Patients from the Randomized GCLLSG CLL8 Trial. Blood (ASH Annual Meeting Abstracts) 2008; 112: Abstract 326.
9. Del Poeta G, Del Principe MI, Buccisano F, at al. Consolidation and maintenance immunotherapy with rituximab improve clinical outcome in patients with B-cell chronic lymphocytic leukemia. Cancer 2008; 112 : 119-128.
10. Ritgen M, Böttcher S, Stilgenbauer S, et al. Quantitative MRD monitoring identifies distinct GVL response patterns after allogeneic stem cell transplantation for chronic lymphocytic leukemia: results from the GCLLSG CLL3X trial. Leukemia 2008; 22 : 1377-1386.
11. Gribben JG, Hallek M. Rediscovering alemtuzumab: current and emerging therapeutic roles. Br J Haematol 2009; 144 : 818-831.
12. Skuhrová Francová H, Tichý B, Malinová K, Mayer J, Pospíšilová Š. Stanovení minimální zbytkové nemoci u Bbuněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů. Trans Hemat dnes 2009; 15(4): 197-203.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Klinický přínos stanovení zbytkové choroby u nemocných s B-chronickou lymfocytární leukemií
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. chromozomu (del(5q), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy
- Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
- Vrozené polycytemie
- Význam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
- Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
- Zpráva z 12. pracovních dnů v transfuzním lékařství
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Vybrané odborné akce v roce 2010
- OBSAH ROČNÍKU 15/2009 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozené polycytemie
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



