-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
Clinical consequence of the cell-mediated antitumor immunity polymorphism in patients with B-cell lymphoma treated with rituximab
The introduction of rituximab therapy into the treatment of B-cell non-Hodgkin’s lymphoma has brought unprecedented improvements in treatment outcomes across the whole population of patients. Although resistance to rituximab is rare, some patients show a poorer treatment response. Detailed study of the mechanisms of rituximab activity showed that the main effector mechanisms leading to the destruction of lymphoma cells are those related to a patient’s antitumor immunity: complement-dependent cellular cytotoxicity (CDC) and antibody-dependent cellular cytotoxicity (ADCC). Study of rituximab interaction with a patient’s T-lymphocytes and NK cells suggests considerable interindividual variability in the severity of the cytotoxic response. The first laboratory and clinical data show that variable quantity and quality of ADCC may be associated with the effectiveness of immunotherapy in a particular patient.
Key words:
rituximab, immunotherapy, B-cell lymphoma
Autoři: V. Procházka
; T. Papajík; Z. Kubová; M. Novák; Z. Pikalová; Š. Rožmanová; M. Jarošová; K. Indrák
Působiště autorů: Hemato-onkologická klinika Fakultní nemocnice Olomouc
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 4, p. 224-228.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Zavedení imunoterapie rituximabem do léčby B-nehodgkinských lymfomů přineslo do té doby nevídané zlepšení léčebných výsledků napříč celou populací nemocných. Jakkoli je rezistence na rituximab vzácná, někteří nemocní vykazují horší léčebnou odpověď. Podrobné studium mechanismů účinku rituximabu přineslo zjištění, že hlavními efektorovými mechanismy vedoucími ke zničení lymfomové buňky jsou mechanismy protinádorové imunity pacienta: komplementem mediovaná cytotoxicita (complement-dependent cellular cytotoxicity, CDC) a cytotoxicita závislá na protilátkách (antibody-dependent cellular cytotoxicity, ADCC). Studium interakce rituximabu s T-lymfocyty a NK buňkami pacienta ukazuje na značnou interindividuální variabilitu síly cytotoxické odpovědi. První laboratorní a klinická data naznačují že různá kvantita i kvalita ADCC může mít souvislost s účinností imunoterapie u konkrétního pacienta.
Klíčová slova:
cytotoxicita závislá na protilátkách, rituximab, imunoterapie, lymfomy z B buněkÚvod
Zavedení pasivní imunoterapie rituximabem (MabThera®) do léčby CD20+ lymfoidních malignit znamenalo významné zlepšení výsledků léčby a dlouhodobé prognózy nemocných. Účinnost samotného rituximabu (1) i jeho konkomitantního či sekvenčního podání s chemoterapií byla potvrzena v řadě prospektivních randomizovaných klinických studií jak u indolentních (2, 3, 4), tak u agresivních forem lymfomů (7, 8, 9, 10). Vliv přidání rituximabu do indukční léčby na celkové přežití nemocných s B-lymfomy byl potvrzen metaanalýzou studií (5). Významným přínosem je také aplikace rituximabu v konsolidační „udržovací“ léčbě indolentních lymfomů (4, 6, 7). Přes optimistické výsledky drtivé většiny studií je zřejmé, že část nemocných identického rizika z imunoterapie dostatečně neprofituje. Vzhledem k tomu, že na zlepšení léčebných výsledků se významně podílela aktivace imunitních mechanismů nemocného, je možné, že variabilita aktivity nespecifické protinádorové imunity může být příčinou variability účinnosti imunoterapie.
Mechanismus účinku rituximabu
Rituximab je chimerická monoklonální protilátka typu IgG1 specificky namířená proti antigenu CD20, který je exprimován na zralých fyziologických lymfoidních buňkách B řady a s různou denzitou i na buňkách téměř 90 % maligních B lymfomů. Na základě in vitro experimentů bylo postulováno několik hypotéz o in vivo mechanismu účinku protilátky anti-CD20. Patří mezi ně komplementem mediovaná cytotoxicita (complement-dependent cellular cytotoxicity, CDC), cytotoxicita závislá na protilátkách (antibody-dependent cellular cytotoxicity, ADCC) a přímá indukce apoptózy (11, 12). Zatímco význam CDC byl studován na tkáňových kulturách a myších modelech (13), v případě ADCC se zdá, že in vivo sledování aktivity autologních cytotoxických mechanismů může predikovat efektivitu imunoterapie.
Polymorfismus Fc receptorů
ADCC je zprostředkována efektorovými buňkami imunitního systému poté, co je navázán Fc fragment opsonizující protilátky (například rituximabu) nízkoafinním receptorem pro imunoglobulin (FγcR). Rozlišujeme tři třídy imunoglobulinových receptorů: FγcRI, FγcRII, FγcRIII a osm podtříd. Z uvedených subtypů má pro ADCC význam FγcRIIa (CD 32), který je exprimován na makrofázích a granulocytech a zejména pak FγcRIIIa (CD 16), přítomen na makrofázích a NK lymfocytech. Geny kódující Fc receptory jsou lokalizovány na 1. chromozomu a vykazují funkční alelický polymorfismus vedoucí k strukturní a tedy i funkční různorodosti kódovaných proteinů (receptorů). Některé polymorfismy byly identifikovány jako genetické dispozice vedoucí ke zvýšenému riziku autoimunních nebo infekčních chorob (14, 15). Nejvíce studovanou alelickou variantou je dimorfismus genu FCGR3A, kódující na pozici 158 aminokyselinu fenylalanin (FγcRIIIa-158F) nabo valin (FγcRIIIa-158V). Bylo prokázáno, že homozygotní forma FγcRIIIa obsahující valin, je schopna vázat molekulu IgG1 mnohem silněji než forma s fenylalaninem, což ve svém důsledku vede k větší degranulaci a tedy silnějšímu cytotoxickému účinku NK buněk (16, 18). Podobný efekt byl pozorován v případě polymorfismu genu FCGR2A, konkrétně alelické varianty kódující na 131 pozici histidin (FγcRIIa-131H). Hatjiharissi s kolegy (17) podrobně studovala u 52 zdravých probandů metodou přímého sekvenování polymorfismy genů kódující FγcRIIa a FγcRIIIa. Ve své práci nalezla 2 základní bialelické polymorfismy FγcRIIa na 27. kodónu (glutamin/tryptofan) a 131. kodónu (histidin/-/arginin) a 2 základní polymorfismy FγcRIIIa: trialelický polymorfismus 48. kodónu (leucin/histidin/arginin) a bialelický polymorfismus na 158. kodónu (fenylalanin/-/valin). Navíc prokázala nenáhodnou intraindividuální asociaci mezi jenotlivými variantami FCGR2Aa FCGR3A genů – zvláště pak asociace vysokoafinních variant receptorů FγcRIIa-131H s FγcRIIIa-158V. Pro afinitu Fc receptorů k rituximabu je zdá se určující polymorfismus genu FCGR3A.
Význam polymorfismu Fc receptorů v laboratorním experimentu
DallęOzzo (16) vyšetřoval cytotoxicitu závislou na rituximabu in vitro za pomocí izolovaných periferních CD16+ mononukleárních buněk 54 zdravých dárců krve. Nebyl nalezen žádný vztah mezi absolutním počtem cirkulujících mononukleárních buněk, lymfocytů, monocytů, subpopulací CD3+CD16+ a CD3-CD16+ lymfocytů a FCGR3A genotypem. Buněčná cytotoxicita byla studována na buněčné linii Burkittova lymfomu (Daudi). Purifikovaná populace monocytů nebo T-lymfocytů nevedla za přítomnosti rituximabu k lýze nádorových buněk, zatímco populace NK buněk ano. Analýza vztahu mezi koncentrací rituximabu a procentem usmrcených buněk prokázala, že NK lymfocyty dárců s V/V genotypem dosáhly EC50 při 4,2krát nižších koncentracích než lymfocyty s F/F genotypem. Při dostatečných koncentracích rituximabu rozdíl v cytotoxickém potenciálu obou subtypů stíral. Z uvedeného vyplývá, že pacienti s F/F genotypem mohou profitovat z vyšších sérových koncentrací, případně delší expozice protilátkou.
Julie Bowlesová (20) zkoumala na kulturách EBV transformovaných lymfoblastů a buněčných liniích Burkittova lymfomu (Raji) inkubovaných s periferními mononukleárními buňkami zdravých dárců vztah polymorfismu FχcRIIIa-158V na aktivaci NK buněk po podání monoklonální protilátky. Bylo zjištěno, že probandi s alespoň jednou V alelou měli po aplikaci rituximabu signifikantně nižší koncentraci CD16 (FγcRIIIa) na povrchu NK buněk. Při stejných koncetracích protilátky byla aktivita NK buněk, měřeno expresí CD54 znaku, významně vyšší u probandů s V alelou. Přítomnost V alely tedy vede in vitro k efektivnější interakci mezi Fc fragmentem a Fc receptorem (CD16), což se projeví silnější degranulací NK buněk.
Význam polymorfismu Fc receptorů v klinických studiích
Vztah mezi polymorfismem genu FCGR3A a léčebnou odpovědí na rituximab byl studován u pacientů s indolentními i agresivními lymfomy, a to jak v případě monoterapie protilátkou anti-CD20, tak při použití chemoimunoterapie.
Guillaume Cartron s kolektivem (21) sledovali vztah mezi polymorfismem FCGR3A genu a léčebnou odpovědí na primoléčbu rituximabem u pacientů s folikulárním lymfomem. Pacienti s homozygotní formou FχcRIIIa-158V dosahovali signifikantně více kompletních i molekulárních remisí. Nezávislý prognostický vliv V/V homozygocie na dosažení léčebné odpovědi byl potvrzen i multivariantní analýzou.
Podrobnější analýzu faktorů podílejících se na aktivitě ADCC provedli Weng s kolektivem (22) na souboru 87 pacientů s folikulárním lymfomem. Kromě přínosu polymorfismu genů FCGR3A a FCGR2A, byla na izolovaných nádorových buňkách studována i in vitro aktivita ADCC. Buněčná cytotoxicita byla vyšetřována pomocí radioizotopické metody – měřením uvolnění izotopu chromu (51Cr) ze značených nádorových buněk. Nebyl nalezen vztah mezi in vitro aktivitou ADCC a kvalitou léčebné odpovědi nemocných, případně mezi ADCC a expresí molekuly CD20 na lymfomových buňkách. Vliv polymorfismu genů FCGR3A na kvalitu dosažené (molekulární) remise byl testován na souboru 34 nově diagnostikovaných nemocných s folikulárním lymfomem léčených prognosticky stratifikovanou chemoimunoterapií. Nebyl nalezen rozdíl mezi jednotlivými podskupinami co do četnosti dosažené molekulární remise, nicméně je zajímavé, že nemocní s homozygotní formou FcgammaRIIIa 158 F/F měli signifikantně vyšší FLIPI skóre při diagnóze než heterozygoti F/V a homozygoti FcgammaRIIIa 158 V/V (24).
Cytotoxicita závislá na protilátkách (ADCC)
Mechanismy buněčné cytotoxicity závislé na protilátkách (ADCC) představují velmi účinný nástroj nespecifické protinádorové imunity. Vazba Fc fragmentu imunoglobulinu na vysokoafinní receptor efektorových cytotoxických lymfocytů (FcR) vede k uvolnění cytotoxických látek (perforin, granzym-B) z granul a tvorbě pórů v buněčné membráně cílové buňky. ADCC byla dlouhá léta studována pouze in vitro. Průlomem ve výzkumu aktivity efektorových T a NK lymfocytů byla zavedení metody průtokové cytometrie schopné vizualizovat degranulované – a tedy aktivní lymfocyty pomocí molekuly CD107a (24). Byla popsána také závislost míry degranulace cytotoxických lymfocytů na dávce (koncentraci) podané protilátky (rituximabu, alemtuzumabu) a byla cytometricky definována populace efektorových buněk: většina nese fenotyp CD56dim, CD69+, NKG2D+, NKp30 neg., NKp46 neg., a CD94 neg. (25).
Tato práce umožnila studium aktivity cytotoxických mechanismů in vivo a byly podány přesvědčivé důkazy, že podání rituximabu promptně zvyšuje aktivitu cytotoxických T a NK buněk u pacientů s CD20+ B-nehodgkinskými lymfomy (26).
Význam absolutního počtu lymfocytů u pacientů s agresivními lymfomy
Bezprostřední vliv na prognózu nemocných nemá pouze schopnost jejich cytotoxických buněk eradikovat nádorový klon, ale důležitou roli hraje také prostý absolutní počet lymfocytů při diagnóze.
Yasuhiro Oki a kolegové (27) zkoumali vyvážený soubor 221 nemocných s primodiagnostikovaným difuzním velkobuněčným B lymfomem léčených chemoterapií CHOP (n = 102) a R-CHOP (n = 119). Dospěli k závěru, že nízký počet lymfocytů při diagnóze (1,0 x 109/l) je nezávislý negativní prognostický faktor pro dobu do progrese nemoci i pro celkové přežití. Rituximab významně zlepšil prognózu právě ve skupině s lymfopenií. Nemocní s lymfopenií se navíc statisticky významně lišili ve vstupních parametrech rozsahu nemoci – častěji měli pokročilou chorobu, vyšší hladinu LDH, extranodální postižení lymfomem a tudíž i vyšší IPI.
Populaci 97 relabovaných, konvenčně léčených nemocných s DLBCL zkoumala skupina Luise F. Porraty (28). Multivariantní analýza prognostických faktorů přinesla řadu překvapení. Zatímco pro interval do progrese nemoci měl prediktivní význam počet lymfocytů (≥ 1,0 x 109/l), hodnota IPI v době relapsu, hladina LDH, provedení autologní transplantace a podání platinového salvážového režimu, délka celkového přežití byla predikovatelná pouze pomocí hodnoty počtu lymfocytů a LDH.
Podobné závěry lze vyvodit na základě analýzy dat populace 1337 pacientů s difuzním velkobuněčným B lymfomem starších 60 let z registru Kooperativní lymfomové skupiny (obr. 1, 2) (29). Medián celkového přežití u nemocných s lymfopenií (lymfocyty < 1,0 x 109/l) dosahuje pouze 1,8 roku, zatímco nemocní bez lymfopenie dosahují mediánu přežití 5,2 roku (p < 0,0001). Prediktivní vliv lymfopenie je zachován i v populaci léčené rituximabem: medián přežití 2,5 roku versus medián nedosažen; p = 0,0039). Prognostická síla lymfopenie byla potvrzena i v mulrivariantní analýze – nemocní s počtem lymfocytů při diagnóze ≥ 1,0x109/l měli o 33 % menší riziko úmrtí (HR 0,67; 95 % CI 0,46-0,99).
Obr. 1. Křivky celkového přežití souboru 1337 nemocných starších 60 let s DLBCL z registru KLS. Stratifikace dle přítomnosti lymfopenie. 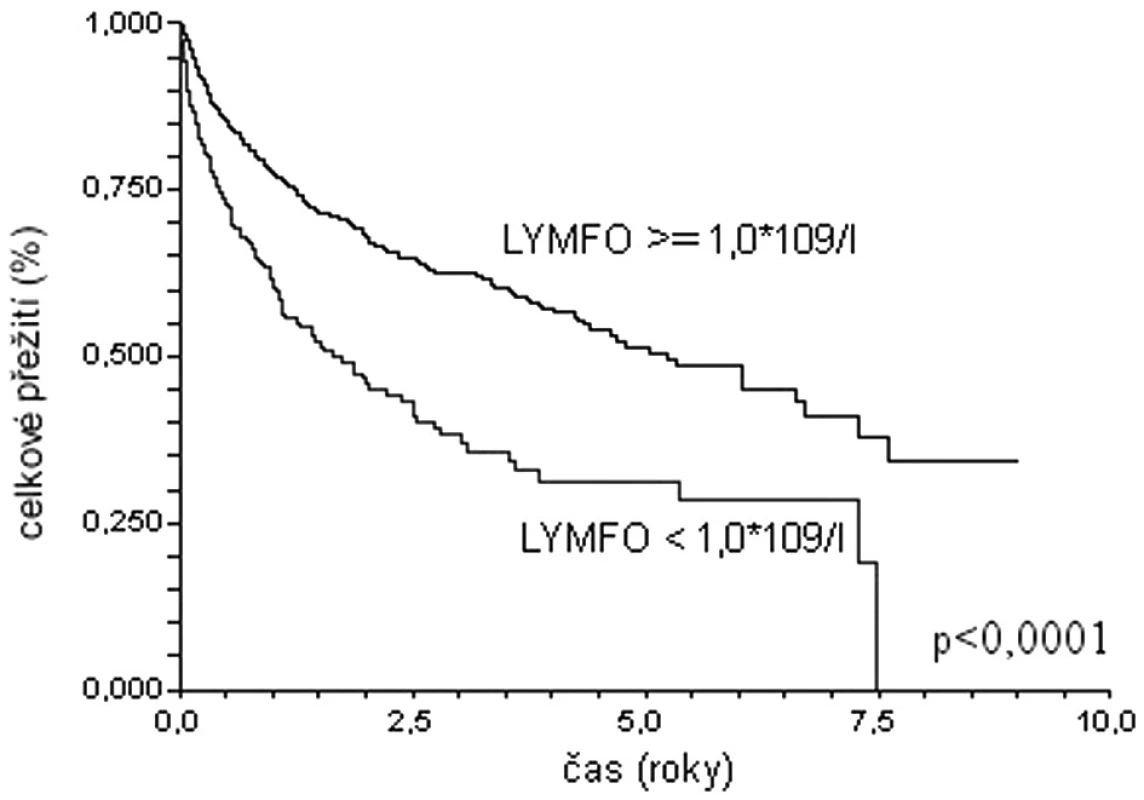
Obr. 2. Křivky celkového přežití souboru 385 nemocných starších 60 let s DLBCL z registru KLS léčených rituximabem. Stratifikace dle lymfopenie. 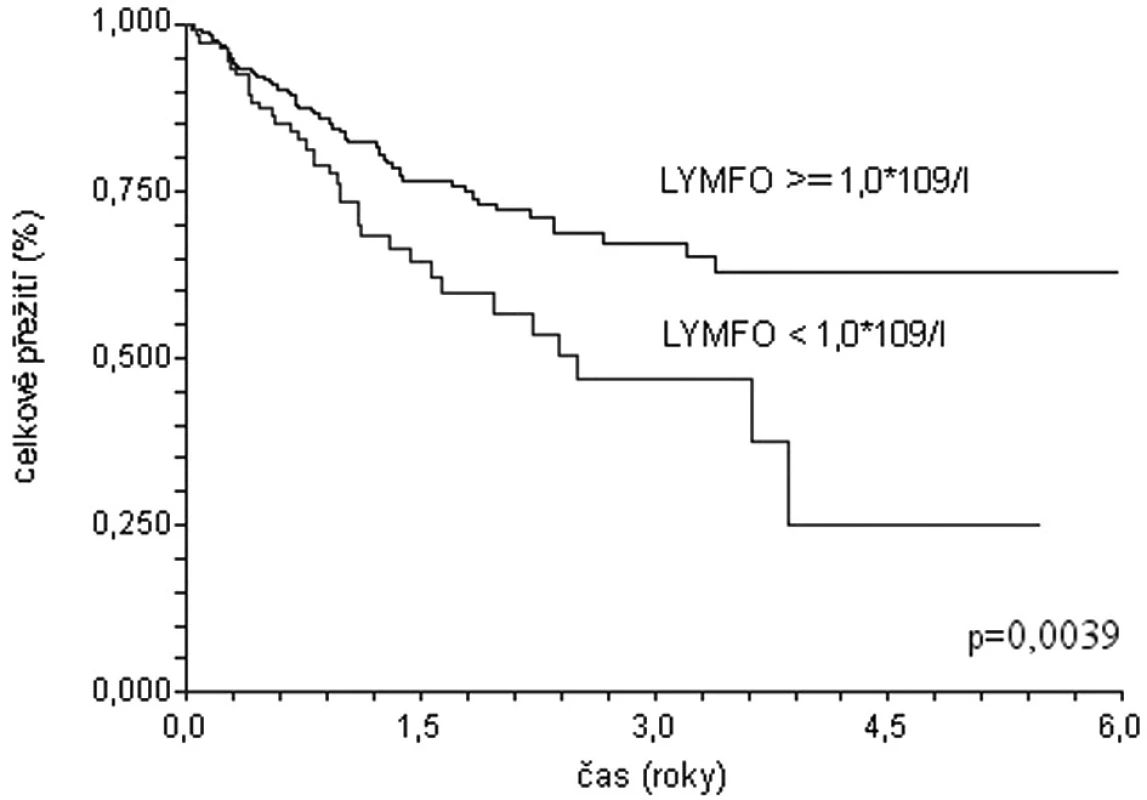
Tyto práce napovídají, že lymfocyty mají klíčovou úlohu jak v kontrole expanze tumoru při diagnóze, tak se významně podílejí svými cytotoxickými mechanismy na účinnosti chemoimunoterapie.
Nové protilátky zaměřené proti antigenu CD20
Významný léčebný efekt rituximabu podnítil rozsáhlý preklinický výzkum, jehož cílem je vyvinout monoklonální protilátku schopnou s vyšší účiností aktivovat mechanismy buněčné i komplementem aktivované cytotoxicity. Jednou z cest je syntéza humanizovaných nebo humánních monoklonální protilátek tzv. II. typu (tositumomab, GA101), které jsou v experimentu schopny navodit hlubší depleci B-lymfocytů, než rituximab (30). Navíc zatímco v případě protilátek I. typu (rituximab) je k efektivní lýze buňky nezbytná dostatečná denzita antigenu CD20 a aktivita komplementu, v případě protilátek II. typu tomu tak pravděpodobně není. Nadějnou cestou ve vývoji imunoterapie je také syntéza genetickým inženýrstvím připravených multivalentních protilátek. In vitro studie bispecifické hexavalentní protilátky anti-CD20/22 ukazují její vysoký potenciál v aktivaci ADCC mechanismů i komplementem mediované lýzy buněk (31). Vazba na dva antigeny současně navíc umožňuje zacílit imunoterapii na nádorový klon a zabránit tak nežádoucí depleci fyziologických B-lymfocytů.
Diskuse
Přes intenzivní celosvětové léčebné využití rituximabu existuje pozoruhodně málo klinických studií zabývajících se příčinami interindividuální variability této pasivní imunoterapie. Dávkovací schémata u většiny lymfoproliferací jsou identická a vycházejí z historických prací.
Vztah mezi populací nádorových buněk a imunitním dozorem hostitelského organismu je těsnější, než bylo donedávna předpokládáno. Imunitní pacienta je klíčová pro kontrolu růstu tumoru i pro účinnost chemoterapie. V éře léčby monoklonálními protilátkami správná „kooperace“ exogenní protilátky a cytotoxických mechanismů nemocného rozhoduje o léčebném výsledku více, než kdykoliv dříve. Poznání, že při léčbě lymfomů se neobejdeme bez aktivní spoluúčasti pacientovy imunity rozvinulo rozsáhlý výzkum se snahou identifikovat nemocné ve vyšším riziku selhání imunoterapie. Byl testován význam hladiny rituximabu na dosažení léčebné odpovědi, jsou vyvíjeny nové monoklonální protilátky s vyšší potencí aktivovat mechanismy buněčné i humorální cytotoxicity nemocného.
Klinické studie přesvědčivě dokázaly, že existuje interidividuální variabilita léčebné odpovědi na monoterapii rituximabem. Bylo prokázáno, že polymorfismus genů kódujících Fc receptory (zejména genů FCGR3A a FCGR2A) ovlivňuje sílu ADCC. Tento poznatek nebyl ověřen u populace nemocných léčených imunochemoterapií, nicméně lze předpokládat, že nemocní s nízkoafinní variantou Fc receptoru mohou méně profitovat například z udržovací terapie rituximabem. Zásadním klinickým poznatkem je nezávislá prediktivní úloha absolutního počtu lymfocytů u nemocných s difuzním velkobuněčným B lymfoem. Nemocní s lymfopenií mají vyšší riziko úmrtí i relapsu lymfomu – pravděpodobně plně neprofitují z efektu imunoterapie v důsledku chybějících efektorových buněk ADCC.
Navození dostatečného a dlouhodobého imunitního dozoru po léčbě prostřednictvím udržovací imunoterapie je také pravděpodobně klíčem k vyléčení opakovaně relabujících lymfomů. Včasná identifikace nemocných s rizikem horší odpovědí na rituximab nám nabízí šanci na zlepšení jejich osudu aplikací vyšších dávek nebo dávkově intenzivního podání protilátky. Přínos nových monoklonálních protilátek v populaci rizikových nemocných ověří až probíhající klinické studie.
MUDr. Vít Procházka
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: vit.prochazka@fnol.cz
Tato práce byla podpořena výzkumným záměrem MŠMT - MSM 6198959205.
Do redakce doručeno: 11. 5. 2009
Přijato: 12. 10. 2009
Zdroje
1. Ghielmini M, Schmitz SF, Burki K, et al. The effect of Rituximab on patients with follicular and mantle-cell lymphoma. Swiss Group for Clinical Cancer Research (SAKK). Ann Oncol 2000; 11 Suppl 1 : 123-6.
2. Marcus R, Imrie K, Belch A, et al. CVP chemotherapy plus rituximab compared with CVP as first-line treatment for advanced follicular lymphoma. Blood. 2005; 105(4): 1417-23.
3. Hiddemann W, Kneba M, Dreyling M, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2005 Dec 1; 106(12): 3725-32.
4. van Oers MH, Klasa R, Marcus RE, et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood 2006 Nov 15; 108 (10): 3295-301.
5. Schulz H, Bohlius JF, Trelle S, et al. Immunochemotherapy with rituximab and overall survival in patients with indolent or mantle cell lymphoma: a systematic review and meta-analysis. J Natl Cancer Inst. 2007 May 2; 99 (9): 706-14.
6. Forstpointner R, Unterhalt M, Dreyling M, et al. German Low Grade Lymphoma Study Group (GLSG). Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas: Results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 2006 Dec 15; 108 (13): 4003-8.
7. Habermann TM, Weller EA, Morrison VA, et al. Rituximab-CHOP versus CHOP alone or with maintenance rituximab in older patients with diffuse large B-cell lymphoma. J Clin Oncol 2006 Jul 1; 24 (19): 3121-7.
8. Feugier P, Van Hoof A, Sebban C, et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: a study by the Groupe d‘Etude des Lymphomes de l‘Adulte. J Clin Oncol 2005 Jun 20; 23 (18): 4117-26.
9. Pfreundschuh M, Trumper L, Osterborg A, et al. MabThera International Trial Group. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol 2006 May; 7 (5): 379-91.
10. Trneny M, Rieger M, Osterborg A, et al. The Addition of Rituximab Eliminates the Negative Prognostic Impact of PMBCL Compared to DLBCL in Young Patients with CD20-Positive Aggressive Lymphomas Receiving a CHOP-Like Chemotherapy: Results of a Subgroup Analysis of the Mabthera International Trial Group (MInT) Study. Blood Nov 2008; 112: (Abstract#839).
11. Cartron G, Blasco H, Paintaud G, et al. Pharmacokinetics of rituximab and its clinical use: thought for the best use? Crit Rev Oncol Hematol 2007 Apr; 62 (1): 43-52.
12. Cartron G, Watier H, Golay J, et al. From the bench to the bedside: ways to improve rituximab efficacy. Blood 2004 Nov 1; 104 (9): 2635-42.
13. Golay J, Cittera E, Di Gaetano N, et al. The role of complement in the therapeutic activity of rituximab in a murine B lymphoma model homing in lymph nodes. Haematologica 2006 Feb; 91 (2): 176-83.
14. Fijen CA, Bredius RG Kuijper EJ, et al. The role of Fχc receptor polymorphisms and C3 in the immune defence against Neisseria meningitidis in complement-deficient individuals. Clin Exp Immunol 2000; 120 : 338-345.
15. Dijstelbloem HM, Scheepers RH, Oost WW, et al. Fχc receptor polymorphisms in Wegeneręs granulomatosis: risk factors for disease relapse. Arthritis Rheum 1999; 42 : 1823-1827.
16. DallęOzzo S, Tartas S, Paintaud G, et al. Rituximab-dependent cytotoxicity by natural killer cells: infuence of FCGR3A polymorphism on the concentration-effect relationship. Cancer research 2004; 64 : 4664-4669.
17. Hatjiharissi E, Hansen M, Santos DD, et al. Genetic linkage of FγcRIIa and FγcRIIIa and implications for their use in predicting clinical responses to CD20-directed monoclonal antibody therapy. Clin Lymphoma Myeloma 2007; 7 : 286-290.
18. Hatjiharissi E, Santos D, Xu L, et al. Individuals expressing FcgRIIIA-158 V/V and V/F show increased NK cell surface expression of FcgRIIIA (CD16), rituximab binding, and demonstrate higher levels of ADCC activity in response to rituximab. Blood 2005; 106 : 229a (Abstract #776).
20. Bowles JA, Weiner GJ. CD16 polymorphisms nad NK activation induced by monoclonal antibody-coated cells. Journal of Immunological Methods 2005; 304 : 88-99.
21. Cartron G, Dacheux L, Salles G, et al. Therapeutic activity of humanized anti-CD20 monoclonal antibody and polymorphism in IgG Fc receptor FγcRIIIa gene. Blood 2002; 99 : 754-757.
22. Weng WK, Levy R. Two immunoglobulin G fragment C receptor polymorphisms independently predict response to rituximab in patients with follicular lymphoma. Journal Clin Oncol 2003; 21 : 3940-3947.
23. Prochazka V, Rozmanova S, Papajik T, et al. Risk-adapted immunochemotherapy overcomes the negative prognostic impact FCGRIIIA of the receptor genotype in patients with follicular lymphoma. Haematologica 2007; 92[suppl.2]: 107.
24. Penack O, Gentilini C, Fischer L, et al. CD56dimC D16neg cells are responsible for natural cytotoxicity against tumor targets. Leukemia 2005 May; 19 (5): 835-40
25. Fischer L, Penack O, Gentilini Ch, et al. The anti-lymphoma effect of antibody-mediated immunotherapy is based on an increased degranulation of peripheral blood natural killer (NK) cells. Experimental Hematology 2006; 34 : 753–759.
26. Prochazka V, Novak M, Pikalova Z, et al. Rituximab enhances cellular mediated cytotoxicity in patients with B-cell lymphoma: in vivo study of NK/T-cells activity. Haematologica 2007; 92[suppl.2]: 111.
27. Oki Y, Yamamoto K, Kato H, Kuwatsuka Y, et al. Low absolute lymphocyte count is a poor prognostic marker in patients with diffuse large B-cell lymphoma and suggests patients‘ survival benefit from rituximab. Eur J Haematol 2008 : 81 (6): 448-53.
28. Porrata LF, Ristow K, Habermann TM, et al. Absolute lymphocyte count at the time of first relapse predicts survival in patients with diffuse large B-cell lymphoma. Am J Hematol 2008; 84 (2): 93-97.
29. Procházka V, Papajík T, Trněný M, et al. Analýza přežití nemocných s difúzním velkobuněčným B-lymfomem starších 60 let z registru Kooperativní lymfomové skupiny. Trans Hemat dnes 2009; 15 : 10-11.
30. Beers SA, Chan CH, James S, et al. Type II (tositumomab) anti-CD20 monoclonal antibody out performs type I (rituximab-like) reagents in B-cell depletion regardless of complement activation. Blood. 2008 Nov 5; 112 (10): 4170-7.
31. Rossi EA, Goldenberg DM, Cardillo TM, Stein R, Wang Y, Chang CH. Novel designs of multivalent anti-CD20 humanized antibodies as improved lymphoma therapeutics. Cancer Res 2008 Oct 15; 68 (20): 8384-92.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Klinický přínos stanovení zbytkové choroby u nemocných s B-chronickou lymfocytární leukemií
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Analýza nemocných s myelodysplastickým syndromem (MDS) s delecí dlouhého ramene 5. chromozomu (del(5q), sledovaných Českou MDS pracovní skupinou. Význam pro diagnostické zařazení a určení prognózy
- Využitie sekundárnej profylaxie s rekombinantným aktivovaným faktorom VII u hemofílie A s inhibítorom: naše skúsenosti a prehľad literatúry
- Vrozené polycytemie
- Význam polymorfismu buněčné protinádorové imunity u pacientů s B-nehodgkinským lymfomem léčených rituximabem
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
- Alogenní transplantace krvetvorných buněk u pacientů s mnohočetným myelomem – zkušenosti centra
- Zpráva z 12. pracovních dnů v transfuzním lékařství
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Výběr z tisku a zprávy o knihách
- Vybrané odborné akce v roce 2010
- OBSAH ROČNÍKU 15/2009 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vrozené polycytemie
- Úloha FLT3 mutací v patogenezi akutní myeloidní leukemie
- Stanovení minimální zbytkové nemoci u B-buněčné chronické lymfocytární leukemie: možnosti a vývoj metodických přístupů založených na PCR a RQ-PCR
- Sekundární myelodysplastický syndrom: retrospektivní analýza dat z registru České pracovní MDS skupiny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



