-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaErytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
Apheresis red cell concentrates - evaluation of apoptosis markers in concentrates obtained from two devices
Background:
Cells apoptosis is induced by the collection and storage of red blood cell concentrates. Aim of our study was to evaluate red cells storage lesions in red blood cells concentrates collected by two separators with different technology of apheresis.Methods:
We prepared 40 TU leukoreduced RBC (MCS RBC-WBC reduced) and 40 TU RBC (MCS RBC) using separator Haemonetics MCS⁺. Using device Trima Accel we prepared 19 TU leukoreduced RBC (Trima RBC) by combined RBC + PLT collections. RBC were compared using evaluation of plasma Hb, pH, LDH, annexin V levels immediately after collection and at the end of expiration. The results between products from both devices and whole blood leukoreduced RBC (WB-RBC) were compared.Results:
The highest increase in the levels of plasma Hb, K⁺, LDH and annexin V was found in non-leukoreduced MCS RBC (plasma Hb: 47 ± 10 to 216 ± 65 mg/TU, v. Trima RBC p < 0.001, v. WB-RBC: p < 0.01; K⁺: 1.2 ± 0.3 to 55.2 ±9.1 mmol/L, p < 0.001; LDH: 2.44 ± 0.5 to 18.8 ± 4.39 μkat/L, p < 0.001; annexin V: 5.7 ± 4.2 to 31.2 ± 3.8 ng/mL, p < 0.001). MCS RBC – WBC reduced in comparison with Trima RBC showed higher rise in the levels of plasma Hb and LDH (p < 0.001). The rise in the levels of K⁺ and annexin V were comparable (p = 0.19/0.33) in these products. Leukoreduced RBC from both separators revealed comparable rise in plasma Hb and K⁺ concentrations compared to WB-RBC. MCS RBC – WBC reduced showed higher increase of annexin V in comparison with WB-RBC (p < 0.01).Conclusions:
The quality of apheresis red blood concentrates was high, blood cells were not damaged by apheresis. Based on the highest rise of all markers in nonleukoreduced apheresis RBC it could be concluded that development of red blood cells storage lesions is not influenced by apheresis technology. Significant factors are storage conditions and leukocyte content in apheresis products.Key words:
red blood cells concentrates, red blood cells storage lesions, annexin V
Autoři: R. Procházková, (STL) 1; C. Andrýs 2
; J. Krejsek 2; M. Bláha 3
Působiště autorů: Transfuzní oddělení, KN Liberec, 2Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové 1; Oddělení klinické hematologie LF UK a FN Hradec Králové 3
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 4, p. 159-165.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Úvod:
V průběhu odběru a skladování erytrocytárních koncentrátů může být indukováno buněčné poškození erytrocytů. Cílem práce bylo zhodnotit parametry buněčného poškození u erytrocytárních koncentrátů získaných ze dvou separátorů s odlišnou technologií aferézy.Metodika:
Na separátoru Haemonetics MCS⁺ bylo odebráno 40 erytrocytárních koncentrátů deleukotizovaných (EAD MCS) a 40 erytrocytárních koncentrátů resuspendovaných (EAR MCS), na separátoru Trima Accel 19 kombinovaných odběrů deleukotizovaných erytrocytárních koncentrátů (EAD Trima) s trombocyty. V den skladování 0 a 40 byla v přípravcích stanovena hodnota pH, hladiny volného Hb, LDH, kalia a annexinu V. Výsledky byly porovnány se souborem 20 deleukotizovaných erytrocytů z plné krve (ERD).Výsledky:
Nejvýznamnější vzestup hladin volného Hb, K⁺, LDH a annexinu V byl nalezen v EAR MCS (volný Hb: 47 ± 10 až 216 ± 65 mg/TU, v. EAD Trima: p < 0.001, v. ERD: p < 0.01; K+: 1,2 ± 0,3 až 55,2 ± 9,1 mmol/L; LDH: 2,44 ± 0,5 až 18,8 ± 4,39 μkat/L; annexin V: 5.7 ± 4.2 až 31.2 ± 3.8 ng/mL, vše p < 0.001). EAD MCS vůči EAD Trima vykázaly vyšší vzestup volného Hb a LDH (p < 0,001), vzestup K⁺ a annexinu V byl srovnatelný (p = 0,19/0,33). EAD MCS i EAD Trima v porovnání s ERD vykázaly srovnatelný vzestup volného Hb a K⁺, EAD MCS vyšší vzestup annexinu V vůči ERD (p < 0,01).Závěr:
Erytrocyty z aferézy vykázaly vysoký standard objemu a obsahu Hb, erytrocyty nebyly aferézami poškozeny. Nejvýznamnější vzestup markerů buněčného poškození u erytrocytů z aferézy bez leukodeplece dokazuje, že použité technologie neovlivňují stav erytrocytů v přípravcích na konci skladování, klíčový význam pro vývoj změn v erytrocytech mají podmínky skladování, zejména kontaminace leukocyty.Klíčová slova:
erytrocytární koncentráty, buněčné poškození, annexin VÚvod
Erytrocytární koncentráty pro transfuzi lze získat mimo zpracování odběrů plné krve také aferetickými technikami. Moderní krevní separátory umožňují současný odběr dvou transfuzních jednotek (TU) erytrocytů (RBC) či kombinaci odběru erytrocytů s trombocyty a/nebo plazmou při jedné aferéze (1, 2). Cílem přípravy je získat přípravek vysoké jakosti, se standardním obsahem hemoglobinu, s minimální kontaminací leukocyty a se zachovanou funkcí přenášet kyslík (3). Přípravky jsou získávány ve finální formě (4).
V současné době lze odběry erytrocytů provádět na několika typech krevních separátorů (5). K antikoagulaci jsou používány roztoky ACD-A, CPD-50 a resuspenzní roztok SAGM. Erytrocyty jsou obvykle následně in-line deleukotizovány.
Erytrocyty, přestože jsou bezjaderné, podléhají apoptóze, procesu programované řízené buněčné smrti (6), ke které dochází stárnutím krevních buněk během skladování (7). Tento proces může být ovlivněn řadou faktorů během odběru a zpracování krve (8), např. technikou odběru, složením antikoagulačního roztoku, kontaktem s povrchem odběrového vaku či setu, metodou zpracování a obsahem leukocytů v produktu či způsobem leukofiltrace (8, 9). Erytrocyty mohou být ovlivněny osmotickým šokem při kontaktu odebírané krve s hyperosmolárním antikoagulačním roztokem („red cell collection injury“) (10). Proces je doprovázen řadou morfologických a metabolických změn („red cell storage lesions“), které limitují jejich skladovatelnost a dle některých autorů mohou asociovat se snížením potransfuzní „recovery in vivo“ (11). Morfologické změny jsou důsledkem zejména deplece adenosintrifosfátu (ATP) v erytrocytu, který mění svůj diskoidní tvar v echinocyt (12). Metabolické alterace erytrocytů se odráží ve změnách pH, zvýšení LDH v supernatantu, v konsumpci glukózy a produkci laktátu (13, 14). Dochází k uvolnění TGF-ß a externalizaci phosphatidylserinu na povrch buněčné membrány (9). Významně klesá obsah 2,3–difosfoglycerátu (2,3-DPG), což může vést k redukci schopnosti uvolnit O2do mikrocirkulace (9, 15). Klesá i hodnota adenosintrifosfátu (ATP), tento pokles ale nemá vliv na poškození erytrocytů během skladování ani na potransfuzní recovery (9, 11). Obsah 2,3-DPG a ATP v erytrocytech se může po transfuzi obnovit (50–70 % za 1 den, plně za týden) (9). Na enzymy regulující koncentraci 2,3-DPG má vliv i hodnota pH, která významně ovlivňuje jeho hladinu a tím i vazbu O2 na Hb (8, 15). Hodnota pH může být ovlivněna koncentrací citrátu v antikoagulačním roztoku (16). Nepřímý efekt zvýšení hladiny dalších mediátorů, jako je intracelulární Ca2+, vede k buněčné dehydrataci, vzniku mikrovesikulací a ztrátě intracelulárního K+ (11). K normalizaci intracelulárního K+ dojde během několika hodin po transfuzi.
Za moderní marker jakosti transfuzních přípravků je považován annexin V, globální marker apoptózy (17, 18). Jde o intracelulární glykoprotein, který je v buňkách fyziologicky obsažen v cytosolu a organelách. Jeho zvýšená plazmatická hladina je v přímé relaci se stupněm buněčného poškození. Při současném stanovení K+ a volného hemoglobinu je vhodným markerem buněčného poškození koncentrátů erytrocytů (18, 19).
Stav krevních buněk významně ovlivňuje obsah leukocytů v přípravku. Snížení obsahu leukocytů časnou leukodeplecí snižuje uvolnění většiny na leukocyty vázaných cytokinů a intracelulárních enzymů, které mohou indukovat poškození erytrocytů během skladování a potransfuzní reakce (9, 20). Uvádí se, že odstranění leukocytů z přípravků před skladováním by mohlo snížit imunosupresi způsobenou transfuzí, názory ale nejsou jednotné (9).
Ne všechny mechanismy, které vedou k poškození krevních buněk, jsou plně objasněny a pochopeny. Jsou v současné době předmětem intenzivního studia.
Materiál a metodika
Cílem práce bylo zhodnotit markery buněčného poškození erytrocytů z aferézy ze dvou typů separátorů s odlišnou technologií aferézy.
Prospektivní studie sledovala určené parametry erytrocytů z aferézy ze dvou typů separátorů s odlišnou technologií aferézy a porovnávala je s odpovídajícími parametry přípravků z plné krve. Projekt byl schválen Etickými komisemi KN Liberec, FN a LF UK v Hradci Králové.
Dárci
Odběry byly provedeny u 51 dárců plazmy (48 mužů a 3 ženy), na základě informovaného souhlasu a vstupních kritérií uvedených v tabulce 1. Před každým odběrem byl dárce vyšetřen lékařem.
Tab. 1. Výběrová kritéria pro dárce krve. 
Legenda: 1hodnota před aferézou; 2doporučená hodnota po aferéze. Upraveno dle Guide to the preparation, use and quality assurance of blood components. 10th ed. Strasburg: Council of Europe Publishing, 2004. Krevní separátory a odběrové protokoly
Odběry byly prováděny na separátoru Haemonetics MCS+ (Haemonetics Corp., Braintree, USA) (dále MCS) a na separátoru Trima Accel (Gambro BCT, Inc. Lakewood, USA) (dále Trima).
Na separátoru MCS+ byly provedeny odběry 2 jednotek erytrocytů (antikoagulační roztok CPD-50), které byly kompensovány kontinuální infuzí 400 ml fyziologického roztoku (50). Erytrocyty z aferézy resuspendované (EAR MCS) byly po odběru (set LN 942, Haemonetics Corp., Braintree, USA) resuspendovány ve 100 ml roztoku SAGM na jednotku. Erytrocyty z aferézy deleukotizované (EAD MCS) byly po odběru (set LN 948 F, Haemonetics Corp., Braintree, USA) rovněž resuspendovány ve 100 ml roztoku SAGM a následně deleukotizovány integrovanými filtry RC 2H PALL za 2 hodiny po odběru bez předchlazení.
Na přístroji Trima jsme provedli kombinované odběry deleukotizovaných erytrocytů (EAD Trima) a trombocytů (TAD 300 Trima: 1,5 TU, tj. > 300 x 109PLT/TU, set Trima Accel LRS Platelet/Plasma/RBC set, Gambro BCT, USA; antikoagulans ACD-A). Erytrocyty byly resuspendovány ve 100 ml SAGM a deleukotizovány do 2 hodin po odběru integrovaným filtrem. Odběry na separátoru Trima proběhly bez objemové náhrady.
Jako kontrolní soubor byly použity erytrocyty resuspendované deleukotizované (ERD), získané odběrem 450 ± 10 ml plné krve do vaků Leukotrap WB s integrovanými filtry WBF3 PALL (Pall Medical, Velká Británie) s antikoagulačním roztokem CPD v poměru 1 : 7. Plná krev byla následně zpracována časnou deleukotizací, centrifugací na centrifuze JOUAN KR.22 (Jouan S.A., Francie) (čas 15 min. při 5010 G, teplota 15 °C, akcelerace 7, brzda 2) a následným oddělením plazmy resuspenzí 100 ml SAGM.
Odběry vzorků
Pro laboratorní vyšetření byly vzorky odebírány v den 0 a den 40, resp. 41. V den 0 bylo odebráno bezprostředně po přípravě 23 ml přípravku, centrifugováno 5 min. při 3400 ot. na laboratorní centrifuze Jouan C 3.12 (Jouan S.A., Francie). Supernatant byl rozplněn do alikvotů po 0,5 ml. Vyšetření pH, laktátu, glukózy a LDH proběhlo týž den do 4 hodin po odběru vzorků. Materiál pro vyšetření annexinu V byl zamražen a skladován při -30 °C. Pro vyšetření markerů na konci exspirace bylo 23 ml koncentrátu sterilně přemístěno do skladovacího váčku (JMS Transfer bag, 150 ml, kat. č. 814-0132, Japan Medical Supply, Pte Ltd, Singapore), který byl skladován při teplotě 4 ± 2 °C. Následné zpracování bylo identické jako u vzorků v den 0.
Laboratorní analýza
Obsah hemoglobinu a hematokriterytrocytárních koncentrátů byly stanovovány na přístroji Coulter T 890 a Coulter STKS (Beckman Coulter, Florida, USA). Přítomnost leukocytů v deleukotizovaných přípravcích byla stanovena v Nageottově komůrce (lyzační roztok Türck firmy Merck). Biochemická vyšetření byla provedena na Oddělení klinické biochemie KN Liberec: Volný hemoglobin: spektrofotometricky (spektrofotometr Shimadzu UV-2101 PC), Hodnota LDH: metoda LDH-L optimized (kat.č. 1876961, Roche Diagnostics, SRN), pH přímou potenciometrií na radiometru ABL 625 GL, hladina kalia nepřímou potenciometrií (ISE indirect Na, K, Cl, kat. č. 825441, Roche Diagnostics, SRN). Stanovení hladiny annexinu V bylo provedeno na Ústavu klinické imunologie a alergologie FN v Hradci Králové (kit IMUCLONE Annexin ELISA Kit, kat. č. 650, American Diagnostica Inc., Stamford, USA).
Hodnocené parametry erytrocytárních koncentrátů
Hodnotili jsme vývoj uvedených parametrů během skladování u jednotlivých typů přípravků a mezi přípravky navzájem. Ke statistickému hodnocení byl použit statistický software Excel 4.0. Ke hodnocení normality rozložení dat v souborech jsme použili DęAgostiniův test. Pro normálně rozložená data byl použit Studentův t-test, F-test, párový test a Pearsonův korelační koeficient. Pro soubory s nenormálně rozloženými daty byly použity Mannův-Whitneyův test, Wilcoxův párový test a Spearmanův korelační koeficient. Statistická významnost byla posouzena na hladině p < 0,05.
Výsledky
Charakteristiku souboru a základní aferetické parametry uvádíme v tabulce 2.Základní parametry jakosti erytrocytárních koncentrátů (objem, Hb, Ht a obsah leukocytů v TU) a jejich vývoj během skladování uvádí tabulka 3.
Tab. 2. Charakteristika souboru dárců a základní parametry aferéz. 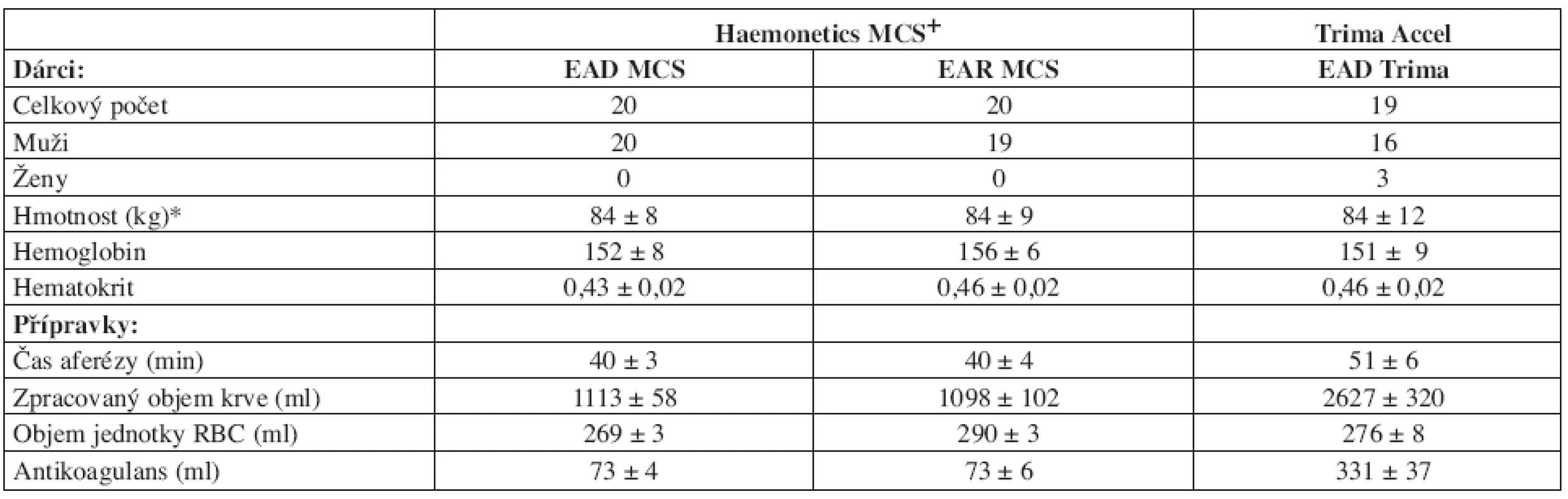
Legenda: EAD MCS: erytrocyty deleukotizované ze separátoru MCS, EAR MCS: erytrocyty resuspendované ze separátoru MCS, EAD Trima: erytrocyty deleukotizované ze separátoru Trima, RBC: erytrocyty, *data uvedena jako medián a rozptyl, ostatní jako průměr SD. Tab. 3. Základní parametry jakosti erytrocytárních koncentrátů. 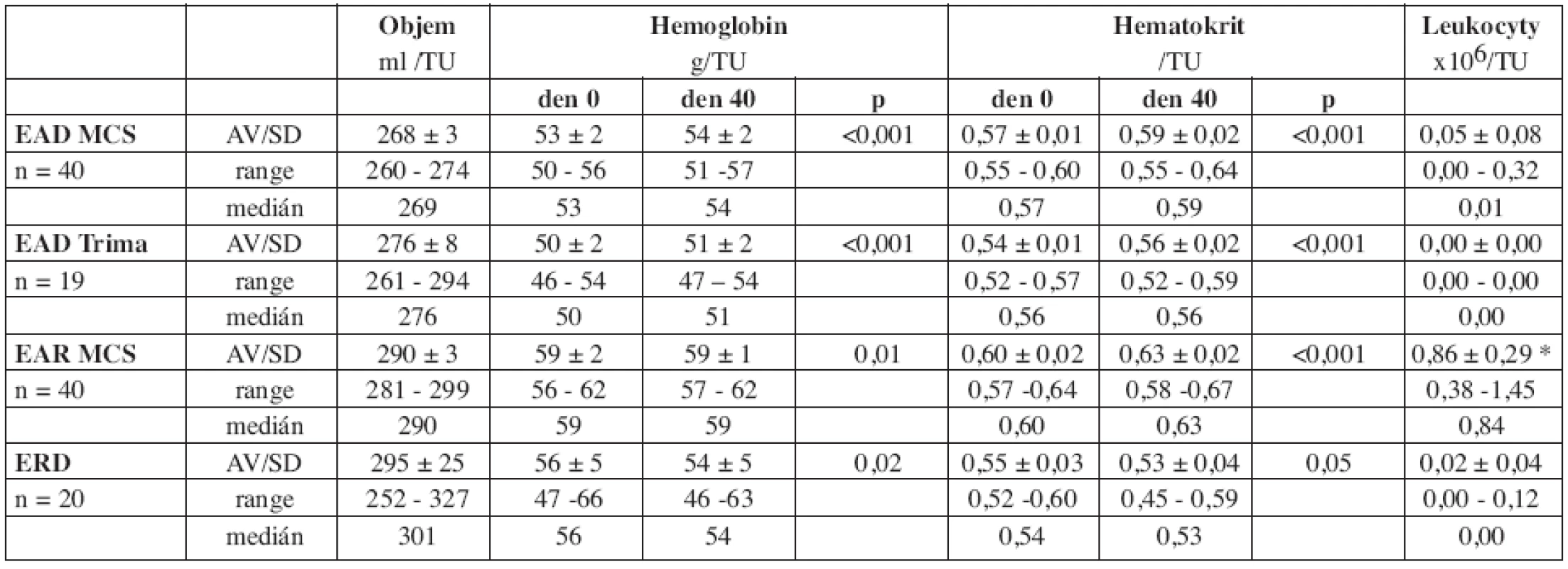
Legenda: EAD MCS: erytrocyty deleukotizované ze separátoru MCS, EAD Trima: erytrocyty deleukotizované ze separátoru Trima, EAR MCS: erytrocyty resuspendované ze separátoru MCS, ERD: erytrocyty deleukotizované z plné krve, * x 109/TU, n: počet transfuzních jednotek. EAD MCS, EAD Trima i EAR MCS vykázaly v souladu s jinými autory (1, 2) vysoký standard objemu a obsahu Hb v TU v porovnání s ERD. U všech jednotek bylo docíleno predikovaného obsahu Hb (> 40 g/TU). Během skladování nedošlo ke snížení obsahu Hb či hodnot Ht v přípravku. Obsah leukocytů u EAD MCS i EAD Trima vyhovoval doporučenému limitu (< 1 x 106/TU) u všech jednotek. U EAR MCS 6 TU stanovený limit (< 1,2 x 109/TU) nesplnilo, 12 TU obsahovalo hraniční příměs leukocytů ( > 1 x 109/TU).
U všech typů erytrocytárních koncentrátů z aferézy i kontrolního souboru erytrocytů plné krve došlo ke statisticky významnému vzestupu markerů membránového poškození buňky. Výsledky stanovení hodnot volného Hb, pH, kalia, hladiny LDH a annexinu V v den skladování 0 a 40 uvádí tabulka 4.
Tab. 4. Vývoj parametrů membránového poškození erytrocytu. 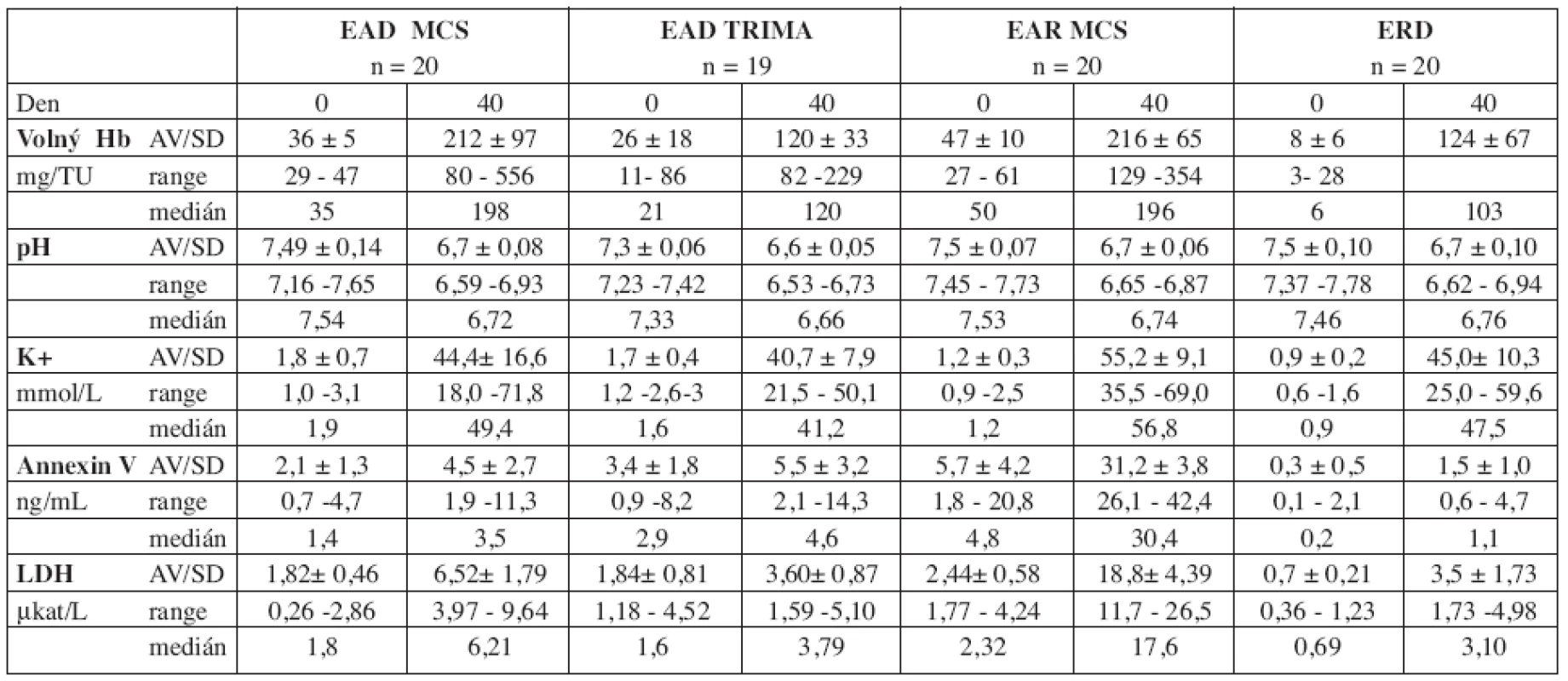
Legenda: EAD MCS: erytrocyty deleukotizované ze separátoru MCS, EAD Trima: erytrocyty deleukotizované ze separátoru Trima, EAR MCS: erytrocyty resuspendované ze separátoru MCS, ERD: erytrocyty deleukotizované. Pro všechny rozdíly mezi dnem 0 a 40: p < 0,001. Předepsaný stupeň hemolýzy (< 0,8 % erytrocytové masy na konci skladování) byl splněn u všech odebraných produktů. Vzestup obsahu volného Hb byl významnější u EAD i EAR ze separátoru MCS v porovnání s ERD z plné krve (EAD MCS: p = 0,03, EAR MCS: p = 0,009) i s EAD Trima (p < 0,001). Rozdíl mezi EAD Trima a ERD nebyl statisticky významný (p = 0,18) (graf 1a). Nejvýznamnější vzestup hladiny kalia jsme zaznamenali u EAR MCS (proti EAD MCS: p = 0,007, proti EAD Trima a ERD: < 0,001), mezi ostatními přípravky nebyly statisticky významné rozdíly (EAD Trima proti EAD MCS: p = 0,19, EAD Trima proti ERD: p = 0,10, EAD MCS proti ERD: p = 0,98) (graf 1b). Korelaci hodnot kalia se stupněm hemolýzy jsme nepotvrdili (r: EAD MCS: -0,1, ERD: 0,1, EAR MCS: 0,3, EAD Trima: -0,2). Významný pokles pH jsme zaznamenali u EAD Trima proti EAR (p < 0,001) a proti EAD MCS (p = 0,03). U žádného typu erytrocytárního přípravku pH nekleslo pod hodnotu 6,5. Vzestup hodnot LDH běhemskladování byl nejvyšší u EAR MCS, vyšší u EAD MCS než u EAD Trima (vše p < 0,001) (graf 1c).Hodnoty LDH korelovaly se stupněm hemolýzy u všech typů erytrocytárních koncentrátů s výjimkou EAD Trima (r: EAD MCS: 0,7, ERD: 0,9, EAR MCS: 0,5). Vzestup hodnot annexinu V byl nejvýznamnější u EAR MCS (p < 0,001). U EAD Trima a EAD MCS byl vzestup annexinu V srovnatelný (p = 0,33) (graf 1d).Při porovnání EAD Trima s ERD z plné krve nebyl zjištěn statisticky významný rozdíl (p = 0,25), u EAD MCS byl vzestup vyšší (p = 0,009). Hladiny annexinu V korelovaly se vzestupem volného Hb u EAD MCS a ERD, s LDH pouze u ERD (graf 2).
Graf 1. Vývoj poškození erytrocytů během skladování. 1a: Volný hemoglobin; 1b: Kalium; 1c: LDH; 1d: Annexin V Legenda: MCS: erytrocyty deleukotizované ze separátoru MCS, Trima: erytrocyty deleukotizované ze separátoru Trima, EAR: erytrocyty resuspendované ze separátoru MCS, ERD: erytrocyty deleukotizované z plné krve. 
Graf 2. Závislost vzestupu annexinu V na volném hemoglobinu a LDH. Annexin V proti Hb EAD MCS: r = 0, 8, p < 0,001 ERD: r = 0,5, p = 0,01 EAR MCS: r = 0,13, p = 0,61 EAD Trima: r = 0,22, p = 0,40 Annexin V proti LDH ERD: r = 0,8, p < 0,001 EAD MCS: r = 0,4, p = 0,08 EAD Trima: r = 0,4, p = 0,16 EAR MCS: r = 0,13, p = 0,6 Legenda: EAD MCS: erytrocyty deleukotizované ze separátoru MCS, EAD Trima: erytrocyty deleukotizované ze separátoru Trima, EAR MCS: erytrocyty resuspendované ze separátoru MCS, ERD: erytrocyty deleukotizované resuspendované. 
Diskuse
Cílem studie bylo zhodnotit parametry jakosti, zejména markery buněčného poškození erytrocytů z aferézy ze dvou typů separátorůs odlišnou technologií aferézy.
Hodnotili jsme dva typy erytrocytů získané dvojitou erytrocytaferézou ze separátoru Haemonetics MCS+ (aferéza probíhá v cyklech): EAR MCS (erytrocyty resuspendované) a EAD MCS (deleukotizované). Ze separátoru Trima Accel (kontinuální aferéza) jsme hodnotili EAD Trima (deleukotizované) získané kombinovaným odběrem s trombocyty.
Při hodnocení základních parametrů jakosti (objem přípravku, obsah Hb, Ht, příměs leukocytů) EAD MCS, EAD Trima i EAR MCS vykázaly v souladu s jinými autory (1, 2, 21, 22) vysoký standard objemu i obsahu Hb v TU (tab. 3). Všechny deleukotizované EAD MCS i EAD Trima vyhověly limitu na příměs leukocytů v TU (< 1,0 x 106/TU) (3). Avšak u EAR MCS se průměrná kontaminace leukocyty pohybovala na hranici doporučeného limitu (0,9 ± 0,6 x 109/TU), 6 TU ze 40 požadovaný obsah leukocytů (< 1,2 x 109/TU) nesplnilo. Nebyl tak splněn jeden ze základních požadavků na jakost přípravku. Přípravek jsme proto nezavedli do běžné praxe.
U hodnocených souborů EAD MCS, EAD Trima i EAR MCS i kontrolního souboru ERD došlo ke statisticky významnému vzestupu markerů membránového poškození buňky(tab. 4). Přítomnost volného Hb v supernatantu přípravku je považována za známku poškození membrány erytrocytu (23).
Vzestup obsahu volného Hb byl vyšší u obou typů erytrocytů ze separátoru MCS ve srovnání s ERD z plné krve (ERD proti EAD MCS: p = 0,03, ERD proti EAR MCS: p = 0,009) i s EAD Trima (p < 0,001), nejvýznamnější byl u EAR MCS bez leukodeplece (p < 0,001) (graf 1a). Přes uvedené rozdíly byly hodnoty volného Hb u všech typů erytrocytárních koncentrátů hluboko pod povoleným limitem (< 0,8 % erytrocytové masy na konci skladování).
Při porovnání vývoje parametrů poškození buňky u deleukotizovaných erytrocytů z aferézy vykázaly EAD MCS vůči EAD Trima vyšší vzestup LDH (p < 0,001), vzestupy hladin kalia (p = 0,19) a annexinu V (p = 0,33) byly srovnatelné (graf 1b–d). U EAD MCS jsme prokázali korelaci hladiny volného Hb vůči LDH (r = 0,7) i annexinu V (r = 0,8), u EAD Trima jen mírnou vůči LDH (r = 0,4) vůči annexinu V nikoli (r = 0,22) (graf 2), pravděpodobně vzhledem k nižším hodnotám volného Hb na konci skladování u EAD Trima (p < 0,001). Zjištění korelace annexinu V s volným Hb je shodné s teoretickými konstatováními z literatury (11, 18), pro korelaci s LDH jsme nenalezli literární reference. Jde o náš původní nález, který pravděpodobně souvisí s mírou poškození erytrocytu a bude třeba jej dále ověřit.
Nejvýznamnější vzestup kalia, LDH a annexinu V vůči všem ostatním typům erytrocytů byl zaznamenán u EAR MCS (p < 0,001). Vzhledem k tomu, že EAR MCS jsou připraveny stejnou aferetickou technikou jako EAD MCS (odlišnost je jen v následné filtraci erytrocytů) lze předpokládat, že typ technologie přípravy koncentrátu jako takový patrně nemá takový vliv na poškození erytrocytu během skladování, jako kontaminace přípravku leukocyty (24). Bylo prokázáno, že přítomnost leukocytů v přípravku může indukovat poškození krevních buněk (9).Toto tvrzení lze doložit i dalšími zdroji, které konstatují, že kombinace mechanického traumatu a přítomnosti leukocytů v přípravku zvyšuje hladinu volného Hb a kalia (18), a že leukodeplece snižuje stupeň hemolýzy v přípravku na konci exspirace (25). Tento předpoklad může doložit i nejvýznamnější zvýšení hladin annexinu V u EAR MCS v porovnání s ostatními typy erytrocytárních koncentrátů (graf 1d).
U kontrolního souboru ERD z plné krve došlo během skladování k méně významným či srovnatelným změnám než u EAD MCS a EAD Trima (kalium: proti EAD Trima: p = 0,10, proti EAD MCS: p = 0, 98, volný Hb: proti EAD Trima: p = 0,18, proti EAD MCS: p = 0,03, annexin V: proti EAD Trima: p = 0,25, proti EAD MCS: p = 0,009). Naše výsledky při hodnocení volného Hb u EAD Trima a ERD jsou v souladu s prací Elfatha a spol., 2000 (4).
Dále jsme u EAD MCS, EAD Trima i EAR MCS zaznamenali pokles pH.
Významný je poznatek, že u žádného typu přípravku pH nekleslo pod hodnotu 6,5, stejně jako zjistili Moog a spol., 2001 (1). Hodnota pH má vliv na enzymy regulující koncentraci 2,3-DPG. Tím významně ovlivňuje jeho hladinu a následně vazbu kyslíku k Hb (8, 26). Hodnota pH může však být ovlivněna mimo proces apoptózy i koncentrací citrátu v antikoagulačním roztoku (16).
Některé literární zdroje konstatují, že jakost erytrocytů z aferézy při hodnocení markerů buněčného poškození je vyšší nežli u přípravků z plné krve (1, 8, 16). Tyto práce vycházejí z téze, že aferetická technika je vůči manuálním odběrům plné krve šetrnější díky postupnému přidávání antikoagulans v nižší koncentraci ve srovnání s jednorázovým „šokovým“ kontaktem s antikoagulans při odběru plné krve. Je pravděpodobné, že aferetická technika takto může minimalizovat tzv. RBC collection injury při odběru (10, 13, 16). Dle našeho názoru je však při formulaci závěrů třeba zvážit komplexní vliv celé řady faktorů působících na erytrocyt během přípravy a skladování. Významný je rozdíl mezi manuálním zpracováním plné krve, kdy po odsátí plazmy zůstávají erytrocyty v původním vaku, na rozdíl od automatického zpracování systémem „top and bottom“, kdy erytrocyty jsou vytlačovány pod tlakem do sekundárního vaku a mohou být při této manipulaci mechanicky poškozeny. Zásadní vliv na stav erytrocytu má také způsob filtrace produktu, typ použitého filtru, její trvání či teplota, při které je prováděna (14, 19, 27). Bez významu nejsou pravděpodobně ani velké rozptyly naměřených hodnot v námi hodnocených i literárních souborech dané tím, že hodnocené parametry mohou být ovlivněny přirozeným stářím erytrocytů při odběru (28). Porovnání s literaturou je velmi obtížné, stanovení a hodnocení annexinu V pro porovnání našich výsledků v tomto rozsahu nebylo zatím publikováno.
Uzavíráme proto, že pro další vývoj stavu erytrocytů v přípravku z MKO má technologie jejich přípravy oběma separátory minimální vliv. Rozhodující vliv mají skladovací podmínky, mimo obsahu leukocytů v přípravku i složení a hodnota pH skladovacího roztoku (26, 29) a pravděpodobně i další faktory.
Otázkou je klinický význam popsaných změn erytrocytu. Aktuálně je diskutován zejména vliv pH na obsah 2,3-DPG v koncentrátu erytrocytů s následnými změnami v uvolňování O2 z Hb (26, 30) a následný význam v akutní péči, zejména v souvislosti s aplikací erytrocytárních koncentrátů v druhé polovině exspirace (31). Vzhledem k tomu, že řada autorů se zabývá vlivem působení apoptotických buněk v organismu (6), tedy i apoptotických buněk dodaných transfuzí, nelze klinický význam těchto změn vyloučit (32).
Poděkování: Autoři děkují RNDr. Lence Hubáčkové za statistické zpracování výsledků.
MUDr. Renata Procházková, Ph.D.
Transfuzní oddělení
Krajská nemocnice Liberec a.s.
Baarova 15
460 63 Liberec
Doručeno do redakce: 3. 9. 2008
Přijato: 11. 11. 2008
Zdroje
1. Moog R, Franck V, Pierce JA,¨Muller N. Evaluation of a concurrent multicomponent collection system for the collection and storage of WBC – reduced RBC apheresis concentrates. Transfusion 2001; 41 : 1159–1164.
2. Moog R, Bartsch R, Muller N. Concurrent collection of in-line filtered platelets and red blood cells by apheresis. Ann Haematol 2002; 81 : 322–325.
3. Guide to the preparation, use and quality assurance of blood components. 10th ed. Strasburg, Council of Europe Publishing, 2004.
4. Elfath MD, Whitley P, Jacobson MS, et al. Evaluation of an automated system for the collection of packed RBCs, platelets, and plasma. Transfusion 2000; 40 : 1214–1222.
5. Smith J.W., Gilcher R.O. The future of automated red blood cell collection. Transfus Apher Sci 2006; 34 : 219–226.
6. Dzik WH. Apoptosis, TGF beta and transfusion – related immunosupresion: Biologic versus clinical efects. Transf Apher Sci 2003; 29 : 127–129.
7. Lang F, Foller M, Lang KS, et al. Ion channels in cell proliferation and apoptotic cell death. J Membrane Bioll 2005; 205 : 147–157.
8. Leitner GC, Stohlawetz P J, Stiegler G, et al. Quality of packed red blood cells and platelet concentrates by multicomponent collection using the MCS Plus device. Journal of Clinical Apheresis 2003; 18 : 21–25.
9. Solheim BG, Flesland O, Seghatchian J, Brosstad F. Clinical implications of red blood cell and platelet storage lesions: an overview. Transfus Apher Sci 2004; 31 : 185–189.
10. Gibson JG, Murphy WP, Scheitlin WA, et al. The influence of intracellular factors involved in the collection of blood in ACD on maintenance of red cell viability during refrigerated storage. Am J Clin Pathol 1956; 26 : 858–873.
11. Bessos H, Seghatchian J. Red cell storage lesions: The potential impact of storage induced CD47 decline on immunomodulation and the survival of leucofiltered red cells. Transf Apher Sci 2005; 32 : 227–232.
12. Wolfe LC. The membrane and the lesions of storage in preserved red cells. Transfusion 1985; 25 : 185–202.
13. Matthes G A. Options and cost effectiveness of multicomponent blood collection. Transfus Apher Sci 2002; 27 : 115–121.
14. Müller – Steinhardt M, Janetzko K, Kandler R, Flament J, Kirchner H, Kluter H. Impact of various red cell concentrate preparation methods on the efficiency of prestorage white cell filtration and red cells during storage for 42 days. Transfusion 1997; 37 : 1137–1142.
15. Llohn A, Vetlesen A, Fagerhol MK, Kjeldsen-Kragh J. The effect of pre-storage cooling on 2,3-DPG levels in red cells stored in SAG-M. Transfus Apher Sci 2005; 33 : 113–118.
16. Holme S, Elfath MD., Whitley P. Evaluation of in vivo and in vitro quality of apheresis-collected RBC stored for 42 days. Vox Sanq 1998; 75 : 212–217.
17. Krailadsiri P, Seghatchian J. Effect of processing and storage on platelet activation, cellular injury and microvesiculation. Transfus Apher Sci 2001, 24 : 237–238.
18. Seghatchian J, Krailadsiri P. Red cell storage lesion assesed by the levels of potassium, hemoglobin and annexin V in supernatantant. Transfus Apher Sci 2002; 26 : 121–127.
19. Hornsey V, Drummond O, Mac Gregor I, et al. Leucofiltration, retention/generation of soluble prion and Annexin V and storage of blood components. Transfus Sci 2000; 22 : 75–76.
20. Lin SJ, Tzeng CH, Hao HY, et al. Cytokine release in febrile non-haemolytic red cell transfusion reactions. Vox Sanq 2002; 82 : 156–160. Sweeney JD. Standardization of the red cell product. Transfus Apher Sci 2006; 34 : 213–218.
21. Zeiler TA, Kretschmer V. Automated blood component collection with the MCS 3p cell separator: evaluation of three protocols for buffy coat – poor and white cell-reduced packed red cells and plasma. Transfusion 1997; 37 : 791–797. Sowemimo-Coker SO. Red blood cell hemolysis during processing. Transfus Med Rev 2002; 16 : 46–60.
22. Procházková R, Andrýs C, Bláha M, Krejsek J. Storage lesions in red blood cell concentrates from separator Haemonetics MCS+ and Trima Accel. Vox Sanq 2008; 95 (suppl 1): 85.
23. Gyongyosy-Issa MIC, Weiss SL, Sowenimo-Coker SO. Prestorage leukoreduction and low-temperature filtration reduce hemolysis of stored red cell concentrates. Transfusion 2005; 45 : 90–96.
24. Hess JR. An update on solutions for red cell storage. Vox Sanq 2006; 91 : 13–19. Bandarenko N, Rose M, Kowalsky RJ, et al. In vivo characteristics of double units of RBC collected by apheresis with a single in-line WBC reduction filter. Transfusion 2001; 41 : 1373–1377.
25. Sparrow RL, Healey G, Patton KA, Veale FV. Red blood cell age determines the impact of storage and leukocyte burden on cell adhesion molecules, glycophorin A and the release of annexin V. Transfus Apher Sci 2006; 34 : 15–23.
26. Högman CF, Löf H, Meryman HT. Storage of red blood cells with improved maintenance of 2,3-bisphosphoglycerate. Transfusion 2006; 46 : 1534–1552.
27. Högman CF, Meryman HT. Red blood cells intended for transfusion: quality criteria revisited.Transfusion 2006; 46 : 137–142.
28. Offner PJ. Age of blood: does it make a difference? Critical Care 2004; 8 (suppl 2): S24–S26.
29. Blanco L. Tailored collection of multicomponent by apheresis. Transfus Apher Sci 2002; 27 : 123–127.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
- Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
- Vyhledávání příbuzenského dárce krvetvorných buněk – koordinace procesu a výsledky jednoho centra
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- DNA mikročipy (microarrays) v diagnostice folikulárního lymfomu: cesta k terapii „šité na míru“ nebo slepá ulička?
- Autotransfuze v České republice v roce 2007
- GRATULUJEME
- Vybrané odborné akce v roce 2009
- OBSAH ROČNÍKU 14/2008 Transfuze a hematologie dnes
- Diagnostika a léčba akutního peripartálního život ohrožujícího krvácení – doporučený postup
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Poporodní krvácení – doporučené postupy diagnostiky a léčby – editorial
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



