-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Chirurgie karcinomu prsu - taktika a technika operací
Autoři: J. Gatěk 1
; M. Duda 2,3
Působiště autorů: Nemocnice Atlas Zlín Univerzita Tomáše Bati ve Zlíně 1; II. chirurgická klinika Fakultní nemocnice Olomouc 2; Chirurgické oddělení nemocnice a Komplexního onkologického centra Nový Jičín 3
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 3, s. 172-180.
Kategorie: Postgraduální vzdělávání
Úvod
Karcinom prsu patří v naší populaci k nejčastějším zhoubným nádorům a jeho zdravotní, ekonomický i společensko-etický význam je neobyčejně vysoký (Obr. 1). Onkochirurgické operace jsou zatím v České republice prováděny na poměrně velkém počtu pracovišť. Dle údajů z Národního onkologického registru (NOR), zpracovaného Systémem pro vizualizaci onkologických dat (SVOD) za léta 2001–2005, byly operace pro karcinom prsu prováděny v tomto období na více než 100 pracovištích, ale jen na 34 z nich byla jejich frekvence více než 40 operací za rok. Velmi závažným zjištěním je skutečnost, že pětileté přežívání u stejných stadií nádorového onemocnění značně kolísá u různých pracovišť v závislosti na počtu provedených operací v neprospěch pracovišť s nízkou frekvencí výkonů [1]. Zvyšující se nároky na kvalitu chirurgické péče vyžadují, aby taktika a technika chirurgického výkonu odpovídala vždy současným, mezinárodně ověřeným postupům. I když jsou dnes k dispozici aktuální zdroje informací o všeobecně akceptované taktice a technice těchto operací, považovali jsme za potřebné a užitečné shrnout zde stručně nejdůležitější fakta pro potřeby postgraduálního vzdělání.
Obr. 1. Invazivní duktuální karcinom prsu zobrazený na mamografii v šikmé projekci 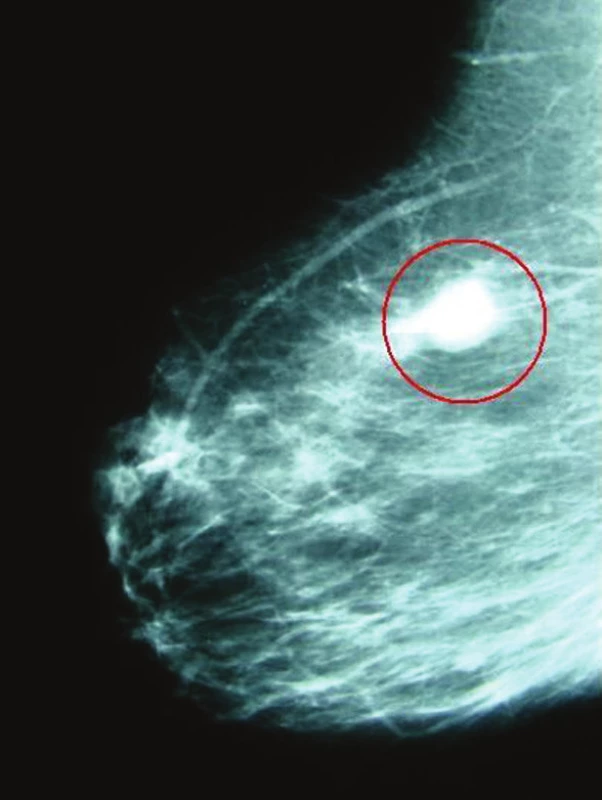
Metody
Výkony na prsu
Invazivní karcinom
Cílem chirurgické léčby musí být: 1. odstranění nádoru, 2. lokální kontrola onemocnění, 3. zařazení onemocnění do stadia, 4. uspokojující kosmetický efekt, 5. rehabilitace. Všechny tyto cíle musejí být zahrnuty do léčebného plánu. Chirurgické výkony na prsu u karcinomu lze v podstatě rozdělit do tří skupin: 1. konzervativní – prs záchovné, 2. radikální – odstraňující prs, 3. rekonstrukční – rekonstrukce prsu po mastektomii nebo po konzervativním výkonu s nepřijatelným kosmetickým výsledkem. Rekonstrukční výkony jsou náplní plastické chirurgie.
Radikální výkony
Prostá mastektomie
Při prosté mastektomii je kompletně odstraněna tkáň prsní žlázy s axilárními uzlinami první etáže. Je používána buď u DCIS (duktální karcinom in situ), nebo jako paliativní výkon u pokročilého karcinomu. V současnosti jsou také používány varianty prosté mastektomie, u kterých je prsní žláza odstraněna a kůže prsu je více či méně šetřena pro navazující plasticko-rekonstrukční výkony (subkutánní mastektomie, skin sparing mastektomie).
Radikální mastektomie dle Halstedta
Odstraňuje se kompletně prsní žláza, velký i malý prsní sval. V axile je odstraňována tuková tkáň axily s uzlinami všech tří etáží en block. Nervově cévní svazek axily je neporušený.
Rozšířená radikální mastektomie
Rozšířená radikální mastektomie na rozdíl od předešlého výkonu zahrnovala odstranění i parasternálních uzlin. Zvýšená radikalita nepřinesla zásadní zlepšení prognózy pacientek, avšak zvyšovala jejich mutilaci.
Modifikovaná radikální mastektomie
Nedostatky radikálních výkonů překonává modifikovaná radikální mastektomie, kterou navrhl Patey. Zůstává zachován velký prsní sval, ale je odstraněn malý prsní sval, přičemž dochází k poranění pektorálního nervu s atrofií laterální části velkého pektorálního svalu. Uzliny I. a II. etáže jsou odstraněny. Zachovává se thorakodorsální nervově-cévní svazek, n. thoracicus longus. V Madenově variantě, nyní nejčastěji používané, se jedná o radikální výkon u pokročilého karcinomu a je odstraněna prsní žláza s pektorální fascií. Ponechán je velký i malý prsní sval a je zachován pektorální nerv. Pouze interkostobrachiální nerv může být obětován, protože prochází tukovou tkání a uzlinami axily. Při maligním postižení axily je jeho zachování mnohdy nemožné. Kožní řez je veden šikmo od dolního okraje sterna směrem do axily nebo vodorovně od středu prsní kosti laterálně. Pro tento typ radikální modifikované mastektomie se také často užívá označení ablace prsu.
Konzervativní výkony
Konzervativní neboli prs záchovné výkony odstraňují nádor s volným lemem zdravé tkáně a zachovávají prs i s bradavkou [2] (Obr. 2).
Obr. 2. Stav po konzervativním výkonu pro karcinom prsu s biopsií sentinelové uzliny 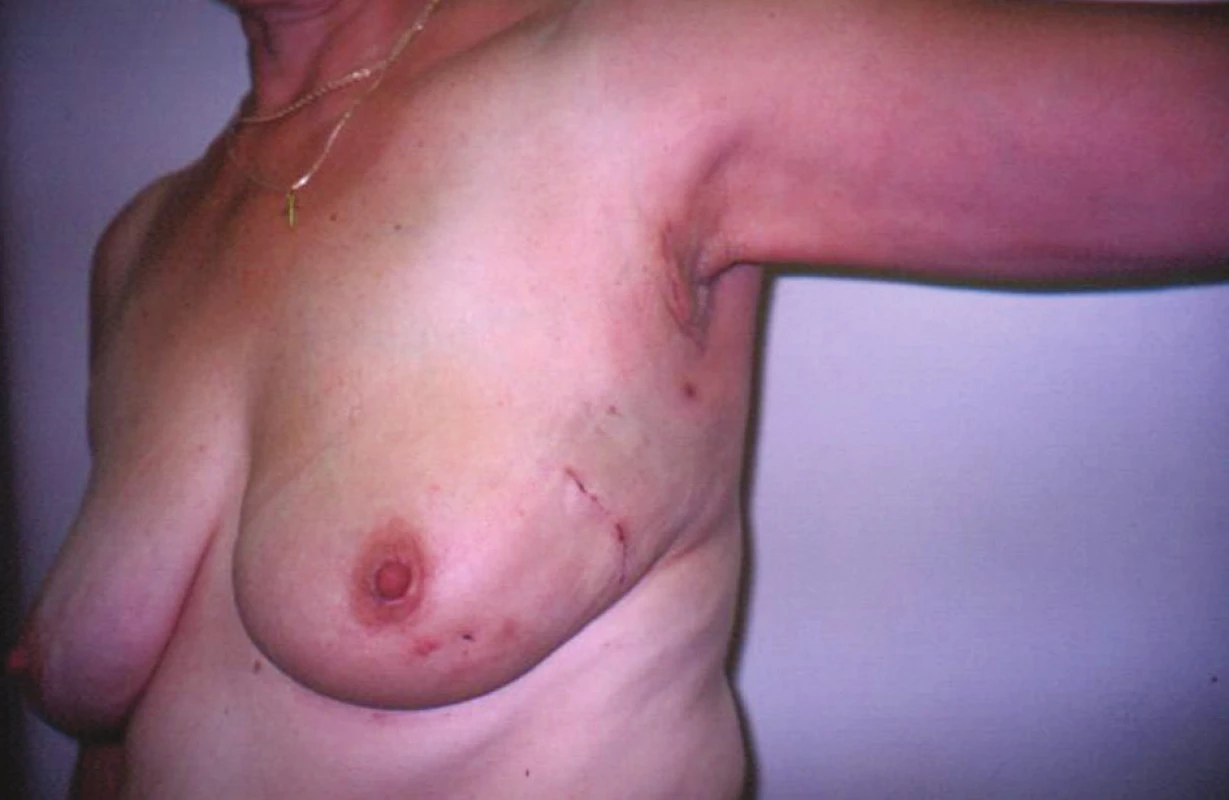
Konsenzus konference v r. 1990 u konzervativního výkonu: bylo doporučileno odstranit nádor s 1 cm okolní tkáně makroskopicky bez nádorových buněk. Mikroskopicky by se maligní buňky neměly dotýkat inkoustem označeného okraje. Resekát by měl být pro patologa stranově označen stehem či barvou (Obr. 3 a 4). Kožní incize u hmatných karcinomů by měla být vedena nad nádorem.
Obr. 3. Operační preparát po záchovné operaci – barvení okrajů resekátu 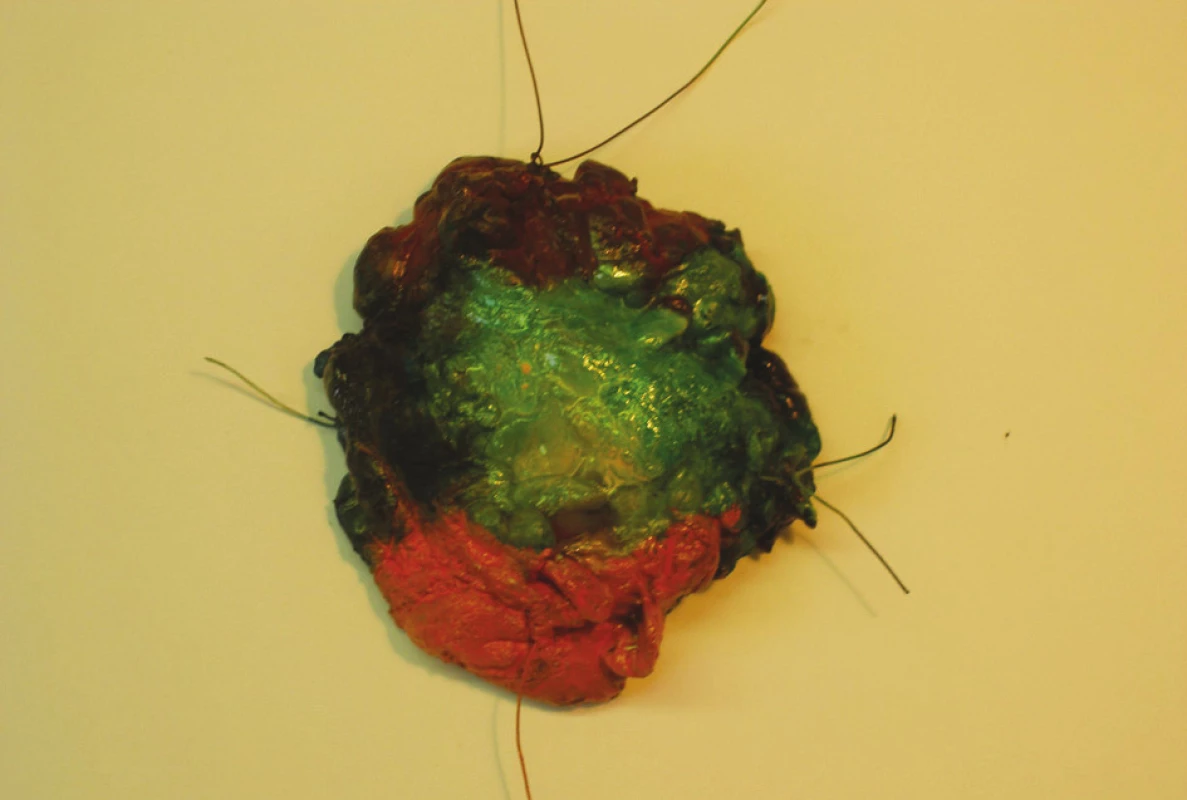
Obr. 4. Histologický obraz duktálního karcinomu se zbarveným resekčním okrajem a vyznačenou vzdáleností tumoru od okraje preparátu 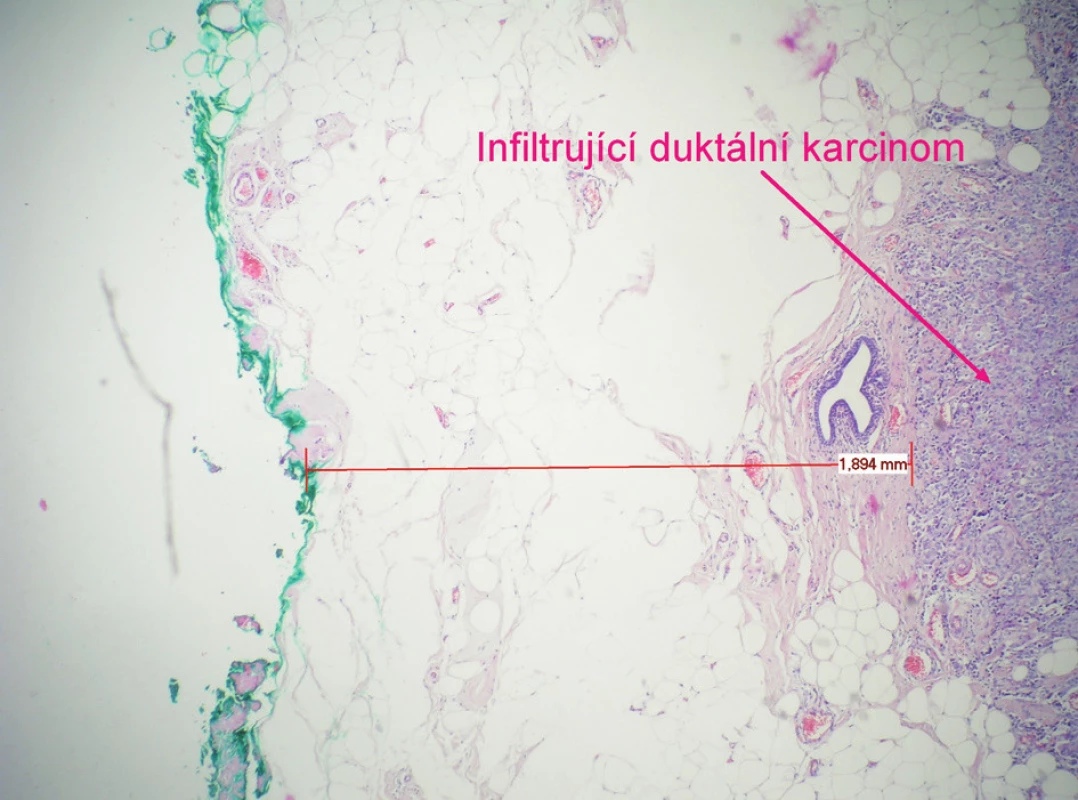
U nehmatných nádorů je nutné předoperační značení barvou či drátky (ROLL-radio-guided occult lesion localisation) (Obr. 5). V horních kvadrantech je doporučeno volit obloukovité řezy. V dolních kvadrantech je možné využít radiální řez, aby nedošlo k rotaci bradavky kaudálně (Obr. 6).
Obr. 5. Mamografický obraz resekátu s označením místa po biopsii klipem a předoperačně stereotakticky zavedeným drátkem s kotvičkou k identifikaci ložiska při operaci 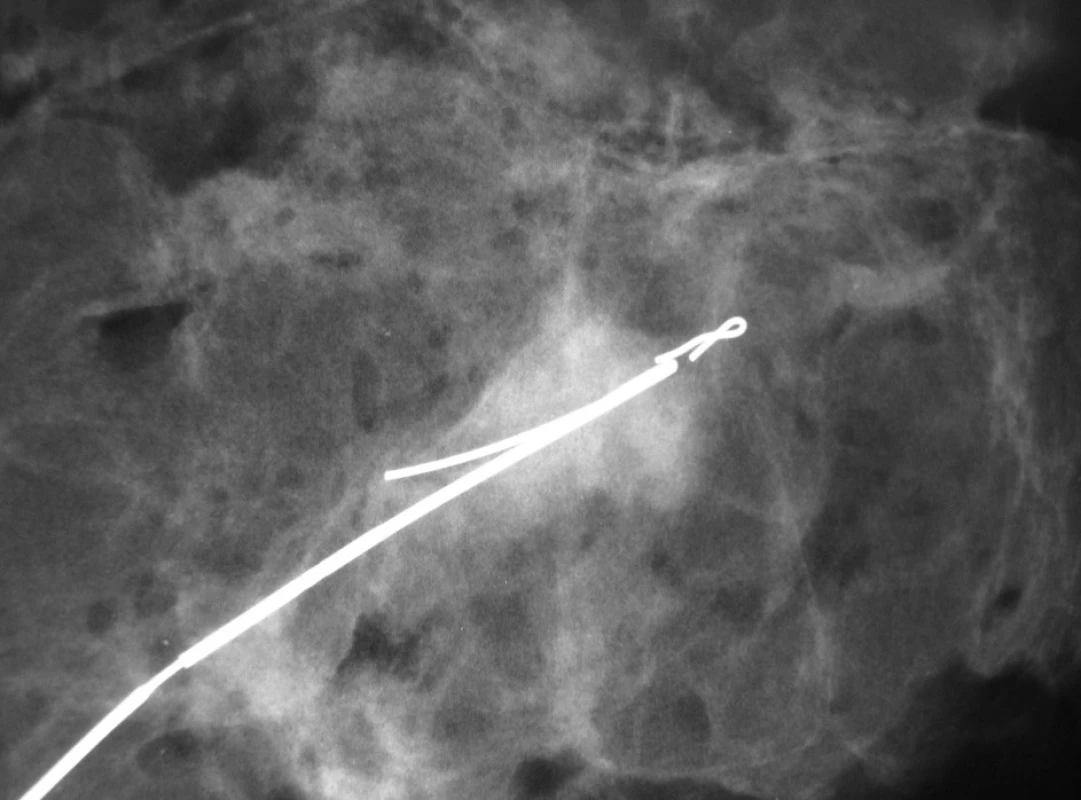
Obr. 6. Schematické znázornění vhodného vedení kožních řezů při záchovných operacích 
Konzervativní postupy byly do léčby zařazeny na základě výsledků randomizovaných studií, které srovnávaly výsledky mastektomií a konzervativních výkonů. Nejvýznamnější roli sehrály nezávislé studie NSABP, NCI, EORTC, dánská, francouzská a milánská. Protokol studií se velmi lišil, avšak výsledky se shodovaly a prokázaly stejnou dobu přežití po mastektomii a po konzervativních výkonech. Závěry studií byly zhodnoceny na Conference on the Treatment of Early-Stage Breast Cancer 1990 konané v USA. Konzervativní výkony byly označeny jako vhodná metoda léčby pro převážnou většinu žen s karcinomem I. a II. stadia. Výsledky byly publikovány v časopise JAMA v roce 1991 [3]. Dvacetileté celosvětové zkušenosti s konzervativními výkony byly opět hodnoceny v Miláně 2005 na Concensus Conference on Breast Conservation. Bylo opět potvrzeno, že většina nádorů T1 a menší nádory T2 mohou být léčeny konzervativně [4]. Moderní multimodální terapie zvyšuje bezpečnost konzervativních výkonů. Mezinárodní konsenzus z roku 2010 souhlasí s předchozími závěry. Negativní okraj definuje „jako tumor nedotýkající se okrajů“ a konstatuje, že chybějí potřebné studie k průkazu přínosu širších resekčních okrajů ke snížení lokálních recidiv. Linie řezu nádorem je vždy indikací k reoperaci [5]. Zásadní indikací a také kontraindikací konzervativního výkonu je přání pacientky. V současnosti panuje poměrná shoda na kontraindikacích konzervativních výkonů: neschopnost dosáhnout negativních okrajů, velikost nádoru přes 5 cm, multicentrický nádor přesahující kvadrant, nepřijatelný poměr mezi velikostí tumoru a prsu a tím kosmetický výsledek, nemožnost pooperační radiace, difuzní maligní mikrokalcifikace, karcinom prsu u kolagenních chorob (lupus, sklerodemia), zánětlivý karcinom. Výkon je nevhodný v prvním a druhém trimestru gravidity.
Terminologie jednotlivých resekčních výkonů není přesně definována, a tak často dochází k prolínání pojmů.
Lumpektomie
Lumpektomie je popsána v doporučení Konsenzus konference jako odstranění nádoru s makroskopicky normální tkání prsu v šíři asi 1 cm. Mikroskopicky by okraje neměly obsahovat tumorózní buňky a neměly by být v kontaktu s inkoustem. Tento výkon můžeme charakterizovat jako nejméně radikální.
Kvadrantektomie
Termín definoval Veronesi jako resekci 2–3 cm volné tkáně od hranice nádoru. Excize zahrnuje kůži nad tumorem a současně i pod ní ležící pektorální fascii.
Segmentální resekce, široká excize
Pojmy, které jsou používány pro výkony, při kterých dochází k odstranění rozsáhlejšího objemu prsní tkáně než při lumpektomii, ale nemají přesnou definici.
Onkoplastické výkony
Stále častěji jsou však u hraničních nálezů z hlediska velikosti a uložení nádoru využívány onkoplastické postupy, které umožňují odstranění i větších nádorů spojením plastické a onkologické chirurgie. S pomocí onkoplastických výkonů lze odstranit až 20–40 % tkáně prsu. Onkoplastické výkony zahrnují „onkologické“ odstranění nádoru s částečnou rekonstrukcí využívajících plastických postupů. Korekce druhého prsu je často součástí takových postupů. Pro onkochirurgické výkony platí stejný požadavek jako u všech konzervativních výkonů na zajištění volných resekčních výkonů [6].
DCIS
DCIS se vyskytoval před screeningem v sestavě karcinomů prsu kolem 5 % a po jeho zavedení již tvoří 15 až 20 %. U DCIS neexistuje jednotné doporučené terapeutické schéma léčení. Orientací může být van Nuys index, který hodnotí riziko vzniku lokální recidivy po konzervativním výkonu na základě bodů vycházejících z velikosti ložiska, resekčního okraje, histopatologického vyšetření a věku. Avšak sám autor van Nuys u indexu Silverstein uvádí: přetrvává množství nejistot, které způsobují zmatky a stresují pacienty i lékaře. Konzervativní metody byly také využity v léčení DCIS, avšak jsou provázeny vysokým procentem lokálních recidiv. Lokální recidivy po pouhém konzervativním chirurgickém výkonu na prsu u DCIS přesahují 20 % a jsou tvořeny invazivním karcinomem až v 50 %. Konzervativní chirurgický výkon doplněný radiací snižuje výskyt lokálních recidiv na polovinu. Tento závěr potvrdilo několik významných studií, zvláště B–17 a studie EORTC [7, 8]. Lokální excize s radiací u pacientek s negativními resekčními okraji zajišťuje excelentní lokální kontrolu onemocnění. Není konsenzus v určení skupiny pacientek, u kterých je možná pouze lokální terapie bez radioterapie. Byla stanovena pouze doporučení, že proces by neměl přesahovat 2–3 cm, volný okraj by měl být minimálně 10 mm, grading s velmi dobře nebo středně diferencovaným typem. U DCIS léčených bez radiace byla podmínka 10 mm volného okraje. V současnosti není tento názor plně akceptován a je doporučen minimální volný okraj 2 mm a radiace [5]. Metastázy v axilárních uzlinách se vyskytují jen výjimečně, takže od rutinní disekce axilárních uzlin bylo upuštěno. Biopsie sentinelové uzliny byla zařazena do chirurgické léčby DCIS.
Mužský karcinom
Karcinom prsu se vyskytuje u mužů asi v 1 % všech diagnostikovaných karcinomů prsní žlázy. V klinickém obraze pozorujeme změněnou subareolární masu. Nádory u mužů jsou obvykle pokročilejší než u žen. Bradavka je zvýšeně citlivá, bolestivá, mohou vzniknout ulcerace. Není výjimkou, že se nádor projevuje zvětšenými uzlinami jako jediným příznakem. Vzdálené metastázy jsou také častější u mužů. Karcinom je tuhý, tvrdý a často s fixovanou kůží. Mamografie není tak významná. Většina léčebných postupů karcinomu prsu u mužů je odvozena od terapie ženského karcinomu. Převážně je prováděna modifikovaná radikální mastektomie s odstraněním uzlin I. a II. etáže. Prs a axilární uzliny mohou být odstraněny z jednoho nebo ze dvou samostatných řezů. Nutnost zajistit volné okraje platí stejně u mužů jako i u žen. Široká excize je prováděna u starých a komorbidních pacientů [9]. Biopsie sentinelové uzliny platí také u mužů.
Gravidita
V terapii karcinomu prsu v graviditě je nezbytný multidisciplinární přístup zkušeného týmu. Kvalita chirurgického výkonu má u těchto nádorů klíčové postavení. Karcinom prsu v těhotenství je definován jako nádor, který je diagnostikován v průběhu těhotenství a rok po porodu. Karcinom prsu (po karcinomu hrdla děložního) je druhou nejčastější maligní diagnózou v těhotenství. Počet se zvyšuje, protože se zvyšuje počet žen, které odkládají první těhotenství do vyššího věku. Chirurgickým řešením je obvykle modifikovaná radikální mastektomie. O konzervativním výkonu se obvykle uvažuje na konci druhého a ve třetím trimestru, protože radiace není považována za zcela bezpečnou pro fétus. Názory se však vyvíjejí. Během těhotenství jsou dukty rozšířené a zvýšené prokrvení prsu může ovlivnit vzdálenost intraduktálního šíření karcinomu, což klade zvýšené nároky na kompletní odstranění nádoru a spolehlivé vyšetření resekčních okrajů. Konzervativní výkony jsou obvykle provedeny během těhotenství a radiace je indikována po porodu. Začátek radiační terapie by neměl přesahovat 12 týdnů po chirurgickém výkonu. Využití biopsie sentinelové uzliny je možné. Existují však rozpory o bezpečnosti použití technecia kvůli riziku radiace. U Patent Blue je třeba počítat s rizikem alergické reakce a není ověřeno působení na těhotné, proto se obvykle provádí disekce axily [10].
Karcinom u mladých žen
Studií, které jsou přímo zaměřeny na karcinom prsu mladého věku, není mnoho a věková hranice se různí. Počet pacientek léčených v jednotlivých centrech není vysoký, což omezuje získání zkušeností. Nádory u mladých žen jsou často diagnostikovány později než u starších žen. Na tuto diagnózu se nemyslí a mladé ženy nejsou součástí screeningových programů. Nádory jsou obvykle agresivnější, méně diferencované s častějším postižením axilárních uzlin. Prognóza mladých žen je horší než u žen starších. Velmi významná je volba chirurgického výkonu a zachovat prs je požadavek téměř všech mladých žen, i když charakter a velikost nádoru výkonu neodpovídají [11]. Studie poukazují na zvýšené riziko lokálních recidiv a Voogd v EORTC uvádí riziko 9krát větší. Závěr žádné studie však neuvádí automatickou nutnost mastektomie v souvislosti s mladým věkem. Každý jednotlivý případ by měl být řešen individuálně, s ohledem na všechny informace, které vycházejí z charakteru nádoru.
Zánětlivý karcinom
Zánětlivý karcinom je charakterizován extrémně špatnou prognózou. Průměrné přežití je 2,9 roku ve srovnání s neinflammatorním karcinomem, které je 6,4 roku. Pro sledování podílu chirurgického léčení na celkové terapii je nedostatek přesných informací. Kombinací moderní chemoterapie, chirurgie a radioterapie se zlepšila doba přežití, avšak počet recidiv a relapsů se pohybuje stále od 25 % do 39 %. V současnosti je snaha opět zařadit chirurgický výkon do léčby, ačkoli v jiném pořadí ve schématu. Výkon je indikován až po chemoterapii. Chirurgický výkon není primárně indikován. Terapií je modifikovaná radikální mastektomie, s podmínkou dosažení zdravých okrajů a kompletního odstranění nádoru. Konzervativní výkon je kontraindikován. U karcinomů, u kterých nedochází k odpovědím na terapii, je prognóza velmi nepříznivá a také lokální kontrola je neuspokojivá. Přes odstranění nádoru se zdravými resekčními okraji a kombinaci chemoterapie, chirurgie a radioterapie se objevují lokální recidivy až ve 20 %. Kontraindikací k výkonu je supraklavikulární lymfadenopatie, fixované axilární uzliny, edém stejnostranné paže. V těchto případech je doporučena radioterapie [12].
Multicentrický karcinom
Multicentrický karcinom prsu zahrnuje výskyt dvou nebo více separátních karcinomů ve stejném prsu. Často dochází k zaměňování termínu multifokalita a multicentricita. V praxi jsou k určení multicentricity používány různé definice: vzdálenost mezi ložisky odpovídající koeficientu nádoru, minimální vzdálenost 5 cm, ložiska oddělená normální tkání, ložiska v různých kvadrantech prsu. Podíl multicentrického karcinomu je mezi 13–65 % v závislosti na definici. Multicentrický nádor hodnotíme dle největšího rozměru a ne součtem jeho částí. Po vyloučení separátních ložisek je možné indikovat konzervativní výkon. Pokud jsou ložiska v takové vzdálenosti, že mohou být všechna spolehlivě odstraněna s volnými okraji a s přijatelným kosmetickým efektem, je možné konzervativní výkon provést [13, 14].
Neoadjuvance a chirurgická léčba karcinomu prsu
U pokročilého karcinomu prsu je v současnosti neoadjuavantní chemoterapie považována za standardní léčbu a stále častěji je využívána i u časnějších stadií onemocnění [15, 16].
Přestože studie neprokázaly zlepšení délky přežití, má neoadjuvantní chemoterapie své přednosti. Redukuje rozsah nezbytného výkonu. Inoperabilní stavy se mění v operabilní, je možné provádět konzervativní výkony u nádorů určených k mastektomii. Neoadjuvantní chemoterapie působí nejen na původní tumor, ale i na metastázy a na mikrometastázy a umožňuje individualizovat terapii. Sledujeme odpověď nádoru na chemoterapii in vivo, a tak je možné identifikovat rezistentní nádory. K pozitivní odpovědi dochází až v 50–80 % a lze dosáhnout až kompletního vymizení nádoru. Kuerer uvádí až 24 % kompletních patologických odpovědí na neoadjuvantní terapii. Z rozsahu odpovědi lze také předpovídat vývoj nemoci. Nejlepší prognózu mají pacientky s kompletní patologickou odpovědí. Pokud jsou nádory na terapii rezistentní, léčba je přerušena a je proveden chirurgický výkon. Růst nádoru během terapie byl pozorován pouze v 5 % a rezistence je výjimečná. Nebylo prokázáno zhoršení hojení vlivem terapie. Histopatologické vyšetření nádoru a uzlin po terapii neztratilo prognostickou hodnotu. Indikací k neoadjuvantní chemoterapii byl původně inoperabilní karcinom, takže se jednalo o stadia III. V současnosti je nasazována neoadjuvantní terapie i u nádorů s cílem umožnit konzervativní výkon. Indikace se tak posunuje i na II. stadium. K neoadjuvantní terapii jsou určeny nádory, které vyžadují z hlediska velikosti, charakteru nádoru a rozsahu postižení uzlin adjuvantní chemoterapii [17]. Diagnóza onemocnění před nasazením terapie musí být přesná, protože lze předpokládat zvýšené riziko vzdálených metastáz. Přínos Pet-CT ke stanovení přesné diagnózy je studován stejně jako význam MRI, která má vysokou citlivost, avšak je méně specifická. Nádor, který bude léčen neoadjuvantní terapií, by měl být označen, aby byl usnadněn následný chirurgický výkon. Chirurgický výkon se pak řídí značením. Klip je vodítkem pro chirurga i pro patologa zvláště při kompletní patologické odpovědi. Spolehlivě nás informuje o místě původního tumoru. Pečlivý výběr pacientek umožní dosáhnout podobného výsledku z hlediska lokálních recidiv jako u časných karcinomů.
V MD Anderson Cancer Center ustupují od konzervativního výkonu po neoadjuvanci, pokud přetrvává kožní otok na prsu, je zachycena kůže prsu nebo hrudní stěna, přetrvává otok horní končetiny, tumor po terapii přesahuje 5 cm, na mamografii nacházíme difuzní mikrokalcifikace, pokud je tumor multicentrický a u kontraindikací radioterapie. Za dodržení těchto podmínek dosáhli pětiletého intervalu bez lokální recidivy u 95 %. [18] Chirurgický výkon musí zahrnovat zvýšené úsilí zaměřené na kompletní odstranění nádoru s volnými okraji. Po neoadjuvanci by se mělo u pozitivních okrajů zvažovat provedení reexcize a v takovém případě spíše indikovat mastektomii. Při rozhodování o volbě výkonu je však také třeba uvážit, že se jedná o ženy s vysokým rizikem vzniku lokálních recidiv i po mastektomii s rizikem generalizace. Pokud existuje klinické a radiologické reziduum, je cílem odstranit pouze toto ložisko s jasnými hranicemi zdravé tkáně. Doporučováno je odstranění pouze reziduálního ložiska, které přetrvává v době chirurgického výkonu, a neodstraňovat původní objem tkáně prsu, která obsahovala nádor před započetím neoadjuvantní chemoterapie [19]. Makroskopický průkaz hranic může být velmi obtížný a okraje původního nádoru se peroperačně velmi špatně identifikují. Zanedbání přísných chirurgických zásad má za následek mnoho lokálních recidiv [19]. Kompletní klinická regrese ještě není kompletní patologická regrese, kdy nádor zcela (histologicky) vymizel. Ta se vyskytuje jen u 30–50 % kompletních klinických regresí. Naopak u klinicky reziduálního tumoru po chemoterapii (tumor je patrný na mamografii, eventuálně na sonografii, nebo palpačně hmatný, ale resekát při histologickém vyšetření již neobsahuje maligní buňky) může být kompletní patologická odpověď [20 ]. Volný resekční okraj je zásadní, ale opět nebyl stanoven rozsah lemu a existují doporučení od 1 do 10 mm. Větší rozsah resekčního okraje bez nádorových buněk je výhodnější, avšak lem přes 10 mm nebyl doporučován. V případě kompletní patologické odpovědi by mělo být místo tumoru „tumor bed“ podrobně vyšetřeno [17]. Jen po podrobném vyšetření může být potvrzena kompletní patologická odpověď. Ženy po mastektomii jsou vhodné k rekonstrukci prsu. Neoadjuvatní chemoterapie není absolutní kontraindikací ani k bezprostřední rekonstrukci. Standardní chirurgický postup k určení stadia je disekce axily. Biopsii sentinelové uzliny (SLNB) je možné provést před započetím chemoterapie. SLNB je akceptovatelná i po neoadjuvantní chemoterapii u klinicky negativních nálezů. Postup musí dodržovat pravidla konsenzuálních doporučení [14]. Tento postup je však stále kontroverzní, může být pacientkám nabídnut s upozorněním, že postup ještě není dostatečně prověřen [17].
Výkony v axile
Metastatické šíření nádoru do lymfatických uzlin u karcinomu prsu
Nádor se šíří z tumoru do spádových uzlin, ve kterých nacházíme jednotlivé maligní buňky, mikrometastázy, makrometastázy vyplňující celou uzlinu, ev. se šířením do okolí. Mikrometastáza byla poprvé prezentována Huvosem v r. 1971 a je definována jako trs buněk větší než 0,2 mm a menší než 2,0 mm. Metastázy menší než 0,2 mm jsou označovány jako izolované nádorové buňky (ITC-sub-mikrometastázy) [21]. Tyto nálezy by měly být dále kvantifikovány na skupiny s méně než 10 buňkami, 10–100 buněk nebo více než 100 maligních buněk. Klinický význam takových nálezů je dosud nejasný. Mikrometastázy tvoří 20–30 % všech metastáz v uzlinách a jsou považovány na rozdíl od izolovaných buněk již za metastatické onemocnění s klinickým významem [22]. Nejčastěji jsou zasaženy nádorovým procesem axilární uzliny. S velikostí nádoru se zvyšuje počet postižených uzlin. Silverstein udává u Tis 0,8 %, T1a 5 %, T1b 16 %, T1c 28 %, T2 47 %, T3 68 %, T4 86 % metastáz v uzlinách. Metastázy v axilárních uzlinách nejprve postihují uzliny I. etáže (uzliny laterálně od m. pectoralis minor) a dále postupují do vyšších etáží. Skip metastázy nejsou časté a studie uvádějí jejich výskyt v 1–3 % [23]. Přesnou informaci o stavu axily umožní vyšetření axilárních uzlin I. a II. etáže (uzliny II. etáže za laterálním a mediálním okrajem m. pectoralis minor). Při resekci uzlin v úrovni I. etáže je 10–12 % chyba a při anatomické disekci I. a II. etáže se snižuje na 2–3 %. Sampling má chybnou výpověď ve 14–45 % [24]. Matematické modely hodnotící stav axily požadují minimální počet 10 vyšetřených uzlin. Výpovědní hodnota se pak blíží 100 %. Parasternální uzliny reprezentují sekundární regionální drenážní oblast. Metastázy v parasternálních uzlinách se objevují současně s výskytem v axile až v 10–26 %. Samostatné metastázy nejsou časté a pohybují se mezi ve 4–7 %. Postoj k biopsii parasternálních sentinelových uzlin je i v současné době kontroverzní. Klinické vyšetření axilárních uzlin má ve stanovení diagnózy omezený význam, protože až v 50 % u negativních nálezů jsou histologicky pozitivní. Přesnost se zvyšuje u hmatných uzlin a zde dosahuje až 70 %. Podobnou úspěšnost má utrasonografické vyšetření. Spolehlivost se zvyšuje s velikostí a ve spojení s FNA (punkce tenkou jehlou) je úspěšná v 80–100 %. U ložisek do 5,0 mm je však citlivost pouze 44 %. Určení metastáz menších než 0,5 cm a zvláště mikrometastáz zůstává diagnostickým problémem. Pouze histologické vyšetření informuje přesně o stavu uzlin [25].
Lymfadenektomie u karcinomu prsu
Prognóza onemocnění vychází z počtu postižených axilárních uzlin. V případě všech negativních uzlin je riziko relapsu 30–35 %, při 1–3 uzlinách s metastázami 55–60 % a u 4 a pozitivnějších uzlin dosahuje již 80–90 % [26]. Procento přežití se významně snižuje s narůstajícím počtem metastatických uzlin. Názor na léčebný efekt disekce je kontroverzní a převážně negativní. Byly však publikovány studie, které poukazují na terapeutický efekt disekce axily. Guyęs Hospital prezentuje studii s 253 pacienty v I. stadiu. Po 8 letech sledování byl statistický rozdíl ve výskytu recidiv a v délce přežití ve prospěch skupiny s disekcí. Metaanalýza z roku 1999 Orrova s vyšetřenými téměř 3000 pacientkami připouští 5,4% výhodu v přežití u disekce s menším tumorem a 1–3 postiženými uzlinami. Terapeutický efekt axilární disekce není toho času spolehlivě stanoven. Disekce axily má nepopiratelný význam v lokoregionální kontrole onemocnění a redukci množství axilárních recidiv. Graversen referuje axilární recidivy do 5 roků v 19 % bez disekce, v 10 % u limitované disekce a pouze 3 % u pacientek s 10 a více odstraněnými uzlinami. Podobné závěry vycházejí ze studie B-04. Po anatomickém odstranění uzlin I. a II. etáže by počet lokálních recidiv měl být v rozmezí 0–3 %. Pozitivní axilární uzliny jsou výrazným rizikovým faktorem v prognóze lokální recidivy v axile. Recidivy v axile se objevují nejčastěji v období 2 let od operace a jejich léčení je zatíženo morbiditou až 40 %. Kompletní odstranění metastáz se daří omezeně (60 %) Prognosticky je lokální axilární recidiva nepříznivý stav. U pacientek s pozitivními uzlinami při primární operaci je výskyt lokální recidivy v axile známkou brzkého objevení distančních metastáz. Léčení lokálních recidiv v axile je převážně multimodální [27].
Technika lymfadenektomie axilárních uzlin I. a II. etáže
Lymfadenektomie axilárních uzlin I. a II. etáže je s biopsií sentinelové uzliny standardní součástí chirurgické léčby karcinomu prsu. Axilární lymfadenektomie při mastektomii je provedena ze stejného kožního řezu. Kožní incize u konzervativního výkonu může být využita k disekci axily u nádorů uložených v blízkosti axily. V ostatních lokalizacích je řez veden samostatně. Nejpoužívanější řez je obloukovitý distálně od ochlupení. Je možné také využít incizi podél laterálního okraje m. pectoralis major, středem axily nebo podél laterálního okraje m. latissimus dorsi. Preparace postupuje do podkoží k axilárnímu tuku a je vedena podél předního okraje m. pectoralis major proximálním směrem k vrcholu axily až k v. axilaris. Tuková tkáň s lymfatickými uzlinami je disekována kaudálně a ventrálně. Preparace proximálně od v. axilaris zvyšuje procento lymfedémů a plexopathií. Interkostobrachiální nerv je vhodné ušetřit. Při jeho poranění se objevují poruchy citlivosti na vnitřní části paže. Šetříme také thorakodorzální cévní svazek. Obsah axily je preparován kaudálním směrem. Při stěně hrudníku se nachází n. thoracicus longus. Poranění nervu způsobuje vlající lopatku. Mediální pektorální nerv vychází z axily a zanořuje se do laterálního okraje velkého pektorálního svalu. Při jeho porušení inervovaná část svalu atrofuje, čímž je porušena konfigurace axily. Distálním směrem je postupně odstraňován obsah axily. Preparace zahrnuje odstranění retroskapulárního tuku včetně uzlin a tuk s uzlinami uloženými za musculus pectoralis minor (II. etáž). Uzliny I. etáže jsou uloženy distálně v těsném kontaktu s tkání prsní žlázy. Do rány v axile je aplikován Redonův drén a v případě, že výkon je součástí mastektomie, tak pokládáme na přední stranu hrudníku druhý Redonův drén [28].
Komplikace axilární lymfadenektomie
Lymfedém horní končetiny je nejobávanější komplikací. Jeho výskyt se udává od 5 % do 30 % v závislosti na rozsahu chirurgického výkonu. Asi 15 % lymfedémů se promítá do kvality života pacientky. Procento výskytu je ovlivněno délkou sledování a přesností měření. Výskyt se zvyšuje u mastektomie, s počtem odstraněných a maligních uzlin, a při disekci uzlin III. etáže. Pooperační radiace axily zvyšuje riziko lymfedému. V léčení lymfedémů existuje mnoho kontroverzních názorů. Výsledky léčby jsou nepřesvědčivé. Neurologické poruchy se projevují převážně poruchou citlivosti. Parestézie a poruchy citlivosti se objevují na vnitřní straně paže až v 80 % po výkonu. Poruchy přetrvávají v 20 %. Většina obtíží souvisí s poraněním interkostobrachiálního nervu. Web syndrom je charakterizován bolestmi při abdukci, omezením pohybu a viditelnými pruhy jdoucími povrchně na paži, často přes kubitální jamku až na předloktí a výjimečně až do palce. Vyskytuje se až v 6 %. Nejčastěji se pruhy formují mezi 2. a 3. týdnem po chirurgickém výkonu. Do 3 měsíců zmizí. Základem léčení jsou antirevmatika a rehabilitace. Pooperační serom není komplikace, spíše vedlejší produkt lymfadenektomie. Méně časté jsou bolesti ramenního kloubu, slabost nebo trvalé omezení pohyblivosti. Zmrzlé rameno se vyskytuje vzácně kolem 3 %. Výjimečně se objevuje scapula alata jako důsledek poranění n. thoracicus longus [29, 30, 31].
Biopsie sentinelové uzliny (SLNB)
Sentinelová uzlina je definována jako první uzlina nebo uzliny, do kterých je nádor drénován a ve které se objevují metastázy (Obr. 7). Průměrný počet sentinelových uzlin prezentovaných ve velkých sestavách je kolem 2,0. S rozmezím od 1–8 uzliny u jednoho pacienta. SLNB je alternativou axiální disekce, což bylo prokázáno na velkém množství pacientů, ale také v milánské randomizované studii a především B-32 studii, která neprokázala rozdíl mezi s SLNB a disekcí axily u 5611 pacientek. Sentinelové uzliny jsou identifikovány pomocí modrého barviva a značeného koloidu [14, 32, 33].
Obr. 7. Vypreparovaná modře zbarvená sentinelová uzlina 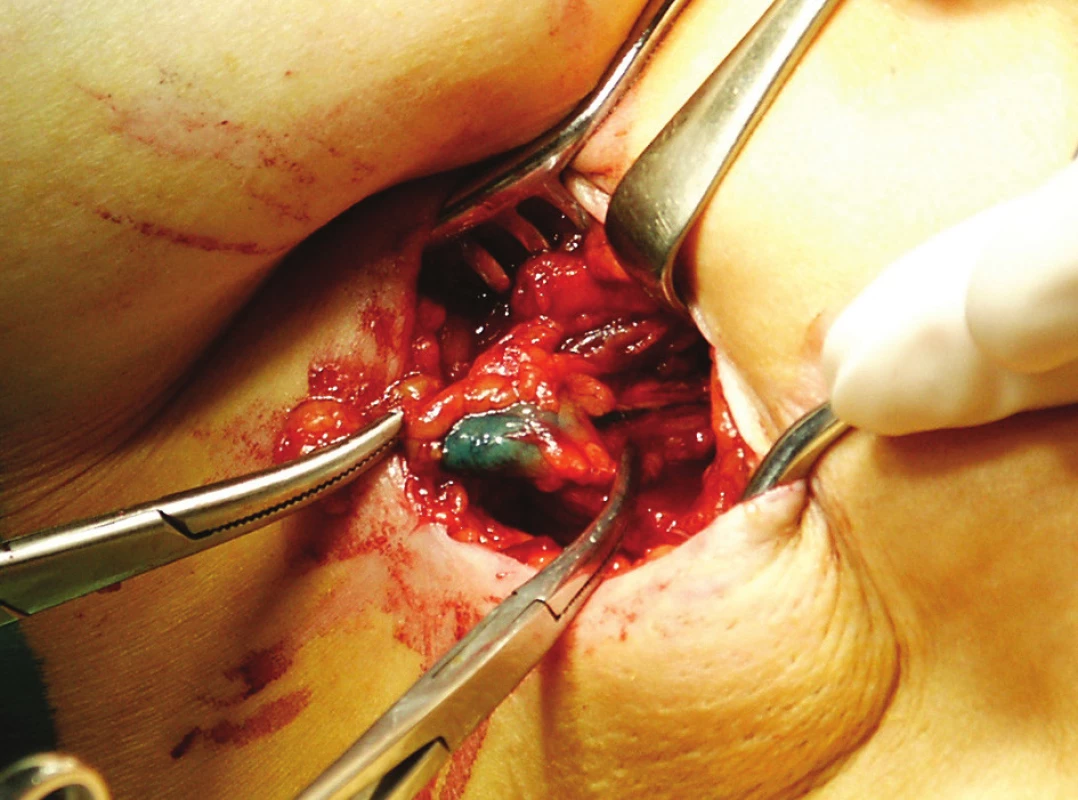
Značení sentinelové uzliny pomocí barviva
K barvení jsou používány preparáty Lymphazurin a Patent Blue. Jsou to lymfotropní látky a z 50 % se vážou na intersticiální proteiny. Lymfou se barva dostává do žilního systému a způsobuje modré zbarvení pacienta. Asi 10 % barviva nezměněno odchází močí, zbytek žlučí a tím stolicí. Lymfatické cesty a uzliny jsou zřetelně modře zbarveny. Komplikací je alergická reakce, která se vyskytuje v 1 %. Alergické reakce mohou být závažné až s projevy anafylaktického šoku. Na kůži v místě vpichu na prsu může přetrvávat modrá tetováž, která se však obvykle do půl roku vstřebá. Obvyklé množství aplikace je 3–5 ml 1% Lymphazurinu nebo 0,5–2 ml Patent Blue. Nejčastější aplikace barvy je intraparenchymálně kolem tumoru nebo do parenchymu stěny kavity po exstirpaci nádoru. U nehmatných nádorů kontrolujeme přesnost aplikace utrasonograficky. Možné jsou i další způsoby aplikace, a to intratumorózně, intradermálně, subdermálně nad tumorem, perialeolárně, subareolárně. Při intradermální, subdermální, subareolární aplikaci díky husté lymfatické síti dochází ke zvýšenému vychytávání preparátu, což se projevuje zvýšenou úspěšností detekce sentinelových uzlin [14, 34].
Značení sentinelové uzliny pomocí značeného koloidu
Identifikace uzlin pomocí značeného koloidu je považována za základ metody a barvení modří jako doplňující postup. Nosič radiofarmaka je fagocytován makrofágy a transportován do uzliny. Biokinetika je závislá na velikosti částic. Absorpce velkých částic je pomalejší, stejně jako transport. Nižší vychytávání radiofarmaka může způsobit selhání metody. Menší částice jsou rychleji vychytávány a transportovány. Preferovaná velikost částic je kolem 80–100 nm. Značený koloid je aplikován obvykle na oddělení nukleární medicíny před operací. Po intradermální, subdermální, event. subareolární aplikaci farmaka je rychlejší vychytávání než u intraparenchymální infiltrace tkáně. Proces je obdobný jako u použití modré. Při aplikaci radiokoloidu do hlubších vrstev intraparenchymatózně a po vyšší dávce je na rozdíl od aplikace „modři“ vyšší záchyt extraaxilárních uzlin. Následuje lymfoscintigrafie. Při lymfoscintigrafii jsou sledovány nejen axilární uzliny, ale i extraxilární lokality, zvláště parasternální uzliny. Vlastní uzlina je detekována pomocí gama sondy na operačním sále. Na trhu jsou různé typy přístrojů. Interval mezi aplikací radiokoloidu a operačním výkonem se různí dle pracoviště. Kolísá od jedné hodiny až po 24 hodin. Sondu musíme při výkonu udržovat ve správném směru. Při neopatrném nastavení sondy můžeme snímat aktivitu axilárních uzlin a simultánně impulzy z místa primárního tumoru. Při SLNB lze použít jedné nebo současně obou metod značení. Nejdříve je aplikován radiokoloid, následuje lymfoscintigrafie, při které je proveden mapping lymfatických uzlin. Na operačním sále před chirurgickým výkonem je aplikována Patent Blue a po 5–10 minutách je provedena incize v axile. Při výkonu je třeba trpělivě preparovat a kontrolovat aktivitu tkáně, až jsme navedeni k aktivní uzlině. Při použití obou metod postupnou preparací dospějeme ke zbarvené lymfatické cévě, která nás přivede k modré a aktivní uzlině. Pomocí sondy kontrolujeme aktivitu uzliny in vivo a in vitro. Aktivní uzlina hot spot je uzlina s nejvyšší aktivitou. Nejčastěji jsou za sentinelové uzliny považovány uzliny, které vykazují aktivitu proti nonsentinelovým uzlinám 10krát větší. Cox uvádí 10krát větší aktivitu in vitro, 3krát in vivo. Neexistuje však jednoznačné pravidlo hodnocení. Po vynětí všech aktivních uzlin kontrolujeme aktivitu reziduální axily s okolím [14, 32, 33, 34, 35].
Lymfoscintigrafie
Radionuklidová lymfoscintigrafie je rozšířenou metodou k zobrazení lymfatických cév, uzlin a event. k diagnostice patologických stavů lymfatik. Negativní lymfoscintigrafie ještě neznamená, že uzliny nebudou při chirurgickém výkonu detekovány. Způsob aplikace a dávka radiokoloidu se liší od pracoviště.
Operační technika sentinelové uzliny
Výkon je prováděn obvykle v celkové anestezii. Masáž prsu po aplikaci barvy zlepšuje identifikaci uzliny. Uvolňování maligních buněk nebylo prokázáno. Je nutné zjistit rozsah aktivity v místě tumoru a místech předpokládaných sentinelových uzlin, abychom korigovali „shine through“ efekt neboli vzájemné překrývání aktivit zvláště u nádoru v horním zevním kvadrantu a u nádoru vnitřních kvadrantů s ohledem na parasternální uzliny. Incize je vedena asi 1 cm pod linií ochlupení, disekce pokračuje až ke klavipektorální fascii. Povrchní lymfatické cévy mohou být proťaty. Důležité jsou lymfatické cévy, které jsou lokalizovány pod fascií. Směr preparace korigujeme pomocí sondy. Nacházíme zbarvenou lymfatickou cévu, která nás přivede k modře zbarvené uzlině. Při poranění cévy se zbarví celé operační pole modrou barvou. Někdy nacházíme pouze zbarvenou část hilu uzliny a nemusí být zbarvena celá uzlina. Jako sentinelová uzlina je také hodnocena uzlina, která má zbarvenou pouze přívodní lymfatickou cévu. Zbarvenou uzlinu současně kontrolujeme pomocí gama sondy. Kontrolujeme operační pole, aby všechny modré a aktivní uzliny byly odstraněny. Každá tuhá, podezřelá uzlina z metastatického procesu musí být odstraněna a vyšetřena.
Při výskytu metastázy v sentinelové uzlině následuje disekce I. a II. etáže axilárních uzlin. Protože u 40–60 % pacientek s pozitivní sentinelovou uzlinou jsou nonsentinelové uzliny negativní, je snaha ve vybraných případech disekci neprovádět. Určit míru rizika výskytu metastáz v nonsentinelových uzlinách se snaží prezentované nomogramy (skórovací tabulky, které určí míru rizika). Nejčastěji citovaný a používaný nomogram byl vytvořen v Memorial Sloan-Kettering Cancer Center New York. Protože všechny prezentované nomogramy vycházejí z podmínek místa vzniku, je jejich uplatnění v odlišných podmínkách limitováno. V současnosti je doporučováno doplnit disekci axily u makrometastáz a mikrometastáz diagnostikovaných v sentinelové uzlině, a to nezávisle na metodě jejich detekce. Rutinní disekce axily není doporučována u ITC nálezů (Obr. 8) [14, 32, 33, 34, 35].
Obr. 8. Histologický obraz mikrometastázy v parasternální uzlině. Izolované tumorózní buňky – klastry v sentinelové uzlině – imunohistochemické barvení cytokeratinem 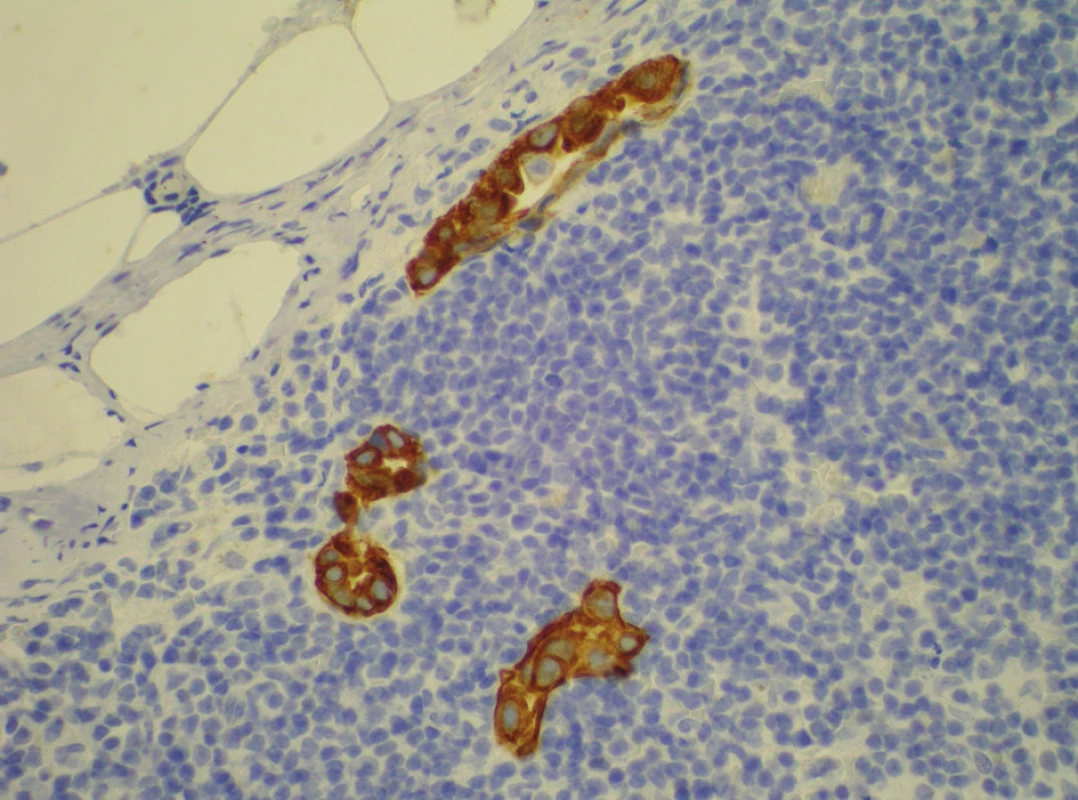
Parasternální sentinelové uzliny
Prostupujeme pektorálním svalem. Podélně protínáme interkostální svaly a dostáváme se do oblasti pod svalovou vrstvu, kde se nachází vasa thoracica interna. Uzliny jsou uloženy v tuku podél cév a s pomocí gama sondy jsou detekovány. Mezižeberní prostor je úzký a často neumožňuje volnou manipulaci se sondou. Pleura může být poraněna mechanicky a zvláště riziková je preparace kauterem. Porušení pleury je poznáno již během operace a jedná se obvykle o drobný defekt, u kterého není třeba zakládat drenáž. Parasternální uzliny jsou malé, dosahují velikosti několika milimetrů a často je nalezena jen jedna, méně dvě a tři uzliny. Obvykle jsou pouze aktivní bez zbarvení [36].
Výsledky biopsie parasternálních sentinelových uzlin mění minimálně terapii, proto v současnosti není na většině pracovišť rutinně prováděna.
Komplikace biopsie sentinelové uzliny
Komplikace po biopsii sentinelové uzliny jsou řídké, zvláště ve srovnání s disekcí axilárních uzlin. Nejzávažnější komplikací je alergická reakce. Na kůži se vyskytují drobné eflorescence, rozsáhlé erytémy, ale také modře zbarvené puchýře. Na kůži prsu může přetrvávat v oblasti aplikace tetováž. Modré zbarvení se rezorbuje spontánně a pouze výjimečně je patrné dlouhodobě. Přechodně se také vyskytují omezení pohybu v ramenním kloubu, neuralgie a web syndrom. Frekvence těchto komplikací je u biopsie sentinelové uzliny nízká.
Falešně negativní sentinelové uzliny
Falešně negativní uzlina je nejobávanější komplikací této metody. Jde o uzlinu, která je označena jako sentinelová, neobsahuje metastázy, je hodnocena jako negativní a v ostatních nonsentinelových uzlinách metastázy nalezneme. Procento se vypočítává pouze z počtu pozitivních „axil“ a pohybuje se na pracovištích, která se metodou zabývají, do 5 %. Obecně avšak počet kolísá od 0 až po 11,2 %. Existuje několik příčin falešné negativity. Kromě technických chyb při aplikaci značících látek či v chirurgické technice je asi nejčastější příčinou zablokování sentinelové uzliny nádorovým procesem [14, 32, 33, 34, 35].
DCIS
Počet metastáz v uzlinách u DCIS nepřesáhl 2 %, takže od rutinní axilární disekce bylo upuštěno. Zavedení jednotného schématu, kdy provádět SLNB u DCIS, je komplikováno mimo jiné až 10% výskytem DCIS s mikroinvazí, který je provázen vyšším počtem metastáz. Pooperační diagnóza mnohdy změní DCIS na DCIS s mikroinvazí a event. na invazivní duktální karcinom. Řada autorů doporučuje provádět SLNB u DCIS ne rutinně, ale výběrově, a to u tumorů větších než 2,5 cm, nálezů mamograficky a sonograficky patrných nebo palpačně hmatných. Povinnou indikací k biopsii sentinelové uzliny u DCIS je mastektomie, protože „up staging“ u extenzivního DCIS je uváděn od 28 % do 48 % a provedení SLNB po mastektomii je sice technicky možné, ale spolehlivost je diskutabilní. Indikace biopsie sentinelové uzliny u DCIS léčeného konzervativním výkonem tak prakticky vychází z diagnostické nejistoty, zda se nejedná o DCIS s mikroinvazí nebo o invazivní karcinom. Cílem biopsie sentinelové uzliny je tak nepřímo zachytit nepoznané invazivní karcinomy. V případě, že je spolehlivě vyloučena invaze, SLNB není nutná bez ohledu na histologii, typ, věk a klinickou prezentaci. Po kompletní diagnostické excizi nádorů menších než 2 cm s volnými resekčními okraji je riziko přehlédnutí mikroinvaze minimální, takže není důvod k biopsii sentinelové uzliny [14, 32, 33, 34, 35].
Kontraindikace použití sentinelové uzliny u karcinomu prsu
U pacientek léčených neoadjuvantní chemoterapií je možné provést SLNB před aplikací prvního cyklu chemoterapie. Původní zdrženlivost k SLNB po neoadjuvantní terapii je opuštěna. Je možné ji provést u klinicky negativních uzlin. Pacientky je však nutné upozornit, že u SLNB po chemoterapii se jedná o nedostatečně ověřenou metodu. Možnost SLNB je však vhodné nabídnout. Platnost působnosti SLNB u multicentrických nádorů byla studiem potvrzena a není striktně kontraindikována. Biopsie není doporučena u rozsáhlých ran v axile a na prsu. Extirpace nádoru na prsu neovlivňuje výsledek SLNB. Pokud jsou suspektní hmatné axilární uzliny, je vhodné pomocí FNA potvrdit nebo vyloučit metastázu. Při negativním nálezu je možná SLNB, která by měla nález potvrdit. Německá guideline doporučuje sonografii uzliny, a pokud není změněna struktura uzliny, je metoda indikována [14, 32, 33, 34, 35].
Doporučení pro praxi a standard kvality chirurgické léčby
V lokoregionální chirurgické léčbě je cílem prevence lokálních recidiv [37]. Pouze kvalifikovaný a zkušený tým, který využívá nejnovější poznatky z diagnostiky, z léčby a respektující mezinárodní doporučení, může dosáhnout současné úrovně léčby karcinomu prsu. Dokonalá operační technika s důsledným označením resekčních okrajů je základním předpokladem. U konzervativních výkonů by počet lokálních recidiv neměl přesahovat 1 % ročně, což je považováno za indikátor dobré kvality. Výsledky každého pracoviště by měly být potvrzeny vlastními individuálními audity. Alternativou disekce axily u časného karcinomu prsu je SLNB. Chirurgická pracoviště, kde je prováděna, by měla zvládnout dokonale techniku disekce axily a provádět ročně v průměru 50 výkonů pro mammární karcinom s 20 biopsiemi sentinelové uzliny. Učební fáze u chirurga, který absolvoval školení nebo kurz v metodice sentinelové uzliny, představuje minimálně 20 SLNB s následnou axilární disekcí. Úspěšnost detekce sentinelové uzliny musí přesahovat 90 % a počet falešně negativních uzlin by měl být pod 5 %. Recidivy v axile bez následné disekce axilárních uzlin by se měly vyskytovat do 2 %. U chirurga, který se v praxi s metodou nesetkal a začíná operovat bez bližšího představení SLNB, by počet biopsií následnou disekcí axily měl být vyšší a je doporučováno 50 biopsií. Na pracovištích, kde je SLNB běžně používána, jsou nároky na začínajícího chirurga nižší, protože lze předpokládat asistenci a vedení zkušeným chirurgem.
Základním předpokladem kvalitní chirurgické léčby karcinomu prsu je multidisciplinární tým v centrech, kde je prováděn dostatečný počet výkonů [4, 12].
MUDr. Jiří Gaťek, Ph.D.
Nemocnice Atlas, a. s., Zlín
760 01 Zlín
e-mail: gatekj@nemocniceatlas.cz
Zdroje
1. Duda M, Žaloudík J, Ryska M, Dušek L. Chirurgická léčba solidních nádorů v České republice. Rozhl Chir 2010;89(10):588–593.
2. Duda M, Hartl P, Hartlová M, Strážnická J. Záchovné operace u karcinomu prsu. Rozhl Chir 1997;76(12):605–608.
3. NIH Consensus Conference Treatment of Early-Stage Breast Cancer. JAMA 1991;16 : 391–395.
4. Schwartz G, Veronesi U, Clouhg K, et al. Proceedings of the Consensus Conference on Breast Conservation, April 28 to May 1, 2005, Milan, Italy. Cancer 2006;107 : 242–250.
5. Kaufmann M, Morrow M, Minckwitz G. Locoregional Treatment of Primary Breast Cancer. Cancer 2010;1 : 184–91.
6. Clough K, Lewis J, Couturaud B, et al. Oncoplastic Techniques allow extensit resections for breast-conserving therapy of breast carcinoma. Ann Surg 2003;237 : 26–346.
7. Fisher E, Dingam, Wolmark N, at al. Lumpectomy and radiation therapy for the treatment of intraductal breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-17. J Clin Oncol 1998;16 : 441–52.
8. Julien J, Bijker N, Fentiman I. Radiotherapy in breast conserving treatment for ductal carcinoma in situ: first results of the EORTC randomised phase 3 trial 10853. Lancet 1990;335 : 528–33.
9. Vetto J, Jun S, Padduch D, et al. Stages at Presentation, Prognostic Factors, and Outcome of Breast Cancer in Males. Am J Surg 1999;117 : 379–383.
10. Kuerer H, Cuninngham J, Bleiweiss I, et al. Conservative Surgery for Breast Carcinoma Associated with Pregnancy. Breast 1998;4 : 171–176.
11. Kroman N, Holtveg H, Wohlfarhrt J, at al. Effect of Breast-Conserving Therapy versus Radical Mastectomy on Prognosis for Young Woman with Breast Carcinoma. Cancer 2004;100 : 688–93.
12. Kell M, Morrow M. Surgical aspects of inflammatory breast cancer. Breast diseases 2005;22 : 67–73.
13. Coufal O. Biopsie sentinelové uzliny u multifokálních a multicentrických karcinomů prsu. Klinická onkologie 2007;20 : 283–286.
14. Lyman G, Giuliano A, Somefield M, et al. American society of clinical oncology guideline recommendation for sentinel node biopsy in early-stage breast cancer. J Clin Oncol 2005;23 : 7703–7720.
15. Schwartz G, Hortobagyi G. Proceedings of the Consensus Conference on Neoadjuvant Chemotherapy in Carcinoma of the Breast April 26-28 2003 Philadelphia Pennsylvania. The Breast 2004; 10 : 273–294.
16. Singletary S. Neoadjuvant chemotherapy in the treatment of stage II and III breast cancer. Am J Surg 2001;182 : 341–346.
17. Kaufman M, von Minckwitz G, Bear D, et al. Recommendation from an international expert panel on the use of neoadjuvant (primary) systemic treatment of operable breast cancer: new perspectives 2006. Ann Oncol 2007;18 : 1927–1934.
18. Chen A, Bernstam F, Hunt K, et al. Breast conservation after neoadjuvant chemotherapy: The M D Anderson Cancer Center Experience. J Clin Oncol 2004;22 : 2303–2312.
19. Buchholz T, Hunt K, Whitman G, et al. Neoadjuvant Chemotherapy for Breast Carcinoma. Cancer 2003;98 : 1150–60.
20. Kurosumi M. Significance of histopathological evaluation in primary therapy for breast cancer-recent trends in primary modality with pathological complete response (pCR) endpoint. Breast Cancer 2004;111 : 39–147.
21. Schildberg F, Löhe F. Grundlagen und Wert der Lymphadenectomie biem Mammacarcinom. Chirurg 1996;67 : 771–778.
22. Rutgers E; Sentinel node micrometastasis in breast cancer. Br J Surg 2004;91 : 1241–42.
23. Veronesi U, Rilke F, Luini A, et al. Distribution of Axillary Node Metastases by Level of Invasion. Cancer 1987;59 : 682–687.
24. Giulliano A, Dale P, Turner R, et al. Improved Axillary Staging of Breast Cancer with Sentinel Lymphadenectomy. Ann Surg 1995;222 : 394–401.
25. Oruwari J, Chung M, Koelliker S, et al. Axillary staging using ultrasound – Guided fine needle aspiration biopsy in locally advanced breast cancer. Am J Surg 2002;184 : 307–309.
26. Konopásek B., Petruželka L. Karcinom prsu. Praha Galen, 1997 : 44–45.
27. Boer R, Hillen H, Roumen R, et al. Detection, treatment and outcome of axillary Recurrence after axillary clearance for invasive breast cancer. Br J Surg 2001;88 : 118–122.
28. Oertli D. Lymphadenektomie der Axila. Chirurg 2007;78 : 194–202.
29. Coufal O, Faith V. Komplikace v mamární chirurgii. V: Coufal O, Faith V, Editoři. Chirurgická léčba karcinomu prsu. Praha, Grada Publishing, 2001 : 239–252.
30. Roses D, Brooks A, Harris M, et al. Complications of Level I. and II. Dissection in the Treatment of Carcinoma of the Breast. Ann Surg 1999;230 : 194–201.
31. Cohen S, Payne D, Tunkel R. Lymphedema. Cancer 2001;92(Suppl): 980–987.
32. Sampao S, Eremin J, El-Sheemy M, et al. Management of the axila in woman with breast cancer: Current clinical Practice and a new selective targeted approach. Ann Surg Oncol 2008;15 : 1282–1296.
33. Krag D, Anderson S, Julian T, et al. Sentinel-lymph-node resection compared with conventional axillary lymph-node dissection in clinically node-negative patient with breast cancer: overall survival findings from the NSABP B-32 randomized phase 3 trial. Lancet oncology 2010;11 : 927–933.
34. Kim T, Giuliano A, Lyman G. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma. Cancer 2006;106 : 4–16.
35. Gatěk J, Hnátek L, Dudešek B, et al. Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi. Rozhl Chir 2008;87 : 180–185.
36. Ent F, Kengen R, Pol H, et al. Halsted Revisited: Internal Mammary Sentinel Lymph Node Biopsy in Breast Cancer. Ann Surg 2001;234 : 79–84.
37. Gatěk J, Dudešek B, Hnátek L, et al. Lokální recidivy po konzervativních výkonech u karcinomu prsu. Klinická onkologie 2008;21 : 169–173.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Jak dál ve vzdělávání v chirurgické onkologii v České republice
- Screening nádorů prsu v České republice potřebuje součinnost chirurgů
- Oznámení výboru sekce intenzivní péče: volby do výboru
- Zhoubné nádory jícnu v České republice
- Vzpomínka
- NOSE (Natural Orifice Specimen Extraction) v kolorektální chirurgii
- Zlomení osteosyntetického materiálu u pacientů se zlomeninou proximálního femuru ošetřenou DHS
- Obnova aktivní extenze nohy při paréze peroneálních nervů
- Výskyt komplikací po laparoskopické cholecystektomii v závislosti na použité koagulační technice – srovnávací studie
- Retrogastrická bronchogenní cysta
- Dopis redakci: Onkologie v praxi z pohledu českého chirurga v zahraničí
- Chirurgie karcinomu prsu - taktika a technika operací
- Význam zavádění portu u onkologických nemocných
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Obnova aktivní extenze nohy při paréze peroneálních nervů
- Chirurgie karcinomu prsu - taktika a technika operací
- Význam zavádění portu u onkologických nemocných
- Retrogastrická bronchogenní cysta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



