-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam zavádění portu u onkologických nemocných
Autoři: J. Fialová; L. Kalinová. M. Duda; P. Bachleda
Působiště autorů: II. chirurgická klinika FN Olomouc, přednosta: Prof. MUDr. P. Bachleda, CSc.
Vyšlo v časopise: Rozhl. Chir., 2012, roč. 91, č. 3, s. 181-184.
Kategorie: Postgraduální vzdělávání
Úvod
Terapie onkologických onemocnění vyžaduje zajištění dlouhodobého a bezpečného žilního přístupu. Pomineme-li žilní přístup periferním řečištěm, který velmi rychle podkožní žilní řečiště ničí, přichází v úvahu kanylace centrálního žilního systému se zavedením katétru nebo použití implantabilního systému – portu (port, SVAD = subcutaneous venous access device). Jeho zásadní výhodou je, že celý systém je uložen do podkoží. Aniž by nemocného výrazněji omezoval, je použitelný jak ke krevním odběrům, tak k podání léků. Jeho výhodou je proti centrálním žilním katétrům bezpečnost, nízký výskyt infekcí a komfort pro nemocného. Technika implantace portu je použitelná i mimo žilní řečiště a lze jeho cestou zajistit permanentní vstup také do arteriálního řečiště, do peritoneální dutiny a epidurálního prostoru. Využití portu převládá v žilním přístupu (90 %), asi 5 % implantovaných portů je určeno pro arteriální přístup a 5 % portů u nemocných k přístupu do peritoneální dutiny, subarachnoideálního nebo epidurálního prostoru.
Základní indikací k zavedení portu je potřeba dlouhodobé chemoterapie. Cytostatika jsou silné kyseliny nebo zásady a jejich aplikace do periferního žilního řečiště vede k žilní trombóze a následnému zániku přístupu. Kromě aplikace cytostatika se na nezvratném poškození periferní žíly podílí trauma žíly spojené s její kanylací. Z tohoto hlediska je mnohem vhodnější přístup do centrálního žilního řečiště.
METODY
Historie žilního přístupu
Přístup do žilního řečiště má svou historii a vývoj. Stručně lze shrnout, že začátkem 60. let minulého století byla vyvinuta technika kanylace velkých žil a zevní arteriovenózní spojka, v polovině 60. let následovala interní arteriovenózní spojka. Arteriovenózní spojka v této indikaci ztratila na významu, ale vylepšila se technika kanylací centrálního žilního systému pomocí ultrasonografie [1], zvýšila se kvalita katétrů a vznikla metoda tunelizace k jejich uložení do podkoží (Broviac, Hickman). V 80. letech minulého století došlo k vyvinutí a používání podkožního žilního portu. Kromě vyššího komfortu pro nemocné se prokázalo, že používání portu je lacinější a bezpečnější než požívání centrálních katétrů [2]. Nemocný, jehož přístup do centrálního žilního řečiště je kontinuálně využíván (např. při hemodialýze, transplantaci kostní dřeně) je kandidátem pro tunelizovaný žilní katétr. Nemocný, který přístup vyžaduje nepravidelně v delším časovém intervalu, je vhodný pro zavedení portu.
Podkožní žilní port
Podkožní port je polyuretanový nebo silikonový katétr zavedený do centrálního žilního systému, který je spojen s komůrkou implantovanou do podkoží. Komůrka je vyrobena z titanu, z umělých hmot nebo z jejich kombinace. Zásadní součástí komůrky je její přední plocha tvořená silikonovou membránou. Pomocí spojovacího kroužku je komůrka spojena s katétrem zavedeným do centrálního žilního systému. Mezi komůrkou a katétrem je tzv. výstupní kanyla. Transkutánně se do komůrky portu zavádí speciální Huberova jehla, kterou se provádí odběry nebo se podávají roztoky určené k intravenózní terapii. Pro správnou funkci portu je kvalita použité jehly zcela zásadní, nesmí se použít běžná podkožní jehla, která u portu poškozuje jeho membránu a může způsobit obstrukci portu. Huberova jehla umožňuje až 3 000 vpichů do komůrky portu. Jehly se liší svým kalibrem a tvarem dle aplikované látky.
Komůrka umožňuje odběry a podání infúzí a léků. Typ portu je třeba zvážit dle indikace jeho použití. Nejběžnější jsou jednokomorové porty s malým průtokem určené pro běžnou chemoterapii solidních nádorů (Obr. 1). Pro speciální použití (parenterální výživa, převody krevních derivátů, apod.) jsou výhodnější porty dvoukomorové nebo porty s vysokým průtokem. Materiál některých portů umožňuje vyšetření metodou nukleární magnetické rezonance.
Obr. 1. Rozložený podkožní port připravený k implantaci 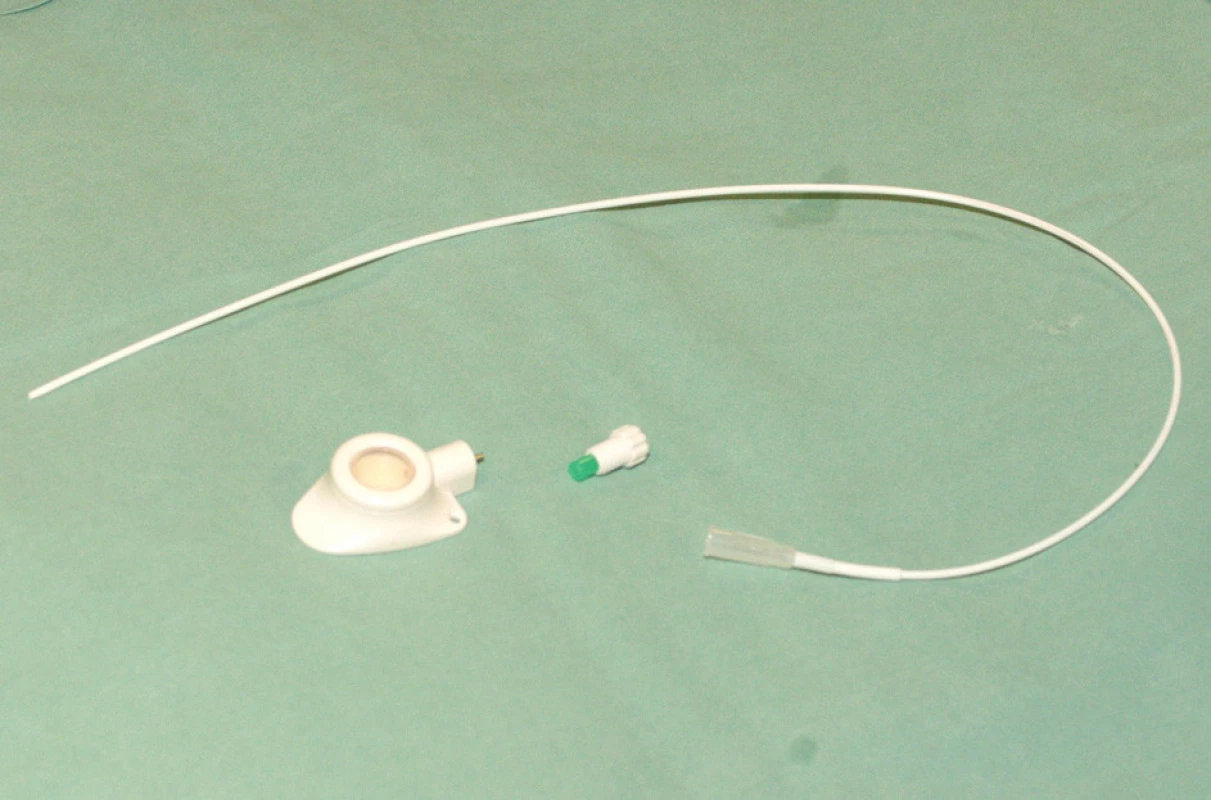
Základní indikací v použití žilního portu je systémová chemoterapie, dalšími indikacemi jsou léčba astmatu, antibiotická léčba, krevní převody, parenterální výživa. Tepenný port je používán v regionální chemoterapii nádorů jater a slinivky břišní. Peritoneální port je indikován k regionální chemoterapii a k vypouštění ascitu. Epidurální nebo spinální port se používá k tišení bolesti u terminálních stavů. Za kontraindikaci k zavedení portu se považuje neutropenie a trombopenie, bakteriémie a septické stavy, těžké poruchy koagulace a trombofilní stavy.
Implantace portu byla ještě v nedávné minulosti chirurgický výkon [3]. V současné době se většinou jedná o perkutánní výkon a této technice se stále častěji věnují intervenční radiologové. Je otázkou, zda jsou jejich argumenty natolik přesvědčivé, aby tyto výkony převzali. Zdůrazňují pružnější radiologický servis, než je chod chirurgických sálů, menší počet komplikací a nižší náklady [4]. Zda jsou tyto argumenty platné i v českém zdravotnictví není jisté. Je třeba však souhlasit s názorem, že onkologický nemocný musí být před zavedením portu podrobně vyšetřen a že některé možné komplikace při zavádění dokáže na rozdíl od chirurga zkušený intervenční radiolog v jedné době vyřešit.
Před zavedením portu je zásadní anamnestické a klinické vyšetření podklíčkových krajin a krku ke zhodnocení předchozích kanylací, které mohou být příčinou stenóz a uzávěru centrálního žilního traktu. Důležitým příznakem je existence podkožního kolaterálního oběhu. U nemocných s pozitivním nálezem je indikováno ultrasonografické vyšetření nebo flebografie [1, 5]. Stenózy nebo uzávěry v této lokalizaci dokáže při implantaci portu radiolog ošetřit. Dalším předoperačním vyšetřením je zhodnocení koagulačních parametrů. Port by se neměl zavádět při hladině trombocytů menší než 50 000 a medikaci Clopidogrelu. Zároveň je doporučen odstup v chemoterapii alespoň 2 týdny před výkonem k omezení komplikacích spojených se špatným hojením rány [6].
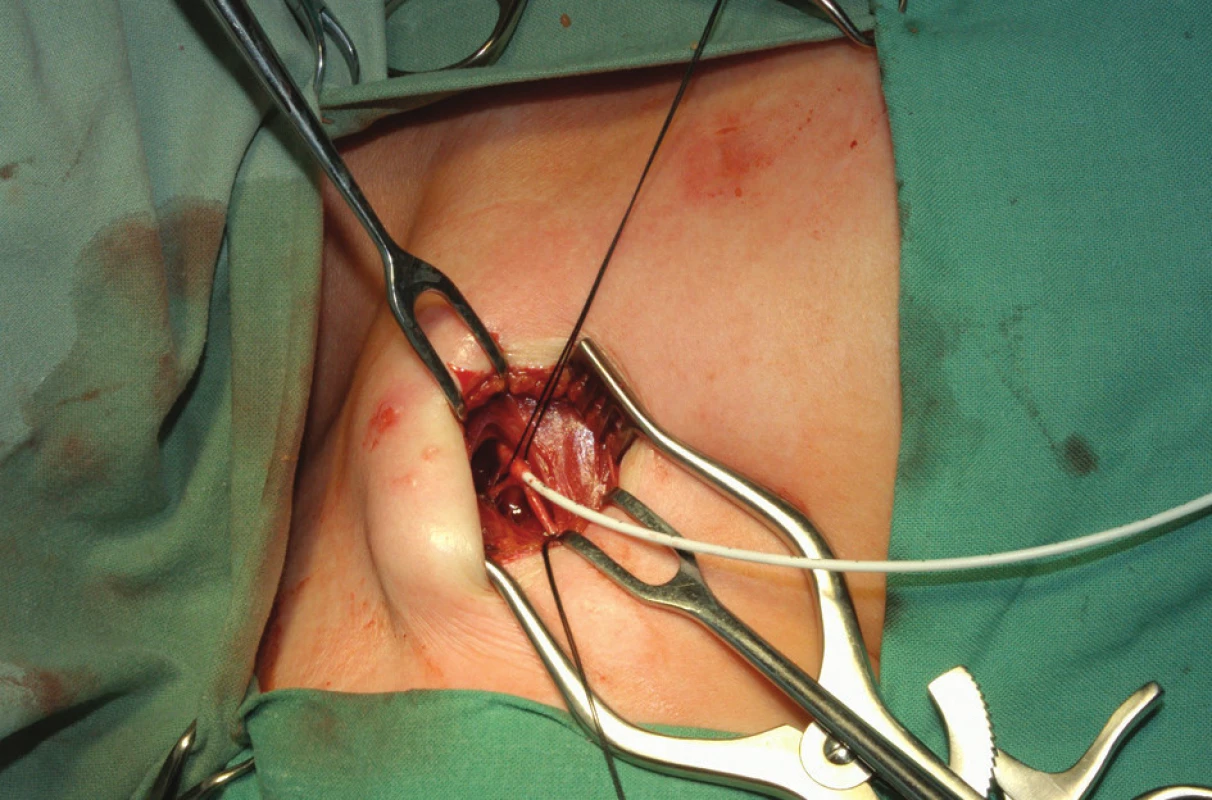
K zavedení podkožního portu se používají chirurgické techniky. Intervenční radiologové zdůrazňují tzv. radiologický přístup. Za aseptických podmínek se v lokální anestézii a eventuálně v sedaci v anatomicky přístupných místech preparuje žíla k zavedení katétru portu nebo se naslepo (chirurgicky) perkutánně kanyluje centrální žíla a Seldingerovou technikou se zavádí vodič do horní duté žíly. Chirurgická slepá kanylace je široce používaná a zkušený chirurg má nízký počet komplikací [7]. Radiologové zdůrazňují výhody kanylace centrální žíly za ultrasonografické kontroly [8]. Přístup do horní duté žíly je umožněn kanylací podklíčkové nebo jugulární žíly. Subklaviální přístup je oblíbený, ale nejvhodnější je přístup vnitřní jugulární žílou vpravo, protože představuje nejpřímější cestu do pravého srdce a tím omezuje riziko zalomení katétru. Většinou se používá firemní implantační set. Po zavedení vodiče se skiaskopicky provede kontrola polohy zavaděče v horní duté žíle. Následuje dilatace kanálu, zavedení katétru a odstranění vodiče. Hrot katétru je lokalizován do místa kavoatriální junkce. Po kontrole žilního návratu se proplachuje katétr fyziologickým roztokem a v pektorální krajině se vytvoří prostor pro komůrku. Port se kompletuje a následuje jeho fixace v podkoží. Fixace portu k fascii vstřebatelným stehem je tradičně používána k zabránění migrace či rotace portu. Jsou však názory nepodporující fixaci portu a k inverzi portu došlo jen u 0,2 % z více než 500 zavedených portů bez fixace [9]. Po zavedení Hubertovy jehly do komůrky aspirací kontrolujeme správnou funkci systému. Po uzávěru rány následuje kontrolní nástřik portu rtg kontrastní látkou (kontrola případného úniku látky), provede se proplach portu fyziologickým roztokem a podání heparinové zátky. Alternativní je chirurgická preparační technika. Ta je vhodná při znalosti techniky k zavedení katétru cestou cefalické žíly po její preparaci v sulcus deltoideopectoralis (Obr. 2, 3 a 4).
Obr. 2. Kanylace cefalické vény 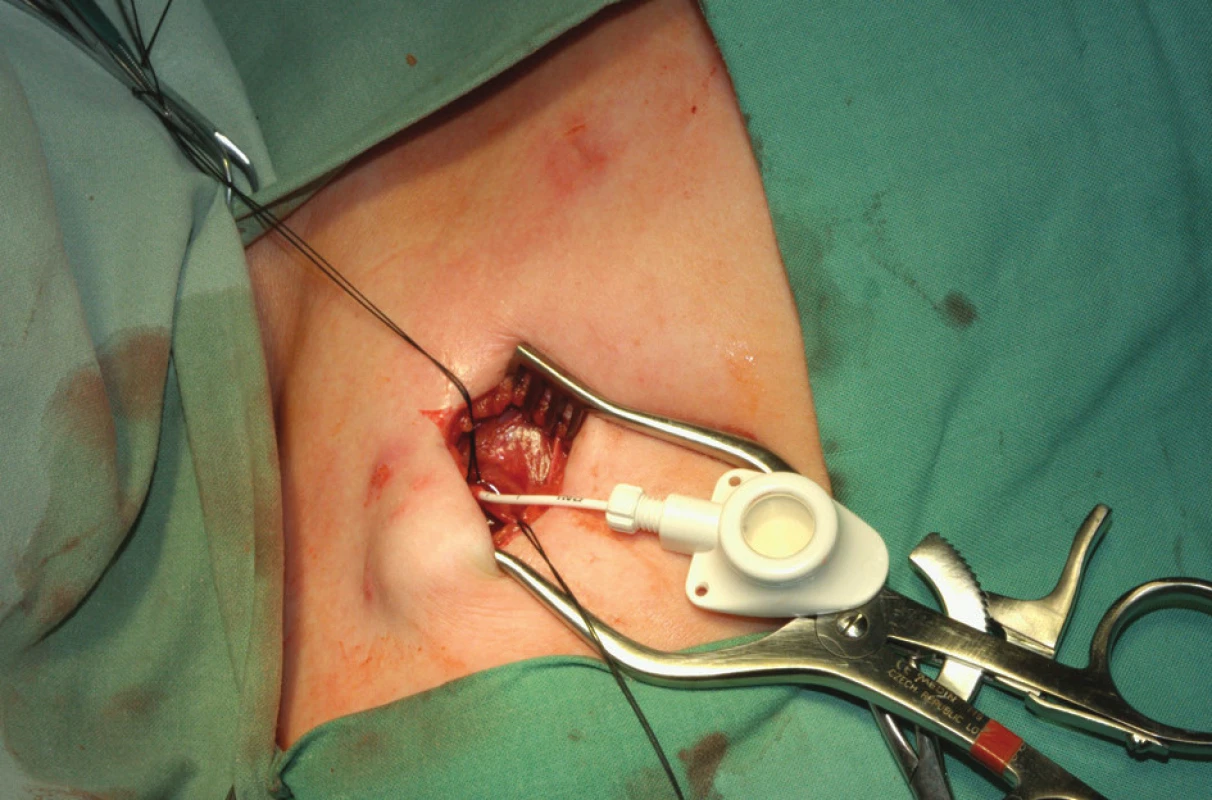
Obr. 3. Port připravený k implantaci 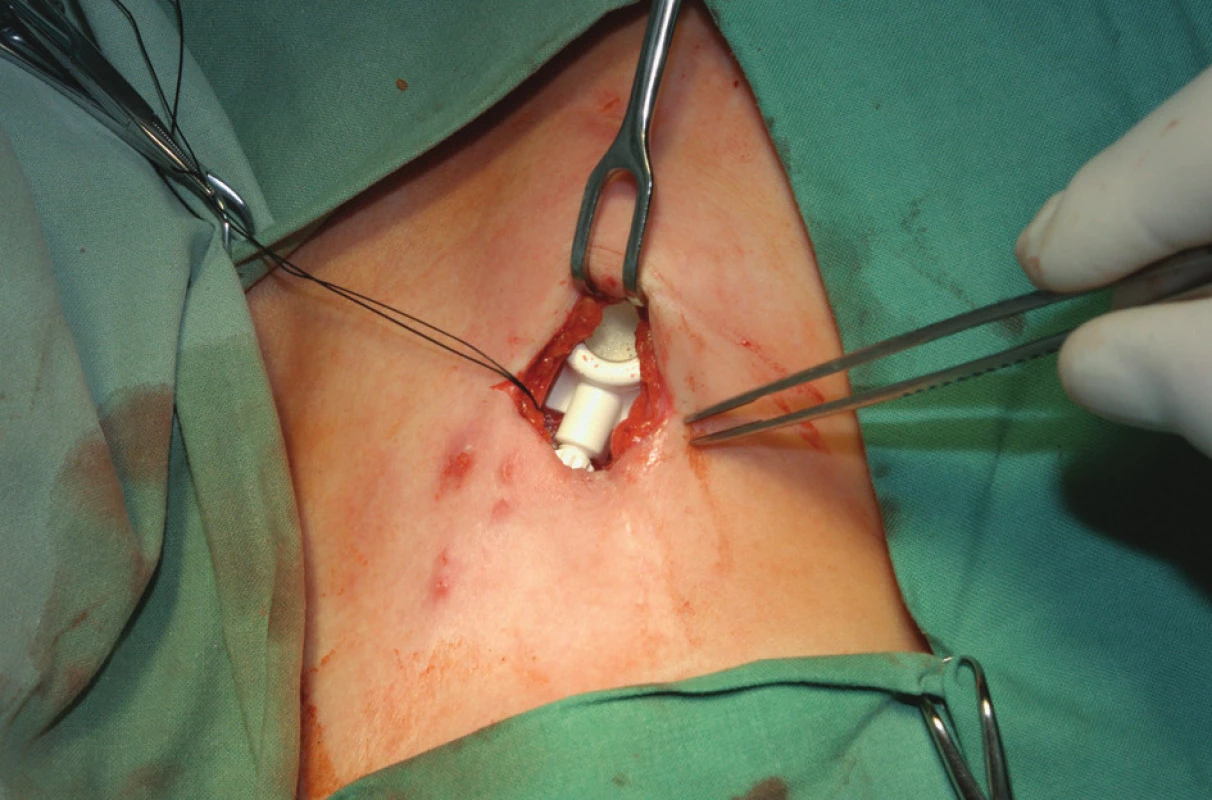
Po podvazu periferie žíly se po její tomii zavede katétr za skiaskopické kontroly do horní duté žíly. Kožní řez se využije k vytvoření podkožní kapsy pro komůrku portu. Metoda vylučuje vznik pneumotoraxu, hemotoraxu nebo poškození katétru [10]. Jako sekundární přístup lze stejnou technikou použít zevní jugulární žílu. Při uzávěru hlavních žilních kmenů horní poloviny těla lze preparační technikou zavést kanylu portu řečištěm v. saphena magna nebo pánevních žil do dolní duté žíly. Někteří autoři doporučují antibiotickou profylaxi, přesto že závazné doporučení chybí [3].
Komplikace
Zavedení a používání podkožního žilního portu může mít komplikace. Časné komplikace se vyskytují v 7–11 % a patří mezi ně pneumotorax po kanylaci žíly (nutná rtg kontrola po 24 hodinách po zavedení portu nebo dle klinického stavu), hematom po mylné punkci artérie, infekce a dehiscence rány. Může dojít k poruše funkce portu pro technickou chybu (např. zalomení nebo špatná poloha katétru), zalomení kateru během zavádění je vzácná komplikace vyskytující se méně než v 1 %. Hematom v místě komůrky portu může být způsoben poruchami hemokoagulace. Neošetřený hematom zvyšuje riziko vzniku abscesu a většinou vyžaduje chirurgickou drenáž. Příliš hluboce zavedený katétr do pravé síně vyvolává arytmie. Během používání portu se mohou vyvinout pozdní komplikace, které jsou indikací k vyjmutí systému [11]. Jedná se o netěsnost systému, dekubitus nad portem, nezvládnutelné místní a celkové infekční komplikace a žilní trombózy. Infekce postihuje kapsu portu, kanál portu nebo je infikovaný katétr příčinou septického stavu. Jeho průkaz je spojen s exkluzí ostatních potenciálních zdrojů. Léčba je u suspektních nebo mírných infekcí konzervativní antibiotická [12] s cílem zachování funkčního portu. Celková antibiotická terapie může být podpořena tzv. antibiotickým zámkem, který je tvořen z vysoké koncentrace antibiotik s heparinem aplikovaným do portu. Tato terapie zachrání 18–100 % portů s infekcí [13]. Konzervativní léčba selhává u nemocných se sníženou imunitou a u nezvládnutelných infekcí je indikováno odstranění celého systému [14]. Katétr portu může způsobit trombotický žilní uzávěr drážděním a poraněním žilní stěny nebo vznikem trombu na hrotu katétru. Ten vzniká velmi časně po implantaci, nejdříve způsobuje poruchu funkce katétru, později je rizikem vznik infikovaného trombu [15]. Preventivní antikoagulační terapie má nejisté výsledky a není široce doporučována. Pouze je na zvážení u jedinců s anamnézou opakovaných trombotických uzávěrů. Při vzniku trombu je možná trombolytická terapie [16, 17], která je schopna obnovit funkci až u 88 %. Stenóza nebo žilní uzávěr postihující přístupovou žílu vzniká kombinací několika faktorů. Vliv má nejenom poranění žilní stěny kanylací a katétrem, podílí se také hyperkoagulační stavy u onkologických nemocných a poškození žilní stěny infúzemi chemoterapeutik. Centrální žilní stenózy jsou většinou asymptomatické a nezpůsobují embolizace do pulmonální artérie. Pokud je port funkční, nemá smysl jej i při prokázané trombóze odstraňovat, protože odstraněním zrušíme jednu přístupovou cestu a nemocný nemá z odstranění žádný benefit.
Pokud nedojde k poruše funkce portu a tím k potřebě jeho vyjmutí, je indikována jeho extrakce půl roku po dokončení terapie, kdy již není předpoklad potřeby přístupu do centrální žíly. V případě delšího nepoužívání portu je doporučován proplach a heparinová zátka každé 3měsíce.
Závěr
Jak již bylo uvedeno, implantace portu byla ještě v nedávné minulosti výhradně chirurgický výkon. V současné době se většinou jedná o perkutánní výkon a této technice se stále častěji věnují intervenční radiologové. Je otázkou, zda jejich argumenty budou natolik přesvědčivé, že tyto výkony zcela převezmou. Zatím však ještě stále musí být znalost chirurgické techniky zavádění portu součástí vzdělání chirurga.
MUDr. Jana Fialová
II. chirurgická klinika FN
775 20 Olomouc, I. P. Pavlova 6
e-mail: jana.fialova@fnol.cz
Zdroje
1. Hind D, Calvert D, Mc Williams R, Davidson A, Paisley S, Beverley C, Thomas S. Ultrasonic locating devices for central venous cannulation: meta-analysis. BMJ 2003;16 : 327–361.
2. Ng F, Mastoroudes H, Paul E, Davies N, Tibballs J, Hochhauser D, Mayer A, Begent R, Meyer T. A Comparison of Hickman Line - and Port-a-Cath-associated Complications in Patients with Solid Tumours Undergoing Chemotherapy. Clinical Oncology 2007;19 : 551–556.
3. Bachleda P. Zajištění cévního přístupu u onkologicky nemocných. V: Jurga ML, editor. Klinická a radiačná onkologia. 1.vydání. Martin Osveta 2010;1526–1527.
4. Marcy PY. Central venous access: techniques and indications in oncology. Eur Radiol 2008;18 : 2333–2344.
5. Marcy PY, Magné N, Castadot P, Bailet C, Macchiavello JC, Namer M, Gallard JC. Radiological and surgical placement of port devices: 4-year institutional analysis of procedure performance, quality of life and cost in breast cancer patients. Breast Cancer Res Treat 2005;92 : 61–67.
6. Walser EM. Venous access ports: indications, implantation technice, follow-up and complications. J Cardiovasc Intervent Radiol 2011;16, e Publisher.
7. Aldrighetti L, Paganelli M, Arru M, Caterini R, Ronzoni M, Ferla G. Complication of blind placement in 980 subcutaneous infusion ports. J Vasc Access 2000;1 : 28–32.
8. Skolnick ML. The role of sonography in the placement and management of jugular and subclavian central venous catheters. Am J Roentgenol 1994;163 : 291–295.
9. McNulty NJ, Perrich KD, Silas AM et all. Implantable subcutaneus venous access devices: is port fixation necessary? A review of 534 cases. Cardiovasc Intervent Radiol 2010;33(4):751–755.
10. Chang HM, Hsieh CB, Hsieh HF, Chen TW, Chen CJ, Chan DC, Yu JC, Liu YC, Shen KL. An alternative technique for totally implantable central venous access device. A retrospective study of 1311 cases. Eur J Surg Oncol 2006;32 : 90–93.
11. Yildizeli B, Lacin T, Batirel HF, Yüksel M. Complications nad management of long-term central venous access catheters and ports. J Vasc Access 2004;5 : 174–178.
12. Bouza E, Burillo A, Munoz P. Catheter-related infections: diagnosis and intravascular treatment. Clin Microbiol Infect 2002;8 : 265–274.
13. Vescia S, Baumgärtner AK, Jacobs VR, Kiechle-Bahat M, Rody A., Loibl S, Harbeck N. Management of venous port systems in oncology: a review of current evidence. Annals of oncology 2008;19 : 9–15.
14. Hall K, Farr B. Diagnosis and management of long-term central venous catheter infections. J Vasc Interv Radiol 2004;15 : 327–324.
15. De Cicco M, Matovic M, Balestreri L, Panarello G, Fantin D, Morassut S, Testa V. Central venous thrombosis: an early and frequent complication in cancer patients bearing long-term silastic catheter. A prospective study. Thromb Res 1997;86 : 101–113.
16. Couban S, Goodyear M, Burnell M, Dolan S, Wasi P, Barnes D, Macleod D, Burton E, Andreou P, Anderson DR. Randomized, placebo-controlled study of low-dose warfarin for prevention of central venous-catheter associated thrombosis in patients with cancer. J Clin Oncol 2005;23 : 4063–4069.
17. Deitcher SR, Fesen MR, Kiproff PM, Hill PA, Li X, McCluskey ER, Semba CP. Safety and efficacy of alteplase for restoring function in occluded central venous catheters. J Clin Oncol 2002;20 : 317–324.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2012 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Jak dál ve vzdělávání v chirurgické onkologii v České republice
- Screening nádorů prsu v České republice potřebuje součinnost chirurgů
- Oznámení výboru sekce intenzivní péče: volby do výboru
- Zhoubné nádory jícnu v České republice
- Vzpomínka
- NOSE (Natural Orifice Specimen Extraction) v kolorektální chirurgii
- Zlomení osteosyntetického materiálu u pacientů se zlomeninou proximálního femuru ošetřenou DHS
- Obnova aktivní extenze nohy při paréze peroneálních nervů
- Výskyt komplikací po laparoskopické cholecystektomii v závislosti na použité koagulační technice – srovnávací studie
- Retrogastrická bronchogenní cysta
- Dopis redakci: Onkologie v praxi z pohledu českého chirurga v zahraničí
- Chirurgie karcinomu prsu - taktika a technika operací
- Význam zavádění portu u onkologických nemocných
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Obnova aktivní extenze nohy při paréze peroneálních nervů
- Chirurgie karcinomu prsu - taktika a technika operací
- Význam zavádění portu u onkologických nemocných
- Retrogastrická bronchogenní cysta
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání