-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRadikalita resekčního výkonu u nemocných s karcinomem pankreatu z pohledu prodloužení života a jeho kvality
Radical Procedures in Patients with Pancreatic Cancer – Impact on Prolongation and Quality of Life
Introduction:
In conjunction with adjuvant chemotherapy, radical resections are the only treatment modality, which significantly prolongs survival in pancreatic cancer (CaP) patients. The author aims to define current standards of radical pancreatic resections in CaP patients and to assess benefits of the surgical procedure based on literature data, as well as to evaluate current options for objective assessment of the quality of life in these patients.Methods:
Employing Pubmed and Ebscohost databases, the author compares radical pancreatic resections depending on the tumor location, performed in conjunction with standard lymphadenectomy in patients with CaP, with the extended version of the resection procedure. The radical procedure is then put into relationship with potential prolongation of survival times, with early mortality incidence rates and with rates of perioperative complications. Based on literature data, the author evaluates current options for objective assessment of the quality of life in these patients.Outcomes:
Radical resection with lymphadenectomy in N1-2 diseases followed by adjuvant chemotherapy is currently considered a standard treatment procedure, the only one which significantly prolongs survival in patients with CaP, with the disease stage T1-3, N0-1M0. Angioinvasion into the portomesenteric segment is not a contraindication for the resection procedure. In cases where R0 resection is achieved, the outcomes are similar to those in subjects without vascular segment resections.
Views on arterial resections – a. hepatica, truncus coeliacus, a. mesenterica sup. are not uniform and, to date, resections of tumor-infiltrated arteries have not been shown to result in life prolongation. Angioinvasion into arteries is considered a sign of the disease stage and the need for extended procedures is associated with increased complication rates. The quality of life following resection procedures is not commonly assessed and its improvement is usually expected, rather than objectively assessed. At the present time, no questionnaire on the quality of life, which would specifically address CaP patients, is being used on a routine basis.Discussion and Conclusions:
Radical resection R0 and administration of adjuvant chemotherapy is the only current treatment modality in patients with ductal pancreatic adenocarcinoma, which results in significant life prolongation with 7-25% five-year survival rates (median of 15–18.5 months). The tumor’s biological characteristics and the fact that the real disease staging is difficult to establish, are the reasons for early relapses after so called R0 resections. Resections of the portomesenteric segment in cases with adherence or penetration of the CaP into the vascular wall is indicated as a part of the radical PDE and do not result in shorter survival times.
Extended radical procedures with arterial resections (a. hepatica, truncus coeliacus, a. mesenterica sup.) do not result in prolonged survival times even in cases where the procedures were assessed as R0 procedures, and cannot be thought of as standard procedures. By using invasive resection procedures, the number of resecable patients would increase, however, the prize of this treatment decision may need to paid off by higher complication rates, compared to those in standard procedures, as well as by lower postoperative quality of life of the patients, while achieving comparable survival time outcomes.Key words:
pancreatic cancer – resection procedure – quality of life
Autoři: M. Ryska
Působiště autorů: Chirurgická klinika 2. LF UK a ÚVN Praha
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 12, s. 725-730.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Radikální resekce je jedinou léčebnou modalitou, která ve spojení s adjuvantní chemoterapií signifikantně prodlužuje přežívání nemocných s karcinomem pankreatu (CaP). Cílem sdělení je definovat současný standard radikální resekce pankreatu u nemocných s CaP, zhodnotit přínos rozšířeného operačního výkonu a pomocí literárních údajů zhodnotit současné možnosti objektivizace kvality života u těchto nemocných.Metoda:
Radikální resekce pankreatu v závislosti na lokalizaci nádoru u nemocných s CaP se standardní lymfadenektomií je s využitím databáze Pubmed a Ebscohost porovnána s rozšířenou modalitou resekce a uvedena do souvislostí s eventuálním prodloužením přežívání, incidencí časné mortality a výskytem perioperačních komplikací. Pomocí literárních údajů jsou zhodnoceny současné možnosti objektivizace kvality života u těchto nemocných.Výsledky:
Radikální resekce s lymfadenektomií v rámci N1-2 je v současné době ve spojení s adjuvantní chemoterapií považována za standardní léčebný postup, který jako jediný signifikantně prodlužuje přežívání u nemocných s CaP se stagingem T1-3,N0-1M0. Angioinvaze do portomezenterického segmentu není kontraindikací k provedení resekčního výkonu a při dosažení R0 resekce jsou výsledky obdobné jako u nemocných bez resekce žilního segmentu. Náhled na resekci tepen – a. hepatica, truncus coeliacus, a. mesenterica sup. není jednotný a t.č. není prokázáno, že resekce nádorem infiltrované tepny vede k prodloužení života. Angioinvaze do tepen je posuzována spíše jako faktor pokročilosti onemocnění a rozšířený resekční výkon prokazuje větší výskyt komplikací.
Kvalita života po resekčních výkonech je sledována spíše ojediněle, její zlepšení po resekčních výkonech je spíše předpokládáno než objektivizováno. V současné době neexistuje rutinně používaný dotazník kvality života specificky zaměřený na pacienta s CaP.Diskuse a závěr:
Jedinou současnou léčebnou modalitou u nemocných s duktálním adenokarcinomem pankreatu, která vede k signifikantnímu prodloužení života, je provedení radikální resekce R0 a podání adjuvantní chemoterapie s pětiletým přežitím 7–25 % (medián 15–18,5 měsíců). Biologická povaha nádoru a obtížně stanovitelný reálný staging onemocnění jsou důvodem časné recidivy po provedené tzv. R0 resekci. Resekce portomezenterického segmentu při adherenci či prorůstání CaP do cévní stěny je indikována v rámci radikální PDE, nevede ke zkrácení přežívání.
Rozšířený radikální výkon s resekcí tepny (a. hepatica, truncus coeliacus, a. mesenterica sup.) pravděpodobně ani při hodnocení výkonu jako R0 resekce nevede k prodloužení přežívání a nelze jej považovat za výkon standardní. Agresivním resekčním přístupem zvýšíme procento resekabilních nemocných, nicméně cena tohoto rozhodnutí může být zaplacena vyšším počtem komplikací ve srovnání s výkonem standardním a nižší kvalitou života pacienta po operaci při dosažení srovnatelné doby přežití.Klíčová slova:
karcinom pankreatu – resekční výkon – kvalita životaÚVOD
Radikální resekce je jedinou léčebnou modalitou, která ve spojení s adjuvantní chemoterapií signifikantně prodlužuje přežívání nemocných s karcinomem pankreatu – CaP [1]. Ten se vyskytuje ve více než 90 % v podobě duktálního adenokarcinomu lokalizovaného v hlavě slinivky.
Radikální resekce je v současné době u naprosté většiny nemocných s CaP prováděna v podobě segmentárního resekčního výkonu se standardní lymfadenektomií N1-2. Resekce portomezenterického žilního segmentu, v případě adherence či prorůstání tumoru do žilní stěny, je považována za součást standardního výkonu, pokud je dosaženo resekce R0 [2]. V ostatních případech je u lokálně pokročilého karcinomu celosvětově diskutována otázka vhodnosti tzv. rozšířených výkonů [3].
Cílem sdělení je definovat současný standard radikální resekce pankreatu u nemocných s CaP, zhodnotit přínos rozšířeného operačního výkonu a pomocí literárních údajů zhodnotit současné možnosti objektivizace kvality života u těchto nemocných.
METODA
Radikální resekce pankreatu v závislosti na lokalizaci nádoru u nemocných s CaP se standardní lymfadenektomií je s využitím databáze Pubmed a Ebscohost porovnána s rozšířenou modalitou resekce a uvedena do souvislostí s eventuálním prodloužením přežívání, incidencí časné mortality a výskytem perioperačních komplikací. Pomocí literárních údajů jsou zhodnoceny současné možnosti objektivizace kvality života u těchto nemocných.
1. Popis výkonů
V souladu s literárně uváděnými typy v současné době prováděných resekčních výkonů u nemocných s CaP (duktální adenokarcinom) lze podle údajů z databází Pubmed a Ebcohost, včetně pravidelně aktualizovaného standardů diagnostiky a terapie, uvést následující operační výkony:
Radikální resekční výkon se současnou standardní lymfadenektomií
Představa o standardní resekci pankreatu s adekvátní lymfadenektomií se v průběhu poslední dekády příliš nezměnila. Operační postup byl stanoven v průběhu devadesátých let minulého století a to především na základě zhodnocení technických možností [4]. CaP se šíří nejen lymfatickou cestou, ale i perineurálně.
Podle lokalizace nádoru je v případě duktálního adenokarcinomu indikována v závislosti na lokalizaci proximální pankreatoduodenektomie, levostranná pankreatektomie či zřídka totální pankreatektomie. Centrální segmentární pankreatektomie není u duktálního adenokarcinomu krčku či těla pankreatu doporučována [3].
Proximální pankreatoduodenektomie (PDE)
PDE je indikována při lokalizaci CaP v oblasti hlavy či krčku pankreatu. Na většině pracovišť se dává přednost modifikaci podle Traverso se zachováním pyloru s vědomím, že je prokázána stejná onkologická radikalita jako při původní operaci podle Kausche-Whipplea s resekcí distální části žaludku [5].
Standardní resekce představuje vyjmutí žlučníku, ductus choledochus, duodena od linie cca 5 cm aborálně od pyloru a hlavy pankreatu (s oblastí krčku, pokud CaP z hlavy přesahuje do oblasti krčku). Je obvyklé, že se resekční plocha pankreatu v oblasti krčku a retroperitoneálně odesílá k rychlému bioptickému vyšetření k ověření, že resekujeme žlázu v parenchymu nepostiženém tumorem a že neponecháváme nádor dorzálně od mezenterických cév.
Za adekvátní lymfadenektomii se v současné době považuje odstranění pojivové tkáně od hilu jaterního (přesněji od místa disekce ductus hepaticus communis těsně nad junkcí d. cysticus), podél lig. hepatoduodenale a vpravo od v. portae, v. mesenterica sup. a dorzálně ležící a. mesenterica sup. Dále je nutné odstranit tkáň podél a. hepatica communis až k truncus coeliacus (Obr. 1).
Obr. 1. Peroperační obrázek znázorňující stav po provedení PDE se standardní lymfadenektomií Fig. 1. Intraoperative view, showing a condition following PDE with standard lymphadenectomy 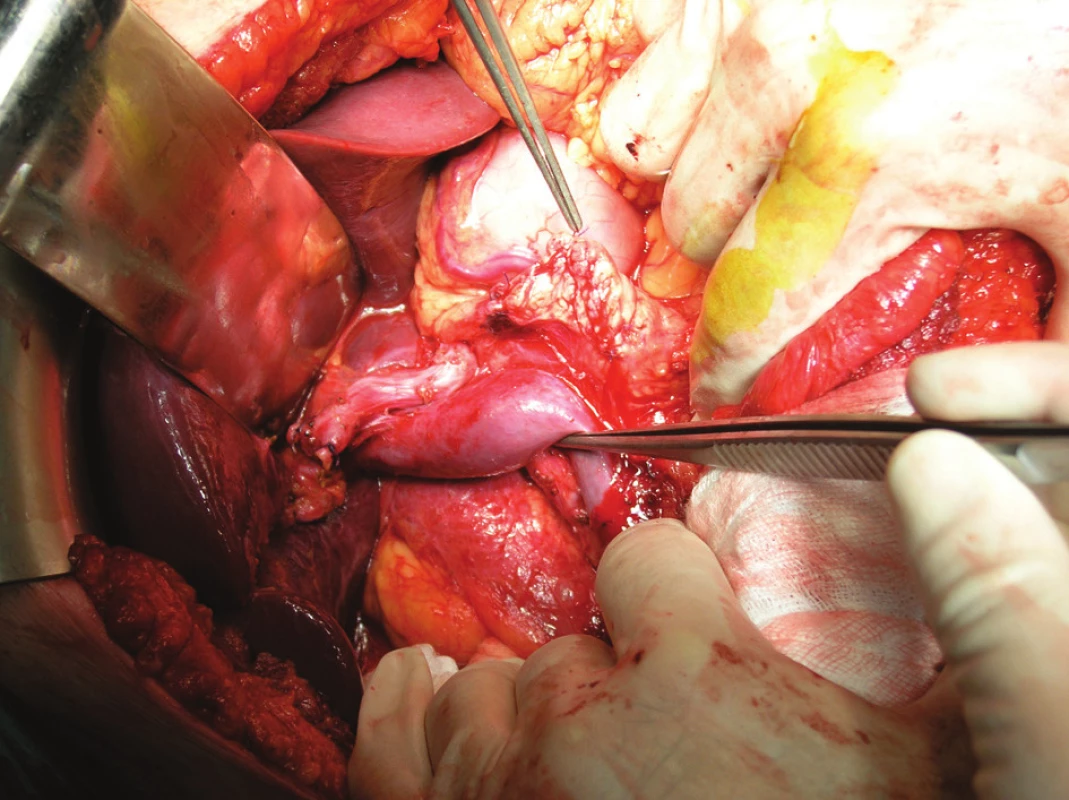
Na některých pracovištích se resekční výkon zahajuje provedením tzv. kocherizace duodena a preparací podél pravé strany a. mesenterica sup. – tzv. „artery first approach“ [6]. K bioptickému vyšetření se na některých pracovištích odebírá vzorek tkáně z retroperitonea z oblasti mezi v. cava inf. a aortou na úrovni hlavy pankreatu (Obr. 2).
Obr. 2. Místo odběru tkáně k peroperačnímu vyšetření (interaortocaval space) – označeno šipkou Fig. 2. The site of the tissue collection for peroperative examination (interaortocaval space) – marked with an arrowhead 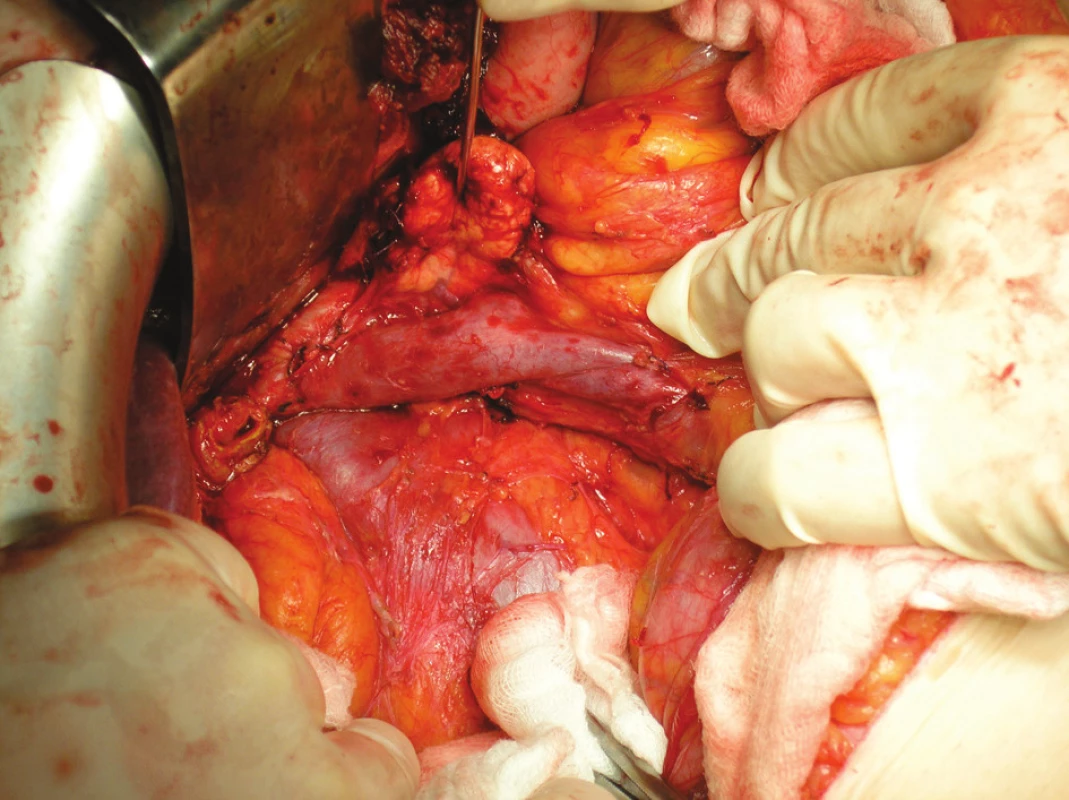
Pokud patolog najde peroperačně v linii resekce maligní tkáň, PDE se doporučuje změnit na TPE [7]. V případě pozitivity odebrané tkáně z resekční linie dorzálně od mezenterických cév je nutné postiženou tkáň dodatečně odstranit, změnit peroperační staging a resekční výkon se spíše stává paliativním. Pokud patolog najde peroperačně pozitivitu z odebrané tkáně v retroperitoneálním prostoru mezi aortou a dolní dutou žílou, od původně plánované radikální resekce je vhodné ustoupit či v přísně selektovaných případech (většinou u mladého nemocného) provést resekci paliativní.
Odběr dalších vzorků na peroperační či definitivní histologické vyšetření (uzliny N2, N3, dorzální resekční plocha apod.) či peroperační provedení ultrasonografického vyšetření jater, závisí na zvyklostech pracoviště či na probíhajících klinických studií.
Po dokončení proximální resekce s výše popsanou lymfadenektomií nastupuje fáze rekonstrukční, při které je třeba postupně provést pankreatojejuno - / pankreatogastro - anastomózu (PJA, PGA), hepatikojejunoanastomózu (HJA) a duodenojejunoanastomózu (DJA), většinou na první kličku jejunální. Typ zvolené rekonstrukce nemá vliv na prognózu pacienta [8], i když se vzhledem k 10% výskytu dehiscencí PJA v poslední době upřednostňuje PGA (D. Jaeck, 2010, osobní sdělení). Založení nazojejunální sondy protažením distálně od DJA k časné pooperační enterální výživě považujeme za součást standardního postupu. Způsob pojistného drénování dutiny břišní závisí na konkrétním pracovišti.
Výše popsaný postup peroperačního vyšetřování odebrané tkáně je spíše maximalistický a nepochybně existují v pankreatické chirurgii velmi kvalifikovaní chirurgové, kteří uvedená vyšetření neprovádějí či nevyžadují jejich peroperační hodnocení patologem s poukazem na časté diskrepance mezi výsledky rychlého bioptického (fresh frozen section) a klasického definitivního vyšetření.
Levostranná pankreatektomie (DPE)
Při lokalizaci CaP v těle či kaudě pankreatu je indikována levostranná radikální pankreatektomie, dříve označovaná jako distální (DPE) (Obr. 3).
Obr. 3. DPE se splenektomií Fig. 3. DPE with splenectomy 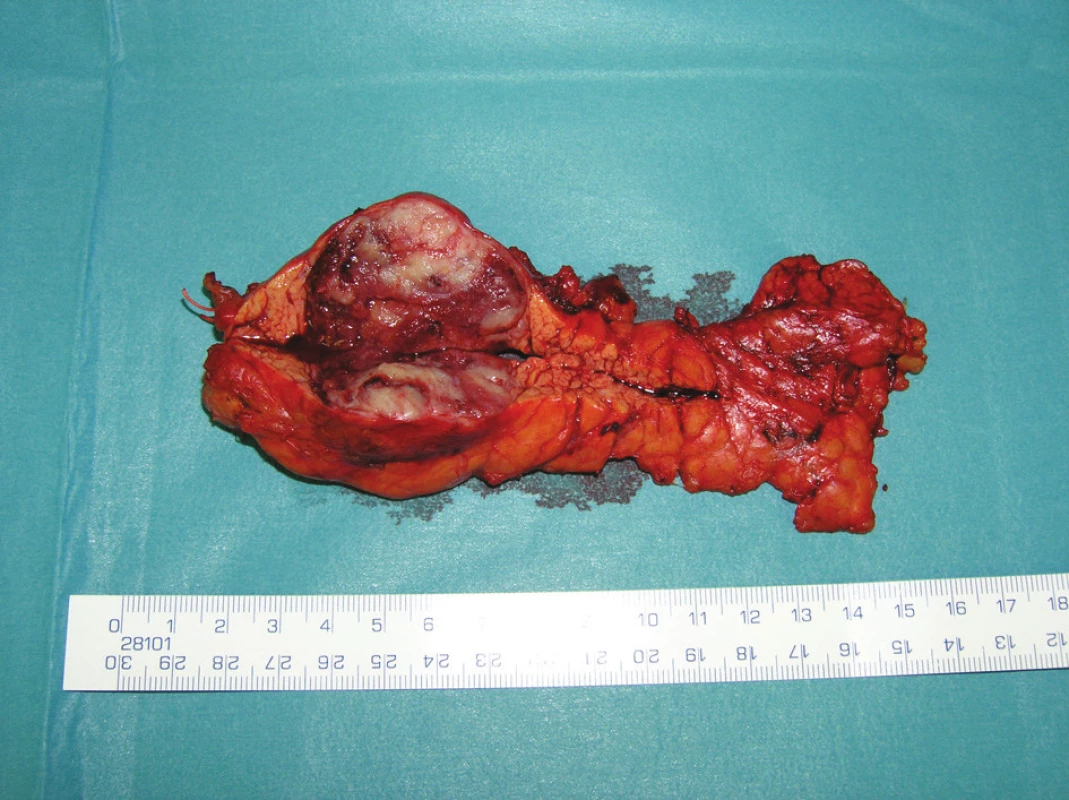
DPE je ve srovnání s PDE technicky jednoduší, indikovaných nemocných s CaP v těle a kaudě pankreatu k DPE je zřetelně méně vzhledem k tomu, že klinické příznaky se dostavují později. Většina nemocných se tak dostaví k první návštěvě lékaře již s neoperabilním CaP.
Žláza se při radikální DPE protíná obvykle v oblasti krčku. Pokud je CaP lokalizován v těle a nemáme průkaz postižení uzlin v oblasti hilu sleziny, můžeme provést resekci se zachováním sleziny.
Lymfadenektomie zahrnuje odstranění uzlin N1, 2, resekční plochu odesíláme peroperačně k rychlému bioptickému vyšetření. Při dostatečné zkušenosti lze DPE provést u většiny nemocných laparoskopicky. Na resekční ploše je nutné uzavřít zející ductus pancreaticus a resekční plochu ošetřit v prevenci pooperačního krvácení.
Totální pankreatektomie (TPE)
Po počátečním nadšení se od provádění TPE koncem minulého století ustoupilo vzhledem k vysokému výskytu pozdních komplikací, především rozvoji diabetu. V posledních letech někteří autoři revokují tento postup s tvrzením, že mortalita a morbidita TPE je srovnatelná se segmentárními resekčními výkony. Výhodu TPE spatřují především ve vyšší potencionální onkologické radikalitě při častém multifokálním výskytu CaP v pankreatu [9].
Podle současného názoru, stanoveného na základě provedených studií, je TPE vhodná při zjištěné pozitivitě resekční plochy či při operační příhodě, která si provedení TPE vynucuje. Elektivní TPE není doporučována [3].
U všech současných standardně prováděných radikálních resekcí pankreatu je za adekvátní lymfadenektomii považováno odstranění lymfatických uzlin N1, 2 s tím, že případná jejich pozitivita má vliv na stanovení pooperačního stagingu. Zjištěná pozitivita lymfatických uzlin proto většinou nemůže mít vliv na rozhodování v průběhu operace.
V případě, že najdeme peroperačně pozitivní resekční linii při PDE či DPE, je doporučeno provést TPE. V případě peroperační pozitivity odebrané tkáně z prostoru mezi v. cava inf. a aortou, lze rozhodnutí provést paliativní resekci či nikoliv, ponechat na úvaze operatéra.
Na některých pracovištích je odebírána ještě uzlina č. 12a, respektive uzlina č. 9 – podle klasifikace japonských autorů – odpovídající uzlině N2, resp. N3 (10). Jejich pooperační vyšetření také mění definitivní staging a provedený resekční výkon považujeme v případě pozitivity N3 za paliativní s příslušnou prospekcí života rovnající se v podstatě exploraci či biliodigestivní spojce [3].
Resekce portomezenteriálního žilního segmentu
U části nemocných s CaP lokalizovaných v hlavě pankreatu nádor intimně adheruje ke stěně v. portae, v případě lokalizace v processus uncinatus k v. mesenterica sup. V některých případech dokonce do žilní stěny prorůstá. Zkušený rentgenolog tuto situaci většinou správně ohodnotí předoperačně při CT vyšetření, snad ještě lépe si počíná zkušený endoskopista provádějící endosonografické vyšetření. Nicméně občas je i nadále nucen předoperačně nerozpoznanou angioinvazi do portomezenterického segmentu řešit chirurg, který patologický nález rozpozná většinou až po protětí krčku pankreatu (Obr. 4).
Obr. 4. PDE s resekcí v. portae – a) stav po vyjmutí preparátu – b) stav po provedené rekonstrukci Fig. 4. PDE with the portal vein resection a) post-resection condition b) following reconstruction 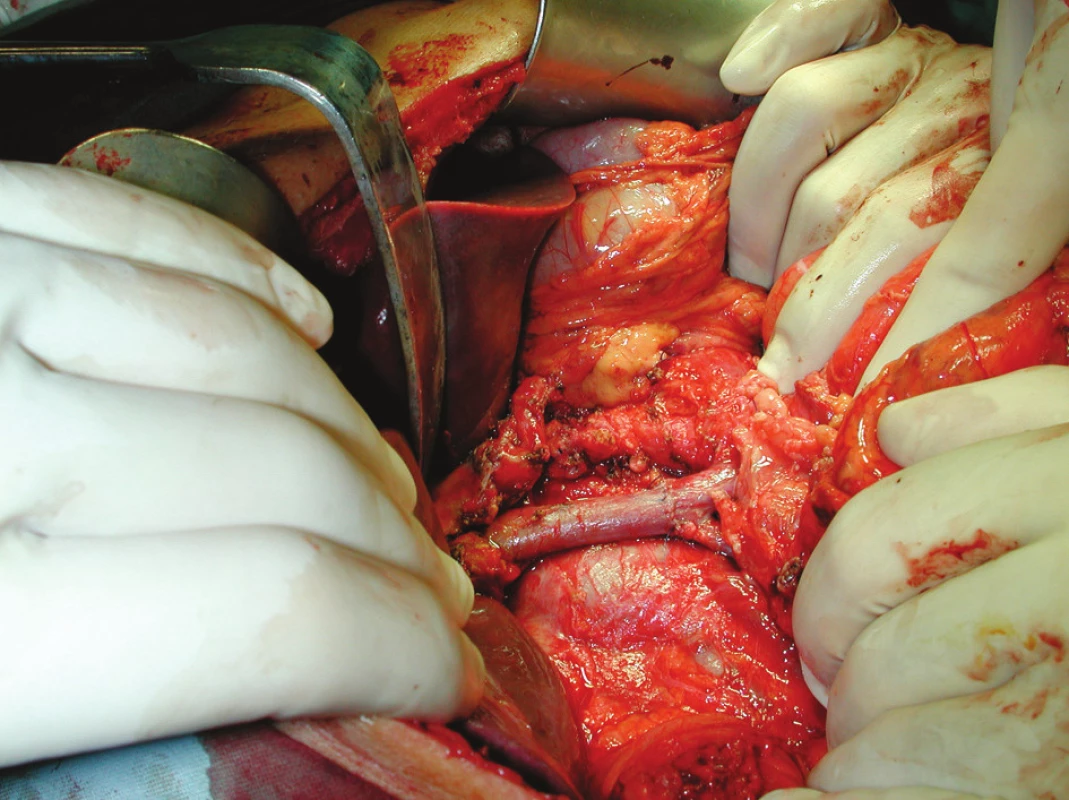
Resekce artcarie
Na rozdíl od resekce portální žíly je arteriální resekce považována za výkon neobvyklý. Resekce a. mesenterica sup. postižené duktálním adenokarcinomem je v literatuře uváděna sporadicky [11, 12] a obecně je považována za kontraindikaci k resekčnímu výkonu (Obr. 5).
Obr. 5. Angioinvaze CaP do a. mesenteria sup. Fig. 5. Angioinvasion of CaP into a. mesenterica sup. 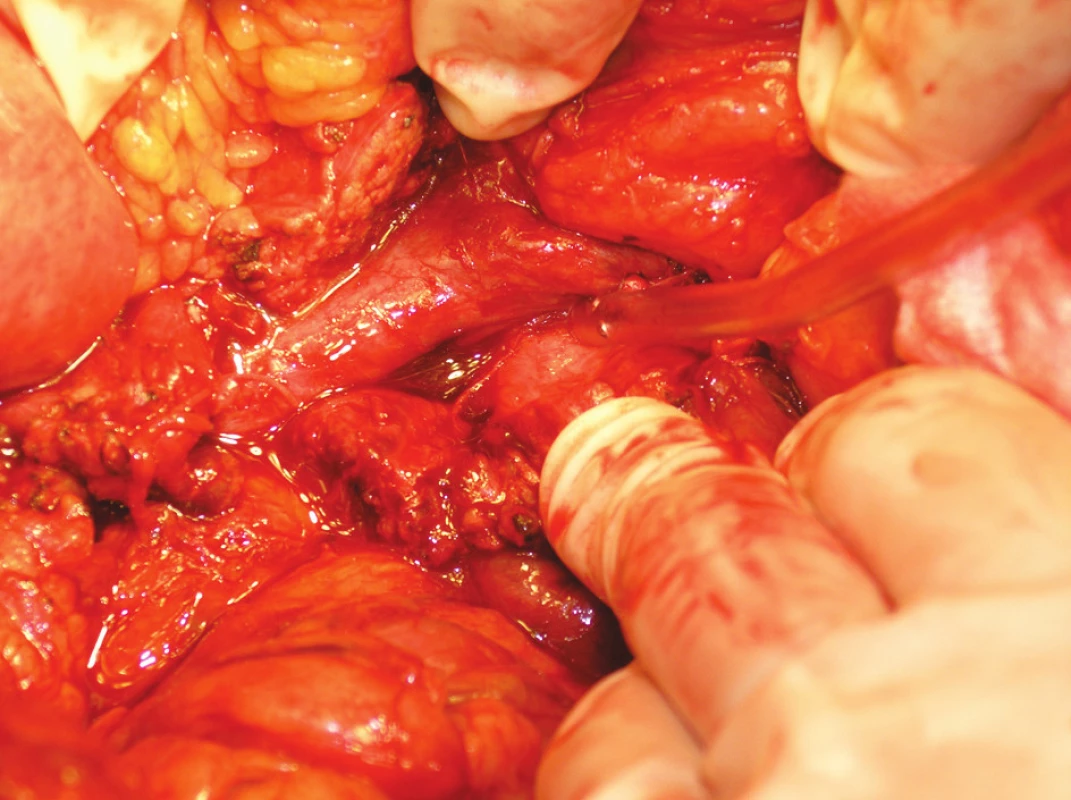
Adherence nebo prorůstání CaP do truncus coeliacus nemusí být považováno jednoznačně za projev neresekability. Celý truncus coeliacus může být odstraněn jako součást výkonu při PDE i DPE s rekonstrukcí pomocí a. hepatica. Je možné předoperačně provést embolizaci tepny [13]. Disekovanou část a. lienalis a a. gastrica sin. není třeba nahrazovat, u některých nemocných je nutné připojit splenektomii. Kontrolu perfuze jater je u takového výkonu vhodné provést ještě v průběhu operace.
Radikální rozšířené resekce pro CaP
Z původních sdělení Fortnera [14] plyne předpoklad autora, že zvýšení onkologické radikality výkonu je závislé na jeho rozšíření mimo slinivku. Resekční výkon znamenal kromě pankreatektomie také multiviscerální resekci s odstraněním pojivové tkáně z retroperitonea a resekci velkých cév v supramezokolickém prostoru. Provedené randomizované studie neprokázaly přínos tohoto postupu ve smyslu prodlouženého přežívání, výsledky se signifikantně nelišily od standardního radikálního resekčního výkonu [15]. Výskyt komplikací v časném pooperačním období byl u rozšířených radikálních výkonů signifikantně vyšší [16].
Nehledě k výhradám k designu randomizovaných studií a nevelkému počtu zařazených pacientů není v současné době provádění těchto výkonů jednoznačně oprávněné vyjma některých zcela ojedinělých případů, které jsou níže popsány jako multiviscerální resekce.
Multiviscerální resekce
Pokud CaP adheruje či zasahuje do sousedních orgánů (např. do zadní stěny žaludku či do colon transversum), lze uvažovat o provedení multiviscerální resekce. Výsledky těchto operací jsou překvapivě srovnatelné se segmentárním radikálním resekčním výkonem. Podmínkou je dosažení R0 resekce [17].
2. Hodnocení kvality života (QoL) po resekčním výkonu pro CaP
Většina autorů automaticky předpokládá, že provedením resekce u nemocného s CaP dosáhneme zlepšení kvality života a v tomto duchu koncipuje i závěr svého sdělení [18]. Překvapivě to nemusí být v řadě případů pravda a to především tam, kde došlo k závažné pooperační komplikaci či stavu, který vyžadoval prodloužení doby hospitalizace.
V současné době neexistuje klinicky zavedený dotazník kvality života, který by byl specifický pro karcinom pankreatu. Používá se proto nespecifický dotazník vhodný i pro onkologické nemocné (např. SF 36/2. verze) či dotazník pro onkologické nemocné, který ale nesplňuje některé specifické požadavky pro nemocné s CaP [19, 20]. Dotazník specificky zaměřený k evaluaci nemocných s CaP je v současné době klinicky zkoušen, nebyl zatím uveden do běžné klinické praxe.
I při zavedení specifického dotazníku bude ale velmi obtížné oddělit vlivy operačního výkonu na fyzický a mentální stav pacienta v pooperačním období a to zejména od vedlejších účinků podávané chemoterapie či biologické léčby. Proto bude pravděpodobně možné posuzovat ovlivnění QoL v rámci konkrétní terapeutické modality a porovnávat ji s modalitou jinou.
V rámci multicentrické studie podpořené grantem IGA MZ ČR NR 9998-4 zpracováváme v současné době data získaná pomocí dotazníku SF36/2.verze u nemocných v průběhu léčby karcinomu pankreatu tak, aby bylo zřejmé, jak dlouho po radikální resekci pacient ohodnotí svůj fyzický a mentální stav srovnatelně či lépe se stavem předoperačním. Jedním z hlavních cílu studie je zobjektivizovat zátěž léčby tak, jak jej hodnotí sami pacienti.
VÝSLEDKY
Radikální resekce s lymfadenektomií v rámci N1-2 je v současné době ve spojení s adjuvantní chemoterapií považována za standardní léčebný postup, který jako jediný signifikantně prodlužuje přežívání u nemocných s CaP se stagingem T1-3, N0-1M0. Angioinvaze do portomezenterického segmentu není kontraindikací k provedení resekčního výkonu a při dosažení R0 resekce jsou výsledky obdobné jako u nemocných bez resekce žilního segmentu. Náhled na resekci tepen – a. hepatica, truncus coeliacus, a. mesenterica sup. není jednotný a t.č. není prokázáno, že resekce nádorem infiltrované tepny vede k prodloužení života. Angioinvaze do tepen je posuzována spíše jako faktor pokročilosti onemocnění a rozšířený resekční výkon prokazuje větší výskyt komplikací.
Kvalita života po resekčních výkonech je sledována ojediněle, její zlepšení po resekčních výkonech je spíše předpokládáno než objektivizováno.
DISKUSE A ZÁVĚR
Jedinou současnou léčebnou modalitou u nemocných s CaP, která vede k signifikantnímu prodloužení života, je provedení radikální resekce R0 a podání adjuvantní chemoterapie [3]. Lze takto dosáhnout pětiletého přežití u 7–25 % nemocných s mediánem 15–18,5 měsíců. U této skupiny nemocných ve stadiu I.–II. podle klasifikace UICC lze očekávat u 95 % operovaných recidivu onemocnění do 2 let.
Z tohoto pohledu je zřejmé, že u naprosté většiny radikálně resekovaných (R0) nemocných je obtížné zpětně ohodnotit operační výkon či reálný staging onemocnění. H. Beger dokonce hovoří o „selhání R0 resekce“ [21].
Kde hledat odpověď?
Především v biologické povaze duktálního adenokarcinomu pankreatu a v jeho šíření. Bylo prokázáno, že postižení N2 lymfatických uzlin může být u duktálního adenokarcinomu zaznamenáno i při malé velikosti nádoru –T1-2 [3]. Kromě toho metoda PCR (Polymerase Chain Reaction – Polymerázová řetězová reakce) vyšetření uzlin prokazuje v 60 % nádorovou pozitivitu oproti vyšetření standardnímu. Nezjištěné perineurální šíření nádoru v peripankreatické tkáni výrazně zhoršuje kvalitu definitivního stagingu a jeho zhodnocení po provedení radikálního resekčního výkonu ve smyslu prospekce života. U těchto nemocných se nejedná o výkon radikální, ale o léčbu paliativní, přesněji řečeno o „debulking“ – tumor redukující resekci. Faktorů ovlivňujících přesnost stagingu je však více.
Popsané poznatky na jedné straně vedou k úvahám o rozšíření radikality výkonu, na straně opačné k velmi střízlivému posuzování „radikality“ resekce [3]. I u nás lze pozorovat protikladné náhledy na tento přetrvávající problém. Počty provedených resekčních výkonů však neumožňují zaujmout stanovisko, které by bylo seriózně podložené dlouhodobými výsledky.
Jak hodnotit angioinvazi?
Na základě řady popsaných pozorování a analýzy sestav nemocných je v současné době zastáván názor, že resekce portomezenterického segmentu při adherenci či prorůstání CaP do cévní stěny je indikována v rámci radikální PDE a že nevede ke zkrácení celkové doby přežívání. Naopak – resekce žíly může umožnit dokončení radikální resekce a tím i prodloužit přežívání [3]. Podmínkou je udržet na chirurgickém pracovišti u těchto nemocných srovnatelnou nízkou peroperační mortalitu. Nicméně postižení žilní stěny tumorem cirkulárně je považováno za špatný prognostický příznak [22]. Přínos arteriálních resekcí hodnotit zatím nelze. Malé sestavy to neumožňují.
Výhodou agresivního resekčního přístupu je skutečnost, že zvýšíme procento resekabilních nemocných s CaP. Vysoká cena tohoto rozhodnutí může být zaplacena vyšším počtem komplikací ve srovnání s výkonem standardním a nižší kvalitou života pacienta po operaci při docílení srovnatelné doby přežití se standardní resekcí [3]. Pokud nedosáhneme R0 resekce – a posoudit výkon z hlediska onkologické radikality může být v konkrétním případě velmi obtížné až nemožné –, lze výkon označit jako neindikovaný. V tomto případě se jedná o operaci paliativní, kterou nejlépe poznáme krátkodobým přežitím srovnatelným s explorací či provedením biliodigestivní spojky.
V současné době se hodnocení QoL v průběhu léčby rutinně neprovádí a ani neexistuje rutinně používaný dotazník kvality života specificky zaměřený na pacienta s CaP.
Práce je podpořena grantem IGA MZ ČR č. NR 9998-4.
Prof. MUDr. Miroslav Ryska, CSc.
Chirurgická klinika 2. LF UK a ÚVN Praha
U Vojenské nemocnice 1 200
160 00 Praha 6
e-mail: miroslav.ryska@uvn.cz
Zdroje
1. Alexakis, N., Halloran, C., Raraty, M., et al. Current standard of surgery for pancreatic cancer. BJS, 2004, 91 : 1410–1427.
2. Koliopanos, A., Avgerinos, C., Farfaras, A., et al. Radical resection of pancreatic cancer. Hepatobiliary Pancreat Dis. Int., 2008; 7 : 11–18.
3. Glanemann, M., Shi, B., Liang, F., et al. Surgical strategies for treatment of malignit pancreatic tumors: extended, standard or local surgery? World J. Surg. Oncol., 2008; 4–6 : 123.
4. Allema, J. H., Reinders, M. E., van Gulik, T. M., et al. Prognostic factors for survival after pancreaticoduodenectomy for patients with carcinoma of the pancreatic head region. Cancer, 75, 1995 : 2069–2076.
5. Patel, A. G., Toyama, M. K., Kusske, A. M., et al. Pylorus – preserving Whipple resection for pancreatic cancer. Is it better? Arch. Surg., 130, 1995 : 838–843.
6. Weitz, J., Rahbari, N., Koch, M., Büchler, M. W. The „artery first“ approach for resection of pancreatic head cancer. J. Am. Coll. Surg., 210; 2010 : 1–4.
7. Büchler, M. W., Wagner, M., Schmied, B. M., et al. Changes in Morbidity After Pancreatic Resection. Toward the End of Completion Pancreatectomy. Arch. Surg., 2003; 138 : 1210–1314.
8. Friess, H., Kleeff, J., Kulli, C., et al. The impact of different types of surgery in pancreatic cancer. Eur. J. Surg. Oncol., 25, 1999 : 124–131.
9. Ihse, I., Andrén-Sandberg, A. Surgical treatment: total pancreatectomy. In: Beger, H., Warshaw, A. L., Büchler, M. W., et al. Pancreas. Blackwell Science, London, 1998 : 1047–1054.
10. Tsunoda, T., Ura, K., Eto, T., et al. UICC and Japanese stage classifications for carcinoma of the pancreas. Int. J. Pancreatol., 8, 1991 : 205–214.
11. Reddy, S. K., Tyler, D. S., Pappas, T. N., et al. Extended resection for pancreatic adenocarcinoma. The Oncologist, 2007; 12 : 654–663.
12. Chen, B., Hu, S., Wang, L., et al. Extended pancreatectomy with en bloc resection of the celiac axis for locally advanced cancer of pancreatic body and tail. , 2008; 55 : 2252–2255.
13. Denecke, T., Andreou, A., Podrabsky, P., et al. Distal Pancreatectomy With En Bloc Resection of the Celiac Trunk for Extended Pancreatic Tumor Disease: An Interdisciplinary Approach. Cardiovasc. Intervent. Radiol., 2010 Oct 9. [Epub ahead of print]
14. Fortner, J. G., Kim, D. K., Cubilla, A., et al. Regional resection of cancer of the pancreas: a new surgical approach. Surgery, 1977; 73 : 307–320.
15. Michalski, C. W., Kleeff, J., Wente, M. N., et al. Systematic review and meta-analysis of standard and extended lymphadenectomy in pancreaticoduodenectomy for pancreatic cancer. Br. J. Surg., 2007; 94 : 265–273.
16. Schniewind, B., Bestmann, B., Henne-Bruns, D., et al. Quality of life after pancreaticoduodenectomy for ductal adenocarcinoma of the pancreatic head. Br. J. Surg., 2006; 93 : 1099–1107.
17. Nikfarjam, M., Sehmbey, M., Kimchi, E. T., et al. Additional organ resection combined with pancreaticoduodenectomy does not increase postoperative morbidity and mortality. J. Gastrointest. Surg., 2009; 13 : 915–921.
18. Schafer, M., Mullhaupt, B., Clavien, P. A. Evidence-Based pancreatic head resection for pancreatic cancer and chronic pankreatitis. Ann. Surg., 2002; 236 : 137–148.
19. Scheingraber, S., Scheingraber, T., Brauckhoff, M., et al. Comparison between a general and a disease-specific health-related quality-of-life questionnaire in patients after pancreatic Sumery. J. Hepatobiliary Pancreat. Surg., 2005; 12 : 290–297.
20. Pezzilli, R., Fantini, L., Morselli-Labate, A. M. Pancreatectomy for Pancreatic Disease and Quality of Life. J. Pancreas, 2007; 8 : 118–131.
21. Beger, H. G., Rau, B., Gansauge, F., et al. Treatment of pancreatic cancer: challenge of the facts. World J. Surg., 2003, 27 : 1075–1084.
22. Siriwardana, H. P., Siriwardana, A. K. Systematic review of outcome of synchronous portal-superior mesenteric vein resection during pancreatectomy for cancer. Br. J. Surg., 2006; 93 : 662–673.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- VĚCNÝ REJSTŘÍK
- OBSAH - AUTORSKÝ REJSTŘÍK
- Resekce pankreatu pro karcinom – nutnost stanovení stagingu onemocnění
- Radikalita resekčního výkonu u nemocných s karcinomem pankreatu z pohledu prodloužení života a jeho kvality
- Chirurgie karcinomu pankreatu na I. chirurgické klinice FN Olomouc
- Náhrada jícnu tlustým střevem – zkušenosti se 109 případy
- Videoasistovaná resekce jícnu pro karcinom – desetileté zkušenosti
- Solitární fibrózní tumor pleurální dutiny
- Riziko kolorektálního karcinomu v terénu ulcerózní kolitidy
- Vlastní modifikace rekonstrukce žaludku po gastrektomii pro karcinom
- Vzácné pupeční abnormality
- Možnosti transanální endoskopické mikrochirurgické techniky
- Ambulantní excize perianálních duplikatur
- Přežívání nemocných po radiofrekveční ablaci jaterních metastáz kolorektálního karcinomu
- XLIF – nová technika náhrady meziobratlové ploténky bederní páteře: první zkušenosti
- ROBOTIKA A FOTODYNAMIKA 2010. Pohled z jihu.
- Blahopřání k sedmdesátým narozeninám
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vzácné pupeční abnormality
- Ambulantní excize perianálních duplikatur
- Solitární fibrózní tumor pleurální dutiny
- XLIF – nová technika náhrady meziobratlové ploténky bederní páteře: první zkušenosti
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




