-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Endoskopická diagnostika a léčba plochých nádorových lézí střevních
Endoscopic Diagnostics and Treatment of Flat Intestinal Lesions
The aim of the article is to provide information on current options for endoscopic diagnostics and treatment of flat tumor intestinal lesions. These neoplasms are frequently and inaccurately described as sessile polyps, which have different genetic and diagnostic features, different prognosis and therapy. Although until recently, the lesions have been managed using surgery, the current approach is predominantly endoscopic.
Key words:
flat tumor intestinal lesions – colorectal carcinoma – endoscopic polypectomy – endoscopic mucosal resection – endoscopic submucosal dissection
Autoři: O. Urban; P. Fojtík; M. Kliment; D. Janík; J. Örhalmi; P. Holéczy
Působiště autorů: Vítkovická Nemocnice a. s., oddělení chirurgie, primář: doc. MUDr. Pavol Holéczy, CSc. ; Vítkovická Nemocnice a. s., Centrum péče o zažívací trakt, primář: MUDr. Ondřej Urban, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 6, s. 310-313.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cílem přehledného článku je seznámit čtenáře se současnými možnostmi endoskopické diagnostiky a léčby plochých nádorových lézí střevních. Tyto neoplazie bývají často nepřesně popisovány jako přisedlé polypy, od kterých se liší geneticky, prognosticky, obtížností diagnostiky a způsobem terapie. Zatímco v nedávné minulosti byly tyto léze většinou léčeny chirurgicky, v dnešní době zcela převážila léčba endoskopická.
Klíčová slova:
plochá nádorová léze střevní – kolorektální karcinom – endoskopická polypektomie – endoskopická slizniční resekce – endoskopická submukózní disekceKolorektální karcinom (KRK) je druhou nejčastější příčinou nádorových úmrtí v západních zemích. Ve vysoce rizikových populacích jako je česká, dosahuje incidence 76/100 000 a stále roste. Výskyt KRK v Evropě předstihl výskyt karcinomu plic a na rozdíl od USA nemá dosud klesající tendenci.
KRK většinou vzniká z původně nezhoubného adenomového polypu. Předpokládá se, že proces kancerogeneze v adenomovém polypu trvá asi 5–15 let [1]. Přerušení tohoto vývoje endoskopickou polypektomií patří mezi nejefektivnější zásahy sekundární prevence v onkologii. Některé karcinomy však nevznikají z prekancerózy polypoidního tvaru, ale z prekancerózy ploché, případně vznikají de novo z dysplastické sliznice.
Polyp je slovo řeckého původu, označující výrůstek, spojený se sliznicí stopkou. První případ polypu byl popsán v roce 1721 [2]. Plochý adenom popsal v roce 1985 Muto [3].
Pro vzájemnou komunikaci lékařů různého zaměření je důležitá makroskopická klasifikace kolorektálních neoplazií. Současnou terminologii určuje Pařížská endoskopická klasifikace povrchovýchneoplastických lézí, publikovaná v roce 2003 [4].
Rozlišují se léze povrchové (superficial) a pokročilé (advanced). Podle definice je neoplastická léze označena jako povrchová, jestliže podle jejího endoskopického vzhledu lze odhadnout, že penetrace do stěny trávicí trubice nepřesahuje submukózu, tj. že není přítomna infiltrace do lamina muscularis propria (tzv. typ 0). Léze typu 0 se dělí na polypoidní a nepolypoidní. Polypoidní léze (typy 0-Ip, Is) zřetelně prominují nad okolní sliznici. Jejich výška je větší než poloměr, endoskopicky jsou vyšší než je průměr zavřených bioptických kleští (2,5 mm) a při histologickém vyšetření je výška léze větší než je dvojnásobek výšky okolní sliznice. Polypoidní léze jsou stopkaté nebo přisedlé (sesilní). Stopkaté mají basi užší než je průměr polypu. U sesilních má báze stejný průměr jako hlava.
Nepolypoidní neoplastické léze jsou vyhloubené (typ 0-III) nebo ploché (typ 0-II). Ploché léze mohou být ve srovnání s okolní sliznicí lehce vyvýšené (typ 0-IIa), zcela ploché (typ 0-IIb) nebo lehce snížené (typ 0-IIc). Jelikož v kolon, na rozdíl od jícnu a žaludku, nejsou neoplazie téměř nikdy v úrovni okolní sliznice a snížené léze jsou velmi vzácné, je pojem plochá léze (PL) často užíván volněji k označení lehce vyvýšených plochých lézí (typ 0-IIa). Představují téměř 50 % všech povrchových lézí. Jejich výška je nižší než poloměr, nedosahují výšky zavřených bioptických kleští (2,5 mm) a při histologickém vyšetření jsou nižší, než je dvojnásobek výšky okolní sliznice. Ploché léze v kolorektu dělíme dále podle velikosti. Je-li jejich průměr roven nebo větší než 10 mm, označují se je jako „laterally spreading type“ (LST). Je-li povrch LST hladký, jedná se o negranulární typ (LST-NG). Pokud je léze hrbolatá, jedná se o typ granulární (LST-G). Významné je odlišení lehce snížených lézí ( typ 0-IIc), protože často obsahují pokročilou neoplazii. Představují však jen 2–4 % všech PL [5]. Endoskopická klasifikace povrchových kolorektálních neoplazií je významná zejména proto, že umožňuje odhadnout riziko submukózní invaze – tzv. endoskopický staging.
Kolorektální karcinomy vznikají ve sliznici a postupně prorůstají střevní stěnou do okolních struktur a infiltrují lymfatické a krevní cévy. Nejdůležitějším prognostickým faktorem při hodnocení kolorektální neoplázie je hloubka nádorové invaze v době diagnózy, označovaná jako stadium (stage). K jeho posouzení se používá Dukesova klasifikace, jejíž původní verzi modifikovali v roce 1954 Astler a Coller [6]. Stala se základem pro klasifikaci TNM.
Povrchové neoplastické léze patří podle definice do stadia Tis nebo T1. Endoskopická terapie PL si vyžádala upřesnění TNM klasifikace. Mikroskopicky lze v rámci stadia Tis rozlišovat stadium m1 – intraepiteliální neoplazie, m2 – invaze do lamina propria, m3 – invaze do lamina muscularis mucosae a ve stadiu T1 stupně sm1 – 3 pro prorůstání karcinomu do horní, střední a bazální třetiny submukózy.
Riziko lymfatických metastáz je v případě slizniční neoplazie v kolorektu 0 %, při postižení submukózy se zvyšuje na 3–18 % [7]. Při invazi do sm1 je riziko metastáz do lymfatických uzlin menší než 1 %, při invazi do sm2 činí 6 % a při invazi sm3 je 18 %. Stěžejním diagnostickým úkonem před endoskopickou terapií je tedy co nejpřesnější odlišení stadií T1m/sm1, vhodných k endoskopické léčbě a T1sm2,3 vhodných k léčbě chirurgické.
Kromě hloubky invaze je významný stupeň diferenciace a posouzení invaze karcinomu do lymfatických a krevních cév. V případě PL poskytuje nejpřesnější staging mikroskopické vyšetření resekátu sliznice získaného při endoskopické slizniční resekci (EMR) nebo endoskopické submukózní disekci (ESD) zkušeným histopatologem. Důraz je kladen na resekci en bloc s následnou orientací resekátu sliznice na korkové podložce.
Histologické hodnocení PL nebylo do nedávné minulosti jednotné [8, 9]. V současné době je doporučována tzv. revidovaná vídeňská klasifikace [10]. Hlavním přínosem je zahrnutí pojmů HGD a intramukózní karcinom do společné skupiny 4.
Ploché nádorové léze střevní se odstraňují metodou endoskopické resekce (ER). ER znamená snesení části stěny trávicí trubice, obsahující sliznici a část nebo celou vrstvu submukózy. Tato metoda se používá ve dvou základních modifikacích. Při endoskopické slizniční resekci (EMR) je řez submukózou proveden mucosektomickou kličkou. V případě endoskopické submukózní disekce (ESD) se řeže speciálně upraveným diatermickým nožem. K ER jsou indikovány ploché neoplazie, u kterých je riziko metastázování do lymfatických uzlin nižší, než riziko chirurgického výkonu. Prakticky jsou to léze intramukózní s případným nádorovým postižením horní třetiny sumukózy, tj. do hloubky 1 000 um měřeno od úrovně lamina muscularis mucosae.
Metoda EMR zahrnuje následující kroky: 1. Chromodiagnostika, 2. Označení okraje, 3. Submukózní injekce, 4. Snesení léze, 5. Vybavení a fixace , 6. Ošetření spodiny.
Ad 1: Chromodiagnostikou se rozumí aplikace barviva na slizniční povrch za účelem zvýšení rozlišení. V kolon je nejčastěji používán 0,2–0,5% roztok indigokarmínu. Před ER je chromodiagnostika důležitá především pro přesné ohraniční patologické léze a dále k posouzení tvaru ústí slizničních kryp na povrchu léze, tzv. pit pattern. Pomocí pit pattern diagnostiky lze odhadnout hloubku invaze.
Ad 2: Okraj léze se označuje asi 2 mm od okraje na intaktní sliznici koagulačními body jehlovým nožem či řezacím drátem ztažené polypektomické kličky. Označení je důležité, protože vzhled léze se může v průběhu submukózní injece změnit a okraj nemusí být dobře patrný (Obr. 1).
Obr. 1. Plochá léze typu 0IIa+IIc rozměrů 30x20 mm v kolon ascendens. Chromodiagnostika 0,2% roztokem indigokarmínu a označení okraje kogulačními body Pic. 1. Flat neoplastic lesion type 0IIa+IIc, size 30x20mm in the ascending colon. Chromodiagnosis with 0.2% indigocarmine solution and marking of the border with coagulation spots 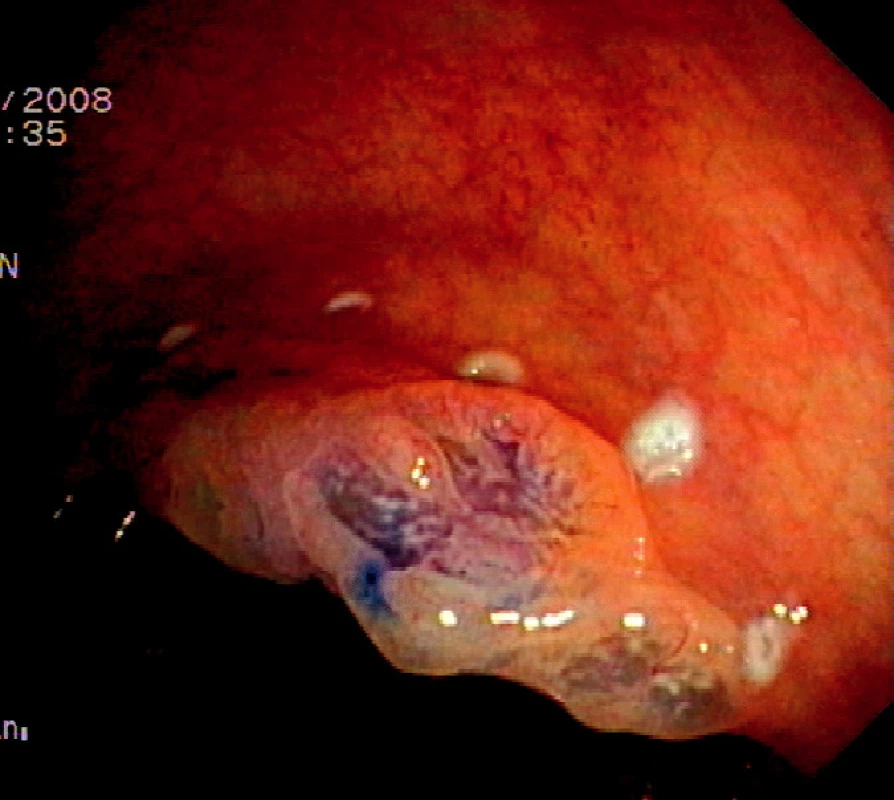
Ad 3: K submukózní injekci se používá nejčastěji fyziologický roztok s adrenalinem v ředění 10 000 : 1. Roztok aplikujeme běžným injekčním katétrem s délkou jehly 4–5 mm. Pokud není léze fixována hlubokou submukózní invazí, dochází k jejímu vyzdvižení submukózním depem roztoku. Vytvořený pseudopolyp se snese kličkou nebo diatermickým nožem (Obr. 2).
Obr. 2. Submukózní injekce 10 ml fyziologického roztoku s adrenalinem Pic. 2. Submucosal injection of 10 cc of saline-epinephrin solution 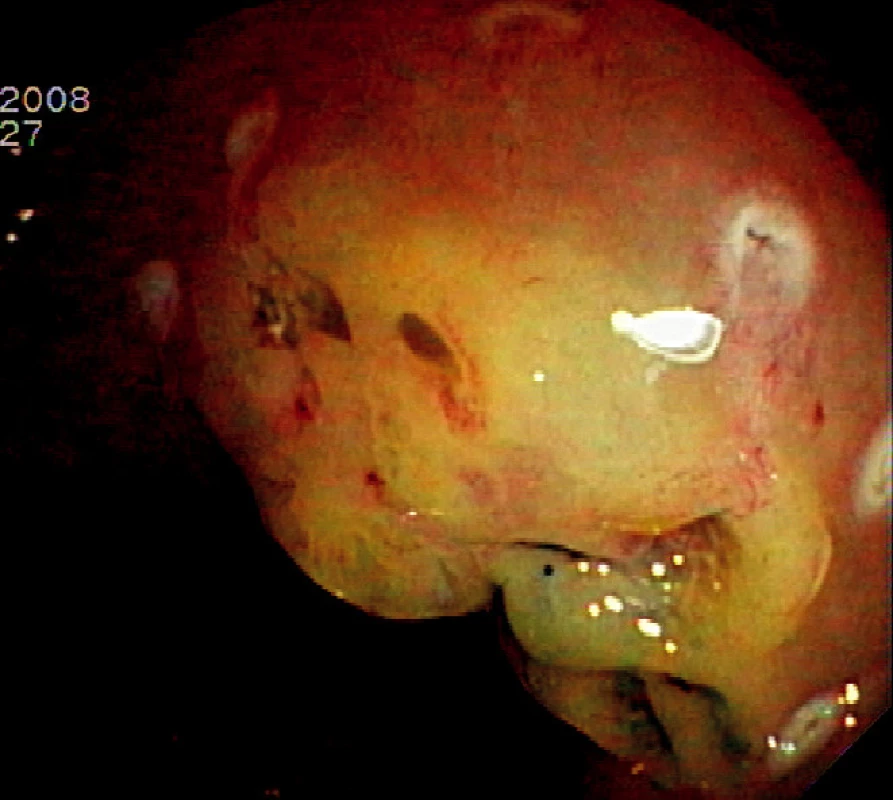
Ad 4: Léze o průměru do 20–30 mm se odstraňuje mukosektomickou kličkou. Léze většího rozsahu lze odstranit po částech. To však ztěžuje následné histopatologické vyšetření. Proto byla vyvinuta metoda ESD, kdy po cirkulární incizi pomocí diatermického nože se disekuje submukóza pod zrakovou kontrolou (Obr. 3, 6, 7).
Obr. 3. Spodina po endoskopické slizniční resekci Pic. 3. The base after endoscopic mucosal resection 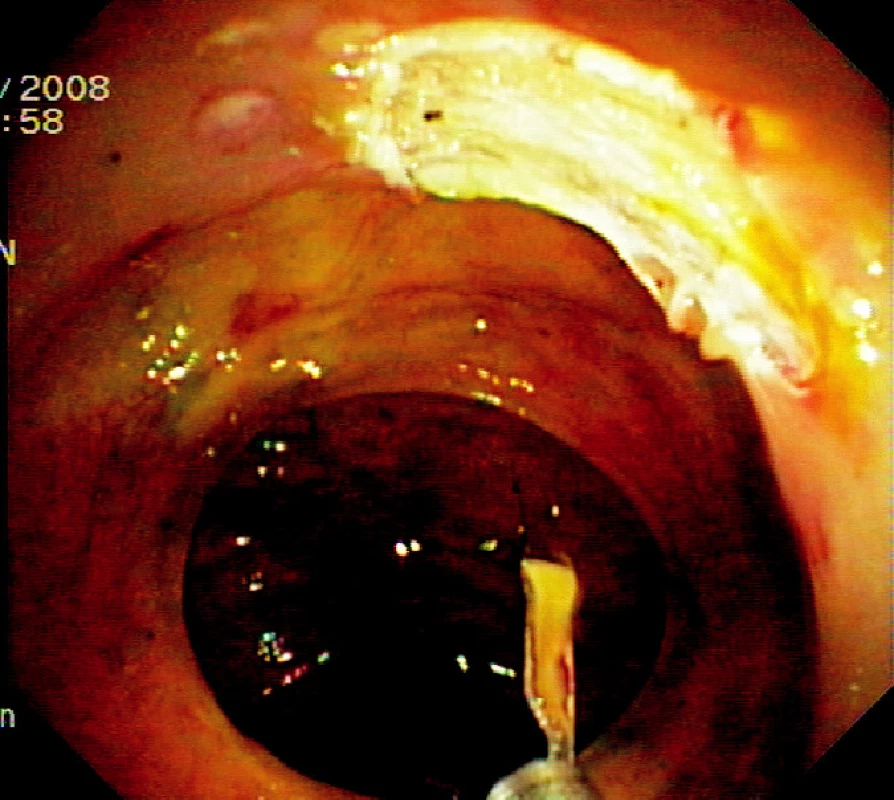
Obr. 4. Endoscopická submukózní disekce: Řez diatermickým nožem Pic. 6. Endoscopic submucosal dissection: The cut with diathermic knife 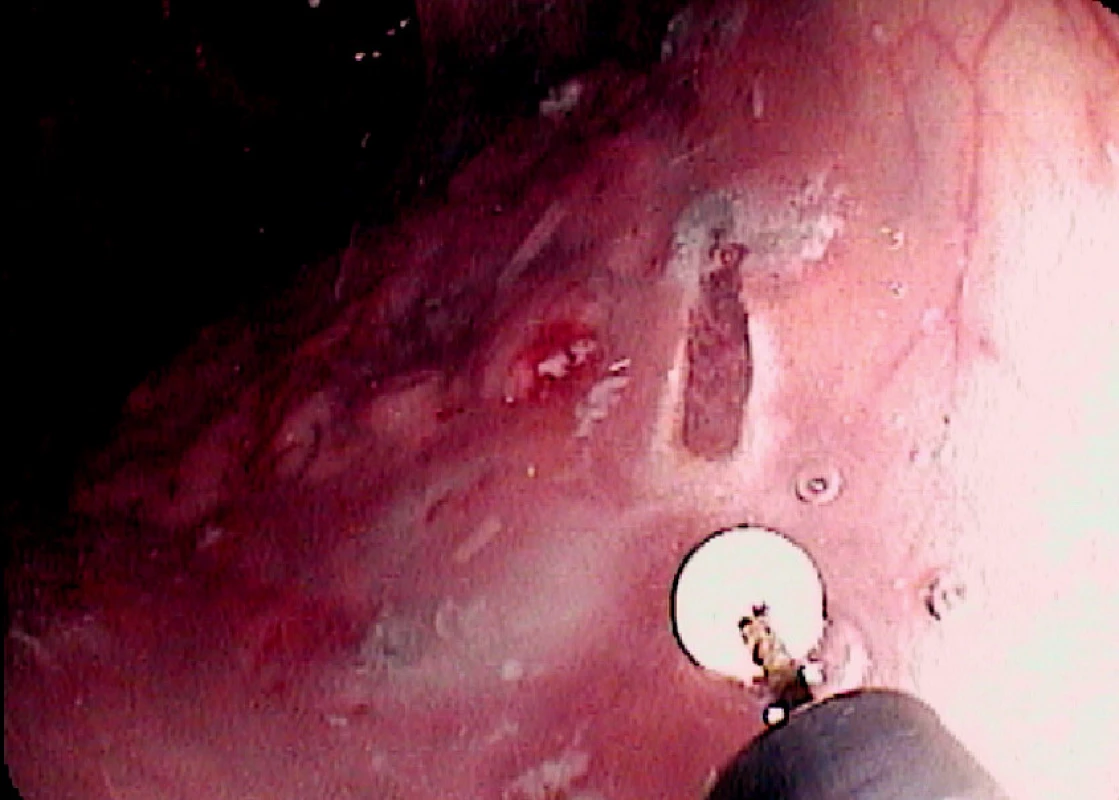
Obr. 5. Spodina po ESD Pic. 7. The base after ESD 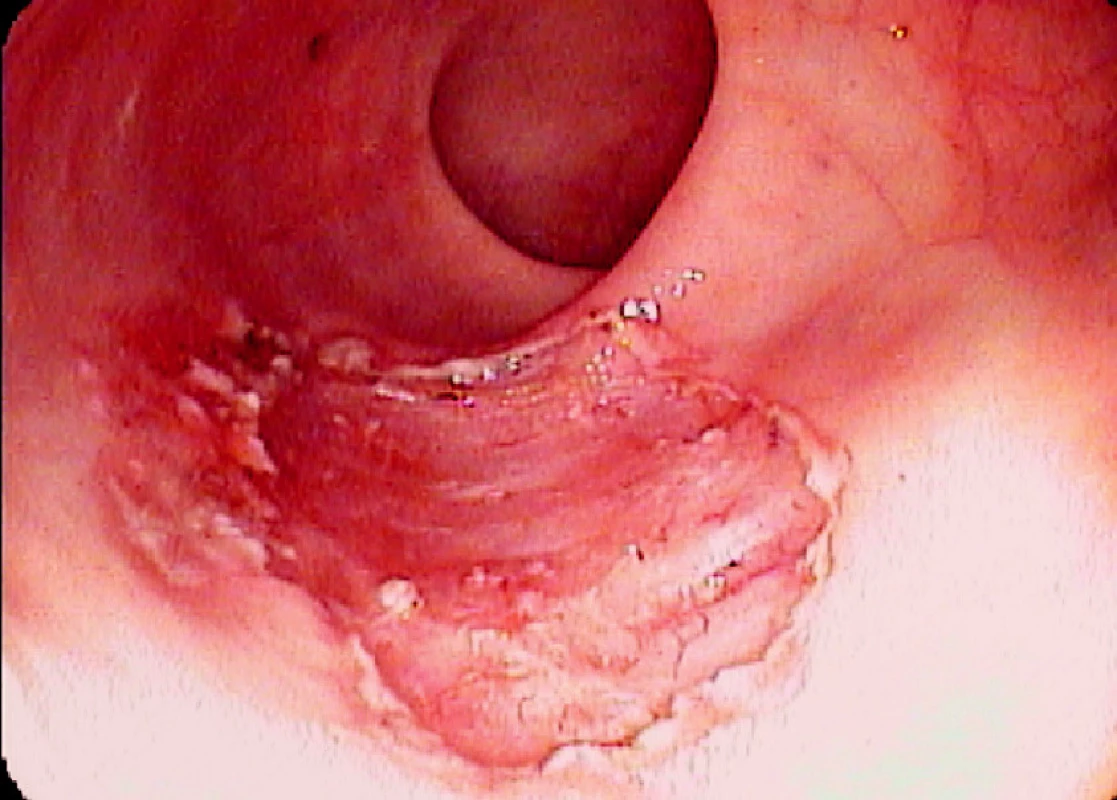
Ad 5: Snesená léze se fixuje na korkové podložce řeznou plochou dolů (Obr. 5, 8).
Obr. 6. Fixace resekátu na korkové podložce (histologicky „serrated adenoma“) Pic. 5. Resected specimen fixed on a corc board 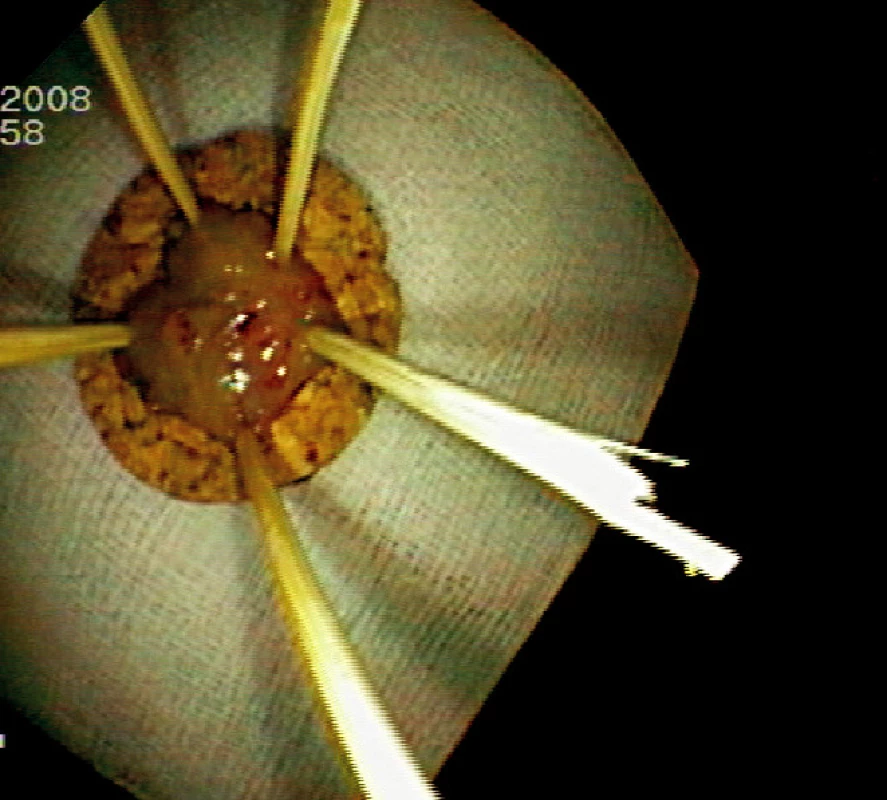
Obr. 7. Resekát fixovaný na korkové podložce (histologicky HGD adenom) Pic. 8. Resected specimen fixed on a corc board (HGD adenoma) 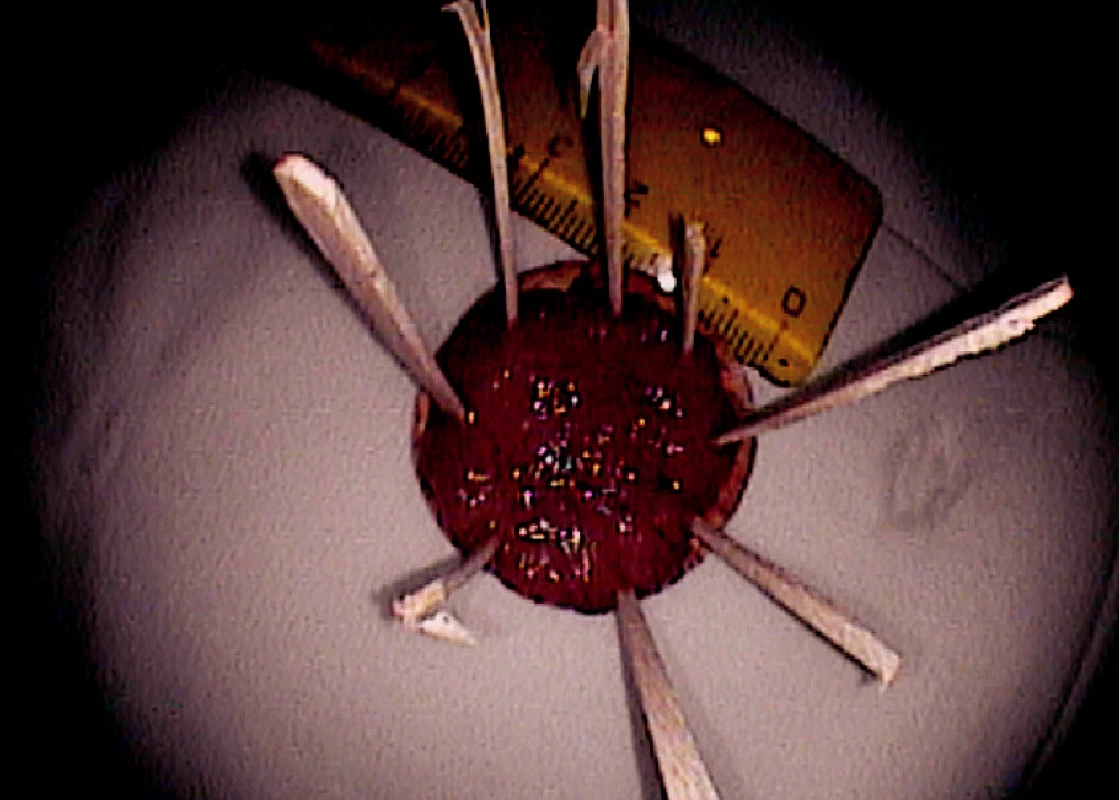
Ad 6: Spodinu po ER je třeba ošetřit v případě krvácení některou z metod endoskopické hemostázy (injekce roztoku adrenalinu, „hot biopsy“ kleště, klipy). Případná mikroperforace se ošetří endoklipy. Klipování se často používá k uzavření slizničního defektu po EMR v levém kolon a céku (Obr. 4).
Obr. 8. Ošetření spodiny 4 endoklipy a vybavení resekátu tripodem Pic. 4. The resection base closed by four endoclips and recovery of the specimen using tripod catheter 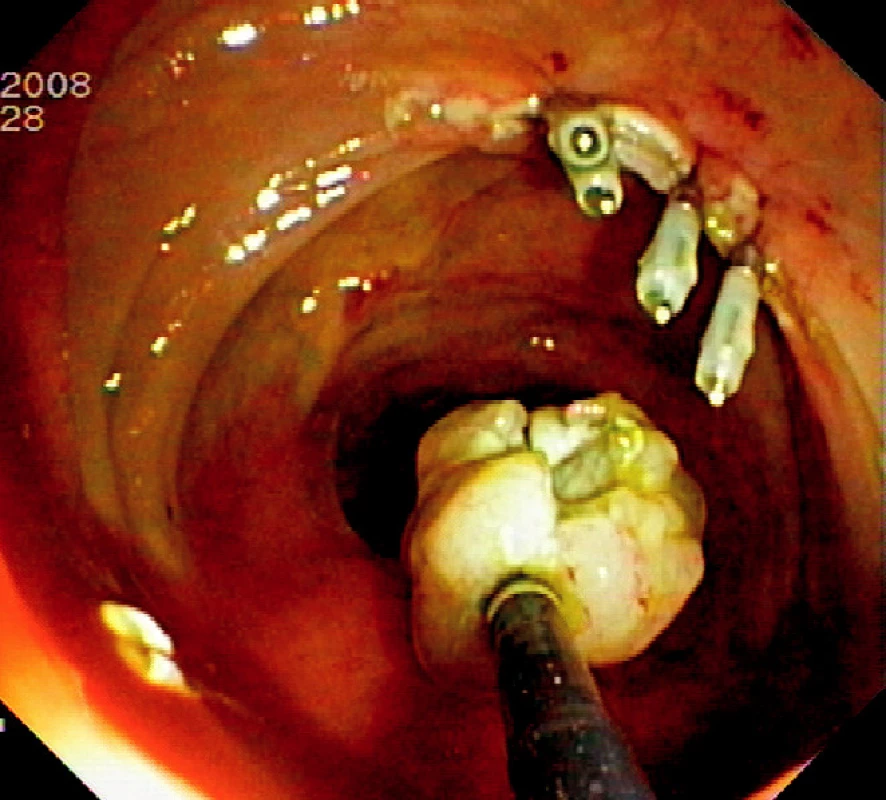
ZÁVĚR
Endoskopická resekce je moderní endoskopická metoda, která se úspěšně zavádí také na některých pracovištích v Česku [11, 12]. Při jejím provádění je nutno počítat s rizikem komplikací, zejména krvácením a perforací trávicí trubice. Proto patří do dobře personálně a technologicky vybavených endoskopických center s dobrou spoluprácí gastroenterologů a chirurgů.
MUDr. O. Urban, Ph.D.
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s.
Zalužanského 1192/15
703 84 Ostrava-Vítkovice
e-mail: ondrej.urban@nemvitkovice.cz
Zdroje
1. Kozuka, S., Nogaki, M., Oteku, T., et al. Premalignancy of mucosal polyp in the large intestine.II. Estimation of the periods required for malignant transformation of mucosal polyps. Dis. Colon Rectum, 1975, 18, s. 494–489.
2. Mentzel, M. De excrentiis verracosocristasis. Acta Med. Berlin, 1721, 9, s. 78.
3. Muto, T., Kamiya, J., Sawada, T. et al. Small „flat adenoma“ of the large bowel with special reference to its clinicopathologic features. Dis. Colon Rektum, 1985, 28, s. 847–851.
4. The Paris Endoscopic Classification of Superficial Neoplastic Lesions: Esophagus, Stomach, and Colon. Gastrointest. Endosc., 2003, 6, Suppl., s. S1–S23.
5. Okuno, T., Sano, Y., Ohkura, Y., Kudo, S. Incidence of and clinicopathological characteristics of depressed type lesions:baseline findings of multicenter retrospective cohort study (abstract). Early Colorectal cancer, 2004, 8, s. 21–27.
6. Astler, V. B., Coller, F. A. The prognostic significance of direct extesions of carcinoma of the colon and rektum. Ann. Surg., 1954, 139, s. 846–851.
7. Yokoyama, J., Aijoka, Y., Watanabe, H., Asakura, H. Lymph node metastasis and micrometastasis of submucosal invasive colorectal carcinoma: an indicator of the curative potential of endoscopic treatment. Acta Medica Biologica, 2002, 5, s. 1–8.
8. Schlemper, R. J., Kato, Z., Stolte, M. Review of histological classifications of gatrointestinal epithelial neoplasia: differences of diagnosis of early carcinomas between Japanese and Western pathologists. J. Gastroentero., 2001, 36, s. 445–456.
9. Schlemper, R. J., Riddell, R. H., Kato, Y., et al. The Vienna classification of gastrointestinal neoplasia. Gut, 2000, 47, s. 251–255.
10. Dixon, M. F. Gastrointestinal epithelial neoplasia: Vienna revisited. Gut, 2002, 51, s. 130–131.
11. Urban, O., Vítek, P., Fojtík, P., Chalupa, J. Endoskopická diagnostika a léčba povrchových nepolypózních neoplázií trávicí trubice. Folia Gastroenterol Hepatol., 2004, 2(4), s. 165–173.
12. Urban O., Vítek P., Fojtík P., Kliment M. Laterally spreading tumors – experience based on 138 consecutive cases. Hepato-gastroenterology, 2008, 1, s. 350–355.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Koloproktologie
- 100 let operace podle Milese – W. Ernest Miles 1869–1947
- Populační screening kolorektálního karcinomu v České republice
- Epidemiologie a léčba kolorektálního karcinomu v českých populačních datech
- Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
- Complications after Colorectal Surgery
- Endoskopická diagnostika a léčba plochých nádorových lézí střevních
- Uzávěr defektu perinea po abdominoperineální resekci rekta pomocí Vertical Rectus Abdominis Flap
- Lymfom rekta – diagnóza k operaci?
- Sexuální dysfunkce u mužů po operacích kolorektálního karcinomu. Novinky v prevenci a terapii
- Výskyt a prognostický význam extranodálních nádorových depozit v mezorektu u pacientů s karcinomem rekta po neoadjuvantní terapii
- Antibiotická profylaxe v kolorektální chirurgii
- Enterální píštěl jako pooperační komplikace – kazuistika
- Využití lokálních hemostyptik při jaterních resekcích
- MUDr. Jiří Smutný, životní jubileum
- Zemřel Prof. MUDr. Hvězdoslav Stefan, CSc.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Endoskopická diagnostika a léčba plochých nádorových lézí střevních
- Chemoterapie a biologická léčba v komplexní léčbě karcinomu tlustého střeva a konečníku. Kdy, proč, jak?
- Antibiotická profylaxe v kolorektální chirurgii
- Enterální píštěl jako pooperační komplikace – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



