-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBioanalytické studium nádorových markerů karcinomu prostaty na úrovni RNA a proteinu
Bioanalytical study of tumour markers for prostate carcinoma at RNA and protein level
Current methods for diagnosis of prostate carcinoma do not enable us to distinguish aggressive tumours (significant tumours) from clinically latent tumours (non-significant tumours). This study aims to determine levels of potential clinically important tumour markers such as
- alpha-methyl CoA-racemase (AMACR),
- caveolin-1,
- metallothionein (MT),
- p53,
- NF-κB,
- c-FOS,
- c-JUN,
- Ki-67,
- prostate-specific antigen (PSA),
- ZIP1 and ZnT-1 in prostatic tissue represented by 22Rv1 (tumour) and PNT1A (healthy) cell lines and in blood serum of patients with histologically evaluated adenocarcinoma (82 tumour patients and 51 healthy volunteers).
In serum, the level of MT was significantly enhanced above 1 μM. Caveolin-1 levels were significantly increased in high-grade tumours, which points to the possibility of using this protein as a marker for the aggressive form of prostate carcinoma.Key words:
tumour diseases, polymerase chain reaction, electrochemistry, immunodetection, molecularly-biological techniques, tumour markers.
Autoři: J. Gumulec 1; M. Masařík 1; S. Křížková 2; P. Babula 2; R. Hrabec 3; A. Rovný 3; M. Masaříková 2; V. Adam 2; T. Eckschlager 4; R. Kizek 2
Působiště autorů: Masarykova univerzita Brno, Lékařská fakulta Ústav patologické fyziologie Přednostka: prof. MUDr. Anna Vašků, CSc. 1; Mendelova univerzita v Brně, Agronomická fakulta Ústav chemie a biochemie Vedoucí: doc. RNDr. Petr Hrdlička, CSc. 2; Fakultní nemocnice u sv. Anny v Brně Urologické oddělení Primář: MUDr. Arne Rovný 3; 2. Lékařská fakulta Univerzita Karlova a Fakultní nemocnice Motol, Praha Klinika dětské hematologie a onkologie Přednosta: prof. MUDr. Jan Starý, DrSc. 4
Vyšlo v časopise: Prakt. Lék. 2011; 91(8): 471-476
Kategorie: Z různých oborů
Souhrn
Současné možnosti diagnostiky karcinomu prostaty neumožňují odlišit agresivní (signifikantní tumory) od klinicky latentních (nesignifikantních forem). Práce se zaměřuje na stanovení hladiny klinicky využitelných tumorových markerů karcinomu prostaty:
- alfa-metyl CoA-racemáza (AMACR),
- caveolin-1,
- metalothionein (MT),
- p53,
- NF-κB,
- c-FOS,
- c-JUN,
- Ki-67,
- prostatický specifický antigen (PSA),
- ZIP1 a ZnT-1 na úrovni prostatické tkáně (reprezentované buněčnými liniemi 22Rv1 a PNT1A) a v séru pacientů s histologicky ověřeným adenokarcinomem (82 karcinomových a 51 kontrolních sér).
V séru je popsáno signifikantní zvýšení metalothioneinu nad hladinu 1 μM. Hladina caveolinu-1 se významně zvyšuje u high-grade tumorů, což jej staví do pozice možného markeru agresivní formy karcinomu prostaty.Klíčová slova:
nádorová onemocnění, polymerázová řetězová reakce, elektrochemie, imunodetekce; molekulárně-biologické techniky, nádorové markery.Úvod
Nádorové markery jsou biomolekuly, upozorňující na aktivně probíhající nádorové onemocnění. Jsou produkovány buď přímo nádorovými buňkami, nebo jsou důsledkem reakce jiných buněk těla na přítomnost neoplastického procesu. Mohou to být
- specifické genové sekvence,
- mutace,
- látky bílkovinné povahy (enzymy, nádorové antigeny, plazmatické proteiny, růstové faktory),
- hormony, a
- produkty metabolických drah specifických pro maligní procesy.
Nádorové markery mohou být detekovány z krve, z moči, přímo z nádorové tkáně, či z jiných biologických materiálů (1, 27, 33, 37, 39). Markery detekované přímo z nádorové tkáně mají využití v hodnocení bioptických vzorků. Těžištěm využití všech nádorových markerů je monitorace v průběhu léčby, anebo detekce po ní s cílem časného záchytu relapsů. Jejich využití ve screeningu je v současnosti velice omezené především pro výrazné ekonomické náklady. Jediným screeningově využitelným markerem je prostatický specifický antigen (PSA), enzym produkovaný buňkami prostaty, poukazující na (nádorové i nenádorové) postižení této tkáně.
Ačkoliv použití tohoto markeru vedlo v posledních dvou desetiletích k výrazné redukci mortality na nádorové onemocnění prostaty (tedy ke splnění hlavního kritéria screeningu), není PSA ideálním diagnostickým nástrojem (6, 20, 35, 38).
Karcinom prostaty, jedno z nejvíce studovaných onkologických onemocnění z důvodu vysoké frekvence v mužské populaci, patří mezi nejčastější příčiny úmrtí na nádorové onemocnění (7–11, 17, 18, 28, 37, 39, 48). Výrazně zvýšené množství odhalených pacientů s tímto onemocněním v posledních desetiletích přímo souvisí se zavedením vyšetření prostatického specifického antigenu (PSA) do běžné klinické praxe (18, 37, 45). Tento marker umožnil identifikovat časná stádia onemocnění, která byla nezjistitelná digitálním rektálním vyšetřením.
Screening PSA přispěl ke snížení mortality o 20 %, jak uvádí studie zaměřená na evropská léčebná zařízení otištěná v prestižním periodiku New England Journal of Medicine (42). Zjištěná redukce mortality je zapříčiněna tím, vyšetření PSA dokáže rozpoznat vyléčitelná stádia T1 a T2 karcinomu prostaty, která nejsou spolehlivě zachytitelné rektálním vyšetřením. U nádorů šířících se mimo prostatu (stádium T3) přestávají být nádory kurabilní a na místě je pouze paliativní přístup. I přes tento zjevný benefit vyšetření PSA má digitální rektální vyšetření stále své místo v diagnostice a nemělo by být opomíjeno ani v ordinaci praktického lékaře (22, 45).
Na druhou stranu je třeba zdůraznit, že přes vysokou incidenci tohoto onemocnění je drtivá většina (až 80 %) nádorů bezpříznaková a jsou často prokázána až při pitvě zemřelých na jinou příčinu či při operačních zákrocích (9, 28). Nádory prostaty je proto vhodné rozdělit do dvou skupin, a to na
- nádory signifikantní, s ohrožením života, a
- nádory nesignifikantní, u nichž je ohrožení života vysoce nepravděpodobné.
Žádná současně používaná diagnostická metoda, tedy ani hladina PSA, digitální rektální vyšetření, transrektální sonografie či biopsie, není schopna odlišit, jedná-li se o agresivní, nebo latentní formu nádoru. Všechny biopticky ověřené karcinomy se proto léčí jako signifikantní život ohrožující formy, tedy radikálně.
Takovýto přístup vede k výraznému snížení kvality života, protože u radikální prostatektomie dochází až u 70 % pacientů k erektilní dysfunkci a u necelých 10 % k inkontinenci (45). Významný podíl pacientů je tedy léčen zbytečně (26). Je proto žádoucí nalézt takové markery karcinomu prostaty, které budou schopny již v iniciálních stádiích bezpečně odlišit agresivní a latentní formy nádoru (8, 25, 28, 32).
Předkládaná práce se zaměřuje na studium změn exprese vybraných genů u buněčných linií a detekci hladin jejich proteinových produktů v séru pacientů trpících karcinomem prostaty a jejich závislosti na klinických datech pacienta. Pro práci byly vybrány následující geny:
- metalothionein,
- caveolin-1,
- Ki-67,
- p53,
- NF-κB,
- alfa-metyl CoA-racemáza,
- c-FOS,
- c-JUN,
- matrixová metaloproteináza 9, a
- zinkové transportéry ZIP-1, ZnT-1.
Jsou to látky, u nichž byla v literatuře popsána změna jejich hladiny ve vzorcích buněčných linií, či v jiném biologickém materiálu, či se změna jejich hladiny očekává v důsledku postižení určitých signálních drah.
Cílem práce je popsat hladiny genů na úrovni RNA a proteinu v nádorové tkáni a v séru pacientů.
Úroveň nádorové tkáně je v této práci nahrazena modelem buněčných linií odvozených od prostatické tkáně.
Metalothioneiny a nádory prostaty
Metalothioneiny jsou skupinou proteinů o molekulární hmotnosti 6–10 kDa s vysokým obsahem cysteinu (12, 30, 31, 33). Přítomnost –SH skupinu obsahujících aminokyselin přímo souvisí se schopností těchto proteinů vázat řadu kovů (2–7, 15, 16, 23). Metalothioneiny proto hrají klíčovou roli v transportu iontů kovů, jejich detoxikaci a v ochraně buněk před oxidativním stresem (12, 24). Funkce těchto proteinů zasahují také do regulace apoptózy, kdy zvýšené hladiny metalothioneinu mají antiapoptické působení. Metalothioneiny dále regulují hladinu, aktivitu a buněčnou lokalizaci transkripčního faktoru NF-κB, který aktivuje antiapoptické geny Bcl-2, c-myc a TRAF-1, které patří do rodiny protoonkogenů.
Tato antiapoptická kaskáda může být využita jako protektivní mechanismus buněk karcinomu prostaty při jejich patologické proliferaci proti apoptickým signálům (15).
Alfa-metyl CoA-racemáza (AMACR) a vztah k prostatické tkáni
Alfa-metyl CoA-racemáza (AMACR) je peroxizomální a mitochondriální enzym účastnící se β-oxidace větvených mastných kyselin, katabolismu metabolitů žlučových kyselin a metabolismu ibuprofenu.
Zvýšení hladin tohoto proteinu je popsáno u většiny adenokarcinomů prostaty a u prostatické intraepiteliální neoplázie vysokého stupně. Nízké hladiny tohoto markeru jsou popsány u benigní hyperplazie a u atypické adenomatózní hyperplazie (14, 28, 32).
Další diagnosticky významné proteiny u karcinomu prostaty
Caveolin-1 (Cav-1) je membránový protein a významná strukturální složka kaveolů. Skupina těchto proteinů hraje důležitou roli v odbourávání cholesterolu, ale také se výrazně podílí na transmembránové signalizaci molekul. V posledních letech byl popsán vliv Cav-1 na progresi nádorových onemocnění a zvýšení jeho sérových hladin specificky u karcinomu prostaty (28).
U androgen-nezávislých forem nádorů prostaty je popsána role komplexu protoonkogenů c-Fos a c-Jun, které aktivují nezávisle na přítomnosti androgenů geny regulované androgeny a mimoto c-Jun samostatně funguje jako kofaktor androgenního receptoru (13).
Tumor-supresorový protein p53 ovlivňuje proliferaci a opravu DNA, apoptózu a odezvu buněk na růstové faktory. U karcinomů prostaty je často mutován (27).
U karcinomu prostaty je důsledkem odchylného metabolismu metalothioneinu zinečnatých iontů a zinkových transportérů očekávaná změna exprese signálních drah ovlivňujících přežívání buněk (12, 15, 19, 23). Hladina zinečnatých iontů je u karcinomu snížena zejména v důsledku snížení hladiny zinkového transportéru ZIP-1. Na tomto se podílí kaskáda RAS-RAF-MEK-ERK-RREB-1 (39, 47), exprimovaná typicky u špatně diferencovaných forem s invazivním růstem a s tendencí metastazovat (21, 48).
Buněčné kultury odvozené od nádorů prostaty
Procesy probíhající v buňkách karcinomu prostaty byly zkoumány zejména na buněčných liniích
- LNCaP (androgen-senzitivní),
- PC-3 (androgen-rezistentní), a
- DU 145 (androgen-rezistentní).
Tyto linie nejsou ideálním modelem a mohou se od in vivo stavu výrazně lišit, protože jsou odvozeny z metastatického rozsevu v kostech (PC-3), mozku (DU 145) a lymfatických uzlinách a nikoli z primárního ložiska.
Buněčná linie 22Rv1 reprezentuje primární prostatický špatně diferencovaný adenokarcinom o Gleason skóre 9. Linie exprimuje androgenní receptor (AR) a syntetizuje vysoké hladiny PSA (44). Linie 22Rv1 je vhodnějším modelem prostatického karcinomu také proto, že vykazuje oproti ostatním liniím výrazně nižší stupeň genové variability a nižší stupeň aneuploidie – karyotyp 50 XY (trizomie 7, 8, 12) – DNA index 1,30 (vedle toho PC-3 1,84 a LNCaP 2,09) (43).
Materiál a metody
V prvních fázích experimentu bylo pracováno s buněčnými liniemi. U nich byla stanovena nejširší skupina sledovaných látek na úrovni RNA. Dle výsledků exprese u buněčných linií byly vybrané látky stanoveny také na úrovni proteinu. U látek, u nichž se očekává, či u nichž bylo popsáno zvýšení jejich hladin v séru (jedná se tedy o „plazmatické markery“), byla detekce provedena na vzorcích s histologicky ověřeným nádorem.
Buněčné linie, séra
V naší studii byly použity dvě buněčné linie:
- kontrolní, PNT1A, lidská buněčná linie získaná imortalizací normálních prostatických epiteliálních buněk 35letého muže post mortem, a
- 22Rv1, linie odvozená z xenograftu pasážovaného na kastrovaných myších.
Tyto buněčné linie byly zakoupeny u HPA Culture Collections (Salisbury, UK). Proteiny z těchto linií a z testovaných vzorků krevních sér pacientů byly izolovány pomocí RIPA pufru mechanickou homogenizací, nebo tepelnou denaturací (99 °C) získaného materiálu.
Soubor pacientů s diagnostikovaným karcinomem prostaty
Ve studii byla použita séra pacientů s histologicky ověřeným adenokarcinomem prostaty (82 vzorků). Věk pacientů se pohyboval v rozpětí 40 až 78 let s průměrem 63 let. Jednalo se o dobře až špatně diferencované tumory s Gleasonovým skóre v rozmezí 5 až 10. Patologický staging vzorků se pohyboval v rozmezí 1c až 4, všichni pacienti byli bez postižení lymfatických uzlin a bez vzdálených metastáz.
V souboru bylo 80 % nekuřáků, 12 % kuřáků a 8 % ex-kuřáků.
Co se přidružených onemocnění týče, 40 % pacientů bylo bez komorbidit, 37 % pacientů mělo jednu komorbiditu, 17 % pacientů mělo 2 a zbylých 6 % mělo 3 a více komorbidit.
Dále 24 % pacientů mělo diagnostikovánu hyperlipoproteinémii, 47 % pacientů hypertenzi, 7 % pacientů ischemickou chorobu srdeční, 7 % diabetes mellitus 2. typu, 2 % ischemickou chorobu dolních končetin, 5 % vředovou chorobu gastroduodena a 1 % pacientů mělo tumor v anamnéze.
V kontrolní skupině bylo 51 testovaných probandů. Věk kontrolní skupiny se pohyboval v rozmezí 18 až 55 let s průměrem 38 let.
Testovaná séra byla získána z Urologické kliniky nemocnice U svaté Anny v Brně. Zařazení pacientů do realizované klinické studie bylo schváleno etickou komisí Lékařské fakulty Masarykovy univerzity a FNUSA.
Polymerázová řetězová reakce
K izolaci RNA z buněčných linií byl použit High pure total RNA isolation kit (Roche, Švýcarsko). Izolovaná RNA byla přepsána do cDNA pomocí Transcriptor first strand cDNA synthesis kit (Roche) dle pokynů výrobce. Real-time PCR byla provedena pomocí systému TaqMan na přístroji 7500 real-time PCR system (Applied Biosystems, USA). Výsledky byly vyhodnoceny v triplikátech komparativní Ct metodou a standardizovány vůči β-aktinu.
Elektrochemická detekce metalothioneinu a imunodetekce caveolinu-1
K detekci hladiny metalothioneinu bylo použito elektrochemické detekce (31, 33). Elektrochemická detekce MT se provádí na přístroji AUTOLAB Analyser v klasickém tříelektrodovém uspořádání pomocí tzv. Brdičkovy reakce. Analyzovaný vzorek je akumulován na povrch pracovní elektrody, kterou je visící rtuťová elektroda. Po akumulaci stanovení probíhá v základním elektrolytu obsahujícím kobaltitou sůl v amonném pufru s pH 9,6 (2, 3, 31).
K detekci caveolinu-1 bylo použito ELISA kitu (USCN Life Science Inc.) Postup ELISA byl proveden dle pokynů výrobce. Výsledek vyjádřený změnou barvy substrátu byl detekován fotometricky při 495 nm.
Gelová elektroforéza
Vzorky byly elektroforeticky separovány na 10% SDS-PAGE gelech, barveny dusičnanem stříbrným (kit BioRad, postup dle výrobce) a souběžně blotovány na nitrocelulózovou membránu a imunodetekovány pomocí specifických protilátek. Pro rychlou orientaci byly používány dot-bloty.
Proti metalothioneinu (izoformě 1a 2) byla použita polyklonální králičí protilátka (Santa Cruz biotechnology, USA), proti AMACR polyklonální králičí protilátka (Clonestar, CZ), proti PSA monoklonální myší protilátka (Santa Cruz Biotechnology, Santa Cruz, USA).
Statistické vyhodnocení
Výsledky byly vyhodnocovány v softwaru Statistica 9. K porovnání hladiny mezi kontrolní a nádorovou skupinou bylo použito t-testů. Korelační matice byly použity k nalezení souvislostí mezi testovanými veličinami.
K orientaci v souboru pacientů byla provedena clusterová analýza (K-means). Hladina významnosti p = 0,05 byla stanovena pro určení signifikantně odlišné hodnoty.
Výsledky
Ze sledovaných biomolekul byla zjištěna změna hladin (ve smyslu zvýšení i snížení) na úrovni mRNA u řady genů, a to:
- Cav1,
- NF-κB,
- FOS,
- JUN,
- p53,
- MT1A,
- Ki67,
- MT2A,
- PSA,
- MMP9,
- AMACR,
- ZnT1,
- ZIP1.
Změna v expresi jednotlivých proteinů není v současnosti aplikovatelná pro běžnou zdravotnickou praxi. Experimentálně ale prokazuje určitou změnu „chování“ nádorové změněné tkáně, která může být v budoucnu pro praktickou medicínu velmi přínosná. Kromě toho změna hladiny na úrovni proteinu (zjištěná na experimentální buněčné linii) může být využita v histochemické analýze (tkáňových markerů) u bioptických vzorků pacientů s nádorovým onemocněním prostaty.
V séru pacientů se zhoubnými nádory prostaty byla sledována hladina caveolinu-1, AMACR a metalothioneinu.
Molekulárně-biologická analýza buněčných linií
Model tkáně karcinomu reprezentuje buněčná linie 22Rv1. V této linii byla stanovena hladina potencionálních markerů tohoto onemocnění na úrovni mRNA a proteinu. Hladina mRNA je vyjádřena jako relativní násobek oproti expresi ve zdravé tkáni. Modelem zdravé tkáně je buněčná linie PNT1A.
Na úrovni mRNA bylo detekováno statisticky významné snížení exprese genů
- Cav-1 (2 % oproti kontrole),
- NF-κB (9 % oproti kontrole),
- c-FOS, (15 % oproti kontole), a
- c-JUN (20 % oproti kontrole).
Významné zvýšení hladiny bylo popsáno u metalothioneinu třídy 1A a 2A:
- MT1A (190 %) a MT2A (240 %),
- PSA (260 %),
- Ki-67 (200 %),
- MMP-9 (370 %),
- AMACR (840 %),
a u zinkových transportérů
- ZIP1 (4 500 %),
- ZnT-1 (2 500 %).
Nebyla popsána statisticky významná změna hladiny protinádorově působícího proteinu p53 (obr. 1A). Na úrovni proteinu bylo nalezeno statisticky významné zvýšení PSA volného (PSA free) i celkového (PSA total) u nádorové buněčné linie, hladina metalothioneinu byla naopak v nádorové linii signifikantně snížena (obr. 1B, C, D).
Obr. 1. Hladina národových markerů u buněčných linií. (A) – hladina mRNA markerů vyjádřená jako relativní násobek exprese nádorové linie (22Rv1) oproti nenádorové linii (PNT1A); (B) – hladina volného PSA (obsah proteinu) v buněčných liniích; (C) – hladina metalothioneinu (obsah proteinu) v buněčných liniích; (D) – hladina celkového PSA v buněčných liniích (obsah proteinu). 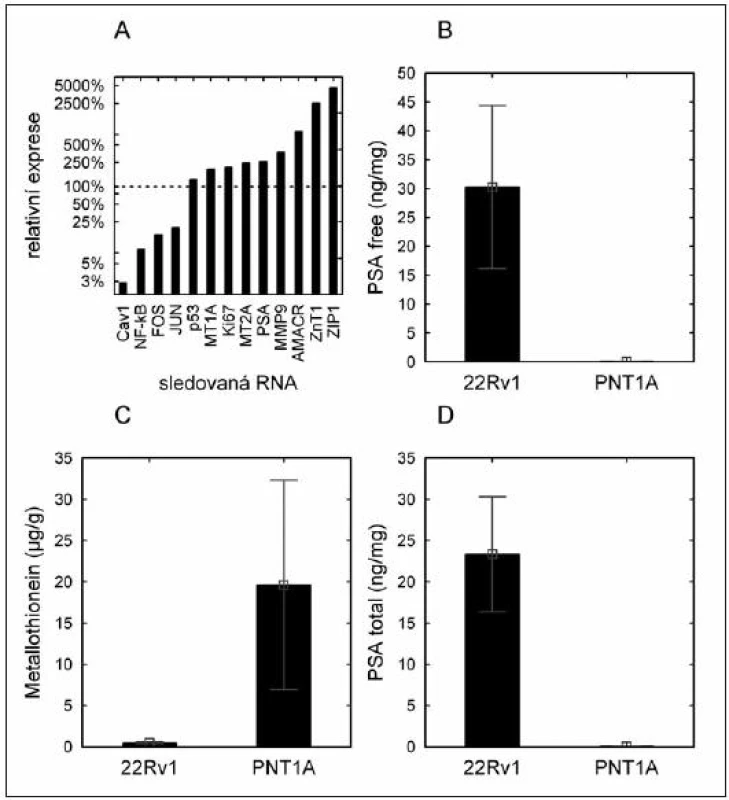
Klinická studie u pacientů s nádorem prostaty
Metalothionein, caveolin-1 a AMACR byly vybrány pro detekci v krevním séru pacientů a dobrovolníků zahrnutých do této studie, protože bylo u těchto proteinů popsáno, že při nádorovém procesu opouštějí prostatickou tkáň a dostávají se tak do séra. Bylo zjištěno statisticky významné zvýšení hladiny metalothioneinu (p < 0,001), přičemž hladina caveolinu-1 a AMACR se mezi kontrolní a nádorovou skupinou signifikantně neměnila (obr. 2A, B).
Obr. 2. Hladina nádorových markerů v séru pacientů. (A) – hladina metalothioneinu; (B) – hladina alfa metyl-Coa-racemázy (AMACR); (C) – hladina Caveolinu-1 v závislosti na stagingu onemocnění; (D) – závislost hladiny caveolinu-1 na hladině celkového PSA; (E) – závislost hladiny AMACR na Gleasonově skóre; (F) – závislost Caveolinu na Gleasonově skóre. 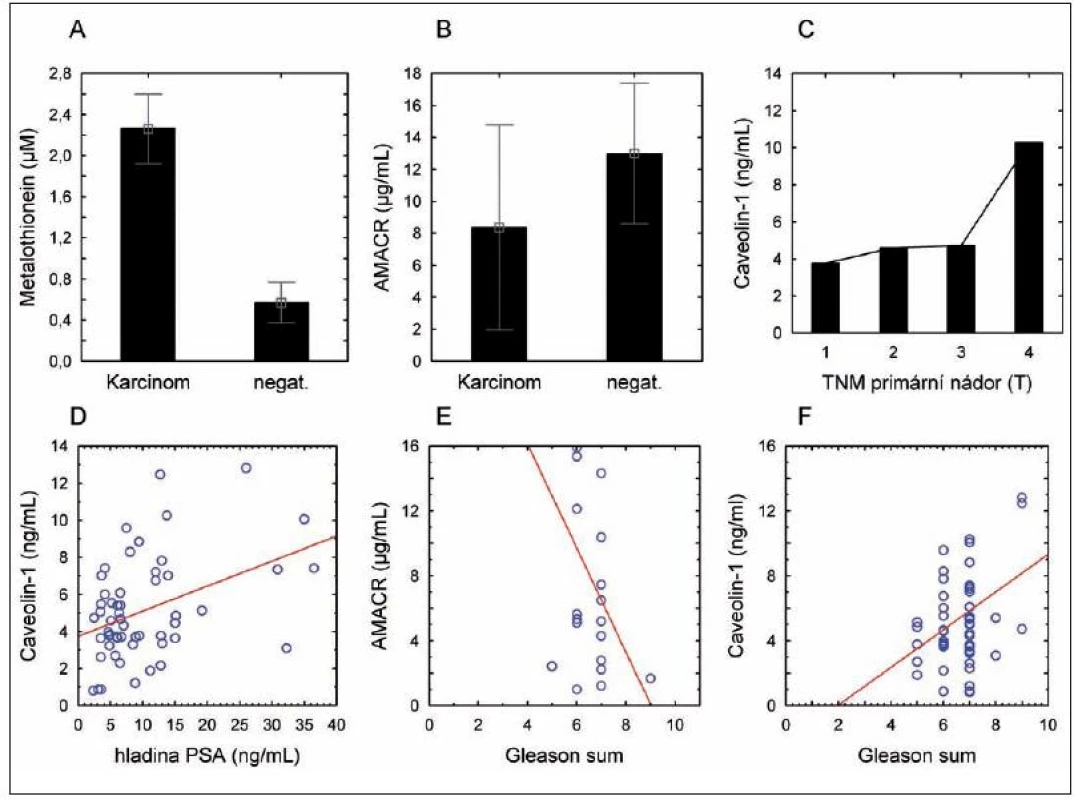
I přes statistickou nevýznamnost odlišností v hladině Cav-1 clusterová analýza odhalila výrazný rozptyl hodnot a rozdělila tak pacienty do dvou skupin a to s vysokým Cav-1 a nízkým Cav-1 (data nezobrazena). Byly proto provedeny korelace s daty získanými z chorobopisů. Díky statistické analýze byly odhaleny slabé závislosti mezi hladinou Cav-1 a PSA (r = 0,41 při p = 0,002) (obr. 2D). Nebyly nalezeny statisticky významné korelace mezi věkem a všemi třemi sledovanými markery.
V závislosti na Gleasonově gradingu onemocnění se hladina AMACR snižuje (hraničně významný jev, r = -0,43 při p = 0,056) (obr. 2E), naopak, hladina Cav-1 se v závislosti na gradingu zvyšuje (r = 0,29 při p = 0,028) (obr. 2F). Metalothionein je na gradingu nádorového onemocnění nezávislý.
Z pohledu hladiny markerů u pacientů s lokalizovaným a šířícím se tumorem nebyly nalezeny statisticky významné rozdíly mezi lokalizovanými (T1, T2) a šířícími se (T3, T4) nádory u všech tří sledovaných markerů (data nezobrazena). Nicméně, sérová hladina Cav-1 byla vyšší u pacientů s nádory T4, nicméně pod hladinou statistické významnosti (obr. 2C).
Hladina žádného ze sledovaných markerů se nemění u pacientů s:
- hypertenzí,
- ischemickou chorobou srdeční a hyperlipoproteinémií,
- ischemickou chorobou dolních končetin, a
- vředovou chorobou gastroduodena.
Obdobně, hladina sledovaných markerů není odlišná ve skupině kuřáků a nekuřáků (data nezobrazena).
Statistická významnost korelace Cav-1 se zvýraznila při následném rozdělení do skupin dle stagingu, komorbidit a gradingu. U dobře diferencovaných tumorů koreluje hladina Cav-1 záporně se stagingem onemocnění, u nízce diferencovaných tumorů koreluje s PSA a gradingem.
U pacientů s komorbiditami hypertenze a hyperlipoproteinémie a u nekuřáků se trend korelace mezi gradingem a věkem zvýrazní. U skupiny kuřáků koreluje hladina Cav-1 s počtem přidružených nemocí.
Diskuse
Metalothionein je u pacientů s nádorovým onemocněním (včetně karcinomu prostaty) výrazně zvýšen (12). To jej staví do pozice možného nádorového markeru tohoto onemocnění (49), minimálně ovlivněného klinickým stavem pacienta, protože jeho vysokou hladinu neovlivňuje kuřáctví, věk, grading onemocnění, ani přítomnost komorbidit častých v populaci. Ze studia na buněčných liniích je patrné, že hladina metalothioneinové exprese na úrovni RNA je vyšší oproti kontrole, a naopak hladina proteinu je v porovnání s kontrolou mírně nížena (32, 33). To nasvědčuje tomu, že metalothionein je u pacientů s karcinomem exprimován ve větší míře (proto vyšší RNA) a následně je aktivně transportován do extracelulárního prostoru prozatím neznámými mechanismy. Z tohoto důvodu je hladina metalothioneinu v cytoplasmě buněk nižší. Vzhledem k jeho vztahu k zinečnatým iontům, jejichž metabolismus je u karcinomu prostaty patologický, je možné očekávat, že se metalothionein může podílet na patogenezi onemocnění (7, 19).
Ač hladina caveolinu-1 nebyla rozdílná mezi skupinou nádorovou a nenádorovou, byla nalezena jeho vyšší sérová hladina u pacientů s postižením okolních tkání a orgánů (TNM stádium T4) oproti stádiím nižším. Hladina tohoto markeru se zvyšuje v závislosti na gradingu onemocnění. Podobně jako u metalothioneinu, hladina caveolinu-1 není ovlivněna přítomností komorbidit ani kouřením a není závislá na věku. Taktéž hladina alfa-metyl CoA-racemázy nebyla rozdílná mezi pacienty a kontrolou. Oproti výše zmíněným markerům se hladina AMACR snižuje v závislosti na gradingu onemocnění.
Žádná ze zde sledovaných látek nesplňuje kritéria markeru agresivní formy onemocnění. Toto tvrzení stojí na předpokladu, že většina tumorů prostaty je latentní a pomalu rostoucí (tedy o stádiu T1 a T2) a pouze malá část se chová agresivně (dosáhne tedy stádia T3 a T4). Mezi těmito dvěma skupinami nebyl popsán statisticky významný rozdíl v hladině sledovaných proteinů. Nicméně, hladina caveolinu-1 je v séru pacientů s tumorem ve stádiu 4 výrazně vyšší a taktéž jeho hladina se zvyšuje s gradingem. Hladinu tohoto markeru je proto žádoucí ověřit na větším souboru pacientů s agresivní formou tumoru.
Metalothionein, byť nesplňuje kritéria pro marker agresivní formy onemocnění, je jako jediný v této studii výrazně zvýšen v séru pacientů s tumory prostaty. Jako jediný ze sledovaných tak může být využit jako doplněk ke screeningu PSA. Nicméně, jeho další využití v klinické medicíně je třeba ověřit na větším souboru dat získaných od pacientů s tímto nádorovým onemocněním.
Poděkování
Práce byla podpořena granty GACR 301/09/P436: Analýza metalothioneinu u karcinomu prostaty na úrovni DNA, RNA a proteinu, IGA MZ 10200-3: Nádorové markery, jejich stanovení a korelace s karcinomem prostaty a Liga proti rakovině Praha LPR2010: Sarkosin, a-methyl-CoA racemáza, prostatický specifický antigen a metalothionein jako nádorové markery u karcinomu prostaty, studie na nádorových buněčných liniích.
J.G. prezentoval výsledky této práce na Studentské vědecké soutěži, kde získal první místo.
doc. Ing. René Kizek, PhD.
Ústav chemie a biochemie
Mendelova univerzita v Brně
Zemědělská 1
613 00 Brno
E-mail: kizek@sci.muni.cz
Zdroje
1. Abate-Shen, C., Shen, M.M. Molecular genetics of prostate cancer. Genes Dev. 2000, 14(19), p. 2410-2434.
2. Adam, V., Baloun, J., Fabrik, I. et al. An electrochemical detection of metallothioneins at the zeptomole level in nanolitre volumes. Sensors 2008, 8(4), p. 2293-2305.
3. Adam, V., Blastik, O., Krizkova, S. et al. Application of the Brdicka reaction in determination of metallothionein in patients with tumours. Chem. Listy 2008, 102(1), p. 51-58.
4. Adam, V., Fabrik, I., Eckschlager, T. et al. Vertebrate metallothioneins as target molecules for analytical techniques. Trends Anal. Chem. 2010, 29(5), p. 409-418.
5. Adam, V., Petrlova, J., Wang, J. et al. Zeptomole electrochemical detection of metallothioneins. PLoS One, 2010, 5(7): e11441. doi:10.1371/journal.pone.0011441.
6. Azzazy, H.M.E., Mansour, M.M.H., Kazmierczak, S.C. Nanodiagnostics: A new frontier for clinical laboratory medicine. Clin. Chem. 2006, (52(7), p. 1238-1246.
7. Babula, P., Kohoutkova, V., Opatrilova, R. et al. Pharmaceutical importance of zinc and metallothionein in cell signalling. Chimica Oggi-Chemistry Today, 2010, 28(6), p. 18-21.
8. Bartek, J., Hamerlik, P., Lukas, J. On the origin of prostate fusion oncogenes. Nature Genet., 2010, 42(8), p. 647-648.
9. de Wit, R., Sternberg, C.N. Cancers of the Genitourinary Tract. In Cavalli, F. et al. Textbook of medical oncology. London: Informa Healthcare, 2009.
10. Dusek, L., Abrahamova, J., Lakomy, R. et al. Multivariate analysis of risk factors for testicular cancer: A hospital-based case-control study in the Czech Republic. Neoplasma, 2008, 55(4), p. 356-368.
11. Dušek, L., Mužík, J., Gelnarová, E., et al. Incidence a mortalita nádorových onemocnění v České republice. Klin. Onkol. 2010, 23(5), s. 311-324.
12. Eckschlager, T., Adam, V., Hrabeta, J. et al. Metallothioneins and cancer. Curr. Protein Pept. Sci. 2009, 10(4), p. 360-375.
13. Edwards, J., Krishna, N.S., Mukherjee, R., Bartlett, J.M.S. The role of c-Jun and c-Fos expression in androgen-independent prostate cancer. J. Pathol. 2004, 204(2), p. 153-158.
14. Evans, A.J. Alpha-Methylacyl CoA racemase (P504S): overview and potential uses in diagnostic pathology as applied to prostate needle biopsies. J. Clin. Pathol. 2003, 56(12), p. 892-897.
15. Fabrik, I., Adam, V., Křížková, S. et al. Určení hladiny termostabilních thiolů u pacientů se zhoubným nádorem. Klin. Onkol. 2007, 20(6), s. 384-389.
16. Fabrik, I., Kukačka, J., Adam, V. a kol. Metalothionein a jeho vztah k protinádorové léčbě na bázi platinových komplexů. Prakt. Lék. 2008, 88(2), s. 90-93.
17. Fiala, R., Ženíšek, J. Adenokarcinom prostaty a screening. Prakt. Lék. 2001, 81(11), s. 613-618.
18. Foltýn, I. Aktivní vyhledávání karcinomu prostaty na základě vyšetření PSA v ordinaci praktického lékaře. Prakt. Lék. 2007, 87(2), s. 117-118.
19. Formigari, A., Irato, P., Santon, A. Zinc, antioxidant systems and metallothionein in metal mediated-apoptosis: Biochemical and cytochemical aspects. Comp. Biochem. Physiol. C. Toxicol. Pharmacol. 2007, 146(4): p. 443-459.
20. Gao, X., Porter, A.T., Grignon, D.J. et al. Diagnostic and prognostic markers for human prostate cancer. Prostate 1997, 31(4), p. 264-281.
21. Gioeli, D. Signal transduction in prostate cancer progression. Clin. Sci. 2005, 108(4), s. 293-308.
22. Grepl, M., Student, V., Furst, T., Furstova, J. Prostate cancer detection yield in repeated biopsy is independent of the diagnosis of earlier biopsies. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub., 2009, 153(4), p. 297-302.
23. Gumulec, J., Masařík, M., Hrabec, R. a kol. Zinek a jeho vztah k nádorům prostaty. Prakt. Lék., 2010, 90(8), s. 455-459.
24. Horáková, Z., Tóthová, E., Salzman, R. a kol. Význam elevace hladin metalothioneinu v krvi u pacientů s nádory hlavy a krku – 2. část. Otorinolaryng. a Foniat. 2008, 57(2), s. 90-97.
25. Housa, D., Vernerová, Z., Heráček, J. et al. Serum resistin levels in benign prostate hyperplasia and non-metastatic prostate cancer: Possible role in cancer progression. Neoplasma, 2008, 55(5), p. 442-446.
26. Humbert, L., Chevrette, M. Somatic molecular genetics of prostate cancer. In Foulkes, et al. Male reproductive cancers epidemiology, pathology and genetics. New York, Dordrecht, Heidelberg, London: Springer Verlag, 2009.
27. Chi, S.G., White, R.W.D., Meyers, F.J. et al. P53 in prostate cancer frequent expressed transition mutations. J. Natl. Cancer Inst., 1994, 86(12), p. 926-933.
28. Jamaspishvili, T., Kral, M., Khomeriki, I. et al. Urine markers in monitoring for prostate cancer. Prostate Cancer Prostatic Dis. 2010, 13(1), p. 12-19.
29. Kerbel, R.S. Molecular origins of cancer: Tumor angiogenesis. New Engl. J. Med. 2008, (358(19), p. 2039-2049.
30. Kizek, R., Vacek, J., Adam, V., Vojtěšek, B. Vztah metalothioneinu k rakovině a protinádorové léčbě. Klin. Biochem. Metabol. 2004, 12(2), s. 72-78.
31. Kizek, R., Vacek, J., Trnkova, L. et al. Application of catalytic reactions on a mercury electrode for electrochemical detection of metallothioneins. Chem. Listy, 2004, 98(4), p. 166-173.
32. Král, M., Rosinská, V., Student, V. et al. Genetic determinants of prostate cancer: A review. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc Czech Repub. 2011, 155(1), p. 3-10.
33. Krizkova, S., Fabrik, I., Adam, V. et al. Metallothionein - a promising tool for cancer diagnostics. Bratisl. Lek. Listy, 2009, 110(2), p. 93-97.
34. Lukeš, M., Záleský, M., Heráček, J. a kol. P53 a karcinom prostaty. Klin. Onkol., 2003, 16(3), s. 141-144.
35. Milon, B.C., Agyapong, A., Bautista, R. et al. Ras responsive element binding protein-1 (RREB-1) down-regulates hZIP1 expression in prostate cancer cells. Prostate 2010, 70(3), p. 288-296.
36. Mlcochova, P., Barinka, C., Tykvart, J. et al. Prostate-specific membrane antigen and its truncated form PSM′. Prostate 2009, 69(5), p. 471-479.
37. Moul, J.W. Prostate specific antigen only progression of prostate cancer. J. Urol. 2000, 163(6), p. 1632-1642.
38. Ondrušová, M., Mužík, J., Kliment, J. a kol. Incidencia a mortalita na karcinom prostaty vo vybraných krajinách strednej Europy. Klin. Onkol., 2011, 24(2), s. 126-132.
39. Petrlová, J., Blaštík, O., Průša, R. et al. Analýza obsahu metatothioneinu u pacientů se zhoubným nádorem prsu, tlustého střeva a nebo melanomem. Klin. Onkol., 2006, 19(2), s. 138-142.
40. Polascik, T.J., Oesterling, J.E., Partin, A.W. Prostate specific antigen: A decade of discovery - What we have learned and where we are going. J. Urol., 1999, 162(2), p. 293-306.
41. Rubin, M.A., Zhou, M., Dhanasekaran, S.M., et al. Alpha-methylacyl coenzyme A racemase as a tissue biomarker for prostate cancer. JAMA 2002, 287(13), p. 1662-1670.
42. Schroeder, F.H., Hugosson, J., Roobol, M.J. et al. Screening and prostate-cancer mortality in a randomized European study. N. Engl. J. Med., 2009, 360(13), p. 1320-1328.
43. Sramkoski, R.M., Pretlow, T.G., Giaconia, J.M. et al. A new human prostate carcinoma cell line, 22Rv1. In Vitro Cell. Dev. Biol. Anim. 1999, 35(7), p. 403-409.
44. Štern, P., Vranovský, K., Šafarčík, K. Karcinom prostaty – molekulární podstata, diagnostika a ekonomika prevence. Klin. Biochem. Metabol., 2008, 16(1), s. 19-26.
45. Študent, V., Grepl, M., Král, M., Hartmann, I. Má vyšetření PSA stále význam při vyhledávání karcinomu prostaty? Urol. Prax., 2006, 5(5), s. 214-218.
46. Thiagalingam, A., DeBustros, A., Borges, M. et al. RREB-1, a novel zinc finger protein, is involved in the differentiation response to ras in human medullary thyroid carcinomas. Mol. Cell. Biol., 1996, 16(10), p. 5335-5345.
47. Thomson, J.O., Dzubak, P., Hajduch, M. Prostate cancer and the food supplement, PC-SPES: Minireview. Neoplasma, 2002, 49(2), p. 69-74.
48. Webber, M.M., Bello, D., Quader, S. Immortalized and tumorigenic adult human prostatic epithelial cell lines: Characteristics and applications. 3. Oncogenes, suppressor genes, and applications. Prostate 1997, 30(2), p. 136-142.
49. Zelená, J., Potěšil, D., Vacek, J. et al. Metalothionein jako prognostický marker nádorového onemocnění. Klin. Onkol., 2004, 17(6), s. 190-195.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Jubilea
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2011 Číslo 8- Nitrofurantoin s řízeným uvolňováním – osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
-
Všechny články tohoto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
VIII. Politické rozhodování - Problematika dopingu v ordinaci praktického lékaře
- Což takhle dát si šálek kávy…
- Ze života odborných společností ČLS JEP
- Pokroky v operační léčbě končetinových zlomenin
- Udělení medailí a čestného členství ČLS JEP
- Pohled pacienta na problematiku hyperaktivního močového měchýře
- Bioanalytické studium nádorových markerů karcinomu prostaty na úrovni RNA a proteinu
- Odolnost rodiny s handicapovaným dítětem
- Nová technologie způsobu léčby atriální fibrilace
- Porucha vývoje kostní hmoty – potenciální komplikace fenylketonurie
- Studie čtyř systémů měření glykovaného hemoglobinu HbA1c v režimu POCT
- Ze života odborných společností ČLS JEP
- Krátká intervence a první pomoc pro lidi s návykovými nemocemi
-
Miniportréty slavných českých lékařů
Profesor MUDr Jan Levit – lékař s nešťastným koncem - Literární Ceny Josefa Hlávky za rok 2010
- Evropský nefrologický kongres ERA-EDTA 2011
- Moderní vybavení pro jilemnickou nemocnici
- Čtvrtstoletí transplantací v ÚHKT
- Virové hepatitidy stále ohrožují zdraví i životy
- Thomayerova nemocnice získala unikátní technické zařízení
- Zemřel profesor Vladimír Pacovský
- Jubilea
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pokroky v operační léčbě končetinových zlomenin
- Krátká intervence a první pomoc pro lidi s návykovými nemocemi
- Studie čtyř systémů měření glykovaného hemoglobinu HbA1c v režimu POCT
-
Miniportréty slavných českých lékařů
Profesor MUDr Jan Levit – lékař s nešťastným koncem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



