-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Změny N-glykosylací na sérových proteinech při nádorových onemocněních
Changes of serum protein N-glycosylation in cancer
Background: Glycosylation is a posttranslational modification responsible for many biological processes including protein-protein interactions, cell signaling or cell cycle regulation. Changes in glycosylation of serum proteins reflects the status of tissues and cells in the organism and therefore can be used as markers for diagnosis of cancer, its progression and determination of its subtypes. N-glycan profiling is often used for characterization of N-glycosylation changes. It is based on the measurements of N-glycans released from the serum proteins. Beside the N-glycan profiling, glycoproteomic approach is emerging as it preserves the information about glycan composition, original protein, and its glycosylation sites. Purpose: This review covers existing works describing the changes in serum protein N-glycosylation in various cancer types. Attention was paid to both the glycomic and glycoproteomic approaches. The last part of the review shortly presents the analytical methods used for these analyses.
Keywords:
Serum proteins – Mass spectrometry – glycomics – glycoproteomics – N-glycans – N-glycan profiling – glycopeptides
Autoři: I. Benešová 1; A. Paulin Urminský 1; J. Halámková 2; L. Hernychová 1
Působiště autorů: Výzkumné centrum aplikované molekulární onkologie, MOÚ, Brno 1; Klinika komplexní onkologické péče LF MU a MOÚ, Brno 2
Vyšlo v časopise: Klin Onkol 2022; 35(3): 174-180
Kategorie: Přehled
doi: https://doi.org/10.48095/ccko2022174Souhrn
Východiska: Glykosylace jsou posttranslační modifikace zodpovědné za mnohé buněčné procesy vč. interakcí mezi proteiny, za buněčnou signalizaci nebo regulaci buněčného cyklu. Změny glykosylací na sérových proteinech reflektují stav buněk a tkání v organizmu a ukazují se proto jako užitečný marker pro diagnostiku přítomnosti a progrese nádorových onemocnění a jejich subtypizaci. Pro charakterizaci změn je hojně využíváno tzv. glykanové profilování, tedy měření N-glykanů uvolněných ze sérových proteinů. S rozvojem analytické instrumentace a pokročilých bioinformatických postupů se pro charakterizaci N-glykosylací prosazuje stále více glykoproteomický přístup, který vedle glykomické informace zachovává i informaci proteomickou, tj. znalost původního proteinu a glykosylačního místa. Cíl: Cílem této přehledové práce je zmapovat dosavadní studie popisující změny glykosylací na sérových proteinech během nádorových onemocnění. Pozornost je věnována glykomickým i glykoproteomickým přístupům. Poslední část článku shrnuje analytické metody používané pro tento typ analýz.
Klíčová slova:
glykomika – glykoproteomika – N-glykany – N-glykanové profilování – glykopeptidy – sérové proteiny – hmotnostní spektrometrie
Úvod
Glykosylace je komplexní posttranslační modifikace probíhající postupně v endoplazmatickém retikulu a Golgiho aparátu. Na glykosylaci se podílí skupina enzymů přenášejících rozličné aktivované monosacharidové jednotky na akceptorové proteiny, lipidy a na již přítomné glykanové struktury na těchto biomolekulách [1–3]. Glykosylace proteinů zahrnují především N-glykosylace, O-glykosylace a glykosaminoglykany. O-glykosylace, tj. glykanové struktury připojené přes hydroxylovou skupinu serinu nebo threoninu, příp. hydroxylysinu, většinou obsahují pouze jednu až čtyři monosacharidové jednotky. N-glykanové struktury jsou připojené přes amidovou skupinu asparaginu, který se nachází v sekvenčním motivu Asn-X-Ser (X ≠ Pro); základem této glykosylace je rozvětvená struktura složená ze dvou N-acetylglukosaminových a tří manózových jednotek, která je dále více či méně dekorovaná dalšími monosacharidy [1,4]. Nejběžnější glykanové struktury jsou zobrazeny na obr. 1.
Obr. 1. Jednotlivé typy glykosylací přítomných na lidských proteinech a typické struktury, na které je v tomto přehledovém článku odkazováno. 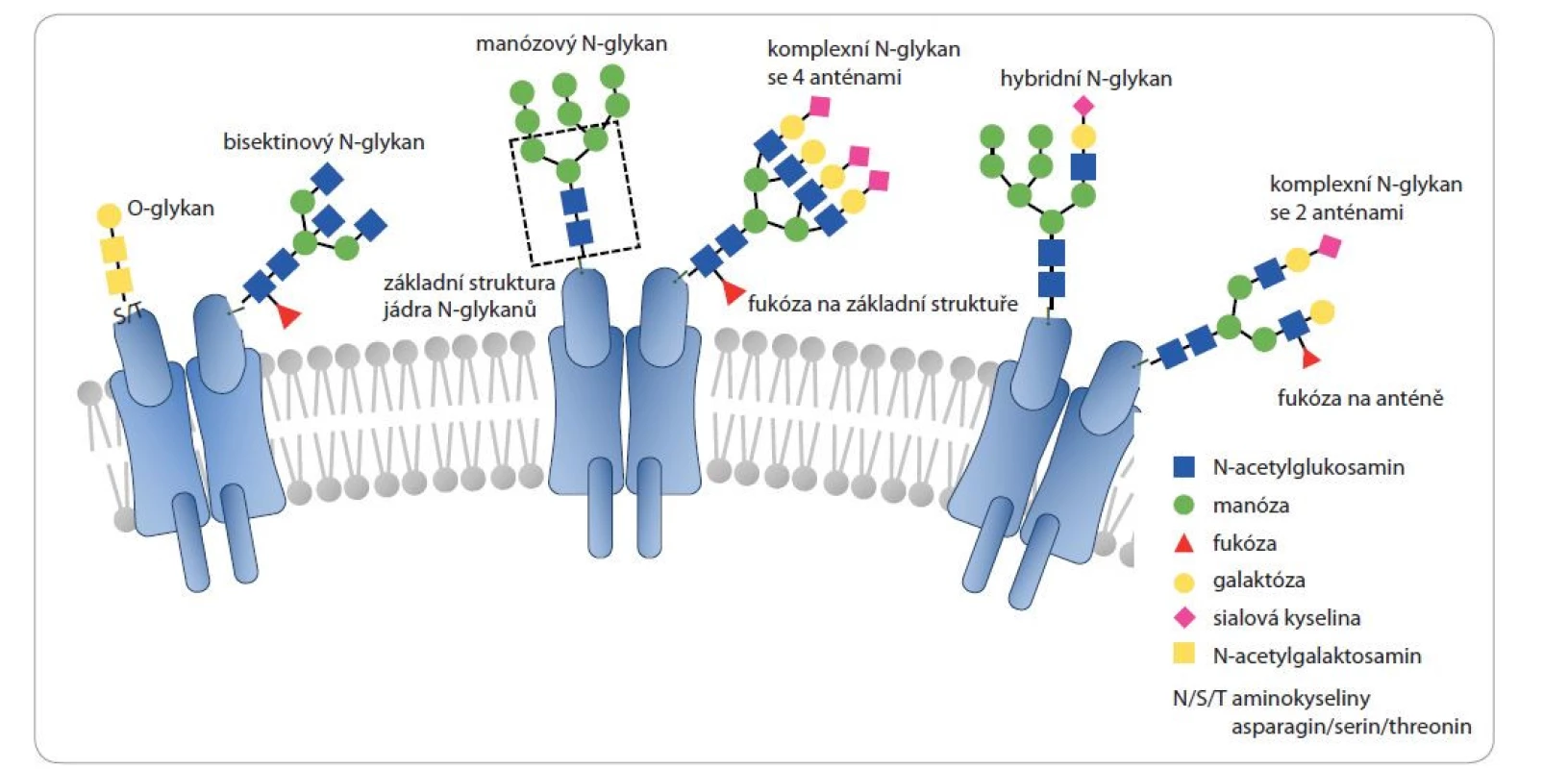
Změny v glykosylacích na sérových proteinech během nádorových onemocnění reflektují změny na proteinech v nádorových tkáních vč. receptorových proteinů. Tyrosinkinázový receptor epidermálního růstového faktoru, jeden z hlavních cílů protinádorových léků, je na extracelulární doméně bohatě glykosylovaný. Bylo popsáno, že změny v glykosylacích ovlivňují vazbu ligandů a aktivaci receptorů [76]. N-glykosylace proteinů jsou zapojené do řady biologických procesů, vč. interakcí mezi proteiny, buněčné signalizace nebo regulace buněčného cyklu [5,6]. Není tedy překvapující, že změny v expresi glykosyltransferáz zapojených do biosyntézy těchto struktur mají patologické důsledky. Už před více než 50 lety byla popsána souvislost mezi změnami v glykanových strukturách a nádorovou transformací buněk [7]. Obvykle jsou pozorovány změny jak v kvantitě přirozeně se vyskytujících glykanů, tak ve výskytu nových, více rozvětvených typů glykanů [6,8]. Sérové glykoproteiny i typ glykanů, které nesou, reflektují stav tkání a buněk v organizmu, ze kterých do cirkulace vstupují. Současně je krevní sérum rutinně dostupný diagnostický materiál, a proto jsou sérové glykoproteiny ideálními kandidáty pro biomarkery [9,10]. Řada glykoproteinových biomarkerů již byla schválena Úřadem pro kontrolu potravin a léčiv v USA a je využívána pro diagnostiku řady onemocnění [11]. Tyto glykoproteiny zahrnují i řadu nádorových markerů, mj. antigen CA-125, dobře charakterizovaný marker karcinomu vaječníku. CA 19-9 je využíván k diagnostice zhoubného nádoru pankreatu a a-1-fetoprotein (AFP) jako marker karcinomu jater. Jiným schváleným biomarkerem je prostatický specifický antigen (PSA). I přes rostoucí množství markerů nádorových onemocnění je stále obtížné spolehlivě předpovědět prognózu a úspěšnost léčby; fyziologické koncentrace biomarkerů se navíc vyskytují i u maligních onemocnění. Při stanovování těchto glykoproteinů je pouze měřena jejich koncentrace v séru, typy glykanových struktur však sledovány nejsou. I z tohoto důvodu se mnoho vědeckých skupin zaměřuje na studium těchto posttranslačních modifikací v nádorové patogenezi [12–14].
Tento přehledový článek se věnuje dosud popsaným změnám v N-glykosylacích proteinů v séru a plazmě během nádorových onemocnění. První část se věnuje tzv. glykanovému profilování, tzn. charakterizaci glykanových struktur přítomných na sérových proteinech po jejich uvolnění z proteinů. Druhá část popisuje glykoproteomický přístup pro charakterizaci změn N-glykosylací se zachováním informací o původu glykanů, tj. původních proteinech, které glykany nesou, a informací o obsazenosti jednotlivých glykosylačních míst na těchto proteinech. V závěru článku jsou popsané nejběžnější analytické přístupy používané pro charakterizaci glykosylací.
Glykanové profilování séra a jednotlivých sérových proteinů
Jedním z přístupů pro sledování změn glykosylací ve vývoji onemocnění je glykanové profilování. Glykomický přístup nespoléhá na jednotlivé molekulové markery, ale porovnává relativní koncentrace všech detekovatelných, strukturně odlišných glykanů odštěpených z jednoho proteinu nebo směsi proteinů (obr. 2a).
Obr. 2. Schéma glykomického a glykoproteomického přístupu ke studiu změn N-glykosylací. 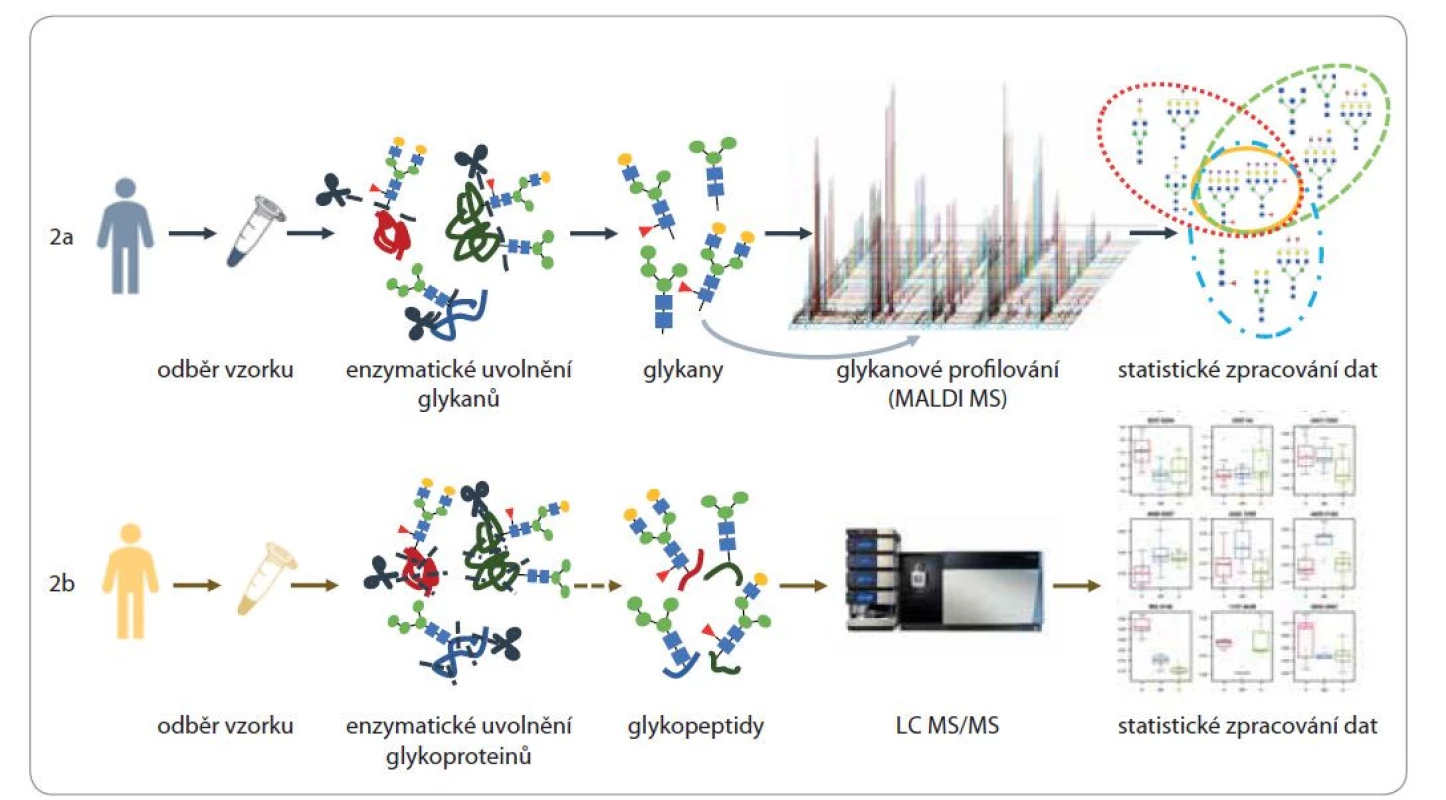
Oba přístupy se liší enzymatickým zpracováním vzorku sérových proteinů. V glykomickém přístupu (2a) jsou s využitím glykosidázy uvolňovány pouze glykanové struktury, které jsou následně kvalitativně i kvantitativně stanoveny, typicky hmotnostní spektrometrií s laserovou desorpcí/ionizací za účasti matrice. S využitím pokročilých statistických metod jsou pak nalezeny struktury odlišující se v jednotlivých skupinách pacientů. Glykoproteomický přístup (2b) využívá k enzymatické proteolýze glykoproteinů specifické proteázy, které štěpí proteinový vzorek na směs peptidů a glykopeptidů. Glykopeptidy jsou ze směsi izolovány a charakterizovány s využitím kapalinové chromatografie a hmotnostní spektrometrie. V hmotnostním spektrometru jsou jednotlivé glykopeptidy fragmentovány a ze spekter je tak možné získat proteomické (sekvenci aminokyselin) i glykomické informace (umístění glykanové struktury, sumární vzorec glykanu a jeho základní strukturní informace). S využitím datové analýzy jsou podobně jako v glykomických pracích identifikovány rozdíly mezi studovanými skupinami pacientů.
LC MS/MS – kapalinová chromatografie s tandemovou hmotnostní spektrometrií, MALDI MS – hmotnostní spektrometrie s laserovou desorpcí/ ionizací za účasti matricePrvotní studie se zabývaly především vývojem metod, diagnostikou a prognostiku jednotlivých typů onemocnění a pracovaly s malými soubory pacientů [13,15–19]. S rozvojem pokročilých analytických metod, automatizace a bioinformatických nástrojů se v posledních letech objevuje stále více prací většího rozsahu, které cílí i na diferenciaci jednotlivých subtypů a stadií onemocnění.
Pierce et al našli rozdíly v N-glykanech izolovaných ze sér skupin pacientek s benigním nádorem a maligním karcinomem prsu. V rámci druhé skupiny dokázal odlišit i skupiny pacientek, u nichž se karcinom z prsu (ne) rozšířil do lymfatických uzlin [20]. Šaldová et al sledovali změny sérových glykanů u pacientek s karcinomem prsu v různých stadiích nemoci: po diagnóze onemocnění, neoadjuvantní léčbě, chirurgickém odstranění nádoru, radioterapii a následně po dobu 3 let. Změny v sérových glykanech byly překvapivé, např. glykanový profil po chemoterapii odpovídal profilu typickému pro přítomnost zánětlivého stavu v organizmu; současně byl pozorován nárůst struktur asociovaných s přítomností nádorů v organizmu [21]. Změny v N-glykanech uvolněných z proteinů krevního séra a v N-glykanech izolovaných pouze z imunoglobulinu G (IgG) během nádorového onemocnění prsu byly popsány u populace etiopských žen s karcinomem prsu. Ve stadiu I a II bylo významně zvýšeno 17 komplexních N-glykanů [22]. V jiné práci stejná vědecká skupina popsala variabilitu sérového N-glykomu mezi jedinci různých etnik; zajímavým zjištěním bylo, že N-glykanové profily zdravých etiopských jedinců se podobaly profilům japonských pacientů s hepatocelulárním karcinomem. Upozornili tak na nutnost zohlednění etnického původu pacientů při použití N-glykanů jako diagnostických markerů [23]. Změny v množství bifukosylovaných N-glykanů u čínských žen s nádorovým onemocněním prsu byly popsány v práci autorů Ju et al [24]. Lee et al využili pro zpracování dat N-glykanových spekter dedikovaného softwaru NosIDsys a dokázali s ním diferenciovat jednotlivá stadia invazivního lobulárního karcinomu [25].
U pacientek s různými typy zhoubných nádorů prsu sledovali Haakensen et al souvislosti mezi výskytem jednotlivých sérových N-glykanů s nádorovým transkriptomem (mRNA a miRNA). Mimo jiné popsali, že přítomnost třiantenárních-trigalaktosylovaných-trisialylovaných glykanů je spojena s nižším množstvím transkripčních produktů zapojených do buněčné adheze zprostředkované integriny [26].
Murphy et al použili pro diagnostiku indolentního karcinomu prostaty nejen N-glykanové profilování, ale současně i DNA metylace a proteinové a transkripční biomarkery. S tímto „multiomickým“ přístupem dokázali zpřesnit spolehlivost diagnostiky. Hodnota obsahu plochy pod křivkou multiAUC (area under the curve) pro multiomický přístup byla 0,91; konvenční přístup dosahoval hodnoty 0,67 [27].
Profilování N-glykanů bylo využito i ve studii autorů Gilgunn et al, která se věnovala změnám jednotlivých glykoforem u pacientů s různými formami tohoto onemocnění. Autoři studie popsali, že s rozvojem nemoci směrem k agresivnějším formám dochází k nárůstu hybridních, oligomanózových a biantenárních-digalaktosylovaných-monosialylovaných glykanů, současně byl zaznamenán pokles monofukosylovaných i nefukosylovaných triantenárních-trigalaktosylovaných-trisialylovaných glykanů [28].
Matsumoto et al ve své práci zkoumali diagnostický a prognostický potenciál sérových N-glykanů u pacientů s kastračně rezistentním karcinomem prostaty (castration-resistant prostate cancer – CRPC). Analýzou heterogenních vzorků dalších typů tohoto karcinomu v různých stadiích nemoci a použitím pokročilých statistických metod získali sadu devíti N-glykanů, jejichž výskyt byl signifikantně spojen s CRPC [29].
Vzorky sér i nádorových tkání pacientů s karcinomem vaječníku byly analyzovány i v práci autorů Zahradníková et al, kteří se zabývali rozdíly N-glykanů mezi pacientkami citlivými a rezistentními na chemoterapii založené na platinových léčivech [30].
Bartling et al sledovali změny v desialylovaných N-glykanových profilech mezi zdravými jedinci a pacienty s nemalobuněčným karcinomem plic (on-small cell lung carcinoma – NSCLC). Biantenární a bisektinové glykany fukosylované a-1,6-vazbou na základní struktuře glykanu byly zastoupeny v menších kvantitách u pacientů s NSCLC, naopak rozvětvené triantenární glykany s a-1,3-fukózou na anténě byly u těchto pacientů zvýšené [31].
V jiné rozsáhlé studii byly u 633 pacientů s kolorektálním karcinomem v různém stadiu nemoci a u 478 kontrolních jedinců profilovány N-glykany z krevní plazmy. Mezi jednotlivými skupinami byly nalezeny statisticky významné rozdíly, viditelný byl především pokles biantenárních glykanů s fukosylací na glykanovém jádře u pacientů s kolorektálním karcinomem (p < 0,0009) [32]. V jiné studii byla sledována souvislost mezi sérovým N-glykomem a prognózou přežití u pacientů s tímto nádorovým onemocněním. Bylo popsáno několik N-glykanů s prognostickým potenciálem; studie poukázala na větší spolehlivost při využití celého panelu N-glykanů pro prognózu onemocnění [33].
Gaye et al využívali pro diagnostiku karcinomu jícnu charakterizaci změn sérových N-glykanů a iontovou mobilitu spojenou s hmotnostní spektrometrií. S využitím bioinformatického přístupu založeného na rozpoznávání charakteristických vzorců v glykanových spektrech dokázali rozlišit jednotlivé subtypy tohoto onemocnění [34–36].
Zhang et al popsali změny v sérových N-glykanech u pacientů s mnohočetným myelomem: u pacientů s mnohočetným myelomem zaznamenali pokles a-2,3 - a a-2,6-sialylace, galaktosylace a nárůst fukosylací u komplexních N-glykanů [37].
N-glykany uvolněné ze sérových proteinů byly sledovány i u pacientů s pankreatickým duktálním adenokarcinomem (PDAC). U glykanů izolovaných ze sér pacientů s PDAC byl zaznamenán větší stupeň větvení a fukosylací na anténách glykanů ve srovnání se vzorky od zdravých jedinců. Dále byl u pacientů s PDAC pozorován nárůst poměru a-2,6 - k a-2,3-sialylaci [38].
Glykanové struktury jsou specifické pro různé tkáně, buňky a proteiny. Z tohoto důvodu se některé práce zaměřují na profilování N-glykanů jen z vybraných proteinů, u kterých se předpokládají největší změny. Nejčastěji mapovaným proteinem je IgG, který je v séru dominantně zastoupen [22,39–42]. Byly sledovány i změny N-glykanů uvolněných z haptoglobinu u pacientů s karcinomem žaludku [43] nebo z ceruloplazminu u pacientů s karcinomem pankreatu [44].
Glykoproteomický přístup: změny glykanů na jednotlivých proteinech a glykosylačních místech
Po popisu změn v N-glykanových profilech vyvstává otázka o původu, příčinách a důsledcích těchto rozdílů. Identifikace glykoproteinů a glykosylačních míst, odkud pocházejí nejvíce se odlišující glykanové struktury, je tak dalším přirozeným krokem pro pochopení biologických procesů, do kterých jsou tyto struktury zapojeny. Glykomický přístup je proto postupně doplňován a nahrazován glykoproteomickými analýzami (obr. 2b), které zachovávají informace o glykanové mikroheterogenitě (tj. variantách glykanových struktur na konkrétním glykosylačním místě) i makroheterogenitě (stupni obsazenosti jednotlivých glykosylačních míst). Přístupnost jednotlivých glykosylačních míst na polypeptidovém řetězci se může v závislosti na jeho struktuře lišit a typy glykanových struktur na různých pozicích jednoho proteinu se tak mohou výrazně různit [45–48].
Analýza celkového sérového N-glykoproteomu dosud není vzhledem k vysoké komplexitě vzorku rutinně prováděnou metodou, vyvíjí se a využívá progresivní vývoj analytické instrumentace a softwarové nástroje pro interpretaci dat [48–51].
Hledání glykoproteomických markerů karcinomu vaječníků v sérových glykoproteinech se dlouhodobě věnuje vědecká skupina Mikia Mikami. Z glykopeptidů stanovených v sérech pacientů s různými typy epiteliálních nádorů vaječníku (n = 134) a zdravých jedinců (n = 159) byl vybrán glykopeptid A2160: plně sialylovaný glykopeptid z a-řetězce complement 4-binding proteinu, který byl označen jako potenciální marker světlobuněčného karcinomu vaječníku (ovarian clear cell carcinoma – OCCC). A2160 byl významně zvýšen ve všech stadiích OCCC a vykazoval i vyšší spolehlivost ve srovnání s CA-125 [52]. V navazující práci byly pro diagnostiku rané fáze epiteliálního nádorového onemocnění vaječníku využity pokročilé vyhodnocovací metody a umělá inteligence; tímto přístupem bylo dosaženo přesnosti diagnózy 95 % [53,54].
V jiné práci byl popsán leucine-rich alpha-2-glycoprotein-1 s fukosylovaným triantenárním N-glykanem (LRG–FTG) jako alternativní sérový marker kolorektálního karcinomu. Hladina LRG-FTG sledovala i trendy v odpovědi pacienta na terapii [55].
Signifikantní pokles monofukosylovaných a nesialylovaných oligosacharidových struktur na asparaginu 180 na IgG1 pozorovali na malém vzorku pacientů s karcinomem pankreatu Liu et al [49].
Řada prací se zaměřuje i na glykoproteomickou charakterizaci jednotlivých proteinů izolovaných ze séra a změn v jejich N-glykosylacích na jednotlivých glykosylačních místech. Hojně jsou charakterizovány změny N-glykosylací na všech čtyřech glykosylačních místech haptoglobinu, často v souvislosti s nádorovými onemocněními jater, ve kterých je haptoglobin produkován [56]. Pompach et al sledovali nárůst struktury typu Lewis Y a fukosylací u pacientů s onemocněním jater, vč. hepatocelulárního karcinomu [57,58]. Změny N-glykosylací haptoglobinu u pacientů s různými typy karcinomů popsali i Takahasi et al [59]. Změny N-glykosylací na sérových imunoglobulinech byly sledovány v jiné práci Ruhaaka et al. Nejvíce abnormálních N-glykosylací pro odlišení vzorků pacientů s nádorovým onemocněním vaječníku od zdravých jedinců nesly především IgG [60].
Analytické metody pro charakterizaci glykoproteinů
Porozumění biologickému významu glykosylací vyžaduje jejich podrobnou charakterizaci. Nejběžnější metody pro charakterizaci glykanových struktur ať na glykomické (tj. analýza uvolněných glykanů), nebo glykoproteomické úrovni (analýza glykopeptidů) na sérových proteinech spoléhají na pokročilé analytické metody s hmotnostně spektrometrickou detekcí, na nukleární magnetickou rezonanci, separační metody (kapalinová chromatografie a kapilární elektroforéza), příp. na kombinaci separačních metod s hmotnostní spektrometrií [61,62]. Hmotnostní spektrometrie je ve spojení se separačními technikami v současné době dominantní analytickou metodou v této oblasti, je vhodná pro určení velikosti a sumárních vzorců glykanů, pro detailní popis vazeb mezi jednotlivými monosacharidy se lépe uplatňuje nukleární magnetická rezonance [63]. Strukturní charakteristiku lze získat i při použití separačních metod interpretací retenčních/migračních časů [64].
Glykomické i glykoproteomické studie jsou prováděny buď na jednotlivých proteinech, nebo na jejich směsích, typicky izolovaných z tkání, sér či buněčných kultur. Při práci s komplexními vzorky je prvním krokem izolace proteinů, kdy při glykomické analýze jsou následně z těchto proteinů uvolňovány N-glykany pomocí endoglykosidázy PNGázy F [65]. Po uvolnění jsou glykany přečištěny a následně derivatizovány, nejběžněji se používá permethylace, při které jsou vodíky na hydroxylových skupinách nahrazeny methylovými skupinami. Permethylace glykanů zvyšuje separační účinnost při kapalinové chromatografii a zvyšuje ionizační účinnost v hmotnostní spektrometrii s laserovou desorpcí a ionizací za účasti matrice [66].
Při glykoproteomické analýze jsou glykoproteiny enzymaticky štěpeny proteázou trypsinem na glykopeptidy a peptidy. V důsledku velké glykanové heterogenity jsou koncentrace jednotlivých glykopeptidů proti koncentracím peptidů násobně nižší, a tak i obtížněji detekovatelné, a proto se hojně využívají techniky pro jejich obohacování [67]. Nejběžněji se pro obohacování používají techniky na principu hydrofilní interakční kapalinové chromatografie [68], lektinů [69], hydrazidové chemie [70] a imunoafinitní metody [71]. Glykopeptidy jsou následně charakterizovány tandemovou hmotnostní spektrometrií, ve které jsou jednotlivé glykopeptidy fragmentovány. Pro kompletní charakterizaci se často využívá kombinace různých fragmentačních technik zahrnující vysoko - a nízkoenergetickou kolizně indukovanou disociaci a disociaci přenosem elektronu [72]. Z hmotnostních spekter glykopeptidů vyhodnocených vhodným softwarem [73] se získají informace nejen o glykanových strukturách, ale i o původních proteinech.
Závěr
S rozvojem analytické instrumentace se vědecké komunitě daří stále podrobněji charakterizovat komplexní posttranslační modifikace přítomné nejen na sérových proteinech, mezi které patří glykosylace. Získané poznatky poukazují na přítomnost abnormálních forem glykanů při nádorových onemocněních. Tyto formy mohou být samostatně či v sadách využity pro diagnostiku přítomnosti a progrese nádorových onemocnění. O významu těchto prací svědčí i fakt, že protinádorová léčiva odvozená od monoklonálních protilátek cílí právě na glykanové struktury [74,75].
N-glykanové profilování má potenciál charakterizovat glykany uvolněné ze sérových proteinů, ale tento přístup neposkytuje informace o původních glykoproteinech ani o obsazení glykosylačních pozic. Z tohoto důvodu se začíná prosazovat glykoproteomický přístup propojující glykomiku s proteomikou a doplňující proteomické informace, které umožňují zasazení poznatků o glykanech do biologického kontextu. Vědecké práce na klinických vzorcích využívající glykoproteomický přístup jsou v současné době spíše raritní, ale v následujících letech lze očekávat jejich rozšíření.
Práce byla podpořena Evropským fondem pro regionální rozvoj – projekt ENOCH (reg. č. CZ.02.1.01/0.0/0.0/16_019/0000868) – a MZ ČR –RVO (MOÚ, 00209805).
This work was supported by the European Regional Development Fund – Project ENOCH (No.CZ.02.1.01/0.0/0.0/16_019/0000868) and by the Ministry of Health, Czech Republic – Conceptual Development of Research Organization (MMCI, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential confl icts of interest concerning drugs, products,or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedicalpapers.Obdrženo/Submitted: 1. 9. 2021
Přijato/Accepted: 18. 10. 2021prof. Ing. Lenka Hernychová, Ph.D.
Výzkumné centrum aplikované
molekulární onkologie,
Masarykův onkologický ústav
Žlutý kopec 7
602 00 Brno
e-mail: lenka.hernychova@mou.cz
Zdroje
1. Reily C, Stewart TJ, Renfrow MB et al. Glycosylation in health and disease. Nat Rev Nephrol 2019; 15 (6): 346–366. doi: 10.1038/s41581-019-0129-4.
2. Colley KJ, Varki AK. Cellular organization of glycosylation. In: Varki A. (ed). Essentials of glycobiology. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press 2017.
3. Ho WL, Hsu WM, Huang MC et al. Protein glycosylation in cancers and its potential therapeutic applications in neuroblastoma. J Hematol Oncol 2016; 9 (1): 100. doi: 10.1186/s13045-016-0334-6.
4. Ohtsubo K, Marth JD. Glycosylation in cellular mechanisms of health and disease. Cell 2006; 126 (5): 855–867. doi: 10.1016/j.cell.2006.08.019.
5. Munkley J, Elliott DJ. Hallmarks of glycosylation in cancer. Oncotarget 2016; 7 (23): 35478–35489. doi: 10.18632/oncotarget.8155.
6. Pinho SS, Reis CA. Glycosylation in cancer: mechanisms and clinical implications. Nat Rev Cancer 2015; 15 (9): 540–555. doi: 10.1038/nrc3982.
7. Ladenson RP, Schwartz SO, Ivy AC. Incidence of the blood groups and the secretor factor in patients with pernicious anemia and stomach carcinoma. Am J Med Sci 1949; 217 (2): 194–197. doi: 10.1097/00000441-194902000-00011.
8. Dube DH, Bertozzi CR. Glycans in cancer and inflammation – potential for therapeutics and diagnostics. Nat Rev Drug Discov 2005; 4 (6): 477–488. doi: 10.1038/nrd1751.
9. Grishman E. Histochemical analysis of mucopolysaccharides occurring in mucus-producing tumors. Mixed tumors of the parotid gland, colloid carcinomas of the breast, and myxomas. Cancer 1952; 5 (4): 700–707. doi: 10.1002/1097-0142 (195207) 5 : 4<700:: aid-cncr2820050408>3.0.co; 2-n.
10. Clerc F, Reiding KR, Jansen BC et al. Human plasma protein N-glycosylation. Glycoconj J 2016; 33 (3): 309–343. doi: 10.1007/s10719-015-9626-2.
11. Ludwig JA, Weinstein JN. Biomarkers in cancer staging, prognosis and treatment selection. Nat Rev Cancer 2005; 5 (11): 845–856. doi: 10.1038/nrc1739.
12. Demetriou M, Nabi IR, Coppolino M et al. Reduced contact-inhibition and substratum adhesion in epithelial cells expressing GlcNAc-transferase V. J Cell Biol 1995; 130 (2): 383–392. doi: 10.1083/jcb.130.2.383.
13. Zhao Y, Sato Y, Isaji T et al. Branched N-glycans regulate the biological functions of integrins and cadherins. FEBS J 2008; 275 (9): 1939–1948. doi: 10.1111/j.1742-4658.2008.06346.x.
14. Hernychová L, Uhrík L, Nenutil R et al. Glycoproteins in the sera of oncological patients. Klin Onkol 2019; 32 (Suppl 3): 39–45. doi: 10.14735/amko20193S.
15. Bereman MS, Williams TI, Muddiman DC. Development of a nanoLC LTQ orbitrap mass spectrometric method for profiling glycans derived from plasma from healthy, benign tumor control, and epithelial ovarian cancer patients. Anal Chem 2009; 81 (3): 1130–1136. doi: 10.1021/ac802262w.
16. Alley WR, Vasseur JA, Goetz JA et al. N-linked glycan structures and their expressions change in the blood sera of ovarian cancer patients. J Proteome Res 2012; 11 (4): 2282–2300. doi: 10.1021/pr201070k.
17. Abd Hamid UM, Royle L, Saldova R et al. A strategy to reveal potential glycan markers from serum glycoproteins associated with breast cancer progression. Glycobiology 2008; 18 (12): 1105–1118. doi: 10.1093/glycob/cwn 095.
18. Kyselova Z, Mechref Y, Al Bataineh MM et al. Alterations in the serum glycome due to metastatic prostate cancer. J Proteome Res 2007; 6 (5): 1822–1832. doi: 10.1021/pr060664t.
19. Isailovic D, Kurulugama RT, Plasencia MD et al. Profiling of human serum glycans associated with liver cancer and cirrhosis by IMS-MS. J Proteome Res 2008; 7 (3): 1109–1117. doi: 10.1021/pr700702r.
20. Pierce A, Saldova R, Abd Hamid UM et al. Levels of specific glycans significantly distinguish lymph node-positive from lymph node-negative breast cancer patients. Glycobiology 2010; 20 (10): 1283–1288. doi: 10.1093/glycob/cwq090.
21. Saldova R, Haakensen VD, Rødland E et al. Serum N-glycome alterations in breast cancer during multimodal treatment and follow-up. Mol Oncol 2017; 11 (10): 1361–1379. doi: 10.1002/1878-0261.12105.
22. Gebrehiwot AG, Melka DS, Kassaye YM et al. Exploring serum and immunoglobulin G N-glycome as diag - nostic biomarkers for early detection of breast cancer in Ethiopian women. BMC Cancer 2019; 19 (1): 588. doi: 10.1186/s12885-019-5817-8.
23. Gebrehiwot AG, Melka DS, Kassaye YM et al. Healthy human serum N-glycan profiling reveals the influence of ethnic variation on the identified cancer-relevant glycan biomarkers. PLoS One 2018; 13 (12): e0209515. doi: 10.1371/journal.pone.0209515.
24. Ju L, Wang Y, Xie Q et al. Elevated level of serum glycoprotein bifucosylation and prognostic value in Chinese breast cancer. Glycobiology 2016; 26 (5): 460–471. doi: 10.1093/glycob/cwv117.
25. Lee SB, Bose S, Ahn SH et al. Breast cancer diagnosis by analysis of serum N-glycans using MALDI-TOF mass spectroscopy. PLoS One 2020; 15 (4): e0231004. doi: 10.1371/journal.pone.0231004.
26. Haakensen VD, Steinfeld I, Saldova R et al. Serum N-glycan analysis in breast cancer patients – relation to tumour biology and clinical outcome. Mol Oncol 2016; 10 (1): 59–72. doi: 10.1016/j.molonc.2015.08.002.
27. Murphy K, Murphy BT, Boyce S et al. Integrating biomarkers across omic platforms: an approach to improve stratification of patients with indolent and aggressive prostate cancer. Mol Oncol 2018; 12 (9): 1513–1525. doi: 10.1002/1878-0261.12348.
28. Gilgunn S, Murphy K, Stöckmann H et al. Glycosylation in indolent, significant and aggressive prostate cancer by automated high-throughput N-glycan profiling. Int J Mol Sci 2020; 21 (23): 9233. doi: 10.3390/ijms21239233.
29. Matsumoto T, Hatakeyama S, Yoneyama T et al. Serum N-glycan profiling is a potential biomarker for castration-resistant prostate cancer. Sci Rep 2019; 9 (1): 16761. doi: 10.1038/s41598-019-53384-y.
30. Zahradnikova M, Ihnatova I, Lattova E et al. N-Glycome changes reflecting resistance to platinum-based chemotherapy in ovarian cancer. J Proteom 2021; 230 : 103964. doi: 10.1016/j.jprot.2020.103964.
31. Bartling B, Vanhooren V, Dewaele S et al. Altered desialylated plasma N-glycan profile in patients with non-small cell lung carcinoma. Cancer Biomark 2011; 10 (3–4): 145–154. doi: 10.3233/CBM-2012-0239.
32. Doherty M, Theodoratou E, Walsh I et al. Plasma N-glycans in colorectal cancer risk. Sci Rep 2018; 8 (1): 8655. doi: 10.1038/s41598-018-26805-7.
33. de Vroome SW, Holst S, Girondo MR et al. Serum N-glycome alterations in colorectal cancer associate with survival. Oncotarget 2018; 9 (55): 30610–30623. doi: 10.18632/oncotarget.25753.
34. Gaye MM, Valentine SJ, Hu Y et al. Ion mobility-mass spectrometry analysis of serum N-linked glycans from esophageal adenocarcinoma phenotypes. J Proteome Res 2012; 11 (12): 6102–6110. doi: 10.1021/pr300756e.
35. Lavine BK, White CG, Ding T et al. Wavelet based classification of MALDI-IMS-MS spectra of serum N-Linked glycans from normal controls and patients diagnosed with Barrett’s esophagus, high grade dysplasia, and esophageal adenocarcinoma. Chemom Intel Lab Syst 2018; 176 : 74–81.
36. Gaye MM, Ding T, Shion H et al. Delineation of disease phenotypes associated with esophageal adenocarcinoma by MALDI-IMS-MS analysis of serum N-linked glycans. Analyst 2017; 142 (9): 1525–1535. doi: 10.1039/c6an02697d.
37. Zhang Z, Westhrin M, Bondt A et al. Serum protein N-glycosylation changes in multiple myeloma. Biochim Biophys Acta Gen Subj 2019; 1863 (5): 960–970. doi: 10.1016/j.bbagen.2019.03.001.
38. Vreeker GCM, Hanna-Sawires RG, Mohammed Y et al. Serum N-glycome analysis reveals pancreatic cancer disease signatures. Cancer Med 2020; 9 (22): 8519–8529. doi: 10.1002/cam4.3439.
39. Kawaguchi-Sakita N, Kaneshiro-Nakagawa K, Kawashima M et al. Serum immunoglobulin G Fc region N-glycosylation profiling by matrix-assisted laser desorption/ionization mass spectrometry can distinguish breast cancer patients from cancer-free controls. Biochem Biophys Res Commun 2016; 469 (4): 1140–1145. doi: 10.1016/j.bbrc.2015.12.114.
40. Zou X, Yao F, Yang F et al. Glycomic signatures of plasma igg improve preoperative prediction of the invasiveness of small lung nodules. Molecules 2020; 25 (1): 28. doi: 10.3390/molecules25010028.
41. Saldova R, Royle L, Radcliffe CM et al. Ovarian cancer is associated with changes in glycosylation in both acute-phase proteins and IgG. Glycobiology 2007; 17 (12): 1344–1356. doi: 10.1093/glycob/cwm100.
42. Liu S, Cheng L, Fu Y et al. Characterization of IgG N-glycome profile in colorectal cancer progression by MALDI-TOF-MS. J Proteomics 2018; 181 : 225–237. doi: 10.1016/j.jprot.2018.04.026.
43. Lee SH, Jeong S, Lee J et al. Glycomic profiling of targeted serum haptoglobin for gastric cancer using nano LC/MS and LC/MS/MS. Mol Biosyst 2016; 12 (12): 3611–3621. doi: 10.1039/c6mb00559d.
44. Balmaña M, Sarrats A, Llop E et al. Identification of potential pancreatic cancer serum markers: increased sialyl-Lewis X on ceruloplasmin. Clin Chim Acta 2015; 442 : 56–62. doi: 10.1016/j.cca.2015.01.007.
45. Hülsmeier AJ, Paesold-Burda P, Hennet T. N-glycosylation site occupancy in serum glycoproteins using multiple reaction monitoring liquid chromatography-mass spectrometry. Mol Cell Proteomics 2007; 6 (12): 2132–2138. doi: 10.1074/mcp.M700361-MCP200.
46. Mariño K, Bones J, Kattla JJ et al. A systematic approach to protein glycosylation analysis: a path through the maze. Nat Chem Biol 2010; 6 (10): 713–723. doi: 10.1038/nchembio.437.
47. Hong Q, Ruhaak LR, Stroble C et al. A method for comprehensive flycosite-mapping and direct quantitation of serum glycoproteins. J Proteome Res 2015; 14 (12): 5179–5192. doi: 10.1021/acs.jproteome.5b00756.
48. Ueda K, Takami S, Saichi N et al. Development of serum glycoproteomic profiling technique; simultaneous identification of glycosylation sites and site-specific quantification of glycan structure changes. Mol Cell Proteomics 2010; 9 (9): 1819–1828. doi: 10.1074/mcp.2010/000893.
49. Liu L, Zhu B, Fang Z et al. Automated intact glycopeptide enrichment method facilitating highly reproducible analysis of serum site-specific N-glycoproteome. Anal Chem 2021; 93 (20): 7473–7480. doi: 10.1021/acs.analchem.1c00645.
50. Li Q, Kailemia MJ, Merleev AA et al. Site-specific glycosylation quantitation of 50 serum glycoproteins enhanced by predictive glycopeptidomics for improved disease biomarker discovery. Anal Chem 2019; 91 (8): 5433–5445. doi: 10.1021/acs.analchem.9b00776.
51. Takakura D, Harazono A, Hashii N et al. Selective glycopeptide profiling by acetone enrichment and LC/MS. J Proteomics 2014; 101 : 17–30. doi: 10.1016/j.jprot.2014.02.005.
52. Mikami M, Tanabe K, Matsuo K et al. Fully-sialylated alpha-chain of complement 4-binding protein: diagnostic utility for ovarian clear cell carcinoma. Gynecol Oncol 2015; 139 (3): 520–528. doi: 10.1016/j.ygyno.2015.10. 012.
53. Tanabe K, Ikeda M, Hayashi M et al. Comprehensive serum glycopeptide spectra analysis combined with artificial intelligence (CSGSA-AI) to diagnose early-stage ovarian cancer. Cancers 2020; 12 (9): 2373. doi: 10.3390/cancers12092373.
54. Matsuo K, Tanabe K, Hayashi M et al. Utility of comprehensive serum glycopeptide spectra analysis (CSGSA) for the detection of early stage epithelial ovarian cancer. Cancers 2020; 12 (9): 2374. doi: 10.3390/cancers12092374.
55. Shinozaki E, Tanabe K, Akiyoshi T et al. Serum leucine-rich alpha-2-glycoprotein-1 with fucosylated triantennary N-glycan: a novel colorectal cancer marker. BMC Cancer 2018; 18 (1): 406. doi: 10.1186/s12885-018-42 52-6.
56. Dobryszycka W. Biological functions of haptoglobin – new pieces to an old puzzle. Clin Chem Lab Med 1997; 35 (9): 647–654.
57. Sanda M, Pompach P, Brnakova Z et al. Quantitative liquid chromatography-mass spectrometry-multiple reaction monitoring (LC-MS-MRM) analysis of site-specific glycoforms of haptoglobin in liver disease. Mol Cell Proteomics 2013; 12 (5): 1294–1305. doi: 10.1074/mcp.M112.023325.
58. Pompach P, Brnakova Z, Sanda M et al. Site-specific glycoforms of haptoglobin in liver cirrhosis and hepatocellular carcinoma. Mol Cell Proteomics 2013; 12 (5): 1281–1293. doi: 10.1074/mcp.M112.023259.
59. Takahashi S, Sugiyama T, Shimomura M et al. Site--specific and linkage analyses of fucosylated N-glycans on haptoglobin in sera of patients with various types of cancer: possible implication for the differential diagnosis of cancer. Glycoconj J 2016; 33 (3): 471–482. doi: 10.1007/s10719-016-9653-7.
60. Ruhaak LR, Kim K, Stroble C et al. Protein-specific differential glycosylation of immunoglobulins in serum of ovarian cancer patients. J Proteome Res 2016; 15 (3): 1002–1010. doi: 10.1021/acs.jproteome.5b01 071.
61. Raman R, Raguram S, Venkataraman G et al. Glycomics: an integrated systems approach to structure-function relationships of glycans. Nat Methods 2005; 2 (11): 817–824. doi: 10.1038/nmeth807.
62. Cao L, Qu Y, Zhang Z et al. Intact glycopeptide characterization using mass spectrometry. Expert Rev Proteomics 2016; 13 (5): 513–522. doi: 10.1586/14789 450.2016.1172965.
63. Guerrini M, Raman R, Venkataraman G et al. A novel computational approach to integrate NMR spectroscopy and capillary electrophoresis for structure assignment of heparin and heparan sulfate oligosaccharides. Glycobiology 2002; 12 (11): 713–719. doi: 10.1093/glycob/ cwf084.
64. Pabst M, Altmann F. Glycan analysis by modern instrumental methods. Proteomics 2011; 11 (4): 631–643. doi: 10.1002/pmic.201000517.
65. Azadi P, Heiss C. Mass spectrometry of N-linked glycans. Methods Mol Biol 2009; 534 : 37–51. doi: 10.1007/978-1-59745-022-5_3.
66. Harvey DJ. Matrix-assisted laser desorption/ionization mass spectrometry of carbohydrates. Mass Spectrom Rev 1999; 18 (6): 349–450. doi: 10.1002/ (SICI) 1098-2787 (1999) 18 : 6<349:: AID-MAS1>3.0.CO; 2-H.
67. Alley WR, Mann BF, Novotny MV. High-sensitivity analytical approaches for the structural characterization of glycoproteins. Chem Rev 2013; 113 (4): 2668–2732. doi: 10.1021/cr3003714.
68. Dedvisitsakul P, Jacobsen S, Svensson B et al. Glycopeptide enrichment using a combination of ZIC-HILIC and cotton wool for exploring the glycoproteome of wheat flour albumins. J Proteome Res 2014; 13 (5): 2696–2703. doi: 10.1021/pr401282r.
69. Ruiz-May E, Catalá C, Rose JKC. N-glycoprotein enrichment by lectin affinity chromatography. Methods Mol Biol 2014; 1072 : 633–643. doi: 10.1007/978-1-62703-631-3_43.
70. Zhang H, Li X-J, Martin DB et al. Identification and quantification of N-linked glycoproteins using hydrazide chemistry, stable isotope labeling and mass spectrometry. Nat Biotechol 2003; 21 (6): 660–666. doi: 10.1038/nbt827.
71. Liu T, Qian WJ, Gritsenko MA et al. Human plasma N-glycoproteome analysis by immunoaffinity subtraction, hydrazide chemistry, and mass spectrometry. J Proteome Res 2005; 4 (6): 2070–2080. doi: 10.1021/pr0502065.
72. Scott NE, Parker BL, Connolly AM et al. Simultaneous glycan-peptide characterization using hydrophilic interaction chromatography and parallel fragmentation by CID, higher energy collisional dissociation, and electron transfer dissociation MS applied to the N-linked glycoproteome of Campylobacter jejuni. Mol Cell Proteomics 2011; 10 (2): M000031–MCP201. doi: 10.1074/mcp.M000031-MCP201.
73. Bern M, Kil YJ, Becker C. Byonic: advanced peptide and protein identification software. Curr Protoc Bioinformatics 2012; 13 : 13.20. doi: 10.1002/0471250953.bi1320s40.
74. Amon R, Rosenfeld R, Perlmutter S et al. Directed evolution of therapeutic antibodies targeting glycosylation in cancer. Cancers 2020; 12 (10): 2824. doi: 10.3390/cancers12102824.
75. Rabu C, McIntosh R, Jurasova Z et al. Glycans as targets for therapeutic antitumor antibodies. Future Oncol 2012; 8 (8): 943–960. doi: 10.2217/fon.12.88.
76. Gao Y, Luan X, Melamed J et al. Role of glycans on key cell surface receptors that regulate cell proliferation and cell death. Cells 2021; 10 (5): 1252. doi: 10.3390/cells10051252.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2022 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Oslepení
- Změny N-glykosylací na sérových proteinech při nádorových onemocněních
- Souvislost polymorfizmu IL-8 -251T>A a IL-18 -607C>A s náchylností ke karcinomu prsu – metaanalýza
- Novinky v paliativní systémové terapii análního spinocelulárního karcinomu
- Metabolická plasticita nádorových buněk
- Neurobiológia nádorových chorôb – význam inervácie nádorového tkaniva
- Přímé a nepřímé dopady pandemie COVID-19 na pacienty s nádory plic a pleury – retrospektivní analýza dat pacientů léčených na Klinice nemocí plicních a tuberkulózy FN Brno v době 2. a 3. koronavirové vlny
- Analýza výsledků radioterapie a chemoradioterapie na pozadí imunoterapie pacientů s karcinomem ústní dutiny a orofaryngu
- Meigsův syndrom
- Informace z České onkologické společnosti
- Difuzní velkobuněčný B-lymfom asociovaný s ileocekální intususcepcí v dospělosti
- Remineralizace kosti po paliativní radioterapii
- Aktuality z odborného tisku
- Prof. MUDr. Luboš Petruželka, CSc.
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Meigsův syndrom
- Analýza výsledků radioterapie a chemoradioterapie na pozadí imunoterapie pacientů s karcinomem ústní dutiny a orofaryngu
- Změny N-glykosylací na sérových proteinech při nádorových onemocněních
- Metabolická plasticita nádorových buněk
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



