-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBrachyterapie s vysokým dávkovým příkonem v léčbě časných stadií karcinomu penisu
High-Dose Rate Brachytherapy in the Treatment of Early Stages of Penile Carcinoma
Background:
Interstitial low dose rate brachytherapy is established organ sparing treatment of T1– T2 penile carcinoma. Experience with high-dose rate brachytherapy is limited in this indication.
Materials and methods:
Twenty-six patients with early penile carcinoma were treated by high-dose rate brachytherapy at dose 18 × 3 Gy per fraction twice daily between 2002– 2018 at the Department of Oncology and Radiotherapy, University Hospital in Hradec Kralove. Breast interstitial brachytherapy template was used for fixation and precise geometry reconstruction of stainless hollow needles.
Results:
Median follow up was 85 months (range 7– 200 months). Acute reaction usually consisted of grade 2 mucositis that dissolved during 8 weeks after the treatment. Local recurrence occurred in 6 patients, 5 of them were successfully treated with partial amputation. One patient had a nodal recurrence successfully salvaged by lymphadenectomy. One patient developed necrosis of the glans requiring partial amputation. Currently, there are 24 patients alive without signs of disease. One patient died of cardiac comorbidity, one died of duplicate lung cancer. Nineteen patients have a preserved penis (73%), 18 of them sexually active before treatment report satisfactory intercourse.
Conclusion:
Hyperfractionated interstitial high-dose rate brachytherapy with 18 × 3 Gy per fraction twice daily is a promising method in selected patients with penile carcinoma and deserves further evaluation in a larger prospective study.
Key words
penile neoplasms – conservative treatment – brachytherapy
This work was supported by programm Progres Q40.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 8. 1. 2019
Accepted: 15. 1. 2019
Autoři: D. Pohanková 1; I. Sirák 1; L. Kašaová 1; J. Grepl 1; P. Paluska 1; M. Louda 2
; L. Holub 2; J. Špaček 2; P. Prošvic 3; J. Petera 1
Působiště autorů: Klinika onkologie a radioterapie LF UK a FN Hradec Králové 1; Urologická klinika LF UK a FN Hradec Králové 2; Urologické oddělení, Oblastní nemocnice Náchod 3
Vyšlo v časopise: Klin Onkol 2019; 32(1): 52-57
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko201952Souhrn
Východiska:
Intersticiální brachyterapie s nízkým dávkovým příkonem je ověřená orgán šetřící léčba T1– T2 karcinomu penisu. Zkušenosti s brachyterapií s vysokým dávkovým příkonem jsou v této indikaci limitované.
Materiál a metody:
V období 2002– 2018 bylo na Klinice onkologie a radioterapie LF UK a FN Hradec Králové léčeno 26 pacientů s časným stadiem karcinomu penisu brachyterapií s vysokým dávkovým příkonem dávkou 18 × 3 Gy aplikovanou 2× denně. Mammární intersticiální můstek byl použit k fixaci a precizní geometrii brachyterapeutických aplikačních jehel.
Výsledky:
Medián doby sledování byl 85 měsíců (7 vs. 200 měsíců). Akutní toxicita obvykle spočívala v mukozitidě stupně 2, která zpravidla odezněla do 8 týdnů po léčbě. Lokální recidiva se vyskytla u 6 pacientů, u 5 z nich byla úspěšně léčena parciální amputací. Jeden pacient měl uzlinový relaps úspěšně řešený lymfadenektomií. U jednoho pacienta vznikla postradiační nekróza glandu vyžadující parciální amputaci. V současné době žije 24 pacientů bez známek onemocnění. Jeden pacient zemřel na kardiální komorbiditu, jeden na duplicitní karcinom plic. Celkem 19 pacientů má zachovaný penis (73 %), z toho 18 sexuálně aktivních před léčbou udává plnohodnotný pohlavní styk.
Závěr:
Brachyterapie s vysokým dávkovým příkonem s dávkou 18 × 3 Gy aplikovaných 2× denně je slibná metoda orgán zachovávající léčby u vybraných pacientů s karcinomem penisu a zaslouží si zhodnocení ve větší prospektivní studii.
Klíčová slova
novotvary penisu – konzervativní léčba – brachyterapie
Úvod
Karcinom penisu je ve vyspělých zemích vzácné onemocnění s incidencí 1/ 100 000 obyvatel [1]. V kontrastu s tím je incidence tohoto onemocnění v rozvojových oblastech, kde může dosahovat až 10 % ze všech malignit [2]. Různá incidence může být spojená s rozdílností rizikových faktorů zahrnujících užívání tabákových výrobků, kulturní požadavky na cirkumcizi, sexuální praktiky, hygienu [1,3]. Devadesát pět procent případů tvoří skvamózní karcinom [1]. Incidence karcinomu penisu v ČR v roce 2016 byla dle údajů z Národního onkologického registru 100 nových případů, tj. 1,02 případu na 100 000 obyvatel [4].
Karcinom penisu se objevuje převážně v oblasti glandu a preputia, častější je výskyt u mužů bez předchozí obřízky, na druhé straně i u mužů, jimž byla provedena obřízka, může vzniknout karcinom penisu, většinou v souvislosti s infekcí lidským papilomavirem [5].
Dle recentních doporučení European Association of Urology [6] má být pacientům s lokalizovaným malým (carcinoma in situ, T1– T2) karcinomem nabídnuta přednostně orgán zachovávající léčba – lokální chemoterapie, glans resurfacing, laser u carcinoma in situ a u velmi malých a superficiálních invazivních karcinomů a konečně radioterapie (RT) u ostatních T1– T2 tumorů. Chirurgická léčba spočívá v lokální excizi, parciální glansektomii nebo totální glansektomii. Výběr léčby závisí na velikosti tumoru, histologii, stadiu a gradingu, lokalizaci a preferenci pacienta. V několika málo porovnáních chirurgické léčby a RT jsou výsledky chirurgie mírně lepší. V metaanalýze porovnávající chirurgický zákrok a RT bylo 5leté celkové přežití (overall survival – OS) a lokální kontrola (local control – LC) 76 a 84 % pro chirurgickou léčbu a 73 a 79 % pro RT [7]. RT byla spojena se zachováním orgánu v 74 % a nebyl statisticky signifikantní rozdíl v přežití. Lokální recidivy po RT jsou úspěšně řešeny záchranným chirurgickým výkonem [8].
Karcinom penisu se lymfogenně šíří do uzlin inguinálních a poté pánevních. V případě pTis/ pTa nádorů a u pacientů s pT1G1 nádory je riziko uzlinových metastáz nízké a je možné je pouze sledovat. Pacienti s pT1G2 nádory mají střední riziko a pacienti s pT1G3 a většími nádory s cN0 mají riziko lymfogenní diseminace vysoké a je doporučen chirurgický staging uzlin. U pacientů s hmatnými tříselnými uzlinami je indikováno jejich chirurgické odstranění a v případě pozitivity lymfadenektomie [6].
V RT karcinomu penisu lze využít zevní ozařování nebo brachyterapii (BT) technikou muláže nebo intersticiální aplikace, tj. zavedení zdrojů záření do nádorového ložiska. Preferovaná je intersticiální BT, protože umožňuje dosažení vysokých dávek záření limitovaných přímo na oblast tumoru. Kontraindikací jsou karcinomy > 4 cm a invaze do uretry, protože v těchto případech se neúměrně zvyšuje riziko recidivy a postradiační nekrózy. Publikované práce prokazují excelentní LC se zachováním orgánu a jeho funkce [9– 12]. Převážná většina zkušeností je založena na brachyterapii s nízkým dávkovým příkonem (low dose rate brachytherapy – LDR BT), tj. s dávkovým příkonem 0,45– 0,5 Gy/ h a celkovými dávkami 60– 70 Gy aplikovaných kontinuálně během 6– 7 dnů. LDR BT byla v poslední době vytlačena pulse-dose rate brachyterapií a brachyterapií s vysokým dávkovým příkonem (high-dose rate brachytherapy – HDR BT) s ohledem na pohodlí pacienta, náklady, a především vyšší radiační bezpečnost. V ČR je jedinou současně dostupnou formou HDR BT, která využívá dálkově ovládané afterloadingové přístroje s dávkovým příkonem > 12 Gy/ hod. Důležitou výhodou HDR BT je možnost zlepšení dávkové distribuce v cílovém objemu pomocí počítačové optimalizace pozic radioaktivního zdroje a času, po který v nich setrvává. HDR BT prokázala srovnatelné nebo lepší výsledky v porovnání s LDR BT v řadě situací (intrakavitární BT nádorů hrdla děložního, intraluminární BT nádorových stenóz bronchů či žlučových cest, intersticiální BT nádorů prostaty). Nicméně obecně je přechod od LDR na HDR BT spojen s vyšším rizikem vedlejších účinků, především u intersticiálních aplikací. Zatímco LDR BT se aplikuje v jedné frakci a v jejím průběhu dochází k reparaci zdravých tkání z radiačního poškození, HDR BT se aplikuje frakcionovaně a k reparaci dochází mezi jednotlivými frakcemi. Stanovení počtu frakcí HDR BT a její celkové dávky jsou zásadní podmínkou dosažení srovnatelného efektu na tumor a normální tkáně v porovnání s LDR BT.
Pionýrem využití intersticiální HDR BT u časných karcinomů penisu bylo naše pracoviště, které publikovalo výsledky pilotní studie v roce 2011 [13] na souboru 10 pacientů. Cílem našeho recentního sdělení je aktualizace výsledků s delší dobou sledování a vyšším počtem pacientů.
Materiál a metody
V letech 2002– 2018 bylo na Klinice onkologie a radioterapie LF UK a FN Hradec Králové léčeno intersticiální HDR BT 26 pacientů s histologicky prokázaným spinocelulárním karcinomem penisu. U 9 pacientů byla HDR BT indikována pro recidivu po předchozí léčbě excizí + laseroterapií. Cirkumcize před BT byla provedena u 25 pacientů. Všichni pacienti podstoupili stagingový ultrazvuk pánve a tříselných uzlin nebo vyšetření počítačovou tomografií (computed tomography – CT). Pacienti a charakteristiky nádoru jsou prezentovány v tab. 1.
Tab. 1. Charakteristika souboru pacientů (n = 26). 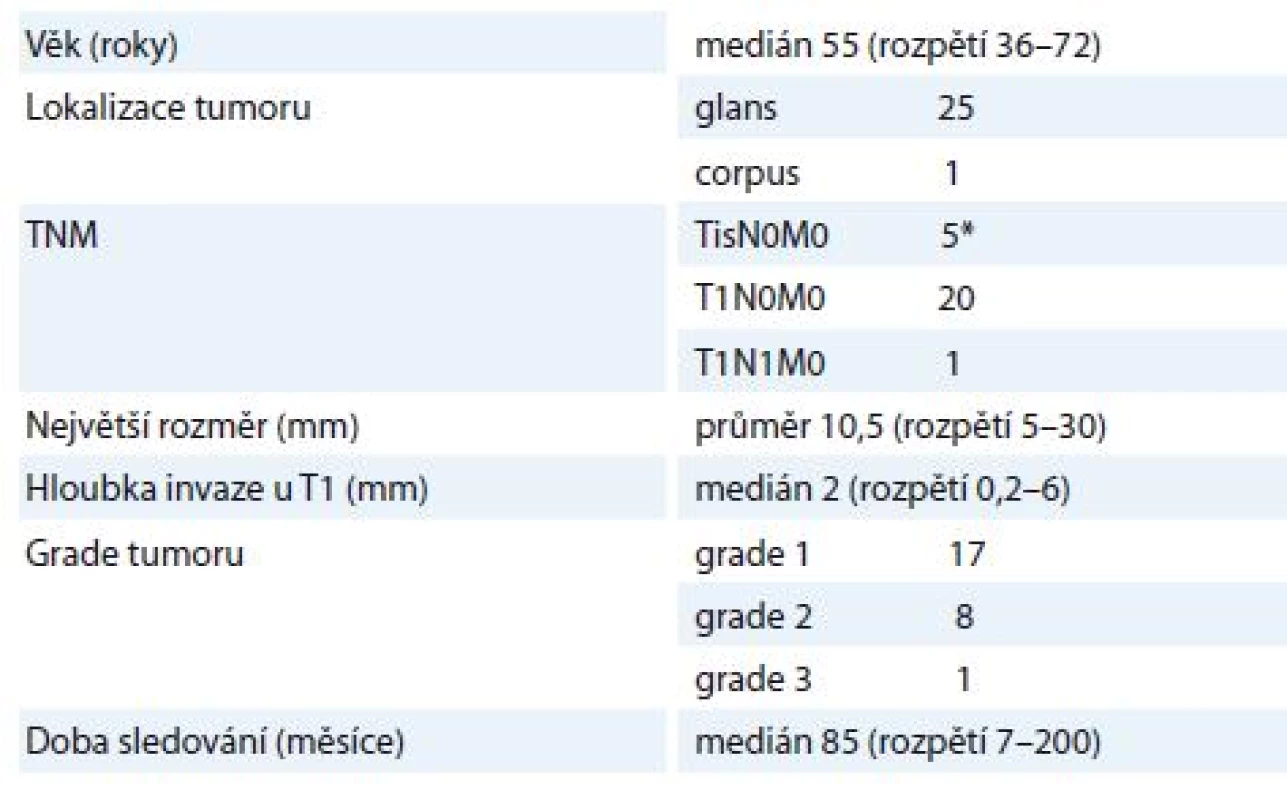
* Důvodem brachyterapie byla recidiva (4×) nebo pozitivní okraje (1×). TNM – klasifi kace tumor–nodes–metastases Jeden pacient s cT1cN0M0 a G2 nádorem podstoupil adjuvantní zevní RT tříselných uzlin. U dvou pacientů byla provedena tříselná lymfadenektomie, u jednoho v čase biopsie a cirkumcize před HDR BT, u druhého s cT1cN1M0 a G1 nádorem po ukončení BT.
Po ukončení léčby byli všichni pacienti sledováni urologem a radiačním onkologem v tříměsíčních intervalech. Součástí každé kontroly byla anamnéza vč. cílených dotazů na urologické a sexuální funkce, klinické vyšetření a ultrazvuk pánve a tříselných uzlin. Závažnost komplikací byla hodnocena dle Common Terminology Criteria for Adverse Events version 4.0. Všichni pacienti podepsali informovaný souhlas s léčbou.
Brachyterapie
Aplikace byla prováděna v celkové anestezii. Cílový objem zahrnoval tumor s bezpečnostním okrajem 0,5– 1 cm. Po zavedení permanentního močového katetru byly aplikovány duté ocelové jehly o průměru 1,6 mm. Jehly byly zavedeny tak, aby jejich minimální vzdálenost od uretry byla 5 mm a aby se celý cílový objem nacházel uvnitř implantátu. U 7 pacientů byla použita jednorovinná, u 12 pacientů dvourovinná a u 7 pacientů trojrovinná aplikace se čtvercovou geometrií a separací 10 mm mezi jehlami. K zajištění přesné fixace jehel a geometrie implantátu jsme použili mammární intersticiální brachyterapeutický můstek. Pro dosažení stabilní pozice penisu během léčby sloužil molitanový límec (obr. 1). Celá procedura trvala přibližně 20– 30 min. K zabránění vzniku pooperačního otoku byly aplikovány kortikoidy intravenózně.
Obr. 1. Aplikace brachyterapie s vysokým dávkovým příkonem karcinomu penisu. 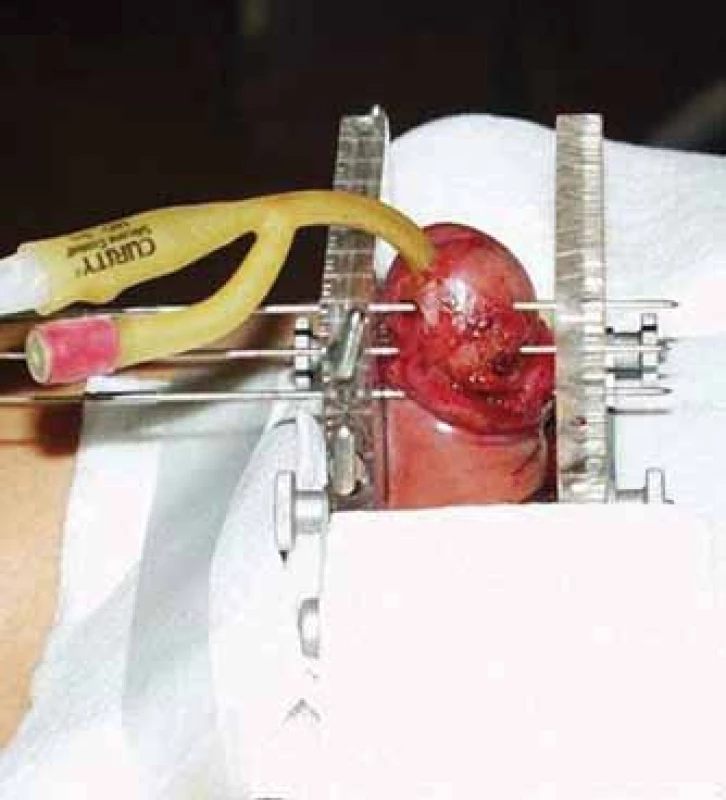
Dávková distribuce byla u prvních 2 pacientů kalkulována v plánovacím systému Abacus GammaMed (GammaMed, Německo), u ostatních v plánovacím systému Brachyvision (Varian, USA). Protože užití CT pro plánování bylo limitováno artefakty ocelových aplikačních jehel, byla měřena vzdálenost mezi destičkami fixačního můstku, mezi špičkou jehel a můstkem, špičkou jehel a jejich výstupem ze sliznice a špičkou jehel a vstupem do sliznice. Délka jehel byla 11 cm a tloušťka fixačních destiček 1 cm. Data byla zadána do plánovacího systému, do programu pro čtvercovou geometrii aplikace se separací radioaktivních linií 1 cm. Referenční bod byl specifikován 5 mm od roviny jehel a na povrchu mukózy. Při výpočtu byla použita geometrická optimalizace a bodové excesivní dávky byly korigovány nástrojem dose shaper.
Předepsaná dávka pro cílový objem byla 18 × 3 Gy 2× denně v 9 dnech s intervalem min. 6 hod mezi frakcemi. Ozáření bylo provedeno HDR automatickým afterloadingovým přístrojem GammaMed (GammaMed, Německo). Vzdálenost jednotlivých kroků iridiového zdroje (dwelling position) byla 3 mm. Detaily BT jsou prezentovány v tab. 2. Brachyterapeutické jehly a močový katetr byly odstraněny bezprostředně po poslední frakci BT.
Tab. 2. Fyzikální charakteristiky brachyterapie. 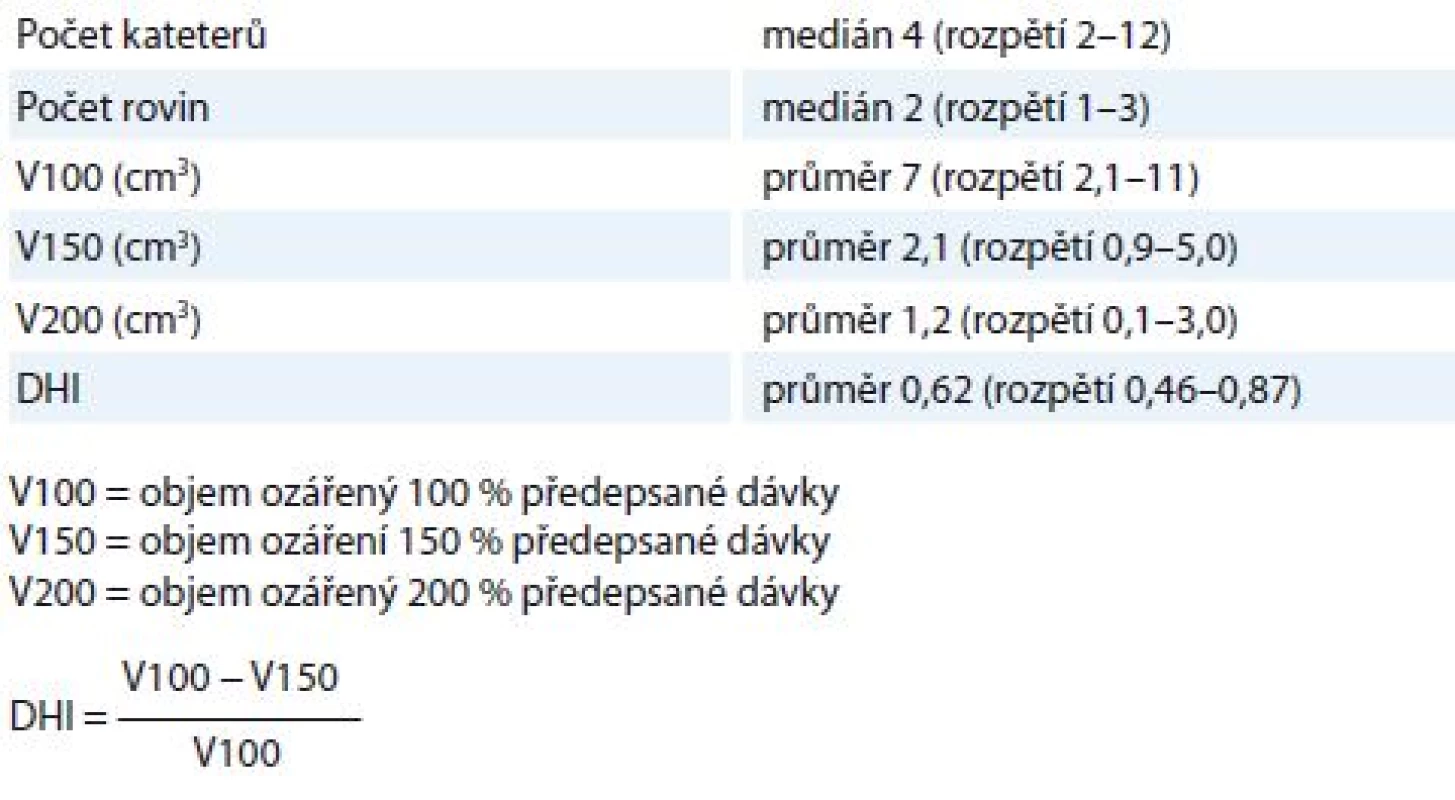
DHI – index dávkové homogenity Výsledky
Intersticiální implantát byl dobře tolerován; všichni pacienti zvládli celou dobu trvání BT bez přerušení. Analgetika byla zapotřebí pouze první den po aplikaci. Všichni pacienti byli schopni po odstranění jehel a močového katetru na konci léčby močit spontánně.
S mediánem sledování 85 měsíců (rozpětí 7– 200 měsíců) se u 6 pacientů vyskytla recidiva na glans penis (23 %), z toho v jednom případě mimo ozařovanou oblast na opačné straně glandu. Medián doby do recidivy byl 32 měsíců (rozpětí 7– 98 měsíců). Pětiletá pravděpodobnost dosažení LC je 83 % (95% CI 67– 98 %) dle Kaplan-Meierova modelu. U pěti pacientů se jednalo o izolovanou lokální recidivu, která byla řešena parciální amputací penisu. Všichni tito pacienti jsou naživu bez známek onemocnění. U jednoho z šesti pacientů byla lokální recidiva spojena s relapsem v tříselných uzlinách. Tento pacient měl T1N0M0 nízce diferencovaný tumor. Pacient podstoupil záchrannou parciální amputaci penisu, lymfadenektomii a pooperační zevní ozáření. Krátce poté zemřel na duplicitní karcinom plic ověřený biopticky. U jednoho pacienta došlo k uzlinovému relapsu bez lokální recidivy. Podstoupil lymfadenektomii a pooperační RT a je naživu bez známek onemocnění po 7 letech od relapsu. Z 26 léčených pacientů je 24 naživu bez známek onemocnění, dva zemřeli, jeden na kardiální komorbiditu a jeden na duplicitní plicní karcinom.
Akutní radiační reakce spočívala obvykle v mukozitidě stupně 2 (obr. 2), která se zhojila do 8 týdnů po léčbě (obr. 3). Pozdní toxicita se vyvinula u sedmi pacientů v podobě postradiačních angiektázií stupně 1 na glandu, uretrální stenózy stupně 1 u dvou pacientů a postradiačního vředu, který musel být řešen parciální amputací glandu, u jednoho pacienta.
Obr. 2. Akutní mukozitida krátce po ukončení brachyterapie. 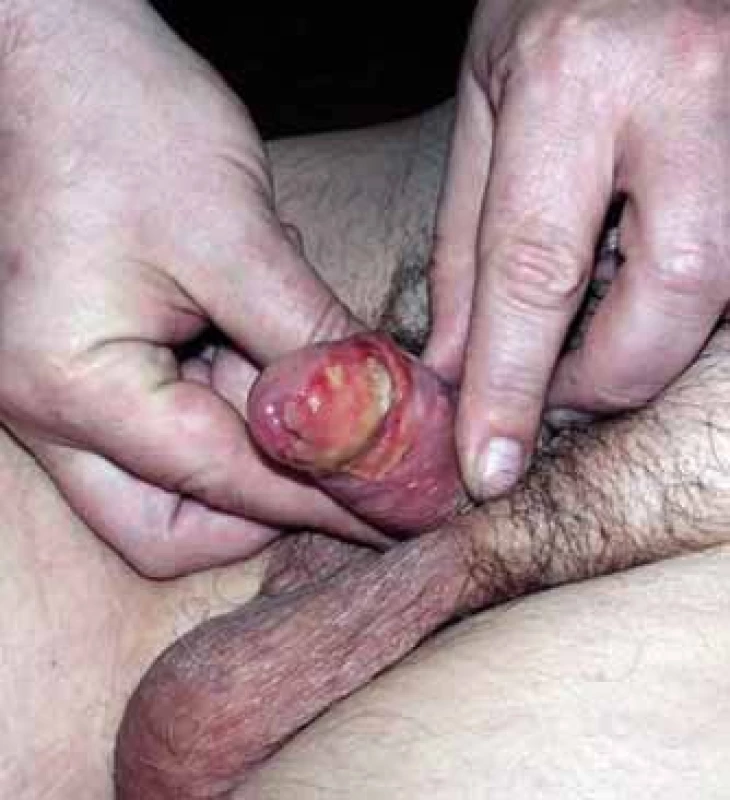
Obr. 3. Definitivní nález s odstupem času od brachyterapie. 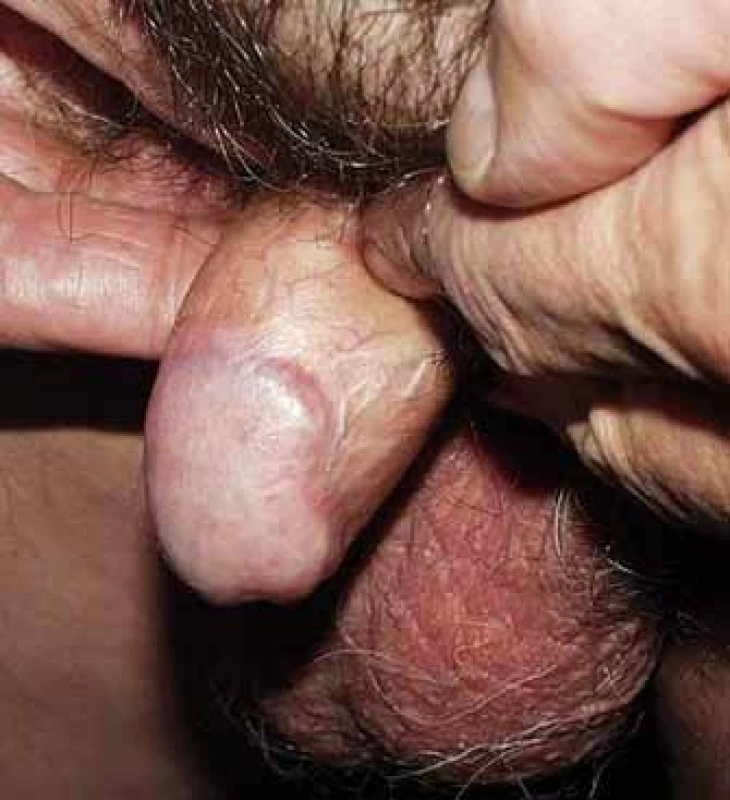
Celkem 19 pacientů žije se zachovaným penisem bez známek tumoru (73 %), což odpovídá 5leté pravděpodobnosti zachování penisu v 85 % případů dle Kaplan-Meierovy analýzy. Z toho 18 pacientů sexuálně aktivních před léčbou hodnotilo kvalitu erekce, frekvenci pohlavního styku a sexuální satisfakci jako stejné ve srovnání se stavem před BT.
Diskuze
LDR BT karcinomu penisu je klinickými studiemi ověřená úspěšná orgán zachovávající metoda v léčbě časných stadií karcinomu penisu s LC 70– 80 %. Hlavní komplikace zahrnují lokální postradiační nekrózu (kolem 20 %) a uretrální stenózu (4– 45 %) [14– 17]. Na řadě pracovišť byla LDR BT nahrazena HDR automatickými afterloadingovými přístroji vzhledem k vyšší radiační bezpečnosti a praktickým výhodám umožňujícím léčit větší objem pacientů. Avšak HDR BT je pro intersticiální BT využívána stále s velkou opatrností vzhledem k teoretickému vyššímu riziku komplikací. V poslední době bylo publikováno několik studií s nadějnými výsledky u nádorů ORL, karcinomu prsu a karcinomu prostaty [18– 20]. Nicméně zkušenosti s intersticiální HDR BT u karcinomu penisu jsou minimální.
Kontinuální LDR BT umožňuje reparaci zdravých tkání v průběhu ozařování a dosažení příznivého terapeutického poměru mezi pravděpodobností kontroly nádoru a rizikem komplikací. S HDR BT reparace DNA probíhá mezi jednotlivými frakcemi, a proto je mezi nimi nutný dostatečný interval, min. 6 hod. HDR BT má vyšší biologický efekt v porovnání s LDR BT, který je více vyjádřen pro pozdně reagující zdravé tkáně než pro tumor. Výsledkem je horší terapeutický poměr. Proto je nezbytné HDR BT frakcionovat a aplikovat vyšší počet frakcí s nízkou jednotlivou dávkou, aby bylo dosaženo biologické ekvivalence s LDR BT. Na základě našich předchozích zkušeností s HDR BT u nádorů jazyka a sarkomů měkkých tkání jsme se rozhodli použít v léčbě karcinomu penisu jednotlivé dávky o velikosti 3 Gy [21,22]. K dosažení celkové délky BT srovnatelné s LDR a k zabránění reproliferace nádorových buněk v průběhu ozařování jsme využili hyperfrakcionovaný režim 2 frakce denně s intervalem 6 hod. Podle lineárně kvadratického modelu je 18 × 3 Gy ve 14 dnech biologicky ekvivalentních s dávkou 66,77 Gy na tumor při LDR 0,5 Gy/ hod v 7 dnech, s mírně vyšší biologickou dávkou na pozdně reagující tkáně (114 vs. 108 Gy). Tato dávka na nádor je v horní části dávkového rozmezí používaného při LDR BT pro karcinom penisu. Medián dávky použití ve studii de Crevoisiera et al [9] byl 65 Gy, dávky publikované Mazeronem et al [23] byly 60– 70 Gy a Delannes et al [14] užili dávky 50– 65 Gy. Parametry, které jsme použili v lineárně kvadratickém modelu, byly α/ β = 10 Gy pro tumor a 3 Gy pro pozdně reagující tkáně; parametr repopulace 0,3/ den pro tumor a 0,01/ den pro pozdně reagující tkáně. Automatický HDR afterloadingový přístroj GammaMed s možností naprogramování pozic miniaturního iridiového zdroje s milimetrovou přesností a využití počítačového plánovacího systému představují fyzikální výhody HDR BT.
Technika intersticiální HDR BT s použitím mammárního intersticiálního můstku pro zabezpečení rigidní fixace brachyterapeutických jehel je jednoduchá a dobře tolerovaná. Protože většina pacientů v našem souboru měla malé nádory s mediánem velikosti 1 cm, byl medián velikosti cílového objemu (V100) pouze 7 cm3 (2,1 vs. 11 cm3). Pro porovnání, medián V100 v de Crevoisierově studii byl 22 cm3 a ve studii Escande et al [24] byl medián V100 27,7 cm3. Index dávkové homogenity (dose homogeneity index – DHI) je důležitým faktorem pro riziko postradiační nekrózy [25]. DHI 0,46 byl v našem souboru spojen se vznikem postradiačního vředu, který bylo nutné řešit amputací. V současné době neakceptujeme DHI < 0,60.
LC onemocnění 83 % v pěti letech v našem souboru je akceptovatelná, podobně jako pětiletá pravděpodobnost zachování penisu u 83 % pacientů, a jsou v souladu s LDR BT studiemi (tab. 3). Recentně publikovaná největší studie LDR BT karcinomu penisu na souboru 201 pacientů [24] uvádí 5letou LC 82 %, 5leté OS 79 % a 5letou pravděpodobnost zachování penisu 85 %.
Tab. 3. Klinické výsledky studií s brachyterapií s nízkým dávkovým příkonem pro karcinom penisu. 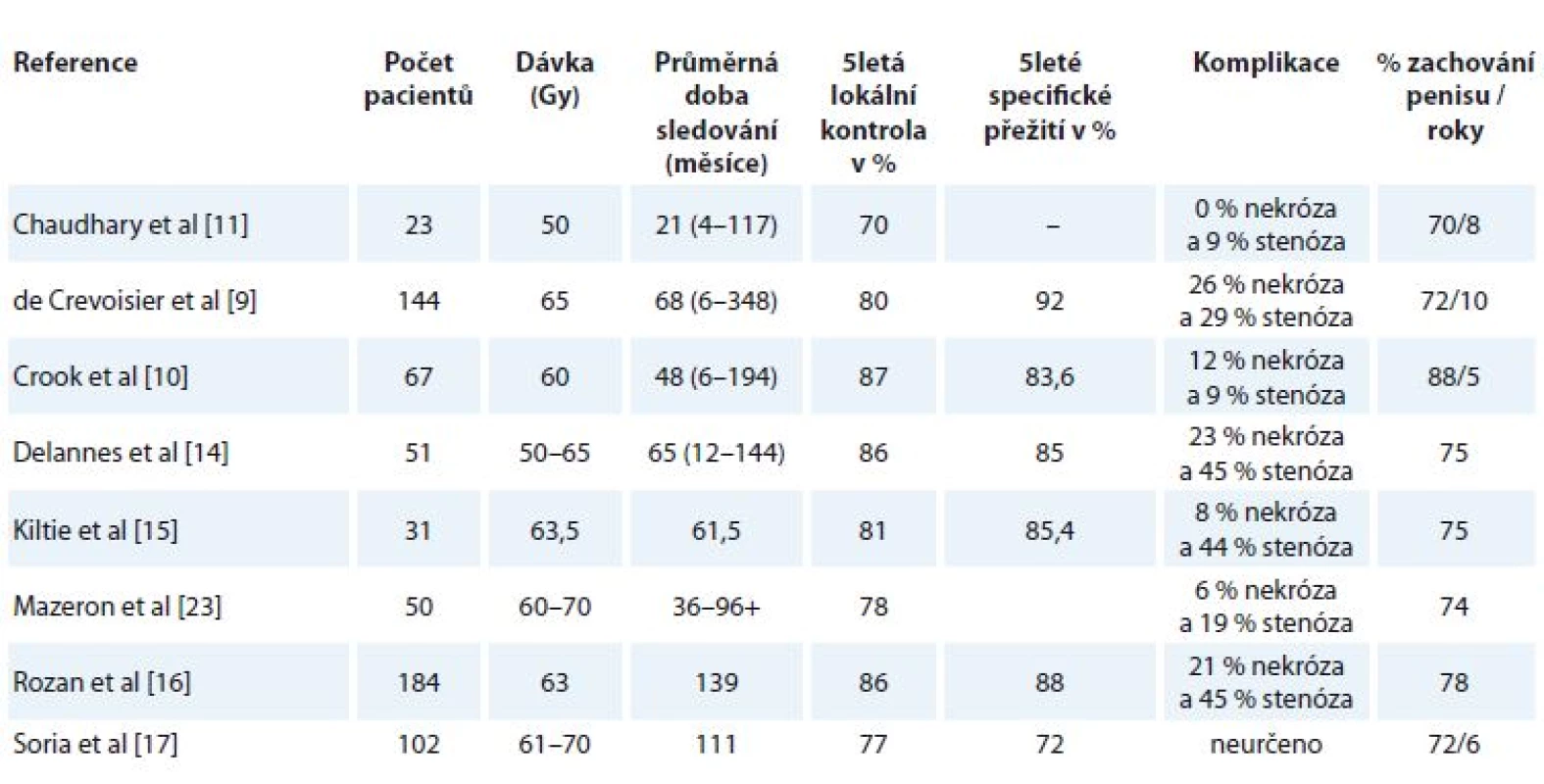
Naše studie zahrnovala 5 pacientů s TisN0M0 nádorem, ve všech případech se jednalo o recidivující či perzistující karcinom po předchozí léčbě a indikace byla v souladu s mezinárodními doporučeními [25]. V jednom případě byla v lokální léčbě použita BT i při N1 onemocnění, po lymfadenektomii je pacient 14,6 roku bez relapsu nádoru.
Akutní toxicita stupně 2 byla přítomna u všech pacientů, je však dobře tolerována a zhojí se do 8 týdnů od BT. Výskyt pozdních komplikací byl příznivý v porovnání s výsledky publikovaných LDR studií, byť je nutné vzít v úvahu nízký počet našich pacientů. Stenóza uretry se objevila jen u 2 pacientů (7,7 %) a byla jen mírného stupně. Postradiační nekrózou byl postižen jen jeden pacient a příčinou byl nízký DHI provedené aplikace.
Řešením je použití dostatečného počtu radioaktivních linií k pokrytí cílového objemu.
Naše pracoviště jako první publikovalo časné výsledky HDR BT karcinomu penisu v roce 2011 na pilotním souboru 10 pacientů. Od té doby byly publikovány pouze 2 další práce na toto téma. Sharma et al [26] použili techniku plastických trubiček a CT plánování u 14 pacientů s T1– T2 nádory a dávku 42– 51 Gy v 14– 17 frakcích 2× denně. S mediánem sledování 22 měsíců 2 pacienti recidivovali. Všichni pacienti měli akutní toxicitu stupně 3, která se zhojila do 6– 8 týdnů, u žádného se nevyvinula stenóza uretry ani nekróza měkkých tkání. Rouscoff et al [27] léčili 12 pacientů HDR BT s dávkou 39 Gy v 9 frakcích během 5 dní. S mediánem follow up 27 měsíců byla pravděpodobnost pětiletého OS bez známek choroby 83 %. Pouze u jednoho pacienta se objevila pozdní toxicita stupně 3 úspěšně léčená hyperbarickou komorou a jeden případ stenózy uretry, která vyžadovala meatotomii.
Porovnání BT a chirurgické léčby bylo předmětem metaanalýzy Hasana et al [7]. Metaanalýza zahrnovala 2 178 pacientů, z nichž 1 505 bylo léčeno chirurgicky, 676 BT. Pětileté OS bylo 76 % ve skupině léčení operací vs. 73 % ve skupině léčené BT, bez statisticky signifikantního rozdílu. Chirurgický výkon byl spojen s vyšší 5letou LC v porovnání s BT (84 vs. 79 %; p = 0,009). Zachování orgánu bylo dosaženo u 74 % pacientů léčených BT. U chirurgicky řešených pacientů ve stadiu I/ II bylo 5leté OS a LC 80 % a 86 %. U pacientů léčených pro totéž stadium BT bylo 5leté OS a LC 79 % a 84 %. Chi-kvadrát test nedemonstroval žádný rozdíl jak pro OS, tak pro LC.
BT nezhoršuje OS u časných stadií karcinomu penisu v porovnání s chirurgickou léčbou a umožňuje zachování plně funkčního orgánu u 70– 80 % pacientů. Lokální recidiva je řešitelná záchranným chirurgickým výkonem stejného rozsahu jako v případě primární chirurgické léčby spojené s mutilací penisu. Bohužel většina urologů u nás provádí amputační výkon, aniž by pacientům nabídla možnost orgán šetřící BT. To je hlavní důvod malého počtu pacientů v našem souboru. Naše dosavadní limitované zkušenosti podporují hypotézu, že hyperfrakcionovaná HDR BT s dávkou 18 × 3 Gy aplikovanou 2× denně je bezpečná a efektivní metoda u selektovaných pacientů s časným stadiem karcinomu penisu a výsledky jsou srovnatelné s LDR BT. Domníváme se, že metoda si zaslouží další výzkum v prospektivní studii s větším počtem pacientů vč. hodnocení kvality života [28].
Závěr
Hyperfrakcionovaná HDR BT s dávkou 18 × 3 Gy aplikovanou 2× denně je slibná metoda léčby u selektovaných pacientů s karcinomem penisu a zaslouží si další zhodnocení ve větší prospektivní studii.
Práce byla realizována za podpory programu Progres Q40.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Igor Sirák, Ph.D.
Klinika onkologie a radioterapie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: igor.sirak@fnhk.cz
Obdrženo: 8. 1. 2019
Přijato: 15. 1. 2019
Zdroje
1. Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin 2017; 67(1): 7– 30. doi: 10.3322/ caac.21387.
2. Korzeniowski MA, Crook JM. Contemporary role of radiotherapy in the management of penile cancer. Transl Androl Urol 2017; 6(5): 855– 867. doi: 10.21037/ tau.2017.07.02.
3. Morrison BF. Risk factors and prevalence of penile cancer. West Indian Med J 2014; 63(6): 559– 560. doi: 10.7727/ wimj.2015.381.
4. Novotvary 2016. Cancer Incidence in the Czech Republic. Praha: ÚZIS ČR 2016.
5. Schoen EJ. The relationship between circumcision and cancer of penis. CA Cancer J Clin 1991; 41(5): 306– 309.
6. Uroweb.org. Penile cancer. European Association of Urology. [online]. Available from: https:/ / uroweb.org/ guideline/ penile-cancer/ .
7. Hasan S, Francis A, Hagenauer A et al. The role of brachytherapy in organ preservation for penile cancer: a meta-analysis and review of the literature. Brachytherapy 2015; 14(4): 517– 524. doi: 10.1016/ j.brachy.2015.03.008.
8. Azrif M, Logue JP, Swindell R et al. External-beam radiotherapy in T1-2 N0 penile carcinoma. Clin Oncol (R Coll Radiol) 2006; 18(4): 320– 325.
9. De Crevosier R, Slimane K, Sanfilippo N et al. Long-term results of brachytherapy for carcinoma of penile confined to the glans (N - or NX). Int J Radiat Oncol Biol Phys 2009; 74(4): 1150– 1156. doi: 10.1016/ j.ijrobp.2008.09.054.
10. Crook J, Ma C, Grimard L. Radiation therapy in the management of the primary penile tumor: an update. World J Urol 2009; 27(2): 189– 196. doi: 10.1007/ s00345-008-0309-5.
11. Chaudhary AJ, Ghosh S, Bhalavat RL et al. Interstitial brachytherapy in carcinoma of the penis. Strahlenther Onkol 1999; 175(1): 17– 20.
12. Gerbaulet A, Lambin P, Haie-Meder C. Brachytherapy in cancer of the penis. Ann Urol (Paris) 1994; 28(6– 7): 206– 311.
13. Petera J, Sirák I, Kašaová L et al. High-dose rate brachytherapy in the treatement of penile carcinoma – first experience. Brachytherapy 2011; 10(2): 136– 140. doi: 10.1016/ j.brachy.2010.05.007.
14. Delannes M, Malavaud B, Douchez J et al. Iridium-192 interstitial therapy for squamous cell carcinoma of the penis. Int J Radiat Oncol Biol Phys 1992; 24(3): 479– 483.
15. Kiltie AE, Elwell C, Close HJ et al. Iridium-192 implantation for node-negative carcinoma of the penis: the Cookridge Hospital experience. Clin Oncol (R Coll Radiol) 2000; 12(1): 25– 31.
16. Rozan R, Albuisson E, Giraud B et al. Interstitial brachytherapy for penis carcinoma: a multicentric survey (259 patients). Radiother Oncol 1995; 36(2): 83– 93.
17. Soria JC, Fizazi K, Piron D et al. Squamous cell carcinoma of the penis: multivariate analysis of prognostic factors and natural history in monocentric study with a conservative policy. Ann Oncol 1997; 8(11): 1089– 1098.
18. Yamazaki H, Inoue T, Yoshida K et al. Brachytherapy for early tongue cancer: low dose rate to high dose rate. J Radiat Res 2003; 44(1): 37– 40.
19. Strnad V, Ott OJ, Hildebrandt G et al. 5-year result of accelerated partial breast irradiation using sole interstitial multicatheter brachytherapy versus whole-breast irradiation with boost after breast– conserving surgery for low-risk invasive and in-situ carcinoma of the female breast: a randomised, phase 3, non-inferiority trial. Lancet 2016; 387(10015): 229– 238. doi: 10.1016/ S0140-6736(15)00471-7.
20. Scopus-com. Soumarova R, Homola L, Perkova H et al. Interstitial HDR boost in the treatment of localized prostate carcinoma – our results. [online]. Available from: https:/ / www-scopus-com.ezproxy.is.cuni.cz/ record/ display.uri.
21. Petera J, Dolezel M, Jirousek Z et al. High dose rate brachytherapy in the treatment of oral cancer – the preliminary one institution experience. Neoplasma 2006; 53(3): 232– 236.
22. Petera J, Soumarova R, Ruzickova J et al. Perioperative hyperfractionated high-dose rate brachytherapy for the treatment of soft tissue sarcomas: multicentric experience. Ann Surg Oncol 2010; 17(1): 206– 210. doi: 10.1245/ s10434-009-0684-1.
23. Mazeron JJ, Langois D, Lobo PA et al. Interstitial radiation therapy for carcinoma of the penis using iridium 192 wires: the Hanri Mondor experience (1970– 1979). Int J Radiat Oncol Biol Phys 1984; 10(10): 1891– 1895.
24. Escande A, Haie-Meder C, Mazeron R et al. Brachytherapy for conservative treatment of invasive penile carcinoma: prognostic factors and long-term analysis of outcome. Int J Radiat Oncolo Biol Phys 2016; 99(3): 563– 570. doi: 10.1016/ j.ijrobp.2017.02.090.
25. Crook JM, Haie-Meder C, Desmanes DJ et al. American Brachytherapy Society-Groupe Européen de Curiethérapie-European Society of Therapeutic Radiation Oncology (ABS-GEC-ESTRO) consensus statement for penile brachytherapy. Brachytherapy 2013; 12(3): 191– 198. doi: 10.1016/ j.brachy.2013.01.167.
26. Sharma DN, Joshi NP, Gandhi AK et al. High dose rate interstitial brachytherapy for T1– T2 stage penile carcinoma: short-term results. Brachytherapy 2014; 13(5): 481– 487. doi: 10.1016/ j.brachy.2014.06.003.
27. Rouscoff Y, Falk AT, Durand M et al. High-dose rate brachytherapy in localized penile cancer: short-term clinical outcome analysis. Radiat Oncol 2014; 9 : 142. doi: 10.1186/ 1748-717X-9-142.
28. Doležalová H, Blechová N, Petera J. Kvalita života pacientů s časnými nádory dutiny ústní léčených pooperační brachyterapií s vysokým dávkovým příkonem pro těsné nebo pozitivní okraje. Klin Onkol 2018; 31(2): 125– 129. doi: 10.14735/ amko2018125.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Extrakraniální stereotaktická radioterapie – přehled současných indikací
- Mají subtypy HER2 pozitivního karcinomu prsu význam pro klinickou praxi?
- Zhubné nádory penisu – diagnostika a liečba
- Plazmocelulární leukemie – zapomenutá nemoc
- Epidemiologie plazmocelulární leukemie v České republice
- Karcinom penisu – podceňovaná diagnóza?
- Brachyterapie s vysokým dávkovým příkonem v léčbě časných stadií karcinomu penisu
- Vliv velikosti nádorové masy a stavu p16 na léčebné výsledky – dosažení kompletní remise u prospektivně sledovaných pacientů s nádory orofaryngu
- Rozvoj rezistentní GvHD u pacientky léčené nivolumabem pro relaps Hodgkinova lymfomu po alogenní nepříbuzenské transplantaci
- Účinná imunoterapie glioblastomu u adolescenta se syndromem konstitučního deficitu v mismatch repair opravném systému
- Aktuality z odborného tisku
- Onkologie v obrazech - Efekt radioterapie u inoperabilního karcinomu kůže
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zhubné nádory penisu – diagnostika a liečba
- Extrakraniální stereotaktická radioterapie – přehled současných indikací
- Vliv velikosti nádorové masy a stavu p16 na léčebné výsledky – dosažení kompletní remise u prospektivně sledovaných pacientů s nádory orofaryngu
- Mají subtypy HER2 pozitivního karcinomu prsu význam pro klinickou praxi?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



