-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití terapeutické aferézy v dermatologii
The Use of Therapeutic Apheresis in Dermatology
The article provides an overview of therapeutic apheresis methods treatment options in dermatology. Therapeutic apheresis has been successfully used in severe autoimmune bullous disease, especially immunoadsorption in pemphigus vulgaris and epidermolysis bullosa acquisita. The reduction of the IgE level in severe atopic dermatitis has been a new indication. Extracorporeal photochemotherapy is an important method in the treatment of skin T lymphomas. Cytapheresis has been tested in psoriasis. The experience with these methods in dermatologic diseases in the Czech Republic is limited.
Keywords:
atopic dermatitis – therapeutic apheresis – immunoadsorption – photochemotherapy – pemphigus – pemphigoid
Autoři: H. Jedličková
Působiště autorů: Dermatovenerologické oddělení FN Brno, primářka MUDr. Olga Faustmannová, Ph. D., MBA
Vyšlo v časopise: Čes-slov Derm, 95, 2020, No. 3, p. 100-106
Kategorie: Terapie, farmakologie a klinické studie
Souhrn
Článek podává přehled možností léčby metodami terapeutické aferézy v dermatologii. Terapeutická aferéza byla s úspěchem použita u těžkých autoimunitních bulózních onemocnění, zejména imunoadsorpce u pemphigus vulgaris a epidermolysis bullosa acquisita. Novou indikací je snížení hladiny IgE u těžké atopické dermatitidy. Extrakorporální fotochemoterapie je důležitou metodou terapie kožních T lymfomů. Cytaferéza je zkoušena u psoriázy. V České republice zatím s těmito metodami u kožních onemocnění existují omezené zkušenosti.
Klíčová slova:
terapeutická aferéza – imunoadsorpce – fotochemoterapie – pemfigus – pemfigoid – atopická dermatitida
ÚVOD
Terapeutická aferéza (TA) zahrnuje několik typů technik, které odstraňují z krevního řečiště nežádoucí látky nebo buňky adsorpcí nebo filtrací na nosič v extrakorporálním oběhu. Počátky metody leží v devadesátých letech minulého století. Pomocí TA lze odstranit imunoglobuliny a cirkulující imunokomplexy (imunoadsorpce), látky s vysokou molekulovou hmotností jako lipoproteiny (lipoproteinová aferéza) nebo fibrinogen (reoferéza), buňky (leukocytaferéza, erytrocytaferéza, trombocytaferéza) aj. [23]. Patří sem i výměnné metody – výměnná plazmaferéza a imunomodulační výkony – extrakorporální fotochemoterapie.
Léčby pomocí TA se využívá u širokého spektra indikací, např. v transplantologii u desenzitizace před samotnou transplantací a léčby akutní humorální rejekce po transplantaci srdce, jater, ledvin, plic (protilátky proti HLA ale i AB0 antigenům); v neurologii při Guillainově-Barrého syndromu, myastenia gravis, při akutní diseminované encefalomyelitidě, demyelinizující polyradikulopatii, paraproteinemické demyelinizující neuropatii; u interních chorob při dilatační kardiomyopatii (protilátky proti beta1 adrenergnímu receptoru), hemolytické anemii, trombocytopenické purpuře aj. K dalším indikacím TA patří například hyperlipoproteinémie (lipoproteinová aferéza), věkem podmíněná makulární degenerace, poruchy mikrocirkulace (rheoferéza), morbus Crohn a ulcerózní kolitida (leukocytaferéza) a řada dalších [23, 27].
U dermatologických onemocnění je důležité především použití TA s odstraněním imunoglobulinů, tzv. imunoaferéza neboli imunoadsorpce (IA) u autoimunitních bulózních onemocnění a nově u atopické dermatitidy. Vzhledem k selektivitě adsorpce a šetrné separaci krevních elementů se neodstraní ostatní plazmatické proteiny, neaktivuje se bradykininová dráha, nežádoucí účinky jsou tak minimální (pokles tlaku, poruchy koagulace). Neselektivní metodou je terapeutická plazmaferéza (TPE), u které dochází k výměně určitého objemu plazmy. Ztrátu plazmy je nutno nahradit (mražená plazma dárce, albumin). TPE byla použita u systémové sklerodermie, Schönlein Henochovy purpury, toxické epidermální nekrolýzy a dermatomyozitidy. Používá se i u bulózních onemocnění, oproti IA je neselektivní. TPE jsou léčena i další onemocnění, která mají kožní příznaky, jako systémový lupus erythematosus s nefritidou, katastrofický antifosfolipidový syndrom, vaskulitidy s protilátkami proti cytoplazmě neutrofilů (ANCA). Další metodou, kterou lze využít v dermatologii je extrakorporální fotochemoterapie (ECP), indikovaná u Sézaryho syndromu, GVHD (graft versus host onemocnění), skleromyxedému aj. Při ECP se separují lymfocyty a monocyty, které se senzibilizují psoraleny a následně ozáří UVA. U psoriázy s artritidou a u pustulózní psoriázy byla použita cytaferéza s adsorpcí granulocytů a monocytů, se snížením produkce zánětlivých cytokinů [4].
Přehled dermatologických indikací, který je zpracován podle posledních Doporučení Americké společnosti pro aferézu pro využití terapeutické aferézy v praxi, je uveden v tabulce 1 [23].
Tab. 1. Přehled dermatologických indikací podle Doporučení Americké společnosti pro aferézu pro využití terapeutické aferézy v praxi 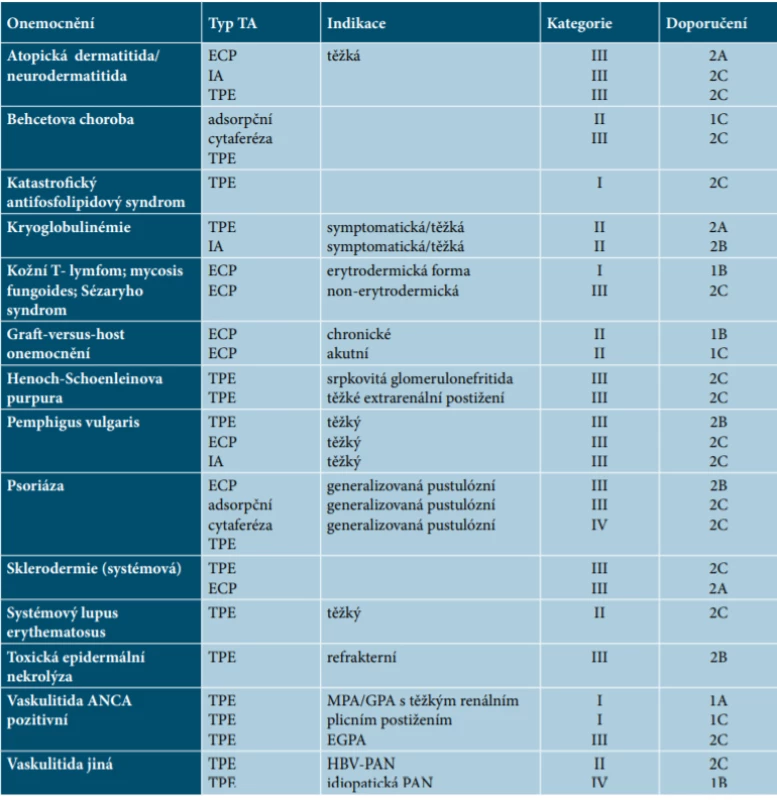
Kategorie I – onemocnění, u kterých patří TA do první linie terapie
Kategorie II – onemocnění, u kterých TA patří do druhé linie terapie
Kategorie III – optimální využití TA nebylo stanoveno, vyžaduje individuální přístup
Kategorie IV – rozporuplné publikace o efektivitě metody
Stupně doporučení
1A – silné doporučení, kvalitní důkazy;
1B – silné doporučení, středně kvalitní důkazy;
1C – silné doporučení, slabé důkazy 2A – slabé doporučení, silné důkazy; 2B – slabé doporučení, středně silné důkazy; 2C – slabé doporučení, slabé důkazy ECP – extrakorporální fotoferéza TA – terapeutická aferéza – zahrnuje všechny výkony – depleční, výměnné, imunomodulační IA – imunoaferéza/imunoadsorpceIMUNOADSORPCE U AUTOIMUNITNÍCH BULÓZNÍCH ONEMOCNĚNÍ
Autoimunitní bulózní dermatózy (AIBD) – přehled
Autoimunitní bulózní onemocnění patří mezi nejzávažnější kožní onemocnění, výrazně zhoršují kvalitu života, zkracují přežití a jsou i příčinou úmrtí pacienta. V organismu dochází k tvorbě autoprotilátek proti antigenům epidermis a bazální membrány. Titr těchto protilátek souvisí s aktivitou choroby a je prokázáno, že protilátky se podílí na patofyziologii onemocnění.
Skupina pemfigu, s tvorbou intraepidermálního puchýře zahrnuje jednotky pemphigus vulgaris (PV), pemphigus vegetans, pemphigus foliaceus a pemphigus erythematosus. Extrémně vzácný je paraneoplastický pemfigus (PNP) s těžkým průběhem, který se objevuje u zhoubných onemocnění krvetvorby.
Pemphigus vulgaris je vzácné autoimunitní puchýřnaté onemocnění, vyskytuje se zhruba v počtu 6 nových případů na milion obyvatel za rok, v České republice je incidence o něco nižší než jinde ve světě. Postihuje muže i ženy rovnoměrně, objevuje se po 30. roku života, nejčastěji kolem čtyřicítky. Terapie pemfigu se volí podle formy onemocnění a podle rozsahu, v současnosti existují doporučené standardy léčby [20]. Lékem první volby jsou kortikosteroidy (KS) ve vysokých dávkách (úvodní dávka 1,0–1,5 mg/kg/d), kombinované proto s adjuvantní kortikosteroidy-šetřící terapií imunosupresivy. První volbou je mykofenolát mofetil (MMF) nebo azathioprin, dále se používá cyklofosfamid, metotrexát a dapson. V terapii první linie je nyní prosazován rituximab pro svůj razantní účinek v počátcích léčby [20]. Aktivitu onemocnění modulují i čištěné imunoglobuliny. Další léčebnou možností je imunoadsorpce. IA snižuje významně titry protilátek a urychluje remisi onemocnění.
Skupina pemfigoidu s tvorbou subepidermálního puchýře zahrnuje bulózní pemfigoid, jizvící pemfigoid, anti-p200 pemfigoid, IgA lineární dermatózu, pemphigoid gestationis a další subepidermální dermatózu epidermolysis bullosa acquisita.
Bulózní pemfigoid je autoimunitní bulózní dermatóza s tvorbou protilátek proti antigenům hemidesmozomů v bazální membráně. Onemocnění je nejčastější AIBD v Evropě, jeho incidence stále stoupá, z 6 pacientů/milion obyvatel před 20 lety na 20 pacientů/milion obyvatel v současnosti. Onemocnění se váže na vysoký věk, ve věkové skupině nad 70 let je incidence až 200 případů na milion obyvatel za rok [11]. Ve většině případů je onemocnění asociováno s neurodegenerativními onemocněními vysokého věku, asi ve 13 % s neoplaziemi, možná je i indukce léky. Bulózní pemfigoid reaguje dobře na kortikosteroidy (utlumení zánětlivé aktivity), starší pacienti ale mají velmi často nežádoucí účinky léčby, proto se používají KS v nižší dávce do 0,7mg/kg/den a kombinují s imunosupresivy (azathioprin, metotrexát, dapson, mykofenolát mofetil). Důležitá je i lokální KS terapie. Aferéza by byla vhodná pro pacienty s těžkým nebo refrakterním onemocněním, při indikaci je nutno zohlednit další komorbidity a kvalitu života, např. podle Karnofského skóre.
Anti-p200 pemfigoid je klinicky podobný BP nebo EBA, jako cílový antigen byl nedávno identifikován gama řetězec lamininu 1.
Pemphigoid gestationis je vzácnou variantou pemfigoidu v těhotenství. TA byla použita u refrakterních případů.
Jizvící slizniční pemfigoid je vzácné onemocnění, které postihuje především sliznice, a to dutiny ústní, spojivky, nazofaryngu, laryngu, ezofágu, genitálu. Ohrožuje pacienta jizvením a stenózami, při očním postižení může skončit slepotou. Aferéza je vhodná u refrakterních případů [8].
Lineární IgA dermatóza je vzácné onemocnění s kožním i slizničním postižením. Vyskytuje se v dětském věku, u dospělých může být vyvoláno léky. Aferéza byla s úspěchem použita u refrakterního onemocnění [13].
Epidermolysis bullosa acquisita (EBA) je vzácné autoimunitní bulózní onemocnění s tvorbou subepidermálního puchýře s protilátkami zaměřenými proti kolagenu VII, který je součástí kotvících fibril pod bazální membránou. EBA má dvě základní formy – nezánětlivou, s fragilní kůží, upomínající vrozené epidermolýzy, a formu zánětlivou, která je podobná bulóznímu pemfigoidu. EBA může být asociována s dalšími onemocněními, především onemocněním střev a diabetem. V terapii se používají KS, imunosupresiva (mykofenolát mofetil, azathioprin, cyklosporin, cyklofosfamid), kolchicin, dapson, rituximab, intravenózní imunoglobuliny. EBA je velmi špatně terapeuticky ovlivnitelná, často je rezistentní na terapii, aferéza je pak důležitou terapeutickou možností.
Princip imunoadsorpce
Imunoadsorpce snižuje hladiny sérových autoprotilátek v krvi adsorpcí na nosič v mimotělním oběhu. Pacient má zajištěn žilní přístup, separátor filtrací nebo centrifugací oddělí krvinky a destičky od plazmy, ta potom prochází adsorpční kolonou, ve které se specificky naváží imunoglobuliny převážně třídy IgG. Jako antikoagulační roztok se přidává citrát, ale i heparin nebo kombinace obojího. Ošetřená plazma i s krevními elementy se pak vrací do krevního řečiště, nedochází tedy ke ztrátě objemu. U imunoadsorpčních kolon s proteinem A se s vysokou afinitou navazuje IgG1,2,4, s nižší afinitou i IgG3, IgM a IgA. IA se provádí v několika cyklech, ve kterých se redukuje množství cirkulujících protilátek až o 90 %. Opakované použití odstraňuje i protilátky vyplavené z tkání a protilátky nově vytvořené [19]. Kolony pro imunoadsorpci jsou buď jednorázové, nebo pro opakované použití, které je možno použít u jednoho pacienta až 20krát během jednoho roku. Jednorázová kolona pro adsorpci IgG se během terapie regeneruje a je s ní možné léčit až 6 litrů plazmy. Namísto toho jednorázová kolona pro adsorpci IgE se používá maximálně do „vysycení“ vazebných míst, což odpovídá asi 2násobku plazmatického objemu pacienta. Kolony pro adsorpci IgG a pro opakované použití jsou párové a střídavě regenerují během cyklu, který se ukončí při požadovaném objemu plazmy. Je možné vyčistit až tři objemy plazmy během jedné terapie. Jako adsorber se používá protein A, tryptofan, syntetický peptid GAM, ovčí protilátky proti lidským imunoglobulinům aj., jako matrix sefaróza, celulóza nebo polyvinyl alkohol [5, 29]. IA je selektivní pro jednotlivé třídy imunoglobulinů, v budoucnu by mělo být možné navazovat přímo specifické autoprotilátky, např. proti desmogleinu 3 u pemfigu, což je zatím možné pouze experimentálně [7].
Indikace imunoadsorpce
Základní indikací IA v dermatologii je použití u těžkého pemphigus vulgaris. Imunoadsorpce byla s úspěchem použita i u kortikorezistentního pemphigoid gestationis, těžkého bulózního pemfigoidu, slizničního pemfigoidu, pemphigus foliaceus a paraneoplastického pemfigu.
Podle aktuálních světových doporučených postupů je imunoadsorpce indikována u bulózních onemocnění jako kortikosteroidy-šetřící terapie druhé linie, pokud je dostupná [20]. V první linii je indikována u závažných urgentních stavů [29]. Konsenzuální mítink německých, rakouských a švýcarských specialistů používajících imunoaferézu z roku 2007 doporučil IA jako léčbu první linie u pacientů s pemfigem nebo EBA s akutním a těžkým onemocněním (postižení více než 30 % povrchu těla, nebo více než 25 % povrchu sliznic včetně spojivky a ezofágu) [33]. Diagnóza musí být potvrzena klinickým obrazem, imunofluorescenčním vyšetřením kůže a detekcí protilátek (nepřímá imunofluorescence, ELISA). U pacientů s ostatními bulózními onemocněními je doporučena IA u refrakterních onemocnění s trváním déle než 3 měsíce, která nereagují alespoň na dvě adekvátní imunosupresivní terapie. IA by se měla provádět ve specializovaných aferetických centrech nejlépe s hospitalizací pacienta. Kvůli vyššímu riziku infekcí je dávána přednost funkčnímu perifernímu vstupu před centrálními venózními katétry. Kontraindikací IA jsou závažné systémové infekce, známá hypersenzitivita na materiál kolony, závažné srdeční selhání, krvácivost při antikoagulační terapii, léčba ACE inhibitory (vysadit alespoň 72 hodin před aferézou), u dětí hmotnost pod 15 kg [29].
V současnosti doporučovaných schématech se provádí IA v indukční fázi 3–4krát ve dnech jdoucích po sobě. Další postup závisí na klinickém zlepšení pacienta. IA je možná v týdenních i měsíčních intervalech ve 3–4 dnech, po dobu 1–2 let. Ukončuje se při zhojení 90 % lézí [28]. Pacienti mají standardně KS v klesající dávce, kombinované s imunosupresivy. Je nutno monitorovat titr autoprotilátek po každé IA.
PUBLIKOVANÉ REŽIMY IMUNOADSORPCE
Pemphigus vulgaris
U PV jsou zatím největší zkušenosti a bylo publikováno několik režimů IA. V zásadě se IA v úvodu provádí 2–4 dny po sobě, další cykly pak následují po týdnu, pak v intervalech 2, 3, 4 týdny, do zhojení v řádech měsíců. IA je vždy kombinována s kortikosteroidy a imunosupresivy, ve dvoj - i trojkombinaci. Imunosupresivní terapie je nutná k potlačení nové tvorby autoprotilátek, zvyšuje ale výskyt komplikací. KS se používají v dávkách methylprednisolon 0,5–2 mg/kg den, případně dexamethason v pulzech 100 mg/den. Jako imunosupresivum se používá cyklofosfamid 500–750 mg/m2 v pulzu, rituximab 375 mg/m2 nebo 1 g/den v pulzech, azathioprin 50–250 mg/d nebo MMF 2 g/d. V některých režimech se podávají i intravenózní imunoglobuliny [2, 3,17, 25, 26, 28].
Uvádíme jako příklad protokol u pemfigu, používaný v Německu [29]:
- aferéza – první třídenní cyklus, další cyklus po třech týdnech, další cykly po 4 týdnech, dokud se nezhojí 90 % lézí a protilátky v séru neklesnou na 10 % původní hladiny;
- rituximab 2krát 1 g den 4. a den 25.;
- dexamethason v pulzu 100 mg vždy 3 dny spolu s aferézou (místo prednisonu);
- azathioprin 2,5 mg/kg/d nebo MMF 2 g/d.
Efekt autoři hodnotili jako velmi dobrý.
Refrakterní bulózní pemfigoid, pemphigoid gestationis, anti-p200 pemfigoid a jizvící pemfigoid
U pacientů s refrakterním a těžkým pemfigoidem byla IA použita v krátkých schématech – v jednom dvoudenním cyklu, v dvoutýdenním cyklu se 4 nebo 6 aferézami. U všech případů došlo k rychlému zlepšení kožního nálezu a poklesu autoprotilátek [6, 9, 10, 21]. Ve velkém souboru 20 pacientů s těžkým nebo refrakterním pemfigoidem byl použit jeden třídenní cyklus s rychlým klinickým efektem, poklesem protilátek a přetrváváním efektu několik měsíců [14]. U pacienta s anti-p200 pemfigoidem byly použity 2 aferézy v kombinaci s doxycyklinem. Remise nastoupila rychle, ale trvala pouze 18 týdnů. Onemocnění exacerbovalo 2 týdny po vysazení doxycyklinu [12].
Zajímavé je použití IA u pemphigoid gestationis (PG). U pacientky s PG, která nereagovala na methylprednisolon 1 mg/kg/den byla použita aferéza v 6 sezeních mezi 30. a 34. týdnem gravidity s dobrým efektem [32]. U další pacientky s PG, která nereagovala na 60 mg prednisolonu denně byla použita IA v 10 sezeních během 4 týdnů s výborným efektem [31]. U pacientky s refrakterním PG byla terapie kortikosteroidy doplněna 15 IA se zlepšením stavu [18]. U jizvícího anti-laminin 332 pemfigoidu byla s úspěchem použita aferéza v kombinaci s rituximabem u pacienta, který nereagoval na pulzy cyklofosfamidu a dexamethasonu [24].
Epidermolysis bullosa acquisita
U inflamatorní EBA bylo použito protokolu u pemfigu s methylprednisolonem a azathioprinem, s IA 3 dny, pak 4krát po týdnu, 2, 3 týdnech dále po 4 týdnech; po 37 aferézách bylo dosaženo klinické remise při minimální dávce prednisonu. U mechanobulózní varianty byla použita aferéza ve dvou dnech v kombinaci s rituximabem a mykofenolát mofetilem s dosažením částečné remise [22, 29].
Nežádoucí účinky imunoadsorpce
Dokumentované nežádoucí účinky u IA byly řídké – hluboká flebotrombóza, perforující divertikulitida (neprokázána souvislost s IA), epizoda hypotenze a bradykardie, anafylaktická reakce, stafylokoková kanylová sepse, parestezie rukou a rtů s úlevou po aplikaci kalcia. Vyšší výskyt se objevil jen u protokolu s IA, rituximabem, vysokými dávkami methylprednisolonu, s azathioprinem nebo mykofenolát mofetilem, kde se vyskytly u 4 ze 7 pacientů (stafylokoková sepse, pneumocystis carinii pneumonie, herpes zoster, hluboká flebotrombóza, plicní embolie) [26]. Ve studii Tselmina se ve skupině 52 pacientů infekční komplikace vyskytly u 4 pacientů (7,7 %), kteří užívali další imunosupresivní terapii [30]. Kolesnik popsal kombinaci IA s rituximabem a nízkou dávkou KS u 15 pacientů s AIBD s výborným efektem a nízkým počtem nežádoucích účinků [16].
IMUNOADSORPCE U ATOPICKÉ DERMATITIDY
V dermatologii je aferéza používána též k redukci vysokých hladin IgE u atopické dermatitidy. Atopická dermatitida (AD) postihuje asi 15–30 % dětí a 2–10 % dospělých v rozvinutých zemích. Komplex atopických onemocnění zahrnuje dále astma bronchiale, alergickou rýmu a konjunktivitidu. Základem léčby AD je lokální terapie, u těžších forem se používá světloléčba, systémově cyklosporin, omezeně kortikosteroidy. Ke snížení hladin se používá anti-IgE protilátka omalizumab, terapeutické možnosti rozšířil nejnověji dupilumab, protilátka proti alfa podjednotce receptoru pro IL4.
IA má využití u těžké atopické dermatitidy, s vysokými hodnotami IgE (> 3500 kU/l). Cílem je snížení hladin IgE a současné klinické zlepšení atopické dermatitidy. Podle zatím dostupných zkušeností v průběhu IA dochází ke zlepšení klinického obrazu, po jejím ukončení se ale opět stav zhoršuje.
Ve studii Zinka et al. byla použita IgE imunoadsorpce v kombinaci s omalizumabem, s dobrým ale krátkodobým efektem. V této studii byla provedena imunoadsorpce 2–4krát ve dnech jdoucích po sobě a následně byl aplikován omalizumab 450 mg s. c. ve dvoutýdenních intervalech po dobu 24 týdnů. Byla použita adsorpční kolona vázající lidské imunoglobuliny včetně IgE. Volné IgE protilátky byly redukovány na 36 ± 23 % výchozího stavu po aferéze, po 24týdenní aplikaci omalizumabu u poloviny pacientů dosáhly normálních hodnot (< 150 kU/l). Během sledování dalších 24 týdnů se ale vrátily téměř na původní hodnoty. Hodnoty TARC (thymus and activation regulated chemokine – CCL17) se po aferéze mírně zvýšily, v dalším průběhu terapie klesly. Klinický stav koreloval s výší hladin IgE. Hodnoty SCORAD klesly během terapie na polovinu (59,9 na 27,2) [35]. Zřejmě bude třeba hledat optimální schéma kombinované terapie, které by zajistilo trvalejší klinický efekt. Studie s omalizumabem samotným nemají jednoznačné výsledky, selhává u pacientů s extrémně vysokými hladinami IgE. U těchto pacientů by IA měla významně posílit snížení IgE hladin. Recentní studie Kasperkiewicze et al. s novou specifickou anti-IgE adsorpční kolonou ve schématu dva cykly 5denní IA s odstupem 3 týdnů ukázala významnou redukci IgE a zlepšení klinického nálezu, které přetrvávalo ještě 6 měsíců po IA [15].
Nežádoucí účinky byly mírné, pacienti popisovali bolest hlavy, uzlin, závrať, únavu, bylo detekováno zvýšení transamináz.
Extrakorporální fotochemoterapie
Extrakorporální fotochemoterapie (ECP) je metoda používaná od osmdesátých let minulého století v terapii kožních lymfomů, u akutní i chronické GVHD, skleromyxedému aj. U ECP jsou separovány lymfocyty a monocyty pacienta. Ty se inkubují s 8-methoxypsoralenem (8-MOP), vystaví UVA a následně se vrací do oběhu. Používá se především u pokročilé mycosis fungoides (MF), erytrodermické formy MF a u Sézaryho syndromu, považovaného za leukemickou variantu MF. Mechanismy imunomodulačního účinku nejsou plně známy, nicméně výsledkem ECP je výrazné snížení populace maligních lymfocytů v periferii i uzlinách, ačkoliv se při jednom cyklu ozáří jen asi 5–10 % leukocytů. Maligní lymfocyty podléhají apoptóze, aktivují se dendritické buňky, které prezentují nádorové antigeny cytotoxickým T lymfocytům. Cytotoxické T lymfocyty se aktivují a zvyšuje se jejich počet [34]. ECP zlepšuje klinický nález, kvalitu života, prodloužení délky přežití zatím jednoznačně prokázáno nebylo. Zkoumá se použití u časnějších stadií. ECP se zkouší i u bulózních onemocnění, sklerodermie apod. V indikacích mimo dermatologii jsou to i akutní rejekce orgánů, morbus Crohn aj.
ZÁVĚR
Terapeutická aferéza v celé šíři výkonů je moderní terapií u řady závažných stavů interních, neurologických, v transplantologii, onkologii a u autoimunitních onemocnění včetně dermatologických. Je vymezena pro úzké spektrum pacientů se závažnými diagnózami. TA je výkon, který je možno provádět na specializovaných pracovištích s odpovídajícím přístrojovým vybavením s možností extrakorporálního oběhu a školeným personálem.
ECP u kožních lymfomů se provádí v České republice na několika pracovištích, jedná se o několik pacientů ročně. Plazmaferéza a imunoadsorpce u pacientů s autoimunitními bulózními onemocněními se provádí vzácně. Nezanedbatelná je vysoká finanční náročnost terapie IA. Opakované použití adsorpčních kolon ale významně finanční náklady snižuje na úroveň jiných metod. Jedná se o metodu účinnou, která sníží celkovou dávku kortikosteroidů a imunosupresiv u závažně nemocných pacientů s autoimunitními onemocněními. Snížení titru patologických protilátek urychluje hojení a zastavuje kaskádu zánětlivých procesů, které vedou k nezvratnému poškození tkání, čímž TA jednoznačně prodlužuje přežití nemocných. Závažných dermatologických pacientů, kteří by takovou péči potřebovali, je málo. Ze známé incidence puchýřnatých chorob vyplývá, že se jedná spíše o jednotlivce než desítky pacientů během jednoho roku. V České republice vznikla recentně Iniciativa k ustavení aferetických center, která si klade za cíl cestou odborných společností sjednotit indikace a pracovní postupy u jednotlivých diagnóz, zvýšit dostupnost péče a garantovat její kvalitu [1].
Prohlášení o střetu zájmů: Autor v souvislosti s tématem práce v posledních 12 měsících nespolupracoval s žádnou farmaceutickou firmou.
Do redakce došlo dne 14. 4. 2020.
Adresa pro korespondenci:
doc. MUDr. Hana Jedličková, Ph.D.
Dermatovenerologické oddělení FN Brno
Jihlavská 20
625 00 Brno
e-mail: Jedlickova.Hana@fnbrno.cz
Zdroje
1. BLÁHA, V., BLÁHA, M., PIŤHA, J. et al. Iniciativa k ustavení aferetických center: indikace a provádění lipoproteinové aferézy v České republice. AtheroRev, 2019, 4(1), p. 19–27.
2. DIETZE, J., HOHENSTEIN, B., TSELMIN, S. et al. Successful and well-tolerated bi-weekly immunoadsorption regimen in pemphigus vulgaris. Atheroscler Suppl, 2017, 30, p. 271–277.
3. EMING, R., RECH, J., BARTH, S. et al. Prolonged clinical remission of patients with severe pemphigus upon rapid removal of desmoglein-reactive autoantibodies by immunoadsorption. Dermatology, 2006, 212, p. 177–187.
4. FUJISAWA, T., MORIYA, CH., SHIBUYA, Y. et al. Combination Therapy of Infliximab and Granulocyte/Monocyte Adsorption Apheresis for Refractory Pustular Psoriasis with Psoriatic Arthritis. Acta Derm Venereol, 2013, 93, p. 364–365.
5. GÜNTHER, C., LASKE, J., FRIND, A. et al. Successful therapy of pemphigus vulgaris with immunoadsorption using the TheraSorb adsorber. J Dtsch Dermatol Ges, 2008, 6, p. 661–663.
6. HERRERO-GONZÁLEZ, J. E., SITARU, C., KLINKER, E. et al. Successful adjuvant treatment of severe bullous pemphigoid by tryptophan immunoadsorption. Clin Exp Dermatol, 2005, 30, p. 519–522.
7. HOFRICHTER, M., DWORSCHAK, J., EMTENANI, S. et al. Immunoadsorption of Desmoglein-3-Specific IgG Abolishes the Blister-Inducing Capacity of Pemphigus Vulgaris IgG in Neonatal Mice. Front. Immunol, 2018, https://doi.org/10.3389/fimmu.2018.01935.
8. HOLTSCHE, M. M., ZILLIKENS, D., SCHMIDT, E. Mucous membrane pemphigoid. Hautarzt, 2018, 69(1), p. 67–83.
9. HÜBNER, F., KASPERKIEWICZ, M., KNUTH-REHR, D. et al. Adjuvant treatment of severe/refractory bullous pemphigoid with protein A immunoadsorption. J Dtsch Dermatol Ges, 2018,16, p. 1109–1118.
10. INO, N., KAMATA, N., MATSUURA, C. et al. Immunoadsorption for the treatment of bullous pemphigoid. Ther Apher, 1997,1(4), p. 372–376.
11. JOLY, P., BARICAULT, S., SPARSA, A. et al. Incidence and mortality of bullous pemphigoid in France. J Invest Dermatol., 2012, 132(8), p. 1998–2004.
12. KASPERKIEWICZ, M., HOPPE, U., ZILLIKENS, D. et al. Relapse-associated autoantibodies to BP180 in a patient with anti-p200 pemphigoid. Clin Exp Dermatol, 2010, 35(6), p. 614–617.
13. KASPERKIEWICZ, M., MEIER, M., ZILLIKENS, D. et al. Linear IgA disease: successful application of immunoadsorption and review of the literature. Dermatology, 2010, 220(3), p.259–263.
14. KASPERKIEWICZ, M., SCHULZE, F., MEIER, M. et al. Treatment of bullous pemphigoid with adjuvant immunoadsorption: a case series. J Am Acad Dermatol, 2014, 71(5), p. 1018–1020.
15. Kasperkiewicz, M., Mook, S. C., Knuth-Rehr, D. et al. IgE-Selective Immunoadsorption for Severe Atopic Dermatitis. Front Med (Lausanne), 2018, 5, p. 27.
16. Kolesnik, M., Becker, E., Reinhold, D. et al. Treatment of severe autoimmune blistering skin diseases with combination of protein A immunoadsorption and rituximab: a protocol without initial high dose or pulse steroid medication. J Eur Acad Dermatol Venereol, 2014, 28(6), p. 771–780.
17. LÜFTL, M., STAUBER, A., MAINKA, A. et al. Successful removal of pathogenic autoantibodies in pemphigus by immunoadsorption with a tryptophan-linked polyvinylalcohol adsorber. Br J Dermatol, 2003, 149(3), p. 598–605.
18. MARKER, M., DERFLER, K., MONSHI, B. et al. Successful immunoapheresis of bullous autoimmune diseases: pemphigus vulgaris and pemphigoid gestationis. JDDG, 2011, 9, p.27–31.
19. MEYERSBURG, D., SCHMIDT, E., KASPERKIEWICZ, M. et al. Immunoadsorption in dermatology. Ther Apher Dial, 2012,16, p. 311–320.
20. MURRELL, D. F., PEŃA, S., JOLY, P. et al. Diagnosis and Management of Pemphigus: recommendations by an International Panel of Experts. J Am Acad Dermatol, 2018, pii: S0190-9622(18)30207-X. doi: 10.1016/j.jaad.2018.02.021, update JAAD 82/3 2020 p. 575–585.
21. MÜLLER, P. A., BRÖCKER, E. B., KLINKER, E. et al. Adjuvant treatment of recalcitrant bullous pemphigoid with immunoadsorption. Dermatology, 2012, 224(3), p. 224–227.
22. NIEDERMEIER, A., EMING, R., PFÜTZE, M. et al. Clinical response of severe mechanobullous epidermolysis bullosa acquisita to combined treatment with immunoadsorption and rituximab (anti-CD20 monoclonal antibodies). Arch Dermatol, 2007, 143(2), p. 192–198.
23. PADMANABHAN, A., CONNELLY‐SMITH, L., AQUI, N. et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice – Evidence‐Based Approach from the Writing Committee of the American Society for Apheresis: The Eigth Special Issue. J Clin Apher., 2019, 34, p. 171–354.
24. RECKE, A., SHIMANOVICH, I., STEVEN, P. et al. Treatment-refractory anti-laminin 332 mucous membrane pemphigoid. Remission following adjuvant immunoadsorption and rituximab. Hautarzt, 2011, 62(11), p. 852–858.
25. SHIMANOVICH, I., HERZOG, S., SCHMIDT, E. et al. Improved protocol for treatment of pemphigus vulgaris with protein A immunoadsorption. Clin Exp Dermatol, 2006, 31(6), p. 768–774.
26. SHIMANOVICH, I., NITSCHKE, M., ROSE, C. et al. Treatment of severe pemphigus with protein A immunoadsorption, rituximab and intravenous immunoglobulins. Br J Dermatol, 2008, 158(2), p. 382–388.
27. SHIMOYAMA, T., YAMAMOTO, T., UMEGAE, S. et al. Faecal calprotectin level for assessing endoscopic activity and predicting future clinical course in patients with moderately active ulcerative colitis undergoing granulomonocytapheresis: a prospective cohort study. BMC Gastroenterol, 2018, 18, p. 120.
28. SCHMIDT, E., KLINKER, E., OPITZ, A. et al. Protein A immunoadsorption: a novel and effective adjuvant treatment of severe pemphigus. Br J Dermatol, 2003, 148(6), p. 1222–1229.
29. SCHMIDT, E., ZILLIKENS, D. Immunoadsorption in dermatology. Arch Dermatol Res, 2010, 302(4), p. 241–253.
30. TSELMIN, S., JULIUS, U., BORNSTEIN, S. R. et al. Low rate of infectious complications following immunoadsorption therapy without regular substitution of intravenous immunoglobulins. Atheroscler Suppl, 2017, 30, p. 278–282.
31. Westermann, L., Hügel, R., Meier, M. et al. Glucocorticosteroid-resistant pemphigoid gestationis: successful treatment with adjuvant immunoadsorption. J Dermatol, 2012, 39(2), p.168–171.
32. WÖHRL, S., GEUSAU, A., KARLHOFER, F. et al. Pemphigoid gestationis: treatment with immunoapheresis. J Dtsch Dermatol Ges, 2003,1(2), p. 126–130.
33. ZILLIKENS, D., DERFLER, K., EMING, R. et al. Recommendations for the use of immunoapheresis in the treatment of autoimmune bullous diseases. J Dtsch Dermatol Ges, 2007, 5(10), p. 881–887.
34. ZIC, J. A. Extracorporeal Photopheresis in the Treatment of Mycosis Fungoides and Sézary Syndrome. Dermatologic Clinics, 2015, 33, p. 765–776.
35. ZINK, A., GENSBAUR, A., ZIRBS, M. et al. Targeting IgE in severe atopic dermatitis with a combination of immunoadsorption and omalizumab. Acta Derm Venereol, 2016, 96, p. 72–76.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2020 Číslo 3- Jak včas rozpoznat vzácné onemocnění? S diagnostickou rozvahou pomůže accelRare
- INFOGRAFIKA: Vzácná diagnóza včas
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
Nejčtenější v tomto čísle- Darierova choroba: současný pohled. Část II.
- Rituximab v léčbě pemphigus vulgaris – popis případu
- Využití terapeutické aferézy v dermatologii
- Lokalizované edémy bérců
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



