-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rituximab v léčbě pemphigus vulgaris – popis případu
Rituximab in the Treatment of Pemphigus Vulgaris – Case Report
The authors describes a case of a 18-year-old patient suffering from pemphigus vulgaris in whom adjuvant therapy with rituximab has been initiated due to the protracted course of treatment, frequent exacerbations of the disease, development of multiple complications during long-term systemic corticosteroid therapy and ineffective prior adjuvant therapy (azathioprine, cyclophosphamide, mycophenolate mofetil). Currently, the described patient has been in complete remission of the disease for 21 months only with supportive osteoporosis therapy. Rituximab is a chimeric (murine/human) monoclonal antibody targeting B cell surface receptor CD20 and has been newly introduced to the first line of systemic therapy of pemphigus and induced good therapeutic response and steroid-sparing effect in clinical trials. The authors present an overview of current knowledge about the treatment of this disease with rituximab.
Keywords:
rituximab – pemphigus vulgaris – desmoglein 1 and 3 – CD19 positive B-lymphocytes
Autoři: O. Kodet 1,2,3; L. Lacina 1,2,3; Z. Plzáková 1; I. Krajsová 1; J. Štork 1
Působiště autorů: Dermatovenerologická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. Jiří Štork, CSc. 1; Anatomický ústav 1. LF UK, Praha, přednosta prof. MUDr. Karel Smetana, DrSc. 2; BIOCEV – Biotechnologické a biomedicínské centrum Akademie věd a Univerzity Karlovy ve Vestci u Prahy, ředitel prof. MUDr. Pavel Martásek, DrSc. 3
Vyšlo v časopise: Čes-slov Derm, 95, 2020, No. 3, p. 108-114
Kategorie: Kazuistika
Souhrn
Autoři popisují případ 18letého pacienta trpícího pemphigus vulgaris, u kterého pro protrahovaný průběh léčby, četné exacerbace onemocnění, rozvoj komplikací v rámci dlouhodobé kortikoterapie a neúčinnost předchozí adjuvantní terapie (azathioprin, cyklofosmamid, mykofenolát mofetil), byla zahájena adjuvantní terapie rituximabem. V současné době je popisovaný pacient již 21 měsíců v kompletní remisi onemocnění, jen s podpůrnou terapií osteoporózy. Rituximab je chimérická (myší/lidská) monoklonální protilátka namířená proti povrchovému receptoru CD20 B-lymfocytů, která je nově indikována v první linii celkové terapie pemfigu a která v klinických studiích prokázala dobrou terapeutickou odpověď a steroidy šetřící efekt. Autoři předkládají přehled současných poznatků o léčbě tohoto onemocnění rituximabem.
Klíčová slova:
rituximab – pemphigus vulgaris – desmoglein 1 a 3 – CD19 pozitivní B-lymfocyty
ÚVOD
Pemfigus představuje skupinu chronických puchýřnatých autoimunitních onemocnění postihujících kůži a sliznice. Podstatou onemocnění pemphigus vulgaris (PV), nejběžnějšího zástupce této skupiny chorob, je produkce autoprotilátek, které se váží na proteiny desmoglein 1 a 3 (Dsg1 a Dsg3). Tyto proteiny patří do skupiny cadherinů, strukturálních podjednotek desmozomů, které jsou odpověděné za mezibuněčné spoje v epitelu sliznic a v epidermis. Pemphigus vulgaris představuje spíše vzácnější onemocnění. Celosvětově udávaná incidence široce kolísá v rozsahu od 0,6 do 32 případů/milion obyvatel a je závislá na geografických a také etnických vlivech, ale patrně i na dosažitelnosti a funkčnosti zdravotní péče [30]. Klasická mukokutánní forma je častější pro bělošskou populaci Evropy a USA. Samostatnou variantou s přítomností pouze Dsg1 protilátek je pemphigus foliaceus (PF), který je častější v Jižní Americe (Brazílie) a u severoafrické populace [18]. Je zdokumentována i forma paraneoplastická (pemphigus paraneoplasticus), která může být doprovodným onemocněním hematologické malignity či paraneoplastickým projevem solidních nádorů.
Pemphigus vulgaris může postihovat pacienty v jakémkoliv věku, ale typicky se vyskytuje ve čtvrtém až šestém deceniu, mírně častěji postihuje ženy než muže. V klinickém obraze dominuje postižení kůže a sliznic s tvorbou plihých vezikul či bul na nezánětlivé spodině, které snadno erodují.
V terapii se uplatňují především systémové kortikoidy v kombinaci s adjuvantní terapií např. azathioprinem, mykofenolát mofetilem, cyklofosfamidem nebo metotrexátem. Nověji je v adjuvantní terapii pro středně závažné až závažné formy PV/PF zaváděna biologická terapie anti-CD20 rituximab, která patří podle mezinárodních doporučení již do léčby první volby [30].
POPIS PŘÍPADU
Osmnáctiletý pacient byl v listopadu 2015 přijat k hospitalizaci na naše pracoviště pro stále progredující projevy již diagnostikovaného pemphigus vulgaris. Pacient byl na pracoviště přijat již na zavedené celkové kombinované terapii prednisonem 50 mg/den a azathioprinem 100 mg/den (zahájeno na spádovém lůžkovém pracovišti), která ale nekontrolovala efektivně stav onemocnění. Samotné onemocnění začalo aftózními projevy v dutině ústní v září 2015 s následnou progresí v říjnu 2015, kdy došlo k vzniku projevů na trupu a obličeji (obr. 1, 2).
Obr. 1. Osmnáctiletý pacient s pemphigus vulgaris při přijetí v listopadu 2015 projevy v dutině ústní 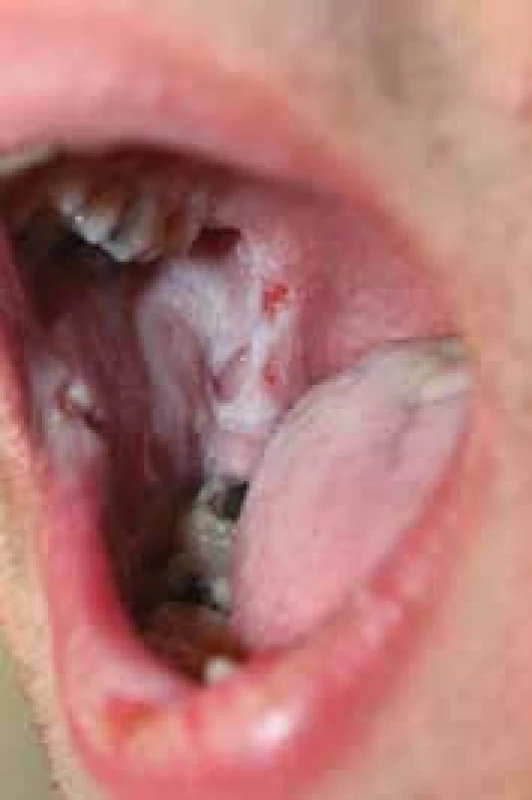
Obr. 2. Erodované projevy na zádech, steroidní akné a počínající strie, listopad 2015 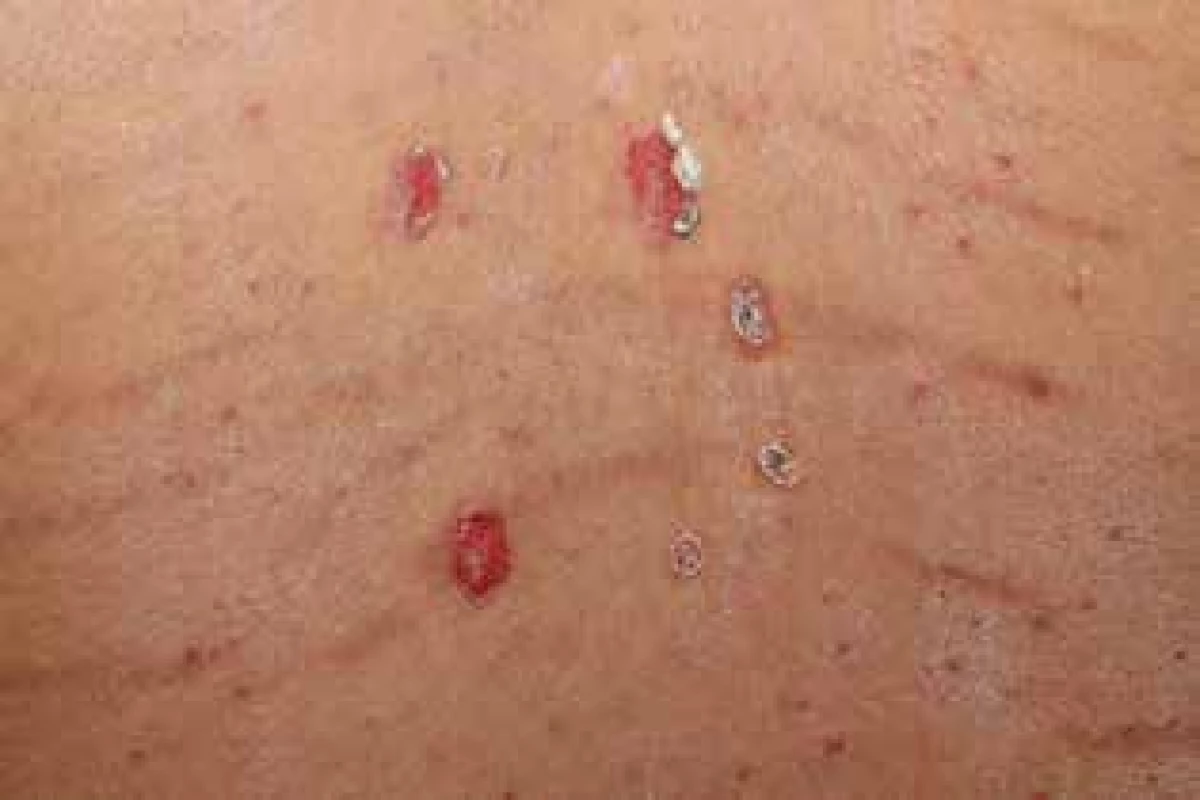
Diagnóza pemfigu byla stanovena v říjnu 2015 biopticky průkazem intraepidermálních vezikul a imunofluorescenční pozitivitou IgG a C3 komplementu intraepidermálně. Na přelomu listopadu a prosince 2015 byla pro trvající progresi onemocnění za hospitalizace podána pulzní terapie solumedrolem v dávce 250 mg i. v. po tři dny a navýšena celková dávka prednisonu na 90 mg/den (1,2 mg/kg – tělesná hmotnost 75 kg) a azathioprin ponechán na dávce 100 mg/den. Vzhledem k navozenému uspokojivému hojení byla následně dávka prednisonu na přelomu ledna a února 2016 postupně snížena až na dávku 55 mg/den. Na této dávce došlo však opětovně k recidivě onemocnění a rozvoji nových projevů na trupu i obličeji. Prednison byl proto na konci února 2016 navýšen na předchozí efektivní dávku 65 mg/den a azathioprin eskalován až na 200 mg/den. Vzhledem k neuspokojivému hojení a protrahovanému průběhu byla v březnu 2016 terapie azathioprinem ukončena. Provedené genetické vyšetření totiž u pacienta prokázalo přítomný polymorfismus genu pro enzym thyopurinmethyltransferázu (TPMT), tento stav je nutné spojovat s rizikem toxicity při vyšších dávkách.
Prednison byl změněn na farmakologicky výhodnější methylprednisolon. Stav byl navíc komplikován kolonizací kůže na ranných plochách methicilin rezistentním zlatým stafylokokem (MRSA). K eradikaci byla podle citlivosti zvolena léčba doxycyklinem v dávce až 400 mg/den na 10 dní a následně 14 dní v dávce 200 mg/den s lokální antiseptickou terapií – směs undecylenamidopropylbetainu (tenzid) a polyaminopropylbiguanidu (konzervační polyhexanid) ve vodném roztoku. Za těchto okolností byla celková léčba doxycyklinem cíleně kombinovaná s podáním niacinamidu 500 mg/den, tato kombinace podle některých literárních údajů může být rovněž efektivní léčbou pemphigus vulgaris [22]. Na této terapii dočasně došlo sice k mírné stabilizaci onemocnění, ale při poklesu methylprednisolonu pod 36 mg/den (ekvivalent 45 mg prednisonu) došlo k opětovné progresi (duben 2016), která byla i biopticky a imunoflorescenčně verifikována (obr. 3).
Obr. 3. Vyšetření přímou imunoflorescencí (PIF), pozitivita IgG interepidermální a v oblasti vlasových folikulů, duben 2016 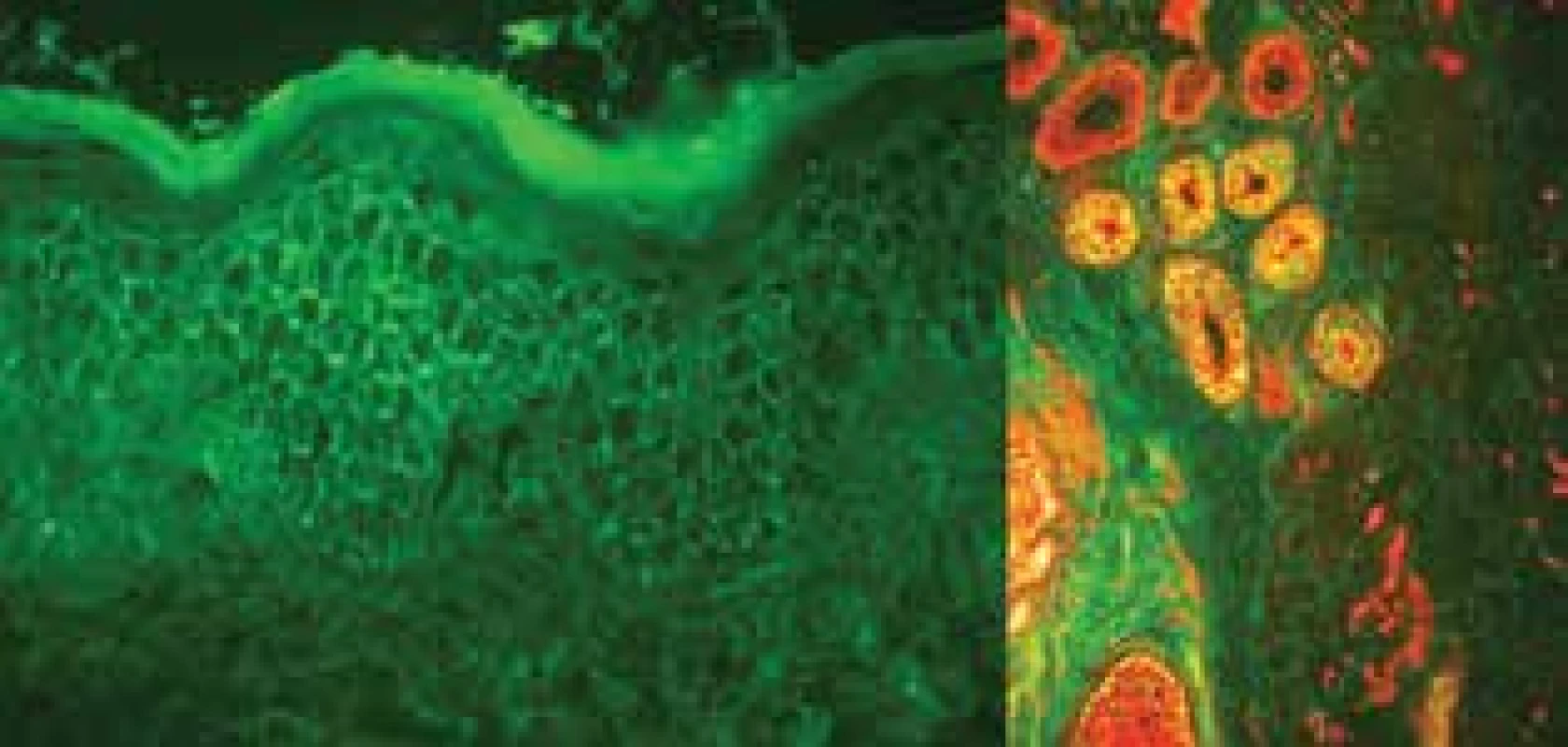
Vzhledem k opakovaným recidivám byla zvolena adjuvantní terapie cyklofosfamidem v pulzním podání následovaná perorální formou léčby. Před zahájením této terapie byla vzhledem k věku pacienta a hrozícím reprodukčním komplikacím provedena kryoprezervace spermatu. Pulzní léčba cyklofosfamidem byla zahájena v dubnu 2016 v dávce 600 mg i. v. (6,5 mg/kg – tělesná hmotnost 92 kg) a opakována po 6 týdnech opět dávkou 600 mg i. v., poté byla současně nasazena perorální léčba cyklofosfamidem 150 mg/den. Po pulzní terapii cyklofosfamidem došlo ke stabilizaci onemocnění s možností snížení dávky methylprednisolonu na 12 mg/den. V září 2016 však došlo k další recidivě onemocnění s nutností opětovného navýšení methylprednisolonu na dávku 32 mg/den. Vzhledem k neuspokojivému a opět protrahovanému hojení byla adjuvantní terapie cyklofosfamidem na konci září 2016 ukončena. Následně byla po schválení zdravotní pojišťovnou zahájena adjuvantní terapie mykofenolát mofetilem v dávce 2 mg/den. Při této terapii došlo opět ke stabilizaci onemocnění s možností snížení methlyprednisolonu až na dávku 16 mg/den. Při opakovaných pokusech o snížení pod 16 mg/den vždy však docházelo k recidivám onemocnění. Navíc docházelo v průběhu léčby postupně k manifestaci nežádoucích účinků kortikoidů. Finálně došlo i přes profylaktická opatření k rozvoji kortikoidy indukované významné osteoporóze hrudní a bederní páteře s průkazem patologických fraktur obratlů Th 11, 12 a L 1, 2 a 3. Vzhledem k obtížnému snižování celkové terapie kortikosteroidy na uspokojivé a dlouhodobě méně zatěžující dávky bylo zažádáno o adjuvantní terapii rituximabem. Ta byla schválena a podána podle tzv. revmatologického schématu (modifikováno s plánovaným podáním podle Joly et. al. 2017) [16] v první dávce 1000 mg v červenci 2017, druhá dávka 1000 mg byla podána za 14 dní. Po zahájení této terapie došlo pozvolna k plné stabilizaci onemocnění, snížení celkové dávky methylprednisolonu na 8 mg/den a následně i postupnému vysazení mykofenolát mofetilu. Od prosince 2017 byl pacient pouze na dávce 4 mg/den methylprednisolonu v monoterapii bez známek recidivy onemocnění. Třetí aplikace rituximabu (již 500 mg) byla podána vzhledem k repopulaci CD19 pozitivních B-lymfocytů a možnému riziku recidivy onemocněn po 8 měsících (duben 2018). Následně byla v červnu 2018 vzhledem k remisi onemocnění ukončena celková terapie methylprednisolonem. Čtvrtá dávka rituximabu (500 mg) byla aplikována v půlročním odstupu od třetí dávky v říjnu 2018. V současné době je pacient již 21 měsíců (od června 2018) v plné remisi onemocnění (31 měsíců od zahájení terapie rituximabem, červenec 2017), bez terapie kortikosteroidy, jen s podpůrnou terapií osteoporózy (kalciem 500 mg/den a vitaminem D 400 IU/den, vitamin D 15 kapek 3krát týdně a bisfosfonáty – risedronát 35 mg 1krát týdně). Poslední dávka rituximabu byla podána před 17 měsíci v říjnu 2018. Pacient nadále dochází na pravidelné kontroly klinického stavu i laboratoře po dvou měsících.
Mementem tohoto sdělení je, že patrně nevyhnutelná dlouhodobá kortikoterapie ve vysokých dávkách vedla u takto mladého pacienta k rozvoji mohutných strií, steroidního akné, masivního cushingoidního habitu (obr. 4), a dokonce až ke kortikoidy indukované osteoporóze s patologickou frakturou hrudní a bederní páteře. Tato kostní léze vznikla navzdory cíleně zahájenému aktivnímu sledování v osteologické poradně a navzdory zahájené léčby pomocí osteoanabolické terapie teriparatidem.
Obr. 4. Cushingoidní syndrom a mohutné striae indukované dlouhodobě podávanými kortikoidy, duben 2016 a při srovnání v listopadu 2018 po léčbě rituximabem 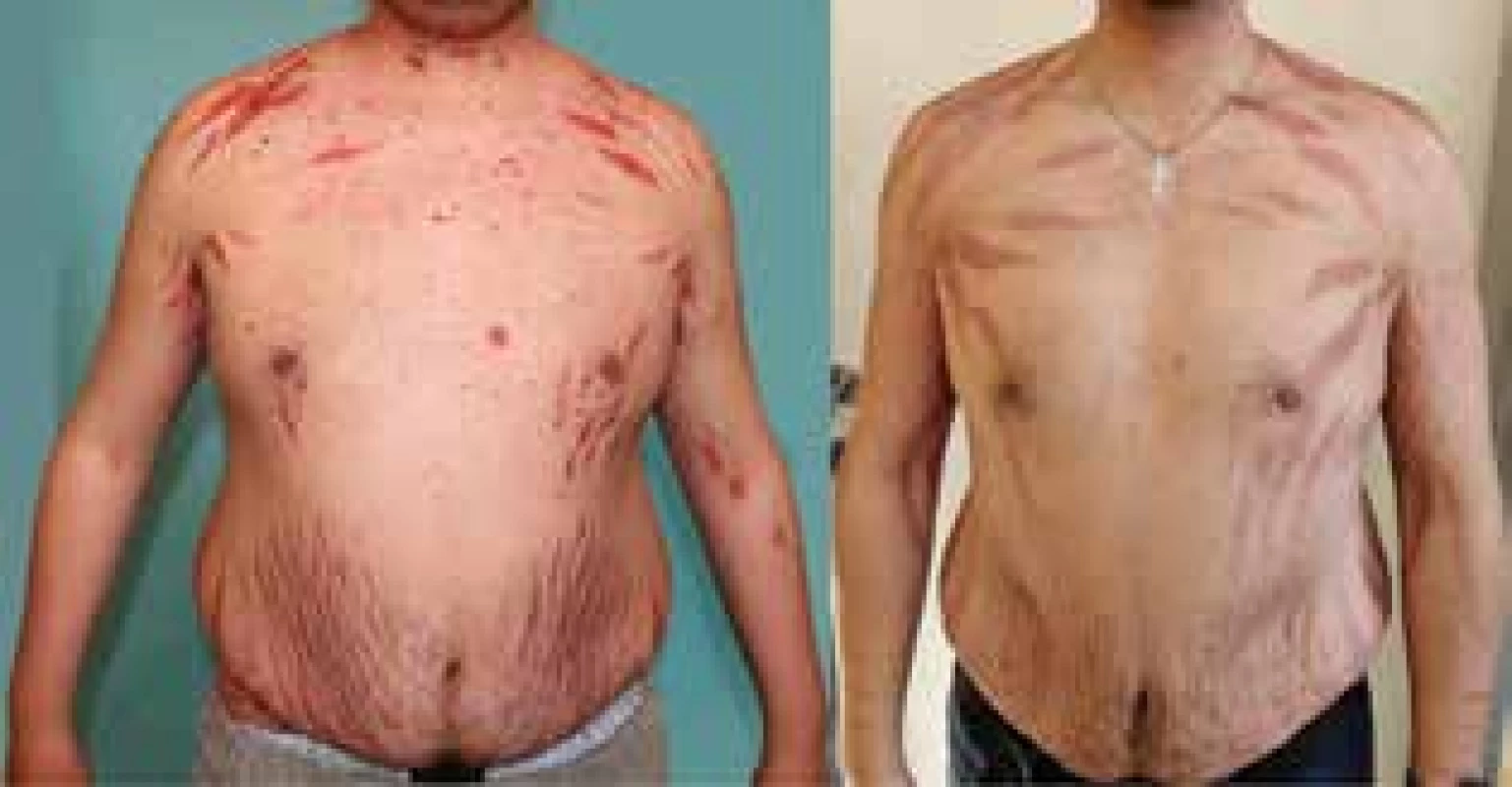
Prevence osteoporózy byla u pacienta zahájena hned při zavedení celkové terapie kortikosteroidy v říjnu 2015 kombinovaným preparátem vitaminu D (400 IU/den) a vápníku (500 mg/den). Vzhledem k pokročilé kortikoidy indukované osteoporóze měl pacient od května 2016 do května 2018 osteoanabolickou terapii teriparatidem 1krát denně 20 µg subkutánně aplikovanou injekcí. Po stabilizaci kostních lézí a po ukončení celkové terapie kortikoidy je pacient od června 2018 na terapii bisfosfonáty – risedronát 35 mg 1krát týdně, kalciem 500 mg/den a vitaminem D 400 IU/den a vitaminem D 15 kapek 3krát týdně.
Teprve zahájení terapie rituximabem vedlo k ukončení celkové terapie kortikoidy za současné plné kontroly onemocnění. Jedinou pozorovanou komplikací této terapie bylo komplikované hojení zubního váčku s následným rozvojem radikulární cysty dolní čelisti vlevo, s nutností chirurgické revize a nutnou antibiotickou terapií klindamycinem (300 mg á 6 hod.) po dobu 14 dnů. Stav se rozvinul po půl roce od zahájení terapie rituximabem v lednu 2018, ale po chirurgickém odstranění došlo k plnému zhojení bez další recidivy. Celkovou terapii, i samotné podání rituximabu, jinak pacient toleroval velice dobře bez komplikací. Během léčby a laboratorních kontrol pacienta byla prováděna opakovaně nepřímá imunoflorescence (metoda ELISA s detekcí Dsg1 a 3 není na našem pracovišti dostupná), která navzdory remisi onemocnění je nadále pozitivní s průkazem protilátek Dsg3.
DISKUSE
Rituximab je chimérická (myší/lidská) monoklonální protilátka namířena proti povrchovému receptoru CD20 B-lymfocytů. Receptor CD20 funguje jako kanál pro vápenaté ionty a jeho aktivace současně zasahuje do procesů buněčné diferenciace. Receptor CD20 je fyziologicky exprimován na povrchu normálních B-lymfocytů, v patologických procesech je jeho exprese přítomna i u většiny B-buněčných lymfomů. Současně jeho exprese chybí na povrchu hematopoetických kmenových buněk, na povrchu diferencovaných plazmatických buněk a v parenchymatózních orgánech. Tato distribuce CD20 umožňuje tedy cílenou blokádu se specifickým zaměřením prakticky pouze na požadované buňky. Rituximab působí specificky zpomalení až zástavu růstu nádorových buněk. Další výhodou je, že antigen CD20 se nachází jen v nepatrném množství v B lymfocytech cirkulujících v krevním řečišti, a nedochází tak k urychlenému vyvázání léčiva, které není poté neutralizováno před vazbou na cílovou buňku [25]. Vazba protilátky na povrchové struktury buňky je schopna aktivovat komplement klasickou dráhou a zesilovat také interakce s receptory pro Fc fragmenty. To následně vede k cytotoxickému poškození buňky s navázanou protilátkou a jejich eliminaci procesem apoptotické buněčné smrti [16, 25]. Tento mechanismus pravděpodobně hraje roli i v efektu rituximabu v léčbě pemfigu, kdy dochází k přechodné eliminaci autoreaktivních B lymfocytů [6, 25].
V klinickém použití byl rituximab schválen již v roce 1997 pro léčbu non-Hodgkinských lymfomů v dávce 375 mg/m2 – 1krát týdně po 4 následující týdny [20]. Od roku 2006 byl rituximab schválen i pro léčbu revmatoidní artritidy, a to v dávce 1000 mg i. v. podané v den 0 a potom 14. den [8, 24]. První práce o použití rituximabu v léčbě pemfigu byly publikovány roku 2001, kdy byl popsán příznivý efekt anti-CD20 terapie u pacientů trpících non--Hodgkinským lymfomem sdruženým s paraneoplastickým pemfigem [11]. V dalších letech byly prostřednictvím spíše jednotlivých případů podány důkazy dobrého efektu i v komplikovaných případech pemfigu nevázaného na hematologická onemocnění, ale recidivujících při běžně používaných schématech léčby založené na systémové kortikoterapii, či kombinaci s adjuvantními imunosupresivy [29]. První pilotní studie popisující efekt anti-CD20 protilátek na 5 pacientech byla publikována v roce 2007. Goh et al. popsali efekt aplikace rituximabu podávaného podle hematologického schématu (375 mg/m2 – 1krát týdně po 4 následující týdny) s pozorovanou terapeutickou odpovědí po 2–8 měsících trvající 13–18 měsíců. Tato studie byla provedena na 5 pacientech. U jednoho pacienta bylo dosaženo kompletní remise s vysazením celkové imunosupresivní terapie. Dva pacienti měli výrazné zlepšení, bez klinicky pozorovaných projevů, ale nadále pokračovali v imunosupresivní terapii. U dvou pacientů byla pozorována progrese onemocnění a u dvou pacientů byly zaznamenány významné infekční komplikace (pneumonie spojená s neutropenií a cytomegalovirová infekce). Tato studie poukázala na účinnost rituximabu při užití hematologického schématu a nutnost pečlivého sledování možných infekčních komplikací [9]. Horváth et al. popsali efekt nízké dávky rituximabu u 15 pacientů (3 s pemphigus foliaceus a 12 s pemphigus vulgaris). Rituximab byl v této studii podán v dávce 500 mg v intervalu dvou týdnů. Medián sledování byl 94 týdnů, kdy byl pozorován efekt u všech pacientů. Kompletní remise onemocnění byla pozorována u 8 pacientů (4 bez terapie, 4 na minimální terapii) s mediánem dosažení remise 5 týdnů. U 7 pacientů byla dosažena částečná terapeutická odpověď s mediánem trvání 34,5 týdne. Relaps onemocnění byl pozorován u 6 pacientů s mediánem 97 týdnů od zahájení terapie. Práce dále popisuje dobrou korelaci efektu terapie s navozením remise a poklesem počtu B lymfocytů pod < 1 % a poklesem Dsg1 protilátek [12].
Zásadní data přinesla další klinická studie popisující srovnání nízkého dávkování rituximabu (500 mg ve 2týdenním intervalu, 0. a 15. den) a vyššího dávkování (1000 mg ve 2týdenním intervalu, 0. a 15. den). Do této studie bylo zařazeno 22 pacientů rozdělených do dvou ramen (s nízkou vs. s vyšší dávkou). Pacienti byli sledováni po dobu 48 týdnů s prováděným hodnocením klinického stavu, sérové hladiny protilátek Dsg1 a Dsg3 metodou ELISA a hodnocením počtu CD19 pozitivních B lymfocytů. Během sledování nebyl pozorován významnější klinický rozdíl u obou skupin, a to ani v ohledu na kumulativní dávku podaných celkových kortikosteroidů. Ve skupině s nižší dávkou bylo dosaženo ale statisticky významněji vyšší kumulativní dávky adjuvantně podávaného azathioprinu (P = 0,018). Navíc u vyšší dávky podaného rituximabu byl zaznamenán významně lepší pokles cirkulujících protilátek Dsg1 i Dsg3. U skupiny s nižším dávkováním došlo i k repopulaci CD19 pozitivních B lymfocytů výrazně rychleji (již po 8. týdnu od zahájení terapie) [17].
Pravděpodobně nejzásadnější studie byla publikována v roce 2017, popisuje efekt rituximabu v první linii léčby kombinované s nízkou dávkou kortikosteroidů. Do studie bylo zařazeno celkově 90 pacientů rozdělených do dvou ramen (1 : 1), v prvním rameni byli pacienti léčeni monoterapií prednisonem v dávce 1–1,5 mg kg/den. Ve druhém rameni byli pacienti léčeni nižší dávkou prednisonu 0,5–1 mg kg/den (do navození remise 3–6 měsíců) v kombinaci s rituximabem podávaným v dávce 1000 mg v den 0 a 14. den léčby a dalším podáním 500 mg za 12 a 18 měsíců od zahájení terapie [16]. Sledování pacientů probíhalo celkově 3 roky, ačkoli základní cíl studie byl stanoven na dosažení kompletní remise ve 24. měsíci od zahájení terapie. V rameni s podávanými kortikoidy v monoterapii bylo dosaženo kompletní remise pouze u 34 % pacientů (15 ze 44). U pacientů léčených kombinací kortikoidů a rituximabu kompletní remise ve 24. měsíci od zahájení terapie dosáhlo dokonce 89 % pacientů (41 ze 46), což představuje rozdíl úspěšnosti 55 % (95%; CI (interval spolehlivosti) 38,4–71,7; p < 0,0001). Překvapivě i přítomnost nežádoucích účinků vyššího stupně závažnosti (tj. 3–4) byla pozorována častěji ve skupině pacientů léčených pouze monoterapií kortikoidy (53 hlášených nežádoucích účinků u 29 pacientů) než ve skupině s kombinovanou léčbou rituximabem a kortikosteroidy (27 u 16 pacientů). Z nežádoucích účinků byly mírně častější infekční komplikace při terapii kombinací rituximabu a kortikoidů (pneumonie, septický stav, spondylodiscitida). U monoterapie kortikosteroidy pravděpodobně i vzhledem k vyšší úvodní dávce byly pozorovány častější komplikace endokrinní (diabetes mellitus, cushingoidní syndrom, insuficience nadledvin). Relativně překvapivý byl stejný výskyt závažných kostních komplikací, tedy indukované osteoporózy, v obou ramenech studie, navzdory nižší dávce a kratší délce léčby kortikosteroidy v rameni s rituximabem [16]. V podobné studii (Ritux 3) byl navíc prokázán významný tzv. steroidy šetřící efekt adjuvantní terapie rituximabem [14]. Průměrná celková kumulativní dávka prednisonu byla 5 800 mg v rameni rituximabu s prednisonem oproti 20 520 mg při podávání pouze prednisonu. Navíc byla potvrzena opět nižší toxicita a podíl významných nežádoucích komplikací při použití nižší dávky kortikosteroidů a rituximabu. Celkově 24 ze 36 pacientů (67 %) léčených samotným prednisonem mělo komplikace související s léčbou hodnocených stupněm 3/4; oproti 13 ze 38 pacientů (34 %) léčených kombinací rituximabu s prednisonem [14].
V nedávné době byla publikována studie s použitím jednorázové, a to i poměrně nízké dávky rituximabu. U osmi pacientů byla aplikována jednorázová dávka rituximabu (200 mg). Po infuzi měli všichni pacienti dobrou terapeutickou odpověď. Na konci sledování dosáhlo 5 pacientů úplné remise a u 3 pacientů byla dosažena částečná remise onemocnění. S výjimkou jednoho případu septického stavu způsobené Citrobacter freundii a pneumonie způsobené Haemophilus influenzae nebyly zaznamenány vážnější nežádoucí účinky a jiné komplikace terapie [28].
Pro potřebu monitorování úspěšnosti terapie s možností i predikce možného relapsu onemocnění byly zavedeny biologické markery, které lze rutinně vyšetřovat při pravidelných kontrolách pacienta. Poměrně dobrá klinická odpověď léčby u pacientů s PV/PF se promítá na poklesu sérové hladiny zejména anti-Dsg1, méně pak Dsg3 autoprotilátek. Při stanovení sérových koncentrací se používá metoda ELISA [1], která však na řadě našich pracovišť není dostupná a její nahrazení nepřímou imunoflorescencí nemusí přinášet adekvátní náhradu při sledování a hodnocení efektu terapie. Jako poměrně spolehlivý biomarker možného relapsu onemocnění se ukazuje počet CD19 pozitivních B-lymfocytů. Terapeutické anti-CD20 protilátky maskují při vyšetření na fluorescenčním cytometru (FACS) antigeny B-buněk, což by vedlo k falešné negativitě. Jako náhradní ukazatel efektivity léčby rituximabem byl tedy zvolen koexprimovaný marker CD19 [25]. Po zahájení terapie rituximabem dochází k výrazné depleci CD19 pozitivních B lymfocytů až k nulovým hodnotám a následné pozvolné repopulaci, která však může indikovat relaps onemocnění [12, 14, 17, 31]. Albers a jeho spolupracovníci retrospektivně vyhodnotili 62 pacientů léčených rituximabem pro pemphigus vulgaris, u nichž docházelo v průměru k repopulaci CD19 pozitivních B lymfocytů za 8,5 měsíce od zahájení terapie, avšak k relapsu onemocnění docházelo v průměru až výrazně později, a sice za 15,9 měsíce od zahájení terapie. Jako možný prediktor relapsu onemocnění se však v této studii ukázala korelace více biomarkerů, a to repopulace CD19 pozitivních B lymfocytů (> 5%), detekce vyšší hladiny cirkulujících protilátek proti Dsg1 a Dsg3 (> 20 IU) a nízká hladina CD4+ lymfocytů (< 400 buněk/µl) [2].
Před samotným zahájením terapie rituximabem musí být pacient pečlivě vyšetřen jak klinicky, tak i laboratorně. Vedle základní biochemie a krevního obrazu je nutné vyloučení infekční hepatitidy, HIV a vyšetření quantiferonu k vyloučení tuberkulózy. Je vhodné provádět vyšetření elfo bílkovin, globulinů (zejména pak IgG, pro možný rozvoj hypogamaglobulinemie) a vyšetření subpopulace lymfocytů se zaměřením na CD19 B lymfocyty a CD4 T lymfocyty [5]. Vhodné je doplnění základního onkologického screeningu a vyšetření možných fokusů infekcí, které jsou nečastější komplikací léčby rituximabem. U fertilních žen je nutné vyšetření β-hCG k vyloučení gravidity a poučení o nutnosti dodržování kombinované antikoncepce, a to při léčbě a v období 12 měsíců po jejím ukončení [4].
ZÁVĚR
Anti-CD20 protilátky se již dostávají mezi základní pilíře terapie u pacientů s pemfigem, podle mezinárodních doporučení vedle systémových kortikosteroidů patří mezi léky první linie léčby. K této terapii jsou indikováni pacienti se středně těžkým až těžkým pemfigem. Vedle rituximabu je v současné době dostupná i plně humánní monoklonální protilátka anti-CD20 ofatumumab a humanizovaná protilátka anti-CD20 veltuzumab [7, 26]. Většina dostupných relevantních klinických studií však byla doposud provedena pouze s rituximabem.
Rituximab je podle doporučení indikován pro léčbu středně těžkého až těžkého pemfigu nebo u pacientů, kteří nedosahují klinické remise u léčby systémovými kortikosteroidy s jinou formou adjuvantní léčby a s nutností rychlejšího snižování vyšších dávek kortikosteroidů [10, 16, 23]. Pro léčbu pacientů s pemfigem jsou doporučena dvě možná aplikační schémata, a to tzv. revmatologické, s podáním 1000 mg ve 2týdenním intervalu nebo podle tzv. hematologického schématu s aplikací 375 mg/m2 – 1krát týdně po 4 následující týdny. V případě klinického relapsu může být léčba opakována, nebo podána již 6 měsíců od zahájení terapie při možném relapsu onemocnění. Pro opakovanou léčbu lze použít i nižší dávku (standardně 500 mg). Kombinace s kortikosteroidy se doporučuje krátkodobá (< 4 měsíce) ve snaze zabránit dlouhodobým nežádoucím účinkům. Dále je doporučena dlouhodobá kombinace s jinými imunosupresivy (> 12 měsíců), případně i v kombinaci s podávanými imunoglobuliny nebo imunoadsorpčními metodami [10, 23]. Rituximab do dermatologické péče přináší nové možnosti léčby chronických, mnohdy velice terapeuticky komplikovaných, autoimunitních onemocnění, jako je pemphigus vulgaris. Rituximab má současně době v České republice v souhrnu údajů o přípravku (SPC) schválenou indikaci pro pemphigus vulgaris v úvodní dávce 2krát 1000 mg podaných intravenózní infuzí s odstupem 2 týdnů. Udržovací intravenózní infuze již pouze v dávce 500 mg má být podána ve 12. a 18. měsíci, a pak v případě potřeby každých 6 měsíců, na základě klinického zhodnocení. Mechanismus úhrady je však stále na schválení revizním lékařem.
Navzdory všem pokrokům je ale dlouhodobá prognóza pacientů nadále nejistá a riziko relapsu onemocnění je poměrně velké. Do budoucna bude zásadní dlouhodobé sledování pacientů po léčbě rituximabem a zhodnocení trvanlivosti navozeného efektu a případného výskytu pozdních nežádoucích účinků.
Na prezentovaném případě došlo u mladého pacienta v mnoha aspektech k dosažení až maximální únosné terapeutické zátěže, kterou na něj vyvíjela postupně indikovaná léčiva a z nich plynoucí nežádoucí účinky. Je nutno kriticky zhodnotit, že jistá část těchto iatrogenních efektů je nevratného charakteru. Současně je ale dobře mít na paměti, že bez účinně nastavené léčby je i dnes nutno považovat pemphigus vulgaris za potenciálně letální onemocnění. Causa mortis v těchto případech bývala zejména infekce, ať již septikémie vycházející z obnažených ploch poškozeného kožního krytu, nebo závažná systémová infekce jako např. pneumonie. Teprve zavedením systémových kortikoidů do terapeutických možností dermatologie poklesla u pacientů trpících pemfigem velmi významně mortalita z fatálních 75 % na dnes i tak vysokých 30 % [19]. Rychlé rozšíření kortikoidů v praxi vedlo rovněž k rychlému poznání jejich nežádoucích účinků. Prakticky všechny, které demonstruje i náš případ, byly známy již kolem roku 1960 [3]. Kombinace kortikoidů s adjuvantní imunosupresí dostupnou od osmdesátých let 20. století dále snížily mortalitu pemfigu, která ale i v ideálních podmínkách zůstávala okolo 5 % [27]. I v dnešní situaci je ve vyspělých zemích a při plném respektu ke konsenzuálně přijatým doporučeným terapeutickým postupům založeným na moderních léčivech nutno mít na paměti, že adjustovaná mortalita u pacientů s pemfigem je i tak 2–3násobně zvýšena oproti normální populaci [13, 20].
Do redakce došlo dne 5. 3. 2020.
Adresa pro korespondenci:
MUDr. Ondřej Kodet, Ph.D.
Dermatovenerologická klinika 1. LF UK a VFN
U Nemocnice 499/2
128 00 Praha 2
e-mail: ondrej.kodet@lf1.cuni.cz
Zdroje
1. ABASQ, C., MOUQUET, H., GILBERT, D. et al. ELISA testing of anti-desmoglein 1 and 3 antibodies in the management of pemphigus. Arch. Dermatol., 2009, 145(5), p. 529–535.
2. ALBERS, L. N., LIU, Y., BO, N. et al. Developing biomarkers for predicting clinical relapse in pemphigus patients treated with rituximab. J. Am. Acad. Dermatol., 2017, 77(6), p. 1074–1082.
3. BENEDEK, T. G. History of the development of corticosteroid therapy. Clin. Exp. Rheumatol., 2011, 29(5 SUPPL. 68).
4. BILGIC, A., MURRELL, D. F. What is novel in the clinical management of pemphigus. Expert Review of Clinical Pharmacology, 2019, 12(10), p. 973–980.
5. BOLETO, G., AVOUAC, J., WIPFF, J. et al. Predictors of hypogammaglobulinemia during rituximab maintenance therapy in rheumatoid arthritis: A 12-year longitudinal multi-center study. Semin. Arthritis Rheum., 2018, 48(2), p. 149–154.
6. DUPUY, A., VIGUIER, M., BÉDANE, C. et al., Treatment of Refractory Pemphigus Vulgaris with Rituximab (Anti-CD20 Monoclonal Antibody). Arch. Dermatol., 2004, 140(1), p. 91–96.
7. ELLEBRECHT, C. T., CHOI, E. J., ALLMAN, D. M. et al. Subcutaneous Veltuzumab, a Humanized Anti-CD20 Antibody, in the Treatment of Refractory Pemphigus Vulgaris. JAMA Dermatology, 2014, 150(12), p. 1331–1335.
8. GOLDBLATT, F., ISENBERG, D. A. New therapies for rheumatoid arthritis. Clinical and Experimental Immunology, 2005, 140(2), p. 195–204.
9. GOH, M. S. Y., McCORMACK, C., DINH, H. V. et al., Rituximab in the adjuvant treatment of pemphigus vulgaris: A prospective open-label pilot study in five patients. Br. J. Dermatol., 2007, 156(5), p. 990–996.
10. HARMAN, K. E., BROWN, D., EXTON, L. S. et al., British Association of Dermatologists’ guidelines for the management of pemphigus vulgaris 2017. Br. J. Dermatol., 2017, 177(5), p. 1170–1201.
11. HEIZMANN, M., ITIN, P., WERNLI, M. et al., Successful treatment of paraneoplastic pemphigus in follicular NHL with rituximab: Report of a case and review of treatment for paraneoplastic pemphigus in NHL and CLL. Am. J. Hematol., 2001, 66(2), p. 142–144.
12. HORVÁTH, B., HUIZINGA, J., PAS, H. H. et al. Low-dose rituximab is effective in pemphigus. Br. J. Dermatol., 2012, 166(2), p. 405–412.
13. HUANG, Y.-H., KUO, C.-F., CHEN, Y.-H. et al. Incidence, mortality, and causes of death of patients with pemphigus in Taiwan: a nationwide population-based study. J. Invest. Dermatol., 2012, 132(1), p. 92–97.
14. CHEN, D. M., ODUEYUNGBO, A., CSINADY, E. et al. Rituximab is an effective treatment in patients with pemphigus vulgaris and demonstrates a steroid-sparing effect. Br. J. Dermatol., 2019.
15. JOHNSON, P., GLENNIE, M. The mechanisms of action of rituximab in the elimination of tumor cells. Seminars in Oncology, 2003, 30(1 SUPPL. 2), p. 3–8.
16. JOLY, P., MAHO-VAILLANT, M., PROST-SQUARCIONI, C. et al. First-line rituximab combined with short-term prednisone versus prednisone alone for the treatment of pemphigus (Ritux 3): a prospective, multicentre, parallel-group, open-label randomised trial. Lancet, 2017, 389(10083), p. 2031–2040.
17. KANWAR, A. J., VINAY, K., SAWATKAR, G. U. et al. Clinical and immunological outcomes of high - and low-dose rituximab treatments in patients with pemphigus: A randomized, comparative, observer-blinded study. Br. J. Dermatol., 2014, 170(6), p. 1341–1349.
18. KRIDIN, K. Pemphigus group: overview, epidemiology, mortality, and comorbidities. Immunologic Research, 2018, 66(2), p. 255–270.
19. KRIDIN, K., SAGI, S. Z., BERGMAN, R. Mortality and Cause of Death in Patients with Pemphigus. Acta Derm. Venereol., 2017, 97(5), p. 607–611.
20. LANGAN, S. M., SMEETH, L., HUBBARD, R. et al. Bullous pemphigoid and pemphigus vulgaris – Incidence and mortality in the UK: Population based cohort study. BMJ, 2008, 337(7662), p. 160–163.
21. LEGET, G. A., CZUCZMAN, M. S. Use of rituximab, the new FDA-approved antibody. Current Opinion in Oncology, 1998, 10(6), p. 548–551.
22. McCARTY, M., FIVENSON, D. Two decades of using the combination of tetracycline derivatives and niacinamide as steroid-sparing agents in the management of pemphigus: Defining a niche for these low toxicity agents. J. Am. Acad. Dermatol., 2014, 71(3), p. 475–479.
23. MURRELL, D. F., PEÑA, S., JOLY, P. et al. Diagnosis and management of pemphigus: Recommendations of an international panel of experts. J. Am. Acad. Dermatol., 2020.
24. PALYLYK-COLWELL, E., McGAHAN, L. Rituximab for rheumatoid arthritis. Issues Emerg. Health Technol., 2006, (89), p. 1–4.
25. PESCOVITZ, M. D. Rituximab, an anti-CD20 monoclonal antibody: History and mechanism of action. American Journal of Transplantation, 2006, 6(5 I). p. 859–866.
26. RAPP, M. B., PENTLAND, A. P., RICHARDSON, C. T. Successful treatment of pemphigus vulgaris with ofatumumab. J. Drugs Dermatology, 2018, 17(12), p. 1338–1339.
27. RAZZAQUE AHMED, A. MOY, R. Death in pemphigus. J. Am. Acad. Dermatol., 1982, 7(2), p. 221–228.
28. RUSSO, I., MIOTTO, S., SAPONERI, A. et al. Ultra-low dose rituximab for refractory pemghigus vulgaris: a pilot study. Expert Opin. Biol. Ther., 2020, p. 14712598.2020.1727440.
29. SCHMIDT, E., HUNZELMANN, N., ZILLIKENS, D. et al. Rituximab in refractory autoimmune bullous diseases. Clinical and Experimental Dermatology, 2006, 31(4). p. 503–508.
30. SCHMIDT, E., KASPERKIEWICZ, M., JOLY, P. Pemphigus. The Lancet, 2019, 394(10201), p. 882–894.
31. TROUVIN, A. P., JACQUOT, S., GRIGIONI, S. et al. Usefulness of monitoring of B cell depletion in rituximab-treated rheumatoid arthritis patients in order to predict clinical relapse: A prospective observational study. Clin. Exp. Immunol., 2015, 180(1), p. 11–18.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2020 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Význam lokální oxygenoterapie a ozonoterapie pro léčbu nehojivých ran
Nejčtenější v tomto čísle- Darierova choroba: současný pohled. Část II.
- Rituximab v léčbě pemphigus vulgaris – popis případu
- Využití terapeutické aferézy v dermatologii
- Lokalizované edémy bérců
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



