-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Diagnostika kontaktného ekzému in vitro – vyšetrenie mononukleárnych buniek periférnej krvi pacientov s kontaktnou precitlivenosťou na nikel lymfocytotransformačným testom a metódou ELISA na stanovenie interleukínu IL-5
In vitro Diagnostics of Allergic Contact Dermatitis – Examination of Peripheral Blood Mononuclear Cells of Nickel Allergic Patients by the Means of Lymphocyte Transformation Test and ELISA for Determination of Interleukin 5
The diagnostics of the etiology of allergic contact dermatitis (ACD) is currently almost solely based on the results of patch tests, which, however, have several disadvantages. Therefore there is a real need for an alternative diagnostic method. The aim of our study was to characterize the potential utility of two different laboratory methods for in vitro diagnosis of contact nickel hypersensitivity. Peripheral blood mononuclear cells of patients with nickel allergic contact dermatitis and a control group of healthy persons without contact allergy were examined and the characteristics of lymphocyte transformation test and interleukin 5 (IL-5) ELISA test were studied as potential diagnostic methods. Our results suggest that both tests might be suitable for in vitro diagnostics of ACD caused by nickel. However, it is necessary to increase the number of patients enrolled into study to confirm this conclusion.
Key words:
diagnostics – allergic contact dermatitis – lymphocyte transformation test – ELISA – IL-5
Autoři: D. Buchvald 1; L. Lundeberg 2
Působiště autorů: Detská dermatovenerologická klinika LF UK a DFNsP, Bratislava prednosta doc. MUDr. T. Danilla, CSc. 1; Unit of Dermatology and Venereology, Department of Medicine, Karolinska University Hospital, Stockholm, Švédsko prednosta prof. Mona Stahle-Backdahl, MD, PhD. 2
Vyšlo v časopise: Čes-slov Derm, 83, 2008, No. 1, p. 16-24
Kategorie: Klinické a laboratorní práce
Souhrn
Diagnostika etiológie kontaktného ekzému sa v súčasnosti opiera takmer výlučne o výsledky epikutánnych kožných testov, ktoré však majú viaceré nedostatky a požiadavka alternatívnej diagnostickej metódy reálne jestvuje. Cieľom našej práce bolo zhodnotenie dvoch laboratórnych metód z hľadiska ich možného využitia na in vitro diagnostiku kontaktnej precitlivenosti na nikel. Pomocou vyšetrenia mononukleárnych buniek periférnej krvi súborov pacientov s kontaktným ekzémom a zdravých osôb bez kontaktnej precitlivenosti sme zisťovali charakteristiky lymfocytotransformačného testu a ELISA testu na stanovenie interleukínu 5 (IL-5) ako potenciálnych diagnostických testov. Naše výsledky naznačujú možnosť využitia oboch testov na in vitro diagnostiku niklom vyvolaného kontaktného ekzému. Rozšírenie vyšetrených súborov je však nevyhnutné na potvrdenie tohto záveru.
Kľúčové slová:
diagnostika – kontaktný ekzém – lymfocytotransformačný test – ELISA – IL-5Úvod
Kontaktný ekzém patrí medzi najčastejšie sa vyskytujúce choroby kože, často má charakter profesionálnej dermatózy a jeho sociálno-ekonomické dôsledky môžu byť pre postihnutých jedincov a celú spoločnosť značné. Diagnostika príčiny kontaktného ekzému sa v súčasnosti opiera takmer výlučne o výsledky epikutánnych kožných testov, ktoré sú v prípade súladu s anamnestickými údajmi a klinickým obrazom jediným kritériom podporujúcim diagnózu. Epikutánne testovanie však má aj niektoré nedostatky – ich odčítanie je subjektívnou interpretáciou zrakového vnemu a je závislé od skúsenosti vyšetrujúceho (4), výsledky môžu byť ovplyvnené pôsobením hormónov, niektorých liekov alebo ultrafialového žiarenia a nezanedbateľná je aj časová náročnosť vyšetrenia. Navyše, kontraindikácie, respektíve ťažkosti technického charakteru, bránia využitiu epikutánneho testovania napr. u tehotných žien alebo u pacientov s generalizovanými zápalovými dermatózami, diskutovaná je aj otázka možnosti senzibilizácie pacienta expozíciou kontaktnému alergénu. Senzitívnosť a špecifickosť epikutánnych testov sa odhaduje na 70 %–80 % (12), hodnotenie ich reprodukovateľnosti poukázalo na možnosť dyskordantných výsledkov pri opakovanom vyšetrení pacienta tým istým alergénom s časovým odstupom (18). Mnoho úsilia bolo preto venovaného hľadaniu alternatívnych, predovšetkým in vitro diagnostických postupov, ktoré by mohli doplniť a prípadne aj nahradiť epikutánne kožné testy pri diagnostike príčiny kontaktného ekzému.
V patogenéze kontaktného ekzému rozhodujúcu úlohu zohráva oneskorená, bunkami sprostredkovaná precitlivenosť a efektorovými bunkami sú tak CD4 ako aj CD8 T-lymfocyty (8). Pri štúdiu možností in vitro diagnostiky tejto dermatózy sa preto pozornosť sústreďuje predovšetkým na vyšetrenie reakcie lymfocytov periférnej krvi pacienta na kontakt s podozrievaným alergénom. Najviac študovaným in vitro ukazovateľom precitlivenosti pacienta je antigénom indukovaná proliferácia lymfocytov – v tzv. lymfocytotransformačnom teste (LTT) sa prostredníctvom kvantitatívneho stanovenia inkorporácie tríciom rádioaktívne značeného tymidínu do novosyntetizovanej DNA deliacich sa buniek hodnotí stupeň ich proliferačnej reakcie (9, 14, 17, 28, 35). V ostatných rokoch sa objavili práce hodnotiace iný možný in vitro diagnostický postup – sledovanie podozrievaným alergénom indukovanej sekrécie rôznych cytokínov pomocou ELISA alebo ELISpot testov (19, 26, 30). Výsledky štúdií rôznych autorov sa však značne rozchádzajú v hodnotení využiteľnosti týchto testov pri diagnostike kontaktného ekzému.
V našej práci sme prostredníctvom vyšetrenia súboru pacientov s kontaktnou precitlivenosťou na nikel a kontrolného súboru zdravých dobrovoľníkov hodnotili charakteristiky lymfocytotransformačného testu a ELISA testu na stanovenie interleukínu (IL)-5 ako potenciálnych diagnostických testov pri kontaktnom ekzéme.
Metódy
Vyšetrené súbory
Vyšetrený súbor pacientov tvorilo 20 osôb (17 žien a 3 muži) vo veku 18–50 rokov (priemer 38,9 roka) s klinickým obrazom kontaktného ekzému a diagnózou potvrdenou pozitívnym výsledkom epikutánneho testu, hodnoteným ako reakcia ++ alebo +++ intenzity. Do súboru boli zaradení len pacienti s kontaktnou precitlivenosťou na nikel (v niektorých prípadoch aj na kobalt), ale nie na iné alergény zo štandardnej série epikutánnych testov. Kontrolný súbor tvorilo 20 zdravých dobrovoľníkov (14 žien a 6 mužov) vo veku 19–48 rokov (priemer 30,7 roka) s negatívnym výsledkom vyšetrenia rutínnej série epikutánnych testov. Podmienkou zaradenia do štúdie bola u pacientov aj kontrolných osôb negatívna osobná anamnéza atopie, fyziologická hodnota hladiny celkového IgE a negatívne skríningové vyšetrenie špecifických IgE voči zmesi 11 najrozšírenejších inhalačných atopických alergénov (pele stromov, tráv a burín, vzdušné plesne, roztoče Dermatophagoides, epitélie psa a mačky) (Phadiatop®, Pharmacia Diagnostics, Uppsala, Švédsko).
Izolácia a skladovanie mononukleárnych leukocytov
Od všetkých vyšetrených osôb sme odobrali venepunkciou po 30 ml venóznej krvi. Od pacientov sme krv odoberali počas remisie ekzému, žiadny z nich neužíval v čase odberu systémové kortikosteroidy alebo iné lieky s imunomodulačným účinkom. Medzi epikutánnym testovaním a odberom krvi bol u všetkých vyšetrených osôb odstup najmenej 6 týždňov. Od 10 pacientov sme krv odobrali dvakrát, s časovým intervalom 3–4 mesiacov. Mononukleárne leukocyty sme izolovali z heparinizovanej venóznej krvi pomocou centrifugácie vo Ficoll-Paque Plus® (Pharmacia Biotech, Sollentuna, Švédsko). Získanú bunkovú suspenziu sme použili v LTT teste resp. ELISA teste s čerstvo izolovanými lymfocytmi, u 10 pacientov a 10 kontrolných osôb sme časť suspenzie po postupnom zmrazení v médiu RPMI-1640 (Gibco BRL, Life Technologies Ltd., Paisley, Veľká Británia), obsahujúcom 20 % ľudského teplom-inaktivovaného AB+ séra a 7,5 % dimetysulfoxidu (Sigma, Saint Louis, Missouri, USA), skladovali v koncentrácii 1x107 buniek/ml pri – 150 °C po dobu niekoľkých mesiacov a v LTT teste použili po rozpustení, premytí v kultivačnom médiu a kontrole viability pomocou testu s trypanovou modrou.
Epikutánne testy
Rutínna séria alergénov pre epikutánne testovanie (Chemotechnique Diagnostics, Malmö, Švédsko) bola aplikovaná na kožu chrbta všetkých vyšetrených osôb v komôrkach Finn Chambers® (Epitest, Helsinki, Fínsko) po dobu 48 hodín a výsledky testov boli odčítané 30 minút po ich sňatí a znovu po ďalších 48 hodinách. Intenzita reakcie bola semikvantitatívne hodnotená v rozsahu – až +++, podľa odporučenia ICDRG („International Contact Dermatitis Research Group”) (22).
Lymfocytotransformačný test
Mononukleárne bunky izolované z periférnej krvi sme kultivovali v koncentrácii 2x106 buniek/ml v médiu RPMI-1640 doplnenom o L-glutamín (2 μmol/ml), streptomycín (100 μg/ml), penicilín (100 IU/ml) (všetko Gibco BRL, Life Technologies Ltd., Paisley, Veľká Británia) a 10 % teplominaktivovaného ľudského AB+ séra. Bunky od každej vyšetrenej osoby sme kultivovali v 12 jamkách 96-jamkovej mikrotitračnej doštičky s plochým dnom (Falcon, Becton Dickinson Labware, Franklin Lakes, New Jersey, USA) pri 37 °C v atmosfére s 5 % CO2. Po 30-minútovej preinkubácii sme do 6 jamôk pridali ku 100 μl suspenzie buniek po 20 μl roztoku NiSO4.6H2O (Merck, Darmstad, Nemecko) vo fyziologickom roztoku NaCl (9 mg/ml) tak, aby výsledná koncentrácia síranu nikelnatého bola 3,8.10-5 mol/l. K bunkám v druhej, kontrolnej šestici jamôk sme pridali po 20 μl fyziologického roztoku NaCl. Kultúry sme inkubovali po dobu 5 dní a na posledných 6 hodín sme do každej jamky pridali 0,5 μCi 3H-tymidínu (špecifická aktivita 5 Ci/mmol, Pharmacia-Amersham, Buckinghamshire, Veľká Británia) v 10 μl fyziologického roztoku NaCl. Po ukončení kultivácie sme bunky pomocou podtlaku (Skatron cell harvester, Molecular Devices Co., Sunnyvale, California, USA) preniesli na filter zo sklených vláken a po ich vysušení sme rádioaktivitu inkorporovanú do deliacich sa buniek z každej jamky merali na scintilačnom spektrofotometri Packard (Packard BioScience Co., Meriden, Connecticut, USA). Výsledok sme vyjadrili vo forme stimulačného indexu (SI), ktorý je pomerom priemerného počtu impulzov za minútu (cpm) v jamkách s bunkami stimulovanými niklom a v kontrolných jamkách.
ELISA test na stanovenie IL-5
500 μl suspenzie čerstvo izolovaných mononukleárnych buniek s koncentráciou 2x106 buniek/ml média sme 6 dní inkubovali (v rovnakom kultivačnom médiu ako pri LTT teste) v plastových skúmavkách so 100 μl roztoku síranu nikelnatého (38 μmol/l) pri 37 °C v atmosfére obohatenej o 5 % CO2. Kontrolné, nestimulované kultúry boli namiesto niklu doplnené o 100 μl fyziologického roztoku NaCl (9 mg/ml). Po ukončení kultivácie sme bunky odstránili centrifugáciou a supernatanty skladovali zmrazené pri -70 °C. Na vyšetrenie obsahu cytokínov v supernatantoch sme použili metódu enzýmovej imunosorbentovej analýzy s využitím setu na stanovenie IL-5 (human DuoSet ELISA development systems, R&D systems, Minneapolis, MN, USA). Od hodnoty adsorbancie nameranej vo vyšetrovanej vzorke sme odčítali hodnotu adsorbancie v nestimulovanej vzorke (na vylúčenie vplyvu spontánnej sekrécie cytokínu) a koncentráciu niklom-indukovanej produkcie interleukínu v supernatante sme stanovili odčítaním z kalibračnej krivky.
Výpočet charakteristík testov LTT a ELISA
Pri arbitrárnom stanovení hraníc pozitívnosti LTT aj ELISA testu sme vychádzali z výsledkov v kontrolnom súbore a určili sme ich tak, aby test mal čo najvyššiu senzitívnosť a súčasne aj špecifickosť, t.j. poskytoval čo najnižší počet falošne pozitívnych aj falošne negatívnych výsledkov. Použili sme metódu analýzy ROC („receiver operating characteristics“) krivky pomocou software MedCalc® (MedCalc Software, Belgicko). Ako referenčnú metódu sme pri kalkulácii charakteristík LTT aj ELISA testu využili epikutánne testy, ktorých výsledky sme pre tento výpočet považovali za zodpovedajúce reálnemu stavu, za skutočne pozitívne resp. skutočne negatívne. Senzitívnosť konkrétneho testu pre stanovenú hranicu pozitívnosti je v percentách vyjadrený pomer počtov testom správne určených ako pozitívne a všetkých skutočne pozitívnych výsledkov, neidentifikované sú falošne negatívne výsledky. Špecifickosť je pri stanovenej hranici pozitívnosti v percentách vyjadrený pomer počtov testom správne určených ako negatívne a všetkých skutočne negatívnych výsledkov, nesprávne identifikované sú falošne pozitívne výsledky. Správnosť („accuracy“) je vyjadrením schopnosti testu poskytnúť pravdivý diagnostický záver pri stanovenej hranici pozitívnosti vyšetrovanej hodnoty. Je to v percentách vyjadrený pomer počtov všetkých správne určených (negatívnych aj pozitívnych) výsledkov a všetkých vyšetrených osôb (10).
Štatistika
Na štatistické hodnotenie významnosti rozdielu výsledkov LTT resp. ELISA testu medzi súbormi vyšetrených osôb sme použili neparametrický Mannov-Whitneyov test. Štatistickú významnosť rozdielov výsledkov testu pri použití. čerstvo izolovaných a zmrazených mononukleárnych buniek, resp. pri použití buniek z dvoch rôznych odberov krvi sme hodnotili neparametrickým párovým Wilcoxonovým testom. Korelácie sme hodnotili neparametrickým Spearmanovým testom. Za štatisticky významnú sme považovali hodnotu p ≤ 0,5. Použili sme software StatView® (SAS Institute Inc., USA).
Výsledky
Výsledky epikutánnych testov so síranom nikelnatým a namerané hodnoty stimulačného indexu a sekretovaného IL-5 po stimulácii mononukleárnych buniek periférnej krvi u všetkých vyšetrených osôb sú zhrnuté v tab. 1.
Tab. 1. Výsledky epikutánnych testov a namerané hodnoty stimulačného indexu a sekrécie IL-5 po stimulácii mononukleárnych buniek periférnej krvi niklom 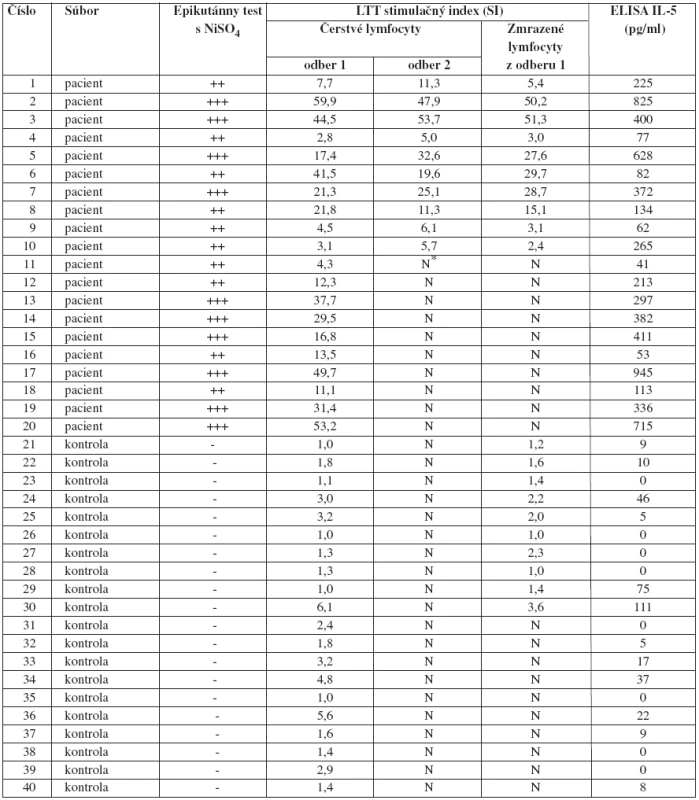
*N = nevyšetřené Na obr. 1 sú znázornené výsledky vyšetrení proliferačnej odpovede čerstvo izolovaných mononukleárnych buniek periférnej krvi na in vitro stimuláciu iónmi Ni2+, vyjadrené ako stimulačné indexy v obidvoch vyšetrených súboroch. Lymfocyty pacientov s kontaktným ekzémom (priemer x = 24,20; stredná chyba priemeru SEM = 4,05) reagovali v teste štatisticky vysoko signifikantne intenzívnejšie ako lymfocyty zdravých dobrovoľníkov (priemer x = 2,35; SEM = 0,35) (p < 0,0001).
Obr. 1. Proliferačná odpoveď mononukleárnych buniek periférnej krvi na stimuláciu niklom v súbore pacientov s kontaktnou precitlivenosťou na nikel a v kontrolnom súbore zdravých osôb. Vodorovnými čiarami sú znázornené priemerné hodnoty stimulačného indexu v oboch súboroch. 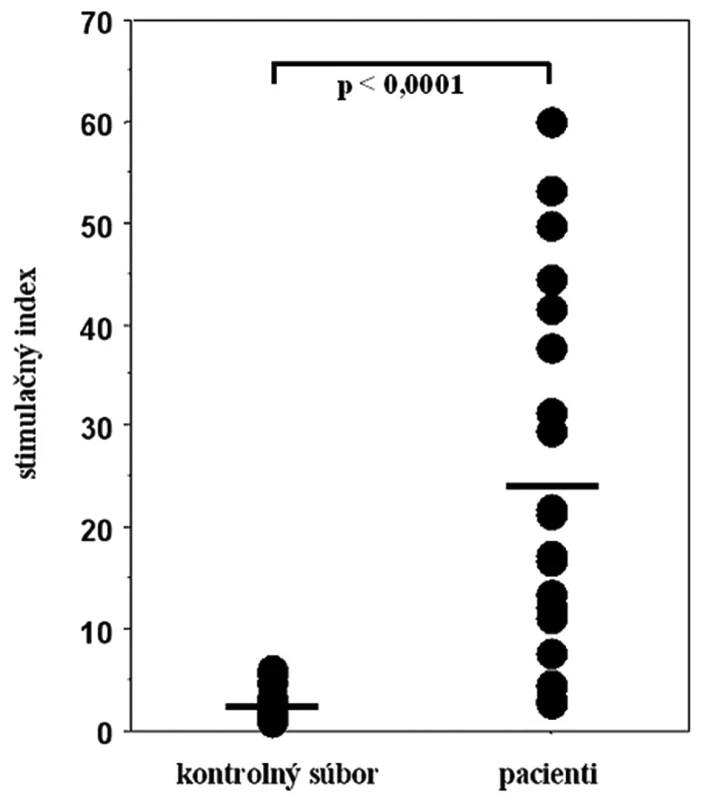
Lymfocyty v kontrolných, nestimulovaných kultúrach pacientov aj zdravých osôb spontánne produkovali len minimálne množstvá IL-5 a bunky zdravých osôb nereagovali na stimuláciu niklom štatisticky významným zvýšením sekrécie cytokínu v porovnaní s bazálnou, nestimulovanou produkciou. Niklom stimulované mononukleárne bunky periférnej krvi pacientov s precitlivenosťou na nikel produkovali signifikantne viac IL-5 (priemer x = 328,80 pg/ml, SEM = 59,59 pg/ml) ako bunky kontrolných osôb (priemer x = 17,70 pg/ml, SEM = 6,55 pg/ml) (p < 0,0001). Množstvá niklom-indukovaného IL-5 sekretovaného do supernatantov kultúr mononukleárnych buniek periférnej krvi oboch vyšetrených súborov sú znázornené na obr. 2.
Obr. 2. Sekrécia IL-5 mononukleárnymi bunkami periférnej krvi po stimulácii niklom v súbore pacientov s kontaktnou precitlivenosťou na nikel a v kontrolnom súbore zdravých osôb. Vodorovnými čiarami sú znázornené priemerné hodnoty sekretovaného IL-5 v oboch súboroch 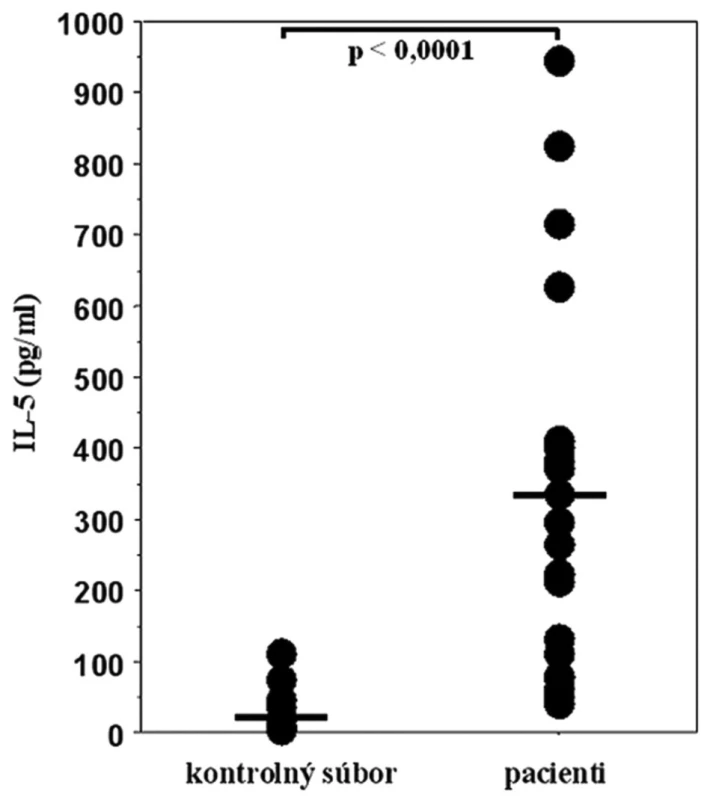
Z analýzy ROC kriviek pri zohľadnení požiadavky čo najvyššej senzitívnosti a súčasne špecifickosti oboch testov vyplynuli hranice pozitívnosti pre LTT test stimulačný index S.I. = 3,3 a pre ELISA test koncentrácia IL-5 = 47 pg/ml. Charakteristiky použitých testov pri týchto hraniciach pozitívnosti sú uvedené v tab. 2.
Tab. 2. Charakteristiky hodnotených testov pri uvedenej hranici pozitívnosti 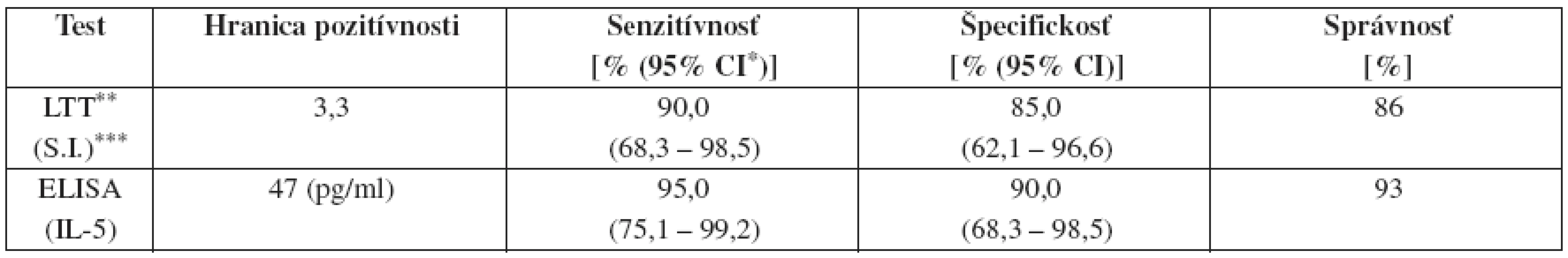
*95% CI = 95% konfidenčný interval, **LTT = lymfocytotransformačný test, ***S.I. = stimulačný index Namerané hodnoty stimulačného indexu v súbore pacientov signifikantne korelovali s intenzitou reakcie v epikutánnom teste (korelačný koeficient r = 0,711; p = 0,0019), rovnako ako výsledky stanovenia sekrécie IL-5 (r = 0,867; p = 0,0002). Výsledky LTT a ELISA testov v pacientskom súbore signifikantne korelovali aj navzájom (r = 0,692; p = 0,0026) (obr. 3).
Obr. 3. Korelácia proliferačnej a sekrečnej odpovede mononukleárnych buniek periférnej krvi na stimuláciu niklom v súbore pacientov s kontaktným ekzémom. 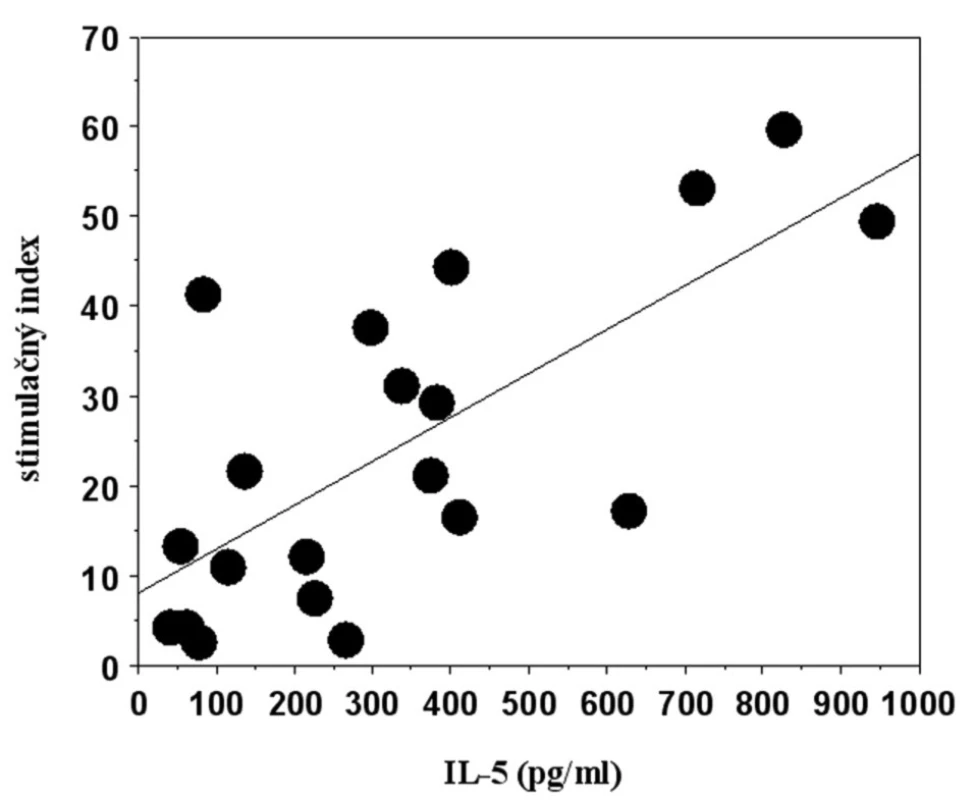
Medzi hodnotami stimulačného indexu získanými pri vyšetrení čerstvo izolovaných mononukleárnych buniek pochádzajúcich z dvoch rôznych odberov krvi od 10 pacientov s kontaktným ekzémom nebol štatisticky signifikantný rozdiel. Ani v jednom prípade sme nezaznamenali dyskordanciu diagnostického záveru testu pri porovnaní výsledkov vyšetrení lymfocytov z prvého a druhého odberu.
Ani štatistické vyhodnotenie nameraných hodnôt stimulačného indexu pri vyšetrení čerstvo izolovaných a v zmrazenom stave skladovaných mononukleárnych buniek z periférnej krvi 10 pacietov s kontaktným ekzémom a 10 zdravých kontrolných osôb neukázalo signifikantný rozdiel v proliferačnej odpovedi čerstvých a skladovaných lymfocytov. V prípade jedného pacienta s kontaktným ekzémom (číslo 1 v tab. 1), ktorý bol pri vyšetrení čerstvo izolovaných lymfocytov testom správne označený ako precitlivený na nikel, sme však pri vyšetrení skladovaných lymfocytov zaznamenali slabšiu proliferačnú odpoveď vedúcu k falošne negatívnemu výsledku.
Diskusia
Súčasný „zlatý štandard” diagnostiky kontaktného ekzému, epikutánne testy, majú niektoré obmedzenia a ich využitie nie je vždy možné resp. bezproblémové. Okruh kontraindikácií ich aplikácie nie je široký a zväčša sa jedná o kontraindikácie dočasné. Závažnejším faktorom je subjektívny charakter odčítania ich výsledkov. Napriek snahám však ani súčasné najmodernejšie metódy merania prietoku krvi, intenzity erytému alebo zmien objemu kože nedokážu nahradiť inšpekciu, palpáciu a klinickú skúsenosť lekára, aj keď v ostatnom čase sa objavili správy o možnom využití reflektančnej konfokálnej mikroskopie (32). Ťažkosti môžu vznikať aj pri interpretácii výsledkov kožných testov. V klinickej praxi nezriedka vznikajú problémy predovšetkým s hodnotením relatívne častých pozitívnych, ale klinicky a anamnesticky irelevantných reakcií (11), alebo s odlíšením reakcií toxických (iritačných). Príčinou falošne negatívnej reakcie býva najčastejšie chyba v technike testovania, ale napríklad Rustemeyer a spolupracovníci (30) zaznamenali v štúdii s pacientmi alergickými na nikel až 46% falošne negatívnych výsledkov pri epikutánnom testovaní na špecializovanom pracovisku a ich výsledky nie je možné vysvetliť nesprávnym postupom pri testovaní. Príčinou mohli byť fyzikálno-chemické faktory ovplyvňujúce penetráciu resp. väzbu alergénu. Aj štúdie reprodukovateľnosti epikutánnych testov poukázali na určitý problém pri hodnotení výsledkov tohto vyšetrenia. Napríklad porovnanie reakcií na dve rovnaké sady kontaktných alergénov aplikované súčasne na protiľahlé polovice chrbta ukázalo úplnú dyskordanciu, t.j. negatívny výsledok na jednej a pozitívny výsledok testu s tým istým alergénom na druhej strane chrbta, u 8% z 383 pacientov (2). Potenciálnym, aj keď len minimálnym, rizikom pri epikutánnom testovaní je aj možnosť aktívnej senzibilizácie dovtedy neprecitliveného pacienta, najmä pri testovaní niektorých alergénov s vyšším senzibilizačným potenciálom (napr. zmes seskviterpénlaktónov alebo primín) (20, 21).
Ťažkosti pri hodnotení výsledkov epikutáneho testovania je možné v niektorých prípadoch vyriešiť jeho doplnením vytestovaním pacienta otvorenou metódou – napríklad testom opakovanej otvorenej aplikácie (ROAT – „repeated open application test”). Iným možným riešením je využitie in vitro vyšetrovacej metódy, ktorá by sa mohla uplatniť nielen ako doplnková k epikutánemu testovaniu, ale aj ako alternatívna v prípade kontraindikácie alebo iného dôvodu nemožnosti realizácie kožných testov. S výnimkou ojedinelých štúdií možnosti využitia testu inhibície migrácie makrofágov (35) sa pozornosť sústreďuje predovšetkým na hodnotenie podozrievaným alergénom indukovanej proliferačnej alebo sekrečnej odpovede lymfocytov z periférnej krvi pacienta. Proliferačná reakcia sa hodnotí najčastejšie pomocou lymfocytotransformačného testu (LTT) alebo jeho modifikácií, sekrečná odpoveď sa môže hodnotiť meraním produkcie rôznych cytokínov pomocou ELISA alebo ELISpot testu (3).
Spoločnou nevýhodou proliferačného aj sekrečného testu je možnosť ich uplatnenia len v prípade vo vode rozpustných alergénov, proliferačný test znevýhodňuje využitie rádioaktívneho trícia (aj keď sa jedná o slabý žiarič). Na druhej strane, výsledky týchto testov možno objektívne vyhodnotiť, nevyžadujú kontakt pacienta s potenciálne senzibilizujúcimi substanciami a výraznejšie neobmedzujú jeho aktivity. Doteraz boli v experimentálnych štúdiách a ojedinelých klinických kazuistikách niektorým z týchto testov hodnotené reakcie lymfocytov periférnej krvi len na niektoré zo širokej škály potenciálnych kontaktných alergénov – najčastejšie na nikel, ale aj na iné kovy, niektoré lieky na topické použitie, metylizotiazolinóny, vonné látky alebo parafenyléndiamín (17, 27). Dôkazom o tom, že o takúto diagnostickú možnosť je skutočný záujem, je diskusia, ktorá sa rozpútala na stránkach časopisu Contact Dermatitis, keď sa v ňom objavil článok referujúci o úspešnom využití LTT testu na dôkaz precitlivenosti pacienta na minoxidil v roztoku na lokálne použitie (1, 17, 24, 37). Na druhej strane, často referovaná nedostatočná senzitívnosť a/alebo špecifickosť týchto metód zatiaľ bráni ich rutínnemu využitiu v praxi a je aj dôvodom snáh o zlepšenie ich výpovednej hodnoty pridávaním reaktivitu-stimulujúcich cytokínov (najmä IL-4, IL-7 a IL-12, resp. ich zmesí) do kultivačného média, tak v prípade LTT ako aj ELISA, resp. ELISpot testov (27, 30, 31). Takýto postup môže špecifickú proliferáciu alebo sekréciu cytokínov výrazne zosilniť, znamená však umelý zásah a tým aj potenciál ovplyvnenia priebehu reakcie a zvýšené riziko nesprávneho vyhodnotenia jej výsledku.
V súlade so súčasným názorom na etiopatogenézu kontaktného ekzému viacerí autori dokázali, že lymfocyty periférnej krvi alergického pacienta môžu po stimulácii relevantným kontaktným alergénom sekretovať cytokíny typu 1 (IL-2, interferón IFN-γ) aj typu 2 (IL-4, IL-5, IL-13) (16, 23, 25). Produkcia cytokínov typu 2 je pritom nezávislá na atopickej konštitúcii pacienta (5, 33). V rôznych štúdiách boli preto hodnotené testy založené na indukcii sekrécie rozdielnych cytokínov, ich diskriminačná schopnosť odlíšiť nealergických a precitlivených jedincov sa líšila v závislosti od vyšetrovaného alergénu. Interferón γ sa napr. ukázal ako nevhodný na odlíšenie jedincov alergických na nikel (31), ale s vysokou senzitívnosťou aj špecifickosťou diagnostikoval pacientov s kontaktným ekzémom vyvolaným zlatom (10). Pri vyšetrovaní precitlivenosti na nikel autori hodnotili ako najvýhodnejšie využitie sledovanie sekrécie IL-2, IL-4, IL-5 alebo IL-13, a to tak v systémoch bez ako aj s pridaním stimulačných cytokínov (19, 26, 31).
V našej štúdii sme v ELISA teste na diagnostiku niklom vyvolaného kontaktného ekzému zvolili ako indikátorový cytokín IL-5, ktorý je nestimulovanými lymfocytmi sekretovaný len v minimálnych množstvách, na rozdiel od IL-13 (19). Nevýhodou využitia ELISA testu s IL-4 v porovnaní s IL-5 je možnosť konzumpcie IL-4 kultivovanými bunkami, pretože všetky typy mononukleárnych buniek periférnej krvi exprimujú IL-4 receptor (ale nie IL-5 receptor) a môžu tento cytokín spotrebovávať (15). Podobne sa na svoje receptory na lymfocytoch môže viazať aj IL-2.
Hodnotenie laboratórnej metódy z hľadiska jej potenciálneho využitia v diagnostike sa zvyčajne opiera o porovnanie s referenčným diagnostickým postupom, ktorého výsledky sa považujú za zodpovedajúce skutočnosti. V našej štúdii sme za takýto referenčný diagnostický postup považovali epikutánne testovanie, hoci jeho senzitívnosť ani špecifickosť nedosahuje 100%. Porovnanie výsledkov kožných testov s anamnézou a klinickým obrazom však umožňuje vyčleniť spomedzi všetkých vyšetrených jedincov podskupiny osôb skutočne alergických a skutočne neprecitlivených na testovaný alergén. V našej štúdii sme do súboru pacientov zaradili len osoby s klinicky relevantným pozitívnym výsledkom epikutánneho testu a do kontrolného súboru len jedincov s negatívnou anamnézou ekzémovej dermatózy a negatívnym výsledkom epikutánneho testu. Takýto výber nás oprávnil považovať zloženie vyšetrených súborov za zodpovedajúce skutočnému stavu reaktivity voči iónom niklu.
Stanovenie špecifickosti a senzitívnosti potenciálneho diagnostického testu závisí okrem spoľahlivej referenčnej metódy aj od do určitej miery arbitrárne určenej hranice jeho pozitívnosti. Bežným postupom stanovenia tejto hranice je jednoduché využitie štatistických charakteristík polohy a rozptylu – priemerná hodnota v kontrolnom súbore zväčšená o jej dve alebo tri smerodajné odchýlky sa ako hranica pozitívnosti často uplatňuje napríklad pri konštrukcii rôznych ELISA testov na sérologickú diagnostiku, ale aj pri sledovaní sekrécie cytokínov pri kontaktnom ekzéme (6, 26). Tento postup zabezpečí vysokú špecifickosť, ale často na úkor senzitívnosti – vysoká hranica pozitívnosti nesie so sebou riziko testom poskytovaných falošne negatívnych výsledkov, hodí sa preto najmä pre testy konfirmačné. Iným postupom stanovenia hranice pozitívnosti testu, ktorý sa v ostatnom čase začína viac využívať, je analýza ROC („receiver operating characteristics“) krivky. Umožňuje zvoliť takú hodnotu hranice, aby bol test čo najšpecifickejší a súčasne čo najsenzitívnejší (10, 30) a jeho diagnostická hodnota čo najvyššia. V našej štúdii by napríklad využitie hranice pozitívnosti rovnej priemeru kontrolnej skupiny zväčšenému o tri smerodajné odchýlky viedlo k zhoršeniu správnosti ELISA testu z 93 % na 85 %.
Potenciálna diagnostická vyšetrovacia metóda sa najčastejšie hodnotí pomocou stanovenia jej senzitívnosti, špecifickosti a správnosti. Určenie ďalších charakteristík testu, predovšetkým pozitívnej a negatívnej prediktívnej hodnoty, je možné len pri známej prevalencii vyšetrovanej choroby v konkrétnej populácii resp. prevalencii zodpovedajúcom zložení vyšetrovaných súborov (13), komplikujúcim je aj fakt, že prevalencia precitlivenosti na nikel je odlišná medzi pohlaviami (29, 34). V našej štúdii preto prediktívne hodnoty testov neuvádzame.
Špecifickosť aj senzitívnosť LTT pri diagnostike kontaktnej precitlivenosti na nikel sa podľa publikovaných skúseností pohybuje v širokom rozmedzi, najčastejšie sa špecifickosť testu udáva medzi 60 %–80 %, senzitívnosť v rozsahu 60 %–95 % (30, 35). Podľa našich výsledkov sú charakteristiky testu na horných hraniciach týchto udávaných rozmedzí a preto aj nami vyhodnotená správnosť testu je výrazne vyššia ako hodnota 68 %, ktorú zaznamenali Rustemeyer a spolupracovníci (30). Rovnako ako v prípade alergénom indukovanej proliferácie lymfocytov aj pri hodnotení sekrečnej odpovede lymfocytov na stimuláciu niklom sa závery autorov veľmi líšia. Moed so spolupracovníkmi (27) pomocou sledovania sekrécie IL-5 v ELISA teste dokázali precitlivenosť u všetkých siedmich vyšetrených pacientov s kontaktným ekzémom vyvolaným týmto kovom, v kontrolnej skupine siedmich zdravých osôb zaznamenali jeden falošne pozitívny výsledok. Naopak, Rustemeyer so spolupracovníkmi (30) po vyšetrení 156 osôb vyhodnotili senzitívnosť IL-5 ELISA testu ako potenciálnej diagnostickej metódy na dôkaz alergie na nikel len na 61 % a jeho špecifickosť na 84 %. Až pridanie stimulačných cytokínov do kultivačného média zvýšilo správnosť ich testu zo 75 % na 83 %.
Charakteristiky oboch nami hodnotených testov na diagnostiku kontaktného ekzému na nikel patria pri porovaní s hodnotami publikovanými inými autormi medzi najlepšie. Rozdiely v hodnotení testov môžu mať viaceré príčiny. Okrem už diskutovanej otázky postupu stanovenia hranice pozitívnosti testu to môžu byť aj iné faktory technického charakteru – napríklad v predbežných experimentoch stanovená optimálna použitá koncentrácia alergénu alebo dĺžka inkubácie lymfocytov s alergénom. Určitú minimálnu proliferačnú odpoveď lymfocytov na stimuláciu iónmi niklu sme zaznamenali aj v kontrolnom súbore. Svedčí to o miernom nešpecifickom, mitogénnom účinku niklu. Navyše, príliš vysoká koncentrácia niklu môže pôsobiť na lymfocyty toxicky (25). Nami použitá koncentrácia síranu nikelnatého bola stanovená v predbežných experimentoch tak, aby bola zabezpečená dostatočná senzitívnosť oboch metód na jednej strane a súčasne minimalizovaný nešpecifický stimulačný a prípadný toxický účinok niklu na strane druhej. Podobne, optimálne zvolený čas inkubácie lymfocytov s alergénom môže veľmi ovplyvniť charakteristiky testu – sekrécia rôznych cytokínov má odlišnú dynamiku (10). Dôležitým faktorom je aj vyšetrenie dostatočne vysokých počtov osôb a to tak v pacientskom ako aj kontrolnom súbore, z tohto hľadiska považujeme závery našej štúdie za predbežné a bude nutné ju rozšíriť o vyšetrenie ďalších osôb.
Dôvodom vysokej senzitívnosti aj špecifickosti nami použitých testov môže byť aj vylúčenie atopických osôb z vyšetrovaných súborov. Väčšina iných autorov atopickú konštitúciu vyšetrovaných osôb neskúmala. Kontraindikáciou zaradenia do našej štúdie bola u pacientov aj kontrolných osôb anamnéza, laboratórny nález alebo klinický obraz svedčiaci pre akúkoľvek formu atopie. Atopická konštitúcia je spojená s dysbalanciou v systéme subpopulácií lymfocytov, ktorá by mohla ovplyvniť výsledky testu založeného na hodnotení proliferačnej alebo sekrečnej aktivity týchto buniek (7). Na druhej strane, v praxi využívaný vyšetrovací test musí umožniť urobiť diagnostický záver s dostatočne vysokou správnosťou u všetkých vyšetrovaných osôb, bez ohľadu na ich atopický status alebo choroby. Zhodnotenie charakteristík nami použitých testov pri vyšetrení kontaktnej precitlivenosti na nikel v súbore atopických osôb a v z tohto hľadiska neselektovanom súbore bude obsahom našej ďalšej štúdie.
Len štatisticky nesignifikantné rozdiely výsledkov vyšetrení proliferačnej reakcie na stimuláciu niklom a najmä nezmenený diagnostický záver LTT testu pri vyšetrení lymfocytov pochádzajúcich z dvoch rôznych odberov krvi s časovým odstupom 3–4 mesiacov v malom podsúbore našich pacientov naznačujú dobrú reprodukovateľnosť testu. Výhodnou je aj možnosť použitia v zmrazenom stave skladovaných lymfocytov, aj keď nami pozorovaný prípad falošne negatívneho výsledku LTT testu pri vyšetrení rozmrazených buniek jedného z pacientov poukazuje na možnosť ovplyvnenia ich proliferačnej schopnosti v procese zmrazovania resp. rozmrazovania. Bol však zavinený pravdepodobne len technickou chybou v tomto procese. Viacerí autori postup skladovania lymfocytov v zmrazenom stave vo svojich štúdiách použili, a to tak pri LTT, ako aj ELISA, resp. ELISpot testoch (26, 27). Nezmenenú schopnosť rozmrazených lymfocytov sekretovať po stimulácii mitogénom cytokíny dokázali Wang so spolupracovníkmi (36).
Záverom, naše výsledky naznačujú možnosť využitia LTT aj IL-5 ELISA testu na in vitro diagnostiku kontaktného ekzému vyvolaného niklom. Stanovenie niklom indukovanej sekrécie IL-5 pritom dosiahlo vyššiu špecifickosť, senzitívnosť a správnosť testu ako hodnotenie proliferačnej reakcie. Rozšírenie vyšetrených súborov je však nevyhnutné na potvrdenie týchto záverov.
Poznámka: Laboratórna časť práce bola vypracovaná počas študijného pobytu autora na Kožnej klinike Karolinskej univerzitnej nemocnice v Štokholme
Došlo do redakce 10. 1. 2008
MUDr. Dušan Buchvald, PhD.
Detská dermatovenerologická klinika LF UK a DFNsP
Limbová 1
833 40 Bratislava
E-mail: buchvald@nextra.sk
Zdroje
1. BASKETTER, D., MENNE, T. Lymphocyte transformation test in patients with allergic contact dermatitis. Contact Dermatitis, 2005, 53 (1), p. 1.
2. BOURKE, JF., BATTA, K., PRAIS, L. et al. The reproducibility of patch tests. Br J Dermatol, 1999, 140 (1), p. 102-105.
3. BREHLER, R., MERK, H. In-vitro-Tests zum Nachweis von Kontaktallergien. Hautarzt, 2005, 56 (12), p. 1141-1143.
4. BRUZE, M., ISAKSSON, M., EDMAN, B. et al. A study on expert reading of patch test reactions: inter-individual accordance. Contact Dermatitis, 1995, 32 (6), p. 331-337.
5. BUCHVALD, D. Indukcia sekrécie interleukínu (IL)-5 pri kontaktnom ekzéme. Derma, 2004, 4 (3), p. 4-8.
6. BUCHVALD, D., BUCHVALDOVÁ, D. Antigény pre ELISA test na sérodiagnostiku infekcie Helicobacter pylori. Cs Epidem, 1993, 42 (1), p. 16-21.
7. BUCHVALD, D., LUNDEBERG, L. Impaired responses of peripheral blood mononuclear cells to nickel in patients with nickel-allergic contact dermatitis and concomitant atopic dermatitis. Br J Dermatol, 2004, 150 (3), p. 484-492.
8. CAVANI, A., ALBANESI, C., TRAIDL, C. et al. Effector and regulatory T cells in allergic contact dermatitis. Trends Immunol, 2001, 22 (3), p. 118-120.
9. CEDERBRANT, K., HULTMAN, P., MARCUSSON, JA. et al. In vitro lymphocyte proliferation as compared to patch test using gold, palladium and nickel. Int Arch Allergy Immunol, 1997, 112 (3), p. 212-217.
10. CHRISTIANSEN, J., FARM, G., EID-FOREST, R. et al. Interferon-γ secreted from peripheral blood mononuclear cells as a possible diagnostic marker for allergic contact dermatitis to gold. Contact Dermatitis, 2006, 55 (2), p. 101-112.
11. DE GROOT, AC. Clinical relevance of positive patch test reactions to preservatives and fragrances. Contact Dermatitis, 1999, 41 (4), p. 224-227.
12. DEVOS, SA., VAN DER VALK, PGM. Epicutaneous patch testing. Eur J Dermatol, 2002, 12 (5), p. 506-513.
13. DIEPGEN, TL., COENRAADS, PJ. Sensitivity, specificity and positive predictive value of patch testing: the more you test, the more you get? ESCD Working Party on Epidemiology. Contact Dermatitis, 2000, 42 (6), p. 315-317.
14. EVERNESS, KM., GAWKRODGER, DJ., BOTHAM, PA. et al. The discrimination between nickel-sensitive and non-nickel-sensitive subjects by an in vitro lymphocyte transformation test. Br J Dermatol, 1990, 122 (3), p. 293-298.
15. EWEN, C., BACA-ESTRADA, ME. Evaluation of interleukin-4 concentration by ELISA is influenced by the consumption of IL-4 by cultured cells. J Interferon Cytokine Res, 2001, 21 (1), p. 39-43.
16. FALSAFI-AMIN, H., LUNDEBERG, L., BAKHIET, M. et al. Early DNA synthesis and cytokine expression in the nickel activation of peripheral blood mononuclear cells in nickel-allergic subjects. Int Arch Allergy Immunol, 2000, 123 (2), p. 170-176.
17. HAGEMANN, T., SCHLUTTER-BOHMER, B., ALLAM, JP. et al. Positive lymphocyte transformation test in a patient with allergic contact dermatitis of the scalp after short-term use of topical minoxidil solution. Contact Dermatitis, 2005, 53 (1), p. 53-55.
18. HINDSEN, M., BRUZE, M., CHRISTENSEN, OB. Individual variation in nickel patch test reactivity. Am J Contact Dermat, 1999, 10 (2), p. 62-67.
19. JAKOBSON, E., MASJEDI, K., AHLBORG, N. et al. Cytokine production in nickel-sensitized individuals analysed with enzyme-linked immunospot assay: possible implication for diagnosis. Br J Dermatol, 2002, 147 (3), p. 442-449.
20. JENSEN, CD., PAULSEN, E., ANDERSEN, KE. Retrospective evaluation of the consequence of alleged patch test sensitization. Contact Dermatitis, 2006, 55 (1), p. 30-35.
21. KANERVA, L., ESTLANDER, T., ALANKO, K. et al. Patch test sensitization to Compositae mix, sesquiterpene-lactone mix, Compositae extracts, laurel leaf, Chlorophorin, Mansonone A, and dimethoxydalbergione. Am J Contact Dermat, 2001, 12 (1), p. 18-24.
22. KRASTEVA, M., KEHREN, J., SAYAG, M. et al. Contact dermatitis II. Clinical aspects and diagnosis. Eur J Dermatol, 1999, 9 (2), p. 144-159.
23. MASJEDI, K., AHLBORG, N., GRUVBERGER, B. et al. Methylisothiazolinones elicit increased production of both T helper (Th)1 - and Th2-like cytokines by peripheral blood mononuclear cells from contact allergic individuals. Br J Dermatol, 2003, 149 (6), p. 1172-1182.
24. MERK, HF. Lymphocyte transformation test as a diagnostic test in allergic contact dermatitis. Contact Dermatitis, 2005, 53 (4), p. 246.
25. MINANG, JT., ARESTROM, I., TROYE-BLOMBERG, M. et al. Nickel, cobalt, chromium, palladium and gold induce a mixed Th1 - and Th2-type cytokine response in vitro in subjects with contact allergy to the respective metals. Clin Exp Immunol, 2006, 146 (3), p. 417-426.
26. MINANG, JT., TROYE-BLOMBERG, M., LUNDEBERG, L. et al. Nickel elicits concomitant and correlated in vitro production of Th1-, Th2-type and regulatory cytokines in subjects with contact allergy to nickel. Scand J Immunol, 2005, 62 (3), p. 289-296.
27. MOED, H., VON BLOMBERG, M., BRUYNZEEL, DP. et al. Improved detection of allergen-specific T-cell responses in allergic contact dermatitis through the addition of ‘cytokine cocktails’. Exp Dermatol, 2005, 14 (8), p. 634-640.
28. RASANEN, L., TUOMI, ML. Diagnostic value of the lymphocyte proliferation test in nickel contact allergy and provocation in occupational coin dermatitis. Contact Dermatitis, 1992, 27 (4), p. 250-254.
29. RUFF, CA., BELSITO, DV. The impact of various patient factors on contact allergy to nickel, cobalt, and chromate. J Am Acad Dermatol, 2006, 55 (1), p. 32-39.
30. RUSTEMEYER, T., VON BLOMBERG, BME., VAN HOOGSTRATEN, IMW. et al. Analysis of effector and regulatory immune reactivity to nickel. Clin Exp Allergy, 2004, 34 (9), p. 1458-1466.
31. SPIEWAK, R., MOED, H., VON BLOMBERG, BME. et al. Allergic contact dermatitis to nickel: modified in vitro test protocols for better detection of allergen-specific response. Contact Dermatitis, 2007, 56 (2), p. 63-69.
32. SWINDELLS, K., BURNETT, N., RIUS-DIAZ, F. et al. Reflectance confocal microscopy may differentiate acute allergic and irritant contact dermatitis in vivo. J Am Acad Dermatol, 2004, 50 (2), p. 220-228.
33. SZEPIETOWSKI, JC., MCKENZIE, RC., KEOHANE, SG. et al. Atopic and non-atopic individuals react to nickel challenge in a similar way. A study of the cytokine profile in nickel-induced contact dermatitis. Br J Dermatol, 1997, 137 (2), p. 195-200.
34. UTER, W., PFAHLBERG, A., GEFELLER, O. et al. Risk factors for contact allergy to nickel-results of a multifactorial analysis. Contact Dermatitis, 2003, 48 (1), p. 33-38.
35. VON BLOMBERG-VAN DER FLIER, M., VAN DER BURG, CKH., POS, O. et al. In vitro studies in nickel allergy: diagnostic value of a dual parameter analysis. J Invest Dermatol, 1987, 88 (4), p. 362-368.
36. WANG, SY., HSU, ML., TZENG, CH. et al. The influence of cryopreservation on cytokine production by human T lymphocytes. Cryobiology, 1998, 37 (1), p. 22-29.
37. WOLF, R., DAVIDOVICI, B., MARCOS, B. et al. Lymphocyte transformation test in patients with allergic contact dermatitis. Contact Dermatitis, 2005, 53 (4), p. 245.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2008 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
-
Všechny články tohoto čísla
- Doškolování lékařů – Kontrolní test
- Diagnostika kontaktného ekzému in vitro – vyšetrenie mononukleárnych buniek periférnej krvi pacientov s kontaktnou precitlivenosťou na nikel lymfocytotransformačným testom a metódou ELISA na stanovenie interleukínu IL-5
- Kontaktní ekzém po tetováži henou
- Melanomový den poosmé
- Klinický případ: Papula s modřinovitým lemem na paži
- Francisco Goya: Španielsky kráľ Karol IV. s rodinou. Pohľad dermatológa a oftalmológa
- Prof. MUDr. Alexander Rehák, DrSc., zakladateľ modernej slovenskej dermatovenerológie
- Odborné akce v r. 2008
- Metastázy do kůže
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Metastázy do kůže
- Kontaktní ekzém po tetováži henou
- Diagnostika kontaktného ekzému in vitro – vyšetrenie mononukleárnych buniek periférnej krvi pacientov s kontaktnou precitlivenosťou na nikel lymfocytotransformačným testom a metódou ELISA na stanovenie interleukínu IL-5
- Klinický případ: Papula s modřinovitým lemem na paži
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



