-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Miliární BCG–pneumonitida: vzácná komplikace intravezikální terapie BCG
Miliary BCG–pneumonitis: a rare complication of intravesical BCG therapy
Adjuvant intravesical immunotherapy with Bacillus Calmette-Guérin (BCG) vaccine is an effective treatment for patients with high risk non-muscleinvasive bladder carcinoma. The therapy is usually well tolerated and accompanied only by local or mild systemic symptoms (dysuria, mild increase of body temperature). Life-threatening systemic complications (nephritis, pneumonitis, BCG - sepsis) occur rarely. Their diagnostics can be challenging due to non-specific symptoms and frequent negative findings in the urine, sputum or blood culture. A recommended treatment of systemic BCG infection is long-term antimicrobial therapy with chinolones and antituberculotics including the corticosteroids. Current knowledge of complications of intravesical BCG therapy comes mainly from individual case reports. We report a case of the patient with miliary BCG-pneumonitis. The aim of this work is to increase awareness of disseminated disease as a complication of intravesical BCG immunotherapy, discuss the diagnostic methods and emphasise early antitubercular therapy even without the demonstration of viable bacteria or positive cultures.
Keywords:
Bacillus Calmette-Guérin – disseminated pulmonary disease – immunotherapy – Mycobacterium bovis.
Autoři: Barbora Nechanská 1; Jan Zaplatílek 1; Richard Pabišta 1; Olga Zadražilová 2
Působiště autorů: Urologické oddělení, Oblastní nemocnice Mladá Boleslav, a. s., Mladá Boleslav 1; Plicní oddělení, Oblastní nemocnice Mladá Boleslav, a. s., Mladá Boleslav 2
Vyšlo v časopise: Ces Urol 2019; 23(2): 140-148
Kategorie: Kazuistika
Souhrn
Intravezikální imunoterapie Bacillus Calmette - Guérin (BCG) vakcínou je účinná adjuvantní léčba vysoce rizikového svalovinu neinfiltrujícího karcinomu močového měchýře. Terapie je obvykle dobře tolerována a provázena jen lokálními či mírnými celkovými příznaky (dysurie, subfebrilie). Život ohrožující systémové komplikace (nefritida, pneumonitida, BCG-sepse) se vyskytují vzácně. Jejich diagnostika bývá obtížná vzhledem k nespecifickým příznakům a často negativním kultivačním nálezům v moči, sputu či hemokultuře. Doporučenou léčbou systémové BCG infekce je dlouhodobá antimikrobiální terapie chinolony a antituberkulotiky, včetně kortikoidů. Současné poznatky o komplikacích intravezikální BCG terapie pochází převážně z jednotlivých kazuistik. Prezentujeme pacienta s miliární BCG-pneumonitidou. Kazuistika reflektuje možnost rozvoje diseminovaného onemocnění v souvislosti s intravezikální imunoterapií BCG vakcínou, pojednává o možnostech diagnostiky a klade důraz na časné zahájení terapie antituberkulotiky, a to i bez průkazu životaschopných mykobakterií či pozitivních kultivací.
Klíčová slova:
Bacillus Calmette-Guérin – diseminované plicní onemocnění – karcinom močového měchýře – Mycobacterium bovis.
ÚVOD
Zhoubné nádory močového měchýře jsou celosvětově 11. nejčastějším maligním onemocněním (1). Většinou mají epiteliální původ a vychází ze slizniční výstelky močového měchýře. Nejčastějším typem je uroteliální karcinom. Dle hloubky invaze se nádory močového měchýře dělí na svalovinu neinfiltrující (NMIBC, Non-muscle-invasive Bladder Cancer) a invazivní karcinomy (MIBC, Muscle-invasive Bladder Cancer). Přibližně u 75 % pacientů je nádor omezen na mukózu (stupeň Ta, CIS) nebo submukózu (stupeň T1) (1).
Standardní léčbou NMIBC je transuretrální resekce (TUR) tumoru močového měchýře, obvykle s jednorázovou instilací intravezikální chemoterapie. V indikovaných případech u nádorů se středním a vysokým rizikem recidivy, resp. progrese, následuje po TUR adjuvantní intravezikální terapie. Při recidivě tumoru po instilační chemo - či imunoterapii u vysoce rizikových typů NMIBC a v případě MIBC je indikována radikální cystektomie s derivací moči. Je‑li operační výkon kontraindikován z důvodu rozsahu onemocnění či inaptabilitou nemocného, volíme multimodální postup (maximální TUR tumoru, chemoterapie, radioterapie) (1).
U vysoce rizikových a vybraných středně rizikových svalovinu neinfiltrujících nádorů močového měchýře je doporučena adjuvantní intravezikální imunoterapie, jež snižuje počet nádorových recidiv po TUR s větší úspěšností než intravezikální aplikace cytostatik (mitomycin) (1, 2). Vakcína Bacillus Calmette-Guérin se v terapii karcinomu močového měchýře používá od roku 1976 (2). Je připravena ze živých atenuovaných mykobakterií podkmene Mycobacterium bovis, které ztratily svou virulenci, ale zachovaly si antigenicitu. Relativně nezávažné nežádoucí účinky, které vymizí během několika hodin nebo dní po aplikaci, se objevují u 69,5 až 91 % pacientů a bývají především místní (dysurie, hematurie) a mírné celkové (subfebrilie, únava, nevolnost, zimnice, malátnost) (2, 3, 4).
U méně než 5 % pacientů se mohou vyskytnout komplikace závažné:
- lokální (např. epididymitida, granulomatózní prostatitida)
- systémové (např. hepatitida, pneumonitida, osteomyelitida)
- život ohrožující BCG-sepse (1, 5, 6)
Většina informací o komplikacích spojených s intravezikální léčbou BCG pochází z jednotlivých kazuistik. Plicní postižení je vzácné a vyskytuje se u 0,3–0,7 % pacientů léčených intravezikálně BCG vakcínou (7).
POPIS KLINICKÉHO PŘÍPADU
Muž, 58 let, byl odeslán praktickým lékařem k urologickému vyšetření pro rok trvající intermitentní asymptomatickou makroskopickou hematurii. Anamnesticky prodělal před šesti lety hlubokou žilní trombózu, byla mu zjištěna heterozygotní forma mutace v enzymu methylentetrahydrofolátreduktáze (MTHFR) a koagulačních faktorů II a V, trvale léky neužíval, alergie neudával, kuřák (40 let 20 cigaret denně).
Obr. 1. Skiagram hrudníku: mnohočetná drobná nodulární zastínění
Fig. 1. Chest X-ray: small and multiple pulmonary miliary nodules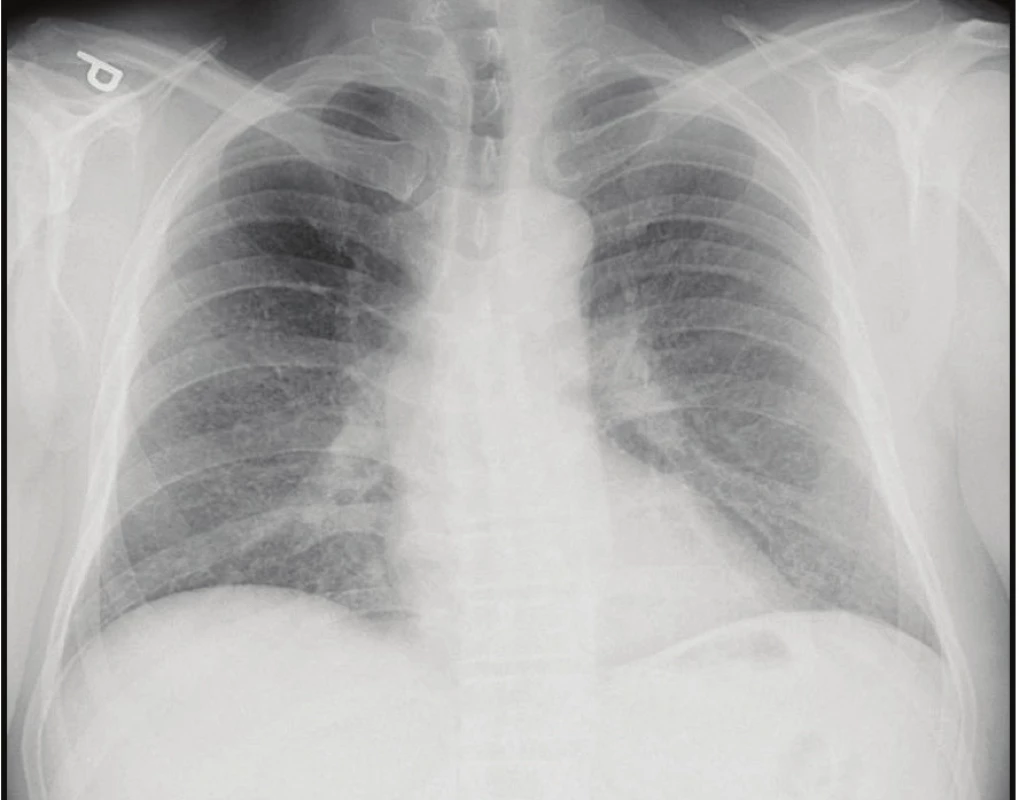
Počítačová tomografie s intravenózní urografií (CT urografie) neprokázala zdroj hematurie v horních močových cestách. Při cystoskopickém vyšetření byl nalezen papilární útvar lehce vyvýšený nad úroveň sliznice, pokrývající levou boční stěnu, levou polovinu trigona a ústí levého močovodu, o ploše 30 × 20 mm. Pacientovi byla provedena transuretrální resekce tumoru včetně ústí levého močovodu. Pro riziko vzniku striktury močovodu jizvením v oblasti resekovaného ústí byl zaveden ureterální stent vlevo. Histopatologicky byl prokázán svalovinu neinfiltrující uroteliální karcinom močového měchýře pT1G2, klinicky bez průkazu generalizace. Po šesti týdnech od primární resekce byla provedena sekundární TUR s negativním histopatologickým průkazem karcinomu v odebrané tkáni a extrakce stentu.
Pacient byl indikován k adjuvantní intravezikální terapii BCG vakcínou podávanou v nejčastěji užívaném režimu šest iniciačních dávek v týdenním intervalu, následně tři instilace v týdenních intervalech po 3, 6 a 12 měsících. V kontaktu s tuberkulózou nebyl, měl negativní tuberkulinový test. Pět dní před každou instilací bylo prováděno kultivační vyšetření moči.
Vakcíny byly aplikovány pacientovi bez projevů akutní infekce močových cest a na základě negativních výsledků kultivace moči.
Iniciační fáze byla zahájena po devíti týdnech od endoskopického výkonu a šest aplikací BCG vakcíny v týdenních intervalech absolvoval pacient bez komplikací.
Po šesti týdnech od ukončení iniciační fáze byla provedena cystoskopie a studená biopsie zarudlých plošných ložisek sliznice močového měchýře. Histopatologicky byl verifikován uroteliální karcinom pTaG1. Po šesti týdnech od biopsie byla podána první instilace udržovací intravezikální imunoterapie, která proběhla bez komplikací. Za týden, po aplikaci druhé dávky již bezprostředně po odchodu z ambulance pacient pociťoval slabost, celkovou nevolnost a nadměrné pocení.
Opakovaně pozoroval makroskopickou hematurii. Do druhého dne se dostavily horečky s maximem 39,2 °C, zimnice, únava a občasný suchý kašel bez hemoptýzy. Pacient obtíže podceňoval, febrilie nad 38,5 °C přetrvávaly do kontroly. Urologickou ambulanci navštívil až po jednom týdnu – k další aplikaci BCG vakcíny. Intravezikální léčba podána nebyla. Pacient byl přijat na urologické oddělení.
Obr. 2, 3. CT hrudníku: difuzní mikronodulární rozsev v obou plicích
Fig. 2, 3. Thorax CT: diffuse bilateral micronodular pulmonary dissemination
Vstupně byl proveden skiagram hrudníku, kde byl popsán suspektní obraz intersticiálního plicního procesu, laboratorní vyšetření odhalilo zvýšené CRP (91 mg/l) a elevaci jaterních enzymů (AST 0,80 μkat/l, ALT 0,88 μkat/l, ALP 6,81 μkat/l, GGT 5,98 μkat/l), další biochemické nálezy a krevní obraz byly v normě. V analýze močového sedimentu nalezeny leukocyty (110/μl) a erytrocyty (931/μl).
Po domluvě s mikrobiologem byly empiricky nasazeny fluorochinolony (ciprofloxacin 400 mg dvakrát denně i.v.), podávány krystaloidy a antipyretika (paracetamol), po nichž ustoupily horečky a pacient cítil zlepšení.
Na doporučení pneumologů byla provedena CT hrudníku a břicha, která prokázala mikronodulární proces v obou plicních křídlech s mediastinální hilovou lymfadenopatií, hepatosplenomegalií a plicní embolii větví pro zadní segmenty dolního laloku vlevo.
S podezřením na systémovou BCG‑itidu s postižením plicní tkáně byl pacient přeložen na plicní oddělení. Bylo doplněno ultrazvukové vyšetření dolních končetin bez nálezu hluboké žilní trombózy, jež by poukazovala na vzdálený původ plicní trombembolie.
Byla provedena bronchoskopie s transbronchiální biopsií z dolního bronchu vpravo a bronchoalveolární laváží (BAL). Mikroskopické vyšetření neprokázalo přítomnost granulomů ani acidorezistentních tyček. Kultivace, polymerázová řetězová reakce (PCR) a cytologie odebraných materiálů při bronchoskopii byly negativní. Opakovaně byly odebírány hemokultury, sputum (fluorescenční mikroskopie, kultivace, PCR) a moč (kultivace, fluorescenční mikroskopie, PCR). Ani jedna z uvedených metod neprokázala přítomnost mykobakterií či jiných patogenů. Bylo doplněno vyšetření na přítomnost HIV s negativním výsledkem. Diagnóza BCG‑pneumonitidy tak byla stanovena na základě zobrazovacích metod a klinického obrazu.
Byla zahájena dvouměsíční iniciální fáze terapie antituberkulotiky ve složení HRE (H – isoniazid 300 mg jednou denně p. o., R – rifampicin 600 mg jednou denně p. o., E – ethambutol 2 000 mg jednou denně p. o.) spolu s podpůrnou terapií antiuratiky (allopurinol 300 mg tbl. jednou denně p. o) a vitaminem B6 (pyridoxin 20 mg tbl. jednou denně p. o.). Ciprofloxacin byl jako antituberkulotikum druhé linie ponechán. Vzhledem k progredující elevaci jaterních transamináz (AST 1,42 μkat/l, ALT 2,36 μkat/l) byla do medikace přidána hepatoprotektiva (silymarin 100 mg dvakrát denně p. o.). Pro nález trombózy v segmentální plicní tepně byla zahájena terapie nízkomolekulárními hepariny v terapeutické dávce (enoxaparin 0,8 ml dvakrát denně s. c.).
Po týdnu zavedené léčby byl pacient bez větších potíží, bez mikčních symptomů a kašle, afebrilní, s přetrvávající únavou. Došlo k poklesu jaterních enzymů v séru (AST 0,73 μkat/l, ALT 1,89 μkat/l) a na skiagramu hrudníku byla prokázána parciální regrese mikronodulárního procesu. Pacient se cítil dobře, byl bez dechových obtíží, afebrilní a jen lehce unavený.
Po 18 dnech hospitalizace byl ve stabilizovaném stavu propuštěn do domácího ošetřování.
Po ukončení iniciální fáze terapie antituberkulotiky následovala čtyřměsíční fáze pokračovací ve složení HR (isoniazid 300 mg jednou denně p. o., rifampicin 600 mg jednou denně p. o.). Intravezikální terapie BCG vakcínou byla ukončena a pacient je sledován v plicní a urologické ambulanci. Kontrolní uretrocystoskopie po třech a šesti měsících neprokázaly recidivu nádoru.
DISKUZE
Po několik desetiletí zůstává instilace BCG standardní adjuvantní léčbou pacientů se svalovinu neinfiltrujícím uroteliálním karcinomem močového měchýře s vysokým rizikem progrese (1).
Přesný mechanizmus působení BCG vakcíny není plně známý. Po intravezikální aplikaci dochází ve stěně močového měchýře ke kaskádě imunologických reakcí, při nichž se aktivuje jak buněčná (T-lymfocyty, natural killers – NK buňky), tak humorální složka (imunoglobuliny, cytokiny) (2, 8, 9). Především se uvádí imunitní reakce pozdního typu (IV. typu) charakteristická tvorbou granulomů, které bývají histopatologicky prokazatelné ve vyšetřovaných tkáních (6, 7, 10, 11, 12).
Virulence oslabeného BCG je nízká a BCG imunoterapie je obvykle dobře tolerována.
Více než 95 % pacientů ji snáší bez významné morbidity (2). Většina nežádoucích stavů spojených s imunoterapií BCG jsou výsledkem imunitní stimulace a projeví se lokálními symptomy dolních močových cest (6). Nebývají klasifikovány jako komplikace BCG terapie, ale považují se za marker adekvátního protinádorového účinku (6, 9, 10). Vyskytují se frekventní mikce (71 %), urgence a dysurie (67 %) či intermitentní hematurie (23 %). Z celkových projevů jsou nejčastější subfebrilie až febrilie do 38,5 °C (25 %) a symptomy podobné chřipce (únava, malátnost, zimnice) (8). Uvedené obtíže obvykle ustoupí do 24 až 48 hodin po instilaci a neměly by být léčeny jinou než symptomatickou terapií (rehydratační terapie, antipyretika, spasmoanalgetika) (6).
Mezi závažné lokální a systémové komplikace léčby se řadí febrilie přes 38,5 °C (2,9 %), makrohematurie (1,0 %), granulomatózní prostatitida (0,9 %), hepatitida nebo pneumonitida (0,7 %), artralgie a artritida (0,5 %), epididymitida (0,4 %), BCG sepse (0,4 %), exantém (0,3 %), obstrukce ureteru (0,3 %), svraštělý močový měchýř (0,2 %) a pancytopenie (0,1 %) (5, 8, 10). Exantém, artralgie a artritida jsou považovány spíše za alergickou reakci než za následek akutní infekce (8, 9). Komplikace se dostaví obvykle po několika dnech až týdnech od poslední instilace BCG, ačkoli jsou známé i případy miliární BCG-pneumonitidy, která se manifestovala po letech od BCG terapie (4).
Miliární BCG‑pneumonitida je vzácná komplikace intravezikální BCG imunoterapie, jejíž výskyt je v retrospektivní studii od Pérez-Jacoiste et al. z roku 2014 udáván až 2,3 % (6), v prospektivní multicentrické studii Brausi et al. (2014) uvádí 0,4 % (5). Je nejčastější formou diseminované BCG infekce (6). K systémovému šíření dochází po vstupu mykobakterií do krevního oběhu narušenou uroteliální bariérou. Mezi absolutní kontraindikace podání BCG vakcíny se proto řadí stavy, kdy dochází k porušení stěny močového měchýře – časná instilace BCG do dvou týdnů od transuretrální resekce, traumatická katetrizace močového měchýře, makrohematurie, probíhající symptomatická infekce močových cest (1). Dále je léčba kontraindikována u pacientů s aktivní tuberkulózou, v imunodeficientním stavu (např. aktivní léčba cytostatiky, leukemie, infekce HIV, léčba imunosupresivy, stav po transplantaci či po splenektomii), v těhotenství a laktaci (1, 2, 6, 11, 12).
Přítomnost leukocytů v sedimentu moči, mikrohematurie nebo asymptomatická bakteriurie nejsou podle doporučení EAU Guidelines 2018 překážkou aplikace BCG (1).
Publikované studie uvádějí, že většina komplikací se vyskytuje v prvním roce terapie (6, 7). Pravděpodobně vznikají jako následek predisponujících stavů (velké poškození sliznice močového měchýře, traumatická katetrizace nebo nepoznaně imunokompromitovaný jedinec) a jejich rozvoj příliš nesouvisí s podávanou dávkou, počtem instilací BCG či intervalem od TUR (6, 7).
Námi prezentovaný pacient nebyl imunokompromitován a intravezikální léčba BCG vakcínou byla zahájena v dostatečném časovém odstupu od transuretrální resekce. Kultivace moči, které na našem pracovišti odebíráme před každým podáním BCG vakcíny, byly negativní. Příznaky zánětu močových cest či krev v moči pacient před aplikací neudával.
Hematurie se objevila až po intravezikální instilaci, nelze tak vyloučit možnost vzniku traumatické katetrizace při aplikaci BCG vakcíny.
Systémové příznaky (horečka, zimnice, nevolnost, únava, úbytek hmotnosti, noční pocení), absence mikčních obtíží (dysurie, polakisurie) a přítomnost symptomů onemocnění dýchacích cest (kašel, dyspnoe, hemoptýza, dušnost, až těžké respirační selhání) jsou charakteristické klinické známky miliární BCG-pneumonitidy (4, 6, 7).
Subklinická plicní embolie, resp. trombóza, prokázaná na CT, může být náhodným nálezem u postižených tuberkulózou. Pacienti s touto diagnózou obvykle vykazují vysoké koncentrace plazmatického fibrinogenu a reaktivní trombocytózu (13). Na hyperkoagulačním stavu se též podílí přímým poškozením endotelu samotné mykobakterie (13). V případě našeho pacienta přispěly ke vzniku trombózy i dědičné predispozice – mutace v enzymu MTHFR a koagulačních faktorů II a V.
Primární diagnostickou metodou komplikací vyvolaných BCG vakcínou je zobrazovací vyšetření. Skiagrafické vyšetření hrudníku má nízkou citlivost (6). Dle dostupných studií neodhalí miliární rozsev přibližně u jedné čtvrtiny pacientů, kterým je nakonec zjištěna miliární tuberkulóza (6, 14, 15, 16). V případě podezření na miliární BCG-pneumonitidu by měla být proto počítačová tomografie hrudníku upřednostňována před prostým skiagramem hrudníku (6).
Laboratorní nálezy poukazují nespecificky na systémový zánět. Často bývá nevýrazně zvýšené CRP, v těžších případech elevace jaterních testů (AST, ALT), případně až pancytopenie (7, 8, 10).
Průkaz mykobakterií je možný několika způsoby. Metoda PCR (sputa, BAL) poskytuje nejvyšší senzitivitu – 41,8 % (6). M. bovis lze dále detekovat barvením odebrané tkáně dle Ziehl-Neelsena, které vykazuje pozitivitu jen u 25,3 %, a kultivací mykobakterií v biopsii postiženého orgánu, moči, abscesu, krvi či sputu (Löwenstein-Jensen medium a Middlebrook medium) s celkovou pozitivitou u 40,9 % pacientů (6, 7, 17).
K upřesnění nálezu v případě diagnostických pochybností lze provést odběr plicní tkáně – transbronchiální biopsii a kryobipsii prováděnou pneumology či chirurgickou excizi z mikrotorakotomie (18, 19, 20).
Charakteristický nález miliárního rozsevu na zobrazovacím vyšetření spolu s klinickým obrazem jsou dostatečné k zahájení antituberkulotické terapie. Je důležité poznamenat, že ke klinickému zlepšení dochází mnohdy i po více jak dvou týdnech a někdy je třeba zesílit účinek léčby podáním glukokortikoidů (21).
V případě našeho pacienta ani jedna z vyšetřovacích metod neprokázala přítomnost mykobakterií. Diagnóza byla stanovena na základě anamnézy imunoterapie BCG vakcínou, klinických příznaků a nálezu na zobrazovacích metodách (především CT hrudníku).
Dostupná literatura a jednotlivé prezentované případy vykazují heterogenitu v terapii komplikací souvisejících s intravezikálním podávání BCG vakcíny. Neexistuje jednoznačná shoda v indikaci antituberkulózní terapie, preferovaný režim nebo její trvání. Podávání antituberkulotik, a to buď samostatně nebo v kombinaci s kortikosteroidy či chirurgickým zákrokem (například orchiektomie u konzervativně nezvládnutelné, či dokonce abscedující orchiepididymitidě), za podpory nesteroidních antiflogistik je v systémové i lokální formě závažnějších komplikací BCG imunoterapie zásadní (6).
M. bovis patří do skupiny M. tuberculosis complex obligatorně patogenních pro člověka, která je standardně léčena antituberkulotickou terapií v doporučených režimech.
Terapie se zahajuje iniciační fází – HRZE (H – isoniazid, R – rifampicin, Z – pyrazinamid, E – etambutol) na dobu dvou měsíců, po které následuje fáze pokračovací – HR (H – isoniazid, R – rifampicin) na čtyři měsíce (1, 6). Je prokázáno, že M. bovis je primárně rezistentní na pyrazinamid, a proto se jeho podávání při infekci bovinním kmenem nedoporučuje.
Některé kmeny mohou být i nízce citlivé k isoniazidu (1, 10, 22).
Při infekci M. bovis (zvláště kmen Connaught BCG) je prokázána účinnost chinolonů.
Lze je tak použít jako terapeutika druhé řady, např. při kontraindikaci isoniazidu a rifampicinu (23, 24). Dle dostupné literatury byli dokonce někteří pacienti úspěšně léčeni režimy bez antituberkulotik právě pouze chinolony (ofloxacinem, ciprofloxacinem, moxifloxacinem a levofloxacinem) (6, 18, 25). Výhodou je jejich nižší hepatotoxicita oproti antituberkulotikům první linie. Na druhou stranu je třeba upozornit na riziko tendinopatie (především Achilovy šlachy), aneuryzmatu aorty a aortální disekce, se kterými je jejich dlouhodobé užívání spojeno (6). Z tohoto důvodu jsou dnes fluorochinolony doporučovány k dlouhodobé terapii pouze v případě závažných (často život ohrožujících) infekcí (26, 27).
Při těžkém septickém průběhu miliární BCGpneumonitidy, u pacientů s přetrvávajícími dýchacími obtížemi a nereagujících na terapii antituberkulotiky, je vhodné zavést do medikace glukokortikoidy (obvykle prednison 40 mg denně) (6, 10).
Námi prezentovaný pacient zareagoval na iniciálně podávaný fluorochinolon a následně trojkombinaci tuberkulotik dobře a došlo ke zlepšení jeho stavu a ústupu obtíží. Nebylo třeba rozšiřovat terapii o kortikosteroidy. Léčba trvala šest měsíců a proběhla bez komplikací.
Většina autorů považuje systémovou komplikaci BCG terapie, včetně déletrvající nevysvětlitelné horečky, za absolutní kontraindikaci další intravezikální aplikace BCG vakcíny (28, 29, 30). Oproti tomu je možné při nezávažných nežádoucích projevech, jako je reaktivní artritida nebo uveitida, instilace BCG obnovit (1, 28, 29, 30). Mortalita na systémovou BCG infekci se udává 5,4 % (6). Nejčastěji k ní dochází následkem respiračního, jaterního nebo multiorgánového selhání (6, 7).
ZÁVĚR
Vzhledem k možnosti vzniku život ohrožujících komplikací je nutné před zahájením intravezikální imunoterapie BCG vakcínou pacienta řádně poučit a sepsat informovaný souhlas. Předpokladem efektivního průběhu léčby s minimalizací případných komplikací je spolupracující pacient. Při přetrvávající horečce po aplikaci BCG vakcíny a při dalších nespecifických a respiračních symptomech (slabost, zimnice, abnormální poty, dušnost, kašel) je nutné v diferenciální diagnostice pomýšlet na systémovou BCG-pneumonitidu. Včasné mikrobiologické vyšetření včetně PCR (sputa či BAL) se spolu s CT hrudníku jeví jako nejrychlejší způsob stanovení diagnózy. Přestože je izolace mykobakterie pro diagnózu žádoucí, negativní nález by neměl být důvodem k vyloučení BCG infekce z diferenciální diagnostiky. Klinický obraz a radiologický nález jsou vzhledem k nezanedbatelnému riziku úmrtí a trvalé morbidity dostatečné k okamžitému podání antituberkulotické léčby. Pokud je zahájena vhodná terapie včas, prognóza onemocnění je dobrá.
Hlavní stanovisko práce: Intravezikální terapie BCG vakcínou je účinná adjuvantní léčba vysoce rizikového svalovinu neinfiltrujícího karcinomu močového měchýře. Je obvykle dobře tolerována. Život ohrožující systémové komplikace se vyskytují vzácně. Prezentujeme kazuistiku pacienta s miliární BCG-pneumonitidou.
Došlo: 31. 1. 2019
Přijato: 26. 3. 2019
Kontaktní adresa:
MUDr. Barbora Nechanská
Urologické oddělení Oblastní nemocnice Mladá Boleslav, a. s.
V. Klementa 147, 293 01 Mladá Boleslav
e‑mail: nechanska@gmail.com
Střet zájmů: Žádný.
Prohlášení o podpoře: Autorka prohlašuje, že zpracování článku nebylo podpořeno farmaceutickou firmou.
Zdroje
1. Babjuk M, Burger M, Compérat E, et al. 2018 EAU Guidelines on Non-Muscle-invasive Urothelial Carcinoma of the Bladder. Retrieved from: http://uroweb.org/guideline/non‑muscle‑invasive‑bladder‑cancer/ [1. 12. 2018].
2. Naudžiunas A, Juškaité R, Augryté A, el al. Tuberculosis Complications After BCG Treatment for Urinary Bladder Cancer. Medicina 2012; 48(11): 563–565.
3. Kaburaki K, Sugino K, Sekiya M, et al. Miliary Tuberculosis that Developed after Intravesical Bacillus Calmette‑Guerin Therapy. Internal Medicine 2017; 56(12): 1563–1567.
4. Colmenero JD, Sanjuan‑Jimenez R, Ramos B, Morata P. Miliary pulmonary tuberculosis following intravesical BCG therapy: case report and literature review. Diagnostic Microbiology and Infectious Disease 2012; 74(1): 70–72.
5. Brausi M, Oddens J, Sylvester R, et al. Side Effects of Bacillus Calmette‑Guérin (BCG) in the Treatment of Intermediate - and High‑risk Ta, T1 Papillary Carcinoma of the Bladder: Results of the EORTC Genito‑Urinary Cancers Group Randomised Phase 3 Study Comparing One‑third Dose with Full Dose and 1 Year with 3 Years of Maintenance BCG. European Urology 2014; 65(1): 69–76.
6. Pérez‑Jacoiste Asín MA, Fernández‑Ruiz M, López‑Medrano F, et al. Bacillus Calmette‑Guérin (BCG) Infection Following Intravesical BCG Administration as Adjunctive Therapy For Bladder Cancer. Medicine 2014 : 93(17): 236–254.
7. Calleris G, Marra G, Corcione S, et al. Miliary pulmonary infection after BCG intravesical instillation: a rare, misdiagnosed and mistreated complication. Le Infezioni in Medicina 2017; 25(4): 366–370.
8. Batista M, Alves C, Boinas C, Camacho E. Tuberculosis Miliary in Patients Treated With Bacillus Calmette‑Guerin Immunotherapy: Case Report. Journal of Medical Cases 2017; 8(7): 233–235.
9. Vazquez‑Lavista L G, Flores‑Balcazar CH, Llorente L. The bacillus Calmette‑Guerin as immunomodulator in bladder cancer. Revista de Investigación Clínica 2007; 59 : 146–152.
10. Elzein F, Albogami N, Saad M, et al. Disseminated Mycobacterium Bovis Infection Complicating Intravesical BCG Instillation for the Treatment of Superficial Transitional Cell Carcinoma of the Bladder. Clinical Medicine Insights: Case Reports 2016; 9.
11. Babjuk M, Soukup V. Intravezikální léčba povrchových nádorů močového měchýře. Urolog. praxi 2004; 3 : 116–120.
12. Král M, Mucha Z, Študent V. Imunoterapie karcinomu močového měchýře. Onkologie 2013; 7(1): 30–34.
13. Moniruzzaman M, Islam S, Chandra S, Koli A, Hassan MJ. Tuberculosis and Deep Venous Thrombosis, a rare complication of a common disease: A case report. KYAMC Journal 2017; 6(1): 598–600.
14. Cobas Pas A, Garcia Tejedor JL, González Pineiro A, Fernández‑Villar A. Miliary tuberculosis due to BCG in an asymptomatic patient: initial onset or a condition not yet described? Tuberculosis miliar por BCG en un paciente asintomático: ¿afectación inicial o una entidad no descrita? Archivos de Bronconeumología 2010; 46(7): 394–395.
15. Dammert P, Boujaoude Z, Rafferty W, Kass J. Fever of unknown origin and pancytopenia caused by culture‑proven delayed onset disseminated bacillus Calmette‑Guerin (BCG) infection after intravesical instillation. Case Reports 2013; 2013: bcr2013008949.
16. Manfredi R, Dentale N, Piergentili B, Pultrone C, Brunocilla E. Tubercular Disease Caused by Bacillus of Calmette‑Guérin as a Local Adjuvant Treatment of Relapsing Bladder Carcinoma. Cancer Biotherapy and Radiopharmaceuticals 2009; 24(5): 621–627.
17. Siatelis A, Houhoula DP, Papaparaskevas J, Delakas D, Tsakris A. Detection of Bacillus Galmette‑Guerin (Mycobacterium bovis BCG) DNA in Urine and Blood Specimens after Intravesical Immunotherapy for Bladder Carcinoma. Journal of Clinical Microbiology 2011; 49(4): 1206–1208.
18. Sheth JS, Belperio JA, Fishbein MC, et al. Utility of Transbronchial vs. Surgical Lung Biopsy in the Diagnosis of Suspected Fibrotic Interstitial Lung Disease. Chest 2017; 151(2): 389–399.
19. Tomasetti S, Wells A U, Costabel U, et al. Bronchoscopic Lung Cryobiopsy Increases Diagnostic Confidence in the Multidisciplinary Diagnosis of Idiopathic Pulmonary Fibrosis. American Journal of Respiratory and Critical Care Medicine 2016; 193(7): 745–752.
20. Sharp C, Mccabe M, Adamali H, Medford AR. Use of transbronchial cryobiopsy in the diagnosis of interstitial lung disease - a systematic review and cost analysis. An International Journal of Medicine 2017; 110(4): 207–214.
21. Delimpoura V, Samitas K, Vamvakaris I, Zervas E, Gaga M. Concurrent granulomatous hepatitis, pneumonitis and sepsis as a complication of intravesical BCG immunotherapy. Case Reports 2013; bcr2013200624.
22. Watts MR, Taylor PC, Sintchenko V, et al. Implications of Isoniazid Resistance in Mycobacterium bovis Bacillus Calmette‑Guerin used for Immunotherapy in Bladder Cancer. Clinical Infectious Diseases 2011; 52(1): 86–88.
23. Durek C, Rüsch‑Gerdes S, Jocham D, Böhle A. Sensitivity of BCG to Modern Antibiotics. European Urology 2000; 37(Suppl. 1): 21–25.
24. Dooley KE, Golub J, Goes FS, Merz WG, Sterling TR. Empiric Treatment of Community Acquired Pneumonia with Fluoroquinolones, and Delays in the Treatment of Tuberculosis. Clinical Infectious Diseases 2002; 34(12): 1607–1612.
25. Gonzalez OY, Musher DM, Brar I, et al. Spectrum of Bacille Calmette Guerin (BCG) Infection after Intravesical BCG Immunotherapy. Clinical Infectious Diseases 2003; 36(2): 140–148.
26. Fluorochinolony pro systémové a inhalační podání: riziko aneurysmatu aorty a aortální disekce [online]. Státní ústav pro kontrolu léčiv [cit. 17. 10. 2018]. Dostupné z: http://www.sukl.cz/leciva/informacni‑dopis‑fluorochinolony.
27. Fluorochinolonová antibiotika – omezení používání potvrzeno [online]. Státní ústav pro kontrolu léčiv [cit. 22. 11. 2018]. Dostupné z: http://www.sukl.cz/fluorochinolonova‑antibiotika‑omezeni‑pouzivani‑potvrzeno.
28. Rischmann P, Desgrandchamps F, Malavaud B, Chopin DK. BCG Intravesical Instillations: Recommendations for Side‑Effects Management. European Urology 2000; 37(suppl 1): 33–36.
29. Lamm DL, van der Meijden PM, Morales A, et al. Incidence and treatment of complications of bacillus Calmette‑Guerin intravesical therapy in superficial bladder cancer. Journal of Urology 1992; 147(3): 596–600.
30. Rodríguez F, Palou J, Martínez R, et al. Practical guideline for the management of adverse events associated with BCG installations. Archivos Españoles de Urología 2008; 61(5): 591–596.
Štítky
Dětská urologie Nefrologie Urologie
Článek EditorialČlánek Melanom ženské uretry
Článek vyšel v časopiseČeská urologie
Nejčtenější tento týden
2019 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Chirurgická léčba inkontinence moči u dětí
- Současné trendy při rekonstrukci striktur penilní uretry
- Léčba rektoanastomotických píštělí po laparoskopické radikální prostatektomii
- Cystické léze ledvin: zkušenosti jednoho urologického centra
- Miliární BCG–pneumonitida: vzácná komplikace intravezikální terapie BCG
- Melanom ženské uretry
- Využití antegrádní flexibilní ureterorenoskopie v terapii urolitiázy u pacientky s ureterosigmoideostomií po operaci extroficko-epispadického komplexu
- Zpráva z výroční konference EAU v Barceloně
- Jarní edukační urologické sympózium, 12.–13. 4. 2019, Karlovy Vary
- Komplexní novinky v onkourologii (KNOU) 2019
- Editorial
- Robotická intrakorporální ortotopická neovezika dle Hautmanna
- Miniinvazivní uzávěr vezikovaginální píštěle pomocí robota jednoportovým vstupem
- Česká urologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cystické léze ledvin: zkušenosti jednoho urologického centra
- Melanom ženské uretry
- Současné trendy při rekonstrukci striktur penilní uretry
- Miniinvazivní uzávěr vezikovaginální píštěle pomocí robota jednoportovým vstupem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



