-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKazuistika nediagnostikovaného intracerebrálního krvácení u pacientky po anuloplastice trikuspidální chlopně
Case report of missed diagnosis of intracranial haemorrhage in a patient after tricuspid valve annuloplasty
This case report describes the management of a patient who required reoperation for tricuspid valve regurgitation. The procedure was further complicated by right ventricular failure and an unsatisfactory result of tricuspid valve annuloplasty. On the ICU this patient developed systemic inflammatory response syndrome, followed by multiple-organ failure requiring V-A ECMO. The clinical course was also complicated by acute kidney failure needing continuous renal replacement therapy and by pulmonary haemorrhage requiring several bronchoscopy interventions and blood transfusions. The patient deceased 5 days after surgery. The presumed causes of death were 1) systemic inflammatory syndrome with profound vasoplegia, 2) right ventricular failure and 3) pulmonary haemorrhage. Autopsy revealed assumed shock organ changes but also brain haemorrhage. This unexpected pathology may have contributed to the patient’s hemodynamic instability. In a situation where standard neurological methods are inconclusive, novel biochemical markers of brain damage could be helpful.
Keywords:
anaesthesia – cerebral protection – mechanical circulatory assistance – valve disease
Autoři: Matloch Zdeněk 1; Říha Hynek 1; Netuka Ivan 2; Kment Martin 3; Kotulák Tomáš 1
Působiště autorů: Klinika anesteziologie a resuscitace, Institut klinické a experimentální medicíny, Praha 1; Klinika kardiovaskulární chirurgie, Institut klinické a experimentální medicíny, Praha 2; Oddělení klinické patologie, Institut klinické a experimentální medicíny, Praha 3
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 4, s. 277-280
Kategorie: Anesteziologie - Kazuistika
Souhrn
Kazuistika popisuje terapeutický postup u pacientky přicházející pro reoperaci chlopně pro trikuspidální regurgitaci. Operace byla komplikována pravostranným srdečním selháním a neuspokojivým výsledkem anuloplastiky trikuspidální chlopně. Na pooperačním oddělení dochází k progresi pravostranné srdeční insuficience, rozvoji syndromu systémové zánětové odpovědi organismu (SIRS), následovaný multiorgánovou dysfunkcí (MODS) s nutností implantace V-A ECMO podpory. Klinický průběh byl dále komplikován rozvojem akutního renálního selhání vyžadující kontinuální hemodialýzu (CRRT) a difuzním krvácením do plic, léčeným opakovanými bronchoskopickými aspiracemi a podáním transfuzních přípravků. Pacientka zemřela 5. pooperační den. Předpokládanými příčinami úmrtí byly: 1. SIRS s těžkou vazoplegií;2. pravostranné srdeční selhání; 3. krvácení do plic. Při anatomicko-patologické pitvě byly nalezeny šokové změny na orgánech, ale také intracerebrální krvácení. To mohlo přispět k hemodynamické nestabilitě pacientky. V takovýchto situacích, kdy nelze spoléhat na standardní neurologické vyšetření, by bylo výhodou mít možnost používat biochemické markery poškození mozkové tkáně.
Klíčová slova:
anestezie – cerebrální protekce – mechanická srdeční podpora – onemocnění chlopníKAZUISTIKA
Pacientka (72 let) s BMI 27 a ICHS byla operována v březnu 2011. V osobní anamnéze měla arteriální hypertenzi, hypotyreózu, hyperlipidémii a osteoporózu. Byly provedeny náhrady aortální a mitrální chlopně biologickými protézami. Operace proběhla bez problémů a pacientka byla po 14 dnech propuštěna z nemocnice do lázní k rekonvalescenci. Další operace, které pacientka prodělala, byly levostranná mastektomie pro karcinom, s následnou radioterapií a chemoterapií, appendektomie a cholecystektomie.
V říjnu 2012 pacientka přišla k hospitalizaci pro dušnost a únavu (NYHA II-III). Transtorakální echokardiografie (TTE) prokázala hlavně dilatovanou pravou komoru (D-RV) se středně omezenou funkcí, dilatovanou pravou síň (D-RA) a těžkou trikuspidální regurgitaci (4/4). U pacientky byla plánována reoperace s cílem anuloplastiky trikuspidální chlopně. Předoperační logistické EuroSCORE II bylo 12,16 %. Operace proběhla v listopadu 2012. Operatér implantoval Tailor ring a pojistil plastiku ještě procedurou De Vega. Perioperační vyšetření TEE prokázalo trikuspidální regurgitaci (2/4), ale také známky plicní hypertenze, těžce dysfunkční dilatovanou pravou komoru a turbulentní tok v levokomorovém výtokovém traktu s obrazem „systolic anterior motion“ (SAM). Celý výkon byl proveden na mimotělním oběhu, ale bez použití aortální svorky. Mimotělní oběh trval 85 minut. Pacientka byla odpojena od mimotělního oběhu s kombinovanou farmakologickou podporou oběhu:milrinone 0,5 mg/kg/min, dobutamin 2,5 mg/kg/mina noradrenalin 0,3 mg/kg/min.
Po operaci došlo k progresi hemodynamické nestability s rozvojem SIRS a vazoplegie. Během zvyšování dávky noradrenalinu jsme nasadili i vazopresin v infuzi. Kvůli obtížnému zavádění plicnicového katétru jsme kalibrovali přístroj LiDCO a srdeční indexy se pohybovaly v rozmezí 3,1 až4,5 l/min/m2, systémová vaskulární rezistence (SVR) byla jen kolem 600 dyn·s/cm-5. Zkusili jsme terapii hydrokortizonem a podali metylénovou modř k ovlivnění refrakterní vazoplegie. Pro akutní renální selhání s oligurií a známky plicního edému musela být zahájena CRRT. Kvůli postupnému zhoršování metabolického stavu, pravostrannému srdečnímu selhání, poruchu oxygenace a SIRS s vazoplegií jsme první pooperační den implantovali veno-arteriální mechanickou srdeční podporu (V-A ECMO).
SIRS a multiorgánové selhání (MOF) progredovaly. Největším problémem byl rozvoj krvácení do plic. Provedli jsme celou řadu bronchoskopických vyšetření a aspirací, krvácení bylo však difuzní a neztišitelné. Multidisciplinární tým rozhodl o nerozšiřování péče a pacientka zemřela 5. pooperační den.
Pravděpodobnou příčinou úmrtí byla kombinace SIRS s vazoplegií, pravostranného srdečního selhání a neztišitelného krvácení do plic. Následující pitva prokázala předpokládané šokově změněné orgány, ale také velké intracerebrální krvácení. Tento nález byl pro nás překvapením a zřejmě mohl přispět k hemodynamické nestabilitě pacientky (obr. 1).
Obr. 1. Frontální řez mozkem v oblasti frontálních laloků Pitva fixovaného mozku I přes fixaci je mozková tkáň anatomicky málo přehledná a potrhaná. Mozek prokrojen ve frontálních řezech po 2 cm. Ve frontálním laloku vlevo hemoragie a vs malatické ložisko velikosti 4 x 3cm. Rozsáhlé krvácení je v pravé hemisféře, zasahuje od zadní části frontálního laloku až k laloku okcipitálnímu a propaguje se do postranní mozkové komory velikosti přibližně 12 x 8 x 7 cm. Další hemoragické ložisko je v okcipitálním laloku vlevo velikosti 6 x 5 x 5 cm. Mozeček na řezu přiměřený, pons a oblongata s drobnými hemoragickými ložisky. Spodinové arterie jsou převážně jemné s ojedinělými lipoidními pláty. Mozkové pleny jemné, lehce překrvené. 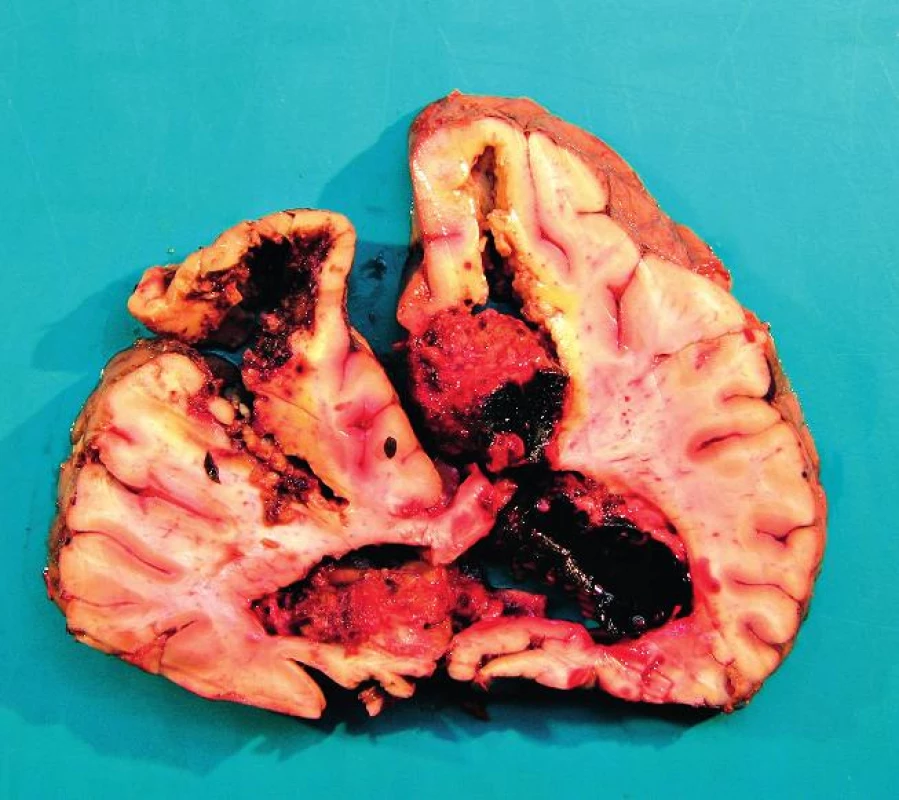
DISKUSE
Hypotenze, hypoperfuze a ischémie mozku mohou vést k reperfuznímu poškození přes kalciem mediované uvolnění některých vazoaktivních substancí. Ty mohou vyvolat krvácení do mozku a jeho poškození. Klinické příznaky a standardně monitorované parametry mají zpočátku nevypovídající hodnotu. Existují biochemické markery, např. kalcium vázající protein S100B a protein přítomný v centrálním nervovém systému – activin A, které byly zmíněny jako potenciálně užitečné v neinvazivnímu monitorování poškození mozkové tkáně u pediatrických pacientů s podporou ECMO [1].
Mateen ve své studii poukázal na to, že 42 pacientů z 87 léčených pomocí ECMO trpělo nějakým neurologickým deficitem [2]. U zemřelých pacientů byly v 90 % při pitvě nalezeny hypoxicko-ischemické a krvácivé vaskulární léze. Autor se domnívá, že potenciálně fatální neurologické poškození je podpořeno, anebo přímo způsobeno terapií pomocí ECMO.
Hervey-Jumper hodnotil ve své studii neurologické komplikace u dětí léčených pomocí ECMO [3]. Na základě multicentrického registru – Extracorporeal Life Support Organization Registry – z let 1990–2009, byla incidence intracerebrálního krvácení u všech pacientů, léčených pomocí ECMO 7,4 %. Incidence s ECMO asociovaným intracerebrálním krvácením je vyšší u novorozenců ve srovnání se staršími dětmi a také u dětí ve srovnání s dospělými.
De Mol nalezl v retrospektivní studii na 24 novorozencích signifikantní vztah mezi rozvojem intracerebrálního krvácení a podáním více než 8 infuzí (bolus 20–50 ml buď krystaloidu, nebo koloidu, včetně transfuzních přípravků) nebo infuzí o objemu více než 300 ml v prvních 8 hodinách anebo více než 10 infuzí v prvních 24 hodinách po zahájení léčby pomocí ECMO [4]. Vysvětlením může být skutečnost, že patologický proces, který vedl k intracerebrálnímu krvácení, také způsobuje neadekvátní venózní drenáž do ECMO, což vede k další potřebě volumoterapie.
Szabó shrnuje možné patofyziologické mechanismy dysfunkce myokardu po smrti mozku [5]. Smrt mozku vede ke ztrátě tonu sympatiku, k rychlému poklesu afterloadu, což vede k relativní intravaskulární hypovolémii s následným poklesem preloadu. V dřívějších studiích se z myokardiální dysfunkce hlavně obviňovala Cushingova reakce s deplecí hormonů. V současnosti se však ukazuje, že tyto jsou spíše precipitujícím mechanismem v daleko složitější kaskádě, spuštěné po smrti mozku, spíše než hlavní příčinnou.
Uvědomujeme si, že uvedené práce byly provedeny na pediatrické populaci nebo na zvířecím modelu. Naše pacientka měla při opakovaném vyšetření izokorické zornice reagující na osvit, a proto jsme nepředpokládali žádné vážnější neurologické problémy. Sedována byla midazolamem 5 mg/h a sufentanilem 15 mg/h, proto formální neurologické vyšetření by bylo s nevýpovědní hodnotou. Přerušení sedace u pacientky na vysoké inotropní a katecholaminové podpoře, s krvácením do plic, nebylo indikováno. Ani transport na vyšetření CT mozku nebyl pro tyto okolnosti vhodný. Navíc naše nemocnice nenabízí možnost vyšetření proteinů S100B nebo activinu A. Retrospektivně hodnoceno, známky koagulopatie byly přítomny. Počet trombocytů 53 x 109/l, INR 1,4, aPTTr 1,5 a fibrinogen 2,8 g/l byly naměřeny po implantaci V-A ECMO. Během celé hospitalizace na pooperačním oddělení pacientka dostala 49 IU mražené plazmy, 26 IU erytrocytárních přípravků a 10 IU trombocytů z aferézy. Bohužel nemůžeme s jistou říci, kdy k intracerebrálnímu krvácení došlo, ale je možné, že hemodynamická nestabilita byla primárně vyvolána postižením mozku spíše než rozvojem SIRS s MOF.
ZÁVĚR
V-A ECMO pomáhá v léčbě výrazně hemodynamicky nestabilních pacientů po kardiochirurgických výkonech. Nicméně použití ECMO je také spojeno s potenciálně závažnými problémy, jako např. s intracerebrálním krvácením. Základní vyšetření zornic u pacienta na vysokých dávkách inotropik a katecholaminů, s kontinuální analgosedací, je nespolehlivé. Pacienti s rychle progredující hemodynamickou nestabilitou po operaci, vyžadující rescue implantaci V-A ECMO, mohou být postiženi intracerebrálním krvácením. Z těchto důvodů bychom měli mít nízký práh pro indikaci CT vyšetření mozku. Rozmach v používání nových biochemických markerů postižení mozkové tkáně v klinické praxi je žádoucí.
Do redakce došlo dne 18. 2. 2014.
Do tisku přijato dne 2. 5. 2014
Adresa pro korespondenci:
MUDr. Zdeněk Matloch
KAR, IKEM
Vídeňská 1958/9
140 21 Praha 4-Krč
e-mail: zdmt@ikem.cz
Zdroje
1. Moresco, L., Bellissima, V., Colivicchi, M., Crivelli, S., Guerriero, F., Ricotti, A., Sabatini, M., Strozzi, M. C., Temporini, F., Gazzolo, D.Markers of brain injury in non-invasive biological fluids. Minerva Pediatr. 2010, 62, p. 141–143.
2. Mateen, F. J., Muralidharan, R., Shinohara, R. T., Parisi, J. E., Schears, G. J., Wijdicks, E. F. Neurological injury in adults treated with extracorporeal membrane oxygenation. Arch. Neurol., 2011, 68, p. 1543–1549.
3. Hervey-Jumper, S. L., Annich, G. M., Yancon, A. R., Garton, H. J.,Muraszko, K. M., Maher, C. O. Neurological complications of extracorporeal membrane oxygenation in children. J. Neurosurg. Pediatr., 2011, 7, p. 338–344.
4. De Mol, A. C., Gerrits, L. C., van Heijst, A. F., Straatman, H., van der Staak, F. H., Liem, K. D. Intravascular volume administration: a contributing risk factor for intracranial hemorrhage during extracorporeal membrane oxygenation? Pediatrics, 2008, 6, p. 1599–1603.
5. Szabó, G. Physiologic changes after brain death. J. Heart. Lung. Transplant., 2004, 23, p. 223–226.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2014 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Hypotermie během anestezie – (ne)kazíme si sami výsledky naší práce?
- Česká porodnická anestezie a rok 2014
- Změníme přístup ke zvládání dechové nedostatečnosti?
- Výskyt hypotermie v perioperačním období – unicentrická observační studie
- První zkušenosti s biluminální fibrooptickou kanylou Vivasight ETView ® v hrudní chirurgii
- Kazuistika nediagnostikovaného intracerebrálního krvácení u pacientky po anuloplastice trikuspidální chlopně
- Postavení remifentanilu v porodnické analgezii
- Program INKA – porodní analgezie „na míru“
- První klinické zkušenostis dárcovstvím orgánů po nevratné zástavě oběhu – kazuistika
- Odběr orgánů od dárce zemřeléhov důsledku nevratné zástavy oběhu – kazuistika a přehled problematiky
- Aktuální trendy dlouhodobé farmakologické sedace kriticky nemocných
- Ultrazvukové vyšetření ledvinv perioperační medicíně a intenzivní péči
- Sepse, těžká sepse, septický šok
- Pacient nejde odpojit od umělé plicní ventilace – fyziologický přístup (se zaměřením na kardiální příčiny)
- Klinická doporučení pro praxi – diagnostika a léčba hyponatrémie
- „Prodám ledvinu.Zn.: Potřebuji peníze!“
- Praha je již etablovaným zkušebním centrem pro Evropský diplom z intenzivní medicíny (EDIC) v novém formátu
- Nové slovenské publikace
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- „Prodám ledvinu.Zn.: Potřebuji peníze!“
- Pacient nejde odpojit od umělé plicní ventilace – fyziologický přístup (se zaměřením na kardiální příčiny)
- Sepse, těžká sepse, septický šok
- Klinická doporučení pro praxi – diagnostika a léčba hyponatrémie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



