-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití fibrobronchoskopie v intenzivní péči
The utilization of fiberoptic bronchoscopy in intensive care
Fiberoptic bronchoscopy (FOB) is one of the most utlilised instrumental methods in intensive care. It is used therapeutically for removal of retained bronchial secretions and management of haemoptysis, and in diagnosis of pulmonary infections and other pathologies in mechanically ventilated patients. FOB is also used for tracheal intubation and to confirm tube positioning. The professional competence to perform FOB in the intensive care setting might be a matter of debate. The authors believe that education of intensivists in cooperation with trained chest physicians is the preferred way of training physicians working in intensive care units.
Keywords:
fibreoptic bronchoscopy – intensive care – intubation – ventilator-associated pneumonia – haemoptysis – aspiration
Autoři: Bartáková Hana 1; Otáhal Michal 1; Votruba Jiří 2; Balík Martin 1
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF UK a VFN 1; Centrum plicní endoskopie, Nemocnice Na Homolce 2
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 4, s. 203-210
Kategorie: Intenzivní medicína - Přehledný článek
Souhrn
Fibrobronchoskopie (FOB) je jednou z nejpoužívanějších instrumentálních metod v intenzivní péči. Využívá se především terapeuticky k toaletě dýchacích cest, řešení hemoptýzy a v diagnostice plicních zánětů a jiných patologií u ventilovaných pacientů. Dalším využitím FOB je asistence při intubaci a polohování endotracheální roury. Odborná způsobilost k provedení FOB u pacientů na anesteziologicko-resuscitačních odděleních (ARO) a jednotkách intenzivní péče (JIP) může být předmětem diskusí. Autoři článku se domnívají, že edukace intenzivistů ve spolupráci s erudovanými bronchology z řad pneumologů je správnou cestou k rozšíření této metody mezi lékaře JIP a ARO.
Klíčová slova:
fibrobronchoskopie – intenzivní péče – inkubace – ventilátorová pneumonie – hemoptýza – aspiraceÚvod
Fibrobronchoskopie (FOB) je v České republice tradičně součástí erudice pneumologů. Vzhledem k tomu, že naprostá většina pacientů na lůžkových odděleních ARO je z příčin buď primárně plicních, či mimoplicních mechanicky ventilována, je péče o dýchací cesty denním chlebem intenzivistů, respektive anesteziologů. Z tohoto pohledu je žádoucí, aby intenzivista ovládal základní FOB dovednosti, mezi něž patří FOB asistence při intubaci, odběr materiálu na mikrobiologické vyšetření a toaleta dýchacích cest. Okamžitě provedená FOB může v některých případech významně zlepšit ventilační parametry a pozitivně ovlivnit osud pacienta. V tabulce 1 jsou uvedeny nejčastější indikace k FOB na JIP.
Využití FOB při intubaci a polohování endotracheální roury
Využití FOB při obtížné intubaci vyžaduje zkušenosti se zaváděním bronchoskopu u spontánně ventilujících pacientů. I v rukou zkušeného bronchoskopisty může intubace trvat několik minut. Situace je značně ztížená, je-li v oblasti orofaryngu a laryngu přítomen edém, velké množství sekretů nebo krev. Z výše uvedeného vyplývá, že intubace pomocí FOB by měla být nacvičována během standardních, nekomplikovaných intubací. Jako metoda volby je vhodná zvláště tehdy, pokud je pacient dobře prodechnutelný maskou. Předpokládáme-li obtížnou intubaci a zvažujeme použití FOB, je vhodné touto cestou intubaci zahájit, neboť opakovanými neúspěšnými pokusy intubovat přímo endotracheální rourkou zvyšujeme riziko edému a krvácení [1]. FOB rovněž umožní zkontrolovat polohu endotracheální rourky (endotracheal tubus,ET) a vyloučit endobronchiální nebo ezofageální intubaci. Pomocí FOB můžeme také přímo kontrolovat místo vpichu během punkční tracheostomie a upravovat polohu tracheostomické kanyly. V anesteziologii je FOB běžně využívána při zavádění a kontrole umístění biluminálních rourek. FOB kontrola umístění biluminální rourky je více než vhodná, neboť až v 78 % se FOB prokáže malpozice [2]. Pro tuto indikaci jsou vhodné tenké a ultratenké bronchoskopy o vnějším průměru 2,8–4,2 mm, které lze využít pro všechny typy dospělých biluminálních rourek.
V souvislosti s alternativním zajištěním dýchacích cest je třeba se zmínit o možnosti provádět bronchoskopie přes laryngeální masku, což je metoda, která není u dospělých na rozdíl od dětí ve větší míře využívána, ale intenzivistům může usnadnit provést bronchoskopii u neintubovaných pacientů.
Diagnostická a terapeutická FOB u ventilovaného pacienta
V následujícím textu se nejdříve zmíníme o technických aspektech, indikacích, zdravotních rizicích a úpravě ventilačního režimu před FOB, poté o provádění diagnostických a terapeutických výkonů.
Technické vybavení
Pro hladký a bezpečný průběh FOB u intubovaného pacienta je třeba dostatečného rozdílu mezi vnějším průměrem fibroskopu a vnitřním průměrem ET. Je-li rozdíl mezi vnitřním průměrem ET a vnějším průměrem bronchoskopu příliš malý, je manipulace s bronchoskopem obtížná, hrozí dislokace ET, výraznější vzestup intraluminálních tlaků a hypoxémie. V neposlední řadě se zvyšuje riziko poškození pláště bronchoskopu. Jako minimální bývá uváděn rozdíl 1,5 mm [8] až 2 mm [28]. Naše zkušenost je taková, že s bronchoskopem o průměru 5 mm lze pohodlně bronchoskopovat pacienty s ET č. 8, s jistými obtížemi s ET č. 7,5, za minimální rozdíl tedy považujeme 2,0–2,5 mm. Pro pohodlnou manipulaci s bronchoskopem je třeba použít lubrikans. Vhodný je silikonový sprej, běžně se používá lidokainový sprej, použijeme-li mezokainový gel, tak jedině sterilní v balení na jedno použití. Zavedení bronchoskopu do ET umožňuje spojka napojená na ET a filtr okruhu, která má postranní otvor pro přístroj opatřený chlopní minimalizující únik vzduchu.
Indikace
Nejčastější klinické a/nebo rentgenové, respektive ultrazvukové nálezy jsou uvedeny v tabulce 1.
Tab. 1. Nejčastější indikace FOB na JIP 
Rizika a kontraindikace
FOB je poměrně bezpečná metoda zatížena velmi nízkou morbiditou i mortalitou. Bez bližší specifikace pacientů a výkonů provedených během FOB se obecně komplikace různé závažnosti vyskytují s frekvencí desetin procenta a mortalita se pohybuje v řádech setin procenta [3, 5]. Ze závažných komplikací se jedná především o oběhové a respirační komplikace – arytmie, asystolie a těžká hypotenze, hypoxémie, bronchospazmus, pneumotorax, asfyxie z masivní hemoptýzy. Jako absolutní kontraindikace FOB bývá uváděna těžká oběhová nestabilita, život ohrožující arytmie a těžká hypoxémie. V kontextu intenzivní péče je ovšem potřeba u každého pacienta individuálně posoudit, zda lze předpokládat, že provedení FOB závažnou situaci pacienta zlepší, nebo naopak zvrátí nepříznivým směrem. Meduri a Chastre definovali pacienty na umělé plicní ventilaci ohrožené různými typy komplikací a rozdělili je do skupiny s vysokým a relativně vysokým rizikem vzniku komplikací – tabulka 2 [6].
Mezi běžné komplikace FOB v průběhu několika hodin po výkonu patří horečka, která se vyskytuje až u 1/3 pacientů. Ve většině případů je důsledkem uvolnění cytokinů z alveolárních makrofágů, nikoli bakterémie [4].
Úprava ventilačního režimu
Hypoxémie je jednou z nejběžnějších komplikací FOB a závisí na závažnosti plicního postižení a stupni omezení alveolární ventilace, k níž během výkonu dojde. Mezi opatření, jejichž smyslem je snížit riziko či míru hypoxémie, patří řádná preoxygenace před výkonem, tj. ventilace 100% O2 15 minut před výkonem a během FOB, řádná sedace, eventuálně krátkodobá relaxace během výkonu, jenž eliminuje interferenci pacienta s ventilátorem, použití ET o dostatečně velkém průměru, omezení sání bronchoskopem na dobu nezbytně nutnou pro toaletu dýchacích cest [6, 7]. Krátkodobá relaxace omezí i riziko poranění sliznice při kašli pacienta, což má význam zvláště u trombopenických pacientů. Hypoventilaci lze omezit přechodem na objemově řízenou ventilaci s vyšší dechovou frekvencí a malými dechovými objemy (3 až 4 ml/kg), v extrémních případech až na vysokofrekvenční režim. Někteří autoři doporučují před FOB přerušit nebo na 50 % redukovat PEEP z obav z excesivního nárůstu intrabronchiálního tlaku a barotraumatu [8]. Podle našich informací neexistují data, která by identifikovala přesný podíl PEEP na vznik pneumotoraxu během FOB. Na našem pracovišti PEEP během výkonu neredukujeme a pneumotorax jsme v souvislosti s FOB nezaznamenali.
Během výkonu pacienty kompletně monitorujeme. Pokud je pacient po výkonu stabilní, tak rentgenový snímek – čistě z důvodu vyloučení eventuálních komplikací (pneumotoraxu, pneumomediastina) – neprovádíme.
Diagnostická FOB
FOB je v řadě případů výkonem současně diagnostickým i terapeutickým, dělení je pouze schematické. U pacientů na JIP se FOB k diagnostickým účelům používá především u pneumonií vzniklých buď před zahájením UPV, nebo u ventilátorových pneumonií (VAP) k odhalení etiologického agens. Další častější indikací je zjištění zdroje a rozsahu hemoptýzy. Ostatní indikace k diagnostické FOB jsou spíše okrajové.
Diagnostická FOB u pacienta s pneumonií
Smyslem diagnostické FOB u pacientů s pneumonií – ať již vzniklé před zahájením UPV, nebo ventilátorové – je odhalit etiologické agens. V porovnání s běžnými naslepo prováděnými tracheálními aspiráty můžeme pomocí FOB odebrat materiál cíleně z distálních dýchacích cest, respektive alveolů vybrané oblasti a minimalizovat kontaminaci vzorku bakteriemi pocházejícími z horních cest dýchacích. Otázka preference diagnostického přístupu u pacientů s VAP je stále diskutována. Autoři různých studií se snaží vyřešit, zda bronchoskopické odběry sekretů s následným kvantitativním vyhodnocením jsou významně přínosnější než naslepo prováděné kvalitativní nebo kvantitativní tracheální aspiráty. V současnosti zůstává otázkou, zda bronchoskopický odběr materiálu významně snižuje mortalitu pacientů s VAP v porovnání s nebronchoskopickými odběry. Jak ovšem vyplývá z rozsáhlé metaanalýzy, bronchoskopický odběr s následným kvantitativním zpracováním vzorků usnadňuje deeskalaci antibiotické léčby a snižuje celkové množství antibiotik u pacientů s VAP, což může pozitivně ovlivňovat riziko nárůstu rezistentních patogenů [9, 10, 11]. Významně vyšší možnost deeskalace antibiotik na základě FOB odběrů v porovnání s tracheálními aspiráty (oboje kvantitativně zpracované) u pacientů s VAP nedávno prokázala i další studie z Řecka [12]. Navíc recentní americká studie, v níž byla prováděna BAL u každého pacienta oboustranně, prokázala, že v 25 % případů by antibiotická léčba byla prováděna nesprávně, pokud by byla provedena pouze jednostranná BAL. V 80 % těchto případů se přitom jednalo o oboustranné postižení plic [13]. Možnost snadněji vysadit a/nebo deeskalovat antibiotika má i významný efekt na snížení lékových nákladů [29].
Na našem pracovišti upřednostňujeme FOB odběr sekretů z dolních dýchacích cest u pacientů s pneumonií, mj. i pro vizualizaci bronchiálního stromu s možností toalety dýchacích cest. V individuálních případech může mít FOB u pacientů s nově vzniklým infiltrátem i diferenciálně diagnostický význam. FOB jsme např. odstranili z distálních dýchacích cest část odlomené odsávací kanyly nebo fragment tracheální chrupavky, které obturovaly jednu z distálních průdušek.
Materiál k mikrobiologickému vyšetření by měl být v každém případě odebrán před zahájením antibiotické léčby nebo co nejdříve po něm. Pokud po 72 hodinách léčby nedochází ke klinickému zlepšení, lze zvažovat přítomnost rezistentních bakterií a změnu antibiotik. Další odběr by měl být proveden rovněž před nasazením nového antibiotika, optimálně po 48 hodinách bez antibiotické léčby [14, 15].
Bronchoalveolární laváž (BAL)
Smyslem BAL je získat tekutinu, kterou jsme vypláchli dolní dýchací cesty a alveoly vybraného segmentu nebo subsegmentu. Bronchoskop proto zaklíníme do segmentárního nebo subsegmentárního bronchu a poté po jednotlivých porcích pomalu instilujeme FR ohřátý na 37 oC. Po instilaci každé porce aspirujeme tekutinu ihned zpět. Minimální celkové množství instilované tekutiny je 100 ml aplikované po objemech 20–50 ml do vybraného bronchu, standardně provádíme laváž 4krát 50 ml fyziologickým roztokem (FR). První porce, která představuje převážně bronchiální laváž, je vyšetřována zvlášť, ostatní navrácené objemy sléváme do jednoho kontejneru [16, 17]. Takto získaný materiál můžeme odesílat na bakteriologické, mykologické, virologické, cytologické a imunologické vyšetření.
Kromě standardní BAL je v průběhu bronchoskopie získáván materiál pouhou aspirací nebo bronchiálním výplachem několika mililitry fyziologického roztoku. Takto získaný materiál odráží složení bronchiálního sekretu v místě odběru.
Odběr materiálu pomocí chráněného kartáčku
Méně využívanou a nákladnější metodou je odběr materiálu pomocí chráněného kartáčku(protected specimen brush – PSB). Oproti odběrům prováděným běžným nechráněným kartáčkem je redukováno riziko kontaminace vzorku mikroflórou pocházející z horních cest dýchacích. Speciální kartáčky jsou umístěny ve dvou katétrech. Konec vnějšího katétru je uzavřen zátkou ze vstřebatelné hmoty. Po umístění bronchoskopu do oblasti, odkud má být proveden odběr, se vysune katétr z pracovního kanálu, poté se vnitřním katétrem odstraní zátka a nakonec se vysune kartáček a provede se odběr. Kartáček se po odebrání vzorku zasune zpět v přesně obráceném pořadí. Po vytažení celého katétru ven z bronchoskopu se vnější katétr odstřihne, kartáček se vysune z vnitřního katétru a odstřihne se do nádoby se sterilním fyziologickým roztokem nebo Ringer-laktátem, který se potom využívá k mikrobiologickému, eventuálně i cytologickému vyšetření [18].
Kvantitativní vyšetření bronchoskopicky získaného vzorku
K přenesení vyšetřovaného sekretu do kultivačního media se používá kalibrovaných kliček a počet bakterií se vyjadřuje jako počet tzv. „kolonií formujících jednotek“ – CFU/ml neředěného sekretu. Za pozitivní, pro VAP patognomické, se považují nálezy, kdy se bakterie vyskytují v koncentraci ≥ 104CFU/ml v BAL, ≥ 103 CFU/ml v materiálu odebraném PSB [15]. Kvalitativně hodnocený tracheální aspirát je považován za patognomický při CFU/ml ≥ 105. Význam kvantitativního hodnocení BAL stoupá zvláště u imunosuprimovaných a hematoonkologických pacientů. Zde je doporučována minimální koncentrace 103CFU/ml pro stanovení diagnózy ze vzorků z BAL a 102 CFU/ml z PSB [30, 31]. S ohledem na dilema v hodnocení invazivního (bronchoskopického) vs neinvazivního odběru vzorku je někdy kvantitativní hodnocení sputa považováno za esenciální podmínku provádění odběru vzorků bronchoskopicky, a to i u imunokompetentních pacientů. Kvantitativní hodnocení napomáhá odlišit infekci od pouhé kolonizace. Výskyt kontaminujících bakterií pocházejících z horních cest dýchacích se snažíme redukovat zmíněnými chráněnými odběry a jejich koncentrace je rovněž zpravidla pod minimální CFU/ml. Jedná se především o α-hemolytické streptokoky, koaguláza-negativní stafylokoky, Micrococcus spp., Neisseria spp. a některé anaerobní bakterie.
Diagnostická výtěžnost a přesnost BAL a PSB u VAP byla sledována v Chastrově studii, kde byly výsledky BAL a PSB porovnávány s histologickým vyšetřením plicní tkáně. Senzitivita byla 91% a 82%, specificita 78% a 77%, pozitivní prediktivní hodnota 83% a 74% a negativní prediktivní hodnota 87% a 85% [19].
Diagnostická FOB u pacientů s hemoptýzou
Diferenciální diagnostika hemoptýzy (tab. 3) je velice široká a přesahuje rámec tohoto sdělení. V zásadě se s různou měrou vyskytuje u všech plicních patologií a traumat, řady kardiovaskulárních a hematologických onemocnění, předávkování antiagregancii a antikoagulancii.
Tab. 3. Příčiny hemoptýzy na JIP 
Obecně krvácení „z plic“ pochází až v 92 % z bronchiálních arterií odstupujících z aorty. Z iatrogenních příčin může být hemoptýza komplikací samotné bronchoskopie, plicní biopsie a řady invazivních výkonů v oblasti dýchacích cest a hrudníku. Častou příčinou hemoptýzy je v intenzivní péči krvácení z odsávacího traumatu ve velkých dýchacích cestách nebo z trachey při špatně polohované tracheostomické kanyle. Hemoptýza sama může být důvodem pro přijetí na JIP nebo se během hospitalizace objevit. Názor na množství krve, které má být považováno za masivní hemoptýzu, se v literatuře značně liší, uvádí se mezi 100–600 ml/24 h, obvykle 200 ml/24 h [20]. V zásadě však jde především o klinický efekt hemoptýzy. Je třeba mít na mysli, že primárním rizikem hemoptýzy je asfyxie nikoli hemoragický šok. Z toho plyne potřeba, co nejrychleji diagnostikovat zdroj krvácení a pokud možno krvácení zastavit, nebo alespoň krvácející oblast izolovat od zbývajících ventilovaných částí plic.
V běžné pneumologické praxi se při výskytu nevelké hemoptýzy řeší otázka, zda provést FOB časně, do 48 hodin, či odloženě po provedení dalších laboratorních a zobrazovacích vyšetření. V intenzivní péči provádíme FOB co nejdříve i v případě, že se nejedná o masivní hemoptýzu, neboť časná FOB vede signifikantně častěji k lokalizaci zdroje krvácení než odložená [21]. To má význam pro terapeutickou část bronchoskopického výkonu i pro další terapii hemoptýzy (viz níže).
Diagnostická FOB u pacientů s nádory průdušek a plic
Zjištění zhoubného nádoru a jeho klinické stadium často určuje rozsah intenzivní péče, která bude pacientovi poskytována. Nález endobronchiálního tumoru může být náhodný při FOB vyšetření, např. pro infiltrativně-atelektatický proces. Jindy je FOB prováděna pro objasnění povahy patologického ložiska na skiagramu či CT. K cytologické diagnostice endoskopicky patrných tumorů lze provést aspiraci z povrchu pomocí katétru, kartáčkovou nebo jehlovou biopsii. Získaný materiál je vhodné jednak natřít na sklíčko a dále provést výplach kanyly, kartáčku nebo jehly do zkumavky s fyziologickým roztokem. K histologickému vyšetření odesíláme vzorky tkáně ve formolu získané klešťovou biopsií. Zda se jedná o odběr tkáně a nikoli pouze hlenu z povrchu sliznice, se můžeme orientačně přesvědčit tak, že sledujeme, zda bioptické vzorky padají ke dnu zkumavky. Při normálním endobronchiálním nálezu a suspektním rentgenovém ložisku můžeme provést BAL nebo naslepo provedenou aspiraci kanylou či kartáčkem z postiženého segmentu. Za těchto okolností je optimální mít před FOB k dispozici CT, abychom odběry prováděli cíleně.
Diagnostická FOB u intersticiálních plicních procesů spočívá ve standardně provedené BAL s diferenciálním rozpočtem buněk, eventuálně určení specifických částic (azbestová tělíska, křemičitany). Další metodou je transbronchiální biopsie, která je u pacientů s UPV zatížená až 3krát vyšším rizikem pneumotoraxu v porovnání se spontánně ventilujícím [22].
Diagnostika tracheobronchiálních anomálií, cizích těles, píštělí
Pomocí FOB lze vizualizovat jednak vrozené anomálie tracheobronchiálního stromu, jako je např. vzácná tracheobronchomegalie, nebo různá anomální větvení a odstupy bronchů, nebo abnormality vzniklé následkem traumat a jiných patologických procesů. V důsledku špatně umístěné tracheostomické kanyly může např. dojít ke vzniku tracheální stenózy, kterou odhalí tracheoskopie při povytažení ET rourky v apnoi. Punkční tracheostomie se může komplikovat frakturou tracheálních prstenců. Zlomené tracheobronchiální chrupavky s deformací průsvitu dýchacích cest bývají rovněž důsledkem traumat hrudníku nebo nepřímé srdeční masáže.
Aspirace cizích těles může akutně způsobit závažné obtíže, jsou-li tělesa velká a obturují velkou část plic, nebo jsou-li ostrá a způsobí závažnou hemoptýzu. FOB má v tomto případě především urgentní terapeutický význam. Je-li však těleso příliš velké, tuhé nebo naopak plastické, je třeba použít k jeho odstranění rigidní bronchoskop s větším instrumentáriem. Následkem aspirace žaludečního obsahu o nízkém pH může dojít v průběhu 2 hodin k rozvoji chemické pneumonitidy, tzv. Mendelsonově syndromu a ARDS. V těchto případech je FOB indikována nikoli k odstranění kyseliny, neboť ta je absorbována v průběhu několika minut, ale ke zjištění přítomnosti a odstranění zbytků potravy jako možného zdroje bakteriální superinfekce. Cizí tělesa v dýchacích cestách mohou vyvolat vážné obtíže i v odstupu několika dní nebo týdnů v důsledku rozvoje pneumonie za překážkou, jejíž rozsah může být umocněn tvorbou granulační tkáně v okolí. Při FOB vyšetření nemusí být původní cizí těleso rozeznáno a nález může být omylem hodnocen jako tumor.
Velmi složitá je problematika tracheobronchiálních píštělí, obzvláště těch, které vznikly bez souvislosti s plicní operací. Zatímco v opticky přehledné části bronchiálního stromu lze ústí píštěle, často se zarudlou sliznicí a vytékajícím sekretem, relativně dobře identifikovat, obtíže činí diagnostika periferních pleurobronchiálních, respektive alveolopleurálních píštělí. Žádná z historicky používaných ani současných metod není suverénní. Bronchografie, která se prakticky neprovádí, mj. i proto, že podle našich informací není v České republice kontrastní látka schválená k jejímu použití, nebyla v tomto směru příliš přínosná, obdobně jako detekce pomocí metylenové modři aplikovaná buď do pleurální dutiny, nebo bronchoskopicky. V současné době se využívá především kombinace CT a FOB k určení zdroje úniku. Při FOB se využívá různých typů balonkových katétrů zavedených buď přímo do ET pod bronchoskopickou kontrolou, nebo speciálních katétrů, které projdou pracovním kanálem bronchoskopu (např. B5-2C fy Olympus). Postupnou obturací jednotlivých segmentů nafouklým balonkem a sledováním úniku vzduchu hrudním drénem lze detekovat postižený segment, eventuálně k píštěli katétrem vpravit tkáňové lepidlo nebo etanol. Obecně je doporučováno velké a centrálně uložené píštěle indikovat ke stentáži nebo chirurgickému výkonu, u malých a periferně uložených píštělí zkusit FOB řešení [23, 24, 25]. Sami máme zkušenost s diagnostikou bronchopleurální píštěle a perzistujícího pneumofluidotoraxu u pacientky s Wegenerovou granulomatózou pomocí FOB instilovanou metylenovou modří; speciální balonkový katétr jsme zařadili do našeho instrumentária, ale zatím nepoužili.
Terapeutická FOB
Mezi nejběžnější bronchoskopické léčebné výkony patří toaleta dýchacích cest při mukostáze a přítomnosti krve v plicích, stavění krvácení při hemoptýze, odsátí aspirace žaludečního obsahu, extrakce cizích těles a výše zmiňovaná okluze bronchopleurálních píštělí.
Odstranění hlenových zátek a léčba atelaktáz
Tento výkon představuje 75 % terapeutických FOB. Efektivní je především u akutně vzniklých lobárních a segmentárních atelektáz, méně úspěšné je otevírání subsegmentárních atelektáz a kondenzací s patrným vzdušným bronchogramem na skiagramu nebo s periferním dynamickým bronchogramem při ultrazvukovém vyšetření. K ředění sekretu a výplachům ošetřované oblasti se používá fyziologický roztok. Během toalety dýchacích cest lze k mukolýze použít mesnu (Mistabron), zpravidla 600 mg naředěných do 20 ml fyziologického roztoku (FR). Velmi vazký hlen je někdy nutné odstraňovat kleštěmi. Extrémním nálezem jsou pak hlenové zátky tvořící odlitky bronchů při tzv. plastické bronchitidě. Častěji se vyskytují u dětí např. při astmatu, cystické fibróze, alergické bronchopulmonální aspergilóze, bronchiektaziích a srpkovité anémii [20]. Velmi pečlivě je potřeba z průdušek a plic odstraňovat krev a krevní koagula jakéhokoli zdroje, neboť mj. jde o vhodnou živnou půdu pro bakterie.
Zajímavý je ojedinělý literární údaj o léčbě atelaktáz insuflací vzduchu přes pracovní kanál bronchoskopu. Bronchoskop byl zaklíněn do segmentárního bronchu kolabované oblasti a ručním dýchacím přístrojem byl vháněn vzduch do pracovního kanálu. Přes trojcestný adaptér byl připojen měřič tlaku, periferní tlak v dýchacích cestách byl udržován pod 30 cm H2O nebo 10 cm H2O nad původním tlakem. K rozvinutí atelaktázy došlo u 12 ze 14 pacientů do 24 h od výkonu [26].
Terapeutická FOB u hemoptýzy
FOB léčba zahrnuje jednak postupy, které nevyžadují zvláštní vybavení, dále ty, při nichž je potřeba mít k dispozici vhodné příslušenství a konečně poměrně speciální technologie, které nebývají běžným vybavením JIP, což je laser a elektrokauter. Mezi nejběžnější metody patří zaklínění krvácející oblasti bronchoskopem, čímž jsou vytvořeny podmínky pro tvorbu koagula. Tato metoda může být doplněna o hypotermickou vazokonstrikci při oplachu nebo laváži 4°C studeným FR. K vyvolání vazokonstrikce se rovněž používá naředěný adrenalin 1 : 10000, obvykle 1 až 2 ml roztoku, dále podle lokální a systémové reakce. V zahraničí se používá v léčbě krvácení, včetně hemoptýzy, vazopressin, který není v České republice registrován. Má méně nežádoucích hemodynamických účinků než adrenalin, obzvláště při lokálním použití, které je stejně efektivní jako systémové. Úspěšné použití koagulancií a tkáňových lepidel bylo opakovaně popsáno, nicméně se jedná spíše o zkušenosti než studie, a široce nejsou tyto preparáty používány. Možností jsou též topické aplikace hemostyptik (tranexamová kyselina, Exacyl). Ke stavění krvácení, respektive izolaci postižené lokality, se rovněž používají balonkové katétry typu Fogarty nebo Swan-Ganz. Katétrem lze pak instilovat do postižené oblasti studený FR, vazokonstrikční látky, eventuálně koagulancia. Obturace balonkem může hemoptýzu zastavit, nebo pouze napomůže získat čas pro další řešení, např. chirurgické.
Další možností je aplikace bronchiálního obturátoru s pomocí bronchoskopu nebo biluminální intubace a selektivní intubace nekrvácející strany.
Jednotky intenzivní péče, které disponují elektrokautery, mohou použít k hemostáze speciální koagulační elektrody, jako je např. CD-6C-1 fy Olympus nebo kličky či speciální koagulační klíšťky, které jsou jinak používány k biopsiím. Koagulační elektroda je zavedena do pracovního kanálu a po optickém ověření umístění, kdy je viditelný speciální zelený proužek na koagulační elektrodě, je dotekově provedena endobronchiální elektrokoagulace zdroje krvácení.
Časná bronchoskopická diagnostika místa krvácení intenzivistou může napomoci cílené terapeutické embolizaci bronchiálního řečiště při bronchiální arteriografii prováděné invazivním radiologem.
Při rozvoji masivní hemoptýzy u spontánně ventilujícího pacienta je třeba pomýšlet na použití rigidního bronchoskopu, který umožňuje odstraňovat z dýchacích cest velká koagula, pokud přikročíme k intubaci ET, tak by měl být použit co největší průměr [8, 20, 32].
I po „malé hemoptýze“ je vždy u ventilovaného pacienta třeba myslet na možnost obturace segmentů a subsegmentů odlitkovými tromby a riziko atelektázy a rozvoje ventilátorové pneumonie, zvláště paravertebrálně a retrokardiálně. Na místě je proto provedení kontrolní bronchoskopie a ověření průchodnosti bronchiálního stromu pacienta.
FOB u aspirací a extrakce cizího tělesa
Aspirace žaludečního obsahu do dýchacích cest je zvláště u primárních příjmů častým jevem. Její symptomy jsou někdy nevýrazné a skiagramem nemusí být vůbec zachycena. Na našem pracovišti proto indikujeme kontrolní bronchoskopii časně a již při klinickém podezření na aspiraci. I odsátí malého množství žaludečního obsahu nebo atonické tekutiny snižuje riziko infekčních komplikací, zkracuje dobu na umělé plicní ventilaci a snižuje náklady na terapii.
Aspirace cizího tělesa může probíhat různě dramatickým způsobem – od sufokace při obturaci laryngu nebo trachey po chronické obtíže související především se sekundárním zánětem u neasfyktických aspirací. V život ohrožujících stavech je těleso potřeba buď rychle odstranit z dýchacích cest, nebo jej posunout distálněji, uvolnit alespoň část dýchacích cest a jeho odstranění provést následně bronchoskopicky. Extrakce má být provedena co nejdříve, neboť přítomnost cizího tělesa, zvláště organické povahy, vyvolává v okolí edém, zánět a tvorbu granulační tkáně, které mohou později extrakci velmi komplikovat. U intubovaných pacientů odpadá riziko ztráty tělesa během extrakce v zúženém subglotickém prostoru stejně jako při rigidní bronchoskopii. Způsob extrakce závisí na tvaru, velikosti a materiálu tělesa a na přítomnosti zánětu okolní tkáně. Měkká, plastická tělesa, např. kousky masa, lze někdy extrahovat tak, že je přisajeme k pracovnímu kanálu a za stálého sání je vytáhneme i s bronchoskopem. Pro extrakci těles existuje celá řada nástrojů, např. různé typy extrakčních kleští, košíčky, háčky, oka. K posouvání těles orálním směrem se používají rovněž balonkové katétry. Katétr s vyfouklým balonkem se zasune pod těleso, poté se balonek nafoukne a posouvá se vzhůru. V trachee může být poté těleso uchopeno jiným nástrojem. Pokud odstranění tělesa brání granulační tkáň, je možné zvážit její odstranění např. laserem nebo elektrokoagulací [27, 32].
Závěr
Uvádíme aplikace FOB, se kterými se s různou frekvencí můžeme setkat na odděleních intenzivní péče. Za základní výkony, které by měl intenzivista ovládat, považujeme toaletu dýchacích cest při jejich obstrukci hlenovými zátkami či krevními koaguly, ošetření hemoptýzy, extrakce cizích těles. Nejčastěji se jedná o toaletu dýchacích cest u intubovaných pacientů, kterou lze při základním FOB vybavení provádět bez většího rizika po zvládnutí orientace v bronchiálním stromu do úrovně segmentů a subsegmentů. Jiné situace vyžadují velkou zkušenost a dovednost pracovat se speciálními nástroji a technikami – obrázky 1–3. V rozsahu celé škály náročnosti bronchoskopických výkonů se uplatní jak intenzivista, tak specializovaný broncholog. Provoz na odděleních JIP vykazujících nejvyšší škálu TISS předpokládá dostupnost bronchoskopu po 24 h denně a současně i přítomnost v bronchoskopii trénovaného lékaře.
Obr. 1. Tracheomalacie v místě chirurgické tracheostomie u kardiochirurgického pacienta – pooperační průběh komplikován dehiscencí sterna a mediastinitidou 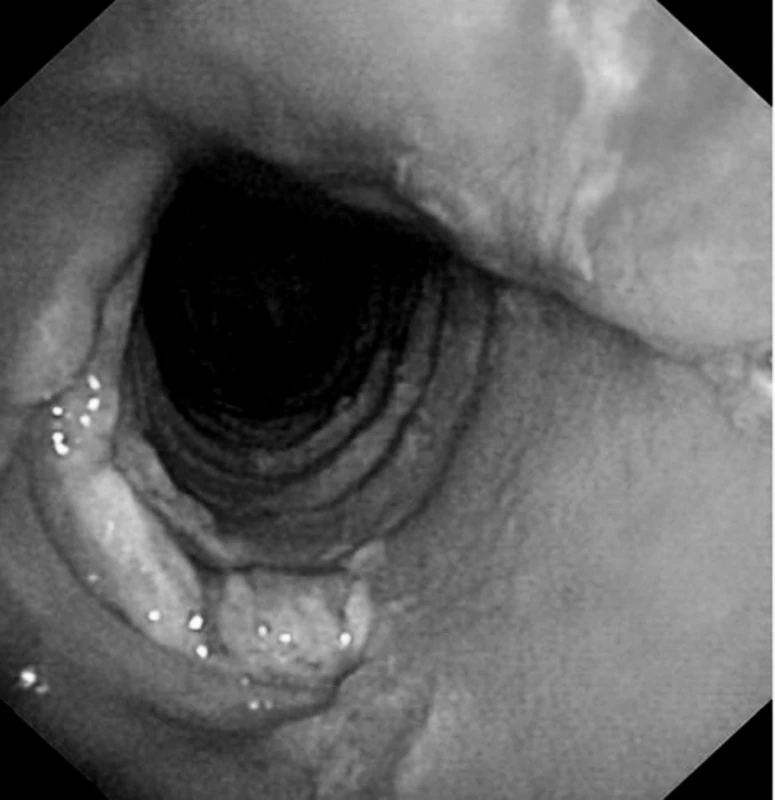
Obr. 2. Tumor (epidermoidní karcinom) obturující lobární bronchus pro horní lalok vpravo jako příčina opakovaných hemoptýz 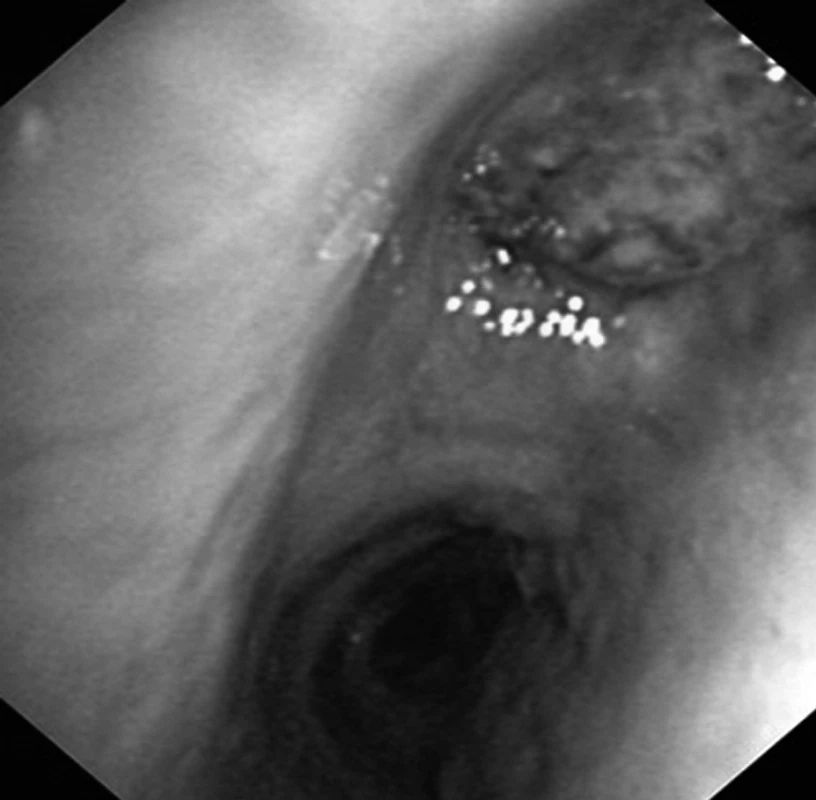
Obr. 3. Extrakce burského oříšku z dolního laloku vpravo pomocí oka 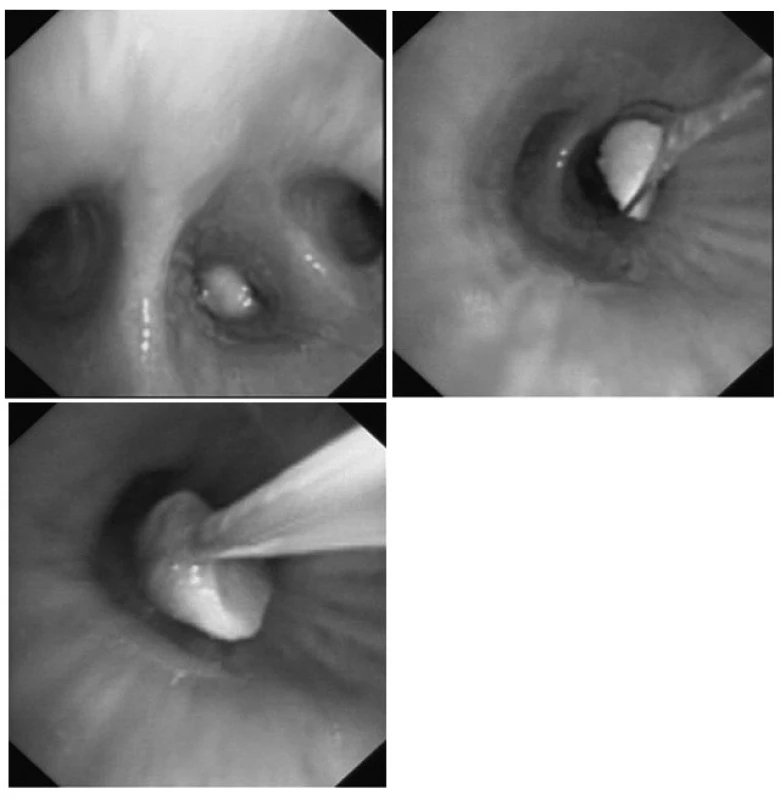
FOB je integrální součástí tréninku intenzivisty v přípravě ke složení diplomu z intenzivní medicíny v Austrálii (FJFICM), Spojených státech (FCCM) a Evropské unii (EDIC).
V České republice jsou bronchologické kurzy určené pro pneumology organizováné v rámci České pneumologické a ftizeologické společnosti. Domníváme se, že vzdělávací akce zaměřené na bronchoskopii v podmínkách intenzivní péče by se mohly stát součástí přípravy lékařů intenzivistů. Odbornou záštitu nad nimi by mohly převzít společně pneumologická a intenzivistická společnost.
Použité zkratky:
FOB – fiberoptic bronchoscopy, fibrobronchoskopie
JIP – jednotka intenzivní péče
ARO – anesteziologicko-resuscitační oddělení
BAL – bronchoalveolární laváž
PSB – protected specimen brush, chráněný kartáček
ET – endotracheal tubus, endotracheální rourka
UPV – umělá plicní ventilace
FR – fyziologický roztok
VAP – ventilator-associated pneumonia (ventilátorová pneumonie)
CFU – colony forming units, kolonie formující jednotky
PEEP – pozitivní endexspirační přetlak
TISS – therapeutic intervention scoring system
PT – protrombinový čas
PTT – parciální tromboplastinový čas
Došlo 15. 1. 2009.
Přijato 11. 3. 2009.
Adresa pro korespondenci:
MUDr. Hana Bartáková
KARIM VFN a 1. LF UK
U nemocnice 2
Praha 2, 128 08
e-mail: bartakov@yahoo.com
Zdroje
1. Miller, R. D. Miller’s Anesthesia, 6th ed., Churchill Livingstone Elsevier Ltd., 2005.
2. Benumof, J. L. Double-lumen tube position should be routinely determined by fiberoptic bronchoscopy. J. Cardiothorac Anesth., 1993, 7, p. 513.
3. Pue, C., Pacht, E. Complications of fiberoptic bronchoscopy at a university hospital. Chest, 1995, 107, p. 430–432.
4. Picard, E., Schwartz, S. et al. A prospective study of fever and bacteremia after flexible fiberoptic bronchoscopy in children. Chest, 2000, 117, p. 573–577.
5. Credle, W. F. Complications of fiberoptic bronchoscopy. Am. Rev. Resp. Diss., 1974, 109, p. 67–72.
6. Meduri, G. U., Chastre, J. The standardization of bronchoscopic techniques for VAP. Chest, 1992, 102, Suppl., p. 557S–564S.
7. Lindholm, C. E. Cardiorespiratory effects of flexible fiberoptic bronchoscopy in critically ill patients. Chest, 74, 1978, p. 362–368.
8. Jolliet, P. Bronchoscopy in the intensive care unit. Intensive Care Med., 1993, 18, 3, p. 160–169.
9. Fagon, J. Y. Invasive and noninvasive strategies for management of suspected ventilator-associated pneumonia. A randomized trial. Ann. Intern. Med., 2000, 132, 8, p. 621–630.
10. Shorr, A. F., Sherner, J. H. et al. Invasive approaches to the diagnosis of ventilator-associated pneumonia: a meta-analysis. Crit. Care Med., 2005, 33, p. 46–53.
11. Leong, J. R. Ventilator-associated pneumonia. Surg. Clin. North. Am., 2006, 86, 6, p. 1409–1429.
12. Giantsou, E. De-escalation therapy rates are significantly higher by bronchoalveolar lavage than by tracheal aspirate. Intensive Care Med., 2007, 33, p. 1533–1540.
13. Jackson, S. R. Utility of bilateral bronchoalveolar lavage for the diagnosis of ventilator-associated pneumonia in critically ill surgical patients. Am. J. Surg., 2008, 195, 2, p. 159–163.
14. Montravers, P., Fagon, J. et al. Follow-up protected specimen brushes to assess treatment in nosocomial pneumonia. Am. Rev. Respir. Dis., 1993, 147, p. 38–44.
15. Mayhall, G. C. Nosocomial Pneumonia: Diagnosis and Prevention. Infectious Disease Clinics of North America, 1997, 11, p. 427–457.
16. Skřičková, J., Homolka, J. et al. Bronchoalveolární laváž (BAL) a její význam. Bulletin, Česká pneumologická a ftizeologická společnost, Česká lékařská společnost J. E. Purkyně, 2001, 2, p. 14–17.
17. Rennard, S. I., Aalbers, R. et al. Bronchoalveolar lavage: performance, sampling, processing and assesment. Eur. Resp. J., 1998, 11, Suppl. 26, p. 13–15.
18. Mayer, J., Skřičková, J. et al. Postižení plic u imunokompromitovaných nemocných, Diferenciální diagnostika a využití bronchoalveolární laváže. 1. vydání, Praha: Institut pro další vzdělávání pracovníků ve zdravotnictví, 1995.
19. Chastre, J., Fagon, J. et al. Evaluation of bronchoscopic techniques for the diagnosis of nosocomial pneumonia. Am. J. Respir. Crit. Care Med., 1995, 152, p. 231–240.
20. Mason, R. J. Murray & Nadel’s Textbook of Respiratory Medicine. 4th ed., Saunders 2005.
21. Stolle, J. K. Diagnosis and management of massive hemoptysis: a review. Respir. Care, 1992, 32, p. 564–581.
22. O’Brien, J. D., Ettinger, N. A. et al. Safety and yield of transbronchial lung biopsy in mechanically ventilated patients. Crit. Care Med., 1997, 25, p. 440–446.
23. Regel, G., Sturm, J. A. et al. Occlusion of bronchopleural fistula after lung injury: a new treatment by bronchoscopy. J. Trauma, 1989, 29, p. 223–226.
24. Ellis, J. H., Sequeira, F. W. et al. Balloon catheter occlusion of bronchopleural fistulae. Am. J. Roentgenol., 1982, 138, p. 157–159.
25. Lois, M., Noppen, M. Bronchopleural fistulas: an overview of the problem with special focus on endoscopic management. Chest, 2005, 128, p. 3955–3965.
26. Yao Taso, T., Juany Tsai, Y. et al. Treatment of collapsed lung in critically ill patients. Chest, 1990, 97, p. 435–438.
27. Ernst, A., Silvestr, G. A. et al. Interventional Pulmonary Procedures Guidelines from the American College of Chest Physicians. Chest, 2003, 123, 5, p. 1693–1717.
28. Aitkenhead, A. R., Rowbotham, D. J., Smith, G. Textbook of Anaesthesia, 5th edition, Churchill Livingstone Elsevier Ltd. 2007.
29. Bonten, M. J. Implementation of bronchoscopic techniques in the diagnosis of ventilator-associated pneumonia to reduce antibiotic use. Am. J. Respir. Crit. Care Med., 1997, 156, p. 1820–1824.
30. Heyland, D. K., Cook, D. J. et al. The Clinical Utility of Invasive Diagnostic Techniques in the Setting of Ventilator-Associated Pneumonia. Chest, 1999, 115, p. 1076–1084.
31. Dunagan, D. P. Bronchoscopic evaluation of pulmonary infiltrates following bone marrow. Chest, 1997, 111, p. 135–141.
32. Wang, K., Mehta, A. C., Turner, J. F. jr. Flexible Bronchoscopy. 2nd Edition, Blackwell Science, 2004.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2009 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Paliativní péče u nemocných s nezvratným orgánovým selháním
- iNO v léčbě akutního respiračního selhání novorozenců – srovnání efektu kombinace s CMV a HFOV
- Časné vyhledávání kriticky nemocných pomocí Medical Emergency System ve Fakultní nemocnici u svaté Anny v Brně
- Měření transalveolárního tlaku pomocí plícnicového katétru
- Pacientka s těžkou protrahovanou hypoglykémií
- Využití fibrobronchoskopie v intenzivní péči
- 2. ČESKÝ KONGRES INTENZIVNÍ MEDICÍNY
- Doporučený postup vyšetření před diagnostickými nebo léčebnými výkony operační a neoperační povahy s požadavkem anesteziologické péče (tzv. předanestetické vyšetření)
- Zásady bezpečné anesteziologické péče
- Konsenzuální stanovisko k poskytování paliativní péče u nemocných s nezvratným orgánovým selháním (ČSARIM ČLS JEP, ČSIM ČLS JEP)
- Konsenzuální stanovisko k použití terapeutické hypotermie (ČSARIM ČLS JEP, ČSIM ČLS JEP, Společnost urgentní medicíny a medicíny katastrof ČLS JEP)
- Seznam doporučení ČSARIM
- Zpráva revizní komise
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Využití fibrobronchoskopie v intenzivní péči
- Pacientka s těžkou protrahovanou hypoglykémií
- Časné vyhledávání kriticky nemocných pomocí Medical Emergency System ve Fakultní nemocnici u svaté Anny v Brně
- Měření transalveolárního tlaku pomocí plícnicového katétru
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




