-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prof. Ryšavá: Náhodný nález při předoperačním vyšetření
14. 9. 2020
Pacient: pan Josef, řidič kamiónu, 39 let.
U praktické lékařky
39letý pacient s diabetem 2. typu se dostavil ke své praktické lékařce pro výpis z dokumentace před plánovanou operací pilonidálního sinu. Sám si na nic nestěžoval, ale až na cílené dotazy připouštěl zhoršující se dušnost a nevýkonnost. Na dotaz na užívané léky sdělil, že nepravidelně užívá metformin a ramipril, TK a glykémie si neměří.
Poslední preventivní prohlídku absolvoval před 2 roky v souvislosti se změnou zaměstnavatele. Tehdy byla doporučena rozsáhlejší medikace – vzhledem k vysokému KV riziku (SCORE tehdy 6 %) byl doporučen i statin, který však pacient odmítl užívat. Nerealizoval ani dříve doporučená vyšetření (TK Holter, oční pozadí a další).
Vitální funkce a ostatní nálezy u PL:
- GCS 4-5-6
- TK 169/101 mmHg
- TF 72/min
- SpO2 pulzním oxymetrem 94 %
- glykémie glukometrem 11,7 mmol/l
- 192 cm/133 kg
EKG: sinusový rytmus 72/min, QRS 0,10, PQ 0,14, QTc 0,48, redukované r V1–V3, elevace ST V1–V3, negat. T V4–V6, aplanace T I, aVL. Obraz rozvinutého IM anteroseptálně.
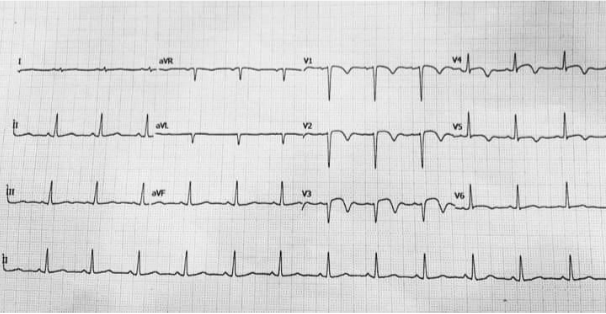
Na základě tohoto nálezu praktická lékařka podala kyselinu acetylsalicylovou (ASA: 500 mg p.o.), nitroglycerin 1 tbl. sublingválně a metoprolol tartrát 25 mg p.o., následně volala ZZS a nemocný byl transportován v doprovodu lékaře RLP do spádového kardiocentra. Ve voze ZZS byla po dohodě s lékařem kardiocentra podána nasycovací dávka tikagreloru (180 mg p.o.), heparin 5000 IU i.v., fentanyl 2 ml, těsně před příjezdem vzhledem k výrazné anxiozitě midazolam 1 mg i.v.
V kardiocentru
Vstupní vitální funkce a základní laboratorní parametry:
- GCS 4-5-6
- TK 152/100 mmHg
- TF 56/min
- SpO2 96 % na O2 maskou flow 2 l/min
- glykémie glukometrem 13,2 mmol/l
- hs-troponin I 72 291 ng/l
- kreatinin 110 mmol/l
- LDL cholesterol 4,2 mmol/l
Nemocný byl přijat s diagnózou primomanifestace ICHS formou STEMI s přechodem do Q infarktu anterosepta. Byl léčen provedením direktní perkutánní koronární intervence uzávěru RIA s implantací lékového stentu, ostatní magistrální tepny byly bez významných stenóz. Ejekční frakce levé komory byla echokardiografickým vyšetřením stanovena na 40–45 %, byla tedy přítomná střední deprese systolické funkce LK.
Vzhledem k dekompenzaci DM 2. typu za hospitalizace bylo doporučeno diabetologické vyšetření ambulantně, hyperglykémie byly řešeny podáváním krátkodobého inzulinu. Glykovaný hemoglobin vyšetřen nebyl, ve vyšetření moči a sedimentu dominovala proteinurie 1+, která nebyla dále kvantifikována.
Z kardiocentra byl pacient propuštěn s nově nastavenou medikací: tikagrelor 2× 90 mg, ASA 1× 100 mg, atorvastatin 1× 80 mg, ramipril 1× 10 mg, metoprolol ZOK 1× 100 mg, metformin 2× 1000 mg.
U ambulantního internisty
Po propuštění byl nemocný předán do péče spádového internisty, kam se dostavil ke kontrole. Sám si stěžoval pouze na úporné průjmy a dyskomfort v epigastriu, který řešil samoléčbou pantoprazolem z tchánových zásob – s částečným efektem. Negoval dušnost, stenokardie nebo synkopy, referoval zlepšení dechových obtíží po dimisi.
Laboratorní nález byl bez větších odchylek oproti nálezu při hospitalizaci, některá vyšetření však byla doplněna:
- HbA1c 76 mmol/mol
- ranní lačná glykémie 8,9 mmol/l
- kreatinin 108 mmol/l
- odhadovaná glomerulární filtrace (eGFR) dle vzorce CKD-EPI 1,22 ml/s (73 ml/min)
- albuminurie 124 mg/l
- proteinurie 248 mg/l, tj. 0,9 g/d
- TSH v normě
- fekální kalprotektin < 50 μg/g stolice
#30 #31 Další osud a prognóza
Nemocný zůstal ve sledování interní ambulance, k metforminu 500 mg/d mu byl nasazen dapagliflozin 10 mg/d. Byl vybaven glukometrem a pravidelně absolvoval všechna periodická vyšetření.
Po úpravě medikace se podstatně zmírnily jako zažívací obtíže, horní dyspeptický syndrom vymizel po nasazení pantoprazolu v režimu on-demand. Gastroskopické vyšetření včetně enterobiopsie neprokázalo zásadní patologii (kromě dráždivého žaludku). Byla provedena kolonoskopie bez patologického nálezu, přechodně byla s dobrým efektem doporučena dieta s omezením FODMAPs. Posléze toleroval i navýšení metforminu XR na 1000 mg/d. Pozitivně se projevila změna zaměstnání, nemocný přešel z kamionové dopravy na pozici řidiče linkového autobusu a začal se pravidelně stravovat doma.
Po 3 letech od příhody byl hospitalizován na spádovém interním oddělení pro atypické bolesti na hrudi, tehdy byla provedena CT koronarografie bez nálezu nových stenóz koronárního řečiště. Laboratorní nálezy (viz níže) jsou stabilizované a DM uspokojivě kompenzovaný.
Medikace po 3 letech: ASA 1× 100 mg, atorvastatin 1× 40 mg, ezetimib 1× 10 mg, perindopril/bisoprolol 1× 5/5 mg, metformin XR 1× 1000 mg, dapagliflozin 1× 10 mg, pantoprazol 20 mg při potřebě, cholekalciferol 2000 IU denně.
Laboratorní a další nálezy po 3 letech:
- 125 kg/193 cm
- TK 138/80 mmHg
- HbA1c 53 mmol/mol
- ranní lačná glykémie 5,6 mmol/l
- kreatinin 101 mmol/l
- eGFR dle vzorce CKD-EPI 1,25 ml/s (75 ml/min)
- albuminurie 60 mg/l
- proteinurie 130 mg/l, tj. 0,52 g/d
- LDL-c 1,8 mmol/l
Závěr
U nemocného se podařilo dosáhnout dobré kompenzace diabetu a projevil se i příznivý kardiovaskulární a renální efekt dapagliflozinu, který byl potvrzen ve velké kardiovaskulární studii DECLARE-TIMI.
Ve srovnání s jinými obory, jako jsou onkologie nebo kardiovaskulární medicína, kde guidelines často zastarávají hned po vytištění, je vývoj v nefrologii méně dramatický. Jedním z důvodů je, že řada nemocí ledvin patří mezi vzácné choroby a tvrdé „endpointy“ jako např. selhání ledvin a nutnost zahájení dialýzy se objevují až po mnoha letech.
Jedním z nejdůležitějších objevů posledních let v nefrologii jsou bezpochyby inhibitory SGLT2. Renální výsledky kardiovaskulární studie (CVOT) DECLARE-TIMI-58 s dapagliflozinem jsou v souladu s dalšími dvěma glifloziny. V prvních letech užívání gliflozinů byla renální insuficience považována za kontraindikaci pro inhibitory SGLT2 (u nižší GFR lze očekávat nižší glukosurický účinek), v současnosti se však diabetická nefropatie vyvíjí v jednu z hlavních indikací pro inhibitory SGLT2, protože jejich nefroprotektivní efekt je nezávislý na účinku snižování hladiny cukru v krvi.
Nefrologové ve velmi krátké době očekávají zveřejnění dalších studií (DAPA-CKD, EMPA-KIDNEY) s glifloziny u nemocných s renální insuficiencí, a to u pacientů jak s diabetem, tak i bez něj.
Autor:
prof. MUDr. Romana Ryšavá, CSc.
CZ-1676
Zkrácená informace o léčivém přípravku FORXIGA® 5 mg potahované tablety
FORXIGA® 10 mg potahované tablety
Kvalitativní a kvantitativní složení:
Dapagliflozinum propandiolum monohydricum odpovídající dapagliflozinum 5 mg v 1 potahované tabletě. Jedna 5 mg tableta obsahuje 25 mg laktosy.
Dapagliflozinum propandiolum monohydricum odpovídající dapagliflozinum 10 mg v 1 potahované tabletě. Jedna 10 mg tableta obsahuje 50 mg laktosy.
Terapeutické indikace: Diabetes mellitus 2. typu (DM2) - jako přídavná léčba k dietě a fyzické aktivitě ke zlepšení kontroly glykemie - jako monoterapie, pokud je podávání metforminu nevhodné v důsledku intolerance; - jako přídavná léčba k jiným léčivým přípravkům k léčbě DM2. Výsledky studií ve vztahu ke kombinované léčbě s jinými léčivými přípravky, vlivy na kontrolu glykemie a kardiovaskulární příhody a studované populace, viz SPC. Diabetes mellitus 1. typu (DM1) – pouze Forxiga 5 mg - jako přídavná léčba k inzulinu u pacientů s BMI ≥ 27 kg/m2, pokud podávání samotného inzulinu při optimalizaci léčby nevede k adekvátní kontrole glykemie.
Dávkování a způsob podání: DM2 -10 mg dapagliflozinu jednou denně Pokud je dapagliflozin podáván v kombinaci s inzulinem nebo inzulinovými sekretagogy, lze uvažovat o jejich snížené dávce, aby se snížilo riziko hypoglykemie. DM1 – 5 mg jednou denně, pouze jako přídavná léčba k inzulinu. Léčba má být zahajována a kontrolována specialisty na léčbu diabetu 1. typu. Přípravek se podává perorálně, jednou denně, kdykoli v průběhu dne, s jídlem nebo mimo jídlo. Tablety se polykají celé.
Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku.
Zvláštní upozornění a opatření pro použití: Léčba nemá být zahájena u pacientů s GFR < 60 ml/min a má být ukončena, pokud je hodnota GFR trvale nižší než 45 ml/min. U pacientů s těžkou poruchou funkce jater je zvýšená expozice dapagliflozinu. V důsledku mechanismu účinku zvyšuje dapagliflozin diurézu, která může vést k mírnému snížení krevního tlaku. Opatrnosti je zapotřebí u pacientů, u kterých může pokles krevního tlaku vyvolaný dapagliflozinem představovat riziko. DM2 - U pacientů léčených inhibitory společného transportéru pro sodík a glukosu (SGLT2i), byly vzácně hlášeny případy diabetické ketoacidózy (DKA), u rizikových pacientů je nutno užívat SGLT2i opatrně. DM1 - V klinických studiích s dapagliflozinem měli pacienti s DM1 vyšší výskyt příhod DKA než ve skupině s placebem. Před zahájením léčby mají být pacienti vyšetřeni s ohledem na riziko DKA. Více informací viz SPC. Pokud se vyskytnou známky nebo symptomy ketoacidózy, mají být pacienti poučeni, aby si změřili hladiny ketonů. Léčba má být přerušena u pacientů, kteří jsou hospitalizováni z důvodu velkých chirurgických výkonů nebo vážného akutního onemocnění a je doporučeno u nich monitorovat ketony (přednostně z krve). U pacientů užívajících SGLT2i, včetně dapagliflozinu, byly velmi vzácně hlášeny případy Fournierovy gangrény. Vylučování glukosy močí může být spojeno se zvýšeným rizikem infekcí močových cest. Ve studiích s jiným SGLT2i byl pozorován zvýšený výskyt amputací na dolních končetinách a není známo, zda jde o skupinový účinek. Je důležité poučit pacienty o pravidelné preventivní péči o nohy.
Interakce s jinými léčivými přípravky a jiné formy interakce: Dapagliflozin může zvyšovat diuretický účinek thiazidů a kličkových diuretik a může zvyšovat riziko dehydratace a hypotenze. U pacientů s DM1 a známým rizikem časté nebo závažné hypoglykemie, může být nezbytné snížit dávku inzulinu v době zahájení léčby dapagliflozinem, aby se snížilo riziko hypoglykemie. Nedoporučuje se monitorovat glykemii metodou stanovení 1,5-AG, neboť měření není u pacientů užívajících SGLT2i spolehlivé.
Těhotenství a kojení: Nejsou dostupné údaje o použití dapagliflozinu u těhotných žen. Jakmile je zjištěno těhotenství, musí se léčba dapagliflozinem přerušit. Není známo, zda se dapagliflozin a/nebo jeho metabolity vylučují do lidského mateřského mléka.
Účinky na schopnost řídit a obsluhovat stroje: Přípravek Forxiga nemá žádný vliv nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Pacienti mají být upozorněni na riziko hypoglykemie, pokud je dapagliflozin podáván souběžně s deriváty sulfonylmočoviny nebo s inzulinem.
Nežádoucí účinky: DM2 - Nejčastěji hlášeným nežádoucím účinkem byla hypoglykemie. Často hlášenými nežádoucími účinky byly dále infekce pohlavních orgánů (vulvovaginitida, balanitida) a močových cest, závrať, dysurie, polyurie, bolest zad, zvýšený hematokrit, snížená renální clearance kreatininu během zahájení léčby, dyslipidémie a vyrážka. U pacientů nad 65 let bylo hlášeno více nežádoucích účinků, vztahujících se k poruše funkce ledvin nebo selhání ledvin anebo k objemové depleci, ve srovnání s placebem. Frekvence výskytu Fournierovy gangrény není známa. Bezpečnostní profil dapagliflozinu u subjektů s DM1 byl podobný profilu bezpečnosti dapagliflozinu u subjektů s DM2, s výjimkou vyššího výskytu příhod DKA ve studiích s DM1. Dapagliflozin 10 mg se nemá používat k léčbě pacientů s DM1.
Zvláštní opatření pro uchovávání: Nevyžaduje se.
Druh obalu a velikost balení: Al/Al blistr, 30x1 a 90x1 potahovaná tableta v perforovaných jednodávkových blistrech.
Držitel rozhodnutí o registraci: AstraZeneca AB, SE-151 85 Södertälje, Švédsko
Registrační čísla: EU/1/12/795/004-005, EU/1/12/795/009-010
Datum revize textu: 19. 11. 2019
© AstraZeneca 2019
Registrovaná ochranná známka FORXIGA je majetkem AstraZeneca plc.
Referenční číslo dokumentu: 19112019API
Přípravek Forxiga 5 mg není v ČR hrazen z prostředků veřejného zdravotního pojištění. Přípravek Forxiga 10 mg je v ČR částečně hrazen z prostředků veřejného zdravotního pojištění. Přečtěte si pozorně úplnou informaci o přípravku, kterou naleznete na webových stránkách Evropské agentury pro léčivé přípravky (EMA) http://ema.europa.eu nebo na adrese zástupce držitele rozhodnutí o registraci v ČR: AstraZeneca Czech Republic s. r. o., U Trezorky 921/2, 158 00 Praha 5 - Jinonice, tel.: +420 222 807 111, http://www.astrazeneca.czZkrácená informace o léčivém přípravku XIGDUO® 5 mg/850 mg potahované tablety
XIGDUO®5 mg/1 000 mg potahované tablety
Kvalitativní a kvantitativní složení: Dapagliflozinum 5 mg a metformini hydrochloridum 850 mg nebo 1000 mg v potahované tabletě.
Terapeutické indikace: Přípravek Xigduo je indikován k léčbě diabetu 2. typu (DM2) jako doplněk k dietním a režimovým opatřením u pacientů, u kterých není glykemie dostatečně upravena maximální tolerovanou dávkou samotného metforminu, v kombinaci s dalšími léčivými přípravky, k léčbě diabetu u pacientů, u kterých není glykemie dostatečně upravena metforminem a těmito léčivými přípravky, u pacientů, kteří jsou již léčeni kombinací dapagliflozin a metformin v jednotlivých tabletách. Výsledky studií ve vztahu ke kombinované léčbě s jinými léčivými přípravky, vlivy na kontrolu glykemie a kardiovaskulární příhody a studované populace viz. SPC.
Dávkování a způsob podání: Dospělí s normální funkcí ledvin (GFR ≥ 90 ml/min): jedna tableta dvakrát denně. U pacientů převedených ze samostatných tablet s dapagliflozinem a metforminem má být celková denní dávka dapagliflozinu 10 mg a dávka metforminu stejná nebo co nejvíce podobná, jako dávka dosud užívaná. GFR má být vyšetřena před zahájením léčby přípravky s obsahem metforminu. Dávkování u pacientů s poruchou funkce ledvin: - Maximální denní dávka metforminu je 3000 mg a má být rozdělena do 2-3 denních dávek. Maximální denní dávka dapagliflozinu je 10 mg. Léčba nemá být zahájena u pacientů s GFR < 60 ml/min a má být ukončena, pokud je hodnota GFR trvale nižší než 45 ml/min. Maximální dávka dapagliflozinu při GFR 45-59 ml/min je 10 mg, maximální denní dávka metforminu je 2000 mg. Zvláště u starších pacientů je nezbytné monitorovat funkci ledvin jako preventivní opatření metforminem navozené laktátové acidózy. Přípravek Xigduo se nesmí podávat pacientům s poruchou funkce jater. Přípravek Xigduo se podává dvakrát denně v průběhu jídla.
Kontraindikace: Přípravek Xigduo je kontraindikován u pacientů s hypersenzitivitou na léčivé látky nebo na kteroukoli pomocnou látku tohoto přípravku; s jakýmkoliv typem akutní metabolické acidózy (laktátová, diabetická ketoacidóza); diabetickým předkomatózním stavem; závažným renálním selháním (GFR < 30ml/min); akutními stavy, které potenciálně predisponují k alteraci funkce ledvin (dehydratace, závažná infekce, šok); akutním nebo chronickým onemocněním, které může vyvolat tkáňovou hypoxii; poruchou funkce jater; akutní intoxikací alkoholem, alkoholismem.
Zvláštní upozornění a opatření pro použití: Laktátová acidóza je velmi vzácná, ale závažná metabolická komplikace v důsledku kumulace metforminu, složky Xigduo. Doporučuje se monitorovat funkce ledvin před zahájením léčby a náskledně v pravidelných intervalech. V důsledku mechanismu účinku zvyšuje dapagliflozin diurézu, která může vést k mírnému snížení krevního tlaku. Opatrnosti je zapotřebí u pacientů, u kterých může pokles krevního tlaku vyvolaný dapagliflozinem představovat riziko. U pacientů léčených inhibitory společného transportéru pro sodík a glukosu (SGLT2i), byly vzácně hlášeny případy diabetické ketoacidózy (DKA), u rizikových pacientů je nutno užívat SGLT2i opatrně. Před zahájením léčby mají být pacienti vyšetřeni s ohledem na riziko DKA. Více informací viz SPC. Pokud se vyskytnou známky nebo symptomy ketoacidózy, mají být pacienti poučeni, aby si změřili hladiny ketonů. Léčba má být přerušena u pacientů, kteří jsou hospitalizováni z důvodu velkých chirurgických výkonů nebo vážného akutního onemocnění a je doporučeno u nich monitorovat ketony (přednostně z krve). U pacientů užívajících SGLT2i, včetně dapagliflozinu, byly velmi vzácně hlášeny případy Fournierovy gangrény. Vylučování glukosy močí může být spojeno se zvýšeným rizikem infekcí močových cest. Ve studiích s jiným SGLT2i byl pozorován zvýšený výskyt amputací na dolních končetinách a není známo, zda jde o skupinový účinek. Je důležité poučit pacienty o pravidelné preventivní péči o nohy. Metformin má být vysazen před nebo v době provedení operace či zobrazovacího vyšetření a jeho podávání nesmí být znovu zahájeno nejméně 48 hodin po provedení vyšetření a za předpokladu, že byla znovu vyhodnocena renální funkce a bylo zjištěno, že je stabilní.
Interakce s jinými léčivými přípravky a jiné formy interakce: Souběžné opakované podávání dávek dapagliflozinu a metforminu zdravým dobrovolníkům nemění zásadně farmakokinetiku dapagliflozinu nebo metforminu. Dapagliflozin - může zvyšovat diuretický účinek thiazidů a kličkových diuretik a může zvyšovat riziko dehydratace a hypotenze. Pokud je dapagliflozin podáván v kombinaci s inzulinem nebo inzulinovými sekretagogy, je vhodné zvážit snížení dávky těchto přípravků, aby se snížilo riziko hypoglykemie. Metformin - konzumace alkoholu a přípravků s alkoholem se má vyloučit. Doporučuje se pečlivé monitorování glykemické kontroly, pokud se souběžně podávají kationtové léčivé přípravky, které se eliminují renální tubulární sekrecí. Je třeba provádět častější kontroly krevní glukózy při léčbě glukokortikoidy, diuretiky a beta-2-agonisty.
Těhotenství a kojení: Xigduo se nedoporučuje podávat v průběhu těhotenství ani kojení.
Účinky na schopnost řídit a obsluhovat stroje: Pacienti mají být upozorněni na riziko hypoglykemie, pokud je dapagliflozin podáván souběžně s přípravky, které způsobují hypoglykemii.
Nežádoucí účinky: S přípravkem Xigduo nebyly provedeny žádné terapeutické klinické studie, ale byla prokázána bioekvivalence přípravku Xigduo s dapagliflozinem a metforminem podávanými současně. Nejčastěji hlášeným nežádoucím účinkem byla hypoglykemie, zejména přikombinované léčbě se sulfonylmočovinou či přidáním k inzulinu, dále gastrointestinální symptomy. Často hlášenými nežádoucími účinky byly dále infekce pohlavních orgánů (vulvovaginitida, balanitida) a močových cest, poruchy chuti, závrať, dysurie, polyurie, , bolest zad, zvýšený hematokrit, snížená renální clearance kreatininu během zahájení léčby, dyslipidémie a vyrážka.
Zvláštní opatření pro uchovávání: Nevyžaduje se.
Druh obalu a velikost balení: PVC/Aclar/Al blistr. 60, resp. 196 potahovaných tablet v neperforovaných blistrech.
Držitel rozhodnutí o registraci: AstraZeneca AB, SE-151 85 Södertälje, Švédsko
Registrační čísla: EU/1/13/900/004, EU/1/13/900/010, EU/1/13/900/012
Datum revize textu: 19. 11. 2019
© AstraZeneca 2019
Registrovaná ochranná známka XIGDUO je majetkem AstraZeneca plc.
Referenční číslo dokumentu: 19112019API
Přípravek Xigduo je v ČR částečně hrazen z prostředků veřejného zdravotního pojištění.
Přečtěte si pozorně úplnou informaci o přípravku, kterou naleznete na webových stránkách Evropské agentury pro léčivé přípravky (EMA) http://ema.europa.eu nebo na adrese zástupce držitele rozhodnutí o registraci v ČR: AstraZeneca Czech Republic s. r. o., U Trezorky 921/2, 158 00 Praha 5 - Jinonice, tel.: +420 222 807 111, www.astrazeneca.czSPC produktu Xigduo (PDF)
SPC produktu Forxiga (PDF)
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Interní lékařství Kardiologie Diabetologie
Nejčtenější tento týden- Proč endometrióza vyžaduje principy precizní medicíny
- INFOGRAFIKA: Světový den boje proti rakovině... aneb jaké výzvy stojí před českou onkologií?
- Precizní psychiatrie má svou cestovní mapu
- AI pomůže personalizovat léčbu fibrilace síní
- „Jednohubky“ z klinického výzkumu – 2026/4
Mohlo by vás zajímat- Clopidogrel je v prevenci kardiovaskulárních příhod přínosnější než kyselina acetylsalicylová
- Rosuvastatin prokázal větší snížení LDL-cholesterolu než ostatní statiny
- Dvojitá léčba aspirinem a klopidogrelem v prevenci cévních mozkových příhod
- Účinky atorvastatinu na renální parametry a kardiovaskulární onemocnění u pacientů s diabetem mellitem
- Rosuvastatin optimalizuje poměr mezi přínosy a riziky terapie určené ke snížení LDL-cholesterolu
- Atorvastatin rychle snižuje riziko kardiovaskulárních příhod u diabetiků
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




