Analýza vztahu volných lehkých řetězců κ/λ a páru těžkých/lehkých řetězců imunoglobulinu ke stratifikaci mnohočetného myelomu podle Mayo Stratification of Myeloma and Revised International Staging System
Analysis of serum free light chains κ/λ ratio and heavy/light chain pairs of immunoglobulin to the stratification of multiple myeloma according to Mayo Stratification of Myeloma and Revised International Staging System
Introduction:
Assessment of serum levels of free light chains (FLC-κ and FLC-λ) and recently heavy/light chain pairs of immunoglobulin (HLC-κ and HLC-λ) and their ratio (FLC-r and HLC-r) has significantly enriched traditional algorithm of multiple myeloma (MM) evaluation. The aim of the presented study was to assess the relationship of classical prognostic parameters of MM, standard FLC-κ/λ and HLC-κ/λ ratio (sFLC-r and sHLC-r), modified ratio of „involved/uninvolved“ FLC and HLC (mFLC-r and mHLC-r ), the difference between „involved – uninvolved“ FLC and HLC (FLC-dif. and HLC-dif.) to current stratification models of MM based on the result of cytogenetic analysis.
Patients and methods:
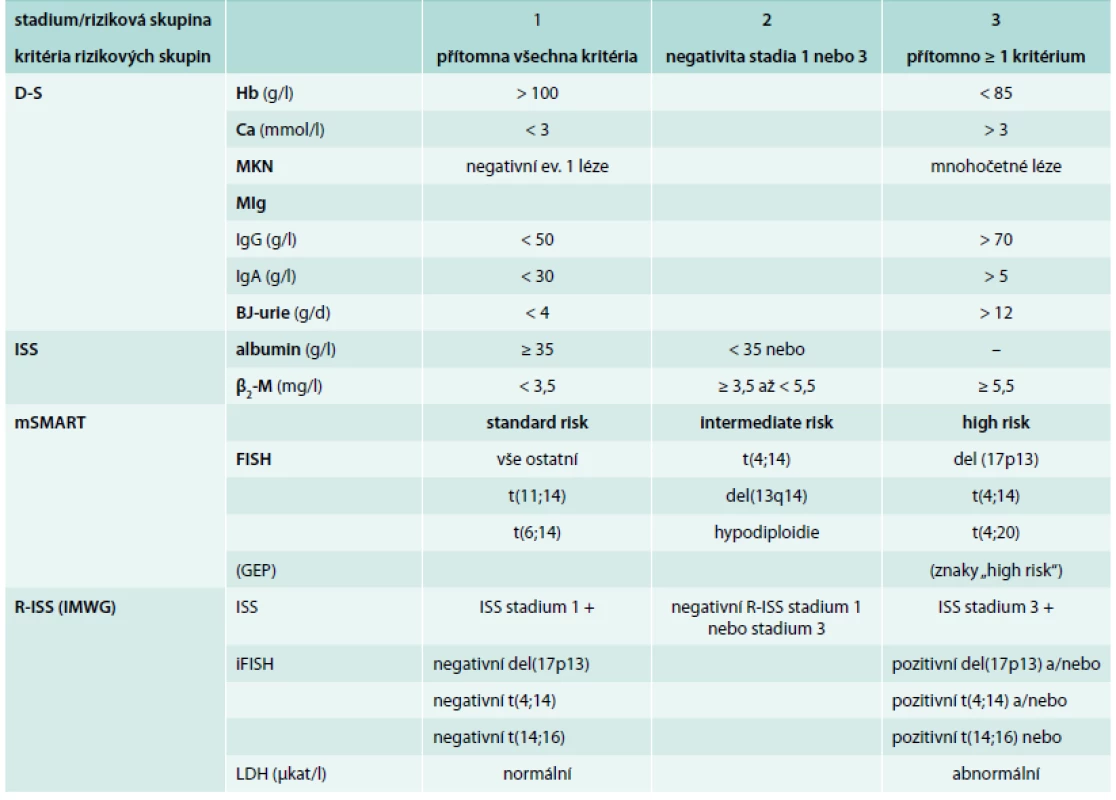
In a group of 97 patients with MM we assessed serum levels of FLC by FreeliteTM method, and we calculated sFLC-r, mFLC-r and FLC-dif. indices by HevyliteTM method. For cytogenetic analysis we used FICTION (fluorescence immunophenotyping and interphase cytogenetics as a tool for the investigation of neoplasms). For MM stratification we used standard staging systems according to Durie-Salmon (D-S) and International Staging System (ISS) as well as novel stratification systems based on the results of cytogenetic analysis, ie. „Mayo Stratification of Myeloma and Risk-Adapted Therapy“ (mSMART) and „Revised International Staging System“ (R-ISS).
Results:
Stratification mSMART and R-ISS has significantly different representation of „standard“ or „low-risk“ (71, 15.5, 11.3 a 29.9 %), „intermediate risk“ (15.5, 53.6, 34 a 33 %) and „high risk“ patients (13.4, 30.9, 54.7 a 37.1 %) compared to standard staging systems. mSMART stratification was compared to prognostic factors of MM (Hb, albumin, β2-M, creatinine and LDH), and the only significant relationship was found in the case of β2-M, R-ISS had relationship only to Hb and creatinine. In the case of D-S staging we found significant relationship of stages 1–3 and substages A and B to the levels of mFLC-r, FLC-dif. and mHLC-r, ISS had moreover relationship to k HLC-dif. and MIg concentration. Analysis of mSMART stratification showed primarily significant relationship of risk categories 1–3 to mFLC-r and sHLC-r indices, and R-ISS to mHLC-r index and MIg concentration. In both cytogenetics-based stratifications there was a lack of relationship to sFLC-r, FLC-dif. and HLC-dif. indices.
Conclusion:
Comparison of the results of standard staging systems according to D-S and ISS with cytogenetics based models mSMART and R-ISS showed different representation of risk groups, and significantly different relationship to classical prognostic factors together with original relationship of sMART stratification to mFLC-r and sHLC-r, and R-ISS to mHLC-r and MIg concentration.
Key words:
cytogenetic analysis – free light chains ratio – heavy/light chain pairs of immunoglobulin ratio – multiple myeloma – prognostic factors – stratification of multiple myeloma
Autoři:
Vlastimil Ščudla 1,2; Jana Balcárková 2; Pavel Lochman 3; Miroslava Vincová 2; Tomáš Pika 2; Jiří Minařík 2; Jana Zapletalová 4; Marie Jarošová 2
Působiště autorů:
III. interní klinika nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
1; Hemato-onkologická klinika LF UP a FN Olomouc
2; oddělení klinické biochemie FN Olomouc
3; Ústav lékařské biofyziky LF UP Olomouc
4
Vyšlo v časopise:
Vnitř Lék 2016; 62(4): 269-280
Kategorie:
Původní práce
Souhrn
Úvod:
Vyšetření hladin volných lehkých řetězců (FLC-κ a FLC-λ) a nověji páru těžkých/lehkých řetězců imunoglobulinu (HLC-κ a HLC-λ) a jejich poměru (FLC-r a HLC-r) podstatně rozšířilo tradiční algoritmus vyšetření u mnohočetného myelomu (MM). Cílem studie bylo zhodnocení vztahu klasických prognostických ukazatelů MM, standardního poměru FLC-κ/λ a HLC-κ/λ (sFLC-r a sHLC-r), modifikovaného poměru, tj. „involved/uninvolved“ FLC a HLC (mFLC-r a mHLC-r ), rozdílu „involved – uninvolved“ FLC a HLC (FLC-dif. a HLC-dif.) k výsledkům stratifikačních modelů MM založených na výsledku cytogenetického vyšetření.
Soubor a metody:
V souboru 97 nemocných s MM byly metodou FreeliteTM vyšetřeny hladiny FLC a vypočteny indexy sFLC-r, mFLC-r a FLC-dif, metodou HevyliteTM stanoveny hladiny HLC a vypočteny indexy sHLC-r, mHLC-r a HLC-dif. K cytogenetické analýze byla použita metoda fluorescenční in situ hybridizace FISH s imunofluorescenčním značením plazmocytů (FICTION, tj. Fluorescence Immunophenotyping and Interphase Cytogenetics as a Tool for the Investigation of Neoplasms), k stratifikaci MM jednak standardní stážovací systémy dle Durieho-Salmona (D-S) a International Staging System (ISS), jednak stratifikační modely založené na výsledcích cytogenetické analýzy, tj. „Mayo Stratification of Myeloma and Risk-Adapted Therapy“ (mSMART) a „Revised International Staging System“ (R-ISS).
Výsledky:
Stratifikace dle mSMART a R-ISS se vyznačuje ve srovnání se standardními stážovacími systémy dle D-S a ISS výrazně odlišným zastoupením nemocných „standard event. low risk“ (71, 15,5, 11,3 a 29,9 %), „intermediate risk“ (15,5, 53,6, 34 a 33 %) a „high risk“ (13,4, 30,9, 54,7 a 37,1 %). Stratifikace dle mSMART prokázala při rozboru vztahu k prognostickým faktorům MM (Hb, albumin, β2-M, kreatinin a LDH) významný vztah pouze k β2-M, R-ISS pouze k Hb a kreatininu. V případě stážování dle D-S byl prokázán významný vztah stadií 1–3 a podstadií A a B k hodnotám mFLC-r, FLC-dif. a mHLC-r, u ISS navíc i k HLC-dif. a koncentraci MIg. Při analýze výsledků stratifikace mSMART byl prioritně popsán významný vztah rizikových kategorií 1–3 k hodnotám indexů mFLC-r a sHLC-r a v případě R-ISS k indexu mHLC-r a koncentraci MIg. V obou cytogeneticky založených stratifikačních modelech byla zjištěna absence vztahu k indexům sFLC-r, FLC-dif. a HLC-dif.
Závěr:
Srovnání výsledků standardních stážovacích systémů dle D-S a ISS s cytogeneticky založenými modely mSMART a R-ISS prokázalo rozdílné zastoupení rizikových skupin, významně odlišný vztah ke klasickým prognostickým ukazatelům a originálně zjištěný vztah stratifikace mSMART k mFLC-r a sHLC-r a R-ISS k mHLC-r a koncentraci MIg.
Klíčová slova:
cytogenetická analýza – mnohočetný myelom – poměr páru těžkých/lehkých řetězců imunoglobulinu – poměr volných lehkých řetězců imunoglobulinu – prognostické faktory – stratifikace mnohočetného myelomu
Úvod
Mnohočetný myelom (MM), toto geneticky vysoce heterogenní onemocnění způsobené nekontrolovanou proliferací a akumulací neoplastických elementů plazmocelulární linie, je souborem genotypicky a klinicky různorodých forem onemocnění vyznačujících se širokým spektrem cytogenetických změn zastávajících určující roli v patobiologii, klinickém obraze, léčebné odezvě a prognóze nemoci [1–5]. Bezmála dvojnásobné prodloužení délky života v poslední dekádě je výsledkem významného posunu znalostí patogeneze nemoci a zavedení stále sofistikovanějších vyšetřovacích, stratifikačních a léčebných metod. Značná genetická různorodost MM vyznačující se vedle zmnožení chromozomů (hyperploidie) především přítomností prognosticky nepříznivých strukturálních aberací charakteru t(11;14)(q13;q32), t(4;14)(p16;q32), t(14;16)(q32;23), t(14;20)(q32;q12) a změnami typu del(13q14), del(17p13) a zmnožení oblasti 1q21 (nonhyperploidie) se projevuje snížením a zkrácením léčebné odezvy i celkového přežívání (OS) [2,3,6–11]. Vzhledem k tomu, že předchozí stážovací systémy dle Durieho-Salmona (D-S) a International Staging System (ISS) [9–11] nenalezly přes svůj nesporný prognostický význam reálné uplatnění při výběru optimální, individuálně uzpůsobené léčby [12], byly sestaveny nové stratifikační modely, založené na výsledcích cytogenetické analýzy FISH (fluorescenční in situ hybridizace), a to jako obohacení kritérií ISS [13–16], β2-M [17] a R-ISS (Revised International Staging System), nebo čistě „cytogenetického modelu mSMART“ (Mayo Stratification of Myeloma and Risk-Adapted Therapy) [12,18,19].
Standardní techniky vyšetření bílkovinného spektra používané v diagnostice, sledování průběhu a hodnocení léčebné odezvy MM, tj. gelová (SPE) a imunofixační (IFE) elektroforéza, vyšetření normálních imunoglobulinů (Ig) s pomocí nefelometrie, stanovení hladin volných lehkých řetězců imunoglobulinu FLC-κ a FLC-λ, jejich poměru (FLC-r) a nově i FLC-diference (FLC-dif.) metodou FreeliteTM, byly aktuálně rozšířeny o separátní kvantitativní vyšetření hladin párů těžkých/lehkých řetězců Ig HLC-κ a HLC-λ včetně jejich poměru, tj. „involved/uninvolved“ HLC (HLC-r) a HLC-diference (HLC-dif.) metodou HevyliteTM [20–26]. Na rozdíl od zavedeného indexu FLC-r se klinické uplatnění indexu HLC-r teprve upřesňuje a hledají se další potenciální indikace vedle prokázaného přínosu v diagnostice a monitoraci IgA a hyposekrečního typu MM, v predikci maligní transformace monoklonální gamapatie nejistého významu (MGUS), hodnocení hloubky léčebné odezvy, časné detekce nastupující progrese/relapsu nemoci a prognostické stratifikaci MM [20,24,27–29].
Vzhledem k tomu, že do nynějška neproběhla ucelená studie, jež by se věnovala rozboru vztahu stratifikačních modelů založených na výsledcích metody FISH k výsledkům FreeliteTM a HevyliteTM analýzy, zaměřila se předložená studie na rozbor vztahu výsledků mSMART a R-ISS stratifikace k indexům vyjadřujícím poměr sekrece monoklonálních (MIg) vs polyklonálních imunoglobulinů (PIg) myelomovými a normálními plazmocyty, tj. k indexům FLC-r a HLC-r. Východiskem studie byla snaha o ověření hypotézy, že hodnoty indexů FLC-r a HLC-r jako nepřímé ukazatele vnitřních biologických vlastností myelomové tkáně by měly souviset s charakterem nalezených chromozomových změn. Důvodem studie byl i předpoklad, že nabyté poznatky přispějí k rozšíření mozaiky dosavadních znalostí patobiologie MM a případně naleznou uplatnění i v klinické praxi.
Soubor nemocných a metody
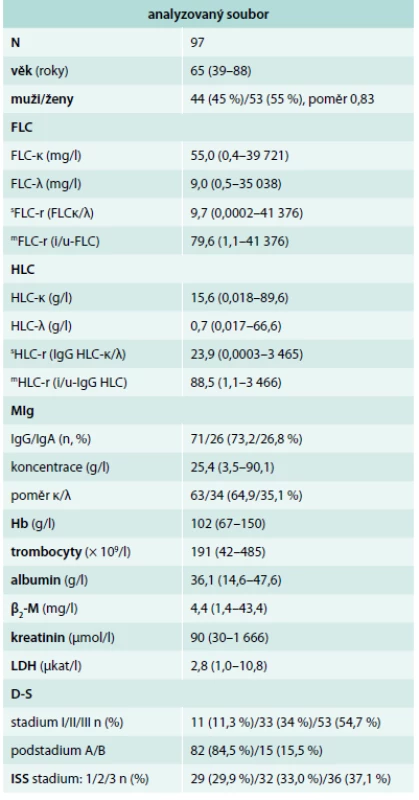
Studie vychází z analýzy 97členného souboru s IgG (73,2 %) a IgA typem MM (26,8 %) vyšetřeného při diagnóze nemoci, splňujícího diagnostická kritéria International Myeloma Working Group (IMWG), tab. 1 [9,10]. Cytogenetická analýza byla provedena pomocí metody fluorescenční in situ hybridizace (FISH) s imunofluorescenčním značením plazmatických buněk (FICTION, tj. Fluorescence Immunophenotyping and Interphase Cytogenetics as a Tool for the Investigation of Neoplasms). Buněčná suspenze kostní dřeně zpracovaná pro klasické cytogenetické vyšetření z 24hodinové kultivace bez stimulace a fixována v metanol : octové kyselině (3 : 1), je převedena do fixace s 96% etanolem. Etanolem fixovaná suspenze byla nakapána na skla, obarvena s pomocí protilátky proti lehkým řetězcům MIg (anti-human κ nebo λ chain) konjugované s 7-amino-4-metalkumarin-3-octovou kyselinou (AMCA) (Vector Laboratories Burlingame, CA). Fluorescenční signál byl zesílen protilátkou (anti-goat) konjugovanou s AMCA (Vector Laboratories Burlingame, CA) pro snadnější identifikaci populace klonálních plazmatických buněk [30]. Pro metodu FICTION byl použit panel komerčně dodávaných sond pro určení delece a zmnožení v oblasti 1p32/1q21, delece 13q14, delece 17p13 (TP53), přestavby genu IgH (sondy XL IGH Plus, LSI IGH/CCND1 Dual Color Dual fusion, IGH/FGFR3 Dual Color Dual Fusion, LSI IGH/MAF Dual Color Dual Fusion, XL t(6;14), XL t(14;16)IGH/MAF) (Abbott Molecular, Des Plaines, IL, USA; Dako, Glostrup, Denmark; Kreatech, Amsterdam, The Netherlands; MetaSystems, Altlusheim, Germany). K určení nejčastějších početních změn chromozomů byly použity centromerické sondy pro chromozomy 15 a 17. Hybridizace byla provedena podle návodu výrobce sondy. Výsledek hybridizace byl hodnocen pomocí fluorescenčního mikroskopu a programu ISIS (MetaSystems). Hodnoceno bylo 100 plazmatických buněk; hodnota cut-off pro genové sondy byla 10 %, pro centromerické 20 %. K analýze proteinů séra byla použita séra zmražená na -78 °C deponovaná v biobance Oddělení klinické biochemie (OKB) a Hematologicko-onkologické kliniky (HOK) FN Olomouc, koncentrace MIg byla vyšetřena SPE přístrojem Sebia Hydrasy s pomocí skeneru Epson 1680, IFE soupravou Hydragel 4 IF. Hladiny FLC byly vyšetřeny soupravami Freelite SPA Plus κ free (rozmezí 3,3–19,4 mg/l) a Freelite SPA Plus λ free (5,7–26,3 mg/l) s výpočtem indexu FLC-r, tj. poměru FLC-κ/FLC-λ (0,6–1,65) [20,24]. Koncentrace HLC v séru byla vyšetřena turbidimetrem SPA Plus (The Binding Site) soupravami Hevylite Human: IgG-κ (3,84–12,07 g/l), IgG-λ (1,91–6,74 g/l), index IgG HLC-r z poměru IgG-κ /IgG-λ (1,12–3,21); hodnoty IgA-κ (0,57–2,08 g/l), IgA-λ (0,44–2,04 g/l), index IgA HLC-r z poměru IgA-κ/IgA-λ (0,78–1,94) [20,24]. Na rozdíl od standardních kritérií, založených stabilně na výpočtu indexů FLC-r (sFLC-r) a HLC-r (sHLC-r) z poměru FLC-κ/FLC-λ resp. HLC-κ/HLC-λ, vedoucích u nemocných s lehkým řetězcem (LŘ) λ k získání nízkých a prakticky obtížně interpretovatelných hodnot, byl použit pro výpočet „modifikovaných“ indexů FLC-r a HLC-r vždy poměr i-FLC/u-FLC (mFLC-r) a i-HLC/u-HLC (mHLC-r), tj. hodnota „involved“ typu použitá v čitateli zlomku (např. v případě i-HLC-λ poměr i-HLC-λ/u-HLC-κ). Jde o analogii principu, použitého v případě FLC-r v některých předchozích studiích [31–33], zejména ale v recentních revidovaných IMWG diagnostických kritériích MM (biomarker malignity FLC-r = i-FLC/u-FLC ≥ 100) [34]. Hodnoty β2-mikroglobulinu (β2-M) byly vyšetřeny metodou ELISA (< 2,3 mg/l), hodnoty Hb, trombocytů, albuminu, kreatininu a LDH (< 3,55 μkat/l) standardními postupy. K stratifikaci MM byly použity vedle standardních stážovacích systémů dle Durieho-Salmona (D-S) a International Staging System (ISS) [9–11] i recentní stratifikační modely mSMART a R-ISS (tab. 2) [12,19]. Zařazení do studie bylo vázáno na podpis informovaného souhlasu, design studie byl schválen etickou komisí FN Olomouc.
Získaná data byla analyzována pomocí statistického software IBM SPSS Statistics 22, normalita dat byla posouzena s pomocí Shapirova-Wilkova testu. Ke statistické analýze byly použity Pearsonův test, Spearmanova korelační analýza, test dle Kruskala-Wallise, U-test dle Manna-Whitneye, případně Fischerův přesný test s Bonferroniho korekcí signifikance. Všechny testy byly prováděny na hladině významnosti p < 0,05.
Výsledky
Výsledky vyšetření základních klinicko-laboratorních charakteristik v souboru 97 nemocných vyšetřených při diagnóze MM jsou shrnuty v tab. 1. Abnormální karyotyp byl zjištěn v 90,7 %, komplexní změny v 64,9 %, del(13q14) v 50,5 %, přestavby genu IgH (těžký řetězec imunoglobulinu) se vyskytovaly v 36,1 %, z toho t(11;14) v 11,3 %, t(4;14) v 17,5 % a t(14;16) v 3,1 %, aberace typu zmnožení oblasti 1q21 v 46,4 % a del(17p13) (TP53) v 8,2 %.
Výsledky stratifikace
Výsledky stratifikace do 3 klinických stadií (stadium 1–3) s pomocí „referenčních“ standardních stážovacích systémů podle D-S a ISS a 2 analyzovaných stratifikačních modelů mSMART a R-ISS, třídících nemocné podle průkazu prognosticky odlišně závažných chromozomových změn do 3 rizikových skupin, tj. „low, resp. standard risk“ (kategorie 1), „intermediate“ (kategorie 2) a „high risk“ (kategorie 3) jsou shrnuty v tab. 2. V rámci usnadnění komparace všech 4 stratifikačních systémů byla ve mSMART stratifikaci provedena v originálním schématu výměna označení rizikových skupin, tj. nemocní „standard risk“ byli označeni jako kategorie 1 a „high risk“ kategorie 3. S výjimkou ISS bylo zastoupení vyčleněných stadií, resp. rizikových skupin u zbývajících 3 stratifikačních systémů nápadně rozdílné: stážování dle D-S se vyznačovalo bezmála 5krát častějším výskytem stadia 3 (velká nádorová masa) nežli stadia 1 (malá nádorová masa), stratifikace mSMART upřednostňovala značně asymetricky, tj. 4,5krát častěji rizikovou skupinu „standard risk“ (kategorie 1) oproti „intermediate“ (kategorie 2) a > 5krát častěji nežli rizikovou skupinu „high risk“ (kategorie 3). Aplikace recentní stratifikace R-ISS vedla k dominanci kategorie 2 na úkor kategorie 3 a zejména kategorie 1 (tab. 3).
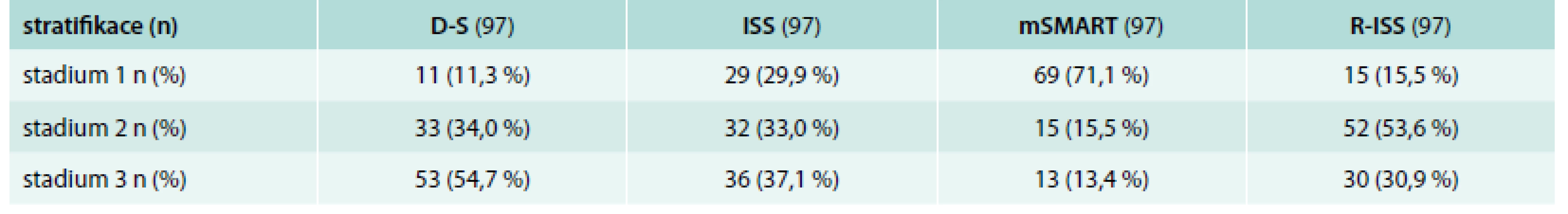
McNemarův-Bowkerův test symetrie popsal shodu klasifikace dle ISS a mSMART v 29,9 %, přičemž klasifikace dle mSMART byla s ohledem na škálu 1–3 nižší v 52,5 %, zatímco ISS pouze v 17,6 %, posun v klasifikaci byl vysoce signifikantní (p = 0,0003). Srovnání ISS vs R-ISS systému prokázalo shodu v 59,8 %, přičemž stratifikace dle R-ISS byla ve vyšší skupině v 21,6 % a ISS stratifikace v 18,6 %, posun v klasifikaci byl významný (p = 0,001). Porovnání klasifikace mSMART vs R-ISS odhalilo shodu v 40,2 %, vyšší klasifikace dle R-ISS byla v 48,5 %, dle mSMART pouze v 11,3 %, posun v klasifikaci byl vysoce signifikantní (p < 0,0001).
Vztah výsledků stratifikace k přítomnosti chromozomových změn
Analýza vztahu 9 vyhodnocených cytogenetických ukazatelů s pomocí iFISH, tj. del(13q14)(Rb1), t(11;14), t(4;14), t(14;16), trizomie chromozomů 15 a 17, zmnožení 1q21, delece 17p13 a přítomnosti komplexních změn neshledala statisticky významnou závislost na stadiích 1–3 vyhodnocených s pomocí stážovacího systému D-S, v případě ISS byl zaznamenán pouze častější výskyt del(13q14) ve stadiu 3 nežli 2. Při analýze systému mSMART bylo po vyloučení chromozomálních aberací patřících mezi vlastní stážovací kritéria zjištěno významně častější zmnožení 1q21 ve skupině „intermediate“ vs „standard risk“ a významně vyšší výskyt komplexních změn ve skupině „high risk“ nežli „standard“ a „intermediate risk“.
Analýza vztahu vybraných prognostických faktorů MM k výsledkům stratifikace
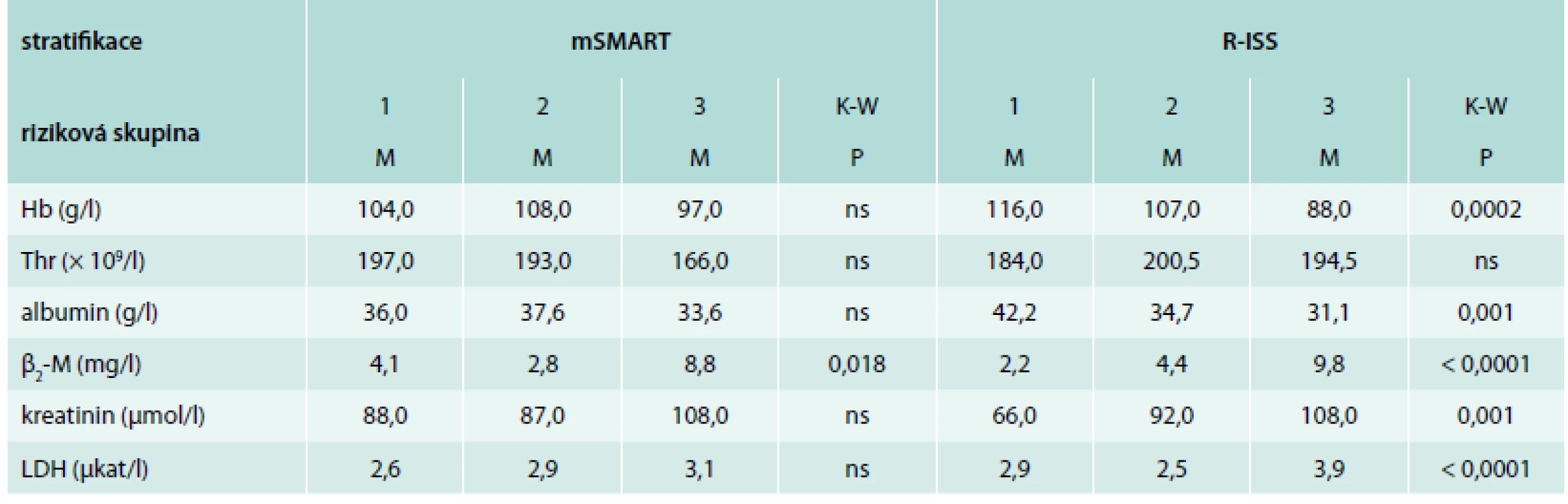
Srovnání vybraných standardních prognostických faktorů (PF) s výsledky stážování dle D-S a ISS nebylo provedeno, neboť jde vesměs o kritéria těchto stážovacích systémů. Analýza vztahu PF k výsledkům stratifikace dle mSMART prokázala pouze v případě β2-M významně vyšší hodnoty v rizikové kategorii „high risk“ (kategorie 3) vs „standard risk“ (kategorie 1), nikoliv v případě Hb, trombocytů (Thr), albuminu, kreatininu a LDH, i když jejich hodnoty vesměs odpovídaly zařazení do jednotlivých rizikových skupin (tab. 4). V případě stratifikace dle R-ISS byly s výjimkou Thr hodnoty mediánů všech ostatních 5 analyzovaných PF statisticky vysoce odlišné a to u albuminu, β2-M a kreatininu mezi kategoriemi 1 vs 3 („low vs high risk“, graf 1A), v případě LDH i mezi stadii 1 vs 2, avšak u Hb pouze mezi stadii 2 vs 3 (tab. 4, graf 1B).
Korelace výsledků SPE, FreeliteTM a HevyliteTM s výsledky stážování dle D-S a ISS
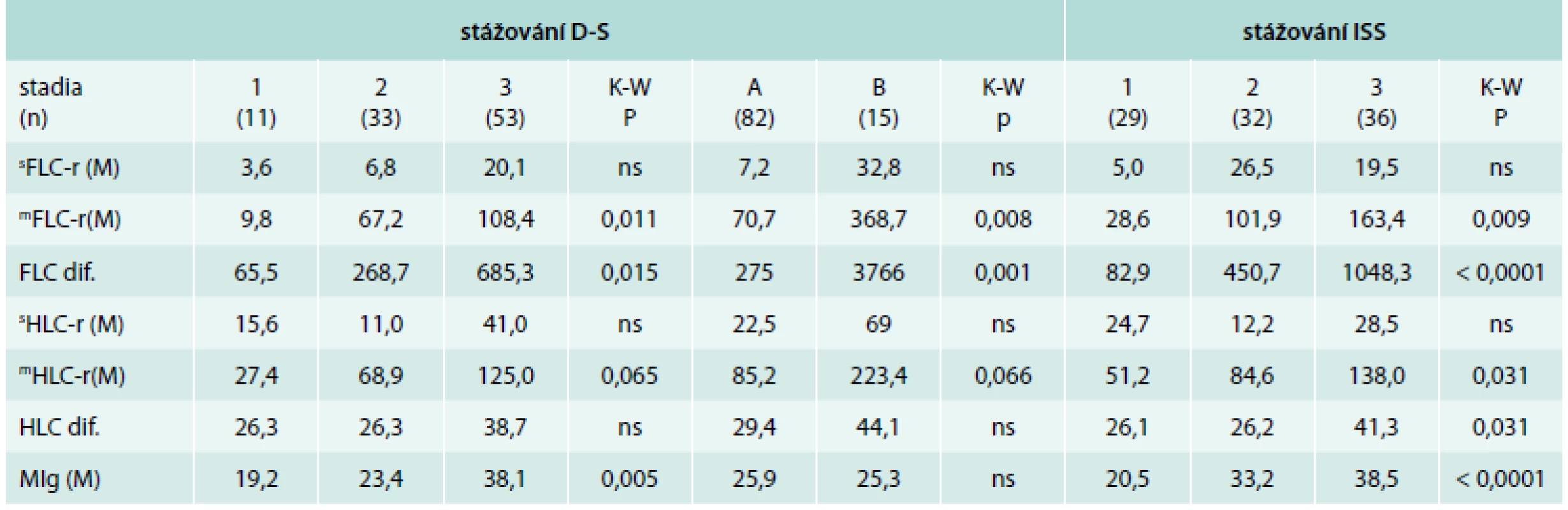
V rámci „referenční analýzy“ v případě klasického, dnes již prakticky opouštěného systému dle D-S byl zjištěn statisticky významný vztah stadií 1–3 pouze k hodnotám modifikovaného indexu mFLC-r (graf 1C) a FLC-dif. (graf 1D), nikoliv k standardnímu indexu sFLC-r, v případě indexu HLC-r byla zjištěna statistická významnost pouze k modifikovanému indexu mHLC-r , nikoliv k sHLC-r a HLC-dif. (tab. 5). V případě MIg bylo v souladu s funkcí D-S stážovacího kritéria zřejmé významné narůstání hodnot mediánu M-proteinu s pokročilostí MM. Při analýze podstadií A vs B dle D-S byla potvrzena významná statistická rozdílnost nápadně odlišných hodnot mediánů mFLC-r, FLC-dif. (graf 2A) a mHLC-r. V případě ISS byl zaznamenán vysoce významný vztah hodnot mFLC-r, FLC-dif. a koncentrace MIg, ale i mHLC-r (graf 2B) a HLC-dif. v séru ke stadiím 1–3 provázený narůstající výší hodnot mediánů signifikantně odlišných ukazatelů (tab. 5).
Korelace výsledků SPE, FreeliteTM a HevyliteTM s výsledky stratifikace dle mSMART a R-ISS
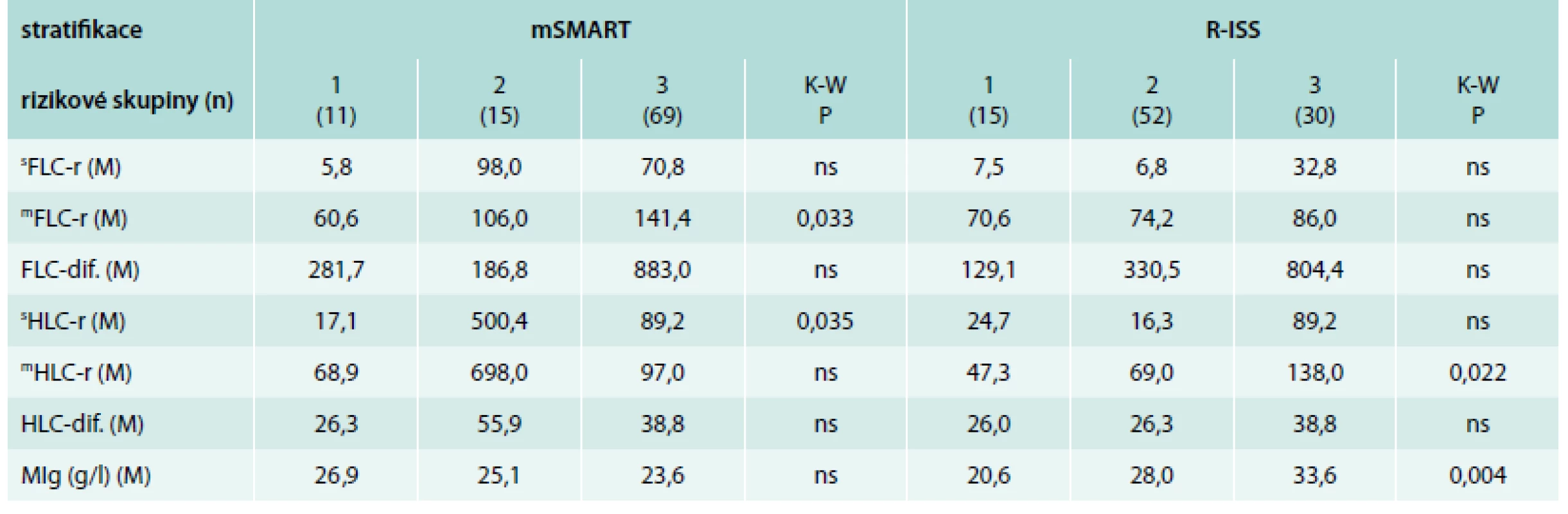
V systému mSMART byly prokázány významně vyšší hodnoty pouze v případě indexu mFLC-r v rizikové skupině „high risk“ (kategorie 3) vs „standard risk“ (kategorie 1) a sHLC-r v rizikové skupině „intermediate“ (kategorie 2) vs skupiny „standard risk“ (kategorie 1). Jak patrno, v případě sFLC-r, sHLC-r, mHLC-r a HLC-dif. byly nejvyšší hodnoty mediánů v kategorii 2, tj. „intermediate risk“ (tab. 6). V případě stratifikace dle R-ISS byly přítomny významně vyšší hodnoty pouze indexu mHLC-r v kategorii 3 vs kategorii 1 (graf 2C) a významně vyšší koncentrace MIg v rizikové kategorii 2 i 3 nežli v kategorii 1 (tab. 6, graf 2D).


Diskuse
MM je plazmocelulární neoplazie s komplexní, neúplně vyřešenou molekulární patogenezou, složitou subklonální strukturou a intraklonální různorodostí, s významnou klinicko-laboratorní, genetickou a molekulárně-biologickou různorodostí [6,7]. Mnoho recentních studií se snaží s použitím molekulárně-biologických metod o odhalení vlastní biologické podstaty nemoci [35,36]. Zavedení FISH do klinické praxe vedlo nejen k hlubšímu pochopení podstaty nemoci, ale stalo se i oporou praktického přístupu k jejímu vedení, neboť přispívá k odlišení nemocných s indolentní formou MM s nízkým sklonem k relapsu od forem s časným progresivním průběhem [8,12,15,37]. Zavedení iFISH do klinické praxe vedlo k sestavení nových stratifikačních systémů, např. mSMART, jež zaznamenala od roku 2007 již 3. revizi [12,18,39], a recentně i „hybridního“ systému R-ISS založeného na kombinaci ISS a prognosticky rizikových chromozomových abnormalit [19]. Obě stratifikace s robustním prognostickým potenciálem jsou považovány za východisko výběru individuální, již od počátku intenzivní kombinované terapie u „high risk“ a méně toxické terapie u „low risk“ forem MM, výběrově i indikace transplantační, konsolidační nebo udržovací terapie [12,18,19].
Výskyt chromozomových aberací začleněných do stratifikačních modelů dle mSMART a R-ISS byl v našem souboru až na lehce nižší výskyt t(11;14), tj. 11,3 % vs 21 % a 18,3 %, vyšší výskyt t(4;14), tj. 17,5 % vs 14 % a 10 %) podobný s výsledky předchozích studií [2,8].
Srovnání výsledků jednotlivých stratifikačních systémů
Rozdělení nemocných pomocí standardních stážovacích systémů (D-S a ISS) a nově zkoncipovaných stratifikačních modelů (mSMART a R-ISS) vyznělo značně rozdílně. Pouze ISS systém vedl k proporcionálnímu rozdělení nemocných do 3 stadií, zatímco v D-S systému byla patrna 5krát častější preference stadia 3 než stadia 1. Systém mSMART začlenil většinu nemocných (71 %) do kategorie „standard risk“, tj. 4,5krát častěji než do „intermediate risk“ a > 5krát častěji nežli do kategorie „high risk“, zatímco v R-ISS dominovali nemocní „intermediate risk“ na úkor kategorie „high risk“ a zejména „low risk“ (tab. 4). Při srovnání s výsledky Mayo kliniky byli v našem souboru častěji zastoupeni nemocní „standard risk“ (60 % vs 71,1 %), a to na úkor nemocných „intemediate risk“ (20 % vs 15,5 %) a „high risk“ (20 % vs 13,4 %) [12]. Taktéž výsledky IMWG stratifikace dle R-ISS se od našeho souboru poněkud lišily: stadium 1 „low risk“ 28 % vs 15,5 %, stadium 2 „intermediate risk“ 62 % vs 53,6 % a stadium 3 „high risk“ 10 % vs 30,9 % [19]. S pomocí Mc Nemarova-Bowkerova testu symetrie byl zaznamenán při srovnání systémů dle ISS vs mSMART vs. R-ISS významný posun: v případě mSMART vs ISS posun do kategorie mSMART „standard risk“ u 1/2 nemocných, v případě ISS vs R-ISS do R-ISS „high risk“ u 1/5 nemocných a při srovnání mSMART vs R-ISS posun do R-ISS „high risk“ kategorie u bezmála 1/2 nemocných. Vzájemná shoda mezi stadii ISS vs mSMART byla u 1/3, mezi ISS vs R-ISS u 2/3 a mezi mSMART a R-ISS u 40 % nemocných. Z uvedeného vyplývá, že specifická, značně odlišná stratifikační kritéria přinesla významně odlišný pohled na třídění nemocných do dílčích, prognosticky odlišných stadií, případně rizikových skupin. Praktická použitelnost všech 4 stratifikačních systémů byla dobrá. Je ale nasnadě, že doporučení nejvhodnějšího stratifikačního postupu v klinické praxi vyplyne z výsledků připravované prognostické analýzy, věnované vztahu k PFS („progression free survival”) a OS.
Vztah výsledků stratifikace k přítomnosti chromozomových změn
Naše zjištění, že standardní stratifikační systémy jen velmi omezeně korelují s přítomností chromozomálních změn, odpovídá i zkušenostem předchozích studií [39–41]. Ačkoliv v naší analýze nebyl zaznamenán významný vztah stratifikace dle D-S k žádné z 9 vyšetřených chromozomových změn, byl popsán častější výskyt del(13q14) ve stadiu 3 [41] a narůstající výskyt nemocných s abnormálním karyotypem s pokročilostí stadia MM [42]. Při analýze systému dle ISS jsme zaznamenali na rozdíl od předchozích zpráv pouze častější výskyt del(13q14) ve stadiu 3 vs 2. V případě zmnožení 1q21 bylo na rozdíl od našich výsledků popsáno významně vyšší zastoupení ISS stadia 3 vs stadia 1 [39,40], prognostický význam platil ale pouze v případě β2-M < 5,5 mg/l, tj. ve stadiu 1 a 2 [40]. V případě stratifikace mSMART byl vyjma rekurentních chromozomových aberací prokázán významně častější výskyt zmnožení 1q21 nemocných s „intermediate“ vs „standard risk“ a komplexních změn nemocných „high risk“ vs „standard“ a „intermediate risk“. Zřejmě průkaz evidentně vyššího prognostického potenciálu „high risk“ chromozomových aberací ve srovnání se standardními stážovacími systémy [2] byl v rámci IMWG impulzem k sestavení R-ISS [19].
Vztah výsledků stratifikace k prognostickým faktorům MM
Korelační analýza mezi vybranými biochemickými PF MM a výsledky stratifikace dle mSMART prokázala ve skupině „high risk“ oproti „standard risk“ významně vyšší hodnoty pouze β2-M, nikoliv ostatních analyzovaných PF, což dokládá nezávislost Hb, albuminu, kreatininu a LDH na přítomnosti „vysoce rizikových“ chromozomových změn. Chybějící vztah albuminu a LDH k chromozomovým aberacím potvrzuje účelnost při zařazení obou parametrů mezi kritéria „hybridního“ R-ISS, zahrnujícího vedle nepříznivých cytogenetických markerů navíc ukazatele se vztahem k rozsahu nádorové masy, poruše renální funkce (β2-M), účinku zánětlivých cytokinů v mikroprostředí KD (albumin) i vysokému proliferačnímu náboji a agresivitě myelomové tkáně (LDH) [43], a tím i lepšímu třídění nemocných s MM do homogenních, prognosticky odlišných rizikových skupin [19]. Z „klasických“ PF nezahrnutých mezi kritéria R-ISS (albumin, β2-M a LDH) byl zaznamenán významně odlišný vztah k rizikovým skupinám R-ISS pouze v případě Hb a kreatininu [43].
Analýza vztahu výsledků SPE, FreeliteTM a HevyliteTM k výsledkům stážování dle D-S a ISS
V rámci „referenční analýzy“ klasického, dnes již stále méně používaného systému dle D-S byl zjištěn významný vztah stadií 1–3 a podstadií A a B pouze k hodnotám modifikovaného indexu mFLC-r a FLC-dif., potvrzující závislost vztahu obou FLC indexů na rozsahu myelomové tkáně a alteraci renální funkce [12,20,24]. V souboru Mayo kliniky se 27 % nemocných s vysokou hodnotou FLC manifestovalo akutní renální insuficiencí (ARI), jde tedy o biomarker renálního rizika [33]. V případě indexu mHLC-r (nikoliv sHLC-r a HLC-dif.) byla zjištěna významná závislost na pokročilosti MM dle D-S, potvrzující kauzální závislost poměru i-HLC/u-HLC na velikosti nádorové masy, tj. nepřímo na množství myelomových buněk a indukované supresi normálních plazmocytů. V případě MIg byl potvrzen očekávaný narůst M-proteinu s pokročilostí MM, zato chybějící rozdílnost mezi podstadii A vs B lze vysvětlit na rozdíl od FLC nezávislostí výše MIg s kompletní molekulou na stavu renální funkce. V případě ISS byl originálně zjištěn vysoce významný vztah hodnot mFLC-r, FLC-dif. a koncentrace MIg, méně nápadně i mHLC-r a HLC-dif. v séru ke stadiím 1–3, podložený narůstající hodnotou mediánů nasvědčující, že i přes svou jednoduchost se ISS vyznačuje významným vztahem k rozsahu a biologickým vlastnostem nádorové tkáně. Naše zjištění je v souladu s již dříve popsaným významným vztahem mezi vysokými hodnotami HLC-r, β2-M a tíží myelomové infiltrace KD [44]. Významné postavení indexu HLC-r v biologii a klinické manifestaci MM vyplývá i ze 2 studií, které pomocí multivariační analýzy prokázaly, že stážovací systém založený na patologických hodnotách HLC-r (< 0,01 nebo > 200, resp. < 0,022 nebo > 45) a β2-M měl vyšší prognostický potenciál nežli stratifikace dle ISS [45–47].
Analýza vztahu výsledků SPE, FreeliteTM a HevyliteTM k výsledkům stratifikace podle mSMART a R-ISS
Statistická analýza věnovaná srovnání výsledků SPE, FreeliteTM a HevyliteTM k výsledkům stratifikace podle mSMART prokázala významně vyšší hodnoty indexu mFLC-r u nemocných „high“ vs „standard risk“ a vyšší hodnoty sHLC-r u nemocných „intermediate“ vs „standard risk“. Z toho vyplývá, že přítomnost prognosticky významných chromozomových změn předurčuje průběh procesů uplatňujících se v produkci, funkčním uplatnění a katabolizmu „involved“ a uninvolved“ FLC a HLC. Uvedené zjištění podporuje existence prokázaného vztahu vysokých hodnot FLC k renální insuficienci a krátkému OS v případě přítomnosti t(14;16), tedy jednoho z kritérií „high risk“ MM podle mSMART [6,8,48]. V dosavadní literatuře jsme stejně zkoncipovanou analýzu a námi podchycený vztah mFLC-r a sHLC-r k výsledkům mSMART stratifikace nezaznamenali. Ve studii věnované stratifikaci dle D-S byly zjištěny hraničně nižší hodnoty indexu FLC-r ve stadiích 1 + 2 vs 3, nikoliv mezi stadii 1 vs 2 + 3, v případě ISS vyzněl vztah FLC-r k výsledkům stážování taktéž významně [49]. Je uváděno, že hodnoty „involved/uninvolved“ FLC-r (mFLC-r) ≥ 100 a hodnota „involved“ FLC > 100 mg/l jsou znakem „high risk“ doutnající/asymptomatické formy MM se 72%, případně 64–100% rizikem progrese do symptomatické fáze v průběhu 2 let [33,50,51]. mFLC-r ≥ 100 je jedním ze 3 biomarkerů malignity, tj. MDE („myeloma defining events”), patřící k novým diagnostickým kritériím MM, a mezi ukazatele progrese, řadící nemocné mezi kandidáty časné terapeutické intervence [33,34,52]. Přínos vyšetřování párů HLC pro biologii MGUS a MM dokládají zjištění Katzmanna, jenž v souboru 999 jedinců s MGUS s izotypem IgG prokázal, že specifická suprese IgG-λ predikuje s mnohaletým předstihem vývin maligní transformace [28]. Přínos vyšetření hladin HLC u MM metodou HevyliteTM vyplývá i z průkazu prognostického významu u asymptomatické formy MM [53] i z průkazu významného vztahu rizikových stadií MGUS ke stupni suprese „uninvolved“ HLC [54]. Analýza stratifikace dle R-ISS vyzněla poněkud odlišně, neboť byly zjištěny významně vyšší hodnoty indexu mHLC-r ve stadiích „high“ a „intermediate risk“ vs „low risk“ a vyšší koncentrace MIg v „intermediate“ vs „high risk“ MM. Z uvedeného vyplývá, že podstatná odlišnost stratifikačních kritérií mSMART, zohledňující pouze výsledky iFISH a „hybridního“ modelu R-ISS opírající se navíc o standardní PF (albumin, β2-M a LDH) vede i k odlišnému vztahu k ukazatelům, odrážejícím doposud jen neúplně probádanou patogenezu MM. Z průkazu signifikantního vztahu indexů mFLC-r a sHLC-r k mSMART a mHLC-r k modelu R-ISS vyplývá, že nejde o nezávislé, a proto ani o vhodné parametry, jež by mohly dále navýšit prognostický potenciál obou cytogeneticky založených stratifikačních systémů. Složitost problematiky umocňuje zjištění Bradwella [45], který na podkladě analýzy PFS vyvodil, že cytogenetické aberace, z nichž t(4;14) a del(17p) patří mezi kritéria mSMART a R-ISS stratifikačních modelů prokázaly v multivariační analýze nižší prognostický význam nežli HLC-r [45]. Budoucí snaha o nalezení citlivějších prognostických markerů MM se bude nejspíše ubírat cestou nalezení vysoce prognosticky potentních rizikových ukazatelů odhalených s pomocí genové expresní analýzy, vyšetření polymorfizmu nukleotidů a dalších ještě náročnějších molekulárně-biologických metod [55,56].
Závěr
Studie potvrdila, že nové stratifikační modely mSMART a R-ISS, založené na výsledcích iFISH, vedou při srovnání se standardními systémy dle D-S a ISS k výrazně odlišnému rozvrstvení nemocných do rizikových skupin, což vysvětlil prakticky chybějící vztah stážování dle D-S a s výjimkou del(13q14) i ISS ke kterékoliv z 9 vyšetřených, prognosticky významných chromozomových aberací u MM. Další příčinou byl izolovaný vztah stratifikace dle mSMART pouze k hodnotám β2-M a „hybridního“ R-ISS k Hb a kreatininu s absencí významného vztahu k některému z ostatních vyšetřených PF (albumin a LDH). V případě stážování podle D-S byl zaznamenán významný vztah stadií 1–3 a rozdíl podstadií A vs B k hodnotám mFLC-r, FLC-dif. a mHLC-r, v případě ISS navíc i k HLC-dif. a koncentraci MIg. Analýza výsledků stratifikace podle mSMART modelu dospěla k originálnímu odhalení významného vztahu rizikových skupin k hodnotám mFLC-r a sHLC-r, zatímco u R-ISS pouze k mHLC-r a koncentraci MIg. Byla ověřena praktická použitelnost stratifikace mSMART a R-ISS s tím, že o výběru nejvhodnějšího modelu pro klinickou praxi rozhodne výsledek budoucí prognostické analýzy věnované PFS („progression free survival“) a OS. Z uvedených výsledků vyplývá, že určení genetických změn je v rutinní klinické praxi zatím nenahraditelné, neboť stratifikuje pacienty do genetických prognostických podskupin, které nejvíce odrážejí heterogenitu klinického průběhu onemocnění a prognózu nemocných s MM.
Dosažené výsledky demonstrují odlišný vztah analyzovaných stratifikací k standardním PF MM, zejména ale originální přínos vyšetření poměru „involved/uninvolved“ forem FLC a HLC, tj. indexů mFLC-r a mHLC-r a jejich rozdílu (FLC-dif. a HLC-dif.) k hlubšímu pochopení doposud neúplně probádané patobiologie MM.
Podpora grantové studie IGA MZ ČR NT /12451–5 a NT/14400–3.
prof. MUDr. Vlastimil Ščudla, CSc.
vlastimil.scudla@fnol.cz
III. interní klinika – nefrologie, revmatologie a endokrinologie LF UP a FN Olomouc
www.fnol.cz
Doručeno do redakce 29. 12. 2015
Přijato po recenzi 27. 1. 2016
Zdroje
1. Avet-Loiseau H, Facon T, Grosbois B et al. Oncogenesis of multiple myeloma: 14q32 and 13q chromosomal abnormalities are not randomly distributed, but correlate with natural history, immunological features, and clinical presentation. Blood 2002; 99(6): 2185–2191.
2. Avet-Loiseau H, Attal M, Moreau M et al. Genetic abnormalities and survival in multiple myeloma: the experience of the Intergroupe Francophone du Myélome. Blood 2007; 109(8): 3489–3495.
3. Kalff A, Spencer A. The t(4;14) translocation and FGFR3 over expression in multiple myeloma: prognostic implications and current clinical strategies. Blood Cancer J 2012; 2: e89. Dostupné z DOI: http://dx.doi.org/10.1038/bcj.2012.37.
4. Liebisch P, Döhner H. Cytogenetics and molecular cytogenetics in multiple myeloma. Eur J Cancer 2006; 42(11): 1520–1529.
5. Keasts J, Reiman T, Maxwell CA et al. In multiple myeloma, t(4;14(p16;q32) is an adverse prognostic factor irrespective of FGFR3 expression. Blood 2003; 101(4): 1520–1529.
6. Greenberg AJ, Rajkumar SV, Therneau TM et al. Relationship between initial clinical presentation and the molecular cytogenetic classification of myeloma. Leukemia 2014; 28(2): 398–403.
7. Avet-Loiseau H. Role of genetics in prognostication in myeloma. Best Pract Res Clin Haematol 2007; 20(4): 625–635.
8. Kumar S, Fonseca R, Ketterling RP et al. Trisomies in multiple myeloma: impact on survival in patients with high-risk cytogenetics. Blood 2012; 119(9): 2100–2105.
9. Hajek R, Adam Z, Scudla V et al. Guidelines of Czech Myeloma Group 2012. Diagnosis and treatment of multiple myeloma. Transfuze Hematol Dnes 2012; 18(Suppl 1): 5–89. Dostupné z WWW: http://www.myeloma.cz/res/file/Trans%20suppl%201.pdf.
10. International Myeloma Working Group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121(5): 749–757.
11. Greipp PR, San Miguel JF, Fonseca R et al. Development of an International prognostic index (IPI) for myeloma: report of the International Myeloma Working Group. Hematol J 2003; 4(Suppl 1): S42-S43.
12. Mikhael JR, Dingli D, Vivek R et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo stratification of myeloma and risk-adapted therapy (mSMART) consensus guidelines 2013. Mayo Clin Proc 2013; 88(4): 360–376.
13. Combining information regarding chromosomal aberrations t(4;14) and del(17p13) with the International Staging System classification allows stratification of myeloma patients undergoing autologous stem cell transplantation.
14. Boyd KD, Ross FM, Chiecchio L et al. A novel prognostic model in myeloma based on segregating averse FISH lesions and the ISS: Analysis of patients treated in the MRC Myeloma IX trial. Leukemia 2012; 26(2): 349–355.
15. Avet-Loiseau H, Durie BGM, Cavo M et al. Combining fluorescent in situ hybridization data with ISS staging improves risk assessment in myeloma: An International Myeloma Working Group collaborative project. Leukemia 2013; 27(3): 711–717.
16. Moreau P, Cavo M, Sonneveld P et al. Combination of international scoring system 3, high lactate dehydrogenase, and t(4;14) and/or del(17p) identifies patients with multiple myeloma (MM) treated with front-line autologous stem cell transplantation and high-risk of early MM progression-related death. J Clin Oncol 2014; 32(20): 2173–2180.
17. Facon T, Avet-Loiseau H, Guillerm G et al. Chromosome 13 abnormalities identified by FISH analysis and serum beta2-microglobulin produce a powerful myeloma staging system for patients receiving high-dose therapy. Blood 2001; 97(6): 1566–1571.
18. Kumar SK, Mikhael JR, Buadi F et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo stratification of myeloma and risk-adapted therapy (mSMART) consensus guidelines. Mayo Clin Proc 2009; 84(12): 1095–1110.
19. Palumbo A, Avet-Loiseau H, Oliva S et al. Revised International Staging System for multiple myeloma: A report from International Myeloma Working Group. J Clin Oncol 2015; 33(26): 2863–2869.
20. Bradwell AR, Harding SJ, Fourrier NJ et al. Assessment of monoclonal gammopathies by nephelometric measurement of individual immunoglobulin κ/λ ratios. Clin Chem 2009; 55(9): 1646–1655.
21. Keren DF. Heavy/light-chain analysis of monoclonal gammopathies. Clin Chem 2009; 55(9): 1606–1608.
22. Katzmann JA, Kyle RA, Benson J et al. Screening panels for detection of monoclonal gammopathies. Clin Chem 2009; 55(8): 1517–1522.
23. Dispenzieri A, Kyle RA, Merlini G et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23(2): 215–224.
24. The Binding Site Group Ltd. Serum free light chain analysis plus Hevylite. 7th ed. The Binding Site: Birmingham 2015.
25. Ščudla V, Pika T, Minařík J. Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (HevyliteTM) u monoklonálních gamapatií. Vnitř Lék 2015; 61(1): 60–71.
26. Bhutani M, Landgren O, Korde N. Serum heavy-light chains (HLC) and free-light chains (FLC) as predictors for early CR in newly diagnosed myeloma patients treated with carfilzomib, lenalidomide, and dexamethasone. 55TH ASH Annual Meeting, 2013. Abstr. No. 762. Dostupné z WWW: http://www.myelomabeacon.com/docs/ash2013/762.pdf.
27. Ludwig H, Faint J, Zojer N et al. Serum heavy/light chain and free light chain measurements provide prognostic information, allow creation of a prognostic model and identify clonal changes (clonal tiding) through the course of multiple myeloma. Blood 2011; 118(23): 1244.
28. Katzmann JA, Clark R, Kyle RA et al. Supression of uninvolved immunoglobulins defined by heavy/light chain pair suppression is a risk factor for progression of MGUS. Leukemia 2013; 27(1): 208–212.
29. Batinic J, Perič Z, Šegulja D et al. Immunoglobulin heavy/light chain analysis enhances the detection of residual disease and monitoring of multiple myeloma patients. Croat Med J 2015; 56(3): 263–271.
30. Balcárková J, Procházková K, Ščudla V et al. Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem. Transfuze Hematol Dnes 2007; 13(4): 176–182.
31. Kyrtsonis MCH, Theodoros P, Vassilakopoulos TP et al. Prognostic value of serum free light chain ratio at diagnosis in multiple myeloma. Brit J Haematol 2007; 137(3): 240–243.
32. Jekarl DW, Min ChK, Kwon A et al. Impact of genetic abnormalities on the prognosis and clinical parameters of patients with multiple myeloma. Ann Lab Med 2013; 33(4): 248–254.
33. Larsen JT, Kumar SK, Dispenzieri A et al. Serum free light chain ratio as a biomarker for high-risk smoldering multiple myeloma. Leukemia 2013; 27(4): 941–946.
34. Rajkumar SV, Dimopoulos MA, Palumbo A et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15(12): e538-e548. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(14)70442–5>.
35. Keats JJ, Chessi M, Egan JB et al. Clonal competition with alternating dominance in multiple myeloma. Blood 2012; 120(5): 1067–1076.
36. Brioli A, Giles H, Pawlyn Ch et al. Serum free immunoglobulin light chain evaluation as a marker of impact from intraclonal heterogeneity on myeloma outcome. Blood 2014; 123(22): 3414–3419.
37. Fonseca R. International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. Leukemia 2009; 23(12): 2210–2221.
38. Dispenzieri A, Rajkumar SV, Gertz MA et al. Treatment of newly diagnosed multiple myeloma based on Mayo Stratification of Myeloma Risk-adapted Therapy (mSMART): consensus statement. Mayo Clin Proc 2007; 82(3): 323–341.
39. An G, Xu Y, Shi L et al. Chromosome 1q21 gains confer inferior outcomes in multiple myeloma treated with bortezomib but copy number variation and percentage of plasma cells involved have no additional prognostic value. Haematologica 2014; 99(2): 353–359.
40. Hanamura I, Stewart JP, Huang Y et al. Frequent gain of chromosome band 1q21 in plasma-cell dyscrasias detected by fluorescence in situ hybridization: incidence increases from MGUS to relapsed myeloma and is related to prognosis and disease progression following tandem stem-cell transplantation. Blood 2006; 108(5): 1724–1732.
41. Zojer N, Königsberg R, Ackermann J et al. Deletion of 13q14 remains an independent adverse prognostic variable in multiple myeloma despite its frequent detection by interphase fluorescence. Blood 2000; 95(6): 1925–1930.
42. Lai JL, Zandecki M, Mary JY et al. Improved cytogenetics in multiple myeloma: a study of 151 patients including 117 patients at diagnosis. Blood 1995; 85(9): 2490–2497.
43. Terpos E, Katodritou E, Roussou M et al. High serum lactate dehydrogenase adds prognostic value to the international staging system even in the era of novel agents. Eur J Haematol 2010; 85(2): 114–119.
44. Koulieris E, Panayiotidis P, Harding SJ et al. Ratio of involved/uninvolved immunoglobulin quantification by HevyliteTM assay: clinical and prognostic impact in multiple myeloma. Exp Hematol Oncol 2012; 1(1): 9.
45. Bradwell AR, Harding S, Fourrier N et al. Prognostic utility of intact immunoglobulin Ig´kappa/Ig´lambda ratios in multiple myeloma patients. Leukemia 2013; 27(1): 202–207.
46. Ludwig H, Milosavljevic D, Zojer N et al. Immunoglobulin heavy/light chain ratios improve paraprotein detection and monitoring, identify residual disease and correlate with survival in multiple myeloma patients. Leukemia 2013; 27(1): 213–219.
47. Ludwig H, Milosavljevic D, Zojer N et al. Supression of the non-involved HLC pair correlates with survival in newly diagnosed and relapsed/refractory patients with myeloma. Congress of European Haematology Association, Milano 2014; P-980. Am J Hematol 2016; 91(3): 295–301. Dostupné z WWW: http://onlinelibrary.wiley.com/doi/10.1002/ajh.24268/pdf
48. Avet-Loiseau H, Malard F, Campion L et al. Translocation t(14;16) and multiple myeloma: is it really an independent prognostic factor? Blood 2011; 117(6): 2009–2011.
49. Cavallo F, Rasmussen E, Zangari M et al. Serum Free-Light chain (sFLC) assay in multiple myeloma (MM). Clinical correlates and prognostic implications in newly diagnosed MM patients treated with total therapy 2 or 3 (TTP2/3). Blood 2005; 106: Abstract no. 3490.
50. Kastritis E, Terpos E, Moulopoulos L et al. Extensive bone marrow infiltration and abnormal free light chain ratio identifies patients with asymptomatic myeloma at high risk for progression to symptomatic disease. Leukemia 2013; 27(4): 947–953.
51. Waxman AJ, Mick R, Garfall AL et al. Modeling the risk of progression in smoldering multiple myeloma. J Clin Oncol 2014; 32(5 Suppl): Abstract 8607.
52. Ghobrial IM, Landgren O. How I treat smoldering multiple myeloma. Blood 2014; 124(23): 3380–3388.
53. Maisnar V, Pour L, Pika T et al (Czech Myeloma Group, Czech Republic). The significance of Hevylite test for determination of prognosis in patients with asymptomatic multiple myeloma-the results of a new CMG project. Clin Lymphoma Myeloma Leuk 2015; 15(Suppl 3): e120. PO-72. Dostupné z DOI: http://dx.doi.org/10.1016/j.clml.2015.07.307.
54. Pika T, Lochman P, Sandecka V et al. Immunoparesis in MGUS – Relationship of uninvolved immunoglobulin pair supression and polyclonal immunoglobuline levels to MGUS risk categories. Neoplasma 2015; 62(5): 827–832.
55. Shaughnessy JD jr, Zhan F, Burington BE et al. A validated gene expression model of high-risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109(6): 2276–2284.
56. López-Corral L, Sarasquete ME, Bea S et al. SNP-based mapping arrays reveal high genomic complexity in monoclonal gammopathies, from MGUS to myeloma status. Leukemia 2012; 26(12): 2521–2529.
Štítky
Diabetologie Endokrinologie Interní lékařstvíČlánek vyšel v časopise
Vnitřní lékařství

2016 Číslo 4
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S profesorem Vladimírem Tesařem o léčbě CKD dle aktuálních doporučení: praktický lékař jako klíč k renoprotekci
- Porovnání empagliflozinu a dapagliflozinu v léčbě srdečního selhání
- Jak souvisí index systémového zánětu s kardiovaskulární mortalitou pacientů s hypertenzí?
Nejčtenější v tomto čísle
- DRESS syndróm
-
PCSK9 inhibitory – nové možnosti v léčbě hypercholesterolemie: U koho budou indikovány?
Stanovisko České společnosti pro aterosklerózu - Betablokátory a chronická obstrukční plicní nemoc
- Chronická obličková choroba, metformín a laktátová acidóza
