-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKarcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
Thyroid carcinomas: the present view on diagnostics and therapy
Thyroid carcinoma (TC) represents 1–2 % of all human tumors, and is the seventh most common tumor. Women are in large majority among new patients. For women, this is the fifth most common tumor. In the Czech Republic, 1 143 new cases of TC were diagnosed in 2015. It is the tumor with the highest increase in incidence. Among newly diagnosed tumors, most of those are differentiated thyroid gland carcinomas (DTCs) originating from follicular thyroid cells. These tumors are follicular and papillary carcinomas and Hurthle carcinoma, accounting for 95 % of new cases. Due to the great progress in treatment, the prognosis is most commonly good for these tumors. Treatment is more difficult for other types of tumors. Anaplastic thyroid cancer (representing less than 1 % of thyroid tumors) is a rare form of thyroid cancer that is very malignant. Also found in the thyroid gland is Euro-C-cell tumor, which originates in C cells. This is the so-called medullary thyroid carcinoma, which is less common (5 % of all thyroid carcinomas). It emerges from the parapolyclic neuroendocrine cells of the thyroid gland. This tumor often metastasizes to the cervical lymph nodes, and frequently occurs in distant bone, liver and lung metastases. In 2015, in this publication we published an article: Thyroid gland carcinomas, current therapeutic procedures. This article was devoted to the diagnosis of thyroid carcinoma and individual treatment procedures. In this article, we look at differentiated thyroid carcinomas (DTCs), especially current opinions on the treatment of low-risk carcinomas.
Key words:
differentiated thyroid cancer – radioidine – targeted therapy
Autoři: Petr Vlček 1; Dana Nováková 1; Rami Katra 2
Působiště autorů: Klinika nukleární medicíny a endokrinologie 2. LF UK a FN v Motole, Praha 1; Klinika ušní, nosní a krční 2. LF UK a FN v Motole, Praha 2
Vyšlo v časopise: Vnitř Lék 2017; 63(9): 572-579
Kategorie: Přehledné referáty
Souhrn
Karcinomy štítné žlázy (TC) představují 1–2 % všech lidských nádorů, jedná se o 7. nejčastější tumor. Mezi novými pacienty je velká převaha žen. U žen se jedná o 5. nejčastější nádor. V České republice bylo v roce 2015 diagnostikováno 1 143 nových případů TC. Jde o nádor s největším nárůstem incidence vůbec. Mezi nově diagnostikovanými nádory jsou hlavně diferencované nádory štítné žlázy (DTC) vycházející z folikulárních buněk štítné žlázy. Papilární, folikulární a Hurthleho karcinomy představují dnes 95 % všech nových případů. Vzhledem k velkému pokroku v léčbě těchto nádorů je prognóza pacientů většinou velmi dobrá. Obtížnější je léčba v případě dalších typů nádorů. Anaplastický karcinom štítné žlázy (představuje méně než 1 % nádorů štítné žlázy) je vzácná forma karcinomu štítné žlázy, která je velmi zhoubná. Ve štítné žláze se také vyskytují neuroendokrinní tumory, vycházející z C buněk. Jde o takzvaný medulární karcinom štítné žlázy, který je méně častý (5 % všech karcinomů štítné žlázy). Vzniká z parafolikulárních neuroendokrinních buněk štítné žlázy. Tento nádor často metastazuje do krčních lymfatických uzlin, častější je výskyt i vzdálených kostních, jaterních a plicích metastáz. V roce 2016 jsme publikovali v tomto časopise článek Karcinomy štítné žlázy: současné terapeutické postupy. V něm jsme se věnovali diagnostice karcinomu štítné žlázy a jednotlivým léčebným postupům. V tomto přehledném článku se věnujeme diferencovaným karcinomům štítné žlázy (DTC), hlavně aktuálním názorům na léčbu nízkorizikových karcinomů.
Klíčová slova:
cílené terapie – diferencované karcinomy štítné žlázy – radiojodÚvod
V posledních 20 letech došlo v rozvinutých zemích k dramatickému nárůstu výskytu karcinomu štítné žlázy. I když přesné důvody nárůstu nejsou objasněny, není pochyb, že velkou část zvýšení incidence karcinomu štítné žlázy je možno přičíst „overdiagnosis“, diagnostikování velmi malých karcinomů štítné žlázy (thyroid carcinoma – TC), které je spojeno s rozšířením nových diagnostických metod. V posledních letech se zvýšilo používání ultrasonografie (USG) štítné žlázy a aspirace tenkou jehlou za kontroly ultrazvukem (FNA – fine-needle aspiration). Došlo také k v pokroku v histologickém hodnocení a k pečlivějšímu vyhodnocení vzorků štítné žlázy.
Přeřazení některých pacientů z kategorie středního rizika do kategorie nízkého rizika umožnil rovněž pokrok ve znalostech rizika recidivy u různých histologických podtypů rakoviny štítné žlázy. I přes tyto popsané skutečnosti zůstává při rozhodování o léčbě u pacientů s nízkým rizikem obava, zda u nich lze riziko recidivy zcela vyloučit. Při rozhodování o způsobu léčby je proto třeba postupovat v léčebném postupu u jednotlivých pacientů velmi individuálně: na základě zkušenosti ošetřujícího lékaře a také na základě aktuálních odborných publikací.
V posledních několika měsících bylo diagnostice a léčbě diferencovaných karcinomů štítné žlázy věnováno několik dále citovaných zajímavých článků, ze kterých jsme čerpali pro účely předkládaného přehledu.
Základním léčebným opatřením v péči o pacienty s diferencovanými karcinomy štítné žlázy (DTC – differentiated thyroid gland carcinomas) zůstává: chirurgická léčba, léčba radioaktivním jodem a následná substituce levotyroxinem. Ve vzácných případech radiojod refrakterních nádorů se používá supresní léčba hormony štítné žlázy, zevní radioterapie a zcela výjimečně systémová cytostatická chemoterapie. V poslední době byla schválena pro léčbu radiojodem refrakterního DTC biologická léčba inhibitory tyrozinkináz.
V roce 2016 jsme publikovali v tomto časopisu článek Karcinomy štítné žlázy: současné terapeutické postupy [1]. V tomto přehledném článku se budeme věnovat diferencovaným karcinomům štítné žlázy (DTC), hlavně aktuálním názorům na léčbu nízkorizikových karcinomů.
Epidemiologie a klasifikace
S nálezem DTC se setkáme u 7–15 % pacientů, kteří podstupují operaci štítné žlázy [2]. Ve Spojených státech se podle publikace Cancer statistics 2017 předpokládá, že v roce 2017 bude v USA diagnostikováno 56 870 nových případů TC. V Německu je diagnostikováno ročně přibližně 6 000 nových případů DTC [3].
V České republice bylo dle ÚZIS v roce 2015 diagnostikováno celkem 1 143 nových případů karcinomu štítné žlázy. Oproti 1 022 novým případům v roce 2011 jde o nárůst o 11,83 %. Informace o výskytu nádorů štítné žlázy v České republice od roku 2011 do roku 2015 jsou uvedeny v tab. 1, která uvádí data o výskytu nádorů podle pohlaví a podle stadia onemocnění.
Tab. 1. Počet a zastoupení stadií u nově diagnostikovaných zhoubných TC u mužů a žen v letech 2011–2015. 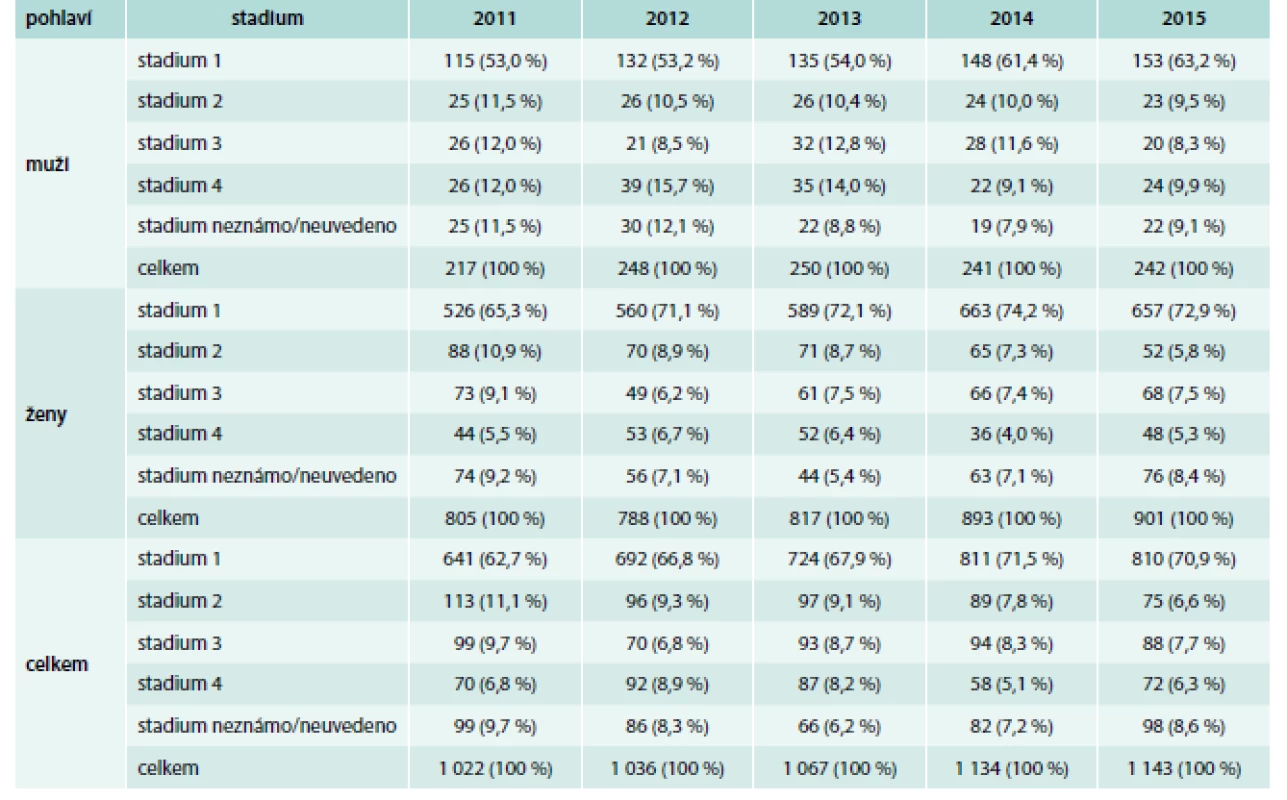
Zdroj: Národní onkologický registr, ÚZIS ČR (http://www.uzis.cz/registry-nzis/nor) Klasifikace nádorů štítné žlázy
Nezbytným předpokladem pro volbu správného léčebného postupu je posouzení rizikovosti nádorů u jednotlivých pacientů a správná klasifikace stadia onemocnění. Je vytvořena celá řada klasifikací rizika DTC; většina je založena na kombinaci velikosti primárního nádoru, histologii, extratyroidálním šíření nádoru a věku v době diagnózy. Tato klasifikace pomáhá předpovídat riziko lokální recidivy, rozvoje metastáz a úmrtnosti. Klasifikace TNM, která je primárně založena na velikosti primárního nádoru, počtu a lokalizaci metastáz do lymfatických uzlin a přítomnosti vzdálených metastáz, ukazuje tab. 2 [4].
Tab. 2. TNM klasifikace rakoviny štítné žlázy – dle histologie. 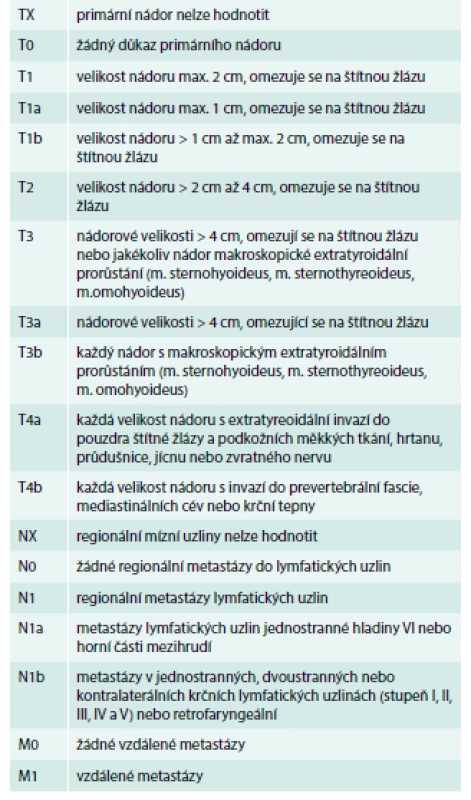
T – tumor (nádor) N – nodus (uzlina) M – metastáza Upraveno podle [4] ATA (Americká tyreoidální asociace) ve svých současných doporučeních navrhuje dělení TC na základě výskytu četnosti rizika recidivy podle některých strukturálních charakteristik [5]:
- vysoce riziková skupina: výskyt extratyreoidálního rozšíření nádoru, neúplné odstranění nádoru, vzdálené metastázy nebo metastazování do lymfatických uzlin velikosti > 3 cm
- skupina se středním rizikem: agresivní histologie, menší extratyreoidální rozšíření, vaskulární invaze nebo > 5 metastatických lymfatických uzlin (0,2–3 cm)
- skupina s nízkým rizikem: intratyreoidální DTC, ≤ 5, výskyt mikrometastáz do lymfatických uzlin (< 0,2 cm)
The American Joint Committee on Cancer (AJCC) využívá při diagnostice rizikových faktorů kombinace TNM klasifikace a věku pacienta > 55 let [6]. Rovněž hodnocení invaze nádoru do lymfatických a krevních cév považují za velmi důležité, neboť bylo prokázáno, že tyto nálezy jsou spjaty se středním rizikem recidivy.
Běžná stratifikace rizika DTC je založena na klasifikaci TNM [7]:
- vysoce riziková skupina: pT3, pT4 každé N1, všechny M1
- skupina s nízkým rizikem: pT1b, pT2, cN0/pN0, CM0
- skupina s velmi nízkým rizikem: pT1a, cN0/pN0, CM0
Kontroverze v léčbě
Jak bylo již uvedeno v úvodu, chceme se věnovat hlavně aktuálním názorům na léčbu nízkorizikových DTC. Je jistě důležité se v klinické praxi opírat nejen o vlastní diagnostické a léčebné zkušenosti, ale rovněž mít přehled o tom, jaké postoje zaujímají jednotlivé světové autority.
Celosvětově existuje mnoho doporučení pro klinickou praxi, diagnostiku, léčbu a následné sledování nemocných s DTC. Evropská asociace štítné žlázy (ETA – the European Thyroid Association) zveřejnila svá doporučení pro léčbu DTC v roce 2013 [8]. Evropská společnost pro nukleární medicínu, (EANM – the European Association of Nuclear Medicine) a Společnost nukleární medicíny a molekulárního zobrazování (SNMMI – The Society of Nuclear Medicine and Molecular Imaging) publikovaly nejnovější pokyny pro terapii DTC radiojodem v letech 2008 a 2012 [9,10]. Japonská asociace endokrinních chirurgů a Japonská společnost chirurgů štítné žlázy přehodnotily své pokyny v roce 2014 [11]. Nové ATA pokyny pro léčbu DTC u dospělých nemocných byly zveřejněny v roce 2015 [12] a aktualizované pokyny ATA pro léčbu dětských pacientů byly zveřejněny v roce 2015 [5].
Prakticky všechny tyto autority se v současné době shodují v léčebném postupu u pacientů s nádorem velikosti > 4 cm. U těchto pacientů je jednoznačný konsenzus: po totální tyreoidektomii každého zajistit ještě radiojodem. Jedná se přibližně o 30 % všech diagnostikovaných TC. Odborná diskuse v současné době řeší otázku, jak radikálně postupovat v léčbě u zbývajících 70 % pacientů, u kterých byly diagnostikovány nádory méně rizikové: jedná se o skupinu s nízkým rizikem a skupinu s velmi nízkým rizikem.
Terapie diferencovaného karcinomu štítné žlázy
Léčba karcinomů štítné žlázy vyžaduje multidisciplinární přístup zahrnující těsnou spolupráci endokrinologa a specialistů pro nukleární medicínu, onkologii a endokrinologickou chirurgii (všeobecnou nebo hlavy a krku). Diagnostické a léčebné možnosti se v posledních letech značně zdokonalily. Máme k dispozici vysoce senzitivní metody pro laboratorní měření hladin sérových nádorových markerů (supersenzitivní tyreoglobulin a kalcitonin), modernější ultrasonografické a scintigrafické přístroje, včetně s možností hybridního zobrazení (SPECT/CT). Toto umožňuje provádět méně zatěžující a pro pacienty tak i lépe tolerované zákroky.
Současným trendem je využívat efektivnějších, méně invazivních a méně nákladných procedur, které jsou schopny zaručit optimální léčebný postup při zachování nejlepší kvality života nemocných.
Přestože má léčba rakoviny obvykle velmi dobrý průběh a nízkou úmrtnost, vyžaduje toto onemocnění celoživotní sledování s pravidelnými kontrolami na tyreoonkologickém pracovišti. Terapeutický přístup při léčbě DTC má být individuální. Optimální je léčba ve specializovaných centrech, která mají s léčbou tohoto onemocnění dlouhodobé zkušenosti.
Chirurgická léčba
U všech široce invazivních folikulárních karcinomů štítné žlázy (FTC) a FTC s angioinvazí se doporučuje totální tyreoidektomie. Současně je při palpačně hmatných uzlinách nebo při nálezu uzlin na předoperačním USG vyšetření prováděna lymfadenektomie.
Pro všechny papilární karcinomy štítné žlázy (PTC) > 1 cm nebo pro všechny metastazované nebo makroskopicky invazivní PTC se bez ohledu na velikost doporučuje rovněž tyreoidektomie. Pokud je při USG nebo v průběhu operace potvrzen nález metastazování do lymfatických uzlin, je pro snížení rizika lokální recidivy v dané oblasti plně indikována lymfadenektomie. Pouhá diagnostická nebo terapeutická exstirpace jednotlivých lymfatických uzlin se za dostačující primární výkon nepovažuje. Význam rutinního provádění centrálních lymfatických disekcí s profylaktickým záměrem je stále diskutován. Je však vysoký předpoklad, že odstraněním lymfatických uzlin v této oblasti se tak sníží riziko recidivy onemocnění. U papilárního mikrokarcinomu štítné žlázy náhodně nalezeného při jednostranné operaci se obvykle nevyžaduje další chirurgický zákrok. Je však nutné se ujistit, že neoperovaný lalok není nádorem postižen. V případě patologického USG nálezu se spíš přikláníme k totalizaci výkonu, neboť riziko založení mikrometastáz není v takto změněném terénu zanedbatelné.
Léčba radiojodem
Léčba radiojodem má více než 60letou tradici. Za tu dobu byl jednoznačně prokázán jeho léčebný efekt u pacientů s DTC s vysokým rizikem recidivy. U pacientů s velmi nízkým rizikem DTC pozitivní vliv podání radiojodu na navození remise a celkové přežití nebyl v posledních prospektivních klinických studiích jednoznačně prokázán.
Léčba radiojodem je u nemocných s DTC definována jako systémové podávání 131I (smíšeného β a γ zářiče) za účelem radioeliminace pooperačních zbytků štítné žlázy, jakož i neresekovatelné nebo neúplně resekované tkáně štítné žlázy.
Tato adjuvantní ablační radioterapie zbytků štítné žlázy nebo nádorové tkáně je optimálním předpokladem pro následné dlouholeté sledování nemocných, pro stanovení sérového tyreoglobulinu (Tg) a pro provádění radiojodových celotělových skenů.
Radiojodem jsme schopni v časné fázi onemocnění detekovat lokální recidivu nebo vzdálené metastázy, což přispívá k úspěšnosti léčby a minimalizaci úmrtnosti. Regionální nebo vzdálené metastázy jsou často také zjistitelné při stoupající hladině Tg po úspěšné tyreoablaci zbytků štítné žlázy. Bylo potvrzeno, že ablativní radioterapie snižuje míru recidivy a mortality v prvních 10 letech od stanovení diagnózy [13–16]. Léčba radiojodem je indikována u vysoce rizikové skupiny DTC (pT3, pT4, každé N1, každé M1), u nízkorizikového DTC (pT1b, pT2, pN0, M0) a u malých velmi nízkorizikových papilárních karcinomů štítné žlázy v případě, že jsou přítomny rizikové faktory [17,18].
Pro zajištění vysokého vychytávání radioaktivního jodu (131I) v reziduální či nádorové tkáni stejně jako pro průkaz metastáz, je nezbytné dosáhnout odpovídající hladiny sérového TSH (> 30 mIU/l). Při této hladině, popř. vyšší, lze předpokládat, že dojde k dostatečně vysoké expresi natrium jodidového symportéru (NIS) ve folikulárních buňkách štítné žlázy. Této úrovně TSH může být dosaženo vysazením hormonů štítné žlázy alespoň na 3 týdny [19]. Následné období hypotyreózy je u většiny pacientů tolerováno poměrně dobře, u některých pacientů se však symptomy hypotyreózy projeví poměrně významně. Jedná se zejména o zvýšenou únavu, poruchy spánku a schopnosti koncentrace, přírůstek hmotnosti. Dochází také ke snížení renálních funkcí, ke kardiovaskulárním obtížím, dyslipidemii, zácpě, suchosti kůže, chrapotu a depresím. Jako alternativu, abychom se vyhnuli těmto stavům, lze použít rekombinantního tyreostimulačního hormonu (rhTSH), který se podává intramuskulárně v odstupu 24 hod ve 2 po sobě následujících injekcích (2krát 0,9 mg rhTSH). Tento preparát je rovněž schválen pro radioablaci (bez známých vzdálených metastáz) u T1–4 nádorů, dále k provádění celotělové diagnostické scintigrafie a pro testování sérové hladiny Tg u dospělých pacientů po ablaci radiojódem [20].
Diagnostická scintigrafie celého těla k ověření úspěšnosti tyreoablace se provádí vždy za 6–12 měsíců po počáteční tyreoablační dávce radiojodu, další scintigrafie se provádí již pouze v případě recidivy [12].
Léčba radiojodem má však i některé kontraindikace. Jsou to období těhotenství a kojení. Relativní kontraindikace zahrnují útlum kostní dřeně (zejména pokud předpokládáme podání vysokých aktivit radiojodu), poruchy funkce slinných žláz, snížení plicních funkcí (u vysokých kumulativních aktivitách při léčbě plicních metastáz). Je rovněž třeba zvýšené opatrnosti při podávání radiojodu u mozkových metastáz a metastáz do CNS, při nichž může jeho podání vést k otoku a k závažným kompresním komplikacím.
K dosažení eliminace nádorového procesu je nezbytné podat dostatečně vysokou dávku radiojodu, a to zejména s ohledem na klinickou závažnost stavu. V současné době se hodně diskutuje o tom, jaké by mělo být nejmenší množství podané aktivity radiojodu, aby bylo dosaženo úplné eliminace pooperačních zbytků. Správným trendem v nukleární medicíně je podávat co možná nejmenší dávku radiofarmaka při zachování maximálního terapeutického účinku.
Studie HiLo (Velká Británie) a studie ESTIMABL (Francie) srovnávaly ablativní podanou aktivitu radiojodu 1,1 GBq se standardně podávanou tyreoablační aktivitou 3,7 GBq (100 mCi) 131I po vysazení hormonů štítné žlázy nebo po stimulaci rhTSH u pacientů s nízkým rizikem karcinomu [21,22]. Obě studie prokázaly, že úspěch ablace je obdobný jak s podanou aktivitou 1,1 GBq (30 mCi), tak i se standardní aktivitou 3,7 GBq. Nicméně tento výsledek není jednoznačně akceptován všemi autoritami. Někteří autoři uvádějí, že podání nízkých aktivit vede častěji k nutnosti podání druhé dávky radiojodu [23].
Německá společnost nukleární medicíny (DGN – Die Deutsche Gesellschaft für Nuklearmedizin) doporučuje jako optimální hodnotu ablační aktivity v rozmezí 1–3,7 GBq (asi 30–100 mCi) 131I [7]. Současně doporučuje provedení scintigrafie s 99mTc-pertechnetátu v den ablace, která může poskytnout velmi užitečné informace o zvažované výši podané aktivity. U pacientů s nízkým rizikem při nálezu velkých zbytků nebo více ložisek je doporučeno podání tyreoablační aktivity 3,7 GBq (100 mCi).
Léčba radiojodem je obecně pacienty velmi dobře tolerována. Mohou se však projevit některé krátkodobé a dlouhodobé vedlejší účinky [9]. Mezi dočasné vedlejší účinky patří: poradiační zánět štítné žlázy, lokální otok akumulujícího ložiska nebo metastáz (včetně kompresivních symptomů), gastritida a nevolnost, sialoadenitida a abnormality chuti a vůně, může dojít k útlumu kostní dřeně a hypospermii.
Dlouhodobé vedlejší účinky zahrnují trvalý útlum kostní dřeně, výskyt následné sekundární malignity (leukemie a solidní tumory), chronickou sialoadenitidu včetně abnormalit chuti a vůně, xerostomii a plicní fibrózu.
Za zvláštní zmínku stojí léčba vzdálených metastáz, především do kostí a plic, které postihují asi 10 % všech pacientů s DTC [24]. Efekt léčby je v těchto případech závislý na akumulační schopnosti metastáz vychytávat radiojod a na rozsahu postižení, obvykle vyžaduje opakované podání vysokých aktivit okolo 7,4 GBq.
Krční lokální metastázy do lymfatických uzlin se rovněž primárně snažíme ovlivnit podáním radiojodu, teprve v případě absence akumulace je indikována chirurgická exstirpace uzlin. V případě miliárního plicního metastatického rozsevu je efekt léčby radiojodem výrazně lepší než u solitárních, nodulárních metastáz, u nichž je dosažení kompletní remise méně pravděpodobné. Výhodou však může být jejich solitární, izolovaný nález, protože ty je možné resekovat. Rovněž kompletní chirurgická resekce izolovaných kostních metastáz vede k lepšímu terapeutickému výsledku [7].
Pro léčbu vzdálených metastáz se podávají standardní aktivity 4–7,4 GBq, výjimečně až 11 GBq (asi 100–300 mCi) radiojodu. Přihlíží se přitom k individuálnímu stavu každého pacienta, k jeho věku, renálním funkcím, k riziku útlumu kostní dřeně a nádorové zátěži.
Karcinom štítné žlázy u dětí – specifika léčby
V srpnu tohoto roku byl publikován v časopisu Advances in Pediatrics článek o karcinomu štítné žlázy u dětských pacientů [25]. Autoři uvádějí, že v USA se celkový výskyt karcinomu štítné žlázy u dětské populace zvyšuje, zůstává však vzácným onemocněním. Zahrnuje 0,7 % všech dětských nádorů. Ve Spojených státech je 1,8 % diagnostikovaných malignit ve štítné žláze u pacientů mladších 20 let. U dívek ve věku od 15 do 19 let se jedná o výskyt s nejvyšší incidencí, v této věkové skupině je u dívek rakovina štítné žlázy druhým nejčastějším karcinomem.
Dle našich zkušeností (na Klinice ušní, nosní a krční 2. LF UK ve FN v Motole, Praha) a určité snaze o centralizaci dané problematiky také pozorujeme nárůst počtu pacientů s maligním onemocněním štítné žlázy v dětském věku. Dobře diferencované karcinomy se objevují i ve skupině dětí do 10 let věku. Přibližně třetina pacientů s DTC má potvrzené metastatické lokoregionální postižení, a proto se k totální tyreoidektomii přidává krční bloková disekce v různém rozsahu.
Stejně jako u dospělých, tak i u dětských pacientů dochází k nárůstu výskytu papilárního karcinomu štítné žlázy. Nárůst je částečně připisován zvýšené detekci malých nádorů. Studie však prokázaly zvýšený výskyt ve všech velikostech nádorů, což naznačuje, že sledování, citlivější diagnostické postupy a dřívější detekce nejsou jediným vysvětlením. Z historického hlediska bylo hodnocení a léčba uzlů štítné žlázy a rakoviny štítné žlázy u dětské populace z velké části založeno na pokynech pro dospělé. Vzhledem k rozdílům v prezentaci, patofyziologii a dlouhodobým výsledkům, ATA nedávno zveřejnila doporučení specificky určené pro léčbu uzlů štítné žlázy a DTC u dětské populace [5].
Hormonální substituce
Po operaci štítné žlázy je nutné doživotní podávání substituční hormonální terapie, obvykle ve formě monoterapie levotyroxinem (LT4). Vzhledem k tomu, TSH je schopen podporovat růst zbývající tyreoidálních buněk (tedy i nádorových), je nezbytné, aby počáteční dávka LT4 byla dostatečně vysoká, aby bylo dosaženo útlumu sekrece TSH. Po tyreoablaci je vhodné při zavedení substituční léčby zkontrolovat funkci štítné žlázy za 6–8 týdnů a v závislosti na aktuálním výsledku pak případně upravit další dávkování.
V současné době je doporučena dlouhodobá suprese TSH na hodnoty < 0,1 mU/l pouze u pacientů s vysokým rizikem a u pacientů s přetrvávajícím onemocněním, u nichž byla tímto postupem potvrzena lepší prognóza [12].
Podle doporučení ATA by měla být u pacientů s vysokým rizikem sérová hladina TSH udržována mezi 0,1–0,5 mU/l, v případě navození remise po tyreoablaci po dobu 5 let. U pacientů s nízkým rizikem, pokud je rovněž odpověď na léčbu radiojodem vynikající (po ablaci radiojodem je dosaženo nulové hladiny tyreoglobulinu a nejsou scintigrafické ani sonografické či klinické známky relapsu), můžeme sérovou hladinu TSH udržovat v rozmezí 0,5–2,0 mU/l, protože neexistují žádná data prokazující, že u pacientů s nízkým rizikem je výhodné dlouhodobě udržovat výraznější supresi TSH.
Při podávání LT4 musíme přihlížet i k dalším faktorům, které mohou ovlivnit zdravotní stav nemocného, např. rozvoj osteoporózy nebo osteopenie, srdeční arytmie, fibrilace síní a podobně. Při hormonální léčbě je třeba vzít v úvahu tyto stavy a zvážit i míru rizika recidivy onemocnění. Zejména u starších pacientů ve věku > 60 let je nezbytné intenzitu hormonální léčby individuálně zvažovat.
Následné sledování
Recidiva DTC se pohybuje kumulativně ve 15–30 %, přitom průměrná délka života pacientů s nízkorizikovým karcinomem štítné žlázy se zásadněji neodlišuje od běžné populace, pokud jsou dodržovány všechny současné doporučované léčebné postupy. Celoživotní sledování je proto nezbytné, protože k recidivě může dojít i po desítkách let, a pokud bude včas odhalena, pak obvykle opět velmi dobře reaguje na naši léčbu. Je vhodné, aby u vysoce rizikových pacientů byly kontroly prováděny 2krát ročně, a to minimálně v prvních 5 letech po diagnóze. Pokud jsou klinické, sonografické i laboratorní nálezy uspokojivé, pak další kontroly jsou dostačující v ročních intervalech.
Za navození remise lze považovat absenci klinických příznaků lokální recidivy při klinickém vyšetření, absenci patologického vychytávání radiojodu na celotělové scintigrafii, nedetekovatelnou hladinu Tg (v hypotyreóze při zvýšené hladině TSH) a absenci protilátek proti tyreoglobulinu [12,26]. Při dosažení těchto podmínek je velmi nízká pravděpodobnost recidivy. Pokud však v průběhu doby dojde ke zvýšení hladiny Tg a objeví se známky relapsu, pak je nezbytné znovu podat radiojod a hledat zdroj zvýšeného Tg. Pokud je radiojodový sken bez výpovědní informace, pokusíme se vyhledat radiojod neakumulující ložiska podáním 18F-fluorodeoxyglukózy a provedením pozitronové emisní tomografie (FDG-PET) v kombinaci s výpočetní tomografií (PET/CT), ideálně pod TSH stimulací (v hypotyreóze). FDG se obvykle zvýšeně vychytává ve špatně diferencovaných lézích, které nejsou patrny na radiojodovém skenu. Prognóza je v těchto případech velmi špatná, odhadovaná střední doba přežití se pohybuje kolem 2,5–3,5 let [27].
Nové léčebné možnosti ovlivnění radiojod refrakterních karcinomů štítné žlázy
U hůře diferencovaného karcinomu štítné žlázy bývá velmi chabé vychytávání radioaktivního jodu, a proto jeho podání není terapeutickou volbou.
Radiojod refrakterní karcinomy štítné žlázy jsou poměrně vzácné, s odhadovaným výskytem 4 případů na milion obyvatel, resp. u 5 % pacientů s aktivním karcinomem. Jako refrakterní na radiojodovou léčbu jsou definováni pacienti s pokročilým onemocněním, a to buď s aktivním nádorem při absenci akumulace radioaktivního jodu, nebo při progresi onemocnění po léčebné aplikaci radiojodu, i s přetrvávajícím onemocněním po opakovaném podání radiojodu, pokud celková podaná aktivita překročila 22 GBq (600 mCi). Kumulativní aktivita radioaktivního jodu je založena na individuálním posouzení průběhu onemocnění u každého pacienta s ohledem na radiosenzitivitu cílových tkání. Častěji se vyskytují u starších pacientů, u pacientů s objemnou masou metastáz, u hůře diferencovaných forem dle histologického nálezu a pokud je vysoká konsumpce fluorodeoxyglukózy na PET/CT skenu. Radiojod refrakterní onemocnění má obvykle agresivnější průběh.
Chemoterapie má vysokou toxicitu s neuspokojivou a poměrně nízkou odpovědí [28]. U těchto pacientů byla proto suprese TSH podáním vysokých dávek LT4 nejlepším způsobem jak přibrzdit nádorový proces.
V posledních letech, spolu s rozvojem poznatků o genové terapii, se podařilo najít novou možnost léčebného ovlivnění radiojod refrakterních pacientů s aktivním tumorem, a to pomocí inhibitorů tyrozinkináz (TKI). Pro blokaci tyrozinkinázové funkce se využívají malé organické molekuly TKI. Jde o skupinu nadějných protinádorových léčiv, jež ovlivňují kinázovou aktivitu vazbou na ATP kapsu kinázy v soutěži s buněčným adenozintrifosfátem (ATP), a tím brání autofosforylaci receptoru, blokují kinázovou aktivitu a signální transdukci. TKI mohou působit i na více než jeden tyrozinkinázový receptor. Inhibitory tyrozinkinázy, jako vandetanib, sorafenib a lenvatinib, jsou relativně novým přístupem k systémové terapii [29].
Nedávný přehled o použití těchto léků prokázal přínos pro přežití bez progrese až o 5 měsíců [30]. Zatímco zpočátku byla prokázána částečná odezva nebo přinejmenším stabilizace nemoci po sorafenibu, což je první TKI schválený pro rakovinu štítné žlázy, u pacientů se téměř vždy vyvine rezistence do 1–2 let. Je proto nutné podat jiný TKI. Terapie TKI bývá doprovázena závažnými vedlejšími účinky. Indukovaná hypertenze je jedním z nejčastějších nežádoucích účinků; základní patofyziologie vzniku tohoto stavu není zatím zcela objasněna. Mezi další nežádoucí účinky patří: průjem, únava, hepatotoxicita, kožní změny, nevolnost, nutnost zvyšování dávky LT4 pro vzestup hladiny TSH, změny v chuti, hubnutí, což vede k výraznému snížení kvality života.
Zahájení léčby TKI má smysl u pacientů s radiojod refrakterním DTC jako užitečný doplněk ke standardní terapii. Monitorování efektu terapie se opírá o výsledek CT nebo PET/CT vyšetření, na hodnocení morfologické nebo metabolické odpovědi na léčbu.
Vzhledem k rozsáhlým vedlejším účinkům by měla být tato léčba vyhrazena pouze pro pacienty s rychlou progresí nádoru a se závažnými až život ohrožujícími příznaky. Podání TKI by mělo být prováděno pouze týmem lékařů zkušených v léčbě nežádoucích účinků.
Léčba papilárního mikrokarcinomu štítné žlázy
Vzhledem k vynikající prognóze papilárního mikrokarcinomu (PTMC – papillary thyroid microcarcinoma) je hemityreoidektomie bez následné léčby radiojodem považována za dostatečnou terapii, ovšem pokud nejsou žádné známky lokální invaze, přítomnosti lymfatických uzlin nebo vzdálených metastáz. Substituce LT4 do eutyreoidního stavu je považována rovněž za dostatečnou.
V publikovaných metaanalýzách byla u PTMC prokázána prevalence vzdálených metastáz ve 0,4 %, pravděpodobnost lokálních recidiv 2,5 %, výskyt mikrometastáz v lokoregionálních lymfatických uzlinách ve 12–50 %. Riziko lymfogenních mikrometastáz se zvyšuje s velikostí primárního nádoru [31]. Pokud je provedena scintigrafie SPECT v kombinaci s CT (SPECT/CT), výskyt metastáz do lymfatických uzlin může být až u 57 %. Podle Creacha et al po 5 letech od diagnózy bylo bez relapsu nemoci 78,6 % nemocných s PTMC bez léčby radiojodem ve srovnání s 95,0 %, kterým byla podána tyreoablační dávka radiojodu [32,33]. Léčba radiojodem je doporučována na základě hodnocení rozsahu resekce a individuálního rizikového profilu. Rizikové faktory jsou multifokalita, infiltrace štítné žlázy, histologické varianty papilárního karcinomu štítné žlázy, nízký stupeň diferenciace, nádor o průměru 6–10 mm, molekulární markery, jako BRAF-V600E mutace, infiltrativní růst nádoru, předchozí zevní ozařování krku [7]. U pacientů se zbytkovou štítnou žlázou (např. pouze po lobektomii) není možné provést tyreoablaci radiojodem, sledování těchto nemocných je pro nemožnost se spolehnout na hladinu tyreoglobulinu proto obtížnější.
Závěr
Diferencovaný karcinom štítné žlázy patří mezi vzácné nádory, ale v posledních desetiletích vykazuje výrazný nárůst výskytu. Diagnostické a léčebné postupy jsou v současné době velmi dobře propracovány, stejně tak jako dlouhodobé sledování nemocných s DTC. Díky tomu jsou klinické výsledky a prognóza pro nemocné velmi příznivé.
V současné době se potýkáme s možností tzv. overdiagnosis, vzhledem k široké dostupnosti diagnostických metod, a to zejména u pacientů s nízkým a velmi nízkým rizikem karcinomu. Stále není jednoznačný jednotný přístup k řešení těchto otázek. Bohužel stále nemáme k dispozici dlouhodobé studie, které by návrhy postupů jednoznačně potvrdily či vyvrátily. Tyto studie jsou jistě nutné (v kontextu pomalého růstu dobře diferencovaného karcinomu štítné žlázy), aby došlo k rozhodnutí, který přístup je nejvhodnější. Je stále nezbytné stratifikovat rizika recidivy v dlouhodobém sledování nemocných, protože k recidivě může dojít i za řadu let od vstupní léčby.
Práce byla podpořena grantem AZV ČR 16-32665A.
prof. MUDr. Petr Vlček, CSc., MHA
petr.vlcek@fnmotol.cz
Klinika nukleární medicíny a endokrinologie 2. LF UK a FN v Motole,
Praha
www.fnmotol.cz
Doručeno do redakce 9. 8. 2017
Přijato po recenzi 4. 9. 2017
Zdroje
1. Vlček P, Nováková D. Thyroid carcinomas – current therapeutic procedures. Vnitř Lék 2016; 62(9 Suppl 3): 115–120.
2. Hegedüs L. Clinical practice. The thyroid nodule. N Engl J Med 2004; 351(17): 1764–1771.
3. Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin 2017; 67(1): 7–30. Dostupné z DOI: <http://dx.doi.org/10.3322/caac.21387>.
4. Schmidbauer B, Menhart K, Hellwig D et al.l Differentiated Thyroid Cancer-Treatment: State of the Art. Int J Mol Sci 2017; 18(6). pii: E1292. Dostupné z DOI: <http://dx.doi.org/10.3390/ijms18061292>.
5. Haugen BR, Alexander EK, Bible KC et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016; 26(1): 1–133. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2015.0020>.
6. Armin MB, Edge S, Greene F et al. AJCC Cancer Staging Manual. 8th ed. Springer USA: New York 2017 : 1–19. ISBN 978–3319406176.
7. Dietlein M, Eschner W, Grünwald F et al. Procedure guidelines for radioiodine therapy of differentiated thyroid cancer. Version 4. Nuklearmedizin 2016; 55(3): 77–89.
8. Leenhardt L, Erdogan MF, Hegedus L et al. 2013 European thyroid association guidelines for cervical ultrasound scan and ultrasound-guided techniques in the postoperative management of patients with thyroid cancer. Eur Thyroid J 2013; 2(3): 147. Dostupné z DOI: <http://dx.doi.org/10.1159/000354537>.
9. Luster M, Clarke SE, Dietlein M et al. Guidelines for radioiodine therapy of differentiated thyroid cancer. European Association of Nuclear Medicine (EANM). Eur J Nucl Med Mol Imaging 2008; 35(10): 1941–1959. Dostupné z DOI: <http://dx.doi.org/10.1007/s00259–008–0883–1>.
10. Silberstein EB, Alavi A, Balon HR et al. The SNMMI practice guideline for therapy of thyroid disease with 131I 3.0. J Nucl Med 2012; 53(10): 1633–1651. Dostupné z DOI: <http://dx.doi.org/10.2967/jnumed.112.105148>.
11. Takami H, Ito Y, Okamoto T et al. Revisiting the guidelines issued by the Japanese Society of Thyroid Surgeons and Japan Association of Endocrine Surgeons: A gradual move towards consensus between Japanese and western practice in the management of thyroid carcinoma. World J Surg 2014; 38(8): 2002–2010. Dostupné z DOI: <http://dx.doi.org/10.1007/s00268–014–2498-y>.
12. Haugen BR, Alexander EK, Bible KC et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016; 26(1): 1–133. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2015.0020>.
13. Mazzaferri EL, Jhiang SM. Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. Am J Med 1994; 97(5): 418–428.
14. Samaan NA, Schultz PN, Hickey RC et al. The results of various modalities of treatment of well differentiated thyroid carcinomas: A retrospective review of 1599 patients. J Clin Endocrinol Metab 1992; 75(3): 714–720.
15. Sawka AM, Thephamongkhol K, Brouwers M et al. Clinical review 170: A systematic review and metaanalysis of the effectiveness of radioactive iodine remnant ablation for well-differentiated thyroid cancer. J Clin Endocrinol Metab 2004; 89(8): 3668–3676.
16. Sawka AM, Brierley JD, Tsang RW et al. An updated systematic review and commentary examining the effectiveness of radioactive iodine remnant ablation in well-differentiated thyroid cancer. Endocrinol Metab Clin N Am 2008; 37(2): 457–480. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ecl.2008.02.007>.
17. Mehanna H, Al-Maqbili T, Carter B et al. Differences in the recurrence and mortality outcomes rates of incidental and nonincidental papillary thyroid microcarcinoma: A systematic review and meta-analysis of 21,329 person-years of follow-up. J Clin Endocrinol Metab 2014; 99(8): 2834–2843. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–2118>.
18. Perros P, Boelaert K, Colley S et al.Guidelines for the management of thyroid cancer. British Thyroid Association. Clin Endocrinol (Oxf) 2014; 81(Suppl 1): 1–122. Dostupné z DOI: <http://dx.doi.org/10.1111/cen.12515>.
19. Cooper DS, Doherty GM, Haugen BR et al. [American Thyroid Association Guidelines Taskforce]. Management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2006; 16(2): 109–142.
20. Schlumberger M, Ricard M, De Pouvourville G et al. How the availability of recombinant human TSH has changed the management of patients who have thyroid cancer. Nat Clin Pract Endocrinol Metab 2007; 3(9): 641–650.
21. Mallick U, Harmer C, Yap B et al. Ablation with low-dose radioiodine and thyrotropin alfa in thyroid cancer. N Engl J Med 2012; 366(18): 1674–1685. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1109589>.
22. Schlumberger M, Catargi B, Borget I et al. Strategies of radioiodine ablation in patients with low-risk thyroid cancer. N Engl J Med 2012; 366(18): 1663–1673. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1108586>.
23. Fallahi B, Beiki D, Takavar A et al. Low versus high radioiodine dose in postoperative ablation of residual thyroid tissue in patients with differentiated thyroid carcinoma: a large randomized clinical trial. Nucl Med Commun 2012; 33(3): 275–282. Dostupné z DOI: <http://dx.doi.org/10.1097/MNM.0b013e32834e306a>.
24. Benbassat CA, Mechlis-Frish S, Hirsch D. Clinicopathological characteristics and long-term outcome in patients with distant metastases from differentiated thyroid cancer. World J Surg 2006; 30(6): 1088–1095.
25. Chan CM, Young J, Prager J et al. Pediatric Thyroid Cancer. Adv Pediatr 2017; 64(1): 171–190. Dostupné z DOI: <http://dx.doi.org/10.1016/j.yapd.2017.03.007>.
26. Tuttle RM, Tala H, Shah J et al. Estimating risk of recurrence in differentiated thyroid cancer after total thyroidectomy and radioactive iodine remnant ablation: using response to therapy variables to modify the initial risk estimates predicted by the new American Thyroid Association staging system. Thyroid 2010; 20(12): 1341–1349. Dostupné z DOI: <http://dx.doi.org/10.1089/thy.2010.0178>.
27. Durante C, Haddy N, Baudin E et al. Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. J Clin Endocrinol Metab 2006; 91(8): 2892–2899.
28. Sherman SI. Early clinical studies of novel therapies for thyroid cancers. Endocrinol Metab Clin North Am 2008; 37(2): 511–524, xi. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ecl.2008.02.005>.
29. Lorusso L, Pieruzzi L, Biagini A et al. Lenvatinib and other tyrosine kinase inhibitors for the treatment of radioiodine refractory, advanced, and progressive thyroid cancer. Onco Targets Ther 2016; 9 : 6467–6477.
30. Vlček P, Kubáčková K. Vzácné endokrinní nádory. In: Kubáčková K et al. Vzácné nádory v onkologii. Mladá fronta: Praha 2015 : 133–153. ISBN 978–80–204–3658–0.
31. Machens A, Holzhausen HJ, Dralle H. The prognostic value of primary tumor size in papillary and follicular thyroid carcinoma. Cancer 2005; 103(11): 2269–2273.
32. Avram AM, Fig LM, Frey KA et al. Preablation 131-I scans with SPECT/CT in postoperative thyroid cancer patients: what is the impact on staging? J Clin Endocrinol Metab 2013; 98(3): 1163–1171. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–3630>.
33. Creach KM, Siegel BA, Nussenbaum B et al. Radioactive iodine therapy decreases recurrence in thyroid papillary microcarcinoma. ISRN Endocrinol 2012; 2012 : 816386. Dostupné z DOI: <http://dx.doi.org/10.5402/2012/816386>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 9- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
Úvodní slovo prof. MUDr. Michala Krška, CSc.,
spolueditora tohoto čísla časopisu Vnitřní lékařství - Onemocnění štítné žlázy v České republice: projekt EUthyroid a vyhodnocení epidemiologických dat VZP za období let 2012–2015
- Skríning tyreopatií v gravidite – odborné usmernenie v praxi
- Chlopenní vady při léčbě hyperprolaktinemie dopaminovými agonisty
- Hypotyreóza u pacientů se srdečním onemocněním
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Diagnostika a manažment metastatického feochromocytómu a paragangliómu
- Kvalita kosti u akromegalikov
- Syndróm neprimeranej antidiurézy (SIAD) a súčasný manažment hyponatriémie
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Primární hyperparatyreóza – nové klinické formy onemocnění
- Efekt antidiabetickej liečby na kosť
- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
-
Úvodní slovo prof. MUDr. Michala Krška, CSc.,
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Adenozín – mediátor s multisystémovými účinkami (alebo hormón?)
- Mužský hypogonadizmus indukovaný steroidními anaboliky: přehled poznatků a kazuistika
- Karcinomy štítné žlázy: současný pohled na diagnostiku a léčbu
- Primární hyperparatyreóza – nové klinické formy onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



