-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaTransplantace srdce a infekce
Heart transplantation and infection
Heart transplantation (HTx) is a method of treatment for patients with end-stage heart failure with severe symptoms despite complex therapy. Post-transplant difficulties include acute rejection and infectious complications, which are the most common reason of morbidity and mortality in the first year after heart transplant. It requires the patient to remain on immunosuppressive medication to avoid the possibility of graft rejection. Therefore the range of infection is much larger. The diagnosis and treatment of viral, bacterial and fungal infections is often difficult.
Key words:
heart transplantation – immunosuppression – infection
Autoři: Eva Ozábalová 1; Jan Krejčí 1; Petr Hude 1; Julius Godava 1; Tomáš Honek 1; Lenka Špinarová 1; Petr Pavlík 2; Helena Bedáňová 2; Petr Němec 2
Působiště autorů: I. interní kardio-angiologická klinika LF M U a FN u sv. Anny v Brně 1; Centrum kardiovaskulární a transplantační chirurgie, Brno 2
Vyšlo v časopise: Vnitř Lék 2017; 63(7-8): 535-539
Kategorie: Přehledné referáty
Souhrn
Ortotopická transplantace srdce (OTS) je již zavedenou léčebnou metodou u pacientů v terminálním stadiu srdečního selhání. V prvních měsících jsou pacienti ohroženi především akutními rejekcemi a infekčními komplikacemi, které jsou nejčastější příčinou morbidity a mortality v 1. roce po transplantaci. Z dlouhodobějšího hlediska je přežívání pacientů ovlivněno malignitami a vaskulopatií štěpu, nicméně doživotní užívání imunosupresivní medikace s sebou nese trvale zvýšené riziko infekcí. Možný je výskyt nejen běžných komunitních infekcí, ale v důsledku četných hospitalizací také nozokomiálních nákaz; často se setkáváme i s různými oportunními infekcemi, které bývají nezřídka spojeny s obtížnější diagnostikou a léčbou.
Klíčová slova:
imunosuprese – infekce – transplantace srdceÚvod
Transplantace srdce má již dlouhodobě své místo v léčbě vybraných pacientů s terminálním srdečním selháním [1]. Úspěšnost této terapie se výrazně zlepšila především po zavedení moderní imunosupresivní terapie, která brání vzniku rejekcí transplantátu. Mezi nežádoucí účinky této léčby patří kromě jiného i riziko vzniku infekčních komplikací. V prvních měsících po úspěšné srdeční transplantaci je významně vyšší pravděpodobnost rozvoje akutní rejekce štěpu [2], proto je nutné držet hladinu imunosupresiv v tomto období na vyšších hodnotách než v celém dalším potransplantačním průběhu. Zavedení nových imunosupresivních léků vedlo k poklesu výskytu akutních rejekcí, ale na druhou stranu přibylo infekčních komplikací [3,4]. Pacienti jsou ohroženi nejen běžnými komunitními, ale především i mnohými oportunními infekcemi z řad bakteriálních, virových, ale i mykotických agens. Četnější hospitalizace před, ale i po transplantaci znamenají pro pacienta zvýšené riziko nozokomiálních nákaz.
Pacienti a výsledky
Historie srdečních transplantací v brněnském transplantačním centru sahá do roku 1992, kdy byla provedena první úspěšná ortotopická transplantace srdce (OTS) u dospělého pacienta. Od té doby bylo do konce roku 2016 transplantováno 549 srdcí, jak uvádí graf 1.
Graf 1. Počet OTS na CKTCH v Brně 
Ke stejnému datu bylo zaznamenáno celkem 259 úmrtí. Příčiny úmrtí v časovém horizontu ukazuje graf 2.
Graf 2. Příčiny úmrtí po OTS v Brně (1992–30.12. 2016) 
V prvním měsíci po OTS zemřelo 30 pacientů, z toho 6 pro akutní rejekci a 24 úmrtí bylo v důsledku multiorgánového selhání (MOS). Od 30. dne do 1 roku po transplantaci jsme zaznamenali 16 úmrtí, z toho 9 v důsledku akutních rejekcí a u 7 pacientů došlo k MOS. Do 3. roku od transplantace zemřelo dalších 7 pacientů pro rejekční epizodu nereagující na antirejekční léčbu. Tyto závažné rejekce, které vedly ke smrti nemocných, se objevovaly především v počátcích našeho transplantačního programu. Významný vliv na pokles výskytu rejekcí mělo jistě i zavedení dalších imunosupresivních léků, které se dnes používají nejčastěji v základní trojkombinaci (kortikosteroidy, kalcineurinové inhibitory – takrolimus nebo cyklosporin, antiproliferativní agens – mykofenolát mofetil).
Druhou nejčastěji se vyskytující komplikací v časném posttransplantačním průběhu bývají právě infekce. V souladu s daty z mezinárodního registru International Society for Heart and Lung Transplantation (ISHLT) jsou i data z našeho centra. V časném pooperačním období zemřelo na našem pracovišti 10 pacientů na septický šok. Ještě závažnější bylo období po 1. měsíci, kdy do 1. roku od OTS zemřelo dalších 33 pacientů na infekční komplikace. V následujícím 2letém období jsme zaznamenali 12krát úmrtí z infekčních příčin. V dalších dvou 5letých časových intervalech zemřelo 6, resp. 7 pacientů na infekce.
Etiologie infekcí se u pacientů po OTS mění v časovém průběhu po srdeční transplantaci [5]. Největším rizikem v časném posttransplantačním období bývá Cytomegalovirus, který byl v našem souboru příčinou úmrtí u 9 pacientů. Z dalších vysoce rizikových agens bývá popisován Pneumocystis jirovecii, který způsobuje především intersticiální pneumonie. Tento patogen způsobil u 3 z našich pacientů těžké infekce, které skončily smrtí.
Závažnou a často fatální infekcí bývá pro imunosuprimované pacienty Aspergillus, který jsme identifikovali jako příčinu 13 úmrtí. Přechodný nárůst těchto infekcí byl s velkou pravděpodobností spojen s prováděnými stavebními úpravami v naší nemocnici v bezprostřední blízkosti našeho pracoviště.
Nejčastěji se vyskytující infekční agens po OTS
Cytomegalovirus
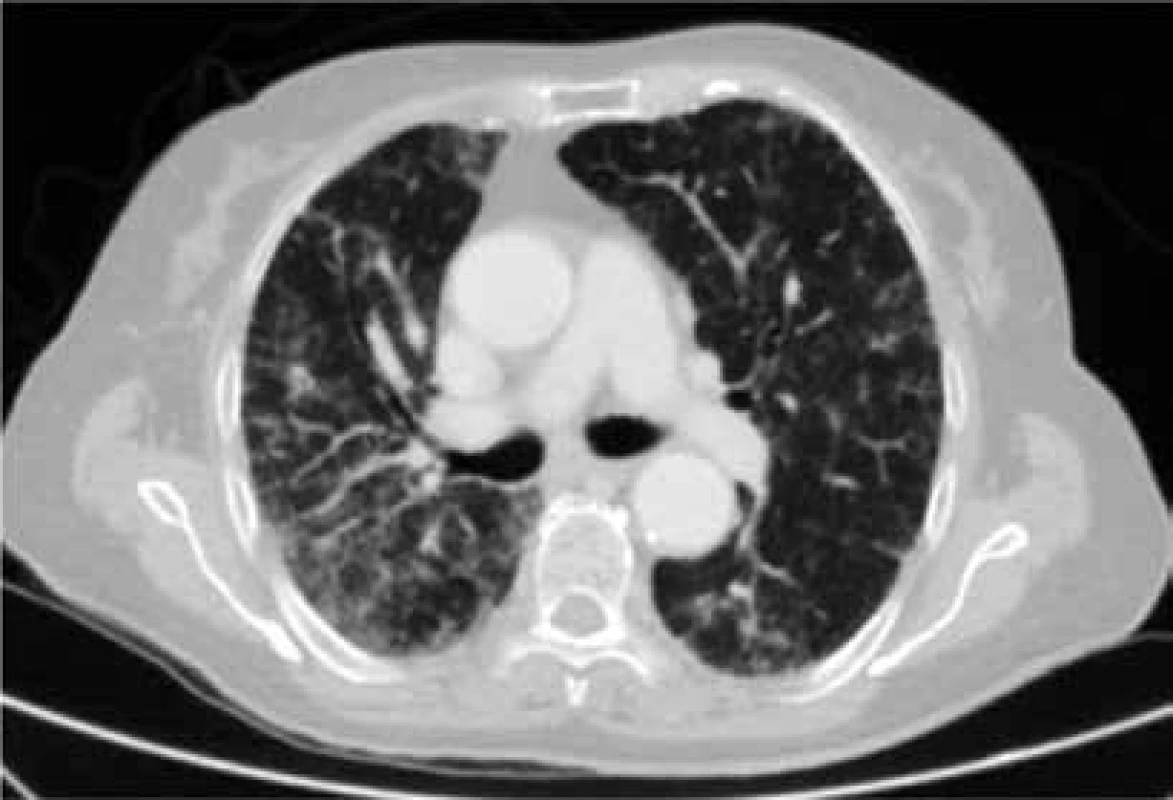
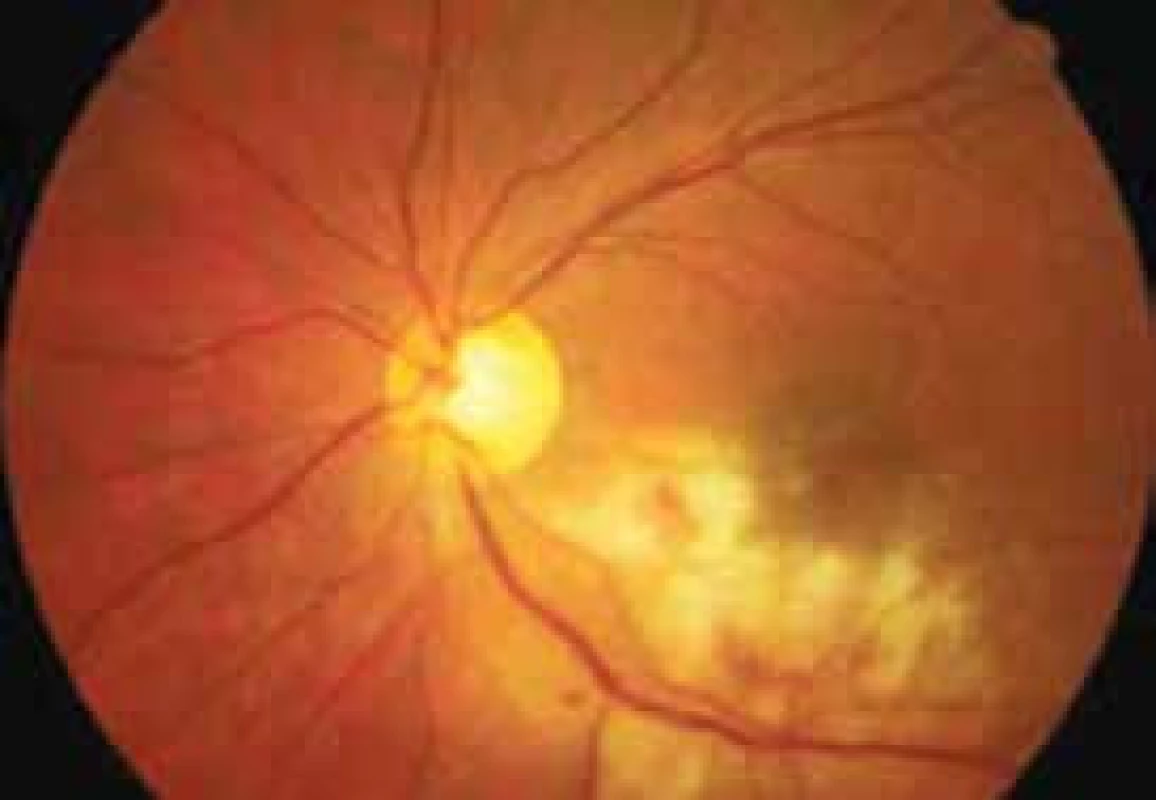
Z virových agens u pacientů po OTS jednoznačně dominuje Cytomegalovirus (CMV). Tento virus se vyskytuje až u 60 % zdravé populace a dokonce u 90 % imunokompromitovaných jedinců [6]. Infekce probíhá pod obrazem chřipky či syndromu připomínající infekční mononukleózu, při klinickém vyšetření tedy pozorujeme zvětšená játra a lymfatické uzliny, v laboratorních odběrech pak zvýšené hodnoty jaterních testů. Zvláště u pacientů s poruchou imunity, mezi které patří i pacienti po srdeční transplantaci a vzhledem k nutnosti doživotního užívání imunosupresivní terapie může být cytomegalovirovou infekcí postižen kterýkoliv orgán. Nejčastěji postihuje plíce jako intersticiální proces (obr. 1), dále může vyvolat gastroenteritidu, vzácněji dochází i k poškození očí (obr. 2) či mozku [7,8]. Samotný CMV ještě více oslabuje imunitu, což vede k riziku tzv. oportunních (doprovázejících) infekcí bakteriálních, virových i mykotických, proto někdy bývá nutná kombinovaná antivirová, antibiotická i antimykotická terapie. Z dlouhodobého hlediska je Cytomegalovirus dáván do souvislosti s rozvojem vaskulopatie štěpu [9].
Průkaz cytomegalovirové infekce je možný pomocí protilátek ze séra, přesnější bývá stanovení a kvantifikace metodou PCR.
Základem antivirové léčby bývá ganciklovir, který se podává v dávce 5 mg/kg i.v. 2krát denně, nebo valganciklovir, který může být i v perorální formě 900 mg 2krát denně. Léčba vedoucí k dosažení dvou negativních výsledků odběrů PCR CMV většinou trvá 2 týdny. Vzhledem k četnosti výskytu Cytomegaloviru u pacientů po OTS jsou všeobecně uznávány 2 možnosti léčby. Tzv. preemptivní podávání představuje častou a pečlivou monitoraci PCR CMV a při nárůstu počtu kopií se zahajuje léčba. Druhý přístup znamená profylaktické podávání (většinou po dobu 3–6 měsíců po OTS) perorální formy valgancikloviru v dávce 450 mg 1krát denně všem pacientům po transplantaci (s výjimkou CMV negativních dárců a CMV pozitivních příjemců štěpu) [10,11].
Invazivní aspergilóza
Invazivní aspergilóza (IA) je u pacientů po srdeční transplantaci nejčastější invazivní mykotické onemocnění. Incidence se dle různých prací pohybuje v rozmezí 1–14 %; mortalita tohoto onemocnění je vysoká a pohybuje se mezi 53–78 % [12]. Většinou se vyskytuje sporadicky, nicméně je popsána řada případů propuknutí nozokomiálních nákaz, zejména v nemocnicích po rekonstrukci, resp. s probíhající stavbou v blízkosti. Aspergily se přirozeně vyskytují v půdě, v prachu, stavebních materiálech, a dokonce ve vodě [13]. Nezávislými rizikovými faktory pro propuknutí infekce jsou reoperace, cytomegalovirová infekce, posttransplantační hemodialýza a výskyt invazivní aspergilózy 2 měsíce před datem transplantace. U pacientů po transplantaci ledviny se také prokázala silná korelace mezi IA a dávkou kortikosteroidů, zejména při průměrné dávce ≥ 1,25 mg/kg/den [14].
Nejčastější branou vstupu infekce je inhalační cesta, proto invazivní aspergilóza postihuje převážně plíce (80–90 %). Aspergilóza paranazálních dutin (invazivní sinoorbitální aspergilóza) a CNS (nitrolební aspergilóza) jsou další 2 nejčastější lokalizace. Při generalizaci procesu může být však postižen jakýkoli orgán (ledviny, slezina atd). Kožní forma invazivní aspergilózy patří mezi méně časté. Klinický stav vzbuzující podezření na invazivní aspergilózu není specifický. Podezření na IA vzbudí neustupující horečka i přes léčbu ATB, kašel, bolest na hrudi, dušnost, ev. hemoptýza. Při invazivní sinoorbitální aspergilóze dominují příznaky z postižení paranazálních dutin (horečka, kašel, epistaxe, bolest hlavy, výtok z nosu, lokální bolest, bolest v krku, atd) a při nitrolební aspergilóze nespecifické známky postižení CNS (alterace vědomí, křeče, atd). Projevy při diseminaci infekce do jiných než výše zmíněných tkání pak mohou mít specifické projevy dle lokalizace [15,16].
Klíčovým bodem úspěchu péče o pacienty s touto život ohrožující infekcí je správné a časné stanovení diagnózy a následné časné podání účinné antimykotické léčby.
Nativní zadopřední RTG snímek hrudníku je z diagnostického hlediska IA relativně málo přínosný. Morfologie RTG nálezu je nespecifická a velmi různorodá. Patologický nález se často objevuje až pozdně. Proto nelze i při negativitě RTG nálezu plicní mykózu vyloučit a je nutné indikovat CT vyšetření. Typickým CT nálezem bronchoinvazivní aspergilózy je obraz „rašícího stromu“ (tree in bud), ale mohou se objevit i nálezy „mléčného skla“ (ground glass), nebo lobární kondenzace. Angioinvazivní aspergilóza má typický počáteční nález „halo sign“(obr. 3), světlejší zónu charakteru mléčného skla (ground-glass attenuation), obkružující nodulární nebo masivní konzolidaci plicní tkáně. Postupným vývojem dochází k retrakci infarktového centrálního ložiska s absorpcí nekrotických hmot na periferii a vzniklý prostor je následně vyplněn vzduchem, což vytváří na CT obraz „air-crescent sign“ (obr. 4) . Tento nález lze považovat za typický pro pozdější stadium IPA, diagnostický význam má však jen u odpovídajícího klinického stavu imunoalterovaných nemocných. Vzhledem k tomu, že nejčastěji bývají infekcí postiženy plíce, provádí se bronchoalveolární laváž. Získaný materiál je vhodný k vyšetření sérologickému (GM), PCR, kultivačnímu a cytologickému. Ze všech nekultivačních metod má v současné době jednoznačné definované a zásadní místo v diagnostice invazivní aspergilózy sérologický test využívající detekci galaktomananu [15,17].
Obr. 3. Halo sign u invazivní aspergilózy (IA) 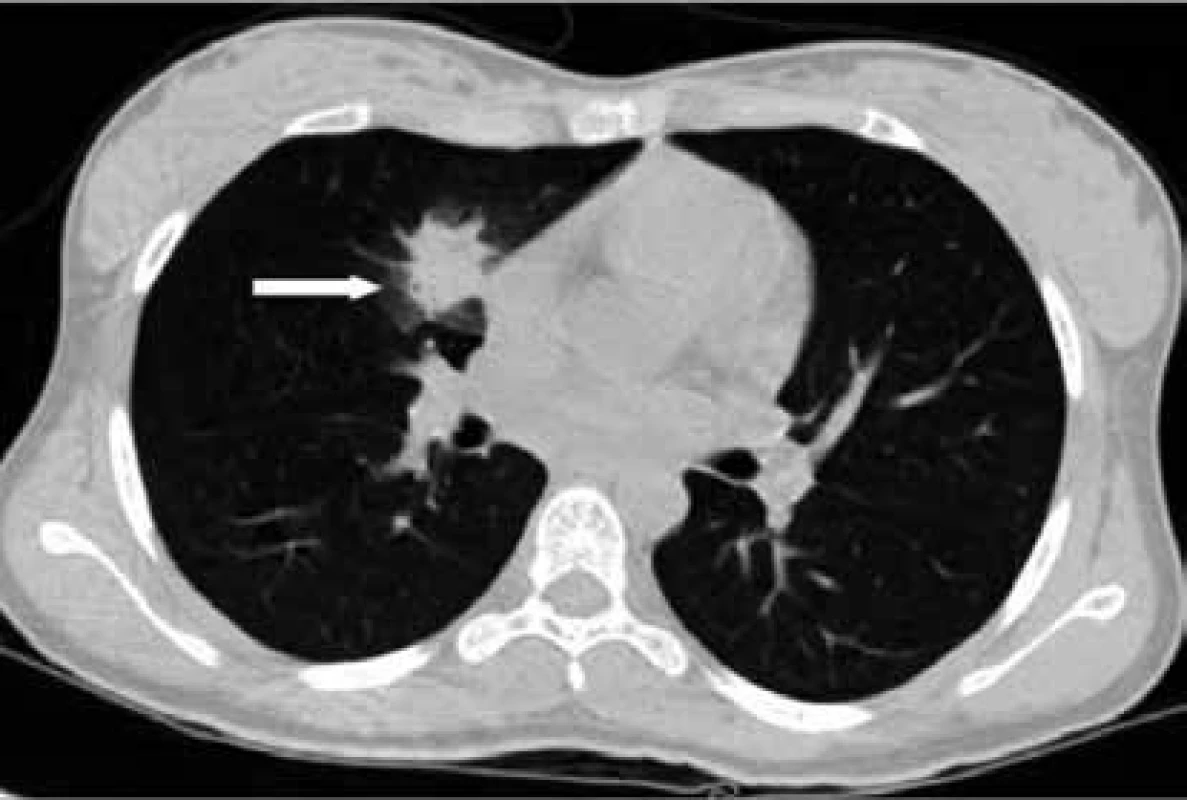
Obr. 4. Air-crescent sign u IA 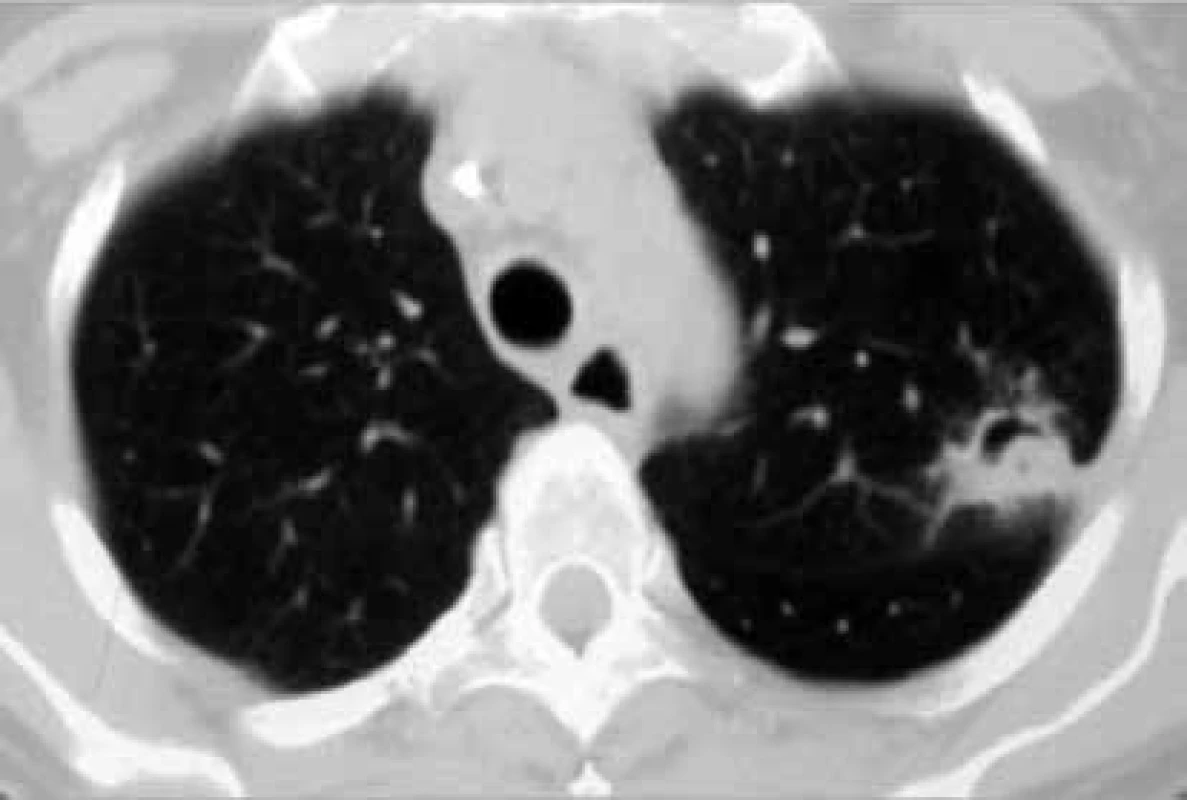
Základem léčby je antimykotická terapie. Nejvíce užívaným preparátem je vorikonazol (6 mg/kg i.v. 2krát denně 1. den, následovně 4 mg/kg i.v. 2krát denně minimálně 7 dní, poté s možností přechodu na p.o. léčbu v dávce 200 mg 2krát denně). Po celou dobu léčby je nutná pravidelná kontrola imunosupresiv, stejně je doporučována i kontrola hladiny vorikonazolu. Kombinovaná antimykotická léčba vorikonazolem s kaspofunginem, resp. mikafunginem s amfoteriny na lipidových nosičích je v případě selhání monoterapie možná [18,19].
Diskuse
Rejekční příhody a infekční komplikace představují v časném období po srdeční transplantaci největší riziko [20]. Současná kombinovaná imunosupresivní terapie sice vede ke snížení výskytu závažných rejekcí, nicméně se spolupodílí s doporučovanou antiinfekční profylaxí na vyšším riziku dřeňového útlumu, což paradoxně zvyšuje pravděpodobnost jiných závažných infekcí [21].
Na našem pracovišti jsme se setkali s několika závažnými cytomegalovirovými infekcemi, které nejčastěji probíhaly pod obrazem pneumonie. Parenterální antivirová léčba s modifikací imunosupresivní terapie vedla většinou k úspěšné léčbě. Přesto jsme bohužel zaznamenali i několik úmrtí. Většinou byly tyto příhody doprovázeny bakteriální superinfekcí a vyžádaly si přidání specifické antibiotické terapie do kombinace. U těchto pacientů pak následuje výrazné „polevení“ v imunosupresivní terapii, v důsledku čehož se po určité době zvyšuje riziko rejekcí. Pečlivé a opakované porovnání rizika infekcí a rejekcí je tedy zásadním momentem určujícím intenzitu imunosupresivní léčby stejně jako práh pro zahájení protiinfekční léčby. Zavedení profylaktického podávání valgancikloviru snižuje zvláště u rizikových pacientů (nejrizikovější kombinací je séropozitivní dárce a séronegativní příjemce) pravděpodobnost infekce [22–24]. Nicméně může být doprovázeno leukopenií, takže je vyžadována pravidelná kontrola krevního obrazu. Při poklesu počtu leukocytů je někdy nutné redukovat podávání dalších myelotoxických preparátů, jako je např. mykofenolát mofetil, případně zvažujeme i předčasné ukončení profylaxe [25]. Dle některých prací je ale tento krok spojen s vyšším rizikem cytomegalovirové reaktivace [26].
Podle našich vlastních zkušeností se pravděpodobně v souvislosti s probíhajícími stavebními pracemi v areálu nemocnice v těsné blízkosti našeho pracoviště přechodně zvýšil výskyt invazivní aspergilózy, kterou jsme do té doby vídali spíše sporadicky. V literatuře bývá popisován tento nárůst právě v důsledku stavební činnosti [27]. Narůst počtu těchto závažných infekcí vedl na našem pracovišti k zavedení rutinního aktivního screeningu u všech, a to i u dosud asymptomatických nemocných. Tato opatření spolu s ukončením stavebních prací vedla k ústupu výskytu aspergilózy, resp. k jejich časnějšímu záchytu a úspěšnější léčbě.
Závěr
Transplantace srdce představuje pro pacienty v terminálním stadiu srdečního selhání unikátní možnost zlepšení kvality života a jeho prodloužení. Rizika spojená s podáváním imunosupresivní terapie, ať už se jedná o infekční komplikace při nadměrné imunosupresi nebo rejekce při její nedostatečné intenzitě, je nutné neustále monitorovat. Kromě rutinních mikrobiologických screeningů je důležitý i samotný postoj pacienta a dodržování režimových opatření a doporučení po srdeční transplantaci. Imunosuprimovaný pacient je ohrožen nejrůznějšími typy infekcí, proto je velmi důležitá včasná diagnostika a detekce infekčního agens. V případě nutnosti nasazení antiinfekční terapie je zásadní myslet na možné interakce této léčby s imunosupresivy a při jakýchkoliv pochybách je nezbytné kontaktovat transplantační centrum k úpravě jejich dávkování.
MUDr. Eva Ozábalová, Ph.D.
eva.ozabalova@fnusa.cz
I. interní kardio-angiologická klinika LF MU
a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 22. 5. 2017
Přijato po recenzi 20. 6. 2017
Zdroje
1. Lund LH, Edwards LB, Dipchand AI et al. The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation: Report – 2016; Focus Theme: Primary Diagnostic Indications for Transplant. J Heart Lung Transplant 2016; 35(10): 1158–1169. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2016.08.017>.
2. Delgado JF, Sánchez V, de la Calzada CS. Acute rejection after heart transplantation. Expert Opin Pharmacother 2006; 7(9): 1139–1149. Dostupné z DOI: <http://dx.doi.org/10.1517/14656566.7.9.1139>.
3. Gurguí M, Muňoz P. Infection in heart transplantation. Enferm Infecc Microbiol Clin 2007; 25(9): 587–597.
4. Montoya JG, Giraldo LF, Efron B et al. Infectious complications among 620 consecutive heart transplant patients at Standford University Medical Center. Clin Infect Dis 2001; 33(5): 629–640.
5. Fishman JA. Infection in solid-organ transplant recipient. NEJM 2007; 357(25): 2601–2614.
6. Sanchez-Lazaro IJ, Almenar L, Blanes M et al. Timing, etiology and location of first infection in first year after heart transplantation. Transplant Proc 2010; 42(8): 3017–3019. Dostupné z DOI: <http://dx.doi.org/10.1016/j.transproceed.2010.07.052>.
7. Melero-Ferrer J, Sanchez-Lazaro IJ, Navea-Tejerina A et al. Repeated CMV Infection in a Heart Transplantation Patient. Case Rep Transplant 2012; 2012 : 305920. Dostupné z DOI: <http://dx.doi.org/10.1155/2012/305920>.
8. Doesch AO. Infections after Heart Transplantation. Transplantationsmedizin 2011; 23 : 115–117. Dostupné z WWW: http://www.transplantation.de/fileadmin/transplantation/txmedizin/txmedizin_2011_2/05_doesch.pdf>.
9. Johansonn I, Andersson R, Friman V et al. Cytomegalovirus infection and disease reduce 10-year cardiac allograft vasculopathy-free survival in heart transplant recipients. BMC Infect Dis 2015; 15 : 582. Dostupné z DOI: <http://dx.doi.org/10.1186/s12879–015–1321–1>.
10. Hummel M. Early postoperative therapy after heart transplantation: Prophylaxis, diagnosis and antibiotic, antimycotic and antiviral therapy of infections. ACP 2011; 15 : 245–255.Dostupné z WWW: <http://www.applied-cardiopulmonary-pathophysiology.com/fileadmin/downloads/acp-2011–4_20111229/09_hummel.pdf>.
11. Hodson EM, Jones CA, Webster AC et al. Antiviral medications to prevent cytomegalovirus disease and early death in recipients of solid-organ transplants: a systemic review of randomised controlled trials. Lancet 2005; 365(9477): 2105–2115.
12. Muñoz P, Rodríguez C, Bouza E et al. Risk Factors of Invasive Aspergillosis after Heart Transplantation:Protective Role of Oral Itraconazole Prophylaxis. Am J of Transpl 2004; 4(4): 636–643.
13. Hajjeh RA, Warnock DW. Counterpoint: invasive aspergillosis and the environment – rethinking our approach to prevention. Clin Infect Dis 2001; 33(9): 1549–1552.
14. Gustafson TL, Schaffner W, Lavely G et al. Invasive aspergillosis in renal transplant recipients: correlation with corticosteroid therapy. J Infect Dis 1983; 148(2): 230–238.
15. Ráčil Z, Mayer J, Cetkovský P et al. Invazivní aspergilóza: současné možnosti diagnostiky. Vnitř Lék 2007; 53(Suppl): S1-S34.
16. Taccone FS, Van Den Abeele AM, Bulpa P et al. Epidemiology of invasive aspergillosis in critically ill patients: clinical presentation, underlying conditions, and outcome. Crit Care 2015; 19 : 7. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–014–0722–7>.
17. Musher B, Fredricks D, Leisenring W et al. Aspergillus Galactomannan Enzyme Immunoassay and Quantitative PCR for Diagnosis of Invasive Aspergillosis with Bronchoalveolar Lavage Fluid. J Clin Microbiol 2004; 42(12): 5517–5522.
18. Ráčil Z, Mayer J, Kocmanová I et al. Léčba invazivní aspergilózy – doporučení odborných společností. Vnitř Lék 2008; 54(12): 1187–1194.
19. Denning DW. Therapeutic Outcome in Invasive Aspergillosis. Clin Infect Dis 1996; 23(3): 608–615.
20. Preiksaitis JK, Green M, Avery RK et al. Guidelines for the prevention and management of infectious complications of solid organ transplantation. Am J Transplant 2004; 4(Suppl 10): S5-S166.
21. Pazdernik M, Malek I, Koudelkova E et al. Bone marrow suppression and associated consequences in patients after heart transplantation: A 6-year retrospective review. Biomed Pap Med Fac Univ Palacky Olomouc 2015; 159(3): 372–377. Dostupné z DOI: <http://dx.doi.org/10.5507/bp.2015.022>.
22. Kotton CN, Kumar D, Caliendo AM et al. International consensus guidelines on the management of cytomegalovirus in solid organ transplantation. Transplantation 2010; 89(7): 779–795. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181cee42f>.
23. Costanzo MR, Dipchand A, Starling R et al. The international society of heart and lung transplantation guidelines for the care of heart transplant recipients. J Heart Lung Transplant 2010;29(8): 914–956. Dostupné z DOI: <http://dx.doi.org/10.1016/j.healun.2010.05.034>.
24. Muňoz P, Crespo Leiro MG. Prophylaxis of cytomegalovirus infection in heart transplantation. Enferm Infecc Microbiol Clin 2011; 29(Suppl 6): S52-S55. Dostupné z DOI: <http://dx.doi.org/10.1016/S0213–005X(11)70059–3>.
25. Sun HY, Wagener M, Singh N. Prevention of posttransplant cytomegalovirus dinase and related outcomes with valganciclovir: a systemic review. Am J of Transpl 2008; 8(10): 2111–2118. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2008.02369.x>.
26. Kalil AC, Levitsky J, Lyden E et al. Metaanalysis: the efficacy of strategies to prevent organ disease by cytomegalovirus in solid organ transplant recipients. Ann Intern Med 2005; 143(12): 870–880.
27. Cahil BC, Hibbs JR, Savik K et al. Aspergillus Airway Colonization and Invasive Disease After Lung Transplantation. Chest 1997; 112(5): 1160–1164.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek PCR diagnostika infekcíČlánek Nozokomiální pneumonie
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2017 Číslo 7-8- Rozpoznejte periferní neuropatii – dotazník pro pacienty, podpora pro lékaře
- Vitamin B12 − mnoho různých forem, žádný rozdíl v absorpci
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Tři jsou více než jeden: Kombinace 3 vitaminů skupiny B prodlužuje délku neuritů
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- 140. internistický den – XXVII. Vanýskův den – program
- Historie a současnost léčby hepatitid B a C
- PCR diagnostika infekcí
- Nozokomiální infekce a antibiotická rezistence v současnosti
- Vývoj názorů na patofyziologii sepse
- Cytomegalovirová a polyomavirová infekce po transplantaci ledviny
- Virová hepatitida A – možný diferenciálně diagnostický a terapeutický problém
- Infekce HIV jako nové onemocnění vnitřního lékařství
- Myokarditidy a zánětlivé kardiomyopatie
- Komunitní pneumonie – základy diagnostiky a léčby
- Nozokomiální pneumonie
- Infekční komplikace u transplantací jater
- Virová hepatitida C a transplantace orgánů
- Transplantace srdce a infekce
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Nozokomiální pneumonie
- PCR diagnostika infekcí
- Nozokomiální infekce a antibiotická rezistence v současnosti
- Komunitní pneumonie – základy diagnostiky a léčby
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání