-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
Suplemented restricted diet in old patients with chronic renal disease
In last decades was confirmed remarkable increase in number of old patients with chronic kidney disease. Despide of developments in dialysis technology and kidney transplantation there is a growing number of old patients who are not suitable for these methods. Recently were published data showing long-term effect of protein restricted diet supplemented with keto amino acids in elderly. Based on our results obtained in re-analysis of 3 000 patients we can confirm also good compliance and low risk of malnutrition.
Key words:
chronic kidney disease – keto amino acids – old age – restricted diet
Autoři: Vladimír Teplan 1,2
Působiště autorů: Subkatedra nefrologie IPVZ, Praha 1; Interní klinika LF OU, Ostrava 2
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 6): 88-96
Kategorie: Přehledné referáty
Souhrn
V posledních desetiletích se významně zvýšil počet nemocných ve vyšších a vysokých věkových kategoriích se závažným onemocněním ledvin. Přes rozvoj dialyzačních technologií a transplantačního programu proto přibývá nemocných, u kterých biologický věk s dalším orgánovým poškozením neumožňuje úspěšnou transplantaci ledviny, ale často ani dlouhodobou léčbu v dialyzačním programu. V posledním údobí se objevily studie o úspěšné dlouhodobé konzervativní léčbě s podáváním modifikovaných restriktivních nízkobílkovinných diet doplněných suplementy u nemocných starších 80 let. Naše předchozí studie u více než 3 000 nemocných prokázaly, že starší nemocní mohou velmi dobře tolerovat nízkobílkovinnou dietu doplněnou ketoanalogy esenciálních aminokyselin, která pomáhá dlouhodobě stabilizovat metabolický stav nemocných. Navíc při většinou dobré komplianci je riziko skryté malnutrice nízké.
Klíčová slova:
chronické onemocnění ledvin – ketoanaloga – restriktivní dieta – vyšší věkÚvod
Celosvětově se prodlužuje věk Existuje předpoklad, že v letech 2010 -2050 budou lidé ve věku 65 let a starší tvořit 7,7 -16,2 % světové populace a v tzv. rozvinutých zemích to bude dokonce 15,9–26,1 %. Významný vzestup se očekává především v populaci 80letých a starších, a to v rozmezí 1,6–4,4 % celosvětově či dokonce 4,3–9,4 % v rozvinutých zemích. I když bude tato generace heterogenní, řada seniorů bude trpět podobnými onemocněními ovlivňujícími metabolický stav organizmu, a tudíž vyžadujícími speciální nutriční péči. Může se jednat o doporučení k restriktivní dietě, jako např. u nemocných s renální insuficiencí, diabetem a obezitou. Je přitom známo, že ve vyšším věku obecně klesá využitelnost živin z důvodů digesčních i metabolických. Není tedy obecně pravdou, že staří lidé mají jíst celkově méně. Jsou totiž náchylní k rozvoji „tiché“ malnutrice spojené s akcentací sarkopenie a psychické deteriorace. Zvláště výrazně se tyto malnutričně-dehydratační syndromy projeví při interkurentním onemocnění, které pak vede k závažnému rozvratu minerálového a vodního metabolizmu spojeného se syndromem dehydratace s psychickou alterací. Dehydratace vede dále k anorexii a apatii s navazujícími terminálními komplikacemi ve smyslu oběhového selhání. Složení stravy seniorů musí být vyvážené, neboť senioři hůře metabolizují proteiny i tuky. Sacharidy jsou sice nejlépe metabolizovány, ale pro často přítomnou hypofunkci pankreatu a diabetes mají svoje množstevní limity [1].
Pokud mají senioři vyšší BMI, lze vždy předpokládat vyšší zastoupení viscerálního tuku. Obecně ve věku nad 75 let ubývá svalové hmoty a při zachování vyššího příjmu energie dojde k zvětšení objemu tukové hmoty. Ta sice představuje energetické depo pro případ nouze, ale využitelnost těchto energetických zásob v akutních stavech také klesá. Více ohrožuje svého nositele aktivací adipocytokinů s proaterogenním účinkem, ale hlavně akcentací inzulinové rezistence. Selektivní úbytek tukové hmoty je proto žádoucí, ale určitě nelze doporučit přísně redukční diety navozující katabolizmus. Úbytek musí být pozvolný a spojený s aktivací svalové hmoty pravidelným cvičením.
V poslední době také významně roste počet nemocných v preterminální fázi chronické renální insuficience, u kterých se stále více diskutuje, zda zahájit pravidelnou dialyzační léčbu, či ponechat nemocné na konzervativní léčbě při úrovni reziduální glomerulární filtrace kolem 10 ml/min (0,17 ml/s), což je u seniorů vysokých věkových skupin souměřitelné až s dvojnásobnou hodnotou u mladých jedinců. Z hlediska mechanizmu účinku nízkobílkovinných diet je však otázkou, zda může úbytek proteinů v dietě ještě pozitivně ovlivnit hemodynamiku glomerulu – tedy zvýšený intraglomerulární tlak (při nefrosklerotickém poškození velkého množství glomerulů). Určitě však nelze doporučit nižší příjem proteinů než 0,6 g kvalitního proteinu/kg tělesné hmotnosti/den, a to ještě za podmínky doplnění např. ketoanalogy esenciálních aminokyselin. Jinak příjem nesmí klesnout pod 0,8 g/kg tělesné hmotnosti/den. Uvedená doporučení však vycházejí z tzv. ideální tělesné hmotnosti, která byla opět stanovena pro mladší jedince. Jaká je optimální hmotnost člověka ve věku např. 80 let, není známo (navíc se zcela mění výškové a váhové poměry nezbytné pro výpočet). Výpočty glomerulární filtrace dle MDRD (modification of diet in renal disease) jsou u seniorů zatíženy značnou chybou danou i nestejným obsahem svalové hmoty u stejně kalendářně starých (ale biologicky ještě odlišných) jedinců.
Onemocnění ledvin u seniorů a nutriční opatření
Více než polovina nemocných v dlouhodobém dialyzačním programu přesahuje svým věkem 65 roků a rychle přibývá pacientů ve věkové kategorii stáří, tj. nad 75 let [2]. Přes rozvoj dialyzačních technologií a transplantačního programu proto přibývá nemocných, u kterých biologický věk s dalším orgánovým poškozením neumožňuje úspěšnou transplantaci ledviny. Pro četné orgánové komorbidity je jejich prognóza špatná i při použití současných technologií dialyzační léčby. Vázne i kompartment sociálních služeb a celková kvalita života klesá. V posledních letech se objevily studie o úspěšné dlouhodobé konzervativní léčbě s podáváním modifikovaných nízkobílkovinných diet doplněných ketoanalogy esenciálních aminokyselin u nemocných nad 80 roků věku [3]. Jejich více než 2letá prosperita při nízké hodnotě renální funkce kolem 10 ml/min (0,17 ml/s) ukazuje u indikovaných seniorů na možnost konzervativního léčení chronické renální insuficience (CKD 4–5) jako alternativu dlouhodobé dialyzační léčby. Navíc je třeba vzít v úvahu skutečnost, že ve stáří fyziologicky klesá hodnota glomerulární filtrace, která u seniorů vysokých věkových kategorii může činit kolem 50 % úrovně glomerulární filtrace ve věku 20–30 let. Snížená hodnota glomerulární filtrace proto musí být vztažena k věku pacientů. K podpoře léčebné alternativy konzervativní nefrologie přispívají i studie deklarující, že pozdější zahájení dialyzačního léčení u seniorů může prodloužit údobí kompenzace při konzervativní léčbě v predialýze a celkově prodloužit dobu aktivního života těchto nemocných [4].
Jsou také přítomny další změny elektrolytového a vodního metabolizmu, které jsou charakteristické pro vyšší seniorský věk [5]. V průběhu stárnutí dochází ke změnám v renálních funkcích, které mohou ovlivnit vylučování vody a elektrolytů. Je snížena schopnost konzervovat vodu následkem poklesu maximální koncentrační schopnosti ledvin. Stejně významné je i snížení schopnosti vyloučit nadbytek vody s následným nebezpečím její retence a vzniku intoxikace vodou vzhledem ke snížení glomerulární filtrace a koncentrační a zřeďovací schopnosti ledvin. Nálezy četných autorů jednoznačně nasvědčují tomu, že v průběhu stárnutí dochází k postupnému poklesu glomerulární filtrace (GF), což se zjišťuje při vyšetření této funkce na podklady clearance inulinu (Cin) stejně jako clearance endogenního kreatininu (CKr). Od 40 let věku nastává pozvolný pokles GF, který u jedinců ve věku 80–90 let dosahuje přibližně poloviční hodnoty proti jedincům ve věku mezi 20–30 lety. Tento pokles GF je důsledkem poklesu průtoku plazmy a krve ledvinou, neboť rovněž clearance paraaminohippurové kyseliny (PAH) v průběhu stárnutí významně klesá. U pacientů ve věku mezi 80–90 lety je dosahováno zhruba poloviční hodnoty proti mladým jedincům. Pokles Cin a CPAH je v průběhu stárnutí prakticky proporcionální, neboť poměr mezi těmito clearancovými hodnotami, označovaný jako filtrační frakce (FF), se v průběhu stárnutí nemění [6].
U seniorů je nutno počítat s měnící se energetickou potřebou a změnami v intermediárním metabolizmu: nevyvážená výživa může být příčinou řady druhotných nemocnění, která negativně ovlivňují možnosti rehabilitace. S postupujícím věkem energetická potřeba klesá paralelně s hodnotami základního i namáhavého metabolizmu. Celková potřeba energie závisí na energetickém výdeji, který je nižší, takže skutečná energetická potřeba je jen asi dvoutřetinová v porovnání s mladým člověkem (25 roků). Ve vyšším věku dochází k některým metabolickým změnám, ke kterým je nutno při léčbě přihlížet. Obvyklá strava starých osob bývá nevyvážená ve svém složení, má většinou příliš vysoký obsah energie a nadbytek tuků, ale nedostatečný podíl kvalitních bílkovin, který může vést k typickým příznakům malnutrice. Jako projev stárnutí se významně uplatňují změny endokrinního systému a je důležité znát reakci jeho složek ve stresových situacích (traumata, operace a náhlá těžká onemocnění). Bývá zvýšena sekrece katecholaminů, hlavně sekrece adrenalinu. Jinak probíhá hormonální odpověď podobně jako u mladých osob. Lze předpokládat dostatečnou adaptibilitu na stres. Trávení a resorpce jsou méně efektivní a mohou být příčinou různých gastrointestinálních poruch. Malabsorpce a rezultující malnutrice mohou být zaviněny chronickou gastritidou, stavem po resekci žaludku nebo chronickou pankreatitidou. Se zhoršeným trávením a resorpcí je třeba počítat i při výživě podávané sondou: dostatečným zdrojem výživy mohou být chemicky nebo nutričně definované diety. U některých onemocnění lze ve stáří použít enterální výživu jako léčebnou metodu (dna, hyperlipoproteinemie), protože výživné směsi většinou neobsahují puriny ani cholesterol. Svalové tkáně ubývá, ze 44 % celkové tělesné hmotnosti v mládí na 27 % ve věku vyšším než 85 let. Antropometrie většinou zjišťuje ztluštění kožní řasy nad tricepsem a současně zmenšení obvodu paže (úbytek svaloviny). U starých lidí bývá omezena kapacita trávicích pochodů a resorpce. Zvýšená tělesná hmotnost může být zaviněna nesprávnou výživou (značný význam má také pokles tělesné aktivity). Se stoupající nadměrnou hmotností se zvyšuje výskyt některých dalších onemocnění, jako je diabetes mellitus, dna, hypertenze, ischemická choroba srdeční, poruchy periferní cirkulace i hyperlipidemie. Hlavním účelem léčebné výživy je dosáhnout i u seniorů ideální tělesné hmotnosti pro danou věkovou skupinu a zajistit optimální složení diety s doporučeným poměrem živin [7]. Přívod energie by měl odpovídat poměrům hmotnosti pacienta s přihlédnutím k příslušným faktorům, které se ve vysokém věku mohou uplatňovat. Při špatné komplianci lze užít u seniorů modifikovaného příjmu proteinů v dietě. Někteří autoři doporučují vložit do 7denního cyklu nízkobílkovinné diety 2 dny s vyšším obsahem bílkovin (až 1 g/kg tělesné hmotnosti/den). Dle našich zkušeností, s ohledem na dlouhodobý metabolický stav nemocných a jídelní stereotyp, vkládáme většinou 1krát týdně jídelní sestavu obsahující 0,8 g bílkoviny/kg tělesné hmotnosti/den. V ostatních případech dáváme raději přednost nutričnímu suplementu či při špatné komplianci a adherenci k dietě přechodu na volnější kontrolovanou dietu s obsahem 0,8 g bílkoviny/kg tělesné hmotnosti/den s omezeným obsahem fosfátů. V současné době populární vegetariánská dieta se do určité míry blíží původní italské resp. i bramboro-vaječné dietě německé. Na základě vegetariánské diety lze výhodně sestavit jídelní lístek pro všechny formy nízkobílkovinných diet. Pro nižší obsah esenciálních aminokyselin v některých vegetariánských pokrmech však musí být tyto diety suplementovány [8]. U diety přísně vegetariánské však nestačí samotný přísun rostlinné bílkoviny pokrýt základní potřebu esenciálních aminokyselin, a ty musí být bezpodmínečně suplementovány. Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich ketoanalogy a hydroxyanalogy (KA). Uskutečněné studie využily mechanizmu reverzibilní transaminace vybraných esenciálních aminokyselin [9]. Podáváním bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich ketoanalog a hydroxynalog vedlo jak k výraznému snížení příjmu exogenního dusíku do organizmu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a metionin. Ostatní esenciální aminokyseliny byly podávány ve své L formě (lysin, treonin a tryptofan), neboť jejich aminace v organizmu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrozin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu. Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před více než 50 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných v chronické renální insuficienci dodnes zcela vyřešena. U nás dostupné přípravky mají ketoanaloga vázána ve formě kalciových solí, což znamená při obsahu např. 50 mg kalcia v 1 tbl přípravku Ketosteril nezanedbatelný přísun kalcia [10]. Na úspěšnosti nízkobílkovinných (NB) diet se nepochybně podílí dlouhodobě vyrovnaná metabolická bilance nemocných, účinná léčba hypertenze a pravidelné kontroly konané v této fázi onemocnění lékařem nejméně 1krát měsíčně. Vedle základních laboratorních parametrů (kreatinin, urea, glomerulární filtrace, KO, sideremie, ev. při léčbě rh-EPO feritin či saturace transferinu, Na, K, Ca, P, kyselina močová, Astrup, glykemie, cholesterol, triacylglyceroly, močový sediment, bakteriurie, proteinurie/24 hod) musíme pravidelně kontrolovat základní parametry nutrice, tj. albumin, transferin ev. aminogram (resp. Whiteheadův kvocient, tj. poměr neesenciálních aminokyselin gly + glu + ser + tau a esenciálních aminokyselin leu + ileu + val + met). K základním údajům patří subjektivní pocity nemocného a jeho celková prosperita měřená antropometricky. Vedle tzv. adherence k dietě, kterou můžeme zhodnotit anamnesticky či lépe formou dotazníku, hodnotíme při nízkobílkovinné dietě tzv. komplianci podle odpadu urey a fosfátů do moči za 24 hod.
Funkce ledvin a metabolizmus aminokyselin
Poznatek o existenci poruchy metabolizmu bílkovin u nemocných s chronickým selháním ledvin má dlouholetou historii [11]. V souladu s historickou tezí Giordana lze predikovat: pokud organizmus dostává denně dostatečné množství esenciálních aminokyselin, stává se limitujícím faktorem pro udržení dusíkové rovnováhy dusík pocházející z neesenciálních aminokyselin. Za těchto podmínek může být využit ke stavbě bílkovin i dusík pocházející z močoviny. Utilizace dusíku urey u nemocných v chronické renální insuficienci může být relativně vysoká (30–40 %). Lepší využití aminokyselin při nedostatečném příjmu bílkovin je umožněno zvýšenou aktivitou proteosyntetických enzymů v játrech, snížením jejich oxidace a snížením aktivity enzymů ureového cyklu. Pro přepočet vyloučeného množství urey v moči na příjem bílkovin či aminokyselin je nutno vědět, že z 1 g bílkovin vzniká přibližně 5,5 mmol urey a 80 % vytvořené urey se vylučuje močí. K prakticky snadno dosažitelným indikátorům intenzity proteinového metabolizmu patří výpočet množství metabolizovaného (a za předpokladu vyrovnané metabolické bilance i přijatého) proteinu na podkladě množství urey vyloučené do moči v mmol za 24 hod: (Uurea × V) × 0,25 (za předpokladu, že se fekálně vylučuje u těchto nemocných kolem 0,031 g N/kg/den). Spektrum aminokyselin v séru se při renální insuficienci zásadně mění. Snižují se koncentrace esenciálních aminokyselin (EAK) s výjimkou fenylalaninu. Koncentrace neesenciálních aminokyselin (NEAK) se většinou naopak zvyšuje. Snižuje se také poměr EAK : NEAK. Toto snížení je však výrazně ovlivňováno stavem nutrice. Vylučování aminokyselin do moči se při renální insuficienci podstatně nemění, což je způsobeno – při snížené glomerulární filtrací – zvýšenou frakční exkrecí aminokyselin [12]. Koncentrace aminokyselin v séru závisí na jejich intracelulárním metabolizmu. Koncentrace volných aminokyselin je v intracelulární tekutině podstatně vyšší, než je v tekutině extracelulární. Tyto aminokyseliny pak mohou být transportovány do extracelulárního prostoru (např. při poklesu sérových hladin aminokyselin při ztrátách vyvolaných hemodialýzou). Snížené hladiny rozvětvených esenciálních aminokyselin jsou jedním z typických nálezů u nemocných v chronické renální insuficienci. Také hladina serinu může být významně snížena, neboť ledviny jsou hlavním místem jeho tvorby. Mohou být ovlivněny hladiny dalších hydroxyaminokyselin (glycin a treonin). Hladina alaninu a glutaminu bývá většinou normální a tyto aminokyseliny představují v postdigestční fázi hlavní zdroj dusíku pro ledviny a splanchnické orgány. Jejich hladina je výrazně ovlivňována dietou, stejně jako stupněm vychytávání (metabolizace) v uvedených orgánech. Stejně tak se zvyšují hladiny některých aminokyselin ureového cyklu (především citrulinu, zatímco arginin zůstává většinou normální), aminokyselin obsahujících síru (cystinu, homocysteinu event. cysteinu, zatímco hladina metioninu zůstává normální), prolinu, hydroxyprolinu a 3-metylhistidinu.
Pro malnutrici je typický pokles tělesné hmotnosti, tělesného tuku, svalové hmoty a intracelulární vody. Klesají hladiny albuminu, transferinu, cholinesterázy, komponent komplementového systému, především C3 složky. Stejně se snižují hladiny valinu, leucinu, izoleucinu, tryptofanu a tyrosinu, poměr celkových esenciálních aminokyselin k neesenciálním, valinu ke glycinu a tyrosinu k fenylalaninu, hladina glycinu je často zvýšena [13]. Tryptofan je jediná aminokyselina vázaná na bílkoviny séra a je mimořádně významná z hlediska zahájení proteosyntézy. Koncentrace tryptofanu v séru při chronické renální insuficienci bývá normální nebo lehce snížená. Mění se však poměr volného a vázaného tryptofanu. Koncentrace vázaného tryptofanu se snižuje, zvyšuje se koncentrace volného tryptofanu. Tryptofan je zdrojem indolových látek, jejichž koncentrace se v renální insuficienci zvyšuje. Porucha metabolizmu fenylalaninu a tyrozinu je známa již delší dobu. Uvádí se, že zvýšená hladina fenylalaninu, jeho zpomalená metabolizace a snížený poměr tyrozinu k fenylalaninu, mohou být způsobeny jak snížením hladiny ledvinné fenylalaninhydroxylázy, tak změnou intra-extracelulární distribuce. Je známou skutečností, že histidin je esenciální aminokyselinou pro nemocné v chronické renální insuficienci. Jeho plazmatické koncentrace bývají nízké, buď pro sníženou syntézu jeho prekurzoru (kyselině imidasolpyrohroznové) nebo sníženou schopnost transaminovat tuto ketokyselinu (snížená aktivita transketolázy v chronické renální insuficienci).
Závažný příspěvek v hodnocení metabolického stavu nemocných v chronické renální insuficienci přinesly studie zabývající se intracelulární koncentrací aminokyselin, především ve svalové hmotě. Jak známo, kosterní svaly představují hlavní zásobní zdroj volných aminokyselin. V chronické renální insuficienci se mění extra-intracelulární distribuce některých aminokyselin, takže plazmatické hladiny nejsou odpovídajícím odrazem hladin intracelulárních. Tato skutečnost se např. týká pro metabolizmus velice důležitých tzv. rozvětvených aminokyselin, leucinu, izoleucinu a valinu. Při snížené plazmatické hladině těchto 3 aminokyselin byly popsány normální intracelulární koncentrace leucinu a izoleucinu (valin byl snížen) a tyto rozdíly přetrvávaly i při dlouhodobé nízkobílkovinné dietě doplněné esenciálními aminokyselinami. Selektivní deplece valinu, a to přes jeho vysoký příjem, ukazovala, že tato aminokyselina byla zvýšeně katabolizována a při uvedené suplementaci esenciálních aminokyselin vznikl mezi valinem a leucinem s izoleucinem tzv. aminokyselinový antagonizmus. Podobně byla zjištěna výrazně snížená intracelulární hladina tyrosinu při relativně zvýšené hladině plazmatické. Treonin byl nalezen snížený jak v plazmě, tak ve svalu. Naproti tomu aminokyseliny ureového cyklu (citrulin, ornitin a arginin) byly nalezeny zvýšené jak ve svalu, tak v séru [14]. Je tedy zřejmé, že syntéza bílkovin v chronické renální insuficienci může být výrazně limitována intracelulárním obsahem aminokyselin, především pak nízkou koncentrací valinu, treoninu a tyrosinu, a u neléčených též histidinu.
Použití esenciálních aminokyselin a jejich ketoanalog
V chronické renální insuficienci byly opakovaně dokumentovány nálezy abnormálních hladin některých aminokyselin v plazmě a kosterním svalu. Bývají zjišťovány nízké koncentrace především esenciálních aminokyselin, zatímco hladina některých neesenciálních bývá zvýšena [15]. Typickým nálezem u dietologicky neléčených nemocných v chronické renální insuficienci jsou sníženy plazmatické koncentrace treoninu, valinu, leucinu, izoleucinu, lysinu, tryptofanu a tyrosinu. Hladina fenylalaninu se zpočátku nemění, později stoupá stejně jako poměr fenylalanin : tyrozin. Hladina histidinu je většinou snížena a vázne jeho využitelnost. Tento nález potvrzuje i snížená hladina karnosinu ve svalu (dipeptid složený z histidinu a β-alaninu). Histidin představuje esenciální aminokyselinu pro nemocné v chronické renální insuficienci a vzhledem k váznoucí metabolizaci je esenciální i tyrosin, z neesenciálních aminokyselin je snížena plazmatická hladina serinu (snížená syntéza v ledvinné tkáni). Ostatní neesenciální aminokyseliny mají plazmatickou hladinu normální (glutamin, glycin, alanin) nebo zvýšenou (kyselina aspargová, kyselina glutamová, citrulin, ornitin, arginin). Ve svalu je zvýšena hladina především aminokyselin ureového cyklu. Jak vyplývá z uvedených údajů, je u nemocných v chronické renální insuficienci porušena distribuce především esenciálních aminokyselin extra-intracelulárního prostoru. Pouze z nálezu plazmatických hladin jednotlivých aminokyselin nelze přesně odvozovat jejich koncentraci v organizmu. Složení spektra aminokyselin neodpovídá nálezu u zdravých jedinců, a tedy nemocní v chronické renální insuficienci vyžadují doplnění aminokyselinami odpovídající jejich metabolickým poruchám.
Velmi významnou úlohu v metabolizmu aminokyselin a bílkovin hrají rozvětvené aminokyseliny (valin, leucin a izoleucin). Jejich nutriční důležitost byla objevena v 50. letech 20. století Rosem, který ukázal, že pro příznivou dusíkovou bilanci je nezbytné adekvátní množství rozvětvených aminokyselin. V 70. letech minulého století byl prokázán důležitý vliv těchto aminokyselin v regulaci proteinového, sacharidového a lipidového metabolizmu. Za fyziologických podmínek se metabolizuje největší množství rozvětvených aminokyselin extrahepatálně ve svalech (asi 55 %) a tento podíl se při metabolických dekompenzacích v organizmu zvyšuje [16].
Při metabolizaci aminokyselin je prvním krokem transaminace na odpovídající ketokyseliny. Tento pochod je reverzibilní, což má zásadní význam při užití ketoanalog esenciálních aminokyselin. Umožňuje tak příslušným ketokyselinám nahradit základní aminokyseliny v bílkovinách diety. Konečným produktem oxidace leucinu a izoleucinu je acetyl-CoA, který může sloužit jako základní zdroj pro syntézu mastných kyselin. Při neúplné oxidaci leucinu vzniká hydroxymetyl-glutaryl-CoA, základní prekurzor cholesterolu. Valin se metabolizuje na sukcinyl-CoA – intermediální metabolit Krebsova cyklu, který má glykogenní účinek. Důležitý je zejména vztah alaninového a glutaminového metabolizmu k metabolizmu rozvětvených aminokyselin. Rozvětvené aminokyseliny jsou zdrojem α-aminodusíku pro syntézu glutaminu a alaninu. Alanin je přenašečem aminoskupin mezi kosterními svaly a játry, takže je možno říci, že rozvětvené aminokyseliny regulují sekundárně přenos α-aminodusíku mezi periferními a viscerálními tkáněmi. Glutamin je přenašečem aminoskupin mezi kosterními svaly a ledvinami. Alanin a glutamin jsou také klíčovými substráty pro glukoneogenezi. Všechny 3 rozvětvené aminokyseliny mají regulační vliv na proteinový metabolizmus ve smyslu poklesu katabolizmu a tendenci k proteosyntéze. Největší protein šetřící účinek byl popsán u ketoanalogu leucinu. Vysoké koncentrace rozvětvených aminokyselin inhibují glukogenezi. V chronické renální insuficienci zjišťujeme snížené plazmatické hladiny rozvětvených aminokyselin (hladina valinu < 150 µmol/l je důkazem těžké malnutrice). Naproti tomu intracelulární koncentrace leucinu i izoleucinu jsou normální, zatímco koncentrace valinu je významně snížena. Tento poměr se nedá upravit ani při běžné suplementaci aminokyselin a je označován jako tzv. antagonizmus rozvětvených aminokyselin.
Použití esenciálních aminokyselin a jejich ketoanalog v klinické praxi je těsně spojeno se stanovením minimálního denního potřebného množství esenciálních aminokyselin u zdravých osob. Zjištěné hodnoty uvádí tab. 1.
Tab. 1. Minimální denní množství esenciálních aminokyselin u zdravých osob 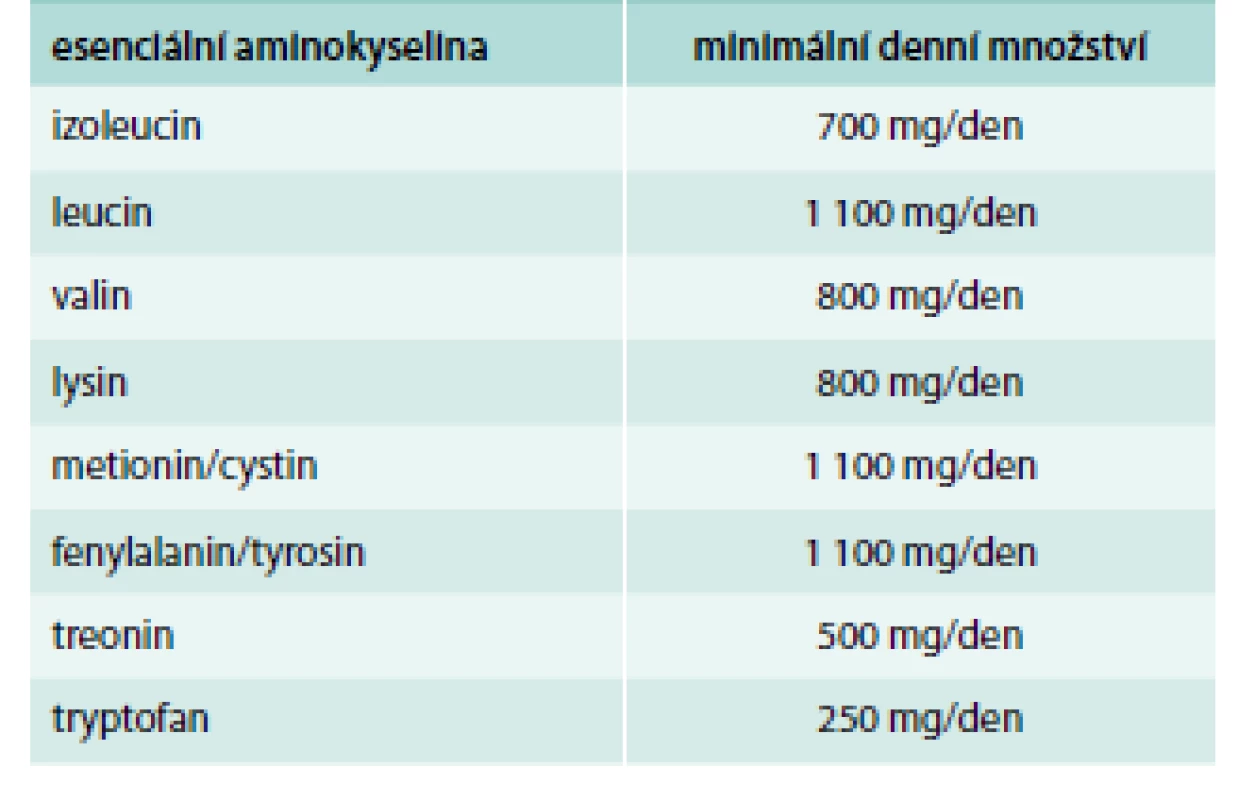
Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich ketoanalogy a hydroxyanalogy (KA). Uskutečněné studie využily mechanizmu reverzibilní transaminace vybraných esenciálních aminokyselin. Podáváním bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich ketoanalogů a hydroxynalogů vedlo jak k výraznému snížení příjmu exogenního dusíku do organizmu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a metionin. Ostatní esenciální aminokyseliny byly podávány ve své L formě (lysin, treonin a tryptofan), neboť jejich aminace v organizmu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrozin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu.
Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před 40 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných v chronické renální insuficienci dodnes zcela vyřešena [17].
Vedle ketoanalog lze podávat u nemocných v chronické renální insuficienci při nízkobílkovinné dietě též přípravky esenciálních aminokyselin. Podání samotných aminokyselin se však dlouhodobě příliš neosvědčilo, neboť stejného účinku lze dosáhnout při menších nákladech přidáním malého množství biologicky vysoce hodnotné bílkoviny či lépe oligopeptidů (navíc je příjem většího množství aminokyselin spojen s nebezpečím prohloubení metabolické acidózy). Podáváme je krátkodoběji (dnes výhradně parenterálně) především v případech, v nichž je metabolická aktivace ketoanalog (aminace) porušena – u nemocných s jaterní lézí, v těžkém metabolickém stavu, u diabetiků apod.
Velikost dávky ketoanalog a esenciálních aminokyselin je závislá na bílkovinném složení diety, hmotnosti nemocného a jeho nutričním stavu. Při neselektivní nízkobílkovinné dietě obsahující 0,6 g bílkovin/kg/den se udává dávka 0,1–0,2 g aminokyselin/kg/den. Minimální dávka nezbytná k udržení dusíkové rovnováhy při naší dietě činila 4,8 g/den (přípravek Ketosteril).
Celkový příjem bílkovin včetně aminokyselin nesmí dlouhodobě klesnout pod 0,7 g/kg tělesné hmotnosti/den.
Kontraindikace v podávání ketoanalog jsou hyperkalcemie, uremická gastrointestinální symptomatologie a těžká jaterní léze. Pro nedostatek klinických zkušeností se nedoporučuje podávat přípravek v těhotenství.
Složení ketoanalog uvádí tab. 2.
Tab. 2. Složení přípravku Ketosteril<sup>®</sup> (Fresenius Kabi) 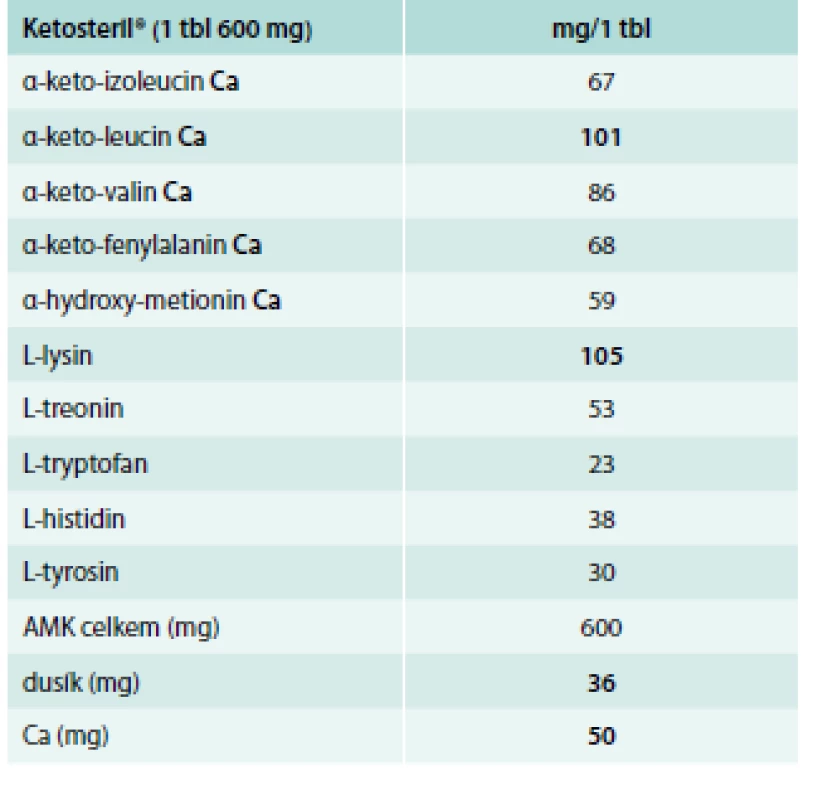
Vzhledem ke zvýšenému příjmu aminokyselin při nízkobílkovinných dietách byla také sledována otázka, zda zvýšená nálož aminokyselin touto cestou neovlivňuje nepříznivě hyperfiltraci v reziduálních nefronech. Experimentální studie ukázaly, že výhodné aminokyselinové složení těchto přípravků naopak hyperfiltraci snižuje [18].
Ketoanaloga významně ovlivňují také kalciofosfátový metabolizmus u nemocných v chronické renální insuficienci. Snižují hyperfosfatemii a hladinu parathormonu, zvyšují kalcemii, čímž příznivě ovlivňují projevy sekundární hyperparatyreózy. Tomuto mechanizmu se také přisuzuje významná role ve zpomalené progresi chronické renální insuficience.
Biomimikry a metabolizmus dusíku
Medvěd hnědý přezimuje každou zimu formou hibernace 5–6 měsíců a během této doby nepřijímá potravu ani vodu, je anurický a bez pohybu. Přes tyto extrémní podmínky se u něho nevyvíjí hyperazotemie, ani se nemění svalová aktivita a kostní denzita. Mechanizmus zodpovědný za snížení hladiny močoviny během hibernace pravděpodobně zahrnuje několik faktorů:
- celkové snížení metabolické aktivity vede k snížení syntézy urey v játrech, během zimy medvěd hnědý získává většinu své energie metabolizací tukových zásob vedoucí k produkci CO2 a H2O
- malé množství již vytvořené urey je recyklováno zpět do kosterních svalů a ostatních tělesných bílkovin, uvažuje se také o tom, zda podobně jako u přežvýkavců není urea hydrolyzována ureázou obsaženou ve střevních bakteriích na konečné produkty amoniak a CO2; amoniak je pak dál využit enterocyty k syntéze glutaminu, který může být inkorporován do proteinů
Analogický ureový transportér byl také zjištěn v tlustém střevě některých savců včetně lidí, což je předpokládáno v intenzivnější formě u medvědů hnědých. Azotemii může během zimního údobí snižovat také glycerol vznikající metabolizací tuku. Dle studií Nelsona et al bylo zjištěno, že hladina urey klesá již na podzim, dokud je ještě dostatek potravy, což předpokládá přítomnost metabolických adaptačních změn již před samotnou hibernací. Velkou roli zřejmě hraje také zvýšený přívod ovoce a lesních plodů, jako jsou severské borůvky, které obsahují velké množství sacharidů a minimálně proteinů, a redukují tak tvorbu a vylučování urey. U přezimujících zvířat byl také potvrzen nižší stupeň inzulinové rezistence, což bylo doloženo lehce zvýšenou glykemií. Mozek přezimujících zvířat může utilizovat také ketony ve formě kyseliny β-hydroxymáselné místo glukózy. Zvýšení hladiny kyseliny močové v letním údobí souvisí zřejmě s velkým příjmem lesních plodů obsahujících fruktózu. Medvěd hnědý během letního období přijímá lesní plody, především borůvky v množství až několik kg denně, v nichž je vedle energie spojené s příjmem fruktózy obsažen též významně resveratrol ovlivňující metabolizmus tubulárních buněk ledviny.
Opakovaně je diskutována a publikována problematika tzv. biomimiker [19]. První významné Nelsonovy studie u medvědů pocházejí již ze 70. let 20. století: předpokládal se účinek tzv. hibernačního hormonu obsaženého v hnědém tuku divokých zvířat (u člověka v malém množství jako vývojový rudiment u novorozence), který však nebyl dosud identifikován a který by mohl řídit vedle procesu hibernace i metabolické adaptace s hibernací související. Vzhledem k výrazně snížené renální funkci – dle lidské terminologie KDIGO CKD 3–4 – bez větší metabolické odezvy i z hlediska katabolizmu, úbytku svalové a kostní hmoty, je tento zvířecí model velmi atraktivní při hledání nových postupů léčby chorob se sníženou renální funkcí.
Stadium CKD 4–5 je charakterizováno častým úbytkem svalové hmoty, rozvojem kardiovaskulárních onemocnění, osteoporózou, známkami chronického zánětu a oxidativního stresu. Je proto přínosné zjistit rozdíly v patofyziologii odpovědi na metabolický stres u přezimujících zvířat a renálních pacientů. Medvěd hnědý si během zimního spánku zachovává základní atributy buněčného metabolizmu, udržuje tělesnou teplotu mezi 30–35 °C, ale je anurický, neboť malé množství vytvořené moči je kompletně vstřebáno zpět z močového měchýře.
Studie potvrdila výjimečnou schopnost medvěda hnědého utilizovat dusík močoviny během hibernační periody. Savci obecně nemohou hydrolyzovat močovinu (nemají enzym ureázu, a proto urea musí být vylučována ledvinami do moči). Protože GFR během periody hibernace klesá na čtvrtinu normálních hodnot (ze 122 na 37 ml/min) a medvěd hnědý je anurický, je nepochybné, že sliznice močového měchýře slouží jako transportní filtr pro reabsorpci vody elektrolytů a produktu dusíkatého metabolizmu, které se následně vracejí do oběhu, aniž by docházelo k jejich laboratorně prokazatelné retenci. Na rozdíl od reutilizace dusíku močoviny, hladina kreatininu, jakožto metabolitu kreatinu (konečný produkt dusíkatého metabolizmu) stoupá, není přítomna jeho reutilizace, ale na druhé straně stupeň svalové devastace je minimální, spojený pouze s 2,5násobným zvýšením jeho sérové hodnoty.
Metabolizmus aminokyselin je u hibernujícího medvěda hnědého spojen s vyššími hladinami celkových aminokyselin, esenciálních i neesenciálních, v letním období (ve srovnání s normami v lidské populaci). Jsou však přítomny změny jednotlivých aminokyselin. Až trojnásobně je zvýšena hladina taurinu, což může být spojeno s jeho klíčovou rolí v konjugaci kyseliny ursodeoxycholové během letní periody. U medvědů chovaných v zajetí bez zimního spánku může deficit taurinu vést k poruše resorpce vitaminu D, a tím k rozvoji metabolické renální osteopatie. Co se týká období hibernace, jsou literární data týkající se hladiny jednotlivých aminokyselin různorodá (od zvýšených až k výrazně sníženým). Ve švédské studii nebyly demonstrovány žádné signifikantní změny v aminogramu rozvětvených aminokyselin. Na rozdíl od lidské populace, u které je déle trvající odnětí potravy spojeno se zásadními změnami aminogramu, je u medvěda hnědého aminogram dlouhodobě stabilní přes měsíce trvající anorexii a hibernaci. Na tomto faktu se podílejí velmi nízké hladiny zánětlivých parametrů a vysoké hladiny prooxidačních činitelů. Protože ani u medvěda hnědého nemohou být esenciální aminokyseliny resyntetizovány z aminokyselin neesenciálních, je zřejmé, že stupeň degradace esenciálních aminokyselin, především rozvětvených (leucin, izoleucin a valin), je extrémně malý a k obnově je používán i metabolický zdroj ve svalu a v ledvině. Popsané snížení metioninu a aminokyselin obsahujících síru, stejně jako zvýšení lysinu a histidinu, mohou souviset se změnami v proteinovém metabolizmu a pravděpodobně dochází i k syntéze aminokyselin ve střevní mikroflóře. Co se týká neesenciálních aminokyselin, největší změny byly zachyceny v aminokyselinách ureového cyklu v údobí hibernace a současně až 50% zvýšení glutaminu v období letní aktivity. Glutamin je tvořen z glutamátu a amonného radikálu, na jehož tvorbě se významně účastní trávicí trakt a bakteriální mikroflóra.
Perspektivy užití suplementovaných nízkobílkovinných diet u seniorů
Užití nízkobílkovinné diety (NBD) jako terapeutické možnosti u nemocných s chronickým onemocněním ledvin (CKD) má dlouhou historii. Poprvé bylo zmíněno Bealem již v roce 1869 a potvrzeno experimentálními studiemi Smithe v roce 1926. V 50. letech 20. století pak tato modifikovaná dieta byla užívána Adisem. Největšího rozvoje bylo dosaženo od 60. let minulého století Giordanem a Giovannettim se současným užitím esenciálních aminokyselin a následně jejich ketoanalog (KA). Užití kombinace nízkobílkovinné diety s ketoanalogy umožňuje dlouhodobou metabolickou kompenzaci a může významně přispět ke zpomalení progrese renálního onemocnění [20]. Opakovaně byly potvrzeny pozitivní výsledky u nemocných nediabetiků i diabetiků. Modifikovaná dieta významně pozitivně ovlivňuje Ca-P metabolizmus a většina pacientů má normální či pouze lehce zvýšené hodnoty parathormonu (PTH). Je ovlivněna periferní inzulinová rezistence, hyperlipidemie, hypertenze a acidobazická rovnováha. Normalizace metabolické acidózy umožňuje dlouhodobě vyrovnaný proteinový metabolizmus, a tedy i optimální metabolické využití sníženého množství bílkovin v dietě. Dieta má nižší obsah Na, K a P, je normoenergetická a specificko-dynamický (termický) efekt přijímaných proteinů je minimální. Tak může dojít i k efektivní transaminaci podávaných ketoanalog a hydroxyanalog esenciálních aminokyselin. Při podávání nízkoproteinové diety klesá v moči titrovatelná acidita i poměr N-acetyl-D-glukosaminidáza (NAG)/kreatinin a TGFβ/kreatinin. Při vegetariánské dietě se může měnit vylučování a frakční exkrece Na, K a dále vylučování endotelinu a aldosteronu [21].
S rozvojem dialyzačních technologií a rozšířením kapacity dialyzačních středisek v 80. a 90. letech minulého století se objevila otázka, zda je tento způsob léčby i nadále výhodný a měl by být pravidelně užíván, neboť vedle pozitivních nálezů byly zjištěny i nemocní, kteří NBD s KA netolerovali. Při metaanalytickém hodnocení 46 studií u nediabetiků a následně ve 26 studiích hodnocení u diabetiků byly prokázány převážně pozitivní výsledky, stabilizace metabolického stavu, pokles proteinurie, zlepšení hyperglykemie a průměrné oddálení zahájení dialyzační léčby až o 1 rok ve srovnání s kontrolními skupinami bez dietní intervence [22]. Rozsáhlá MDRD studie sice v první analýze jednoznačný dopad na progresi renální insuficience neprokázala, ale při následném podrobnějším hodnocení bylo zřejmé nedostatečné ambulantní dodržování skutečného nízkého příjmu proteinů. Příčiny diskrepance mezi výsledky jednotlivých studií mohou být způsobeny nestandardností definice pojmu nízkobílkovinná dieta (příjem proteinů se ve studiích pohyboval v rozmezí 0,28–0,80 g/kg tělesné hmotnosti/den). Navíc se většinou jednalo o deklarované množství příjmu, které se zcela nekrylo s vyloučeným množstvím (dusíku) močoviny a skutečný příjem proteinů je podle našich dlouholetých zkušeností téměř vždy o 10–30 % vyšší. Také příjem ketoanalog se pohyboval v rozmezí 1 tbl (600 mg) ketoanalog na 5–10 kg tělesné hmotnosti/den. Do studií byly zavzaty heterogenní skupiny nemocných s ohledem na věk, základní diagnózu, délku onemocnění a jeho dynamiku, proteinurii, hypertenzi a hyperlipidemii. Hodnocení změn rychlosti progrese bylo provedeno nestejnými metodami: stanovení kreatininu, kreatininové filtrace (měření se sběrem či výpočtově podle Cockcrofta a Gaulta, MDRD, nově CKD-EPI) a v nestejných periodách [23,24]. Pro hodnocení pozitivního výsledku zpomalení progrese onemocnění je však nutné dlouholeté sledování (více než 5leté). Krátkodobý efekt nízkobílkovinné diety – a to již po 4–6 týdnech – je spojen se snížením proteinurie, hladiny urey, kyseliny močové, často i P. Tento krátkodobý efekt je většinou spojen i s lepší kompenzací hypertenze a hyperglykemie u diabetiků. Ve všech studiích i z klinické praxe je známo, že k pozitivnímu účinku nízkobílkovinné diety s KA je klíčová dobrá kompliance ke konzervativní léčbě a dlouhodobá adherence k restriktivní nízkobílkovinné dietě. Podmínkou úspěchu je také klinická zkušenost jak lékaře, tak nutriční terapeutky, kteří jsou hlavně v počátečním údobí zodpovědni za přípravu a realizaci složení nízkobílkovinných diet. Většinou je nezbytné minimálně jednou za měsíc testovat nemocného, zda je ochoten a schopen po náležité instrukci a při pravidelných laboratorních kontrolách tento režim dlouhodobě dodržovat. K pozitivní motivaci přispívá možnost oddálení zahájení dialyzační léčby, snížení jejích komplikací či dnes aktuálně příprava k preemptivní transplantaci od živého či kadaverózního dárce. Na základě opakovaných klinických zkušeností lze predikovat prodloužení predialyzační periody ve vyrovnaném metabolickém stavu o 1–2 roky, což může být významné z hlediska optimalizace přípravy dialyzačně-transplantačního programu.
Kontrolovaná nízkobílkovinná dieta s ketoanalogy esenciálních aminokyselin je při dobré adherenci dlouhodobě bezpečná a po jejím ukončení jsou výsledky následného dialyzačního či transplantačního léčebného postupu velmi dobré, jak dokládají opakované studie [25].
Naše zkušenosti v dietoterapii u seniorů (reanalýza studie CEKAD)
V našich předchozích studiích u více než 3 000 nemocných bylo prokázáno, že starší nemocní mohou velmi dobře tolerovat nízkobílkovinnou dietu doplněnou ketoanalogy esenciálních aminokyselin, která pomáhá dlouhodobě stabilizovat metabolický stav nemocných. Navíc při většinou dobré komplianci je riziko skryté malnutrice nízké [26].
V prospektivní randomizované, dvojitě slepé, placebem kontrolované multicentrické studii CEKAD (Central European Keto Amino Acid Diet) bylo sledováno po dobu 3 let celkem 300 nemocných ve stadiu CKD 3–4, diabetiků a nediabetiků, z čehož 100 nemocných bylo z ČR. Průměrný věk pacientů zařazených do souboru činil 62 ± 6 roků.
Následně byla provedena reanalýza dat s ohledem na věkové složení [27]. Soubor byl rozdělen na skupinu I (nemocní ve věku 65 let a starší) a skupinu II kontrolní (nemocní mladší než 65 let). Obě skupiny měly srovnatelnou vstupní úroveň GF 0,57–0,71 ± 0,32 ml/s. Při 3letém sledování jsme u skupiny I prokázali signifikantně vyšší pokles proteinurie a snížení TK ve srovnání s kontrolní skupinou II (p < 0,025). Bylo zachyceno i zpomalení progrese GF měřené Ckr a úprava parametrů sacharidového a lipidového metabolizmu (p < 0,05). Kompliance nemocných byla dobrá a adherence k dietě přesahovala 80 % (p < 0,02).
U sledovaných seniorů bylo při standardní nutriční kontrole dlouhodobé podávání NBD s KA bezpečné a účinné, a představuje tak alternativní léčebný postup u nemocných vyšších věkových kategorií se špatnou perspektivou na dialyzační léčbě.
prof. MUDr. Vladimír Teplan, DrSc.
vladimir.teplan@seznam.cz
Subkatedra nefrologie IPVZ,
Praha
www.ipvz.cz
Doručeno do redakce 29. 8. 2016
Přijato po recenzi 27. 9. 2016
Zdroje
1. Darmon P, Kaiser JM, Bauer JM et al. Restrictive diet in the elderly: Never say never again. Clin Nutr 2010; 29(2): 170–174. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clnu.2009.11.002>.
2. El Nahas AM, Bello AK. Chronic kidney disease: the global chalenge. Lancet 2005; 365(9456): 331–340.
3. Brunori G, Viola BF, Parrinello G et al. Efficacy and safety of very-low-protein diet when postponing dialysis in the elderly: a prospective randomized multicenter controlled study. Am J Kidney Dis 2007; 49(5): 569–580.
4. Oreopoulos DG, Dimkovic N. Geriatric nephrology is coming of age. J Am Soc Nephrol 2003; 14(4): 1099–1101.
5. Schück O. Examination of kidney function. Martinus Nijhoff Publishers: Boston 1984 : 218–227.ISBN 978–94–010–8997–5.
6. Klahr S, Harris K. Adaptation of remnant nephrons. In: Giovannetti J (ed). Nutritional treatment of chronic renal failure. Kluwer Academic Publishers 1989 : 21–28. ISBN 978–0-7923–0086–1.
7. Teplan V et al. Nefrologie vyššího věku. Mladá fronta [Aesculap]: Praha: 2015. 263–277. ISBN 978–80–204–3521–7.
8. Piccoli GB, Attini R, Vasario E et al. Vegetarian supplemeted low-protein diets. A safe option for pregnant CKD patiens: report of 12 pregnancies in 11 patients. Nephrol Dial Transplant 2011; 26(1): 196–205. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfq333>.
9. Aparicio M, Bellizzi V, Chauveau P et al. Keto acid therapy in predialysis chronic kidney disease patients: final consensus. J Ren Nutr 2012; 22(Suppl 2): S22-S24. Dostupné z DOI: <http://dx.doi.org/10.1053/j.jrn.2011.09.006>.
10. Teplan V. Pharmacological features of a keto amino acids. Am J Nephrol 2005; 25(Suppl 1): S13-S14.
11. Fouque D, Laville M, Boissel JP et al. Controlled low protein diets in chronic renal insufficiency: meta-analysis. BMJ 1992; 304(6821): 216–220.
12. Teplan V. Metabolismus a ledviny. Grada: Praha 2000 : 35–47. ISBN 80–7169–731–1.
13. Mitch WE. Beneficial responses to modified diets in treating patients with chronic kidney disease.. Kidney Int 2005; 67(Suppl 94): S133-S135.
14. Misra M, Nolph K. Efficacy and safety of very-low-protein diet in the elderly: what are the options? Am J Kidney Disease 2008; 51(3): 530. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2007.11.034>.
15. Toigo G, Aparicio M, Attman PO et al. Expert Working Group report on nutrition in adults patients with renal insufficiency (part 1 of 2). Clin Nutr 2000; 19(3): 197–207.
16. Toigo G, Aparicio M, Attman PO et al. Expert Working Group report on nutrition in adults patients with renal insufficiency (part 2 of 2). Clin Nutr 2000; 19(4): 281–291.
17. Teplan V. Effect of keto acids on asymmetric dimethylarginine, muscle, and fat tissue in chronic kidney disease and after kidney transplantation. J Ren Nutr 2009; 19(5 Suppl): S27-S29.
18. Teplan V, Schück O, Knotek A et al. Enhanced metabolic effect of erythropoietin and keto acids in CRF patients on low-protein diet: Czech multicenter study. Am J Kidney Dis 2003; 41(3 Suppl 1): S26-S30.
19. Stenvikel P, Fröbet O, Anderstam B et al. Metabolic changes in summer active and anuric hiberneting free-ranging brown bears (Ursus arctos). PLoS One 2013; 8(9): e72934. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0072934>.
20. Bellizzi V, Di Iorio BR, De Nicola L et al. Very low-protein diet supplemented with ketoanalogues improves blood pressure control in chronic kidney disease. Kidney Int 2007; 71(3): 245–251.
21. Cupisti A, Ghiadoni L, D´Alessandro C et al. Soy protein diet improves endothelial dysfunction in renal transplant patients. Nephrol Dial Transpl 2007; 22(1): 229–234.
22. Pan Y, Guo LL, Jin HM. Low-protein diet for diabetic nephropathy: a meta-analysis of randomized controlled trials. Am J Clin Nutr 2008; 88(3): 660–666.
23. Brenner BM, Meyer TW, Hostetter TH. Dietary protein intake and progressive nature of kidney disease. N Engl J Med 1982; 307(11): 652–660.
24. Apparicio M, Bellizi V, Chauveau P et al. Do ketoanalogues still have a role in delaying dialysis initiation in CKD predialysis patients? Semin Dial 2013; 26(6): 714–719. Dostupné z DOI: <http://dx.doi.org/10.1111/sdi.12132>.
25. Chauveau P, Vendrely B, Haggan WE et al. Body composition of patients on a very low-protein diet. Two – year surfy with DEXA. J Ren Nutr 2003; 13(4): 282–287.
26. Teplan V. Keto/Amino acids in the treatment of chronic kidney disease patients: 30 years experience in 3,000 patients. Am J Nephrol 2005; 25(Suppl 1): S8-S10.
27. Teplan V, Schück O, Malý J et al. Konzervativní léčení chronické renální insuficience (CKD 4–5) u seniorů. Aktuality v nefrologii 2010; 16(2): 59–66.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
-
Chronická dysfunkce transplantované ledviny:
stále nevyřešený problém - Současné možnosti sledování efektivnosti terapie hyponatremie
- Prof. Tomáš Ganz, MD, PhD., a prof. Peter Ganz, MD, synovia košického rodáka prof. Viliama Ganza, MD, PhD., FACC, navštívili Košice
- Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
- Prevalence mikroalbuminurie u pacientů s diabetes mellitus v České republice: Projekt IDN-Micro
- Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
- Prof. MUDr. Otto Schück, DrSc. – stálice na českém nefrologickém nebi
- Metabolická acidóza u chronického onemocnění ledvin
- Suplementácia vitamínu D3 a bunková homeostáza vápnika u pacientov pri chronickej chorobe obličiek
- Bioimpedometrie a její využití v dialyzační léčbě
- Obdiv k zakladatelům a zodpovědnost pokračovatelů
- Výsledky studie SPRINT z pohledu nefrologie
- Systémová a intraperitoneální inflamace u peritoneálně dialyzovaných pacientů
- Využitie salivárnych markerov v nefrológii
- IgA nefropatie – otázky, které nastolil výzkum
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
- Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
- Theralite a mnohočetný myelom
- Současné možnosti léčby hyponatremie
-
Chronická dysfunkce transplantované ledviny:
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Metabolická acidóza u chronického onemocnění ledvin
- Současné možnosti léčby hyponatremie
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



