-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
[Na+] – [Cl-] difference significantly contributes to acidemia in patients with liver cirrhosis
Aim:
To evaluate the role of strong ion difference (SID) in acid-base disorders in patients with liver disease.Patients and methods:
We evaluated the acid-base status in 11 patients with liver cirrhosis both by traditional and quantitative Stewart-Fencl methods.Results:
Nine of eleven patients had pH within the norm, 2/11 had pH above 7.44. One patient had respiratory alkalosis, the second had a combined respiratory alkalemia and metabolic acidemia. The anion gap was increased only in one patient, but after correction for serum albumin concentration, it was above the norm in 10/11 patients. pCO2 was below the normal limit in 5/11 patients. The Stewart-Fencl evaluation revealed decreased SID in 11/11 patients. Both SID and the difference in [Na+] – [Cl-] closely correlated with [HCO3-] (r = 0.9264 and r = 0.7272, respectively, P < 0.01). The not routinely assayed ions [UA-] were increased in 9/11 patients.Conclusion:
The acid-base status in patients with decompensated liver cirrhosis was characterized by a tendency to respiratory alkalemia and metabolic acidemia. Apart from an increase of [UA-], the difference in [Na+] – [Cl-] contributed significantly to acidemia. Thus, this simple parameter aids in determining the causes of acid-base disturbance and influences the treatment strategy.Key words:
acid-base balance – liver cirrhosis – sodium-chloride difference – Stewart-Fencl method
Autoři: Jana Lůžková 1; Bořivoj Lůžek 2; Karel Matoušovic 3,4
Působiště autorů: 2. LF UK, Praha 1; I. interní oddělení nemocnice Most, o. z., Krajská zdravotní, a. s. 2; Interní klinika 2. LF UK a FN v Motole, Praha 3; Oddělení transplantací a tkáňové banky FN v Motole, Praha 4
Vyšlo v časopise: Vnitř Lék 2016; 62(Suppl 6): 14-20
Kategorie: Původní práce
Souhrn
Cíl:
Zjistit význam nábojů nesených silnými ionty v patogenezi odchylek acidobazické rovnováhy u pacientů s jaterní cirhózou.Pacienti a metody:
Vyšetřili jsme 11 pacientů s dekompenzovanou cirhózou a zhodnotili změny acidobazické rovnováhy jak tradiční, tak kvantitativní metodou podle Stewarta a Fencla.Výsledky:
Dle tradiční metody mělo 9/11 pacientů pH v normě a jen 2/11 měli pH > 7,44, z toho jeden měl respirační alkalózu a u druhého bylo pH výsledkem respirační alkalemie a metabolické acidemie. Anion gap byl zvýšen pouze u jednoho pacienta, po jeho korekci na koncentraci albuminu byl však zvýšen u 10/11 pacientů. pCO2 byl snížen u 5/11 pacientů. Dle Stewartova-Fenclova přístupu jsme zjistili snížení náboje neseného silnými ionty (SID – strong ion difference) u 11/11 pacientů. SID těsně korelovala s [HCO3-] (r = 0,9264, P < 0,01). Rozdíl mezi koncentracemi [Na+] a [Cl-] rovněž významně koreloval s [HCO3-] (r = 0,7272, P < 0,01). Ionty, které běžně nestanovujeme [UA-], byly zvýšeny u 9/11 pacientů, především v důsledku zvýšení laktátů (u 11/11 pacientů).Závěr:
Stav acidobazické rovnováhy u pacientů s dekompenzovanou jaterní cirhózou byl charakterizován tendencí k respirační alkalemii a metabolické acidemii. K metabolické acidemii významně přispíval – kromě zvýšení [UA-] – také snížený rozdíl [Na+] – [Cl-]. Posouzení tohoto jednoduchého parametru může upřesnit důvody poruchy acidobazické rovnováhy, a tím i strategii léčby.Klíčová slova:
acidobazická rovnováha – jaterní cirhóza – natriochloridová diference – Stewartova-Fenclova metodaÚvod
Regulace acidobazické rovnováhy organizmu (ABR) je přičítána ledvinám a plicím, ale podílejí se na ní z řady příčin i játra, za fyziologického stavu mimo jiné denní produkcí 1 000 mmol hydrogenkarbonátu. Změny ABR při jaterní cirhóze jsou výsledkem velmi komplikovaných dějů [1], z nichž některé mají acidifikující a jiné alkalizující vliv. Tyto děje se často vzájemně ruší a výsledkem může být normální pH, navzdory rozvratu vnitřního prostředí. V důsledku často přítomného hyperaldosteronizmu je porušen elektrolytový metabolizmus [2,3]. Vázne syntéza albuminu s tendencí k alkalóze [4] a mění se bílkovinné spektrum. Je porušen metabolizmus aminokyselin. Podle některých autorů existuje vazba mezi rychlostí syntézy močoviny v játrech a ABR. Jestliže se sníží HCO3- nebo pH, tlumí se syntéza urey v játrech (z NH3 a HCO3-) a HCO3-, vznikající v průběhu oxidace proteinů, je zadržován v organizmu a slouží ke korekci acidózy [5–7]. Jiní autoři však tento vztah neprokázali [8]. Při ascitu se často rozvine i porucha ledvin v rámci hepatorenálního syndromu. Nezanedbatelný je také vliv podávaných léků, zejména diuretik [9], které působí metabolickou alkalózu [10]. Významnou roli hraje retence tekutin s edémy a ascitem, ale kromě toho často se sníženým efektivním cirkulačním objemem [11]. Hemodynamické změny u cirhózy zahrnují hyperkinetickou cirkulaci s periferní vazodilatací a sníženým průtokem krve ledvinami [12], což přispívá k retenci vody a sodíku v organizmu. Poměrně častá je též porucha tubulární funkce ve smyslu renální tubulární acidózy. Retence vody přispívá k diluční acidóze. Zrychlené dýchání je důsledkem dráždění dýchacího centra retinovanými metabolity a velkého ascitu, což vede k poklesu pCO2 a respirační alkalóze. Dosud publikované studie o poruchách ABR u pacientů s cirhózou analyzují tuto problematiku tradiční metodou založenou na Hendersonově-Hasselbachově rovnici. Tento přístup sice odhalí odchylku ABR a klasifikuje ji na respirační či metabolickou, říká však jen málo o podstatě metabolické (nerespirační) změny. V naší studii hodnotíme stav ABR nejen tradičním přístupem, ale také novější, kvantitativní metodou dle Stewarta a Fencla (S-F) [13–15], která umožňuje popsat příčinu, která odchylku metabolizmu způsobila. Cílem této studie je také zjistit příspěvek silných iontů ke stavu ABR.
Pacienti a metody
Parametry acidobazické rovnováhy (ABR) jsme vyšetřili u 11 pacientů, 6 mužů a 5 žen, ve věku 43–73 roků s dekompenzovanou jaterní cirhózou. Podkladem onemocnění byl u 7 nemocných etylizmus, u 2 chronická hepatitis, u jednoho kombinace hepatitidy a etylizmu a u jednoho pacienta jsme příčinu nezjistili. 9 z 11 pacientů mělo ascites, 7 z nich bylo léčeno diuretiky, 2 furosemidem, 3 spironolaktonem a 2 oběma diuretiky a 4 pacientům jsme diuretika nepodávali; 2 pacienti měli zvýšený sérový kreatinin (102 a 282 µmol/l). Biochemické vyšetření bylo provedeno v rutinní laboratoři, parametry ABR byly získány analýzou kapilární krve podle Astrupa.
Rozbor odchylek ABR jsme provedli jednak tradiční metodou, jednak podle novějšího přístupu navrženého Stewartem a Fenclem.
Tradiční přístup hodnocení ABR (bicarbonate-centered) je založen na Hendersonově-Hasselbalchově rovnici a výpočtu aniontové mezery (anion gap – AG) korigované na sérovou hladinu albuminu (AGkorig) a je všeobecně známý [16–20]. Novější způsob náhledu na ABR podle Stewarta a Fencla (S-F přístup) [13–15,21–35] je méně známý, a proto zde ve stručnosti vysvětlíme jeho podstatu. Respirační složka ABR je při S-F přístupu interpretována stejně jako při tradičním pohledu, tedy podle pCO2. Hodnocení metabolické složky ABR vychází z principu elektroneutrality, podle něhož musí být součet nábojů nesených kationty roven součtu nábojů nesených anionty (schéma). Všechny kationty plazmy jsou silné (tedy plně disociované a chemicky nereagující), zatímco na straně aniontů jsou silnými jen chlor a ionty, které běžně nestanovujeme, označované jako UA- (unidentified anions), tj. ketokyseliny, laktát, anionty hromadící se při jaterním či ledvinovém selhání apod. Ostatní anionty plazmy – albumin, fosfát a hydrogenkarbonát – jsou ionty slabé, neúplně disociované, tedy pufry. S-F teorie ABR vychází z hypotézy, že pH i [HCO3-] jsou sekundární veličiny, které se nemohou změnit samy o sobě (závislé proměnné), ale mění se tehdy a jen tehdy, když se změní některá z nezávisle proměnných veličin.
Schéma. Princip elektroneutrality 
Součet plazmatických kationtů je vždy roven součtu plazmatických aniontů. Tradiční přístup hodnotí metabolickou složku acidobazické rovnováhy podle hodnoty [HCO3-]. Stewartův-Fenclův přístup naopak vychází z principu elektroneutrality a považuje [HCO3-] za hodnotu závislou na koncentraci všech ostatních iontů plazmy. [HCO3-] se tedy nemůže měnit samo o sobě, ale tehdy a jen tehdy, když se změní koncentrace kteréhokoliv jiného iontu (schéma), a to bez ekvimolární změny iontu s opačným nábojem. Strong ion difference – SID = [Na+] + [K+] + [Ca++] + [Mg++] – [Cl-] – [UA-], dle Fencla lze však spočítat nepřímo jako součet aniontů slabých kyselin:SID = [HCO3-] + [Alb-] + [Pi-]. AG (anion gap, aniontová mezera) = [Na+] + [K+] – [Cl-] – [HCO3-]. Z aniontové mezery usuzujeme při tradičním přístupu na koncentraci aniontů silných kyselin, které běžně nestanovujeme [UA-], ale s nepřesnostmi, neboť nekalkuluje s koncentracemi [Ca++] + [Mg++], ale zejména nábojem neseným [Alb-] + [Pi-], což v případě jejich odchylek od normy vede k falešné hodnotě AG. Korigujeme-li vypočtenou hodnotu AG na [Alb-] a [Pi-], přiblížíme se k hodnotě [UA-]. V případě této korekce se AGkorig liší od [UA-] jen málo, a to o [Ca++] + [Mg++]. V klinické praxi většinou stačí korigovat AG na albumin. Metabolická složka ABR je dle tohoto přístupu hodnocena podle dvou nezávisle proměnných veličin, z nichž první je definována silnými a druhá slabými ionty plazmy a to:
- Rozdílem nábojů mezi silnými (plně disociovanými a chemicky nereagujícími) kationty a anionty (tzv. diference silných iontů/strong ion difference – SID = [Na+] + [K+] + [Ca2+] + [Mg2+] – [Cl-] – [UA-], kde [UA-] je koncentrace neurčených silných aniontů). Snížení SID acidifikuje, zvýšení alkalizuje.
- Pomocí celkové koncentrace slabých neprchavých aniontů [Atot], jen částečně disociovaných (albumin a fosfáty), a tedy nábojem jejich disociované složky – [Atot-] = [Alb-] + [Pi-], náboj nesený albuminem a fosfátem můžeme snadno spočítat podle jednoduchých rovnic [15,36,37], snížení alkalizuje, zvýšení acidifikuje [10,38].
Tyto 2 nezávisle proměnné veličiny určují koncentraci hydrogenkarbonátu [HCO3-]. Např. jestliže se zvýší na straně kaniontů [Na+] bez současného zvýšení doprovodného silného aniontu – obvykle [Cl-] – musí se zvýšit – aby zůstala zachována elektroneutralita – koncentrace slabých aniontů, z nichž biologicky nejvýznamnější je [HCO3-]. Tradiční přístup hodnotí tento stav jako metabolickou alkalózu signalizovanou zvýšením [HCO3-], S-F přístup to hodnotí jako alkalózu v důsledku zvýšení SID, dané zvýšením [Na+]. Obdobnou úvahou dospějeme např. k příčině metabolické acidózy vzniklé v důsledku vzestupu [Cl-] (hyperchloremická acidóza tradičního přístupu) nebo iontů [UA-] např. laktátu při jaterním selhání (acidóza se zvýšeným AG). [UA-] je jen přesnějším vyjádřením AG.
Kvantitativně nejvýznamnějšími ionty ovlivňujícími SID jsou Na+ a Cl-. V klinické praxi je hodnotíme izolovaně. Vzhledem k jejich širokému rozmezí normálních hodnot je výhodnější hodnotit rozdíl jejich koncentrací, Diff(NaCl), který nám daleko více napovídá a o jejich příspěvku k odchylkám ABR [28]. Tento parametr pochopitelně výborně koreluje se SID (neboť ostatní silné ionty jsou v plazmě v daleko menší koncentraci), ale z praktického hlediska a z pohledu tradičního přístupu je důležité, že koreluje také s [HCO3-] [39–41]. Pokles Diff(NaCl) může nastat jednak v důsledku dilučního efektu (diluční acidóza tradičního pohledu – neboť plazmatická [Na+] je vyšší než [Cl-], a tudíž se při naředění sníží o více mmol/l než [Cl-]) [42], jednak v důsledku poruchy natrio-chloridového metabolizmu v případech, ve kterých bychom tuto možnost neočekávali [39,43–46]. Takovou situací je např. zvýšení [UA-], kdy koncentrace [Na+] a [Cl-] jsou ještě v referenčním rozmezí, ale v některých případech je již Diff(NaCl) snížena. Tuto poruchu bychom hodnotili jen jako důsledek zvýšené koncentrace běžně nestanovovaných silných kyselin. Příspěvek koncentrací [Na+] a [Cl-] vyplyne teprve při posouzení Diff(NaCl). Vyplývá to z toho, že i při normonatremii a normochloremii může být Diff(NaCl) snížena. Dle tradiční analýzy bychom takovou poruchu mohli posuzovat pouze jako metabolickou acidózu se zvýšeným AG. Z pohledu S-F teorie však v důsledku snížení Diff(NaCl) se sníží SID a následně – v rámci zachování elektroneutrality – se musí snížit [HCO3-], což přispívá k metabolické acidóze. Vztah mezi [HCO3-], Diff(NaCl) a AG můžeme vyjádřit z nejjednoduššího výpočtu pro AG: AG = Diff(NaCl) – HCO3-, který můžeme upravit do tvaru: HCO3- = Diff(NaCl) – AG. Z tohoto vztahu plyne, že pokud je AG blízko normy (nejsou zvýšeny [UA-] S-F přístupu), musí existovat lineární vztah mezi plazmatickou koncentrací HCO3 - a Diff(NaCl). A naopak, je-li hodnota Diff(NaCl) blízko normy, musí existovat nepřímý lineární vztah mezi HCO3 - a AG.
Kromě posuzování Diff(NaCl) je důležité i posouzení poměru jejich koncentrací, natrichloridový poměr – [Na+]/[Cl-], který by mohl pomoci odhalit příspěvek diluce či kontrakce [27,45] na změny ABR. Poměr Na/Cl v případě čisté diluce/kontrakce zůstává (in vitro) nezměněn, na rozdíl od Diff(NaCl), která při diluci klesá a při kontrakci stoupá. Je-li však při metabolické poruše ABR přítomna dysbalance jednoho z těchto iontů z jiného důvodu než změny obsahu vody, mění se i poměr Na/Cl [28,47].
Hodnocení respirační složky ABR je u klasického i S-F přístupu totožné.
Výsledky
Hodnocení dle tradičního přístupu (tab. 1 a 2)
Tab. 1. Laboratorní údaje o jednotlivých pacientech 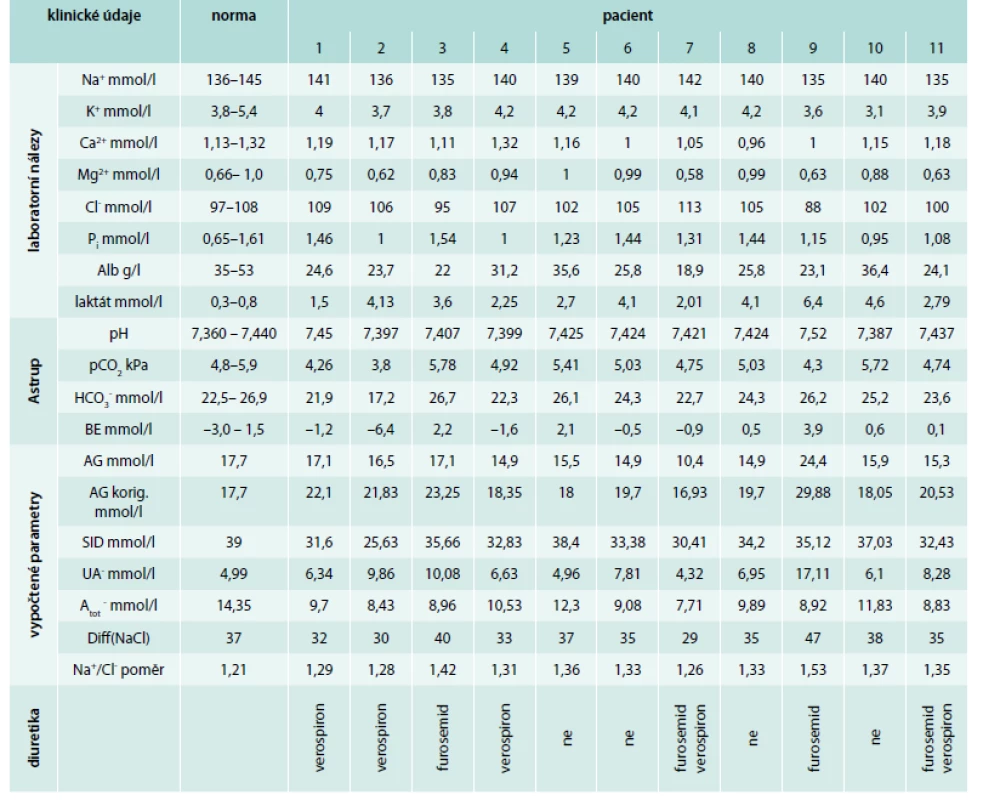
Tab. 2. Počty pacientů, u nichž byly přítomny odchylky od normy 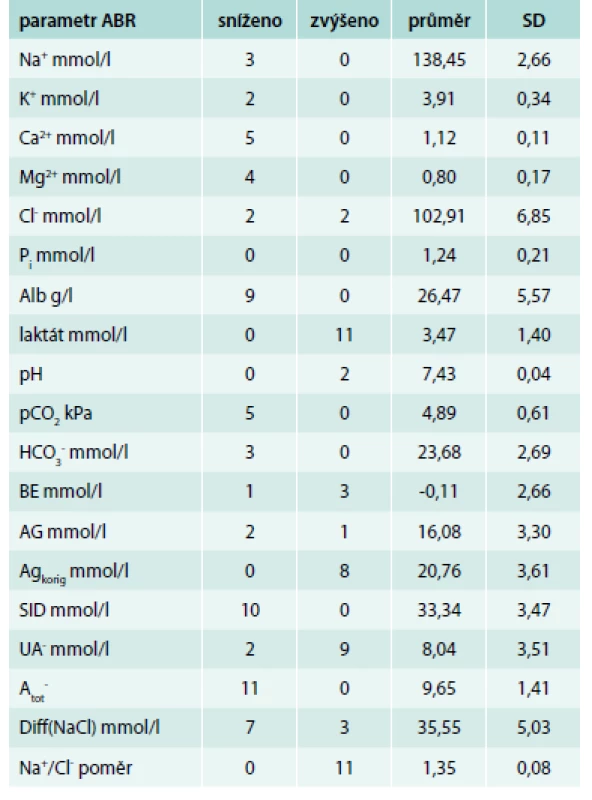
V normě mělo pH 9 z 11 pacientů, 2 z 11 pacientů měli pH > 7,44, tedy alkalózu, z toho v 1 případě respiračního typu, v druhém případě jako součet respirační alkalemie (snížení pCO2) a metabolické acidemie (snížení [HCO3-]). U dalších 9 pacientů, kteří měli pH v normě, byl u 5/11 snížen pCO2 a jen 3/11 měli sníženou hodnotu [HCO3-], tedy pouze u těchto 3 pacientů by při hodnocení stavu ABR tradičním způsobem vzniklo podezření na metabolickou acidózu. Anion gap (AG) jsme počítali dle rovnice: AG = [Na+] + [K+] – [Cl-] – [HCO3-] a za jeho normu jsme považovali součet hodnot středních koncentrací jednotlivých iontů. Nízká hladina albuminu skrývá skutečnou hodnotu AG, a proto jsme takto vyčtený AG následně modifikovali přepočtem na sérovou hladinu albuminu podle rovnice: AGkorig = AG + 0,25 × (40 – Salb) [15,48]. Nekorigovaný AG byl zvýšen pouze u 1 pacienta. Po korekci AG na sérovou hladinu albuminu (AGkorig) jsme však zjistili jeho zvýšení téměř u všech pacientů (10/11), což svědčí o hromadění silných kyselin. AGkorig koreloval s koncentrací laktátu (r = 0,6234, P < 0,05). BE byl snížen jen u jednoho pacienta.
Hodnocení dle Stewartova-Fenclova přístupu (tab. 1 a 2)
SID, hodnotící vliv silných iontů na ABR, byla snížena u všech pacientů (11/11), což přispívalo k metabolické acidemii působené odchylkami silných iontů. Na tomto snížení se podílelo zvýšení [UA-] u 9/11 pacientů [10], dané především zvýšením laktátů u všech 11 pacientů. Ke snížení SID dále přispívalo snížení kationtů, a to u 3/11 [Na+], u 3/11 [K+], u 5/11 [Ca2+], u 4/11 [Mg2+], je však zřejmé, že příspěvek iontů o nízké sérové koncentraci byl malý. Příspěvek [Cl-] ke snížení SID byl rovněž malý, byla zvýšena jen u 1/11 pacientů. Hodnota SID těsně korelovala s [HCO3-] (r = 0,9264, P < 0,01), nikoliv však s pH. Rozdíl mezi koncentracemi kvantitativně nejvýznamnějšího kationtu a aniontu, tedy natria a chloridu – Diff(NaCl) – byl pod střední hodnotou normy u 8/11 pacientů a rovněž těsně koreloval s [HCO3-] (r = 0,7272, P < 0,01), ale zůstal těsně pod korelací s pH (r = 0,5889, NS). Natriochloridový poměr byl u všech pacientů vyšší než střední hodnota normy, vypočítaná jako podíl středních hodnot fyziologického rozmezí koncentrací natria a chloru.
Náboj nesený slabými neprchavými kyselinami – [Atot-] – byl snížen u všech pacientů (což přispívalo k alkalemii), především v důsledku nízké [Alb-] u 9/11 pacientů. I u obou dalších pacientů byl albumin na dolní hranici normy.
Průměrná [Na+] u pacientů léčených furosemidem byla 136,7 mmol/l, u pacientů bez furosemidu 139,4 mmol/l. Nezaznamenali jsme rozdíl v [K+] mezi pacienty bez a s furosemidem.
Již AG jasně koreloval s [UA-] (r = 0,8888, P < 0,01), přestože byl u většiny pacientů v normě. Korelace AGkorig a [UA-] byla téměř absolutní (r = 0,9468, P < 0,01).
Diskuse
Poruchy ABR u cirhotiků jsou nejčastěji charakterizovány respirační alkalemií spolu s metabolickou acidemií. V závislosti na stupni poškození jater se poruchy prohlubují. Při kompenzované cirhóze ve stadiu Child-Pugh A je stav ABR charakterizován mírnou hypalbuminemickou alkalemií, při prohlubující se jaterní lézi ve stadiu B a C přistupuje respirační alkalemie [49]. Při jaterním selhání nabývá převahu metabolická acidemie v důsledku hromadění silných kyselin, zejména laktátu [50]. U poloviny našich pacientů bylo sníženo pCO2. Respirační alkalemie je typickým projevem všech typů jaterních postižení [51]. Pravděpodobně je to důsledek stimulace dýchacího centra retinovanými aminy a jinými látkami, které nejsou dostatečně metabolizovány játry a má také vztah i ke změněné hemodynamice [1]. Také intracelulární acidóza v důsledku porušeného buněčného metabolizmu mozkového kmene může být odpovědna za hyperventilaci [52,53]. Vyšší stav bránice při velkém ascitu také vede ke zrychlenému dýchání, a tím k poklesu pCO2.
Většina našich pacientů s ascitickou jaterní cirhózou měla pH v normě navzdory mnohým odchylkám ve složení extracelulární tekutiny. Nekorigovaný AG ukazoval na hromadění silných kyselin jen u 1/11 pacientů, a není proto průkazný pro retenci silných aniontů. Teprve AG korigovaný na albumin (AGkorig) prokázal hromadění silných kyselin téměř u všech pacientů. Z toho vyplývá nutnost této korekce [19,21,36,37,48,54], neboť nedostatečná syntéza albuminu v játrech způsobující alkalemii může zcela zakrýt hromadění silných kyselin, ale i vliv dalších iontů (působících acidemii). Někteří autoři dále doporučují korigovat AG navíc i na sérovou koncentraci fosfátů, čímž se jeho výpovědní hodnota dále zpřesní. To má význam zejména u nemocných v renální insuficienci, u nichž stoupá hladina fosfátů, které přispívají k metabolické acidóze, a tedy vypočtenou hodnotu AG zvyšují. Sami se domníváme, že v klinické praxi tato korekce nutná není. Hladina AGkorig těsně korelovala s [UA-] S-F přístupu (r = 0,9468, P < 0,01). Z toho vyplývá poznatek, že u pacientů s ascitickou jaterní cirhózou má AGkorig dostatečnou výpovědní hodnotu o hromadění silných kyselin, a není tedy nutné vypočítávat [UA-] z rovnice pro SID.
V čem tedy přispívá S-F přístup k upřesnění poruchy ABR u pacientů s cirhózou? Především v tom, že na rozdíl od tradičního hodnocení detailně zhodnotí příčiny odchylky ABR. Především je to výpočet SID, který odhalí příspěvek koncentrací silných iontů ke změnám ABR. Snížení SID, přítomné u všech našich pacientů, bylo také rozhodující příčinou vývoje metabolické acidemie, neboť téměř absolutně korelovalo s [HCO3-] (r = 0,9264, P < 0,01). SID je výsledkem součtu koncentrací mnoha iontů. Uvědomíme-li si však, že na straně kationtů je příspěvek odchylek [K+] + [Ca2+] + [Mg2+] ve srovnání s [Na+] velmi malý a že na straně aniontů má rozhodující vliv [Cl-] (při vyloučení odchylky [UA-]), je nasnadě, že SID by bylo možno nahradit jednodušším natriochloridovým rozdílem Diff(NaCl). Tuto možnost jsme již prokázali na velkém počtu nefrologických pacientů [27,28]. I v současné studii byla dobrá, i když ne absolutní (v důsledku vysoké hodnoty [UA-]) korelace mezi SID a Diff(NaCl) a velmi těsná korelace mezi Diff(NaCl) a [HCO3-], zatímco korelace mezi [UA-] a [HCO3-] byla nesignifikantní. Dá se tedy soudit, že odchylky v metabolizmu natria a chloru měly ještě větší vliv na metabolickou složku ABR než [UA-]. Z těchto dvou kvantitativně nejvýznamnějších iontů se na snížení SID podílelo především snížení [Na+], které sice bylo jen u 3 pacientů pod hranicí široké normy, ale u většiny pacientů se k dolní hranici blížilo. Je dobře známo, že při cirhóze je zvýšena resorpce natria v distálním nefronu, zároveň však dochází k retenci tekutin a výsledná natremie je dána součtem těchto dějů. V této souvislosti je třeba si uvědomit i změny natriového (i kaliového) metabolizmu v souvislosti s léčbou. Diuretika, infuze roztoků bohatých na chloridy jako fyziologický roztok, které snižují SID, lidského albuminu, jež je slabou kyselinou, velké množství glukózy při porušené glukoneogenezi, to vše může posunout parametry ABR . Také kontrakce efektivního cirkulujícího volumu je u cirhózy s otoky a ascitem běžná [1].
Závěr
Změny ABR u pacientů s jaterní cirhózou jsou velmi komplikované [55] a jsou součtem mnoha odchylek, z nichž některé alkalizují a jiné acidifikují, takže je jejich vliv na koncentraci vodíkových iontů často protichůdný, a pH proto může zůstat v normě, jak tomu bylo u většiny našich pacientů. Nejčastěji popisovanou změnou je respirační alkalemie spojená s metabolickou acidemií. Ve smyslu acidifikace se u našich pacientů uplatňovalo hromadění silných běžně nestanovovaných iontů, zejména laktátu, a ještě silněji pokles SID daný především poklesem rozdílu mezi koncentracemi natria a chloridů – Diff(NaCl). Tuto veličinu bychom měli vzít v úvahu i při pohledu na ABR tradičním způsobem a snažit se ji korigovat (např. roztoky, které obsahují natrium a chlor ve fyziologickém poměru 1,4 : 1, omezením příjmu soli, aplikací NaHCO3 apod). To považujeme za hlavní přínos této studie.
Seznam použitých zkratek
ABR – acidobazická rovnováha AG – aniontová mezera/anion gap AGkorig – aniontová mezera korigovaná na plazmatickou koncentraci albuminu S-F – Stewartův-Fenclův přístup k hodnocení ABR SID – rozdíl mezi náboji nesenými všemi silnými kationty a všemi silnými anionty plazmy/strong ion difference [Atot] – součet koncentrací plazmatického albuminu (g/l) a anorganického fosfátu (mmol/l) [Atot-] – součet koncentrací ionizovaného plazmatického albuminu (mmol/l) a ionizovaného anorganického fosfátu (mmol/l) [HCO3-], [Na+], [K+], [Ca2+], [Mg2+], [Cl-] – koncentrace příslušných iontů v mmol/l [UA-] – koncentrace běžně nestanovovaných iontů (mmol/l) [Pi-] – koncentrace ionizovaného anorganického fosfátu (mmol/l) [Alb-] – koncentrace ionizovaného albuminu (mmol/l) Diff(NaCl) – rozdíl v plazmatických koncentracích mezi natriem a chlorem (mmol/l)
Práce vznikla za podpory grantu 15–33686A.
prof. MUDr. Karel Matoušovic, DrSc.
karel.matousovic@lfmotol.cuni.cz
Interní klinika 2. LF UK a Oddělení transplantací a tkáňové banky FN v Motole,
Praha
www.fnmotol.cz
Doručeno do redakce 1. 9. 2016
Přijato po recenzi 30. 9. 2016
Zdroje
1. Bernardi M, Predieri S. Disturbances of acid-base balance in cirrhosis: a neglected issue warranting futher insights. Liver Int 2005; 25(3): 463–466.
2. Wagner CA. Effect of mineralocorticoids on acid-base balance. Nephron Physiol 2014; 128(1–2): 26–34. Dostupné z DOI: <http://dx.doi.org/10.1159/000368266>.
3. Lee Hamm L, Hering-Smith KS, Nakhoul NL. Acid-base and potassium homeostasis. Semin Nephrol 2013; 33(3): 257–264. Dostupné z DOI: <http://dx.doi.org/10.1016/j.semnephrol.2013.04.006>.
4. Wilkes P. Hypoproteinemia, strong ion difference and acid-base status in critically ill patients. J Appl Physiol 1998; 84(5): 1740–1748.
5. Häussinger D. Liver and kidney in acid-base rtegulation. Nephrol Dial Transpl 1995; 10(9): 1536.
6. Häussinger D, Steeb R, Gerok W. Ammonium and bicarbonate homeostasis in chronic liver disease. Klin Wochenschr 1990; 68(3): 175–182.
7. Häussinger D, Gerok W. Hepatic urea synthesis and pH regulation. Role of CO2, HCO3-, pH and the activity of carbonic anhydrase. Eur J Biochem 1985; 152(2): 381–386.
8. Shangraw RE, Jahoor F. Effect of liver disease and transplantation on urea synthesis in humans: relationship to acid-base status. Am J Physiol 1999; 276(Pt 1): G1145-G1152.
9. Laffi G, La Villa G, Carloni V et al. Loop diuretic therapy in liver cirrhosis with ascites. J Cardiovasc Pharmacol 1993; 22(Suppl 3): S51-S58.
10. McAuliffe J, Lind LJ, Fencl V et al. Hypoproteinemic alkalosis. Am J Med 1986; 81(1): 86–90.
11. Kinouchi T Fluid, electrolyte, and acid-base disorders in liver cirrhosis. Nihon Rinsho 1994; 52(1): 124–131.
12. Henriksen JH, Bendtsen F, Møller S. Acid-base disturbance in patients with cirrhosis: relation to hemodynamic dysfunction. Eur J Gastroenterol Hepatol 2015; 27(8): 920–927. Dostupné z DOI: <http://dx.doi.org/10.1097/MEG.0000000000000382>.
13. Stewart PA. Independent and dependent variables of acid-base control. Respir Physiol 1978; 33(1): 9–26.
14. Stewart PA. Modern quantitative acid-base chemistry. Can J Physiol Pharmacol 1983; 61(12): 1444–1461.
15. Fencl V, Leith DE. Stewart´s quantitative acid-base chemistry: applications in biology and medicine. Respir Physiol 1993; 91(1): 1–16.
16. Henderson LJ. Das Gleichgewicht zwischen Säuren und Basen im Tierischen Organismus. Ergeben Physiol 1909; 8 : 254–325.
17. Haselbalch KA. Die Berechnung der Wasserstoffzahl des Blutes aus der freien and gebundenen Kohlesäure desselben, und die Sauerstoffbildung als Funktion der Wasserstoffzahl. Biochem Z 1916; 78 : 112–144.
18. Salem M, Mujais S. Gaps in anion gap. Arch Int Med 1992; 152(8): 1625–1629.
19. Fencl V, Rossing TH. Acid-base disorders in critical care medicine. Ann Rev Med 1989; 40 : 17–29.
20. Astrup P, Jorgensen K, Andersen Os et al. The acid-base metabolism. A new approach. Lancet 1960; 1(7133): 1035–1039.
21. Fencl J, Jabor A, Kazda A et al. Diagnosis of acid-base disturbances in critically ill patients. Am J Respir Crit Care 2000; 162(6): 2246–2251.
22. Corey HE. Stewart and beyond: new models of acid-base balance. Kidney Int 2003; 64(3): 777–787.
23. Wooten EW. Science review: quantitative acid-base physiology using the Stewart model. Crit Care 2004; 8(6): 448–452.
24. Sirker AA, Rhodes A, Grounds RM et al. Acid-base physiology: the “traditional” and the “modern” approaches. Anaesthesia 2002; 57(4): 348–356.
25. Kurtz I, Kraut J, Ornekian V et al. Acid-base analysis: a critique of the Stewart and bicarbonate-centered approaches. Am J Physiol Renal Physiol 2008; 294(5): F1009-F1031. Dostupné z DOI: <http://dx.doi.org/10.1152/ajprenal.00475.2007>.
26. Matoušovic K, Martínek V. Analýza a korekce poruch acidobazické rovnováhy na základě Stewartova-Fenclova principu. Vnitř Lék 2004; 50(7): 526–530.
27. Havlin J, Matoušovic K, Schuck O et al. Patofyziologie metabolické acidózy u pacientů se sníženou glomerulární filtrací podle Stewartovy-Fenclovy teorie. Vnitř Lék 2009; 55(2): 97–104.
28. Havlin J, Matoušovic K, Schuck O et al. The use of sodium-chloride difference and chloride-sodium ratio in the evaluation of metabolic acidosis in critically ill patients. Eur J Pediatr 2012; 171(11): 1719; author reply 1721–1722. Dostupné z DOI: <http://dx.doi.org/10.1007/s00431–012–1833–2>.
29. Masevicius FD, Dubin A. Has Stewart approach improved our ability to diagnose acid-base disorders in critically ill patients? World J Crit Care Med 2015; 4(1): 62–70. Dostupné z DOI: <http://dx.doi.org/10.5492/wjccm.v4.i1.62>.
30. Schück O, Matoušovic K. Relation between pH and the strong ion difference (SID) in body fluids. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2005; 149(1): 69–73.
31. Schück O, Matoušovic K. Vztah mezi pH a diferencí silných iontů (SID) ve vnitřním prostředí. Klin Biochem Metab 2005; 13/34(1): 32–35.
32. Seifter JL. Integration of acid-base and electrolyte disorders. N Engl J Med 2014; 371(19): 1821–1831. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1215672>.
33. Boyle M, Baldwin I. Introduction to an alternative view of acid/base balance: the strong ion difference or Stewart approach. Aust Crit Care 2002; 15(1): 14–20.
34. Doberer D, Funk GC, Kirchner K et al. A critique of Stewart‘s approach: the chemical mechanism of dilutional acidosis. Intensive Care Med 2009; 35(12): 2173–2180. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–009–1528-y>.
35. Kofránek J. Komplexní model acidobazické rovnováhy krve. In: Ziethamlová M (ed). MEDSOFT 2009. Agentura Action M: Praha 2009 : 23–160.
36. Figge, J, Jabor A, Kazda A et al. Anion gap and hypoproteinemia. Crit Care Med 1998; 26(11): 1807–1810.
37. Figge J, Rossing TH, Fencl V. The role of serum proteins in acid-base equilibria. J Lab Clin Med 1991; 117(6): 453–467.
38. Watson PD. Modeling the effects of proteins on pH in plasma. J Appl Physiol 1999; 86(4): 1421–1427.
39. Relman AS. Renal acidosis and renal excretion of acid in health and disease. Adv Intern Med 1964; 12 : 295–347.
40. Thomas SS, Mitch WE. Mechanisms stimulating muscle wasting in chronic kidney disease: the roles of the ubiquitin-proteasome system and myostatin. Clin Exp Nephrol 2013; 17(2): 174–182. Dostupné z DOI: <http://dx.doi.org/10.1007/s10157–012–0729–9>.
41. Mallat J, Barrailler S, Lemyze M et al. Use of sodium-chloride difference and corrected anion gap as surrogates of Stewart variables in critically ill patients. PLoS One 2013; 8(2): e56635. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0056635>.
42. Garella S, Chang BS, Kahn SI. Dilution acidosis and contraction alkalosis: review of the concept. Kidney Int 1975; 8(5): 279–283.
43. Coles GA. Body composition in chronic renal failure. Q J Med 1972; 41(161): 25–47.
44. Ronco C, Kellum JA, Bellomo R. Acid-Base Problems: Basic Physiology. In: Ronco C, Kellum JA, Bellomo R. Critical Care Nephrology. 2nd ed. Elsevier: Philadelphia 2008. ISBN 978–1416042525.
45. Kurt A, Ecevbit A, Ozkiraz S et al. The use of cloride-sodium ratio in the evaluation of metabolic acidosis in critically ill neonates. Eur J Pediatr 2012, 171(6): 963–969. Dostupné z DOI: <http://dx.doi.org/10.1007/s00431–011–1666–4>.
46. Opatrná S, Matoušovic K, Klaboch J et al. Importance of serum [Na+] and [Cl-] difference in acid-base status classification. Anesth Analg 2010, 111(1): 243; author reply 243–244. Dostupné z DOI: <http://dx.doi.org/10.1213/ANE.0b013e3181dd8a33>.
47. Kříž J, Schück O, Horáčková M. Hyponatremia in spinal cord injury patients: new insight into differentiating between the dilution and depletion forms. Spinal Cord 2015; 53(12): 896. Dostupné z DOI: <http://dx.doi.org/10.1038/sc.2015.131>.
48. Rossing TH, Maffero N, Fencl V. Acid-base effects of altering plasma protein concentration in human blood in vitro. J Appl Physiol 1986; 61(6): 2260–2265.
49. 49 Funk GC, Doberer D, Kneidinger N et al. Acid-base disturbances in critically ill patients with cirrhosis. Liver Int 2007; 27(7): 901–909.
50. Prytz H, Thomsen AC. Acid-base status in liver cirrhosis. Disturbances in stable, terminal and portal-caval shunted patients. Scand J Gastroenterol 1976; 11(3): 249–256.
51. Li XM, Li YX, Meng QH et al. Characteristics of acid-base balance in patients with chronic severe hepatitis: analysis of 126 cases. Zhonghua Yi Xue Za Zhi 2006; 86(30): 2131–2133.
52. Karetzky MS, Mithoefer JC. The cause of hyperventilation and arterial hypoxia in patients with cirrhosis of the liver. Am J Med Sci 1967; 254(6): 797–804.
53. Milionis HJ, Elisaf MS. Acid-base abnormalities in a patient with hepatic cirrhosis. Nephrol Dial Transplant 1999; 14(6): 1599–1601.
54. Hassan H, Joh JH, Bacon BR et al. Evaluation of serum anion gap in patients with liver cirrhosis of diverse etiologies. Mt Sinai J Med 2004; 71(4): 281–284.
55. Lieberman FI, Reynolds TB. Plasma volume in cirrhosis of the liver: its relation to portal hypertension, ascites and renal failure. J Clin Invest 1967; 46(8): 1297–308.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo Suppl 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
-
Chronická dysfunkce transplantované ledviny:
stále nevyřešený problém - Současné možnosti sledování efektivnosti terapie hyponatremie
- Prof. Tomáš Ganz, MD, PhD., a prof. Peter Ganz, MD, synovia košického rodáka prof. Viliama Ganza, MD, PhD., FACC, navštívili Košice
- Rozdíl [Na+] – [Cl-] významně přispívá k acidemii pacientů s jaterní cirhózou
- Prevalence mikroalbuminurie u pacientů s diabetes mellitus v České republice: Projekt IDN-Micro
- Markery oxidačného a karbonylového stresu v plazme a slinách u chorých s akútnou intermitentnou porfýriou
- Prof. MUDr. Otto Schück, DrSc. – stálice na českém nefrologickém nebi
- Metabolická acidóza u chronického onemocnění ledvin
- Suplementácia vitamínu D3 a bunková homeostáza vápnika u pacientov pri chronickej chorobe obličiek
- Bioimpedometrie a její využití v dialyzační léčbě
- Obdiv k zakladatelům a zodpovědnost pokračovatelů
- Výsledky studie SPRINT z pohledu nefrologie
- Systémová a intraperitoneální inflamace u peritoneálně dialyzovaných pacientů
- Využitie salivárnych markerov v nefrológii
- IgA nefropatie – otázky, které nastolil výzkum
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
- Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin
- Theralite a mnohočetný myelom
- Současné možnosti léčby hyponatremie
-
Chronická dysfunkce transplantované ledviny:
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Metabolická acidóza u chronického onemocnění ledvin
- Současné možnosti léčby hyponatremie
- Gitelmanův syndrom jako častá příčina hypokalemie a hypomagnezemie
- Osteoporóza – epidemiologie a patogeneze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



