-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Maligní lymfomy/Chronická lymfocytární leukemie
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum1, p. 59-68.
Kategorie: 30. Olomoucké hematologické dny
2940. Non-Hodgkinovy lymfomy v České republice - trendy v epidemiologii a léčbě
Trněný M., Campr V., Janíková A., Belada D., Procházka V., Móciková H., Pirnos J., Kubáčková K., Ďuraš J., Barsová L., Pukyová J., Brejcha M., Vokurka S., Adamová D., Bár R., Starostka D., Chodacká M., Kessler P., Pytlík R., Dušek L., Benešová K., Sýkorová A., Dlouhá J., Blahovcová P., Boudová L.
(I. interní klinika VFN, Praha; FN Motol, Praha; FN, Brno; FN, Hradec Králové; FN, Olomouc; FN Královské Vinohrady, Praha; Nemocnice, České Budějovice; FN, Ostrava; KN, Liberec; MN, Ústí nad Labem; KOC, Nový Jičín; FN, Plzeň; SN, Opava; Nemocnice, Tábor; NsP, Havířov; Nemocnice, Chomutov; Nemocnice, Pelhřimov; VFN, Praha; Národní onkologický registr, Praha; Datacentrum KLS, Praha)
Non-Hodgkinovy lymfomy (NHL) jsou nejčastější krevní malignitou s incidencí kolem 15 na 100.000 obyvatel, spolu s dalšími lymfoproliferacemi, jako je CLL a HL řazenými dle WHO do skupiny lymfomů, incidence dosahuje 23 na 100.000 obyvatel. Kooperativní lymfomová skupina (CLSG – Czech Lymphoma Study Group) začala od roku 1999 prospektivně budovat databázi nově diagnostikovaných pacientů (pac.) s NHL (Lymphoma Project CLSG – LP-CLSG). V předkládaném sdělení analyzujeme incidenci a výsledky léčby u NHL za 15 let. Metodika: Pro popis vývoje incidence a mortality na základě populačních dat byla použita data z Národního onkologického registru (NOR) a ÚZIS. LP-CLSG umožnil zadávání dat z doby diagnózy, relapsů a sledování. Do analýzy byli zařazeni pouze nemocní s hist. čtením z referenčního centra - RC (7 center). LP-CLSG pokrývá zhruba dvě třetiny všech nově diagnostikovaných NHL, více než 17 center zařadilo 50 a více nemocných. Výsledky: Incidence a mortalita resp. se vyvíjela následovně. V roce 1981 byla 6,1 a 3,6 resp., v roce 2001 10,8 a 6,0 resp. a v roce 2011 13,5 a 5,3 (pokles) resp., vždy na 100 000 obyvatel. Do LP-CLSG bylo celkem zařazeno 11 828 nemocných diagnostikovaných v letech 1999–2014, u 10 333 byla diagnóza stanovena v RC s potvrzením diagnózy B - nebo T-NHL. Difuzní velkobuněčný lymfom (DLBCL) byl nejčastějším podtypem s 4187 pac. (40,5 %), následovaný folikulárním lymfomem (FL) s 1969 (19,5 %) pac., lymfomem z marginální zóny (MZL) s 885 (8,6 %) pac., lymfomem z plášťových buněk (MCL) s 857 (8,3 %) pacienty, lymfomem z malých lymfocytů (SLL) s 393 (3,8 %). Dalších 1252 (12,5 %) pac. mělo jiný typ B-NHL nebo nebyli blíže klasifikováni. Skupinu nemocných s T-NHL tvořilo 283 (2,7 % ) pac. s PTCL NOS, 198 (1,9 %) pac. s ALCL a 309 (3,0 %) pac. mělo jiný typ T-NHL. Věkový medián celého souboru byl 62 let (17-97) a bylo stejné zastoupení mužů (51,2 %) a žen (48,8 %). Celkem 9 718 nemocných mělo dostatečná data léčby a sledování. Medián celkového přežití (OS) B-NHL byl 13,0 let, medián přežití T-NHL 3,4 roku. Medián OS B-NHL léčených chemoterapií byl 8,7 roku, použití rituximabu (R) a chemoterapie vedlo ke 36% snížení rizika úmrtí – medián OS nebyl dosažen (HR 0,64, p<0,0001). Významný podíl na tom mělo zlepšení u pacientů s DLBCL s mediánem OS 5,9 roku po chemoterapii ve srovnání s nedosažením mediánu OS při imunochemoterapii, se snížením rizika úmrtí o 44 % (HR 0,56, p<0,0001). Přidání R k chemoterapii vedlo k signifikantnímu snížení rizika úmrtí u FL o 24 % (HR 0,76, p=0,012), u SLL o 40 % (HR 0,60, p<0,01) a MCL o 33 % (HR 0,67, p<0,001). Při hodnocení dopadu přidání R do léčby MZL nebylo zlepšení signifikantní. Při hodnocení celkového dopadu přidání R do léčby na celou populaci NHL bylo pozorováno signifikantní zlepšení přežití nemocných diagnostikovaných v letech 2009-2014 ve srovnání s lety 1999-2001. Riziko úmrtí bylo sníženo o 14 % (HR 0,86, p<0,001). To bylo způsobeno zejména snížením rizika úmrtí u B-NHL o 13 % (HR 0,87, p<0,005). U T-NHL byl pozorován trend s HR 0,82, který však nebyl signifikantní (p=0,2). Závěry: 1. V průběhu posledních 30 let došlo ke zvýšení incidence NHL v ČR o 100 %, mortalita však od roku 2001 začala klesat. 2. Analýza LP-CLSG v letech 1999-2014 ukázala signifikantní zlepšení osudu nemocných zařazením cílené terapie (rituximab) do léčby. Jednalo se zejména o DLBCL s HR 0,56, FL s HR 0,76, MCL s HR 0,67 a SLL s HR 0,60. To se projevilo zlepšením OS v celé populaci NHL. Nelze však vyloučit i jiné faktory, neboť i u T-NHL bylo pozorováno zlepšení (HR 0,80), byť nebylo signifikantní.
2972. Možnosti diagnostiky a diferenciální diagnostiky B-lymfomů s intermediárními rysy mezi DLBCL a BL
Campr V., Mrhalová M., Kalinová M., Kodet R.
(Ústav patologie a mol. mediciny, FN Motol, Praha)
Burkittův lymfom (BL) a difuzní velkobuněčný B-lymfom (diffuse large B-cell lymphoma, DLBCL) jsou v klasifikaci WHO jednoznačně definované kategorie agresivních B-lymfomů, které mají odlišné morfologické a klinické charakteristiky, v případě dospělých pacientů vyžadují odlišný terapeutický přístup a mají různou prognózu. Jejich odlišení je tak kruciální. Mezi oběma jednotkami existuje poměrně úzká „šedá zóna“ případů s hraniční morfologií a molekulárními změnami, pro kterou klasifikace WHO navrhla termín „neklasifikovatelný B-lymfom s rysy intermediárními mezi DLBCL a BL“ (B-cell lymphoma, unclassifiable, with features intermediate between DLBCL and BL, BCLU). BCLU tedy není nosologická jednotka, ale je to „waste basket“ pro heterogenní skupinu nádorů nesplňujících kritéria pro DLBCL či BL, která umožňuje jejich samostatnou analýzu a současně brání, aby jejich přítomnost ovlivnila výsledky studia sestav dobře definovaných DLBCL či BL.
Burkittův lymfom je definován jako vysoce agresivní ne-Hodgkinův lymfom tvořený monomorfními B-lymfocyty. Nádorové elementy jsou střední velikosti a mají vícečetná drobná jadérka. Mitotická a apoptotická aktivita jsou silně vyjádřené. Pravidlem je obraz „hvězdného nebe“, který je na pozadí tmavší nádorové populace tvořen disperzními světlými histiocyty fagocytujícími apoptotické buňky. Klasický BL je pozitivní při průkazu znaků zralého periferního B-lymfocytu CD20, CD79a, PAX5 a CD22 a má membránovou expresi IgM, negativní je TdT. Silnou expresí CD10 a BCL6 nádorové buňky odpovídají buňkám zárodečných center (germinal center, GC). Negativní jsou BCL2 a MUM1/IRF4, slabá nebo parciální exprese jednoho z těchto znaků však sama o sobě diagnózu BL nevylučuje. Proliferační index stanovený pomocí Ki67/MIB1 je prakticky 100 %. Definující je přestavba genu MYC, nejčastěji v rámci reciproké translokace t(8;14)(q24;q32) resp. jejích variant t(2;8)(p12;q24) a t(8;22)(q24;q11), která je spojena s imunohistologicky detekovanou expresí proteinu MYC. Karyotyp BL typicky není komplexní, přestavby genů BCL2 či BCL6 se neprokazují.
Difuzní velkobuněčný B-lymfom je tvořen velkými buňkami charakteru centroblastů či imunoblastů, případně mohou být anaplastické až RS-like. Nádor exprimuje znaky zralého B-lymfocytu. Proliferace je vysoká a někdy přesahuje 95 %. Pomocí tzv. schématu Hansové je imunohistologicky možno rozlišit GC-like subtyp s expresí CD10 a BCL6 a nonGC-like subtyp CD10 negativní a MUM1 pozitivní. Tyto dvě skupiny se zhruba kryjí se subtypem s genovým expresním profilem buněk zárodečných center (GCB) resp. postgerminálních aktivovaných B-buněk (ABC). Zejména u nonGC-like subtypu je běžná exprese BCL2 často s koexpresí MYC, přičemž přestavba MYC se prokazuje max. u 10 % případů DLBCL. Morfologicky typický DLBCL s přestavbou MYC do kategorie BCLU nepatří. Karyotyp DLBCL je komplexní, běžná je přestavba BCL6 či BCL2. Nádorové buňky bývají silně atypické, ale mohou být i i dosti uniformní, velikostí srovnatelné s elementy BL a při vysokém proliferačním a apoptotickém indexu se může tvořit obraz „hvězdného nebe“. Odlišení DLBCL s GC--like imunofenotypem od BL je někdy obtížné a v části případů se nedaří nádor přesně klasifikovat. Tyto případy se dříve označovaly jako „atypický Burkittův lymfom“ či „Burkitt-like lymfom“. Pro konfúznost termínů se špatnou reprodukovatelností klasifikace WHO jejich používání nedoporučuje a preferuje zařazení nádorů do kategorie BCLU.
Problematiku diferenciální diagózy DLBCL vs. BL vs. BCLU lze shrnout do čtyř hlavních okruhů.
- Případy s morfologií intermediární mezi DLBCL a BL. U nádorů s intermediární morfologií a GC-like imunofenotypem negativita BCL2, proliferace nad 95 % a izolovaná přestavba MYC svědčí spíše pro BL. Naproti tomu pozitivita BCL2, proliferace do 90 % a nepřítomnost přestavby MYC při event. přestavbě BCL6 či BCL2 řadí nádor do kategorie DLBCL. Jako BCLU se označí případy s proliferací nad 95 %, expresí BCL2, komplexním karyotypem a přestavbou MYC ať již typickou (kdy jsou partnerem imunoglobulinové geny) tak atypickou (s jinými partnery).
- BL s atypickým imunofenotypem, zejména s expresí BCL2. Pokud u nádoru s jinak typickými rysy BL není pozitivita BCL2 spojena s přestavbou genu (a jednalo by se tedy o double hit lymfom resp. BCLU), ale je způsobena jinými příčinami, jedná se o BL.
- BL s typickým imunofenotypem bez přestavby MYC. Doporučuje se provádět vyšetření FISH více sondami a event. doplnit cytogenetické vyšetření. Pokud je nepřítomnost zlomu jediným abnormálním rysem, může se tumor označit jako BL. V opačném případě se jedná o BCLU.
- Lymfomy se dvěma a více translokacemi. Jako BCLU se klasifikují všechny lymfomy jakékoli morfologie, u kterých se současně prokáže přestavba MYC a BCL6 resp. BCL2, event. vzácně CCND1, označované „double hit“ lymfomy (DHL). Menší část DHL vzniká transformací folikulárního lymfomu, kdy se přestavba MYC objevuje v nádorové populaci s t(14;18). Vzácně jsou popsány případy s třemi přestavbami („triple hit“ lymfomy).
Závěr. V dobře definovaných jednotkách BL a DLBCL má diagnostika opřená o komplexní vyšetření pevné mantinely. BCLU tvoří směsice různorodých nálezů, které se odklánějí od BL a DLBCL. Lze očekávat, že s rozvojem metod typu sekvenování nové generace se podaří charakterizovat jednotlivé varianty BCLU a zpřesnit jejich diagnostiku, tak aby byla relevantní pro klinické rozhodování a predikci odpovědi na léčbu.
„Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol)“
2952. Současné standardy v určování klinického stadia a hodnocení léčebné odpovědi u nemocných s maligními lymfomy
Sýkorová A., Pytlík R., Móciková H., Belada D., Benešová K., Papajík T., Janíková A., Šálek D., Procházka V., Vokurka S., Campr V., Klener P., Kubáčková K., Trněný M.
(IV. interní hematologická klinika, FN a LF UK, Hradec Králové; I. interní klinika, 1.LF UK a VFN, Praha; Interní hematologická klinika, FN Královské Vinohrady a 3. LF UK, Praha; Hematoonkologická klinika, FN, Olomouc; Interní hematologická a onkologická klinika, FN, Brno; Hematologicko – onkologické oddělení, FN, Plzeň; Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha; Onkologická klinika, FN Motol, Praha)
Úvod: Prognóza nemocných s maligním lymfomem je závislá na histologickém/molekulárně - genetickém podtypu lymfomu, prognostických faktorech a především ji významně ovlivňuje kvalita dosažené léčebné odpovědi. Prognostické faktory jsou specifické pro určité typy lymfomů a většinou zahrnují klinické stadium, věk, tělesnou kondici, a hodnotu laktátdehydrogenázy (LDH). [1-4, 5] Důležitým rizikovým faktorem ve většině prognostických indexech je rozsah onemocnění, které je základem pro hodnocení léčebné odpovědi.
Současné standardy určování klinického stadia a hodnocení léčebné odpovědi jsou založeny na tzv. „Luganské klasifikaci 2014“. [6,7] Tato klasifikace byla podrobena diskusi a konsenzuálnímu stanovisku k jejímu praktickému použití v roce 2015 na výročním zasedání Kooperativní lymfomové skupiny (KLS) a předkládané doporučení je výsledkem tohoto konsenzu. Doporučení v plném rozsahu bylo v lednu roku 2016 přijato k publikaci do časopisu Klinická Onkologie. [8]
Určování rozsahu onemocnění: K určování rozsahu onemocnění se používá fyzikální vyšetření společně se zobrazovacími metodami. Ze zobrazovacích metod má dominantní postavení PET/CT vyšetření, které nahradilo samostatné CT vyšetření, a to nejen u difuzního velkobuněčného B – lymfomu (DLBCL) a Hodgkinova lymfomu (HL), ale i u řady dalších lymfomů. [9-11] PET/CT vyšetření se nedoporučuje provádět u (18F)FDG neavidních lymfomů – tj. u lymfomu z malých lymfocytů, kožních lymfomů, Waldenströmovy makroglobulinemie/lymfoplasmocytárního lymfomu, lymfomu z marginální zóny, pokud u těchto diagnóz není suspekce na transformaci onemocnění nebo mimokožní postižení (v případě primárně kožních lymfomů). [7]
Na podkladě rozsahu onemocnění určeného zobrazovacími metodami se určuje klinické stadium dle modifikované Ann Arbor klasifikace. V „Luganské klasifikaci“ z roku 2014 je představena nová modifikace AA klasifikace, kdy stadium I a II je lokalizovaným, stadium III a IV pokročilým onemocněním a navíc je zvlášť vyčleněno klinické stadium II s přítomností masivního postižení (tzv. KS II s „bulky“ postižením). Toto „intermediární“ klinické stadium však nemá jednotný význam. [6] Tabulka 1 ukazuje revidovanou AA klasifikaci z roku 2014 pro primárně nodální lymfomy.
Tab. 1. Revidovaná Ann Arbor klasifikace dle IWG z roku 2014 a doplněná, resp. modifikovaná klasifikace dle Kooperativní lymfomové skupiny ČR (toto označené kurzívou) 
Legenda „velké“ EN orgány – játra, plíce, mezotel (pleura, pobřišnice, perikard), kostra, měkké tkáně. „malé“ EN orgány – jiné než „velké“ orgány. E – extranodální postižení Hodnocení masivního postižení (tzv. „bulk“): Přítomnost masivního postižení je u některých lymfomů negativním prognostickým znakem. Velikost „bulku“ není současnými kritérii jednoznačně definována a hodnotí se v závislosti na typu lymfomu (Hodgkinův vs. Non-Hodgkinův lymfom).
Určování extranodálního postižení: Revize kritérií z roku 2014 nepřispěla k určování rozsahu onemocnění s extralymfatickým postižením, proto KLS doporučuje se řídit u extralymfatického postižení dohodou z roku 2010, kdy extranodální orgány jsou z praktického hlediska rozděleny na tzv. „malé“ a „velké“, pro které byl zvolen odlišný přístup k určování rozsahu onemocnění z důvodu rozdílného klinického dopadu při jejich postižení [12, obrázek 1]. Označení „E“ je dle nových kritérií z roku 2014 doporučováno uvádět u extralymfatického postižení u časných stadií I bez nodálního postižení a u st. II s nodálním postižením šířícím se „per continuitatem“ extralymfaticky.
Postižení a velikost sleziny/jater: Slezina je označena za postiženou lymfomem, pokud je zvětšena v podélné ose > 13 cm a/nebo je přítomna PET pozitivita a/nebo jsou přítomna ložiska ve slezině a/nebo proběhla histologická verifikace postižení. [6,12,13] Pro postižení jater platí stejné podmínky, ale samotná hepatomegalie neznamená postižení lymfomem. [6,12]
Vyšetření kostní dřeně: Dle současného standardu dle revidovaných kritérií z roku 2014 došlo ke změně požadované velikosti vzorku dřeně z 20 mm na 25 mm z jednostranné biopsie. [6]
Vysoká senzitivita PET/CT vyšetření při postižení dřeně vedla k otázce, zda je nadále třeba provádět histologické vyšetření dřeně u všech typů lymfomů. Doporučení je takové, že u Hodgkinova lymfomu se vyšetření dřeně neprovádí, pokud bylo provedeno PET/CT vyšetření. Vyšetření dřeně není nově vyžadováno ani u difuzního velkobuněčného B – lymfomu, pokud nás nezajímá eventuální diskordantní nález ve dřeni a pokud není pacient zařazen do klinické studie, kde je trepanobioptické vyšetření požadováno. Dle konsenzu KLS dřeň ale nadále vyšetřujeme pro riziko PET/CT falešné negativity/pozitivity či pro možnost přítomnosti diskordantního nálezu ve dřeni. [6] U všech lymfomů s nízkým stupněm malignity a u lymfomů z buněk pláště je nadále doporučeno bioptické vyšetření dřeně provádět.
B – symptomy: Dle nových doporučení z roku 2014 se doporučuje přítomnost „B“ příznaků uvádět pouze u Hodgkinova lymfomu, kde mají prognostický význam. U NHL se nově uvádět nemusí, neboť nejsou součástí žádného prognostického indexu, a tak nemají žádný vliv na prognózu. [6] KLS ale doporučuje přítomnost či nepřítomnost B - symptomů do dokumentace zaznamenávat i u NHL na základě zkušeností, že jejich přetrvávání v průběhu léčby může být známkou nedostatečné klinické odpovědi a jejich znovuobjevení může předcházet jiným projevům relapsu.
Vstupní hodnocení a hodnocení léčebné odpovědi u (18F)FDG PET avidních lymfomů - kvalitativní hodnocení PET/CT dle „Deauville kritérií“ - rok 2014 [7]: Výsledek vstupního záchytu (18F)FDG v postižených oblastech je stěžejní pro hodnocení metabolické odpovědi při hodnocení léčebné odpovědi jak v průběhu léčby (v současnosti především v klinických studiích), tak po jejím skončení. Hodnocení PET nálezu je v současné době hodnoceno vizuální pětistupňovou škálou koncipovanou na 1. Mezinárodním pracovním setkání týkající se použití PET vyšetření u lymfomů v Deauville v roce 2009. [14-16] Charakteristika kritérií je uvedena v tabulce 2.
Tab. 2. „Deauville“ kritéria pro hodnocení metabolické odpovědi u PET/CT vyšetření 
Kooperativní lymfomová skupina doporučuje pro hodnocení léčebné odpovědi používat revidovaná Chesonova kritéria z roku 2014 založená u většiny lymfomů na PET/CT vyšetření. Vzhledem k tomu, že stále není možné PET/CT použít ve všech indikovaných případech a vzhledem k tomu, že je nashromážděno velké množství dat u nemocných, kde pro hodnocení byla použita starší léčebná kritéria, doporučuje KLS při slovním hodnocení odpovědi použít jak hodnocení dle CT, tak dle PET (příklad: dle CT parciální remise, PET negativní, celkově tedy kompletní remise).
Vstupní hodnocení a hodnocení léčebné odpovědi u (18F)FDG PET neavidních lymfomů dle CT: Samostatné CT vyšetření a tzv. „CT kritéria“ se užívají u (18F)FDG neavidních či variabilně (18F)FDG avidních subtypů lymfomů u nemocných bez vstupního (18F)FDG PET/CT vyšetření nebo se vstupně negativním (18F)FDG PET/CT vyšetřením. Při CT vyšetření se vstupně hodnotí až 6 největších dvojrozměrně měřitelných lézí z různých oblastí ve 2 na sebe nejdelších kolmých rozměrech. Do hodnocení musí být zavzato mediastinální a retroperitoneální postižení, pokud je přítomno. Vstupně tedy zjistíme velikost SPD (sum of products diameters), který je definován jako součet násobků dvou na sebe kolmých největších rozměrů u 6 největších uzlin nebo uzlinových infiltrátů/extranodálních měřitelných lézí. [6,17,18] V případě nepřítomnosti měřitelné léze se za neměřitelnou lézi považuje postižení dřeně a difuzní postižení dalších extranodálních tkání (např. kůže, játra, ledviny, mezotel atp.).
Dle nových doporučení z roku 2014 je velikost normální uzliny při hodnocení léčebné odpovědi simplifikována (≤ 1,5 cm v nejdelší ose). [6] Při úplné odpovědi musí slezina regredovat ≤ 13 cm v podélné ose, velikost jater není definována. [6]
Tabulka 3 shrnuje revidovaná doporučení pro hodnocení léčebné odpovědi z roku 2014 podle PET/CT ve srovnání s CT vyšetřením. Tabulky 4 a 5 ukazují zjednodušená „PET/CT a CT kritéria“.
Tab. 3. Revidovaná kriteria léčebné odpovědí z roku 2014 dle PET/CT a CT vyšetření 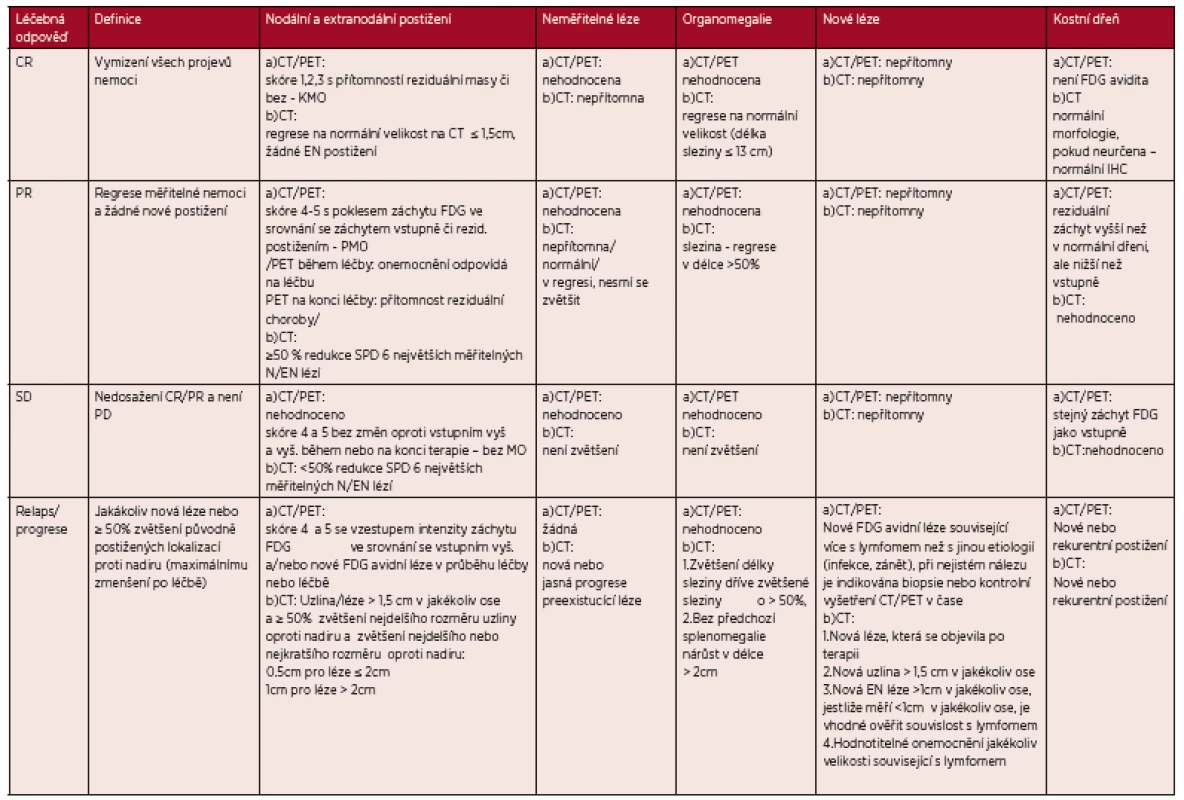
Legenda: CT – computed tomography – počítačová tomografie, PET – pozitronová emisní tomografie, FDG – fluorodeoxyglukoza, IHC - imunohistochemie, SPD (sum of products diameters= součet násobků dvou na sebe kolmých největších rozměrů mnohočetných lézí) Hodnocení FDG avidity – „Devauillské“ skóre 1-5: skóre 1- bez záchytu FDG oproti pozadí, skóre 2 – záchyt FDG ≥ medastinumu, skóre 3 – záchyt FDG >mediastinum ≤játra, skóre 4 – záchyt FDG > játra, skóre 5 – záchyt FDG výrazně vyšší než nad játry a/nebo přítomnost nových lézí, KMO – kompletní metabolická odpověď, PMO – parciální metabolická odpověď, MO – metabolická odpověď. Tab. 4. Zjednodušení tabulky 3 - „PET/CT kritéria“ (Cheson 2014) 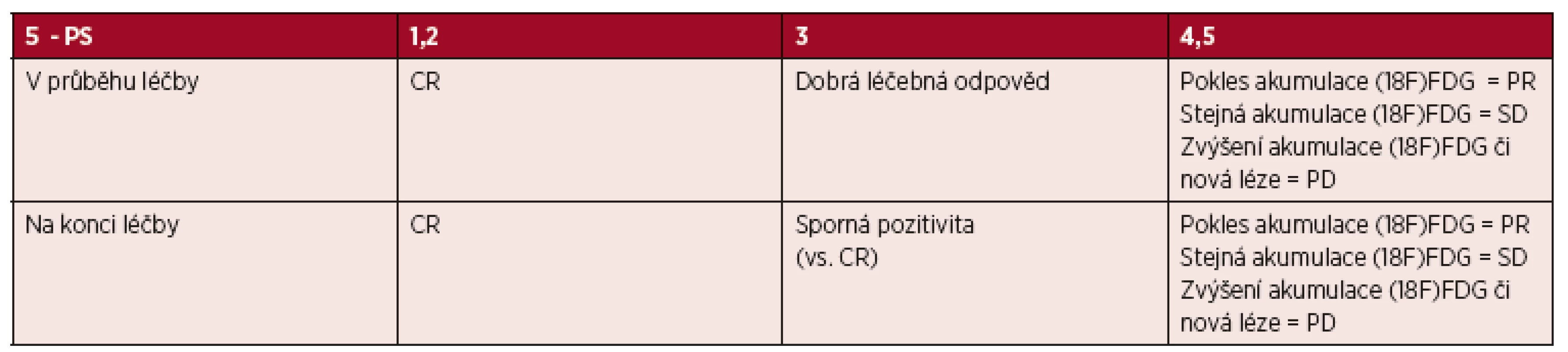
Legenda: CR – kompletní remise, (18F)FDG –18 - fluorodeoxyglukoza, PR – parciální remise, SD – stabilní choroba, PD - progrese Tab. 5. Zjednodušení tabulky 3 – „CT kritéria“ (Cheson 2014) 
Legenda: LU – lymfatická uzlina, EN – extranodální, IHC – imunohistochemie, CR – kompletní remise, PR – parciální remise, PD – progresivní choroba, S – slezina, SPD (sum of products diameters = součet násobků dvou na sebe kolmých největších rozměrů u 6 největších uzlin nebo infiltrátů/lézí). Obr. 1. Dohoda KLS pro určování klinického stadia u NHL s extralymfatickým šířením dle Ann Arbor klasifikace a modifikované Ann Arbor klasifikace, stadium IE vs. IVE 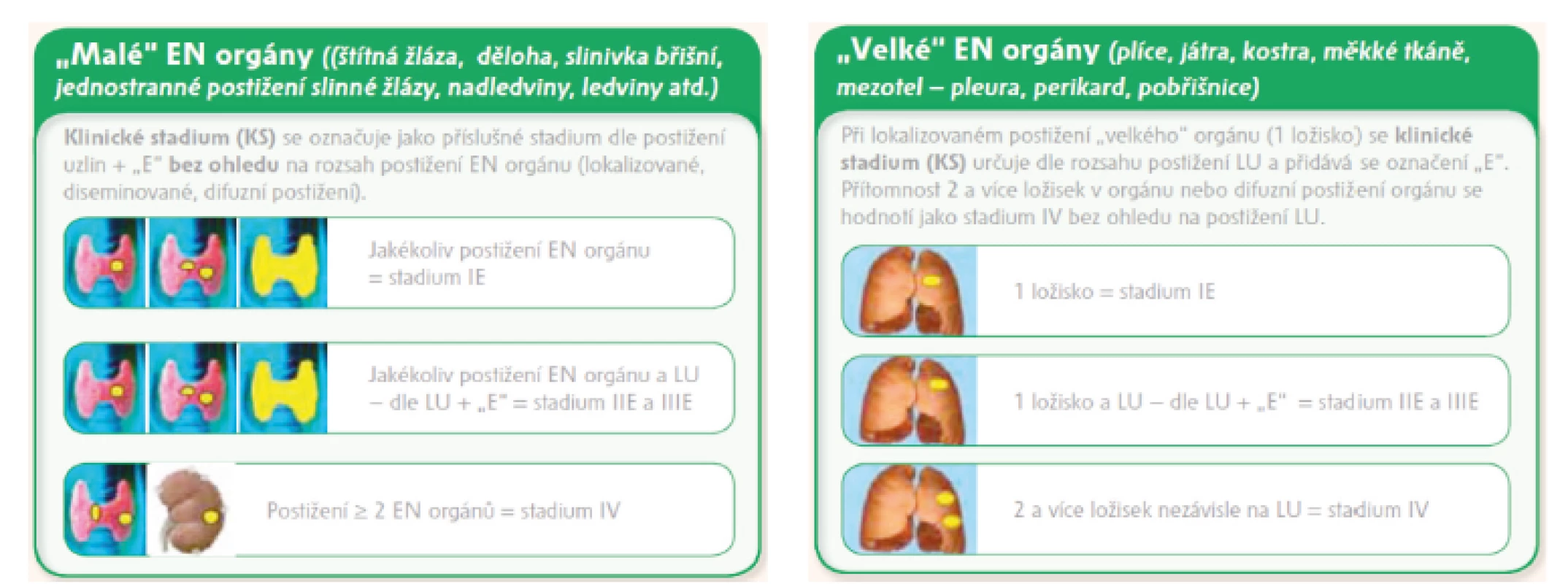
Legenda: LU – lymfatická uzlina, EN – extranodální, IHC – imunohistochemie, CR – kompletní remise, PR – parciální remise, PD – progresivní choroba, S – slezina Závěr:
Současná „Luganská klasifikace 2014“ vznikla s ohledem na široké používání metody PET/CT, kdy léčebná odpověď dle PET/CT je v současné době nejvýznamnějším prognostickým faktorem u nemocných s lymfomy. Standardizace kritérií pro určování klinického stadia a léčebné odpovědi u maligních lymfomů vede ke zlepšenému hodnocení rozsahu onemocnění a odpovědi na léčbu a napomáhá hledání účinnějšího způsobu terapie ke zlepšení prognózy pacientů s tímto onemocněním. Slouží k jednotnému hodnocení výsledků klinických studií a současně zjednodušuje práci regulačním agenturám (EMA, SÚKL) v procesu registrace nových léčiv. Zároveň umožňuje i hodnocení léčebných výsledků mimo klinické studie, například v rámci lymfomového projektu Kooperativní lymfomové skupiny – prospektivně vedené databázi nově diagnostikovaných pacientů s lymfomy. Revize kritérií v roce 2014 přinesla řadu zjednodušení a upřesnění v hodnocení rozsahu onemocnění a hodnocení léčebné odpovědi, ale současně zůstávají nezodpovězené otázky k diskusi, které by měly být předmětem další revize v budoucnu.
Použitá literatura:
- Shipp MA. Prognostic factors in aggressive non-Hodgkin‘s lymphoma: who has „high-risk“ disease? Blood 1994; 83(5):1165-73.
- Sehn LH, Berry B, Chhanabhai M et al. The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Blood 2007; 109(5):1857-1861.
- Solal-Céligny P, Roy P, Colombat P et al. Follicular lymphoma international prognostic index. Blood 2004; 104(5):1258-1265.
- Federico M, Bellei M, Marcheselli L. Follicular lymphoma international prognostic index 2: a new prognostic index for follicular lymphoma developed by the international follicular lymphoma prognostic factor project. J Clin Oncol 2009; 27(27):4555-4562.
- Hasenclever D, Diehl V. A prognostic score for advanced Hodgkin´s disease. International Prognostic Factors Project on Advanced Hodgkin´s Disease. N Engl J Med 1998; 339(21), 1506-1514.
- Cheson BD, Fisher RI, Barrington SF et al. Recommendation for Initial Evaluation, Staging, and Response Assessment of Hodgkin and Non - Hodgkin Lymphoma: The Lugano Classification. J Clin Oncol. 2014;32(27): 3059-3067.
- Barrington SF, Mikhaeel NG, Kostakoglu L et al. Role of Imaging in the Staging and Response Assessment of Lymphoma: Consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014;32(27): 3048-3058.
- Sýkorová A, Pytlík R, Móciková H et al. Určování klinického stadia a hodnocení léčebné odpovědi u nemocných s maligními lymfomy – doporučení Kooperativní lymfomové skupiny na základě revidovaných kritérií z roku 2014 (Luganská klasifikace). KlinOnkol. Přijato k publikaci 1/16.
- Hutchings M, Loft A, Hansen M et al: Position emission tomography with or without computed tomography in the primary staging of Hodgkin’s lymphoma. Haematologica 2006; 91(4):482-489.
- Elstrom R, Leonard JP, Coleman M et al. Combined PET and low-dose, noncontrast CT scanning obviates the need for additional diagnostic contrast-enhanced CT scans in patients undergoing staging or restaging for lymphoma. Ann Oncol 2008;19(10): 1770-1773.
- Pelosi E, Pregno P, Penna D et al. Role of whole-body [18F] fluorodeoxyglucose positron emission tomography/computed tomography (FDGPET/CT) and conventional techniques in the staging of patients with Hodgkin and aggressive non Hodgkin lymphoma. Radiol Med 2008;113(4): 578-590.
- Sýkorová A, Belada D, Smolej L et al. Určování rozsahu onemocnění u non-Hodgkinových lymfomů-doporučení Kooperativní lymfomové skupiny. Klin Onkol 2010; 23(3):146-154.
- Lister TA, Crowther D, Sutcliffe SB et al. Report of a commitee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds Meeting. J Clin Oncol 1989; 7(11):1630-36.
- Boellaard R, Oyen WJ, Hoekstra CJ et al: The Netherlands protocol for standardisation and quantification of FDG whole body PET studies in multi-centre trials. Eur J Nucl Med Mol Imaging 2008;35(12):2320-2333.
- Barrington SF, Qian W, Somer EJ et al: Concordance between four European centres of PET reporting criteria designed for use in multicentre trials in Hodgkin lymphoma. Eur J Nucl Med Mol Imaging 2010;37(10):1824-1833.
- Meignan M, Gallamini A, Haioun C: Report on the First International Workshop on Interim-PET Scan in Lymphoma. Leuk Lymphoma 2009;50(8):1257-1260.
- Cheson BD, Horning SJ, Coiffier B et al: Report of an International Workshop to standardize response criteria for non-Hodgkin’s lymphomas: NCI Sponsored International Working Group. J Clin Oncol 1999; 17(4):1244-1253.
- Cheson BD, Pfistner B, Juweid ME et al. Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25(5):579-86.
2909. Současné možnosti buněčné imunoterapie v léčbě lymfoidních neoplázií
Lysák D., Holubová M.
(Hematologicko-onkologické oddělení, FN, Plzeň)
Protinádorová imunoterapie je širokým pojmem, který zahrnuje množství léčebných modalit. Může se jednat o aktivní imunoterapii nejčastěji ve formě protinádorových vakcín na bázi dendritických buněk či genetické imunizace nebo pomocí modulace imunitní odpovědi s ovlivněním inhibičních či aktivačních receptorů TCR signalizace. Jiným typem imunoterapie je adoptivní přenos imunitně efektivních komponent, kterými mohou být monoklonální protilátky anebo buněčná imunoterapie, která zahrnuje nádorově specifické T-lymfocyty, tumor infiltrující lymfocyty (TIL) a zejména geneticky modifikované lymfocyty exprimující chimerický antigenní receptor (CAR).
T-lymfocyty mají přirozeně schopnost vázat se na nádorové antigeny, rozpoznávat nádorové buňky jako cizorodé a způsobovat jejich destrukci. Bohužel řada nádorů je jen omezeně imunogenních a nevyvolávají dostatečnou T - buněčnou imunitní odpověď a současně využívají řadu mechanismů jak imunitní odpovědi unikat (imunosupresivní cytokiny a inhibiční molekuly, TREG atd.). Důležitým cílem moderní buněčné imunoterapie je její zacílení proti nádorovým buňkám na straně jedné a minimalizace působení na zdravé tkáně na straně druhé.
Myšlenka na využití T - buněčné adoptivní terapie vychází z GVL efektu, který pozorujeme po alogenní transplantaci, a také z úspěšného použití DLI (donor lymphocyte infusion) k léčbě potransplantačních relapsů či perzistujícího smíšeného chimerismu. Alogenní transplantace i imunomanipulace pomocí DLI jsou ale zatížené nezanedbatelnou toxicitou a rizikem těžkých forem reakce štěpu proti hostiteli (GVHD).
Z oblasti buněčné imunoterapie je v současné době v popředí zájmu hemato-onkologů zejména využití tzv. CAR T - lymfocytů. Základní struktura CARu (chimerický antigenní receptor) se skládá z extracelulární domény, která se specificky váže na cílový antigen, a z intracelulární signální domény, která spouští cytotoxickou odpověď. Extracelulární vazebná doména je získána z variabilního regionu monoklonální protilátky specifické k danému antigenu. Intracelulární část využívá nejčastěji CD3ζ aktivační doménu z T-buněčného receptoru (TCR) ve spolupráci s jedním nebo více kostimulačními receptory (jako např. CD28, 4-1BB). Kostimulační signály jsou nezbytné k dosažení plně funkční aktivace T-lymfocytů s dostatečnou mírou proliferace, cytotoxické aktivity a k jejich dlouhodobému přežití. Nádorové buňky a mikroprostředí neposkytují dostatek kostimulačních signálů a podporují vznik anergie T-lymfocytů. Podle počtu kostimulačních domén můžeme rozlišovat různé generace CARů. Například třetí generace CARů kombinuje vícečetné signalizační domény (CD3ζ/CD28/4-1BB, CD3ζ/CD28/OX40 atd.), které dále zvyšují efekt CAR T-lymfocytů. Tzv. čtvrtou generací CARů jsou TRUCK (T cells redirected for universal cytokine killing), kde vektor kódující CAR konstrukt obsahuje také sekvenci pro cytokin (např. IL-12), který je produkován po vazbě CARu na nádorový antigen a kumuluje se v cílové tkáni. Akumulace prozánětlivého cytokinu má za cíl přitáhnout ostatní imunokompetentní buňky (NK buňky, makrofágy atd.).
CAR T-lymfocyt se váže pomocí takto upraveného chimerického receptoru na cílový antigen (např. CD19) nacházející se na povrchu nádorových buněk. Následně dojde k aktivaci buněčných signalizačních kaskád T-lymfocytu, které napodobují přirozenou aktivaci cytotoxického T - lymfocytu, a k lýze nádorových buněk. CAR T-lymfocyty tedy kombinují vazebné vlastnosti monoklonálních protilátek a cytotoxickou kapacitu a schopnost proliferace T-lymfocytů. Výhodou modifikovaného CAR receptoru je skutečnost, že rozeznání a vazba cílového antigenu nejsou závislé na jeho standardní presentaci v kontextu HLA molekuly. CAR T-lymfocyty jsou schopné vázat pouze povrchové antigeny. Použitý antigen musí být nádorově specifický, aby CARy nevyvolávali autoimunitní reakci či jiné vedlejší efekty, které by mohly být i letální. Nejčastěji využívanými jsou CAR T-lymfocyty se specifitou vůči antigenu CD19, který je exprimován na B-lymfocytech a B-lymfoidních progenitorech, nikoliv však na kmenových buňkách, a tím představuje ideální cíl pro léčbu B - lymfoidních neoplazií (ALL, CLL či NHL).
Výchozím materiálem pro přípravu CAR T-lymfocytů je leukaferetický produkt, ze kterého se izolují mononukleární leukocyty nebo T-lymfocyty. Genetická modifikace T-lymfocytů CAR konstruktem se provádí nejčastěji retrovirovým vektorem nebo pomocí transpozoáz. Po provedení transfekce/transdukce jsou T-lymfocyty dále in vitro kultivovány v přítomnosti cytokinů (např. IL-2) a kostimulačních signálů (např. anti-CD3/CD28 protilátky). Během několika dní dochází k jejich aktivaci a několikanásobné expanzi umožňující získat klinicky relevantní dávku.
Dávky CAR T-lymfocytů aplikované v klinických studiích se pohybovaly v rozmezí 1x105 – 3x107/kg hmotnosti pacienta, nejčastěji v jedné infuzi. Jejich podání zpravidla předchází lymfodepleční chemoterapie, která vytváří prostor pro expanzi CAR T-lymfocytů potlačením supresorových vlivů v hostitelském mikroprostředí a snížením endogenní lymfocytární kompetice. CAR T-lymfocyty po aplikaci proliferují a mohou dlouhodobě přežívat (měsíce až roky). Naopak nedostatečný engraftment modifikovaných T-lymfocytů je jedním z hlavních důvodů selhání imunoterapie. Počty CAR modifikovaných T-lymfocytů a jejich perzistenci v krvi pacienta je možné stanovovat pomocí PCR metod nebo detekcí CAR antigenu na povrchu lymfocytů průtokovou cytometrií.
V současné době je ve světě otevřeno více než 90 klinických hodnocení zabývajících se CAR modifikovanými T-lymfocyty (www.clinicaltrial.gov), která se věnují nejen hematologickým maligním onemocněním ale i solidním nádorům (meduloblastom atd.). Nejvíce zkušeností je s B-lymfoidními neoplaziemi, na kterých byla CAR technologie původně vyvíjena. CAR T-lymfocyty se specifitou proti CD19 antigenu (CTL019) prokázaly výbornou efektivitu u pacientů s akutní lymfoblastickou a chronickou lymfocytární leukémií. Jednotlivé studie se obtížně porovnávají pro metodologické rozdíly (různé typy a dávky CARů, různé chemoterapie, načasování léčby atd.) a jedná se většinou o malé soubory pacientů. Obecně je efekt CAR T-lymfocytů vyšší u ALL, kde se dosahuje až 70 -90 % CR, než u CLL s cca 30 % CR (ORR 20 – 75 %). Větší soubor 14 pacientů s výrazně předléčenou relabující/refrakterní (R/R) CLL publikoval recentně Porter a kol. (1). Odpovědi bylo dosaženo u 8 pacientů (ORR 57 %), z toho 4x CR a 4x PR. In vivo expanze CAR T-lymfocytů korelovala s klinickou odpovědí a lymfocyty přežívaly až 4 roky po aplikaci. U pacientů v kompletní remisi nebyla detekovatelná reziduální nemoc, což naznačuje možnost eradikace onemocnění u části pacientů s pokročilou CLL.
První klinická data jsou k dispozici i pro pacienty s nehodgkinovskými lymfomy. Kochenderfer a kol. dosáhl po podání CTL019 kompletní remise u osmi z 15 pacientů s pokročilým NHL (2). Schuster a kol. aplikoval CTL019 20 pacientům s pokročilým CD19+ NHL bez možnosti další kurativní léčby. Bylo dosaženo 67 % ORR a 59 % PFS v 6-ti měsících (3). Turtle a kol. dokazuje na svém souboru 28 pacientů s R/R NHL význam lymfodepleční chemoterapie. Přidání fludarabinu k cyklofosfamidu vedlo k větší expanzi a delší persistenci podaných CTL019, což se projevilo i lepší klinickou odpovědí (ORR 67 % vs. 50 %) (4). Ve studii Sauter a kol. byly CTL019 aplikovány bezprostředně po autologní transplantaci osmi pacientům s R/R NHL, z nichž 5 dosáhlo CR (5). CAR T-lymfocyty namířené proti antigenu CD30 se testují také v terapii R/R Hodgkinova lymfomu, kde budou nejspíše v budoucnu indikovány po autologní transplantaci u pacientů s vysokým rizikem relapsu (6).
Pro CAR buněčnou terapii nelze u mnohočetného myelomu využít antigen CD19, protože jeho exprese na myelomových buňkách je slabá. Jako vhodný cíl se osvědčil BCMA (B-cell maturation antigen), který je přítomen na B-lymfoidní linii včetně myelomových buněk. První aplikace CAR-BCMA (dose escalation study u 11 pacientů s pokročilým R/R MM) prokázala efektivní anti-myelomovou aktivitu CAR T-lymfocytů (7).
CAR T-lymfocyty je možné připravit nejen z autologních lymfocytů, ale je možné modifikovat i alogenní lymfocyty dárcovského původu u pacientů po alogenní transplantaci kostní dřeně. Tím se otvírá možnost léčit potransplantační relapsy nebo implementovat imunoterapii jako součást časné konsolidace po alogenní transplantaci u vysoce rizikových hematologických malignit.
Nové technologie genetického inženýrství umožňují vytvářet universální (off-the-shelf) alogenní CAR T-lymfocyty, které díky odstranění exprese TCR překonávají HLA bariéru, nevyvolávají aloreaktivní odpověď a GVHD. Při současné deficienci CD52 nebo resistenci k fludarabinu je možné provést před jejich aplikací efektivní lymfodepleci neohrožující CAR T-lymfocyty. Tato terapie byla poprvé úspěšně použita u pediatrického pacienta s B-ALL relabující po alogenní transplantaci i léčbě blinatumomabem (8).
Aplikace CAR T-lymfocytů je spojena se specifickými komplikacemi. Častou komplikací je syndrom z uvolnění velkého množství cytokinů (cytokiny release syndrome, CRS), způsobený uvolněním cytokinů (IL-10, IL-6, IFN-γ) při aktivitě a proliferaci CAR T-lymfocytů. Symptomy se pohybují od chřipkových příznaků jako horečka, myalgie až po těžké stavy s hypotenzí, capillary - leak syndromem a respiračním selháním vyžadující intenzivní péči. V různých studiích je výskyt CRS popisován u 20 – 100 % pacientů (těžký CRS u 27 – 53 %). Terapie CRS zahrnuje kortikosteroidy a zejména u těžších forem protilátku proti IL-6 receptoru (tocilizumab). Očekávaným vedlejším účinkem po aplikaci CTL019 je protrahovaná aplazie B-lymfocytů s hypogamaglobulinemií. Závažnost a doba trvání deplece B-lymfocytů závisí především na persistenci CAR T-lymfocytů a slouží zároveň jako nepřímý ukazatel efektivity léčby. Defekt humorální imunity se musí řešit substitucí imunoglobulinů. Neočekávanou toxicitou, která byla popsána v řadě studií, je encefalopatie se symptomatologií zahrnující zmatenost, záchvaty, afázie, změny mentálních funkcí. Tyto nežádoucí účinky jsou reversibilní, časově odpovídají CRS, ale jejich přesná etiologie je nejasná. V rámci snah o zvýšení bezpečnosti léčby CAR T-lymfocyty a omezení zejména dlouhodobé toxicity se testuje využití různých sebevražedných genů jako prostředku eliminace nadměrné nebo již nepotřebné imunitní odpovědi.
Buněčná imunoterapie založená na CAR modifikovaných T-lymfocytech zaznamenává v poslední době mnoho úspěchů nejen u B-lymfoidních neoplazií ale i u dalších hematologických či solidních nádorů. Zůstává nezodpovězena řada otázek týkajících se optimální přípravy a klinického použití CAR T-lymfocytů, na které se snaží odpovědět probíhající klinické studie. Vedle toho se testují možnosti kombinace CARů s monoklonálními protilátkami a imunomodulačními molekulami. CAR T-lymfocyty nabízí obrovský potenciál a možnost vytvářet efektivní protinádorovou léčbu specifickou pro daného pacienta s minimem vedlejších účinků.
Práce byla podpořena grantem MZ ČR-RVO (Fakultní nemocnice Plzeň-FNPl, 00669806), grantem MZ 15-30661A a grantem Nadace pro transplantaci kostní dřeně.
Použitá literatura:
- Porter DL, Hwang WT, Frey NV et al. Chimeric antigen receptor T cells persist and induce sustained remissions in relapsed refractory chronic lymphocytic leukemia. Sci Transl Med 2015; 7(303): 303ra139.
- Kochenderfer JN, Dudley ME, Kassim SH et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor. J Clin Oncol 2015; 33(6): 540-9.
- Schuster SJ, Svoboda J, Nasta S et al. Phase IIa trial of chimeric antigen receptor modified T cells directed against CD19 (CTL019) in patients with relapsed or refractory CD19+ lymphomas. J Clin Oncol 2015; 33 : 8516.
- Turtle CJ, Berger C, Sommermeyer D et al. Anti-CD19 Chimeric Antigen Receptor-Modified T Cell Therapy for B Cell Non-Hodgkin Lymphoma and Chronic Lymphocytic Leukemia: Fludarabine and Cyclophosphamide Lymphodepletion Improves In Vivo Expansion and Persistence of CAR-T Cells and Clinical Outcomes. Blood 2015; 126 (23): 184.
- Sauter CS, Riviere I, Bernal Y et al. Phase I trial of 19-28z chimeric antigen receptor modified T cells (19-28z CAR-T) post-high dose therapy and autologous stem cell transplant (HDT-ASCT) for relapsed and refractory (rel/ref) aggressive B-cell non-Hodgkin lymphoma (B-NHL). J Clin Oncol 2015; 33 : 8515.
- Ramos CA, Ballard B, Liu E et al. Chimeric T Cells for Therapy of CD30+ Hodgkin and Non-Hodgkin Lymphomas. Blood 2015 : 126 (23): 185.
- Ali SA, Shi V, Wang M et al. Remissions of Multiple Myeloma during a First-in-Humans Clinical Trial of T Cells Expressing an Anti-B-Cell Maturation Antigen Chimeric Antigen Receptor. Blood 2015 : 126 (23): LBA-1.
- Qasim W, Amrolia PJ, Samarasinghe S et al. First Clinical Application of Talen Engineered Universal CAR19 T Cells in B-ALL. Blood 2015; 126 (23): 2046.
2944. Aktualizovaná doporučení pro diagnostiku a léčbu chronické lymfocytární leukémie (CLL) České CLL skupiny
Smolej L., Špaček M., Obrtlíková P., Pospíšilová Š., Jarošová M., Urbanová R., Lysák D., Brejcha M., Schwarz J., Doubek M.
(IV. interní hematologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Karlovy, Hradec Králové; I. interní klinika – klinika hematologie, 1. lékařská fakulta Univerzity Karlovy a Všeobecná fakultní nemocnice, Praha; Interní hematologická a onkologická klinika, Fakultní nemocnice a Lékařská fakulta Masarykovy Univerzity, Brno; Hemato-onkologická klinika, Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc; Hematologicko-onkologické oddělení, Fakultní nemocnice, Plzeň; Hematologické oddělení, Nemocnice, Nový Jičín; Ústav hematologie a krevní transfuze, Praha)
V posledních třech letech došlo k zásadnímu vývoji v oblasti prognostických faktorů i léčby chronické lymfocytární leukémie (CLL). Jedná se zejména o prognostický a prediktivní význam mutací genu TP53, zavedení nových monoklonální protilátek a režimů chemoimunoterapie jak do léčby 1. linie nemocných s významnými přidruženými chorobami, tak i do terapie relapsu/refrakterního onemocnění; nejvýznamnější novinku pak představuje registrace cílených inhibitorů drah B-buněčného receptoru, v jejímž důsledku se poněkud mění i postavení alogenní transplantace krvetvorných kmenových buněk. Vzhledem k těmto stěžejním změnám proto vytvořila Česká skupina pro CLL (ČSCLL), sekce České hematologické společnosti ČLS JEP, aktualizovaná doporučení k usnadnění rozhodnování o diagnostických a léčebných postupech v klinické praxi. Doporučení se zakládají na důkladné analýze současné literatury a vycházejí z principů medicíny založené na důkazech. V prezentaci budou shrnuty nejdůležitější změny vůči předchozí verzi doporučení ČSCLL z roku 2013.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek POSTGRADUÁLNÍ SEKCE 1Článek Wiedermannova přednáškaČlánek Postgraduální sekce 2Článek Konference Ošetřovatelství 1Článek Konference Ošetřovatelství 2Článek Mnohočetný myelomČlánek PsychologieČlánek TransplantaceČlánek PREZIDENTSKÉ SYMPOZIUMČlánek Mnohočetný myelomČlánek TransplantaceČlánek Laboratorní diagnostikaČlánek PODPŮRNÁ PÉČEČlánek TRANSFUZNÍ PROBLEMATIKAČlánek RejstříkČlánek MorfologieČlánek Dárcovské a léčebné aferézyČlánek Laboratorní diagnostikaČlánek Anémie/CytopenieČlánek OŠETŘOVATELSTVÍ
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo Supplementum1- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Vliv pH-pufrovací technologie na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Transplantace
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
- POSTGRADUÁLNÍ SEKCE 1
- Laboratorní diagnostika
- PODPŮRNÁ PÉČE
- TRANSFUZNÍ PROBLEMATIKA
- Rejstřík
- Wiedermannova přednáška
- Postgraduální sekce 2
- Symposium on Advances in Molecular Hematology 1: Lymphoma Pathogenesis
- Konference Ošetřovatelství 1
- Symposium on Advances in Molecular Hematology 2: Stressed Hematopoiesis
- Symposium on Advances in Molecular Hematology 3: State of the Art Invited Lecture
- Konference Ošetřovatelství 2
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Psychologie
- Konference zdravotních laborantů 1
- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Transplantace
- Maligní lymfomy/Chronická lymfocytární leukemie
- Konference zdravotních laborantů 2
- PREZIDENTSKÉ SYMPOZIUM
- Morfologie
- Dárcovské a léčebné aferézy
- Laboratorní diagnostika
- Anémie/Cytopenie
- OŠETŘOVATELSTVÍ
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Morfologie
- Anémie/Cytopenie
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



