-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Anémie/Cytopenie
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum1, p. 92-98.
Kategorie: 30. Olomoucké hematologické dny
3006. Nové poznatky v etiopatogenezi a léčbě imunitní anemie a trombocytopenie
Kozák T.
(Interní hematologická klinika, 3. LF Univerzity Karlovy v Praze a FN Královské Vinohrady, Praha)
Autoimunitní hemolytická anémie (AIHA) je způsobena rozpadem erytrocytů díky aktivitě autoprotilátek s aktivací komplementu nebo bez ní. Diagnostika AIHA je souhrnem klinických a laboratorních nespecifických a specifických vyšetření a opírá se zejména o průkaz autoprotilátek navázaných na erytrocyty, tzv. přímý antiglobulinový (Coombsův) test (PAT). Negativní výsledek PAT však ještě AIHA nevylučuje. Více než polovina AIHA je spojena s jiným, základním, onemocněním, jde o sekundární AIHA. AIHA vzniká u vice než 10% pacientů se SLE, u 18% pacientů s původně idiopatickou AIHA se vyvine maligní lymfom. Podle teploty, při níž reagují autoprotilátky s erytrocyty, se rozlišuje AIHA s tepelnými protilátkami (tzv. WA-AIHA), které se vážou na erytrocyt při teplotě 37°C, a AIHA s chladovými protilátkami (CA-AIHA), jejichž optimální teplota pro vazbu na erytrocyt je pod 30°C. AIHA s bifázickými protilátkami se vyskytuje např. u paroxysmální chladové hemoglobinurie (PCH). Incidence WA-AIHA je 1 : 100 000, CA-AIHA je ještě vzácnější onemocnění s incidencí 1 : 1000000. Pro klinický průběh AIHA je důležitý typ autoprotlátky. IgM protilátky dobře aktivují komplement, stejně tak isotypy IgG1 a IgG3. Protilátky IgG2 a IgA aktivují komplement slabě, a isotypy IgG4 komplement neaktivují. Protilátky CA-AIHA jsou většinou IgM, mají tendenci vázat komplement a pokud reagují při teplotě blízké 30°C, jsou klinicky významné. Erytrocyty s navázanými protilátkami IgG za přítomnosti komplementu C3c/C3d nebo bez něho jsou po vazbě na receptor Fc fagocytovány ve slezině, erytrocyty s navázaným smotným kompementem C3c/C3d jsou destruovány v játrech (extravaskulární hemolýza). Vazba IgM na povrch erytrocytu při teplotě blízké 30°C může vyvolat aktivaci komplementu až C6-9 (membránu atakující komplex - MAC) a způsobit hemolýzu intravaskulární. Diagnóza AIHA je postavena na klinickém průběhu s manifestací anemického syndromu a laboratorních nálezech. Pro akutní AIHA jsou v nátěru periferní krve typické mikrosférocyty a při delším trvání makrocyty. Retikulocytóza je typická, ale může chybět v akutní fázi, stejně tak v situaci, kdy je kostní dřeň insuficientní (např. při infiltraci nebo po chemoterapii). V séru je zvýšená hladina nepřímého bilirubinu, v moči urobilinogen, při intravaskulární hemolýze je přítomna hemoglobinurie s detekovatelným hemosiderinem v moči i řadu dní po příhodě. Obvykle je přítomna výrazně zvýšená hladina LDH, nicméně její normální hodnota hemolýzu nevylučuje, je snížen haptoglobin, je pozitivní PAT. Ve vzácných případech s klinicky jasnou AIHA není zachycena pozitivita v PAT. V tomto případě může pomoci např. nátěr krevního obrazu, přítomnost mikrosférocytů v něm podporuje diagnózu AIHA bez detekovatelných protilátek. Při léčbě AIHA stále platí tři zásady:
- snažíme se vyhnout podávání transfuzí, pro riziko reakce s event. aloprotilátkami, neboť aloprotilátky v séru pacienta jsou z klinického hlediska důležitější než autoprotilátky - mohou vyvolat fulminantní hemolýzu.
- Sekundární AIHA léčíme s ohledem na základní onemocnění
- Imunosupresivní terpie je základní přístup k léčbě idiopatické AIHA
První linie léčby WA-AIHA obsahuje vždy kortikosteroidy. U steroid-refrakterních forem lze použít Rituximab, který v 2. linii na mnohých pracovištích nahradil splenektomii, ta je ale stále jednou z možných léčebných modalit. IVIG je možné použít u jinak nezvladatelné akutní AIHA, efektivní dávky však musí být často ještě vyšší než u ITP. Cytostatika s imunosupresivním potenciálem (cyklofosfamid, azathioprin) lze také použít u refrakterní AIHA, ale s nejistým efektem. Výzvou stale zůstává terapie symptomatické CA-AIHA, u které bývají kortikosteroidy a splenektomie bez efektu. Účinek má cyklofosfamid a zejména Rituximab, příznivý efekt byl popsán též u kombinace Rituximab + Bendamustin a také kombinace fludarabinu s Rituximabem byla úspěšně použita v léčbě CA-AIHA. U refrakterních forem je možné zvážit plazmaferézu, anekdotické údaje jsou o pozitivním efektu eculizumabu.
Patogeneze imunitní trombocytopenie má několik složek a úrovní, které zahrnují jak časnou destrukci trombocytu vlivem navázaných protilátek, tak nedostatečnou trombopoezu v kostní dřeni. Specifita protilátek může být u ITP heterogenní, protilátky mohou být namířeny proti jednomu, dvěma nebo i více antigenům destičkového povrchu, většina autoprotilátek u ITP je namířena proti GPIIb/IIIa a GPIb/IX, přitom konformace GP IIb/IIIa není, na rozdíl od GPIb/IX, stabilní. Protilátky proti GPIb/IX se vyskytují u 20-40% pacientů s ITP, patofyziologie jejich působení je zcela odlišná od běžnějších protilátek anti-IIb/IIIa. Protilátky proti glykoropteinu Ib (GPIb) působí destrukci trombocytu mechanismem nezávislým na Fcγ receptoru makrofágu, vedou jednak k vyšší expresi P - selektinu, tím k aktivaci trombocytu, jednak k desialylaci glykoproteinů destičkové membrány, zejména transmembránového uhlovodíkového zbytku GPIbα. Pozměněná struktura antigenu GPIb je rychle detekována jinými typy receptorů než Fcγ, zejména tzv. Aswell – Morellovým receptorem hepatocytu. V případě ITP s autoprotilátkami anti-Ib/IX tak zanikají trombocyty převážně v játrech, ale ne působeních jaterních makrofágů, ale přímo v hepatocytech. Tento mechanismus také vysvětluje pomalou nebo žádnou odpověď na léčbu kortikosteroidy a/nebo IVIG u některých pacientů s ITP. Sialidáza, která způsobuje desialylaci glykoporoteinů destičkové membrány je přítomna v trombocytu v relativně vysoké koncentraci a je možné ji inhibovat přirozenými nebo syntetickými inhibitory sialydáz. Přirozenou sialydázou je u savců lysozomální Neuraminidáza 1 (NEU1). Sialydázy produkuje řada baktérií a virů. Desialylace trombocytů a jejich zkrácené přežívání je prokázaným mechanismem vzniku trombocytopenie u těžkých pneumokových infekcí a u infekce Trypanosoma cruzi (Chagasova choroba), předpokládá se také, že tímto mechanismem vzniká trombocytopenie u infekce virem chřipky. Syntetickými inhibitory jsou DANA (2-deoxy-2,3-didehydro-N-acytelneuraminová kyselina) a také oseltamivir fosfát, užívaný primárně k léčbě infekce chřipkovým virem A a B. Existuje již také několik kazuistik o efektu oseltamiviru v léčbě refrakterní ITP.
Standardní léčba 1. linie ITP se stále opírá o kortikosteroidy, v poslední době jsou preferované spíše p.o., např. Prednison v dávce 0,5 – 2 mg/kg/den. V emergentních situacích je třeba aplikovat vysoké dávky IVIG spolu s kortikosteroidy a při život ohrožujícím krvácení též trombocyty. Léčba druhé linie je spojena s přetrvávajícím dilematem dnešní terapie ITP a tím je splenektomie oproti farmakoterapii. Realitou je, že v posledních letech ve druhé linii léčby ITP je příklon k léčbě nechirurgické, často používaným přípravkem je Rituximab. Splenektomii je obecně doporučeno provádět nejdříve 6 měsíců od diagnózy, u dětí po 12 měsících. Až 2/3 pacientů nemusí mít po splenektomii další léčbu ITP. V léčbě chronické ITP, která je refrakterní k jiným způsobům léčby, se s úspěchem požívají TPO agonisté, t.č. Romiplostim nebo Eltrombopag, které dosahují odpovědi přes 80%. Jejich podávání musí být dlouhodobé, po vysazení dochází u většiny pacientů opět k poklesu počtu trombocytů.
3004. Vrozené syndromy selhání kostní dřeně – současný pohled
Pospíšilová D.
(Dětská klinika, FN a LF UP, Olomouc)
Do skupiny vrozených syndromů selhání kostní dřeně (inherited bone marrow failure syndromes, IBMFS) jsou řazeny vzácné poruchy krvetvorby charakterizované: - geneticky podmíněným selháním funkce jedné nebo více hematopoetických linií (erytrocytární, granulocytární nebo trombocytární); - vrozenými anomáliemi nebo funkčními poruchami postihujícími různé tkáně a orgány: kůži, skelet, srdce, plíce, ledviny, centrální nervový systém, často doprovázené i malým vzrůstem; - zvýšeným rizikem vzniku maligních onemocnění: nejčastěji Akutní myeloidní leukémie (AML), Myelodysplastického syndromu (MDS) nebo solidních nádorů. Společným rysem těchto onemocnění je výrazná fenotypová variabilita jak hematologických tak i somatických změn. Závažnější formy onemocnění se zřetelnými vrozenými anomáliemi, časnou manifestací cytopenií a rozvojem selhání kostní dřeně jsou obvykle diagnostikovány již v časném dětství v kojeneckém, batolecím nebo předškolním věku. Lehčí formy s nenápadnými anomáliemi a pozdní manifestací cytopenií mohou na druhé straně dlouho unikat pozornosti a jsou potom diagnostikovány až v dospělosti nebo dokonce až při vypuknutí maligního onemocnění. Znalost příznaků těchto vzácných nemocí je proto velmi důležitá pro jejich včasnou diagnostiku a správnou volbu léčebného postupu. Do skupiny vrozených syndromů setkání kostní dřeně jsou řazena následující onemocnění: Fanconiho anémie (FA), Dyskeratosis congenita (DC), Diamondova-Blackfanova anémie (DBA), Shwachmanův-Diamondův syndrom (SDS), Těžká vrozená neutropenie (SCN), Syndrom hypoplastických chrupavek a vlasů (Cartilage - hair hypoplasia - CHH), Amegakaryocytární trombocytopenie (CAMT), Trombocytopenie s chyběním radia (TAR), Pearsonův syndrom (PS). Některá z těchto onemocnění byla definována na molekulární úrovni teprve v posledních letech díky rychlému rozvoji metod molekulární genetiky. Na jejich vzniku se podílejí mutace „provozních genů“ (housekeeping genes), které kódují proteiny účastnící se čtyř důležitých regulačních buněčných systémů: reparace DNA (FA), udržování délky telomer (DC), biogeneze ribozomů (DBA, SDS, RD, DC) a regulace buněčného cyklu. Většinou se tedy nejedná o nitrobuněčné procesy specifické pouze pro hematopoezu a poruchy těchto důležitých dějů mají dopad i na řadu jiných buněčných systémů. Autorka podává přehled nejnovějších znalostí o jednotlivých skupinách uvedených onemocnění včetně přehledu dosud popsaných genetických změn.
2879. Etiológia, diagnostika a liečba sideropenickej anémie v mladšom veku
Rohoň P.
(Hemato-onkologická klinika, FN a LF UP, Olomouc)
Úvod: Anémie z nedostatku železa (Fe), sideropenické anémie (IDA) patria k najčastejším ochoreniam v celosvetovom meradle. Ich charakteristickou črtou je mikrocytóza a hypochrómia erytrocytov. Najohrozenejšou skupinou sú deti a mladé ženy. V detskom veku sa IDA môže podieľať na psychomotorickej retardácii, v dospelosti dochádza často k adaptácii i na nízke hladiny hemoglobínu (Hb) a klinický obraz je nešpecifický, chudobný. Rozvoj IDA je dôsledkom troch vzájomne prepojených procesov: zvýšených nárokov organizmu na Fe, jeho nedostatočného prísunu a krvácania. Vznik tohto ochorenia má i socioekonomický rozmer: v rozvojových krajinách je najčastejšou príčinou nedostatočný prísun Fe a/alebo ochorenia parazitmi, vo vyspelých ekonomikách sú časté chronické krvné straty alebo vegetariánstvo. Diagnostika IDA je vo väčšine prípadov jednoduchá s výnimkou situácií, keď je združená so zápalovými ochoreniami alebo niektorými vzácnymi vrodenými genetickými poruchami. V liečbe sa využívajú soli Fe, ktoré majú pri perorálnom podaní obyčajne veľmi dobrý účinok (nízke hladiny hepcidínu uľahčujú absorpciu Fe). V niektorých prípadoch je limitom perorálnej terapie jej intolerancia. Intravenózna aplikácia Fe umožní rýchlu normalizáciu celkovej hladiny Fe (často už po jednorazovej aplikácii) a je vyhradená pre špecifické situácie.
Patogenéza Fe je esenciálnym prvkom pre život a vyskytuje sa viazané v proteínoch (napr. hemové Fe), ktoré sa podieľajú na mnohých bunkových procesov. Voľné Fe je naopak pre bunku toxické, pretože katalyzuje tvorbu kyslíkových radikálov. Fe má svoj podiel i na regulácii imunitných funkcií, umožňuje ale aj rast baktérií, replikáciu vírusov či proliferáciu nádorových buniek. V organizme je preto zaisťovaná homeostáza Fe (celkové zásoby u dospelého jedinca sa pohybujú okolo 3 - 5 g s denným obratom asi 0,5 mg (zvýšené nároky pri raste, gravidite, menštruácii), väčšina cirkulujúceho Fe však vzniká z rozpadnutých erytrocytov (recyklované Fe). Organizmus dokáže ovplyvňovať spotrebu Fe a stav jeho zásob výhradne reguláciou príjmu, nemá však vytvorené cielené mechanizmy výdaja. Tok Fe v organizme je možné rozčleniť do niekoľkých krokov:
- absorbcia v duodene
- vstrebanie hemového Fe je jednoduchšie (doposiaľ neúplne objasnený mechanizmus), anorganické Fe3+ musí byť redukované na Fe2+ (ferrireduktáza, Dcytb)
- transport Fe do cytoplazmy enterocytu zabezpečuje transmembránový proteín DMT1
- Fe môže zostať v enterocyte (väzba na feritín) alebo je uvoľnené do obehu pomocou ferroportínu (transportuje Fe i z makrofágov či hepatocytov)
- oxidácia Fe2+ na Fe3+ pomocou hefestínu
- transport Fe v plazme
- väzba Fe na transferín (apotransferín), po jeho obsadení dvoma molekulami Fe3+ vzniká holotransferín (saturovaný transferín ~ 30 %)
- utilizácia Fe erytroidnými bunkami
- naviazanie holotransferínu na transferínový receptor povrchu bunky
- tvorba endozómu, uvoľnenie Fe3+ z holotransferínu (následná redukcia erytrocytovou ferrireduktázou na Fe2+) a recyklácia apotransferínu i transferínového receptoru
- uvoľnenie Fe2+ z endozómu (erytrocytová DMT1) a prie-nik do mitochondrie (mitoferín-1), nasleduje inkorporácia do protoporfyrínu IX (pomocou ferochelatázy) a vzniká hem (ten je transportovaný do cytoplazmy a napokon spojený s globínovými reťazcami za vzniku Hb)
- recyklácia Fe (erytrocytov)
- prebieha v makrofágoch sleziny, pečene a kostnej drene; export Fe z makrofágov zaisťuje už zmieňovaný ferroportín a plazmová feroxidáza (ceruloplazmín) umožňuje naviazanie Fe3+ na apotransferín, časť Fe je umiestnená v RES vo forme feritínu
- regulácia homeostázy Fe (hepcidín)
- hepcidín je zrejme kľúčovou molekulou v procese homeostázy Fe, je produkovaný v pečeni a jeho syntéza je ovplyvnená zápalom alebo vysokou koncentráciou Fe
- po naviazaní hepcidínu na ferroportín dochádza k jeho degradácii a zastaví sa uvoľnenie Fe z enterocytov a makrofágov
- deficit Fe či hypoxia majú na produkciu hepcidínu antagonistický účinok
(upravené podľa: Horváthová M, Divoký V in Molekulární hematologie, Galén 2013)
Tab. 1. Príčiny vzniku sideropénie 
Tab. 2. Prehľad laboratórnych ukazovateľov pri IDA 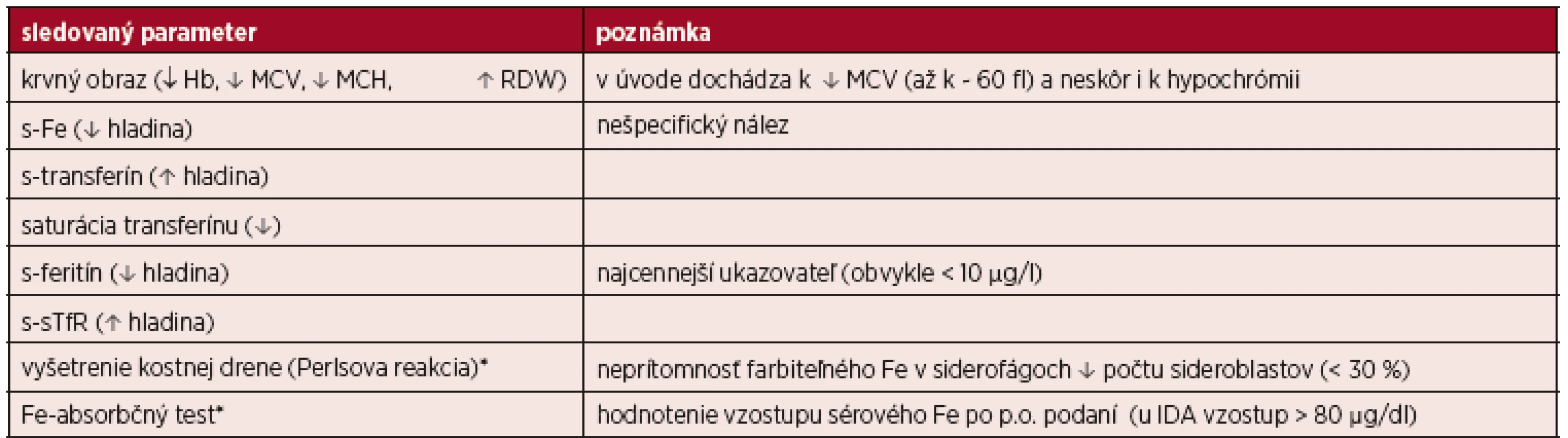
* vyšetrenie v nejasných prípadoch Klinický obraz
Iba malá časť pacientov prichádza k lekárovi pre vlastné príznaky anémie, zreteľné prejavy anemického syndrómu sa prejavia až pri poklese Hb pod 80 g/l a aj v týchto prípadoch sú často nevýrazné (chronický stav s adaptáciou). Vyskytuje sa: bledosť kože a slizníc, pálenie jazyka, zvýšená lámavosť nechtov a koilonychia, ragády ústnych kútikov, Plummer-Vinsonov syndróm (dysfágia a angulárna stomatitída), vzácne tzv. pika.
Diagnostika
Anemické stavy vo všeobecnosti majú celé spektrum príčin a chudokrvnosť je iba zriedkavo konečnou diagnózou ale skôr jedným z rôznorodých prejavov inej choroby. Základom diagnostiky je podrobná anamnéza a komplexné zhodnotenie zdravotného stavu pacienta. V niektorých prípadoch je odhalenie prvotného mechanizmu zložité – najmä vtedy, keď je anémia podmienená multifaktoriálne súbehom viacerých ochorení. Základným prvkom je zhodnotenie hemogramu vrátane retikulocytového indexu a morfológie erytrocytov.
Diferenciálna diagnostika
V prípade mikrocytových (príp. hypochrómnych) anémii je veľmi dôležité zhodnotiť tkanivové zásoby Fe, ktoré dokážu pomôcť pri odlíšení IDA (znížené zásoby) a stavov s normálnymi alebo zvýšenými tkanivovými rezervami (talasémie, anémie chronických chorôb, sideroblastické anémie či niektoré hemoglobínopatie). Dôležitým momentom pre ďalšie diagnostické úvahy je zhodnotenie refrakterity IDA k perorálnej liečbe Fe. Pokiaľ vylúčime základným endoskopickým vyšetrením krvácanie či nadužívanie NSAID je nutný podrobnejší diagnostický prístup.
Liečba
V terapii IDA je najdôležitejšie odstrániť vyvolávajúcu príčinu rozvoja sideropénie. V zásade rozdeľujeme dve formy podania Fe:
- perorálne podanie
- v súčasnosti existuje veľké množstvo preparátov Fe, odporúča sa podanie dvojmocných foriem (sulfáty) 100 - 200 mg Fe/deň
- súčasné podanie kyseliny askorbovej zlepšuje absorbciu Fe
- hodnotenie liečby sa odporúča po 4 - 6 týždňoch (optimálny nárast Hb 0,1g/dl/deň), refrakterita je definovaná ako nedostatočný vzostup po podaní minimálne 100 mg elementárneho Fe počas tohto obdobia
- neodporúča sa ukončiť substitúciu Fe pri normalizácii hladiny Hb ale doplniť i tkanivové zásoby Fe (hladina feritínu by mala byť stabilizovaná > 50 μg/l)
- pri chronických krvných stratách, ktoré nie je možné eliminovať, je nutná intermitentná substitúcia Fe
- intravenózne podanie
- parenterálna liečba Fe je indikovaná v špecifických situáciách – všeobecne pri zlyhaní či refrakterite k perorálnemu podaniu Fe (porucha resorpcie, ochorenia GIT s iritáciou pri perorálnom podaní, významné krvné straty)
- intravenózne preparáty sú pripravené tak, že obsahujú centrálnu (jadrovú) časť s obsahom Fe a schránku z polysacharidového polyméru
- intravenózna liečba musí prebiehať formou pomalej infúzie s možným rizikom rozvoja anafylaktickej reakcie
Tab. 3. Diagnostický prístup pri refrakternej IDA 
IRIDA = iron refractory iron deficiency anemia (upravené podľa: Hershko C, Camaschella C, Blood 2014) Záver: Úlohou hematológa je predovšetkým diagnostika a liečba „nevysvetliteľných“ IDA s dôrazom na refrakterné formy, pri ktorých je nutné prihliadnuť k etiopatogenetickému podielu H. pylori, autoimúnnej gastritídy, celiakie a niektorých vzácnych hereditárnych foriem mikrocytových anémií súvisiacich s poruchami tvorby proteínov zapojených do homeostázy Fe v organizme.
Literárne zdroje
- Camaschella C. How I manage patients with atypical microcytic anaemia. Br J Haematol. 2013; 160 : 12-24.
- Hershko C, Camaschela C. How I treat unexplained refractory iron deficiency anemia. Blood 2014; 123 : 326-333.
- Horváthová M, Divoký V. Metabolismus železa a jeho poruchy. In Molekulární hematologie, Galén 2013, 265-270
- Jaspers A, Caers J, Le Gac G et al. A novel mutation in the CUB sequence of matriptase-2 (TMPRSS6) is implicated in iron-resistant iron deficiency anaemia (IRIDA). Br J Haematol. 2013; 160 : 564-565.
- Krč I. Anemie z nedostatku železa (sideropenické anemie). In Hematologie, Triton 2006, 33-37
Podporené grantom IGA_LF_2016_001 a MZ ČR – RVO (FNOl, 00098892).
2869. Anémie chronických chorob
Indrák K.
(HOK, FN, Olomouc)
Anémie chronických chorob (ACD) představují, společně se sideropenickou anémií, nejčastější anémie v populaci. U nemocných vyššího věku tvoří ACD až třetinu anémií. Jedná se většinou o mírnou až středně těžkou normo-/hypochromií a normocytární anémii, která ale u asi čtvrtiny nemocných přechází v anémii mikrocytární.
Etiopatogeneze:
Příčinou ACD je zvýšená aktivita buněčné imunity vedoucí k nadbytku hepcidinu (Hepatic bacteriocidal protein) v krvi. Tíže anémie koreluje s velikostí aktivace imunitního systému. Proteiny akutní fáze aktivují signální dráhy LPS (lipopolysacharid - endotoxin) a interleukinu 6 (IL-6), které spouštějí, nezávisle na hladině železa, syndrom excesu hepcidinu. Hepcidin snižuje vstřebávání železa v duodenu a interferencí s ferroportinem a jeho degradací blokuje export železa hepatocyty a makrofágy a zvyšuje ukládání železa v makrofágo-monocytovém (MaMo) systému. V kostní dřeni je v důsledku relativně nízké hladiny erytropoetinu, s ohledem na tíži anémie, snížená proliferační aktivita erytropoezy. Poločas přežívání erytrocytů bývá zkrácený v důsledku zvýšené aktivity v MaMo systému. Mezi vyvolávající příčiny ACD patří infekce (akutní a chronické), malignity, autoimunitní onemocnění, chronická onemocnění ledvin, těžká traumata, diabetes mellitus, stáří, infarkty myokardu, velké operace a řada dalších.
Diagnostika a diferenciální diagnostika:
Objem (MCV) erytrocytů v krevním obraze nemocných s ACD bývá normální, zatímco u sideropenie nacházíme mikrocytózu. U ACD bývá snížená až normální hladina sérového železa (Fe) a snížená nebo normální hladina celkové vazebné kapacity (CVK) pro železo. U sideropenické anémie je CVK železa zvýšená. Hladina ferritinu je u ACD normální nebo zvýšená, u sideropenické anémie je snížená. Hladina solubilního transferinového receptoru (sTfR) je u ACD normální a poměr sTfR a logaritmu ferritinu (sTfR/log feritinu) bývá snížený (<1). U sideropenické anémie je hladina sTfR zvýšená a poměr sTfR/log ferritinu bývá zvýšený (>2). Dále u ACD nacházíme zvýšenou hladinu hepcidinu, která je u sideropenické anémie snížená. Také hladina cytokínů (TNF, IL-1, IL-6) je u ACD zvýšená, zatímco u sideropenické anémie bývá normální. V diferenciální diagnostice je vedle obecného odlišení ACD a sideropenické anémie nezbytné odlišit „čistou“ ACD od ACD provázené sideropenií. Odlišení těchto dvou jednotek má zásadní význam pro volbu léčebné strategie, protože u „čisté“ ACD nepodáváme preparáty železa a u ACD provázené sideropenií jsou naopak preparáty železa často nezbytné. Hladina ferritinu >100 µg/l svědčí pro „čistou“ ACD, hladina ferritinu 50-100 µg/l ukazuje na možnou kombinaci ACD a sideropenie. K zpřesnění diagnostiky bývá v tomto případě nezbyté provést další vyšetření. Hladina ferritinu < 30-50 µg/l svědčí pro kombinaci ACD a sideropenie. Hladina sTfR < 2 mg/l svědčí pro „čistou“ ACD, hladina sTfR 2 – 5 mg/l ukazuje, že může jít o kombinaci ACD a sideropenie, hladina sTfR > 5 mg/l ukazuje na přítomnost ACD a sideropenie. Index sTfR/log ferritinu >2 a ferritin < 30 µg/l ukazuje na absolutní deficit železa, index sTfR/log ferritinu <2 a ferritin v séru ≥ 30 µg/l ukazuje na relativní deficit železa, a index sTfR/log ferritinu <1 a ferritin v séru ≥ 30 µg/l ukazuje, že se jedná o „čistou“ ACD bez deficitu železa.
Léčba:
Léčebným cílem je u ACD, podobně jako u ostatních anémií, zvýšení hladiny hemoglobinu a tím i zlepšení kvality života pacienta. Dosud ale nebyl zcela přesně popsán vliv léčby anémie na přetížení železem v MaMo systému, vliv na imunitu, na tvorbu hydroxylových radikálů a na vyvolávající chorobu. Snížená nabídka železa je u ACD obranným mechanismem organismu, protože železo je růstovým faktorem pro mikroorganismy. Proti podávání železa u „čisté“ ACD mluví skutečnost, že pokud není přítomen deficit železa, je dodané železo přesouváno do zásobáren a stejně není pro krvetvorbu využitelné. Podávání preparátů železa pak může podporovat aktivitu onemocnění a může vést k orgánovému postižení svojí toxicitou. Nabídka železa nádorovým buňkám může stimulovat růst nádoru. Přísun železa do systému redoxních reakcí může stimulovat tvorbu volných hydroxylových radikálů. U autoimunitních chorob ale může železo inhibovat prozánětlivé imunitní efektorové dráhy a snižovat aktivitu choroby. Dle tíže anémie a klinických příznaků je proto třeba pečlivě zvažovat, zda ACD vyžaduje kromě léčby základního onemocnění i cílenou léčbu anémie. V cílené léčbě anémie se nejčastěji užívají krevní transfuze, erytropoezu stimulující proteiny (ESP), preparáty železa a zkoušejí se i nové léčebné přístupy. Přetížení železem v důsledku jeho substituce může být škodlivé u dialyzovaných nemocných, u nichž je toto přetížení provázeno zvýšeným rizikem vzniku infekčních komplikací: při hladině ferritinu pod 100 µg/l je riziko infekčních komplikací <20%, při hladině ferritinu >100 µg/l je riziko infekčních komplikací >20% resp. riziko septikemie je při hodnotě ferritinu >100 µg/l 2.5x vyšší, než při nižších hodnotách. Železo obecně nesubstituujeme u ACD s ferritinem >100 µg/l. Erytropoetin je u ACD produkován v relativně menším množství v důsledku působení cytokínů či poškození ledvin. Navíc je popisována snížená citlivost erytroidních prekurzorů na erytropoetin a proto můžeme konstatovat, že ACD je charakteristická relativním deficitem erytropoetinu. Podání erytropoetin stimulujících proteinů (ESP) stimuluje erytropoézu, stimuluje tvorbu sTfr a tlumí tvorbu hepcidinu. Léčebná odpověď na podávání ESP závisí na chorobě vyvolávající ACD, na jejím stádiu, stupni imunitní aktivace a dostupnosti železa. U nádorů, infekcí a u autoimunitních chorob vede podávání ESP ke zvýšení hladiny hemoglobinu, která snižuje potřebu transfuzí i se snížením jejích vedlejších nežádoucích účinků (přetížení železem). Je ale nutno říci, že biologická úloha erytropoetinového receptoru (EpoR) na nádorové buňky zatím nebyla zcela objasněna a existuje podezření, že by se zde mohlo podávání ESP projevit negativně. Proto se léčebná doporučení na podávání ESP u ACD omezují na jejich podávání u ACD při chronické renální insuficienci s cílovou hodnotou hemoglobinu 110-120 g/l (při vyšších hodnotách hemoglobinu stoupá riziko vzniku trombotických komplikací), na ACD u nádorů léčených chemoterapií (solidní TU a lymfoproliferace ), kde je indikováno podávání ESP při hladině hemoglobinu <90 g/l se stejnou cílovou hodnotou hemoglobinu (110-120 g/l). ESP jsou indikovány i u revmatoidní artritidy, ulcerosní kolitidy (efekt u 60% nemocných), u myelodysplastického syndromu (MDS) typu refrakterní anémie (RA) a refrakterní anémie s excesem blastů – 1 (RAEB-1, počet blastů v kostní dřeni <10%; efekt u 30 až 40% nemocných). Je ale popisováno, že téměř žádný efekt ESP nemůžeme očekávat u nemocných s MDS a s hladinou erytropoetinu v séru >500 U/l. Některé práce dokonce uvádějí jako rozhodující pro neúspěch léčby hladinu erytropoetinu >100-150 U/l. Zvláštní léčebný přístup si zaslouží ACD se sideropenií. Železo, které je nezbytné pro basální metabolismus, je zde blokováno v MaMo systému a díky tomu nemůže být ze zásob mobilizováno. U ACD se sideropenií je proto třeba zvažovat současnou substituci preparáty železa a ESP. Pro tuto kombinaci hovoří skutečnost, že zvýšení hladiny erytropoetinu zvyšuje nároky na dodávku železa do kostní dřeně a stimuluje tvorbu sTfR, zatímco nabídka železa použitelného pro krvetvorbu je u ACD snížená v důsledku působení cytokínů způsobujících jeho retenci v MaMo systému. Při špatné absorpci železa v duodenu je u ACD se sideropenií indikováno podávání železa intravenózně. K novým léčebným přístupům patří snaha o ovlivnění tvorby hepcidinu a jeho účinků pomocí antagonistů tvorby hepcidinu: inhibitory BMP (kostní morfogenní protein, který indukuje transkripci mRNA hepcidinu), protilátky proti receptoru pro IL-6; syntetické anti-sense oligonukleotidy, antagonisté účinku hepcidinu - neutralizující protilátky proti hepcidinu. Monoklonální protilátky proti ferroportinu blokující vazbu hepcidinu umožňují pokračování výdeje železa z buňky i za přítomnosti hepcidinu. Příkladem je Lexaptepid, antihepcidin l-oligoribonukleotid, který se váže na hepcidin a blokuje jeho účinek na cílovou molekulu ferroportin a tím brání blokádě výdeje železa z buňky. Jiným zkoušeným preparátem je erytroferon (ERFE), protein regulující účinek erytropoetinu na tvorbu hepcidinu, který zvyšuje sekreci erytropoetinu a vede ke stimulaci tvorby ERFE tlumivým efektem na tvorbu hepcidinu. Důsledkem je zvýšený výdej železa uvolňovaný do cirkulace pro potřebu vystupňované erytropoezy.
Závěr:
Předpokladem správné léčby ACD je přesná diagnostika a odlišení ACD od ACD se sideropenií a od sideropenické anémie. Léčebné přístupy vycházejí u ACD z léčby vyvolávající choroby a dle tíže anémie se rozhoduje o cílené léčbě anémie substitucí erytromasy, pečlivě se zvažuje potřeba podávání železa a/nebo erytropoetin stimulujících proteinů. Nové léčebné přístupy jsou v současnosti na úrovni klinických studií vesměs první fáze.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek POSTGRADUÁLNÍ SEKCE 1Článek Wiedermannova přednáškaČlánek Postgraduální sekce 2Článek Konference Ošetřovatelství 1Článek Konference Ošetřovatelství 2Článek Mnohočetný myelomČlánek PsychologieČlánek TransplantaceČlánek PREZIDENTSKÉ SYMPOZIUMČlánek MorfologieČlánek Dárcovské a léčebné aferézyČlánek Laboratorní diagnostikaČlánek Mnohočetný myelomČlánek TransplantaceČlánek Laboratorní diagnostikaČlánek PODPŮRNÁ PÉČEČlánek TRANSFUZNÍ PROBLEMATIKAČlánek RejstříkČlánek OŠETŘOVATELSTVÍ
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo Supplementum1- Vliv pH-pufrovací technologie na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Transplantace
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
- POSTGRADUÁLNÍ SEKCE 1
- Laboratorní diagnostika
- PODPŮRNÁ PÉČE
- TRANSFUZNÍ PROBLEMATIKA
- Rejstřík
- Wiedermannova přednáška
- Postgraduální sekce 2
- Symposium on Advances in Molecular Hematology 1: Lymphoma Pathogenesis
- Konference Ošetřovatelství 1
- Symposium on Advances in Molecular Hematology 2: Stressed Hematopoiesis
- Symposium on Advances in Molecular Hematology 3: State of the Art Invited Lecture
- Konference Ošetřovatelství 2
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Psychologie
- Konference zdravotních laborantů 1
- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Transplantace
- Maligní lymfomy/Chronická lymfocytární leukemie
- Konference zdravotních laborantů 2
- PREZIDENTSKÉ SYMPOZIUM
- Morfologie
- Dárcovské a léčebné aferézy
- Laboratorní diagnostika
- Anémie/Cytopenie
- OŠETŘOVATELSTVÍ
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Morfologie
- Anémie/Cytopenie
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



