-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaGenetické polymorfismy destičkových receptorů u mladých pacientů s akutním infarktem myokardu (AIM) a rezistencí k protidestičkové léčbě
Genetic polymorphisms of platelet receptors in young patients with AIM and resistance to antiplatelet therapy
The studied group comprises 80 young patients with AIM on dual antiplatelet therapy with acetylsalicylic acid (ASA) and thienopyridines. Antiplatelet therapy was monitored by platelet-rich plasma light transmittance aggregometry using the APACT 4004 analyser (Helena Laboratories, Austria) and by whole blood impedance aggregometry using the Multiplate analyser (Dynabyte, Germany). Platelet aggregation was detected after stimulation with arachidonic acid for the detection of aspirin resistance and with ADP and prostaglandin E1 for the detection of thienopyridine resistance. To determine the frequencies of P2Y12 (i-744T>C; rs2046934), P2Y12 (34C>T; rs6785930) and COX-1 (-842A>G; rs10306114) polymorphisms, DNA of patients with AIM was tested by RT-PCR and melting curve analysis using the LightCycler 480 analyser (Roche Diagnostics, Germany).The cut-offs for patients with effective ASA therapy are 25% of aggregated platelets and 220 AUC/min respectively if LTA or MEA is used. The cut-offs for effective thienopyridine therapy are 45% of aggregated platelets or 298 AUC/min, respectively.The aim of our work was to use the two aforementioned functional laboratory methods to assess both aspirin and thienopyridine resistance and to determine the contribution of platelet receptor genetic polymorphisms to resistance to antiplatelet therapy in AIM.
Key words:
platelet gene polymorphisms, resistance to antiplatelet therapy
Autoři: J. Úlehlová 1; L. Slavík 1; J. Kučerová 1; V. Krčová 1; J. Václavík 2; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika LF UP a FN Olomouc, I. interní klinika FN Olomouc 1
Vyšlo v časopise: Transfuze Hematol. dnes,18, 2012, No. 1, p. 14-18.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Vyšetřovaný soubor tvoří skupina 80 mladých pacientů s AIM na duální protidestičkové terapii kyselinou acetylsalicylovou (ASA) a thienopyridiny. Monitorování protidestičkové léčby bylo provedeno pomocí optické transmisní agregometrie na analyzátoru APACT 4004 (Helena Laboratories, Rakousko) v plazmě bohaté na krevní destičky a současně impedanční agregometrií na analyzátoru Multiplate (Dynabyte, Německo) v plné krvi. Agregace krevních destiček byla detekována po stimulaci kyselinou arachidonovou pro detekci aspirinové rezistence a ADP s prostaglandinem E1 pro detekci thienopyridinové rezistence. Ke zjištění frekvence polymorfismů P2Y12 (i-744T > C; rs2046934), P2Y12 (34C>T; rs6785930) a COX-1 (-842A>G; rs10306114) bylo u pacientů s AIM provedeno testování DNA pomocí RT-PCR a analýzy křivky tání na analyzátoru LightCycler 480 (Roche Diagnostics, Německo). Cut-off pro pacienty na účinné léčbě ASA u agregace krevních destiček je 25 % na optickém agregometru (resp. 220 AUC/min – Multiplate). Cut-off u pacientů na účinné léčbě thienopyridiny je 45 % na optickém agregometru (resp. 298 AUC/min – Multiplate). Cílem naší práce bylo použít dvě výše zmíněné funkční laboratorní metodiky na stanovení aspirinové i thienopyridinové rezistence a zjistit podíl genetických polymorfismů destičkových receptorů na výskytu rezistence k protidestičkové léčbě u AIM.
Klíčová slova:
genetické polymorfismy destičkových receptorů, rezistence na protidestičkovou léčbuÚvod
Akutní infarkt myokardu (AIM) je ve vyspělých zemích včetně České republiky stále jednou z hlavních příčin morbidity a mortality. AIM je nejzávažnější akutní formou ischemické choroby srdeční (ICHS). V současné době stále vzrůstá počet informací o příčinách a patogenetických mechanismech velmi časné manifestace ICHS ve formě akutního infarktu myokardu v mladém věku – u mužů ve věku 18–45 let a u žen 18–55 let. AIM u mladých nemocných má incidenci 8–9krát nižší než u starších osob a reprezentuje pouze 2–6 % všech nemocných s AIM. Tato skupina mladších nemocných je v řadě aspektů odlišná od nemocných, kteří prodělali svůj první AIM až ve věku nad 60 let. Z doposud publikovaných studií je známo, že nemocniční mortalita mladších nemocných s AIM se pohybuje mezi 2,9–5 % versus nemocniční mortalita starších nemocných s AIM, která se pohybuje okolo 20 %.
Klíčovou součástí sekundární prevence infarktu myokardu je duální protidestičková léčba kyselinou acetylosalicylovou (ASA) a thienopyridinovými deriváty. Tato léčba však může selhávat u 5–30 % pacientů z důvodu rezistence na protidestičkové léky (1, 2). Nejprve byl tento fenomén popsán při podávání kyseliny acetylsalicylové a následně u thienopyridinů. Příčiny rezistencí jsou multifaktoriální a jejich laboratorní stanovení využívá více možných detekčních způsobů (3). V posledních letech probíhá vývoj nových laboratorních metod, které jsou využívány k monitorování selhávání protidestičkové terapie. Nejčastěji užívanou metodou pro vyšetření funkce krevních destiček je vyšetření jejich agregace. V dnešní době slouží jako tzv. „zlatý standard“ vyšetření agregace krevních destiček v plazmě bohaté na krevní destičky (PRP) pomocí optické transmisní agregometrie (LTA) (4, 5). Jednou z nových možností jak zjistit reziduální agregaci krevních destiček je použití vícekanálové impedanční agregometrie (MEA), která je prováděna z plné krve (6, 7). Jedná se o měření elektrické impedance mezi dvěma elektrodami v nesrážlivé (hirudinové) plné krvi. Registruje se změna impedance, která vzniká vlivem narůstání agregátů krevních destiček na dvou nezávislých elektrodách.
Další možnou metodikou, která slouží pouze pro stanovení aspirinové rezistence, je detekce 11-dehydrotromboxanu B2 (v séru nebo moči) – test je ale v porovnání s výše zmíněnými agregačními metodikami časově náročnější a může být ovlivněn výskytem tohoto metabolitu z mimodestičkových zdrojů. Pro stanovení thienopyridinové rezistence lze používat i průtokovou cytometrii s vazodilatátor stimulačním fosfoprotein fosforylačním testem (VASP) (8).
S rizikem aterotrombogeneze jsou dnes spojovány i polymorfismy genů receptorů povrchových glykoproteinů krevních destiček nebo jejich enzymů. Jedná se o polymorfismy receptoru pro fibrinogen – integrin GP III (HPA-1), receptoru pro ADP P2Y12 (haplotyp H1/H2 a také 34C > T), receptoru pro trombin PAR-1 (IVS -14A > T), enzymu cyklooxygenázy 1 (-842A > G), receptor pro kolagen GP Ia/IIa (807C > T) a také genu GP VI (13254T > C), jenž nesouvisí pouze s vyšším výskytem koronárních příhod, ale také s žilní trombózou (9, 10). Definitivní rozhodnutí o klinickém významu jednotlivých polymorfismů genů destičkových receptorů zatím není známo. U ADP receptoru P2Y12 jsou známy čtyři polymorfismy (i-139C > T, i-744T > C, i-ins801A a 52G > T), které jsou ve vazebné nerovnováze a tvoří dva haplotypy, které jsou označovány jako H1 a H2. Alela H2 bývá označována jako možná příčina vyššího rizika aterotrombogeneze. Zajímavý je výsledek studie GENDER, kdy u nemocných nesoucích běžnou alelu H1 po perkutánní koronární angioplastice a zavedení stentu byl zjištěn nižší výskyt restenóz. Polymorfismus enzymu cyklooxygenázy 1 zřejmě ovlivňuje odpověď destiček na léčbu kyselinou acetylosalicylovou.
Je nutné si uvědomit, že mimo výše zmíněných genetických příčin má na agregaci krevních destiček vliv řada jiných faktorů. Jedná se o nedostatečnou biologickou dostupnost (non compliance, nedostatečnou dávku, nedostatečnou absorpci, interferenci s jinými léky), zvýšenou funkci destiček (neúplná tvorba TXA2, zvýšený obrat destiček) či interakci krevních destiček s jinými krevními buňkami. Existuje také velmi různorodá skupina získaných faktorů jako např. kouření, hypercholesterolemie, stres, zvýšená aktivita sympatiku, které mají vliv na agregaci krevních destiček. Limitující je také počet krevních destiček. Pro většinu metod stanovení agregace krevních destiček je limitní hodnota 100 x 109/l.
Materiál a metody
Pacienti
Soubor tvořilo 80 mladých nemocných (46 mužů a 34 žen), kterým bylo provedeno protidestičkové vyšetření po minimálně 7 dnech od stanovení diagnózy akutního infarktu myokardu a zahájení léčby 100 mg ASA a 75 mg clopidogrelu denně. Medián u těchto mladých nemocných byl 37,3 roků a průměrný věk byl 41,2 roků. Věkové rozmezí námi sledovaného souboru mladých nemocných s diagnózou akutního infarktu myokardu bylo od 18 do 55 let.
Odběr vzorků
K náběru vzorků krve byly použity odběrové zkumavky a jehly VACUETTE® (Greiner Bio-One, Rakousko). Odběrové zkumavky VACUETTE® pro koagulační vyšetření optické transmisní agregometrie a také pro izolaci DNA obsahovaly pufrovaný roztok citronanu sodného, jehož koncentrace byla 0,109 mol/l (3,2%). Pro stanovení impedanční agregometrie byly použity zkumavky stejné firmy se stejnou technikou náběru protisrážlivým činidlem hirudinem (15 IU/ml), který je přímým inhibitorem trombinu. Každý odebraný vzorek byl ihned šetrně promíchán a co nejrychleji transportován do laboratoře. Všechny vzorky byly zpracovány do 2 hodin po odběru.
Pro veškerá stanovení byly náběry vzorků prováděny stejným týmem zdravotního personálu a také za použití stejné, výše zmíněné techniky náběru.
Optická transmisní agregometrie (LTA)
Stanovení bylo provedeno měřením agregace krevních destiček, v plazmě bohaté na krevní destičky (PRP) (11), pomocí turbidimetrické metody na analyzátoru APACT 4004 (LABiTec, Ahrensburg, Německo). Následovala centrifugace při 150 g po dobu 10 minut a při pokojové teplotě pro získání plazmy bohaté na destičky (PRP) resp. centrifugace při 2000 g po dobu 10 minut opět při pokojové teplotě pro získání plazmy chudé na destičky (PPP) (4). Výsledný počet destiček pro analýzu byl upraven na 250x1012/l (rozmezí 221–282 x 1012/l).
Jako specifický induktor pro stanovení aspirinové rezistence (1) byla použita kyselina arachidonová (Helena Biosciences, UK) v koncentraci 1 μmol/l. Pro stanovení nedostatečného účinku terapie bylo použito u optické transmisní agregometrie indukované AA cut-off 25 % (12, 13).
Pro detekci thienopyridinové rezistence (2) byla stimulace agregace indukována ADP s prostaglandinem E1 v koncentraci 10 μmol/l. Finální koncentrace PGE1 byla 9,4 nmol/l. Pro stanovení nedostatečného účinku terapie bylo použito u optické transmisní agregometrie indukované ADP s PGE1 cut-off 45 % (12, 13).
Impedanční agregometrie (MEA)
Agregace krevních destiček byla měřena v plné nesrážlivé krvi pomocí impedanční metody na analyzátoru Multiplate (Dynabyte, Mnichov, Německo). Reakce je zahájena naředěním hirudinové plné krve fyziologických roztokem (0,9% NaCl) v poměru 1 : 2. Tato směs je temperována za míchání v měřící kyvetě po dobu 3 min na konstantní teplotu 37 °C (6, 7). Agregační reakce byla zahájena přidáním kyseliny arachidonové, pro stanovení aspirinové rezistence, ve finální koncentraci 15 mM jako induktoru. Pro detekci thienopyridinové rezistence bylo použito specifické kombinace induktoru ADP s PGE1 v koncentraci 10 μmol/l. Finální koncentrace PGE1 byla 9,4 nmol/l. Residuální agregace krevních destiček byla monitorována v podobě zvyšující se impedance a vyjádřena v agregačních jednotkách za čas tj. AUC/min s cut-off u ASPI testu v rozmezí 200 AUC/min resp. u ADPHS testu 298 AUC/min (12, 13).
Genotypizace
Izolace DNA byla provedena z leukocytů periferní krve kitem Puregene (Minneapolis, USA) (14). V získaných vzorcích DNA byly detekovány polymorfismy: haplotyp H1/H2 genu destičkového receptoru pro ADP P2Y12, určený stanovením polymorfismu i-744T > C (rs2046934) a polymorfismu 34C>T (rs6785930) ve stejném genu. Dále byl vyšetřen polymorfismus -842A>G (rs10306114) genu pro cyklooxygenázu. Stanovení bylo provedeno pomocí polymerázové řetězové reakce (PCR) v reálném čase s analýzou křivek tání fluorescenčních sond, která je založena na poklesu fluorescence při uvolnění fluorescenční sondy z PCR produktu. Výhodou této metody je možnost detekce přímo v PCR zkumavce tzn. ihned po amplifikaci bez nutnosti otevírat reakční zkumavku, což snižuje potřebu manipulace se vzorkem a riziko kontaminace. Samotná analýza trvá pouze několik minut a je časově úsporná. Detekce byla provedena na analyzátoru LightCycler 480 za použití kitů LightCycler 480 Genotyping Master® (Roche Diagnostics, Mannheim, Německo) dle návodu výrobce.
Princip metody spočívá v amplifikaci úseku pacientovy DNA obsahující polymorfismus. Tato amplifikace je sledována v reálném čase. Reakční směs pro PCR obsahuje mimo obvyklých komponentů i 2 fluorescenční sondy. Jedna ze sond leží přímo v místě polymorfismu, druhá v blízkosti konce první sondy. Sondy jsou na koncích přiléhajících k sobě značeny odlišnými fluorescenčními barvami. Při excitaci jednoho fluoroforu dochází k rezonančnímu přenosu energie na druhý fluorofor, jehož záření detekujeme. Po amplifikaci je teplota snížena na úroveň, při níž nasedají obě sondy a produkují fluorescenční signál. Při postupném zahřívání dojde k uvolnění sondy specifické pro polymorfismus a k poklesu fluorescence. V případě, že DNA obsahuje variantu odlišnou od sekvence sondy, není tato sonda plně komplementární a dojde k jejímu uvolnění při nižší teplotě, než při úplné komplementaritě. Toto je možné měřit jako rozdílné vrcholy fluorescence na teplotní ose. V případě, že má pacient obě alely s jinou než standardní variantou, dojde k poklesu fluorescence například pouze při nižší teplotě. V případě obou wild type alel, dojde k poklesu až při teplotě vyšší. Heterozygot bude mít dva vrcholy při rozdílných teplotách. Sekvence použitých primerů a sond jsou uvedeny v tabulce 1.
Tab. 1. Názvy a sekvence použitých primerů a sond. 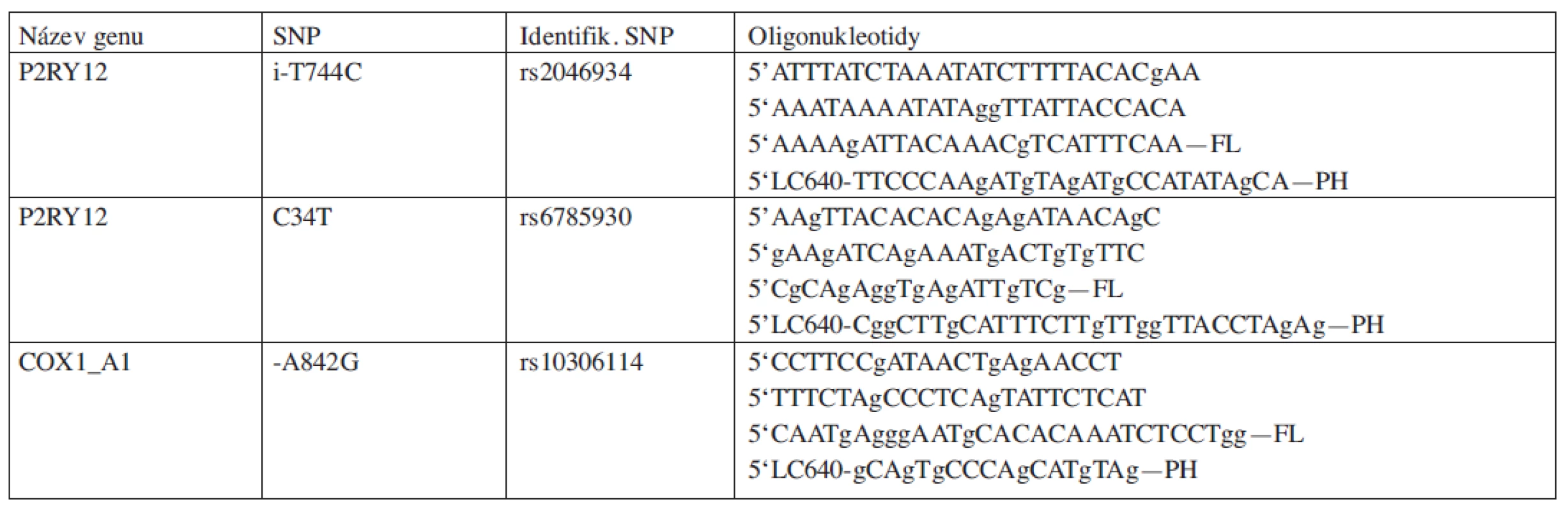
Výsledky
V pilotní studii bylo vyšetřeno 80 mladých pacientů s akutním infarktem myokardu, kteří užívali 7 dnů 100 mg ASA a 75 mg clopidogrelu denně. Zjištěná nedostatečná účinnost aspirinové léčby byla u LTA i u MEA 18,5 % resp. u thienopyridinové léčby byla u LTA i u MEA 17,5 %. Jedním z důležitých faktorů při selhání protidestičkové terapie by mohla být genetická predispozice v polymorfismech destičkových receptorů.
Zastoupení polymorfismů COX1_A1,-A842G (rs1030-6114); P2RY12, C34T (rs6785930) a P2RY12, i-T744C (rs2046934) ve vyšetřovaném souboru viz tabulka 2.
Tab. 2. Zastoupení jednotlivých polymorfismů ve sledovaném souboru 80 mladých pacientů s AIM. 
Ke statistické analýze dat byl použit software SPSS verze 15 (SPSS Inc., Chicago, USA). Závislost mezi mutačním stavem receptorů a odpovědí na léčbu byla posouzena pomocí Fisherova přesného testu (Fisher’s exact test). Test byl hodnocen na hladině signifikance 0,05. Fisherův přesný test neprokázal signifikantní závislost mezi mutačním stavem receptoru COX-1 (wild type vs. heterozygot vs. homozygot) a odpovědí na léčbu (p = 0,292). Signifikantní závislost nebyla prokázána ani mezi COX-1 (wild type vs. heterozygot+homozygot) a odpovědí na léčbu (p = 0,209). Fisherův přesný test neprokázal signifikantní závislost mezi mutačním stavem receptoru P2Y12 – C34T (wild type vs. heterozygot vs. homozygot) a odpovědí na léčbu (p = 0,360). Signifikantní závislost nebyla prokázána ani mezi P2Y12 – C34T (wild type vs. heterozygot+homozygot) a odpovědí na léčbu (p = 0,248). Fisherův přesný test také neprokázal signifikantní závislost mezi mutačním stavem receptoru P2Y12 – T744C (wild type vs. heterozygot) a odpovědí na léčbu (p = 1,000).
Diskuse
Monitorování účinnosti protidestičkové léčby se jeví klíčovým faktorem ve vyšetřování sekundární prevence IM, zejména u mladých pacientů v době příchodu nových léčebných možností.
Vysoké procento selhání této terapie – 18,5 % při léčbě kyselinou acetylsalicylovou resp. 17,5 % při léčbě thienopyridiny, ukazuje na závažnost tohoto problému. Zjišťování příčin selhání léčby je jedním z klíčových faktorů pro racionalizaci a personalizaci protidestičkové terapie, ale také pro další stratifikaci postupu zejména s ohledem na prevenci recidiv aterotrombotických příhod. V poslední době byla identifikována celá řada endogenních (tab. 3) a exogenních (tab. 4) příčin selhání protidestičkové terapie.
Tab. 3. Endogenní příčiny selhávání protidestičkové terapie ASA. 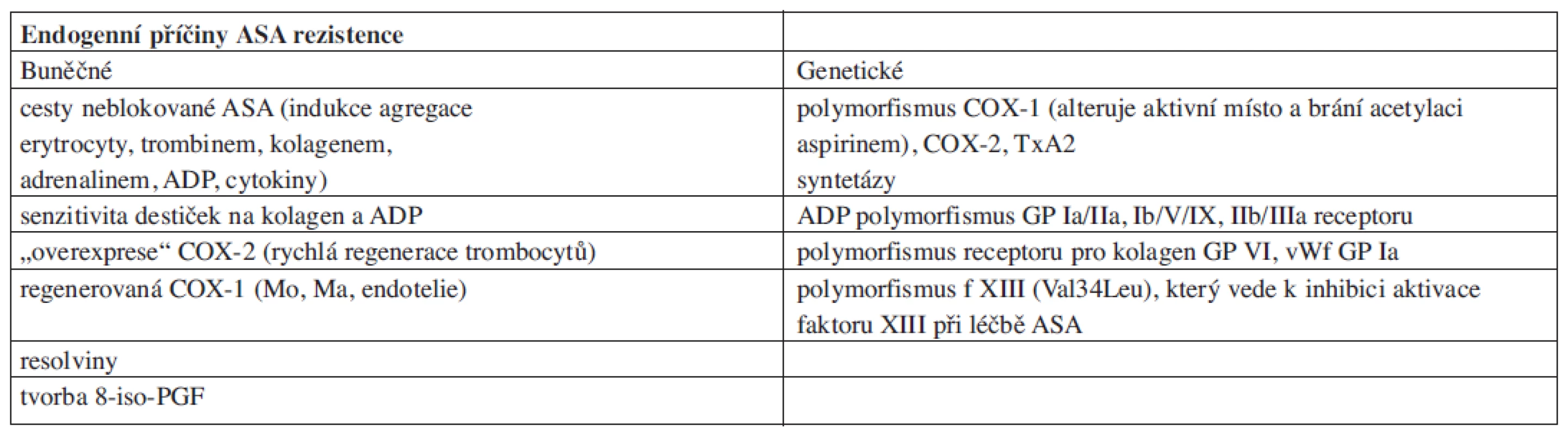
Tab. 4. Exogenní příčiny selhávání protidestičkové terapie ASA. 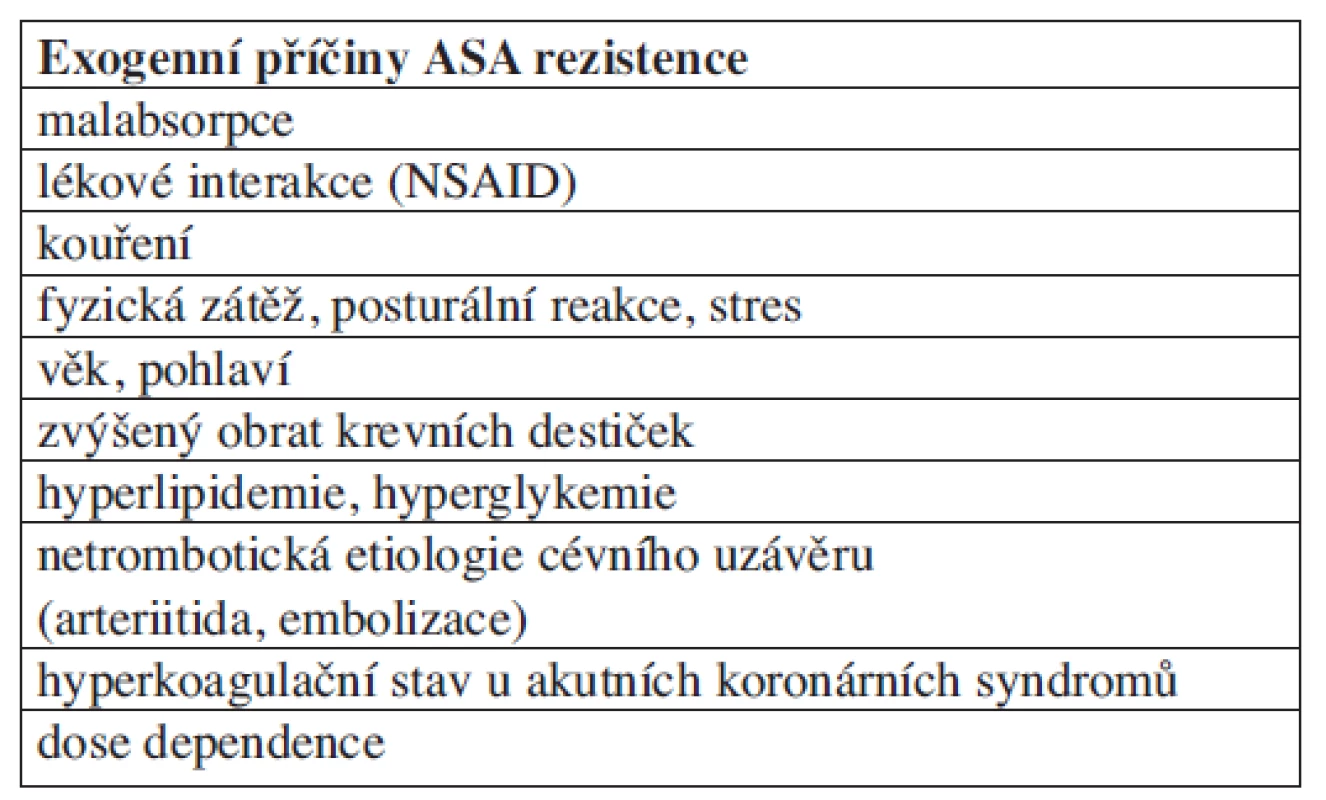
Tab. 5. Příčiny clopidogrelové rezistence. 
Podíl jednotlivých endogenních a exogenních faktorů ovlivňujících selhání terapie se liší s ohledem na použitý protidestičkový lék, jeho metabolizaci a s ohledem na genetické predispozice pacienta.
Situace je relativně lépe dokumentována u kyseliny acetylsalicylové, kde genetický polymorfismus COX-1 zvyšuje riziko předčasného infarktu myokardu. Alela COX-1 je nezávislým prediktorem pro sCD40L úrovně v akutní fázi předčasné AIM, stejně jako jeden rok po události. Výskyt polymorfismu COX-1 u 15 % pacientů s CAD je vyšší než 7,5 % v naší skupině mladých nemocných s infarktem myokardu, což by nesvědčilo pro rizikovost této genetické změny. Nicméně situace se značně změní, pokud zhodnotíme výskyt mutace COX-1 ve skupině pacientů s nedostatečnou odpovědí na léčbu, kde představuje 20%.
Z tohoto pohledu je patrné, jak je důležité zařadit vyšetření reziduální agregace destiček i do stanovení genetických změn destičkových receptorů.
Komplikovanější situace se nachází u clopidogrelu, který je složitě metabolizován, a pouze 15 % proléčiva je v konečné fázi přeměněno na aktivní metabolit. Střevní absorpce proléčiva je omezena efluxem pumpy P-glykoproteinu, jež je kódována genem ABCB1. Většina účinného léku je metabolizována na neaktivní metabolity všudypřítomnými esterázami. Vznik aktivních metabolitů je pak ovlivněn celou řadou jednotlivých nukleotidových polymorfismů (SNP) v CYP3A5, P2RY12 nebo ITGB3. Jednotlivé frekvence variantních polymorfismů destičkových receptorů spojených s vyšší reaktivitou destiček a rezistencí na léčbu clopidogrelem byly popsány u pacientů s CAD v poměrně vysokém procentu (15).
Výskyt klinicky závažných genetických polymorfismů receptorů P2RY12; i-T744C (rs2046934) představuje 15 % a P2RY12; C34T (rs6785930) 11%. Při srovnání s výskytem ve zdravé populaci je to méně v případě P2Y12 (i-T744C) – 27,40 % heterozygotů a více u P2Y12 (C34T), kde je 2,63 % homozygotů.
Pokud však hodnotíme opět pacienty s nedostatečnou odpovědí na léčbu, je výskyt obou genetických změn oproti zdravé populaci vyšší P2RY12; i-T744C (rs2046934) 35,7 % a P2RY12; C34T (rs6785930) 14,3 %. Je zde patrný vliv selhání protidestičkové léčby.
Variabilita účinku protidestičkových léků s ohledem na složitý proces jejich působení a mnoho faktorů, které ovlivňují jejich účinek, představuje velmi složitý problém pro zajištění sekundární prevence ICHS (1).
Rozdílné závěry prací týkající se významnosti vlivu genetických změn destičkových glykoproteinů jsou dané rozdíly ve velikosti souborů vyšetřovaných osob, v zastoupení různých etnik, ve výběru skupin pacientů, respektive kontrol, v konečných cílech jednotlivých prací a v obrovské variabilitě faktorů zevního prostředí, které s genetickými vlivy různě interagují.
Závěr
Zjištění frekvencí variantních polymorfismů genů destičkových receptorů by mohlo poskytnout informaci o podílu pacientů, kde nelze očekávat odpověď na protidestičkovou terapii, jelikož polymorfismy mění vazebné místo receptorů destiček a nedochází k inhibici těchto receptorů aktivními metabolity antiagregancií. Jedním z cílů naší práce bylo získat údaje o frekvenci vybraných polymorfismů spojovaných se zvýšenou aktivitou, respektive agregabilitou destiček a rezistencí na léčbu ASA nebo clopidogrelem u mladých pacientů s AIM. Fisherův přesný test neprokázal signifikantní závislost mezi mutačními stavy receptorů COX-1, P2Y12 – C34T, P2Y12 – T744C a odpovědí na protidestičkovou léčbu, ale tento náš výsledek mohl být ovlivněn chybou malých čísel. Dostupná data z klinických studií zatím poskytují kontroverzní výsledky týkající se vlivu polymorfismů destičkových receptorů na účinnost protidestičkových léků. Experimentální modely a výsledky některých klinických studií však upozorňují na skutečnost, že tyto genetické varianty mohou být u některých skupin pacientů za určitých okolností významnými rizikovými faktory.
Podpořeno grantem IGA MZd ČR NS 10319-3/2009 86-14 a grantovým projektem LF-2011-006.
Mgr. Jana Úlehlová
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
jana.ulehlova@fnol.cz
Doručeno do redakce: 15. 12. 2011
Přijato po recenzi: 20. 1. 2012
Zdroje
1. Cuisset T, Frere C, Quilici J, et al. Aspirin noncompliance is the major cause of „aspirin resistance“ in patients undergoing coronary stenting. Am Heart J 2009; 157 (5): 889-893.
2. Gurbel PA, Tandry US. Clopidogrel resistance? Thrombosis Research 2007; 120 : 311–321.
3. Ševčíková H. Rezistence na protidestičkovou terapii. Interv Akut Kardiol 2006; 5 : 256–258.
4. Cattaneo M, Lecchi A, Zighetti ML, et al. Platelet aggregation studies: autologous platelet poor plasma inhibits platelet aggregation when added to platelet rich plasma to normalize platelet count. Haematologica 2007; 92 : 694–697.
5. Cattaneo M. Resistance to platelet drugs: molecular mechanisms and laboratory detection. J Thromb Heamost 2007; 5(Suppl. 1): 230–237.
6. Mueller T, Dieplinger B, Poelz W, et al. Utility of whole blood impedance aggregometry for the assessment of clopidogrel action using the novel Multiplate analyzer - comparison with two flow cytometric methods. Thromb Res 2007; 121 : 249–258.
7. Seyfert UT, Haubelt H, Vogt A, et al. Variables influencing Multiplate(TM) whole blood impedance platelet aggregometry and turbidimetric platelet aggregation in healthy individuals. Platelets 2007; 18 : 199–206.
8. Blais N, Pharad Ch, Lordkipanidze M, et al. Response to aspirin in heathy individuals. Cross-comparison of light transmission aggregometry, VerifyNow system, platelet count drop, thromboelastography (TEG) and urinary 11-dehydrothromboxane B2. Thromb Haemost 2009; 102 : 404–411.
9. Kvasnička J, Hájková J, Bobčíková P, Křížová P, Dušková D, Poletínová Š, Kieferová V. Polymorfizmy krevních destiček a možnosti monitorace účinku protidestičkové léčby. Interv Akut Kardiol 2008; 7(6): 215–218.
10. Lepäntalo A, Mikkelsson J, Reséndiz JC, et al. Polymorphisms of COX-1 and GPVI associate with the antiplatelet effect of aspirin in coronary artery disease patients. Thromb Haemost 2006; 95(2): 253–259.
11. Linnemann B, Schwonberg J, Mani H, et al. Standardization of light transmittance aggregometry for monitoring antiplatelet therapy: an adjustment for platelet count is not necessary. J Thromb Haemost 2008; 6 : 677–683.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2012 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Genetické polymorfismy destičkových receptorů u mladých pacientů s akutním infarktem myokardu (AIM) a rezistencí k protidestičkové léčbě
- Žilní trombózy u dětských pacientů s akutní lymfoblastickou leukemií
- Senzibilizace polytransfundovaných hematologických pacientů alogenními erytrocytovými a HLA antigeny
- Význam fyzické aktivity u pacientů s hematoonkologickými malignitami
- Asymptomatický makroadenom hypofýzy komprimující optické chiasma – „incidentalom“ – identifikovaný při diagnostickém stážování nemocného s primárně extranodálním difúzním B-velkobuněčným lymfomem očnice a paranasálních dutin – popis případu
- Vyhlášení ceny firmy Janssen
- Anti-Escherichia coli asparaginase antibody levels determine the activity of second-line treatment with pegylated E. coli asparaginase: a retrospective analysis within the ALL-BFM trials
- Warfarin and acetaminophen interaction: a summary of the evidence and biologic plausibility (Evidence-based focused review)
- Úvodní slova
- VKORC1 and CYP2C9 genotype and patient characteristics explain a large proportion of the variability in warfarin dose requirement among children
- XXVI. Olomoucké hematologické dny
- Pražské hematologické dny
- Mobilizace krvetvorných buněk pomocí plerixaforu - zkušenosti transplantačních center v České republice
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Asymptomatický makroadenom hypofýzy komprimující optické chiasma – „incidentalom“ – identifikovaný při diagnostickém stážování nemocného s primárně extranodálním difúzním B-velkobuněčným lymfomem očnice a paranasálních dutin – popis případu
- Význam fyzické aktivity u pacientů s hematoonkologickými malignitami
- Senzibilizace polytransfundovaných hematologických pacientů alogenními erytrocytovými a HLA antigeny
- Mobilizace krvetvorných buněk pomocí plerixaforu - zkušenosti transplantačních center v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



