-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNáhlá progrese mnohočetného myelomu charakterizovaná parciálním „light-chain escape“ fenoménem a sekundární translokací t(8;14)
Pika T., Balcárková J., Lochman P., Minařík J., Jarošová M., Raida L., Bačovský J., Ščudla V.: Progression of multiple myeloma associated with partial „light-chain escape“ phenomenon and secondary t(8;14)
The authors present the case study of a multiple myeloma patient with a good primary response to induction chemotherapy and high-dose treatment supported by autologous peripheral stem cells. The following early and abrupt progression of the disease was characterised by a clone of the morphologically dedifferentiated population of tumorous cells including the loss of the ability to synthesize complete molecules of the monoclonal immunoglobulin and the overproduction of kappa free light chains. A cytogenetic examination revealed the development of a karyotype and the presence of secondary cytogenetic modifications with an unfavourable prognosis – translocation t(8;14) (q24;q32) and increased number of copies of the 1q21 area. The myeloma progression was associated with the subsequent resistance to a state-of-the-art combined therapy.
Key words:
multiple myeloma, immunoglobulin light chains, cytogenetics, t(8;14)
Autoři: T. Pika 1; J. Balcárková 2; P. Lochman 3; J. Minařík 1; M. Jarošová 2; L. Raida 2; J. Bačovský 1; V. Ščudla 1
Působiště autorů: III. interní klinika, LF Univerzity Palackého a Fakultní Nemocnice Olomouc, 2Hemato-onkologická klinika, LF Univerzity Palackého a Fakultní Nemocnice Olomouc, 3Oddělení klinické biochemie a imunohematologie, Fakultní Nemocnice Olomouc 1
Vyšlo v časopise: Transfuze Hematol. dnes,17, 2011, No. 1, p. 30-35.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Autoři předkládají případ nemocného s mnohočetným myelomem s primárně dobrou odpovědí na indukční chemoterapii a vysokodávkovanou terapii s podporou autologních periferních kmenových buněk. Následná časná abruptivní progrese onemocnění byla charakterizována klonem morfologicky dediferencovaných myelomových buněk se ztrátou schopnosti syntézy kompletní molekuly monoklonálního imunoglobulinu a výraznou nadprodukcí volných lehkých řetězců kappa. Cytogenetické vyšetření prokázalo vývoj karyotypu s přítomností sekundárních, prognosticky nepříznivých cytogenetických změn – translokace t(8;14)(q24;q32) a zvýšený počet kopií oblasti 1q21. Progrese myelomu byla spojena s výraznou rezistencí na kombinovanou chemoimunoterapii.
Klíčová slova:
mnohočetný myelom, lehké řetězce imunoglobulinu, cytogenetika, t(8;14)Úvod
Mnohočetný myelom je zhoubné hematologické onemocnění charakterizované klonální proliferací a akumulací neoplasticky transformovaných elementů terminálních stadií B-lymfocytární linie, charakterizované produkcí monoklonálního imunoglobulinu (paraprotein, M-protein) nebo jeho strukturálních součástí (lehké řetězce) detekovatelných v séru a/nebo v moči a s asociovaným orgánovým postižením charakterizovaným zkratkou CRAB (hyperkalcemie, renální nedostatečnost, anémie, kostní léze). Samotné biologické a klinické vlastnosti onemocnění jsou determinovány nejen stupněm postižení, charakteristikou vnitřních interakcí v mikroprostředí kostní dřeně, léčebnou odpovědí nemocného na zvolený typ chemo/radioterapie, ale zejména genetickou výbavou nádorového klonu (1, 2, 3). Předložené sdělení popisuje méně obvyklé pozorování nemocného s progredujícím mnohočetným myelomem.
Popis případu
58letý nemocný byl v březnu 2008 hospitalizován ve spádovém rehabilitačním oddělení pro vertebrogenní algický syndrom. Hospitalizaci předcházely několikaměsíční, postupně progredující bolesti zad v dolní hrudní a bederní páteři i bolesti levého ramene. V rámci komplexního přešetření byla zjištěna vysoká sedimentace (FW 95/h), normocytární normochromní anémie (Hb 95 g/l), hyperkalcemie (2,78 mmol/l), mírná renální insuficience (kreatinin 137 μmol/l) a hyperproteinemie s hodnotou celkové bílkoviny (CB 104 g/l). Nemocný byl rehydratován a promptně odeslán k další péči na specializované oddělení III. interní kliniky FN v Olomouci.
Subjektivní obtíže zahrnovaly několikaměsíční, stupňující se bolesti dolní hrudní a bederní páteře, bez propagace do dolních končetin a výrazné bolesti levého ramene s omezením pohyblivosti paže. Další příznaky zahrnovaly zvýšenou únavu, ponámahovou dušnost a úbytek na hmotnosti asi 9 kg za poslední 3 měsíce.
V oblasti kalvy byly zjištěny 3 hmatné polotuhé polokulovité rezistence do průměru 2 cm temporoparietálně vpravo a znatelně omezená hybnost levého ramenního kloubu zejména při elevaci a rotaci paže. Ostatní fyzikální nález byl bez podstatných odchylek.
V laboratorním obraze byla přítomna vysoká sedimentace erytrocytů (FW 127/142), normocytární normochromní anémie (Hb 94) bez alterace bílé řady či počtu destiček a se záchytem 1 % plazmatických buněk v manuálním diferenciálním rozpočtu leukocytů. V biochemickém rozboru séra byla zjištěna hyperproteinemie (CB 114 g/l), hypoalbuminemie (33 g/l), a vyšší hladinu β2-mikroglobulinu (β2-m, 3,88 mg/l). Elektroforetické a imunofixační vyšetření séra potvrdilo vysoký „peak“ monoklonálního imunoglobulinu IgA kappa v dimerické formě (50,2 g/l), nefelometrické vyšetření séra (FreeliteTM) ukázalo vysoké hladiny volných lehkých řetězců (VLŘ) kappa (129,9 mg/l; normální rozmezí: 3,3–19,4 mg/l) s výraznou patologií indexu klonality kappa/lambda (12,44; normální rozmezí: 0,26–1,65). Elektroforetické a imunofixační vyšetření moče nebylo vzhledem k nízké kvantitě proteinurie (150 mg/den) výtěžné. Viskozita séra byla zvýšena na 3,66 (normální hodnota < 1,95).
Trepanobioptické vyšetření kostní dřeně odhalilo 35 % intersticiálně – nodulární infiltraci kostní dřeně poměrně dobře diferencovanou myelomovou populací (CD 138+) s monoklonální expresí řetězců kappa a s útlakem reziduální hemopoézy. Cytogenetické vyšetření kostní dřeně s nálezem normálního karyotypu, 46 XY, bylo doplněno metodou fluorescenční in situ hybridizace s imunofluorescenčním značením myelomových buněk – metodou cIg FISH, označovanou také jako metoda FICTION (4, 5). Byly nalezeny změny v počtu kopií IgH genu, chromozomu 1, oblasti 1q21, chromozomů 7, 9 a 17 (tab. 1). Radiografické vyšetření skeletu, vyšetření pozitronovou emisní tomografií (18FDG - PET/CT) a scintigrafické vyšetření skeletu s pomocí 99mTc-MIBI potvrdilo četné osteolytické a aktivní léze, v oblasti kalvy a levé lopatky s projevy extramedulárního šíření. Doplněné neurologické vyšetření, včetně elektromyografie, zjistilo kompletní denervaci m. infraspinatus vlevo při útlaku n. suprascapularis extramedulární myelomovou masou.
Tab. 1. Výsledky cytogenetiky a cIg FISH. 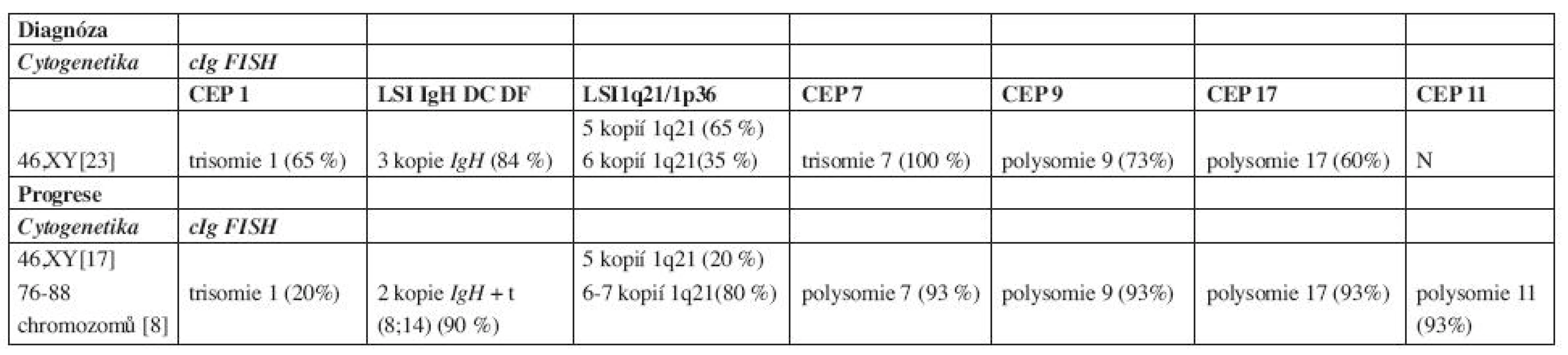
(polysomie 3–6 kopií chromozomů, N – normální nález, CEP – označení pro centromerickou sondu, LSI – označení pro genovou sondu) Stav byl tedy uzavřen jako symptomatický mnohočetný myelom typu IgA-kappa, st. III-A dle Durieho-Salmona, st. 2 dle International Staging System s iniciální extramedulární propagací v oblasti kalvy a levé lopatky (6, 7). V rámci přípravy k vysokodávkované chemoterapii s podporou periferních kmenových buněk (HD-T/ASCT) byl zvolen indukční režim CTD junior (Cyklofosfamid 800 mg i.v. 1. den, Thalidomid 200 mg p.o. denně, Dexametazon 40 mg p.o. 1.–4. a 12.–15. den cyklu) v 21denních intervalech podání v souladu s tehdejším platným protokolem České myelomové skupiny (CMG) (8, 9). Terapie byla doplněna ložiskovou aktinoterapií na oblast levé lopatky a extramedulární léze kalvy v celkové dávce 30 Gy. Jako antiresorpční terapie byla zvolena intravenózní aplikace pamidronátu v pravidelných měsíčních intervalech. Bazální analgetická léčba byla zajištěna transdermální formou fentanylu, na průlomovou bolest byl nemocný vybaven metamizolem a paracetamolem.
Celkem byly podány 4 cykly indukční chemoterapie režimem CTD junior, pro známky polyneuropatie dolních končetin a obstipaci s redukcí dávky thalidomidu od 2. cyklu na 50 % (100 mg denně p.o.). Indukční chemoterapií bylo dosaženo velmi dobré parciální remise onemocnění (VGPR) se snížením hodnoty M-proteinu z 50,2 na 3,62 g/l, tedy s redukcí o > 90 % (10). Rovněž byl zaznamenán pokles hladin VLŘ kappa z hodnoty 129,9 na 82 mg/l. Průběh chemoterapie byl kromě polyneuropatie dolních končetin 2.–3. st., provázen opakovanou exacerbací chronické bronchitidy s nutností antibiotické terapie, vznikem steroidního diabetu II. typu s nutností trvalé terapie perorálními antidiabetiky, ale i epizodou hluboké žilní popliteální trombózy levé dolní končetiny se scintigraficky verifikovanou asymptomatickou plicní embolizací a to i přes trvalou profylaktickou terapii nízkomolekulárním heparinem. Dodatečně byla zjištěna pozitivita lupus antikoagulans. Měsíc po ukončení indukční chemoterapie a po sanaci možných infekčních fokusů byla provedena stimulace a sběr periferních kmenových buněk (stimulační režim vysokodávkovaný Cyklofosfamid 2,5g/m2 + G-CSF 10 μg/kg/den 3.–10. den, leukocytaferéza provedena 11. den s výtěžkem 6,5 x 106/kg CD34+ buněk). V 6 měsíci od diagnózy nemoci byla provedena HD-T/ASCT (přípravný režim vysokodávkovaný Melfalan 200 mg/m2), průběh komplikován respiračním infektem, mukozitidou I. st. a sepsí způsobenou bakterií Enterococcus faecalis.
Po 90 dnech od převodu štěpu bylo provedeno celkové přešetření onemocnění: M-protein 1,47 g/l, hodnoty VLŘ kappa 20,08 mg/l s pouze lehce nadhraniční hodnotou indexu κ/λ – 2,23, ale normální hodnoty hemogramu a ukazatelů biochemického spektra. Histobiopsie kostní dřeně prokázala 1 % monoklonálních plazmocytů jako obraz minimální reziduální nemoci. Výsledný stav byl hodnocen jako velmi dobrá parciální remise a v souladu s doporučeními CMG byl nemocný ponechán bez udržovací terapie, pouze s nastavenou perorální antiresorpční terapií klodronátem (9, 10). Při kontrole ve 4. měsíci od HD-T/ASCT byla zachycena pouze imunofixační pozitivita M-proteinu s normálními hladinami polyklonálních imunoglobulinů, avšak při vyšetření hladin VLŘ byl zjištěn mírný nárůst hladiny řetězce kappa (38,7 mg/l) i indexu κ/λ (3, 55), nemocný byl celkově zcela asymptomatický. V odstupu 2 měsíců byl nemocný odeslán ze spádového interního zařízení pro 2 týdny trvající levostrannou bronchopneumonii s významným poklesem červené složky hemogramu. Byla zjištěna anémie (Hb 80 g/l) s normálními hodnotami bílých krvinek a trombocytů, elevace CRP (232 mg/l), mírný nárůst hladiny M-proteinu na 4,8 g/l, avšak vyšetření VLŘ potvrdilo extrémní nárůst hladiny kappa (1763 mg/l) a indexu κ/λ (226). Histobiopsie kostní dřeně potvrdila progresi myelomu s masivní, 88 % kompaktní infiltrací kostní dřeně anaplastickou myelomovou populací plazmoblastického vzhledu. Cytogenetické vyšetření odhalilo vývoj karyotypu s přítomností nového klonu s počtem až 88 chromozomů, pro špatnou morfologii chromozomů byly hodnoceny pouze početní změny. Metodou cIg FISH byla potvrzena změna karyotypu s nálezem polysomie chromozomů 7, 9, a 17, trisomie chromozomu 1 a 11 a polysomie 1q21. V době diagnózy byly zjištěny tři kopie IgH genu a v době progrese došlo k vývoji karyotypu a jedna nadpočetná kopie genu IgH byla zahrnuta do přestavby, translokace mezi chromozomy 8 a 14, t(8;14)(q24;q32) (tab. 1). V séru byl rovněž zjištěn nárůst hladiny β2-m (2,9 mg/l) a extrémně vysoká hodnota sérové thymidinkinázy (100 IU/l). Aktuální stav byl uzavřen jako: „abruptivní progrese“ mnohočetného myelomu IgA-kappa, s přítomností parciálního „light-chain escape“ fenoménu a se záchytem sekundárních cytogenetických změn.
Chemoterapie režimem VMP junior (Bortezomib 1,3 mg/m2 i.v. 1., 4., 8. a 15. den, Alkeran 9 mg/m2 p.o. 1.–4. den, Prednison 2 mg/kg p.o. 1.–4. den 28denního cyklu) vedla již po 1. cyklu k poklesu hladiny VLŘ kappa (246,7 mg/l) i indexu κ/λ (29,8), zatímco hodnota M-proteinu zůstala beze změny (4,91 g/l), bylo ale zjištěno vymizení BJ-urie (9). V průběhu 3. cyklu chemoterapie VMP došlo k postupnému vývinu oboustranné protruze očních bulbů s pravostrannou diplopií. CT a následně i MR vyšetření zobrazilo extramedulární expanze v obou očnicích s deviací zejména pravého bulbu mediálně (obr. 1, 2). V laboratorním obraze byl zjištěn opětovný nárůst hladiny VLŘ kappa (685 mg/l) s prohloubením patologie indexu κ/λ (237,1), zatímco hodnoty M-proteinu zaznamenaly pouze lehké navýšení na 7,6 g/l. Vzhledem ke zřejmé rezistenci na uvedenou chemoterapii byla zvolena záchranná chemoterapie režimem RAD (Lenalidomid 25 mg p.o. 1.–21. den, Adriablastin 9 mg/m2 i.v. 1. a 15. den, Dexametason 40 mg p.o. 1.–4. a 15.–18. den 28denního cyklu), podaného vzhledem k opětovné závažné exacerbaci infekce dýchacích cest v redukované, 50 % dávce. Souběžně probíhala ložisková radioterapie oblasti pravé očnice. Přes současnou chemo/aktinoterapii došlo k dalšímu rozvoji mnohočetných extramedulárních lézí (rty, paže, trup, žebra a kalva) s dalším nárůstem hladiny VLŘ kappa (873 mg/l) i indexu κ/λ (249) (graf 1). Nemocný zmírá na progresi základního onemocnění komplikovaného nasedající bilaterální bronchopneumonií 17 měsíců od diagnózy myelomu.
Obr. 1. MR vyšetření očnic, expanze v oblasti spodiny pravé očnice. T1 vážená sekvence s potlačením tuku po aplikaci paramagnetické kontrastní látky v koronální rovině. Přístroj Symphony – Siemens 1,5 T. (Poskytnuto MUDr. J. Hrbkem, Radiologická klinika, FN Olomouc). 
Obr. 2. MR vyšetření očnic, expanze v oblasti pravé očnice a druhá, menší léze, v oblasti laterální stěny levé očnice. T1 vážená sekvence s potlačením tuku po aplikaci paramagnetické kontrastní látky v transverzální rovině. Přístroj Symphony – Siemens 1,5 T. (Poskytnuto MUDr. J. Hrbkem, Radiologická klinika, FN Olomouc). 
Graf 1. Průběh onemocnění, srovnání hladiny paraproteinu (IgA kappa) a volných lehkých řetězců kappa (Kappa free). CTD junior (Cyklofosfamid, Thalidomid, Dexametazon), ASCT (vysokodávkovaná chemoterapie s podporou autologního štěpu), VMP junior (Bortezomib, Melfalan, Prednizon), RAD (Lenalidomid, Adriablastin, Dexametazon). 
Diskuse
Předložené pozorování demonstruje průběh mnohočetného myelomu s úvodní dobrou odpovědí na indukční chemoterapii CTD a HD-T/ASCT, avšak s následnou časnou prudkou progresí onemocnění a s rezistencí na kombinovanou léčbu novými biologickými působky, kortikosteroidy a antracyklinu. Představuje zřejmě příklad vyselektování rezistentního anaplastického klonu charakterizovaného morfologicky dediferencovanou populací se ztrátou schopnosti syntézy kompletní molekuly M-proteinu, nadprodukcí VLŘ kappa a přítomností sekundárních prognosticky nepříznivých cytogenetických změn spojených s progresí myelomu s výskytem sekundární translokace t(8;14)(q24;q32) a zvýšení počtu kopií oblasti 1q21 v době progrese MM (11, 12).
Jako „light-chain escape (LCE)“ fenomén, tedy „únik“ nebo „průlom“ je označován stav, kdy se relaps/ /progrese onemocnění vyznačuje masivní produkcí VLŘ detekovatelných v séru a/nebo v moči, avšak bez adekvátního nárůstu hladiny M-proteinu (13). Termín LCE byl poprvé použit J.R. Hobbsem, který popsal detekci LCE fenoménu v moči u části relabujících nemocných (14). V odborné literatuře jsou popisovány 2 typy LCE fenoménu: 1. Pravý typ – definovaný jako nárůst v hladinách VLŘ se stabilní nebo klesající hladinou M-proteinu a 2. parciální typ – definovaný jako masivní nárůst hladin VLŘ, avšak pouze s nízkým nárůstem hladiny M-proteinu (13). Vysvětlením pro tento fenomén je pravděpodobně přítomnost duální plazmocytární populace v kostní dřeni s jednou, produkující převážně kompletní molekuly M-proteinu, a s druhou, většinou méně diferencovanou, produkující ve vysoké míře převážně lehký řetězec imunoglobulinu. V době relapsu/progrese s možnou dediferenciací nádorového klonu dochází ke změně poměru nádorové populace v kostní dřeni ve prospěch syntézy lehkých řetězců, jak bylo demonstrováno pomocí dvojitých imunohistochemických technik (15). LCE fenomén je typický zejména pro relabující/ /progredující onemocnění po předchozí terapii, zejména pak s použitím nových biologických léků (thalidomid, lenalidomid), ale bylo popsáno i pozorování progrese původně asymptomatického onemocnění bez předchozí chemoterapie do symptomatické formy s LCE fenoménem. LCE fenomén je typický zejména pro nemocné s izotypem IgA, ale byl popsán již i u omezeného počtu nemocných s izotypem IgG, avšak většinou v jeho parciální formě. Samotná prevalence LCE fenoménu značně závisí na použitých detekčních technikách, v souborech zahraničních autorů se pohybuje od 2,5 do 20 % relabujících nemocných, přičemž 3–8 % tvoří pravá forma LCE. Je evidentní, že s možností stanovení sérových hladin VLŘ (FreeliteTM) se záchytnost zvyšuje a dovoluje LCE fenomén detekovat mnohem časněji než při vyšetření moči. Z dosavadních studií vyplývá, že nemocní s obrazem LCE v relapsu mají nepříznivou prognózu, rezistenci na terapii a časté extramedulární postižení a proto časná detekce tohoto fenoménu s použitím nejnovějších technik může odhalit časný relaps onemocnění s bezprostředním nasazením intenzivní terapie a prodloužení přežití nemocných (16, 17, 18, 19, 20).
Cytogenetické změny u mnohočetného myelomu lze rozdělit do 2 velkých, prognosticky rozdílných skupin: hyperdiploidie (charakterizované variabilními trisomiemi chromozomů s nízkou prevalencí IgH translokací) a nonhyperdiploidie (zahrnující hypodiploidie, pseudodiploidie a near-tetraploidie s častými translokacemi IgH genu). Mezi další prognostické ukazatele patří delece chromozomu 13, 17 a změny chromozomu 1. Hyperdiploidní změny se vyznačují příznivější prognózou, postihují častěji starší nemocné a častěji jsou spojeny s izotypem IgG kappa, naopak všeobecně nonhyperdiploidní změny jsou zatíženy nepříznivou prognózou, jsou četnější u mladších nemocných a častěji spojeny s izotypem IgA lambda (21). Mezi nejčastější translokace IgH genu patří translokace t(4;14)(p16;q32) a t(4;16) (q32;q23), které jsou obvykle prognosticky nepříznivé a t(11;14)(q13;q32), která je naopak spojena s prognózu příznivou, resp. neutrální (3, 21, 22). Sekundární cytogenetické změny, akumulované během vývoje nádorového klonu s sebou nesou i změnu charakteru biologického chování a primárně příznivé cytogenetické změny mohou být v případě sekundárních, následných změn, příčinou progrese a léčebné rezistence onemocnění (23, 24). V našem případě byla již v době diagnózy zjištěna hyperdiploidie metodou cIgFISH: trisomie chromozomů 1, 7, polysomie 9, 17 a nadpočetné kopie oblasti 1q21. Následně, v době progrese došlo k cytogenetickému vývoji, k objevení se klonu s počtem až 88 chromozomů a metodou cIgFISH byla potvrzena polysomie chromozomů 7, 9, 11, 17, trisomie chromozomu 1 a 4–5 kopií oblasti 1q21. Dále došlo k vývoji nové translokace t(8;14), jako sekundární změny. Translokace (8;14) (q24;q32) je charakteristickou chromozomální translokací u Burkittova lymfomu a vede k deregulaci c-myc onkogenu. V případě mnohočetného myelomu je nalézána přibližně u 1–2 % nově diagnostikovaných nemocných a stejná četnost se udává i u nemocných s relabujícím onemocněním; některé práce předpokládají asociaci s IgA izotypem, což je v souladu s naším pozorováním (25, 26). Úplný klinický dopad není doposud zcela jasný, předpokládá se ale agresivní průběh, i když publikace hodnotící terapii u nově diagnostikovaných nemocných s t(8;14) s použitím bortezomibu či lenalidomidu hovoří spíše o dobré odpovědi na podávanou chemoterapii (21, 27, 28). V našem případě byla zaznamenána ale sekundární změna, spojená s vývinem plazmablastického fenotypu plazmocytární populace s projevy biochemické dediferenciace vedoucí k dominantní sekreci jednoho typu VLŘ, s extramedulárním šířením a rezistencí na intenzivní kombinovanou chemoimunoterapii se začleněním bortezomibu, lenalidomidu a působků antracyklinového typu.
Závěr
Předložené pozorování popisuje nepříznivý průběh mnohočetného myelomu s kumulací nepříznivých prognostických ukazatelů – nepříznivých cytogenetických změn, pokročilým iniciálním postižením, komplikacemi zatíženou chemoterapií a s následnou „abruptivní“ progresí s multifokálním extramedulárním šířením, manifestující se parciálním LCE fenoménem a rezistencí k intenzivní terapii se začleněním moderních biologických působků. Bylo potvrzeno, že nové možnosti stanovení sérových hladin VLŘ (FreeliteTM) a opakované cytogenetické vyšetření dovolují rozpoznat časný relaps/progresi onemocnění, zejména pokud se jedná o případ LCE fenoménu a identifikovat nemocné s krajně nepříznivou prognózou s nutností časné intenzivní terapie. V předloženém pozorování se jednalo o neobyčejně agresivní onemocnění, přičemž samotná manifestace progrese formou LCE fenoménu proběhla ve velmi krátkém intervalu a provázená již poměrně pokročilým postižením.
MUDr. Tomáš Pika
III. interní klinika, Fakultní Nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.pika@seznam.czDoručeno do redakce: 13. 12. 2010
Přijato po recenzi: 12. 1. 2011
Zdroje
1. Kyle RA, Rajkumar SV. Multiple myeloma. Blood 2009; 111 : 2962-2972.
2. International myeloma working group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749-757.
3. Stewart AK, Bergsagel PL, Greipp PR, et al. A practical guide to defining high-risk myeloma for clinical trials, patient counseling and choice of therapy. Leukemia 2007; 21 : 529-534.
4. Balcárková J, Procházková K, Ščudla V, et al. Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem. Trans a Hemat dnes 2007; 4 : 176 -182.
5. Ahmann GJ, Jalal SM, Juneau AL. et al. A novel three-color, clone-specific fluorescence in situ hybridization procedure for monoclonal gammopathies. Cancer Genet Cytogenet 1998; 101 : 7-11.
6. Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Cancer 1975; 36 : 842-854.
7. Greipp PR, Miguel JS, Durie BGM, et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23 : 3412-3420.
8. Zemanová M, Ščudla V, Pour L, et al. Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu. Trans Hematol dnes 2007; 13 : 126-132.
9. Czech Myeloma Group. Diagnostika a léčba mnohočetného myelomu. Transfuze Hematol dnes 2009; 15 : 5-80.
10. Durie BGM, Harousseau J-L, Miguel JS, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20 : 1467-1473.
11. Shaughnessy JD Jr., Zhan F, Burington BE, et al. A validated gene expression model of high-risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109 : 2276-2284.
12. Chng WJ, Santana-Dávila R, Van Wier SA, et al. Prognostic factors for hyperdiploid-myeloma: effects of chromosome 13 deletions and IgH translocations. Leukemia 2006; 20 : 807-13.
13. Bradwell AR. Free light chain escape. In: Bradwell AR. Serum free light chain analysis. 6th edition, The Binding site group Ltd., Birmingham, 2010, 104-105.
14. Hobbs JR. Growth rates and responses to treatment in human myelomatosis. Brit J Haematol 1969; 16 : 607-618.
15. Ayliffe MJ, Davies FE, de Castro D, Morgan GJ. Demonstration of changes in plasma cell subsets in multiple myeloma. Haematologica 2007; 92 : 1135-1138.
16. Mead G, Hobbs J, Sharp K, Harding S, Drayson M. Incidence of light chain escape in myeloma patients at relapse. Brit J Haematol 2008; 141 (Suppl 1): 35.
17. Kühnemund A, Liebisch P., Bauchmüller K, et al. Secondary light chain multiple myeloma with decreasing IgA paraprotein levels correlating with renal insufficiency and progressive disease: Clinical course of two patients and review of the literature. Onkologie 2005; 28 (suppl 3): 165.
18. Kühnemund A, Liebisch P., Bauchmüller K, et al. Light-chain escape-multiple myeloma – an escape phenomenon from plateau phase: report of the largest patients series using LC-monitoring. J Cancer Res Clin Oncol 2009; 135 : 477-84.
19. Dawson MA, Patil S, Spencer A. Extramedullary relapse of multiple myeloma associated with a shift in secretion from intact immunoglobulin to light chains. Haematologica 2007; 92 : 143-144.
20. Granatova J, Bolkova M, Valentova K, Hanzal V, Haber J, Hachova L. Is the light chain escape phenomenon possible without previous hematological therapy? Klin Biochem Metab 2010; 18 : 83-87.
21. Fonseca R, Bergsagel PL, Drach J, et al. International myeloma working group molecular classification of multiple myeloma: spotlight review. Leukemia 2009; 23 : 2210-2221.
22. Liebisch P, Döhner H. Cytogenetics and molecular cytogenetics in multiple myeloma. Eur J Cancer 2006; 42 : 1520-1529.
23. Chng WJ, Mulligan G, Bryant B, Bergsagel L. Survival of genetic subtypes of relapsed myeloma may be modulated by secondary events. Blood 2007; 109 : 3610-3611.
24. Chng WJ, Winkler JM, Greipp PR, et al. Ploidy status rarely changes in myeloma patients at disease progression. Leukemia Res 2006; 30 : 266-271.
25. Sawyer JR, Waldron JA, Jagannath S, Barlogie B. Cytogenetic findings in 200 patients with multiple myeloma. Cancer Genet Cytogenet 1995; 82 : 41-49.
26. Gould J, Alexanian R, Goodacre A, Pathak S, Hecht B, Barlogie B. Plasma cell karyotype in multiple myeloma. Blood 1988; 71 : 453-456.
27. Li JY, Wang LX, Shen WY, Lu SF, Chen LJ, Lu H. Bortezomib in combination with dexamethasone for a young multiple myeloma with t(8;14). Leukemia Research 2009; 33 : 565-600.
28. Yuan J, Shah R, Kulharya A, Ustun C. Near-tetraploidy clone can evolve from a hyperdiploidy clone and cause resistance to lenalidomide and bortezomib in multiple myeloma patient. Leukemia Research 2010; 34 : 954-957.
Vypracováno s podporou VZ MŠMT ČR 6198959205.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2011 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Alogenní transplantace krvetvorných buněk po režimu s redukovanou intenzitou ve složení busulfan, fludarabin a antithymocytární globulin (ATG Fresenius): dlouhodobé výsledky
- A novel prognostic model in elderly patiens with acute myeloid leukemia: results of 909 patients entered into the prospective AML 96 trial
- Vyšetření pozitronovou emisní tomografií u nemocných s Hodgkinovým lymfomem
- Rebalanced hemostasis in patiens with liver disease: evidence and clinical consequences
- Je nutné vyšetření koagulace před adenoidektomií a tonzilektomií?
- Náhlá progrese mnohočetného myelomu charakterizovaná parciálním „light-chain escape“ fenoménem a sekundární translokací t(8;14)
- A review on allogeneic stem cell transplantation for newly diagnosed pediatric acute myeloid leukemia
- Comparable survival after HLA-well-matched unrelated or matched sibling donor transplantation for acute myeloid leukemia in first remission with unfavorable cytogenetics at diagnosis
- Zprávy odborných společností
- Molekulárně genetická vyšetření u trombofilních stavů spojených se žilním tromboembolismem a jeho komplikacemi – konsensus České společnosti pro trombózu a hemostázu ČLS JEP, Společnosti pro lékařskou genetiku ČLS JEP, České hematologické společnosti ČLS
- Doporučení České společnosti pro trombózu a hemostázu ČLS JEP Opatření ke snížení rizika žilního tromboembolismu u hospitalizovaných nemocných
- VYHODNOCENÍ RIZIKOVÝCH FAKTORŮ HLUBOKÉ ŽILNÍ TROMBÓZY (HŽT) U CHIRURGICKÝCH PACIENTŮ
- Základní imunohematologická laboratorní vyšetření červené řady – Obecné zásady a technické postupy
- Úvodník
- Předtransfuzní laboratorní vyšetření
- Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Současné možnosti využítí monoklonálních protilátek v protinádorové léčbě
- Je nutné vyšetření koagulace před adenoidektomií a tonzilektomií?
- Předtransfuzní laboratorní vyšetření
- Doporučení České společnosti pro trombózu a hemostázu ČLS JEP Opatření ke snížení rizika žilního tromboembolismu u hospitalizovaných nemocných
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



