-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Folikulární lymfom a význam nádorového mikroprostředí
Follicullar lymphoma and the significance of its tumour microenvironment
Follicular lymphoma (FL) is an indolent B-lymphoproliferative disease characterized by slow growth and recurrent course. Despite of histological homogeneity, clinically, it is quite heterogeneous disease. Median of survival is about 18 years, but 10–15% of patients die during 2–3 years from the time of diagnosis due to progression of the disease. Spontaneous regressions appear typically in FL and suggest immunological interaction with tumor cells. The importance of the tumor microenvironment as the determining factor of the lymphoma’s biology is supported by the results of several gene expression and immunophenotyping studies. This review summarizes recent knowledge about the “players” of the tumor microenvironment in FL such as follicular dendritic cells (FDC), FOXP3+ T-regulatory cells (T-regs), CD8+ cytotoxic T-cells, lymphoma associated macrophages (LAMs), CD57+ NK-cells, etc. The influence of the tumor microenvironment on biology of follicular lymphoma seems to be clear but the results are often controversial. These discrepancies could be partially caused by diverse design of studies, but especially a different sensibility of each microenvironment subpopulation to the various therapeutic regimens is of value. Understanding the microenvironment elements, their relationship and cross-talk with tumor cells could help to establish precise individual prognosis but also to select a targeted therapeutic strategy.
Key words:
follicular lymphoma, t(14;18), tumor microenvironment, FOXP3, follicular dendritic cells, lymphoma-associated macrophages
Autoři: A. Janíková 1; J. Michalka 1; B. Tichý 1; P. Fabian 2; J. Šupíková 1; J. Mayer 1
Působiště autorů: Interní hematoonkologická klinika, Lékařská fakulta Masarykovy univerzity a Fakultní nemocnice Brno 1; Masarykův onkologický ústav Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,16, 2010, No. 3, p. 150-157.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Folikulární lymfom (FL) je indolentní B-lymfoproliferace charakterizovaná pomalým růstem a rekurentním průběhem. Navzdory histologické uniformitě se klinicky jedná o značně heterogenní onemocnění. Celkový medián přežití se pohybuje kolem 18 let, přesto 10–15 % pacientů umírá v důsledku progrese FL do 2–3 let. Pro FL jsou také příznačné spontánní regrese, což předpokládá imunologickou interakci nádorových buněk s ostatními elementy imunitního systému. Význam nádorového mikroprostředí jako určujícího faktoru chování FL podporují výsledky studií genové exprese a analýzy imunofenotypu ne-nádorových buněk. Předkládaný přehled sumarizuje současné poznatky o jednotlivých „hráčích“ nádorového mikroprostředí FL jako jsou folikulární dendritické buňky (FDC), T-regulační (FOXP3+) a T-cytotoxické lymfocyty (CD8+), s lymfocyty asociované makrofágy (LAM), NK-buňky (CD57+) apod. Vliv nádorového mikroprostředí na chování FL se dnes jeví jako nezpochybnitelný, avšak interpretace výsledků je často nejednotná a rozporuplná. Tyto rozdíly pravděpodobně pramení z různé koncepce jednotlivých studií, ale jsou dány i rozdílnou citlivostí jednotlivých komponent nádorového mikroprostředí k různým typům léčby. Poznání elementů nádorového mikroprostředí, jejich vzájemných vztahů a interakce s nádorovými buňkami by mohlo vést ke stanovení přesnější individuální prognózy pacienta ale také k cílené léčbě „šité na míru“.
Klíčová slova:
folikulární lymfom, t(14;18), nádorové mikroprostředí, FOXP3, folikulární dendritické buňky, s lymfomem asociované makrofágyÚvod
Folikulární lymfom (FL) je jedním z nejčastěji se vyskytujících nehodgkinských lymfomů (NHL). Choroba se typicky manifestuje jako chronicky probíhající nebolestivá lymfadenopatie, vyznačující se návraty ale i spontánními remisemi (1). Medián přežití se nyní pohybuje kolem 18 let (2). Stále však existuje nezanedbatelná část nemocných (cca 10–15 %) s agresivním charakterem choroby, která reaguje nedostatečně na léčbu a vede k úmrtí do 2–3 let od stanovení diagnózy. Příčinou smrti bývají obvykle komplikace vyplývající z toxicity léčby nebo transformace do agresivního lymfomu (3).
Pozorované jevy jako spontánní remise, výborný efekt alogenní transplantace s významným „graft versus lymphoma“ efektem (4) a také prokázané přetrvávání t(14;18)+ buněk v krvi a uzlinách pacientů v dlouhodobých remisích folikulárního lymfomu (5) naznačují, že kromě nádorových buněk se musí uplatňovat v klinické manifestaci FL další faktor. Jedna z prvních prací, která obrátila pozornost směrem k nenádorovým buňkám tzv. mikroprostředí uzliny, je analýza genové exprese na celogenomovém čipu u 96 pacientů s FL. Autoři definovali a validovali dvě nezávislé podskupiny (nazvané „Immune response 1“ a „Immune response 2“), které se lišily expresními profily, klinickým chováním a prognózou (6). Rozdíly v genové expresi se však nepromítaly do B-buněk (CD19+), ale mezi buňky tzv. nádorového mikroprostředí (non CD19+). Dnes existuje celá řada studií podporujících hypotézu, že folikulární lymfom lze nahlížet jako onemocnění funkční interakce nádorových buněk a ostatních nenádorových buněk imunitního systému.
Tento stručný přehled sumarizuje dosavadní poznatky o nádorovém mikroprostředí FL a snaží se je interpretovat v širším rámci této zajímavé diagnózy. Následující text z edukačních a logických důvodů nejprve rozebírá morfologii fyziologické i nádorové uzliny FL včetně charakteristiky vlastních t(14;18) pozitivních buněk. Dále jsou jednotlivé kapitoly věnovány klinicky nejvýznamnějším složkám mikroprostředí v kontextu normální i nádorové tkáně doplněné o výsledky studií a technologické možnosti mapování jednotlivých jejích elementů.
Morfologie lymfatické uzliny
Lymfatická uzlina je sekundární lymfatický orgán (obr. 1), který je osídlen lymfoidními buňkami generovanými v thymu (T-lymfocyty) a kostní dřeni (B-lymfocyty). Histologicky se rozlišuje část periferní – kortikální (zde ještě povrchová vrstva a parakortex blíže centru uzliny) a vnitřní – medulární. Z funkčního hlediska potom lze diferencovat retikulum z kolagenních a elastických vláken tvořící konstrukci uzliny a celulární kompartment (7). Celulární kompartment je tvořen zejména lymfocyty, které jsou v kortikální oblasti shlukovány do tzv. folikulů. Primární folikuly jsou tvořeny malými uniformními lymfocyty bez antigenní stimulace, sekundární folikuly vznikají z primárních po antigenní stimulaci a obsahují světlé blastoidní buňky. Centrální zóna sekundárního folikulu se nazývá zárodečné nebo také germinální centrum (GC) a je obklopena zónou plášťovou („mantle“). Folikuly jsou tvořeny dominantně B-buňkami a GC jsou místem intenzivní humorální imunitní odpovědi. Germinální centra jsou tvořena dvěma populacemi buněk: velkými aktivovanými B-lymfocyty tzv. centroblasty (morfologicky nerozštěpené – „noncleaved“) a menšími centrocyty (rozštěpené – „cleaved“), které vznikají z centroblastů. GC taktéž obsahují Th2 –buňky (CD4+, CD45RO+, CD57+), které mají zásadní význam v T-B interakci. Velká část B-buněk, která není aktivována v rámci humorální odpovědi nebo se nepřemění v paměťové buňky, zaniká apoptózou. Plášťová (mantle) zóna je tvořena malými lymfocyty, které jsou velmi heterogenní po stránce fenotypu i funkce. Parakortex a difuzní zóna kortexu (mezi GC) jsou tvořeny T-lymfocyty a jsou místem celulární imunitní odpovědi (7).
Obr. 1. Mikroskopický snímek a struktura fyziologické uzliny (barvení hematoxylin-eosin; zvětšení 10x). 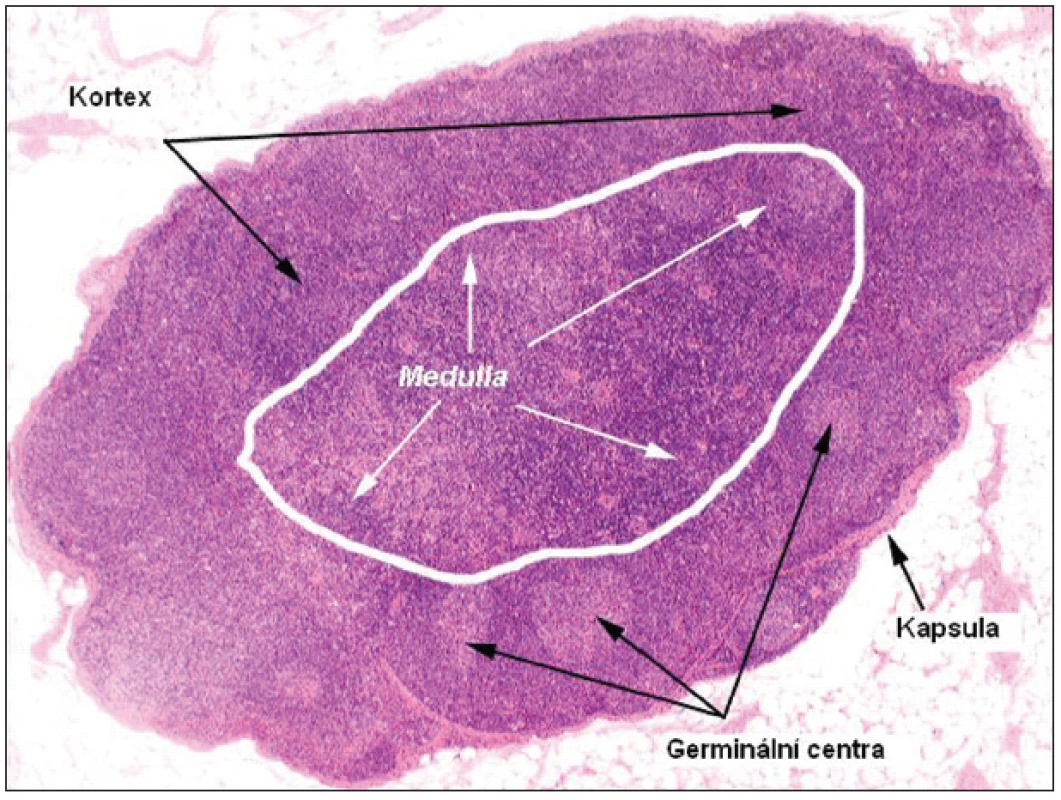
Funkce lymfocytů je závislá na interakci s dendritickými buňkami a makrofágy. Makrofágy jsou obvykle situovány na stěnách sinusů a fagocytují především okolní cizorodé antigeny, modifikují tak kontakt těchto antigenů s jinými elementy imunitního systému a prezentují antigeny fagocytovaného materiálu především T-lymfocytům. Dendritické buňky jsou tzv. profesionální antigen-prezentující buňky a v lymfatické tkáni se vyskytují minimálně ve dvou typech: folikulární dendritické buňky (FDC), které sídlí ve folikulech a interdigitující dendritické buňky lokalizované mimo folikuly (IDC). Každý typ dendritických buněk má odlišnou nejen morfologii, ale i původ a funkci. IDC pocházejí z různých částí těla, jsou především v parakortexu a uplatňují se v rámci T-buněčné odpovědi. FDC pocházejí pravděpodobně z retikulárních buněk uzliny a jsou nezbytné pro existenci a vývoj B-lymfocytů (7).
Morfologie uzliny u folikulárního lymfomu
Folikulární lymfom je definován jako neoplázie z B-buněk folikulárního respektive germinálního centra. Většina FL si obvykle zachovává folikulární charakter s folikuly rostoucími těsně vedle sebe a stírajícími původní strukturu uzliny (obr. 2). Neoplastické folikuly mají obvykle vymizelou plášťovou zónu a centroblasty jsou v různém poměru smíchány s centrocyty, takže folikuly postrádají polarizaci (rozlišitelné zóny centroblastů a centrocytů), která bývá velmi dobře vyjádřena u reaktivní lymfadenitidy (obr. 3). Poměr centrocytů k centroblastům a podíl folikulárního k difuznímu uspořádání určuje tzv. grading FL (grade 1, 2, 3A a 3B). Folikulární dendritické buňky bývají vidět uvnitř nádorových folikulů a jsou CD21+/CD23+. Kromě dendritických buněk jsou v různém počtu zastoupeny i další populace buněk normálně přítomných v germinálních centrech, jako jsou zejména T-lymfocyty (CD3+, CD4+, CD57+, PD1+, CXXCL13+). Proliferace znázorněná barvením Ki 67 bývá u gradu 1 a 2 nízká (obvykle pod 20 %) u gradu 3 vyšší (8).
Obr. 2. Obraz patologických folikulů folikulárního lymfomu (barvení hematoxylin-eosin; zvětšení 100x). 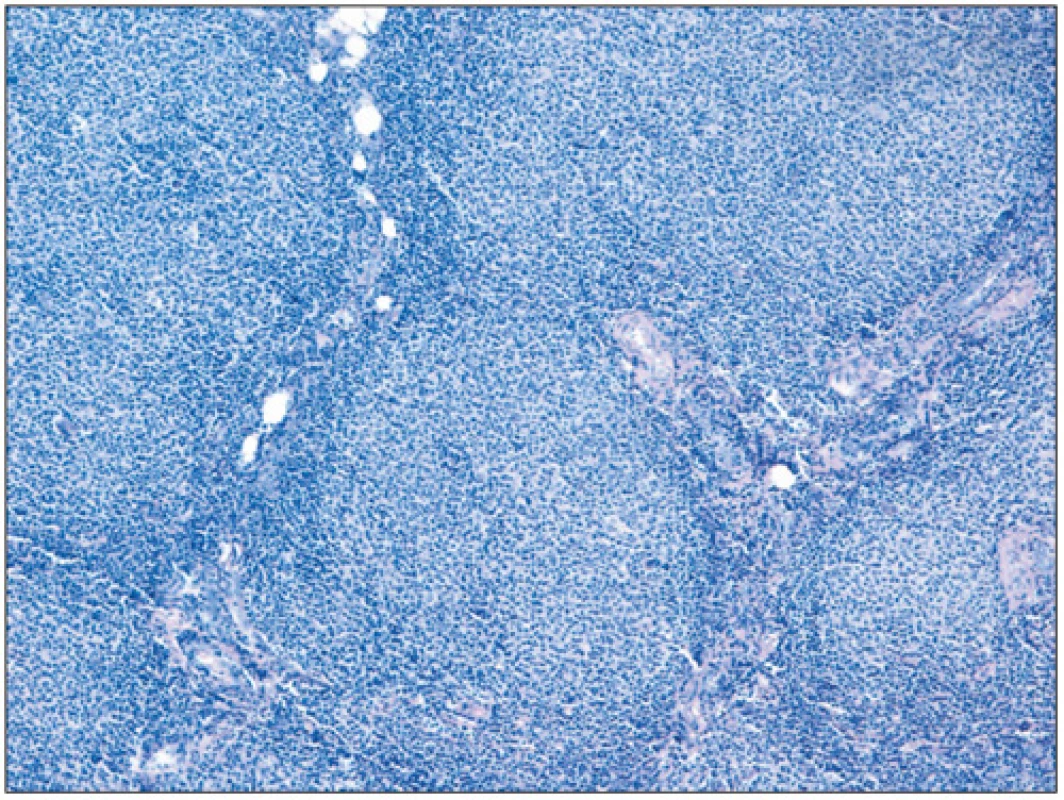
Obr. 3. Obraz reaktivní lymfadenitidy/hyperplázie s polarizací folikulů (barvení hematoxylin-eosin; zvětšení 100x). 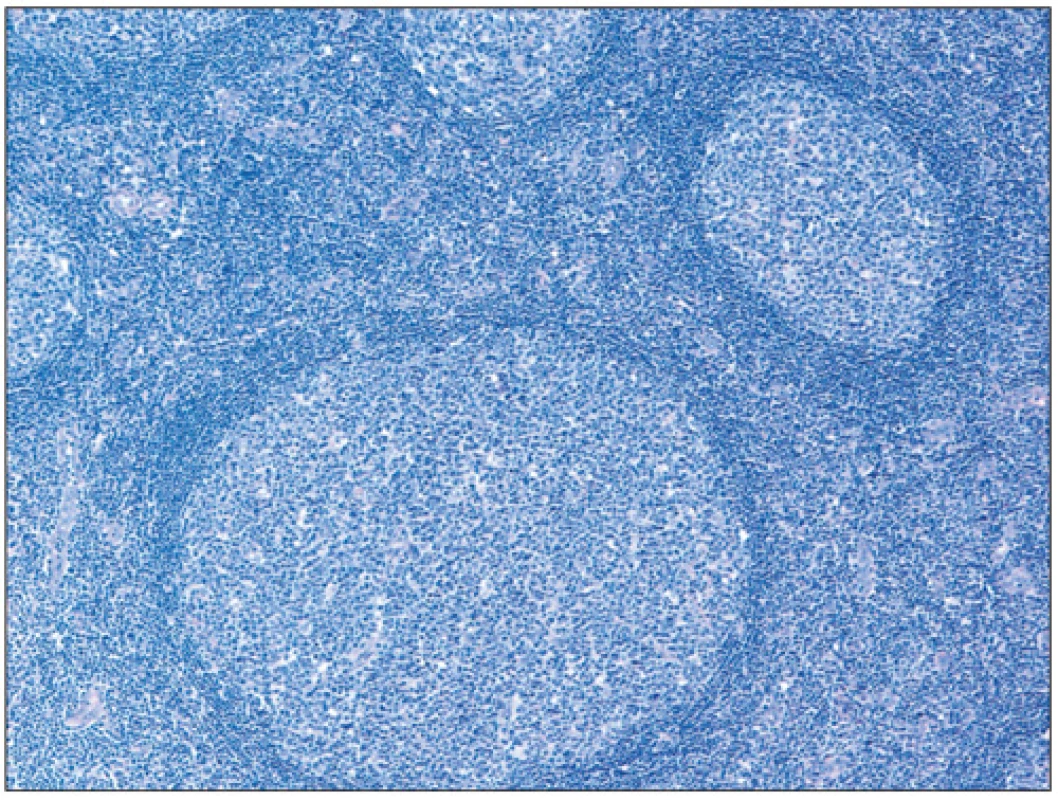
Buňka folikulárního lymfomu a t(14;18)
Folikulární lymfom si udržuje genovou expresi odpovídající B-buňce germinálního centra (6). Nádorové buňky jsou obvykle sIg pozitivní a exprimují antigeny typické pro B-lymfocyty (CD19, CD20, CD22, CD79a), markery germinálního centra Bcl-6, CD10, CD38 a kostimulační molekuly CD95 (FAS), CD86 a CD40 (8). Na rozdíl od normálních GC-buněk, většina folikulárních lymfomů exprimuje bcl-2 jako důsledek translokace t(14;18), která činí tyto buňky rezistentní vůči apoptóze. t(14;18) (q32;q21) je cytogenetickým znakem tradičně spojovaným s folikulárním lymfomem (9, 10, 11). Její výskyt u folikulárního lymfomu se pohybuje mezi 90–95 %, avšak její vztah k tomuto onemocnění není zcela objasněn. Tato translokace je totiž přítomná i u zdravých jedinců (12) a jiných lymfoproliferací (13, 14), sama o sobě navíc nedokáže způsobit vznik FL in vitro (15). K vlastní translokaci t(14;18) dochází v průběhu časné fáze vývoje B-lymfocytu v kostní dřeni a pravděpodobně mechanismem rezistence k apoptóze zvýhodňuje tak v přežívání naivní t(14;18)-pozitivní buňky. Z hlediska vývoje FL je klíčový pobyt t(14;18)-pozitivní buňky v germinálním centru, kde dochází ke vzniku sekundárních genetických změn (16). Kromě t(14;18) lze u folikulárního lymfomu detekovat řadu dalších alterací, jako jsou delece 1p, 6q, 10q a 17p, dále adice chromozomu 1, 6p, 7, 8, 12q, X a 18q (17). U 90 % FL lze zpravidla detekovat alespoň jednu další abnormalitu karyotypu s průměrem 6 chromozomálních alterací (18). Počet přídatných alterací karyotypu stoupá s histologickým gradem a transformací; komplexní karyotyp typicky koreluje s velmi špatnou prognózou (18, 19). Určitá podskupina FL gradu 3B nemá t(14;18) a zvýšenou expresi bcl-2 ale naopak přestavbu 3q27 se zvýšenou expresí bcl-6 (20). Jiná podskupina t(14;18) negativních FL s typicky difuzním růstem nese deleci 1p36 (21).
Je všeobecně akceptovaným faktem, že růst folikulárního lymfomu je u většiny pacientů dán primárně akumulací buněk v důsledku defektu apoptózy než proliferací. Na druhou stranu pokud jsou buňky FL izolovány a kultivovány in vitro, podléhají spontánní apoptóze během 24 hodin. Dlouhodobá kultivace buněk FL je však možná s populací dendritických buněk (22, 23). U FL jsou nádorové B-lymfocyty v těsné interakci s Th buňkami a folikulárními dendritickými buňkami (FDC), zdá se tedy, že buňky FL (podobně jako jejich fyziologické protějšky) vyžadují pro svůj život a růst zásadní podporu ostatních buněčných populací germinálního centra (24).
Metody detekce populací buněk nádorového mikroprostředí
Průtoková cytometrie
Fenotyp nádorových i nenádorových buněk uzliny lze dobře určit průtokovou cytometrií (flowcytometrií) s tříbarevnou fluorescencí. Pro vyšetření je nutné mít suspendovaný nativní vzorek uzliny (25). Výhodou je rychlé, přesné a automatizované hodnocení, nevýhodou je nemožnost lokalizovat populace jednotlivých buněk vzhledem k folikulům a také využít archivního materiálu v parafinu či zamražených vzorků.
TMA (tissue microarray)
V tomto případě jde o variantu klasického imunohistochemického barvení z parafínových bloků. Využívá se však pouze velmi malého válečku vyříznutého z původního bločku. Válečky z různých bločků (obvykle 1,5 mm v průměru) se skládají do nového „bločku“ (araye), z níž jsou nařezány jednotlivé řezy – jakési tkáňové „čipy“. Počet daných buněk se počítá manuálně nebo speciálním automatickým systémem. Výhodou metody je snadná dostupnost materiálu z parafínových bloků, kromě stanovení kvantity je i možná lokalizace buněčných populací (intrafolikulární vs. interfolikulární), nevýhodou je menší přesnost (26).
„Hráči“ nádorového mikroprostředí folikulárního lymfomu a duální charakter folikulární lymfomu
Výsledné klinické chování FL lze chápat jako účinek vzájemného působení genomových a imunologických faktorů. Je jasné, že primárním faktorem vzniku FL je existence nádorového klonu buněk s primární alterací typu t(14;18) umožňující delší přežití a jistou nezávislost na apoptotických případně antiproliferačních signálech. Zda získání sekundárních genetických alterací ovlivňuje také chování a strukturu mikroprostředí, nebo jistý typ mikroprostředí ovlivňuje od počátku vlastnosti nádorových buněk, není dosud zcela jasné.
Buňky, které budí velký zájem mezi kliniky i výzkumníky, jsou folikulární dendritické buňky (FDC), cytotoxické lymfocyty (CD8+), T-regulační lymfocyty (FOXP3), T-helpery (CD4+) a s lymfomem asociované makrofágy (LAM).
Folikulární dendritické buňky (FDC)
FDC jsou nefagocytující buňky, které jsou schopny vázat delší čas antigeny ve formě imunitních komplexů a rozhodují o dalším osudů centrocytů v závislosti na jejich afinitě k danému antigenu. FDC jsou CD21+CD23+ +CD35+CD40+ buňky, které tvoří zhruba 1 % všech buněk GC. Zajišťují především antiapoptotické a růstové signály pro proliferaci centroblastů v místech tmavé zóny GC, kde je fyziologicky nedostatek antigenem aktivovaných T-buněk. FDC komunikují s lymfocyty pomocí adhezivních molekul (ICAM-1 = intercellular adhesion molecule-1, VCAM-1 = vascular cell adhesion molecule-1), které zvyšují intercelulární kontakt, a tím usnadňují antiapoptotické funkce jiných molekul. Další skupinou látek produkovaných FDC jsou molekuly s přímým anti-apoptotickým (BAFF/BLys) a přímým proliferačním efektem (8D6, IL-15 a IL-6) (22, 27). Zdá se, že uvedené vztahy platí jak pro fyziologické B-lymfocyty, tak i pro buňky folikulárního lymfomu (22). FDC naopak pro svoji normální existenci a funkci nutně potřebují signály od ostatních buněk zejména od B-lymfocytů germinálního centra. Tato vzájemná závislost má velmi zásadní implikace v klinické praxi, poněvadž destrukce B-buněk například rituximabem, může způsobit poruchu vývoje a fungování dendritických buněk, jak bylo pozorováno u autoimunitních chorob (28, 29).
Na význam FDC upozornila analýza genové exprese, přičemž zvýšená exprese genů dendritických buněk zde byla sdružena se zkráceným přežitím (6). Ve studii imunofenotypu mikroprostředí FL (n = 66) byla absence FDC nebo výrazně porušená síť dendritických buněk naopak asociována s časnou transformací a horší prognózou (30). Ovšem v jiné studii pacientů s nodálními FL (n=158) léčenými různými typy léčby (včetně vysokodávkované) nebyl význam FDC pozorován (31). V zajímavé analýze vycházející z randomizovaného srovnání režimů CVP (cyklofosfamid, vinkristin, prednison) a fludarabinu u 61 pacientů s FL byl pozorován odlišný prognostický význam FDC v závislosti na typu podané léčby. Sporadický výskyt FDC s lepší odpovědí po fludarabinu vs CVP, naopak dobře vyvinutá síť FDC byla asociována s lepší odpovědí po CVP (32).
T - buňky
T-lymfocyty představují velmi heterogenní skupinu imunitních elementů zahrnující jak regulační, tak i efektorové buňky. Dle analýzy genové exprese byla v rámci „Immune response 1“ s dobrou prognózou zvýšená exprese genů typických pro T-buňky (CD7, CD8, CD3D...), avšak imunofenotypizací nebyla prokázána korelace mezi celkovým počtem T-buněk (CD3+) a prognózou pacientů s FL, což znamená, že za rozdílnou prognózu jsou zodpovědné spíše speciální podskupiny T-buněk (6).
Th-lymfocyty (CD4+)
In vivo představují zejména T-helpery (CD4+) hlavní zdroj CD40L pro vazbu na receptor CD40 B-lymfocytů. Tato ligace je jedním ze silných stimulátorů proliferace a přežití B-buněk. Th-buňky a CD40L chrání před apoptózou jak normální B-lymfocyty tak buňky FL. V souladu s in vitro důkazy o důležité roli CD40L+ nenádorových buněk, je v infiltrovaných uzlinách FL zřejmá hojnost polyklonálních T-buněk, zejména Th lymfocytů (24). Proliferace maligních buněk je stimulovaná IL-4 a jinými cytokiny uvolňovanými taktéž z buněk T-původu (33).
Analýza mikroprostředí FL (n = 59; sledování 6–30 let) využívající tissue microarray (TMA) ukázala, že déle žijící pacienti měli vyšší zastoupení CD4+buněk zejména v perifolikulární lokalizaci (34). Obdobné závěry imunohistochemického hodnocení u FL publikoval i Alvaro a kol. (n=211; medián sledování 6 let) (35). Také v práci kombinující analýzu genové exprese a imunohistochemii byl prokázán vztah mezi počtem infiltrujících CD4+ buněk zejména v interfolikulárním prostoru a aktivovaného stavu T-buněk (CD69+) k transformaci FL na souboru 66 pacientů (30). V jiné studii 61 pacientů s pokročilým FL byla rovněž pozorována dobrá korelace počtu CD4+buněk a příznivé prognózy, která navíc nezávisela na typu podané léčby (CVP vs fludarabin) (32). Na druhou stranu jsou práce, které žádnou korelaci mezi počty CD4+ buněk a přežitím pacientů s FL nenalezly (36, 37, 38).
T-regulační lymfocyty (Treg); FOXP3+
T-regulační lymfocyty (Treg) s imunofenotypem CD4+CD25+ hrají zásadní roli v navození imunotolerance zejména supresí T-efektorových buněk jak na úrovni jejich proliferace, tak i produkce cytokinů. Relativně specifický znak Treg buněk je transkripční faktor FOXP3 (Forkhead Box Protein P3) (39). Masivní přítomnost Treg (FOXP3+) buněk u solidních nádorů, např. u ovariálního karcinomu, je spojená se špatnou prognózou (40). Narozdíl od solidních nádorů se u FL jeví prognostický význam FOXP3 buněk zcela opačný. Předpokládá se, že možný mechanismus působení Treg buněk spočívá v supresi protektivních CD4+lymfocytů (T-helperů) generujících antiapoptotické a proliferační molekuly.
Většina studií u pacientů s folikulárním lymfomem dokládá pozitivní korelaci vysokého počtu FOXP3 buněk ve tkáni infiltrované uzliny s dobrou prognózou (32, 34, 36, 41). Carreras a kol. prokázali, že absolutní počet FOXP3 buněk stanovený imunohistochemicky (n = 97; medián sledován 5,6 roku) pozitivně koreluje s přežitím a dobrou prognózou FL a naopak nízké počty Treg buněk (< 5 %) jsou asociovány s refrakterní chorobou, přičemž výsledky byly nezávislé na FLIPI. Významná byla zejména intrafolikulární infiltrace FOXP3+ buňkami (36). Jiná práce hodnotila řadu buněčných elementů (CD4+, CD7+, CD8+, CD25+, CD68+ a FOXP3+) metodou tissue microarray (n = 59). Vyšší počet CD4+ a FOXP3+ buněk v perifolikulární lokalizaci byl i zde prediktorem delšího celkového přežití (34). Další velká studie (n = 86; medián sledování 7 let) srovnávající absolutní počty FOXP3+ buněk u různých lymfoproliferací prokázala pozitivní korelaci vysokého počtu FOXP3+ buněk u FL s delší dobou do progrese a přežitím vázaným na nemoc (disease-specific survival). V této studii byl podobný efekt FOXP3+ buněk také pozorován u difuzního velkobuněčného lymfomu (GC-typ) a klasického Hodgkinova lymfomu (41). Obdobný prognostický význam FOXP3+ bez ohledu na podaný typ léčby (fludarabin vs CVP) byl u FL potvrzen i další studií (32). Naproti tomu jiné studie prognostický význam FOXP3 neprokázaly (30, 35) nebo prokázaly význam opačný – intrafolikulární infiltráty FOXP3+ buněk asociované s krátkým přežitím (38, 42).
CD8+ buňky
Efektorové nebo také cytotoxické lymfocyty jsou CD8+ a podléhají regulačnímu vlivu jiných buněk. Zdá se, že lze odlišit alespoň dva funkční typy cytotoxických T-lymfocytů: Tc1, které produkují vysoké množství IFNγ a Tc2, které produkují interleukin-4, interleukin-5, interleukin-10 a malé množství IFNγ (43). Tyto podtypy mohou mít v důsledku různých povrchových receptorů a produkovaných cytokinů i různou schopnost pronikat do nádorové tkáně a také různou efektorovou funkci. Určitá podskupina CD8+ lymfocytů může mít i regulační funkce (tzv. CD8+ FOXP3+ buňky) (44).
Ze studie 139 pacientů s FL vyplývá, že vyšší zastoupení CD8+ buněk v bioptických vzorcích (měřeno průtokovou cytometrií) koreluje pozitivně s celkovým přežitím a dobou do progrese. Počet CD8+ nebyl jakkoli závislý na jiných populacích buněk ani na FLIPI. Imunohistochemicky byly CD8+ buňky uloženy uvnitř i vně nádorových folikulů, nejčastěji perifolikulárně (45). Shodné výsledky byly pozorovány i v jiné imunohistochemické analýze FL (n = 211; medián sledování 6 let) (35). Denzní infiltráty zejména v interfolikulární lokalizaci byly rovněž sdruženy s dobrou prognózou v práci analyzující 61 pacientů s FL léčených randomizovaně fludarabinem nebo režimem CVP (32). Naopak v jiné studii nebyl význam CD8+ buněk vůbec prokázán (30).
Makrofágy asociované s lymfomem (LAMs)
Makrofágy se v lidském organismu účastní mnoha různých procesů. V závislosti na prostředí rozeznáváme klasické „zánětlivé“ makrofágy M1, které jsou indukovány IL-12 a TNF-α, a „alternativní“ makrofágy M2, které se účastní tvorby a remodelace tkání a jsou stimulovány IL-4, IL-13 a IL-10. Makrofágy M2 fenotypu hrají pravděpodobně význam u FL (46, 47) a představují takzvané s tumorem/lymfomem-asociované makrofágy (TAM/LAM = tumor/lymphoma associated macrophages). TAM/LAM jsou v jistém smyslu přeprogramovány a indukují supresi v hostitelské imunitní odpovědi uvolněním cytokinů, prostanoidů a dalších mediátorů in situ. Makrofágy také poskytují maligním B-buňkám signály potřebné k jejich růstu a přežití, produkují angiogenní působky, ovlivňují funkci dendritických a Treg buněk (47).
Přítomnost CD68+ makrofágů je dle velké většiny studií sdružena s horší prognózou a kratším přežitím u pacientů s FL (37, 42, 46, 48). 211 pacientů léčených různými typy léčby bylo hodnoceno z hlediska přítomnosti CD68+ buněk a exprese STAT-1 (signal transducer and activator of transcription-1; mediátor interferonem mediované signální dráhy). Zvýšená přítomnost obou uvedených parametrů byla asociována s horší prognózou (medián sledování 6 let) a sice nezávisle na FLIPI (46). Obdobné výsledky publikovali i další autoři (38, 42). Prognostický účinek CD68+ buněk může být, zdá se, anulován léčbou obsahující rituximab (42, 48, 49). Ve studii 96 pacientů s FL léčených R-CHOP (rituximab, cyklofosfamid, vinkristin, adriamycin, prednizon) byl dokonce pozorován pozitivní prognostický efekt zvýšeného počtu CD68+buněk (49). Dle randomizované studie 61 pacientů s FL léčených fludarabinem nebo CVP se jeví, že také různé typy chemoterapie ovlivňují prognostický význam LAM (32). Existují však také práce, které význam CD68+ buněk jako prognostického faktoru u FL nepodporují (30, 34).
Další buňky s potenciálním prognostickým významem
Ojediněle jsou publikované práce zaměřené na význam jiných buněk, jako jsou například T-lymfocyty nesoucí molekulu PD-1 (programmed cell death 1). PD-1 je důležitá v regulaci buněk germinálních center, ale její význam v nádorové imunitě není přesně znám. Svým inhibičním účinkem oslabují T-buněčnou odpověď, a tím mohou umožnit nádorovou expanzi, jde vlastně o jistou alternativu FOXP3+. Infiltrace PD-1 pozitivních buněk (CD3+CD4+CD25-) korelovala pozitivně s dobrou prognózou a negativně s transformací FL (50). Infiltráty mastocyty – s tumorem asociovanými mastocyty (MCs) – byly ve studii 98 pacientů léčených R-CHOP sdruženy s horší prognózou a byly schopny eliminovat pozitivní efekt makrofágů po imunochemoterapii (51). Také infiltráty NK buňkami (CD57+) byly sdruženy s horší prognózou (35).
Vliv různých léčebných modalit na komponenty mikroprostředí u folikulárního lymfomu
Výsledky studií zkoumajících význam mikroprostředí lze jen velmi obtížně shrnout a snadno interpretovat, neboť jsou značně nejednotné (tab. 1). Heterogenita výsledků je zčásti dána různou koncepcí a metodikou, ale z několika studií vyplývá, že zejména typ léčebného režimu může zásadně modifikovat prognostický význam komponent mikroprostředí (42, 51). Z tohoto pohledu je pozoruhodná práce, která navázala na randomizovanou studii zkoumající účinnost fludarabinu vs režim CVP (cyklofosfamid, vinkristin a prednizon) probíhající v 90. letech minulého století (32). V rámci této studie bylo vybráno 61 pacientů s dostupnou biopsií pro imunohistochemickou analýzu metodou tissue microarray (31 léčených fludarabinem a 30 léčených CVP). Exprese CD69 na nádorových buňkách (marker aktivace lymfocytů) byla identifikována jako negativní a intrafolikulární FOXP3+ infiltráty jako příznivý prognostický faktor bez ohledu na typ podané léčby. Zatímco denzní infiltráty FOXP3+buněk a interfolikulární infiltráty CD68+buněk stejně jako kompletní síť dendritických buněk byly sdruženy s lepší prognózou v rameni CVP ale současně s horší prognózou v rameni s fludarabinem (32). Na základě těchto rozdílných výsledků a se znalostí mechanismu účinků fludarabinu lze vyslovit hypotézu, že CVP působí přímo na nádorové buňky, zatímco fludarabin je lymfocytotoxický nejen pro buňky FL, ale ovlivňuje výrazně také mikroprostředí – zejména T-buňky. Tuto studii a její výsledky lze současně považovat za určitý modelový příklad. Z výsledků dalších studií vyplývá, že i další léčebné modality mají pravděpodobně různý vliv na mikroprostředí FL. Rituximab svým působením na B-lymfocyty nepřímo ovlivňuje dendritické buňky a „vakcinačním efektem“ zase vede ke stimulaci T-lymfocytů (28, 29, 52). Vliv na mikroprostředí u FL byl rovněž popsán po nízkých dávkách radioterapie (2 x 2Gy) a týkal se hlavně makrofágů a cytotoxických T-lymfocytů (53). Možnosti působení různých léčebných modalit včetně chemoterapie typu CHOP/CVP, fludarabinu, radioterapie (2 x 2Gy) a rituximabu si můžeme představit na zjednodušeném schématu 1.
Tab. 1. Přehled studií zkoumajících význam nádorového mikroprostředí folikulárního lymfomu. 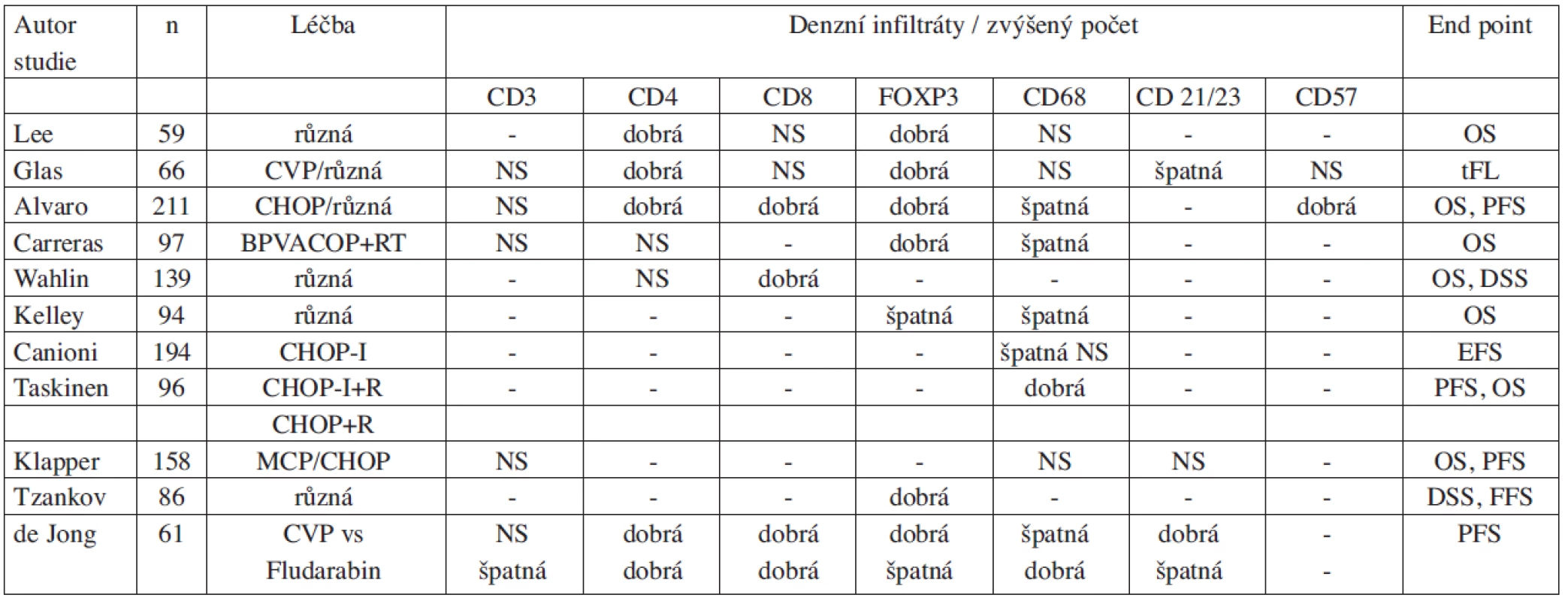
Legenda: Ve snaze zajistit maximální přehlednost není vyznačeno rozlišení mezi intrafolikulárními a interfolikulárními infiltráty. CVP – cyklofosfamid, vinkristin, prednizon; CHOP – cyklofosfamid, adriamycin, vinkristin, prednizon; BPVACOP+RT – bleomycin, cisplatina, etopozid, doxorubicin, vinkristin, prednizon, radioterapie; CHOP-I – cyklofosfamid, adriamycin, vinkristin, prednizon, interferon alfa; MCP – mitoxantron, chlorambucil, prednizon; R – rituximab; NS – nesignifikantní; OS – overal survival (celkové přežití); tFL – transformace folikulárního lymfomu; PFS – progression free survival (doba do progrese); DSS – disease specific survival (přežití vázané na nemoc); EFS – event free survival (doba do události); FFS – failure free survival (přežití do selhání léčby) Schéma 1. A-D. Model Interakce B-buněk FL s mikroprostředím a vliv různých typů léčby. Červenými čarami je vyjádřeno působení dané modality na jednotlivé komponenty nádoru. A. režim CVP (cyklofosfamid, vinkristin, prednizon); B. Fludarabin; C. Rituximab; D. Radioterapie (2x2Gy) 
Závěr
Na folikulární lymfom lze na základě výše uvedených výsledků nahlížet jako na funkční interakci nádorového klonu buněk s primární chromozomální odchylkou t(14;18) (eventuálně jinou adekvátní) a okolním imunitním systémem. Tuto skutečnost podporuje řada klinických pozorování a také analýzy nádorového mikroprostředí uzliny folikulárního lymfomu. Pozoruhodné je zjištění, že různé léčebné modality mohou působit odlišně na komponenty nádorového prostředí a tím patrně i modifikovat výslednou prognózu u konkrétního nemocného. Dosavadní výsledky vyvolávají celou řadu otázek týkajících se jednak dalších možných elementů mikroprostředí, podtypů již definovaných populací buněk a také dalšího výzkumu účinku jednotlivých léčebných modalit na nádorové mikroprostředí.
Doručeno do redakce: 8. 2. 2010
Přijato po recenzi: 29. 3. 2010
MUDr. Andrea Janíková, Ph.D.
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: ajanikova@fnbrno.cz
Zdroje
1. Gattiker HH, Wiltshaw E, Galton DA. Spontaneous regression in non-Hodgkin’s lymphoma. Cancer 1980; 45 : 2627-32.
2. Tan D, Horning SJ. Hematol Oncol Clin North Am 2008; 22 : 863-82.
3. Montoto S, Davies AJ, Matthews J, et al. Risk and clinical implications of transformation of follicular lymphoma to diffuse large B-cell lymphoma. J Clin Oncol 2007; 25 : 2426-33.
4. Mandingers CM, Verdonck LF, Meijerink JP, et al. Graft-versus-lymphoma effect of donor lymphocyte infusion in indolent lymphomas relapsed after allogeneic stem cell transplantation. Bone Marrow Transplant 2003; 32 : 1159-63.
5. Janikova A, Mayer J, Kren L, et al. The persistence of t(14;18)-bearing cells in lymph nodes of patients with follicular lymphoma in complete remission: the evidence for ‚a lymphoma stem cell‘. Leuk Lymphoma 2009; 50 : 1102-9.
6. Dave SS, Wright G, Tan B, et al. Prediction of survival in follicular lymphoma based on molecular features of tumor-infiltrating immune cells. N Engl J Med 2004; 351 : 2159-69.
7. Paraskevas F. Lymphocytes and lymphatic organs. In: Wintrobeęs Clinical Hematology – 12th ed./ Greer JP eds., Lippincott Williams and Wilkins, Philadelphia 2009.
8. Swerdlow SH, Campo E, Hartus NL, et al. Follicular lymphoma. In: WHO classification of tumours of haematopoietic and lymphoid tissues. International Agency for Research on Cancer: Lyon, 2008.
9. Bakhshi A, Wright JJ, Graninger W, et al. Mechanism of the t(14;18) chromosomal translocation: structural analysis of both derivative 14 and 18 reciprocal partners. Proc Natl Acad Sci USA 1987; 84 : 2396-400.
10. Cleary ML, Sklar J. Nucleoside sequence of a t(14;18) chromosomal breakpoint in follicular lymphoma and demonstration of breakpoint-cluster region near a transcriptionally active locus on chromosome 18. Proc Natl Acad Sci USA 1985; 82 : 7439-43.
11. Tsujimoto Y, Croce CM. Analysis of the structure, transcripts, and protein products of bcl-2, the gene involved in human follicular lymphoma. Proc Natl Acad Sci USA 1986; 83 : 5214-18.
12. Limpens J, Stad R, Vos C, et al. Lymphoma-associated translocation t(14;18) in blood B-cells of normal individuals. Blood 1995; 85 : 2528-36.
13. Meijerink JPP. t(14;18), a journey to eternity. Leukemia 1998; 11 : 2175-87.
14. Papajík T, Jedličková K, Kriegová E, et al. Polymerase chain reaction detection of cells carrying t(14;18) in bone marrow of patients with follicular and diffuse large B-cell lymphoma: the importance of analysis at diagnosis and significance of long term follow-up. Neoplasma 2001; 6 : 501-5.
15. McDonnell TJ, Deane N, Platt FM, et al. Bcl-2-immunoglobulin transgenic mice demonstrate extended B cell survival and follicular lymphoproliferation. Cell 1989; 57 : 79-88.
16. Roulland S, Navarro JM, Grenot P, et al. Follicular lymphoma-like B cells in healthy individuals: a novel intermediate step in early lymphomagenesis. J Exp Med 2006; 203 : 2425-31.
17. Martinez-Climent JA, Alizadeh AA, Segraves R, et al. Transformation of follicular lymphoma to diffuse large cell lymphoma is associated with a heterogeneous set of DNA copy number and gene expression alterations. Blood 2003; 101 : 3109-17.
18. Horsman DE, Connors JM, Pantzar T, et al. Analysis of secondary chromosomal alterations in 165 cases of follicular lymphoma with t(14;18). Gen Chrom Cancer 2001; 30 : 375-82.
19. Yunis JJ, Frizzera G, Oken MM, et al. Multiple recurrent genomic defects in follicular lymphoma: a possible model for cancer. N Engl J Med 1987; 316 : 79-84.
20. Jardin F, Gaulard P, Buchonnet G, et al. Follicular lymphoma without t(14;18) and with bcl-6 rearrangement: a lymphoma subtype with distinct pathological, molecular and clinical characteristics. Leukemia 2002; 16 : 2309-17.
21. Katzenberger T, Kalla J, Leich E, et al. A distinctive subtype of t(14;18)-negative nodal follicular lymphoma non-Hodgkin lymphoma characterized by a predominantly diffuse growth pattern and deletions in the chromosomal region 1p36. Blood 2009; 113 : 1053-61.
22. Goval JJ, Thielen C, Bourguignon C, et al. The prevention of spontaneous apoptosis of follicular lymphoma B cells by a follicular dendritic cell line: involvement of caspase-3, caspase-8 and c-FLIP. Haematologica 2008; 93 : 1169-77.
23. Kagami Y, Jung J, Choi YS, et al. Establishment of a follicular lymphoma cell line (FLK-1) dependent on follicular dendritic cell-like cell line HK. Leukemia 2001; 15 : 148-56.
24. Carbone A, Gloghini A, Gruss HJ, et al. CD40 ligand is constitutively expressed in a subset of T cell lymphomas and on the microenvironmental reactive T cells of follicular lymphomas and Hodgkinęs disease. Am J Pathol 1995; 147 : 912-22.
25. Ray S, Craig FE, Swerdlow SH. Abnormal patterns of antigenic expression in follicular lymphoma: a flow cytometric study. Am J Clin Pathol 2005; 124 : 576-83.
26. Hedvat CV, Hegde A, Chaganti RSK, et al. Application of tissue microarray technology to the study of Non-Hodgkinęs and Hodgkinęs lymphoma. Hum Pathol 2002; 33 : 968-74.
27. Park CS, Choi YS. How do follicular dendritic cells interact intimately with B cells in the germinal centre? Immunology 2005; 114 : 2-10.
28. Edwards JC, Szcepanski L, Szechinski J, et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med 2004; 350 : 2572-81.
29. Shaw T, Juan J, Totoritis MC. B cell therapy for rheumatoid arthritis: the rituximab (anti-CD20) experience. Ann Rheum Dis 2003; 62(Suppl 2): 55-9.
30. Glas AM, Knoops L, Delahaye L, et al. Gene-expression and Immunohistochemical Study of specific T-cell subsets and accessory cell types in the transformation and prognosis of follicular lymphoma. J Clin Oncol 2007; 25 : 390-8.
31. Klapper W, Hoster E, Rölver L, et al. Tumor sclerosis but not cell proliferation or malignancy grade is a prognostic marker in advanced-stage follicular lymphoma: the German Low Grade Lymphoma Study Group. J Clin Oncol 2007; 25 : 3330-6.
32. De Jong D, Koster A, Hagenbeek A, et al. Impact of the tumor microenvironment on prognosis in follicular lymphoma is dependent on specific treatment protocols. Haematologica 2009; 94 : 70-7.
33. Schmitter D, Koss M, Niederer E, et al. T-cell derived cytokines co-stimulate proliferation of CD40-activated germinal centre as well as follicular lymphoma cells. Hematol Oncol 1997; 15 : 197-207.
34. Lee AM, Clear AJ, Calaminici M, et al. Number of CD4+ cells and location of Fork head Box Protein P3-positive cells in diagnostic follicular lymphoma tissue microarrays correlates with outcome. J Clin Oncol 2006; 24 : 5052-9.
35. Alvaro T, Lejeune M, Salvado MT, et al. Immunohistochemical patterns of reactive microenvironment are associated with clinicobiologic behavior in follicular lymphoma patients. J Clin Oncol 2006; 24 : 5350-7.
36. Carreras J, Lopez-Guillermo A, Fox BC, et al. High numbers of tumor-infiltrating FOXP3-positive regulatory T cells are associated with improved overall survival in follicular lymphoma. Blood 2006; 108 : 2957-64.
37. Farinha P, Masoudi H, Skinnider BF, et al. Analysis of multiple biomarkers shows that lymphoma-associated macrophage (LAM) content is an independent predictor of survival in follicular lymphoma (FL). Blood 2005; 106 : 2169-74.
38. Lee AM, Clear AJ, Morris KJ, et al. The impact of tumor microenvironment in diagnostic follicular lymphoma samples using tissue microarrays. Ann Oncol 2008; 19 (Suppl 4): 126 (abstr No 131).
39. Roncador G, Brown PJ, Maestre L, et al. Analysis of FOXP3 protein expression in human CD4_CD25_regulatory T cells at the single-cell level. Eur J Immunol 2005; 35 : 1681-91.
40. Curiel TJ, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med 2004; 10 : 942-9.
41. Tzankov A, Meier C, Hirschmann P, et al. Correlation of high numbers of intratumoral FOXP3+ regulatory T cells with improved survival in germinal center-like diffuse large B-cell lymphoma, follicular lymphoma and classical Hodgkinęs lymphoma. Haematologica 2008; 93 : 193-200.
42. Kelley T, Beck R, Absi A, et al. Biologic predictors in follicular lymphoma: importance of markers of immune response. Leuk Lymphoma 2007; 48 : 2403-11.
43. Delfs MW, Furukawa Y, Mitchel RN, et al. CD8+ T cell subsets TC1 and TC2 cause different histopathologic forms of murine cardiac allograft rejection. Transplantation 2001; 71 : 606-10.
44. Zou W. Regulatory T cells, tumor immunity and immunotherapy. Nat Rev Immunol 2006; 6 : 295-307.
45. Wahlin BE, Sander B, Christensson B, et al. CD8+ T-cell content in diagnostic lymph nodes measured by flow cytometry is a predictor of survival in follicular lymphoma. Clin Cancer Res 2007; 13 : 388-97.
46. Alvaro T, Lejeune M, Camacho FI, et al. The presence of STAT1-positive tumor-associated macrophages and their relation to outcome in patients with follicular lymphoma. Haematologica 2006; 91 : 1605-12.
47. Mantovani A, Sozzani S, Locati M, Allavena P, Sica A. Macrophage polarization: tumor-associated macrophages as a paradigm for polarized M2 mononuclear phagocytes. Trends Immunol 2002; 23 : 549-55.
48. Canioni D, Salles G, Mounier N, et al. High numbers of tumor-associated macrophages have an adverse prognostic value that can be circumvented by rituximab in patients with follicular lymphoma enrolled onto the GELA-GOELAMS FL-2000 trial. J Clin Oncol 2008; 26 : 440-6.
49. Taskinen M, Karjalainen-Lindsberg Ml, Nyman H, et al. A high tumor-associated macrophage content predicts favorable outcome in follicular lymphoma patients treated with rituximab and cyclophosphamide-doxorubicin-vincristin-prednisone. Clin Cancer Res 2007; 13 : 5784-9.
50. Carreras J, Guillermo AL, Roncador G, et al. High numbers of tumor-infiltrating programmed cell death 1-positive regulatory lymphocytes are associated with improved overall survival in follicular lymphoma. J Clin Oncol 2009; 27 : 1470-6.
51. Taskinen M, Karjalainen-Lindsberg ML, Leppä S. Prognostic influence of tumor-infiltrating mast cells in patients with follicular lymphoma treated with rituximab and CHOP. Blood 2008; 111 : 4664-7.
52. Hilchey SP, Hyrien O, Mosmann TR, et al. Rituximab immunotherapy results in the induction of a lymphoma idiotype-specific T-cell response in patients with follicular lymphoma: support for a „vaccinal effect“ of rituximab. Blood 2009; 113 : 3809-12.
53. Knoops L, Haas R, de Kemp S, et al. In vivo p53 response and immune reaction underlie highly effective low-dose radiotherapy in follicular lymphoma.Blood 2007; 110 : 1116-22.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Výběr z tisku
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2010 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Globální hodnocení funkce hemostázy – část II. Vlastní zkušenosti s použitím trombin generačního testu u pacientů s trombofilií
- Přínos režimu CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Odlišné hladiny asparagin syntetázy nejsou zodpovědné za rozdílnou senzitivitu leukemických blastů k L-Asparagináze
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Folikulární lymfom a význam nádorového mikroprostředí
- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
- XXIV. Olomoucké hematologické dny s mezinárodní účastí
- Výběr z tisku a zprávy o knihách
- Autotransfuze v České republice v roce 2009
- Produkce transfuzní služby ČR za rok 2009
- Informace o volbách do výboru České hematologické společnosti, revizní komise, výboru zdravotních laborantů a výboru sester.
- Komentář k článku: Novinky v klasifikaci MDS a stanovení prognózy dle WPSS Žídková M., Voglová J., Bělohlávková P., Vrbacký F. Transfuze a Hematologie dnes 2010, 16: 42-46
- Odpověď na komentář Doc. Neuwirtové
- Výběr z tisku
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Folikulární lymfom a význam nádorového mikroprostředí
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




