-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
Idiopathic thrombocytopenic purpura – pathogenesis, modern therapy, and an analysis of its prevalence, diagnostics and therapy in the South Moravian Region
Idiopathic thrombocytopenic purpura (ITP) is ranged among autoimmune diseases. ITP is defined by isolated thrombocytopenia. ITP is usually diagnosed per exclusionem. Pathogenesis of ITP is complex and implicates interaction of T and B lymphocytes, antigen presenting cells and organs of the monocyto-macrophage system. In the pathogenesis of ITP, affliction of megakaryocytes is invoked as well. Therapy of ITP is recommended when the platelet count drops to 20–30 x 109/l and should be individualized according to the risk profile of the patient. As the first-line treatment corticoids, immunoglobulins (IVIG) and anti-D immunoglobulin are used. The second-line treatment is splenectomy and rituximab. The third-line treatment is immunosuppressive and immunomodulant therapy. Therapy using thrombopoetin agonists represents promise for patients with chronic refractory form of ITP. In the article we also discuss diagnostic and therapeutic preferences of hematologists in different work sites in the South Moravian Region. According to our analysis the incidence of ITP is 6 cases of 100 000 inhabitants, and its prevalence is 50.3 cases of 100 000 inhabitants.
Key words:
ITP, pathogenesis, megakaryocytes, thrombopoietin, thrombopoietin agonists
Autoři: L. Červinek; M. Doubek; J. Mayer
Působiště autorů: – pro život (CELL , The CzEch Leukemia Study Group – for Life) ; Interní hematoonkologická klinika LF MU a FN Brno, kooperující pracoviště České leukemické skupiny
Vyšlo v časopise: Transfuze Hematol. dnes,15, 2009, No. 1, p. 23-30.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Idiopatickou trombocytopenickou purpuru (ITP) řadíme mezi autoimunitní onemocnění. ITP je definována izolovanou trombocytopenií. Diagnóza ITP bývá stanovena per exclusionem. Patogeneze vzniku ITP je komplexní a zahrnuje interakci T a B lymfocytů, antigen prezentujících buněk a orgánů monocyto-makrofágového systému. V patofyziologii ITP se uplatňuje i postižení megakaryocytů. Léčba ITP je doporučována při trombocytopenii pod 20-30 x 109/l a měla by být individualizována podle rizikového profilu pacienta. První linii léčby představují kortikoidy, imunoglobuliny (IVIG) a anti-D imunoglobulin. Druhou linii léčby představuje splenektomie a rituximab. Třetí linií je imunosupresivní a imunomodulační terapie. Terapie trombopoetinovými agonisty představuje příslib pro pacienty s chronickou refrakterní formou ITP. V článku diskutujeme i diagnostické a terapeutické preference hematologů v regionu Jihomoravského kraje. Podle naší analýzy je incidence ITP 6 případů na 100 000 obyvatel nad 18 let a prevalence 50,3 případů na 100 000 obyvatel.
Klíčová slova:
ITP, patogeneze, megakaryocyty, trombopoetin, trombopoetinoví agonistéÚvod
Idiopatickou trombocytopenickou purpuru (ITP) řadíme mezi autoimunitní onemocnění.
Choroba je definována snížením počtu krevních destiček, které je způsobeno jejich destrukcí v orgánech monocyto-makrofágového systému, nejvíce ve slezině. Dalším patogenetickým mechanismem, který se u ITP uplatňuje, je postižení megakaryocytů (1).
Incidence ITP
Roční incidence ITP dospělých je přibližně 5,8–6,6 případů na 100 000 osob (2), incidence u dětí je 4–5 případů na 100 000 osob (3, 4). Onemocnění je častější u žen než mužů, poměr činí 3 : 1 (5).
Dělení ITP
ITP lze klasifikovat na primární a sekundární, a dále arbitrárně podle doby trvání onemocnění na akutní (trvá do 6 měsíců) a chronickou ITP. ITP se projevuje různě v dětském věku a v dospělosti. U dětí se ITP většinou manifestuje krvácivými projevy s odstupem několika dnů či týdnů po akutní infekci či po očkování. Typicky postihuje jinak zdravé dítě ve věku okolo 5 let, chlapci a dívky jsou postiženi stejnou měrou. Toto onemocnění mívá benigní průběh s tendencí ke spontánní remisi. ITP u dospělých pacientů je zjišťována většinou bez závislosti na akutní infekci, mívá často již od počátku chronický charakter a její výskyt stoupá s věkem pacientů. Tato forma ITP obvykle nevykazuje tendenci ke spontánní remisi a naopak často vyžaduje dlouhodobou léčbu (6).
Diagnostika ITP
Diagnóza ITP je stanovena po vyloučení jiných příčin trombocytopenie, per exclusionem. V současnosti nemáme k dispozici klinický či laboratorní parametr, jež by zcela jednoznačně určoval diagnózu ITP. V rámci diagnostiky pacienta s podezřením na ITP je nutné diferenciálně diagnosticky vyloučit onemocnění uvedená v tabulce 1.
Tab. 1. Diferenciální diagnostika trombocytopenií. ITP – idiopatická trombocytopenická purpura. 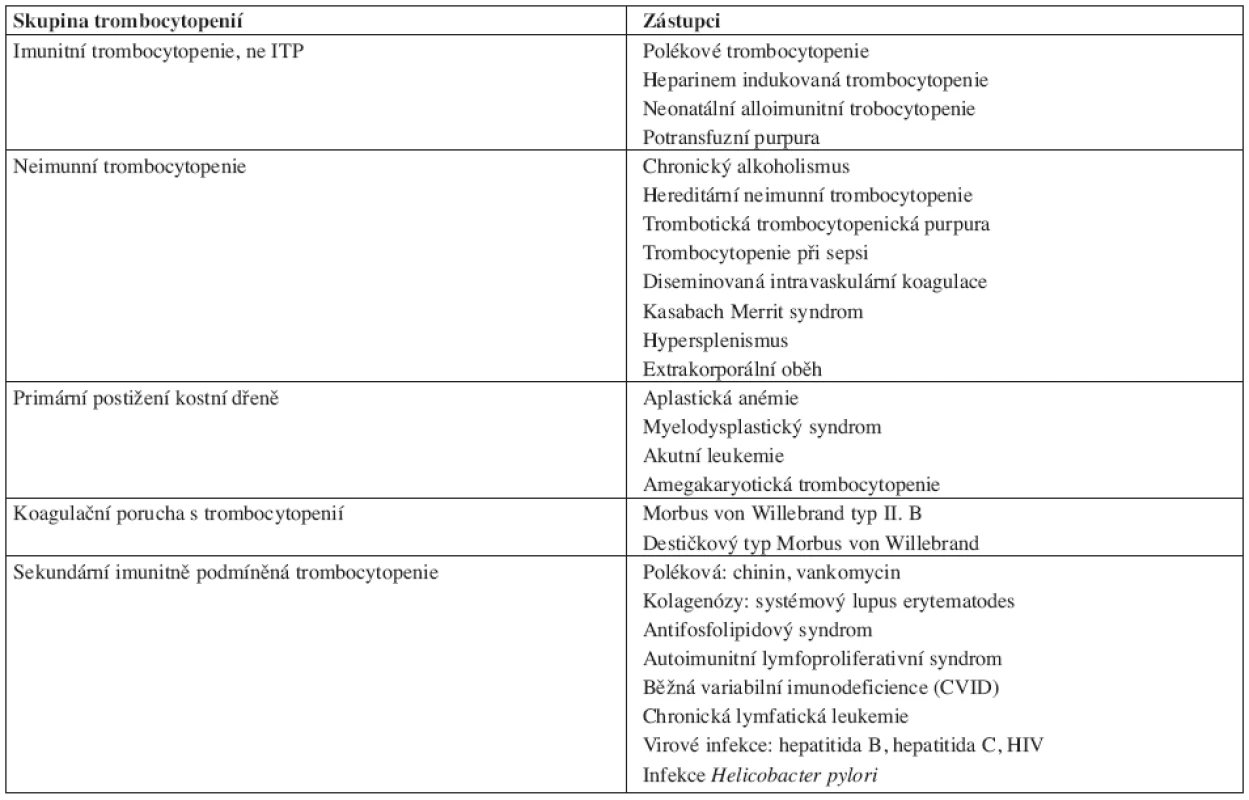
V rámci stanovení diagnózy je nutné provést nátěr periferní krve s mikroskopickou konfirmací trombocytopenie (vyloučení pseudotrombocytopenie, jež bývá způsobena trombocytárními agregáty při použití antikoagulantu EDTA). V periferním krevní nátěru musíme vyloučit patologii, jež by svědčila pro jiná onemocnění asociovaná s trombocytopenií, jako je nález dysplastických změn, blastů či schistocytů. Dále je doporučeno doplnit koagulační vyšetření a screeningový autoimunitní panel.
K diagnóze ITP by měla postačovat anamnéza pacienta, klinické vyšetření a nátěr periferní krve s mikroskopickým vyšetřením. Vyšetření kostní dřeně lze indikovat jen v případech, kdy provedená vyšetření prokazují i jinou patologii než pouze trombocytopenii. Vyšetření kostní dřeně je dále doporučováno u pacientů starších 60 let a dále u pacientů, kteří již mají diagnózu ITP stanovenou a jsou indikováni ke splenektomii a u pacientů jež jsou rezistentní k primární léčbě (7).
Vyšetření antitrombocytárních protilátek nejsou v rámci diagnostiky ITP rutinně doporučována pro svou nedostatečnou specifitu a senzitivitu. Hodí se ale k rozlišení mezi imunní a neimunní trombocytopenií. Vyšetření antitrombocytárních protilátek je doporučeno u pacientů se selháním kostní dřeně v kombinaci s imunitní trombocytopenií, jako jsou pacienti s CLL či pacienti po transplantaci kostní dřeně. Vyšetření protilátek může pomoci k diagnostice u pacientů s polékovou protilátkově mediovanou trombocytopenií (7). V rámci diferenciální diagnostiky trombocytopenií je možné doporučit vyšetření přežívání trombocytů radioizotopovou metodou.
Měření hladiny trombopoetinu nebývá rutinně prováděno, neboť jeho přínos je pouze informativní v rámci diferenciální diagnostiky poruchy produkce destiček (7).
Stanovení destičkové RNA metodou průtokové cytometrie s barvením destiček thiazolovou oranží může být nápomocno k určení stáří destiček. Zvýšení počtu retikulovaných destiček u dětí je asociováno se zvýšenou produkcí destiček (8).
V mnoha studiích byla zjištěna asociace infekce Helicobacter pylori s autoimunitními chorobami, dominantně s ITP. Léčba infekce H. pylori může v některých případech normalizovat trombocytopenii u pacientů s ITP (9).
Historie ITP
Již od starověku byla popisována onemocnění s krvácivými projevy v oblasti kůže, které jsou nazývány purpurou. Označení purpura vychází z barvy, kterou produkuje měkkýš Purpura lapillus. Případ mladé ženy s akutní reverzibilní purpurou popsal podrobně v 18. století Paul Gottlieb Werlhof, dvorní lékař anglického krále Jiřího II. (10). Podle Werlhofa byla ITP nazývána Werlhofova nemoc (morbus maculosus Werlhofi). Werlhofovy spisy jsou uloženy například v londýnské knihovně.
V roce 1915 vyšla v německém písemnictví práce E. Franka, v níž je formulována úvaha o splenickém faktoru, jež potlačuje produkci krevních destiček. V roce 1916 provedl Kaznelson, absolvent pražské německé lékařské fakulty, první splenektomii u pacienta s ITP, jejímž výsledkem byla normalizace počtu destiček (11).
Patogeneze ITP
První světlo do patogeneze ITP vnesly pokusy Williama J. Harringtona v 50. letech minulého století (12). Harrington prokázal, že krevní plazma nemocných s ITP způsobuje snížení počtu destiček u jejích příjemců. Dalším výzkumem bylo prokázáno, že popisovaný efekt závisí na množství podané plazmy. Jako kauzální agens byla identifikována autoprotilátka, imunoglobulin třídy IgG, jež se váže na krevní destičky.
Autoprotilátky, které se váží na krevní destičky, nemají zásadní vliv na destičkové funkce, ale označuji destičky jako cizorodé partikule pro buňky monocyto-makrofágového systému ve slezině, játrech či kostní dřeni. Pacienti s ITP mají často protilátky proti antigenům GPIIb/IIIa, GPIb/IX a GPIa/IIa (13). V imunitním dohledu organismu mají dominantní postavení T lymfocyty s membránovým znakem CD4+, tedy pomocné T lymfocyty. Tyto buňky secernují cytokiny a modulují buněčnou odpověď na antigeny. Rozlišujeme dva typy CD4+ lymfocytů: Th1 buňky, jež se účastní v buněčně zprostředkovaných reakcích a v reakcích oddálené hypersenzitivity (produkují interferon gamma (INFγ), tumor nekrotizující faktor alfa (TNFα), interleukin 2 (IL-2), a Th 2 lymfocyty produkující interleukin 4 (IL-4), interleukin 5 (IL-5), interleukin 6 (IL-6), interleukin 9 (IL-9), interleukin 10 (IL-10) a interleukin 13 (IL-13). Th2 lymfocyty zvyšují produkci protilátek a účastní se na regulaci alergických reakcí. ITP patří mezi onemocnění s aktivovanou Th1 a utlumenou Th2 lymfocytární reakcí. T lymfocytární reakce se podílí na sekreci cytokinů, jež působí na maturaci megakaryocytů a uvolňování krevních destiček (14). Hladina cytokinu transforming growth factor beta (TGFβ), který inhibuje maturaci megakaryocytů, inverzně koreluje s aktivitou ITP (15).
U ITP byl mimo působení antitrombocytárních protilátek prokázán též cytotoxický efekt T lymfocytů na destičky, za nějž odpovídá subpopulace T buněk CD3+8+ (16). Toto vysvětluje fakt, že někteří nemocní s ITP nemají antitrombocytární protilátky zjistitelné.
Destičky potažené autoprotilátkami jsou ničeny buňkami monocytárně-makrofágového systému cestou fagocytózy či komplementem zprostředkované destičkové lýzy. Fagocytóza je zprostředkována Fc receptorem či C3b fixovanou složkou komplementu.
Velmi zajímavá je u ITP otázka trombopoézy. Zpočátku byla u nemoci předpokládaná zvýšená produkce krevních destiček kostní dření. Ve studiích, které byly provedeny v 80. letech minulého století s radioaktivně značenými destičkami, bylo ale zjištěno snížení produkce destiček kostní dření u dvou třetin pacientů s ITP (17). Tento nález je pravděpodobně způsoben přímým působením autoprotilátek na maturaci megakaryocytů a uvolňování destiček. Porucha trombopoézy může být způsobena i autoprotilátkami aktivovanou apoptózou megakaryocytů.
Léčba ITP
Léčba pacientů s ITP v minulosti spočívala především v provedení splenektomie, kterou se odstraňuje místo produkce autoprotilátek a zároveň hlavní místo destrukce destiček. Druhým historicky nejstarším léčebným postupem bylo snížení fagocytární aktivity monocyto-makrofágového systému podáním kortikoidů. Oba tyto postupy, doplněné o aplikaci intravenózních imunoglobulinů (IVIG), zůstávají základními léčebnými postupy ITP i dnes. V léčbě chronické formy ITP je v posledním desetiletí s úspěchem používána další imunosupresivní a imunomodulační terapie.
Léčba pacienta s diagnózou ITP v současné době vychází z doporučení expertů či expertních skupin, aniž by se mohla opřít o jasné výsledky randomizovaných klinických studií, neboť počet pacientů léčených v takovýchto studiích je nízký.
Zahájení léčby pacientů s ITP je většinou doporučováno při počtu krevních destiček pod 20–30 x 109/l (někdy už pod 50 x 109/l, pokud má pacient krvácivé projevy). S léčbou není třeba pospíchat proto, že celkově prognóza pacientů s diagnózou ITP je dobrá. Jejich mortalita je do 4 % a týká se především pacientů s těžkou refrakterní trombocytopenií. Navíc dlouhodobá imunosupresivní léčba může nemocného poškodit víc, než vlastní trombocytopenie (18).
Odlišná situace je u pacientů s těžkou trombocytopení pod 10x109/l s krvácivými projevy, u nichž je indikována emergentní léčba spočívající v podání preparátů první linie či dokonce v kombinaci léčebných modalit.
V léčbě ITP je potřeba zdůraznit několik důležitých aspektů:
- A. Krvácení je zřídkavé a destičkové funkce jsou u pacientů s ITP zachovány.
- B. Léčbu je potřeba individualizovant, přihlédnout k přáním pacienta a jeho životnímu individuálnímu „rizikovému profilu“.
- C. Cílem léčby je prevence krvácení a dosažení bezpečné, i když ne nutně normální hodnoty krevních destiček.
- D. Je nutné vyhýbat se lékům, které interferují s destičkovými funkcemi, jako je kyselina acetylsalicylová, nesteroidní antirevmatika, a konzumaci alkoholu.
Mnoho nemocných s ITP tak může být jen observováno. Observováni jsou většinou dětští pacienti, u kterých v 80 % případů dojde ke spontánní úpravě trombocytopenie do 4–8 týdnů od první manifestace choroby. Těžké krvácivé projevy jsou u těchto pacientů řídké. U dospělých pacientů je spontánní remise vzácná, ale u pacientů bez krvácivých projevů se stabilním počtem destiček je možno vyčkat s nasazením léčby a pacienty také pouze sledovat (19).
Je-li nutná léčba, zahajuje se jedním z léčebných postupů první linie:
1. Kortikoidy.
Kortikoidy potlačují fagocytární aktivitu a snižují syntézu autoprotilátek. Standardním iniciálním dávkováním kortikoidů je prednison (nebo jeho ekvivalent) 1–2 mg/kg/den po dobu 2–6 týdnů s postupným snižováním dávky. Příznivou úvodní léčebnou odpověď lze očekávat u 60–70 % dospělých pacientů s akutní ITP (20). Pacientů, kteří po terapii kortikoidy dosáhnou dlouhodobé remise, je 25–29 %. Vysokodávkované kortikoidy (pulzní metylprednisolon a dexametason) bývají u pacientů s akutní ITP indikovány pro rychlejší nástup účinku ve srovnání s výše uvedenou dávkou prednisonu. Metylprednisolon lze podat parenterálně až v dávce 30 mg/kg po dobu několika dní s následným přechodem na standardní perorální dávku prednisonu. Dexametason v pulzech 40 mg/den po 4 dny (délka léčby 6 měsíců) vede k 83% bezprostřední léčebné odpovědi a 64% dlouhodobé léčebné odpovědi trvající 2 roky. Efektivita této terapie je ale limitována výraznými nežádoucími účinky (20). Léčba vysokými dávkami dexametasonu byla zkoušena i u pacientů s chronickou formou ITP, kde ale provedené studie neprokázaly jednoznačnou efektivitu této terapie. Léčba kortikoidy v současnosti představuje základní kámen terapie akutní ITP a měla by být testována i u pacientů s chronickou formou ITP.
2. IVIG.
Historie podání vysokých dávek směsných imunoglobulinů u ITP začíná v roce 1981, kdy byly použity u dětských pacientů s ITP (21). Následně byla tato léčba převzata i pro dospělé pacienty. Mechanismem působení IVIG je blokáda monocyto-makrofágového systému, působení antiidiotypových protilátek, ovlivnění hladiny cytokinů a modulace Fc receptorů. V provedených studiích u dětí byla demonstrována rychlejší účinnost podaných IVIG ve srovnání s kortikoidy (22). V největší studii testující IVIG u ITP mělo až 90 % pacientů vzestup počtu destiček nad 50 x 109/l v 7. dni léčby. Po dvou týdnech od podání IVIG ale došlo u části pacientů s postupnému poklesu počtu destiček. Nežádoucí účinky IVIG byly především bolesti hlavy a zvýšená tělesná teplota (22). O dávkování IVIG nepanuje všeobecná jednota, je doporučována dávka 1g/kg ve dvou dnech či 2 g/kg v jeden den. Randomizovaná studie neprokázala rozdíl v efektu IVIG podávané v dávce 0,4 g/kg po dobu 5 dnů a v dávce 1 g/kg jednorázově (23).
3. Anti-D imunoglobulin.
Mechanismus působení anti-D je pravděpodobně shodný s IVIG: blokáda monocyto-makrofágového systému. Doporučovaná dávka anti-D je 75 μg/kg v jednom cyklu. Nejčastějším nežádoucím účinkem anti-D protilátky je hemolytická reakce s hrozícím akutním renálním selháním. Byla popsána i aktivace procesu diseminované intravaskulární koagulace. Léčebná odpověď bývá zaznamenána u 79–90 % dospělých nemocných s ITP (24). Tato léčba není v současnosti v České republice k běžnému použití dostupná.
Léčba druhé linie ITP:
1. Splenektomie.
Slezina představuje důležité místo produkce protilátek a je také hlavním místem destrukce destiček s navázanými autoprotilátkami. V současnosti představuje splenektomie druhou linii léčby pacientů s ITP, je tedy doporučována po selhání první linie. V otázce načasování splenektomie dosud není všeobecná shoda, ponejvíce je doporučováno se splenektomií vyčkat 6–12 měsíců od stanovení diagnozy ITP, ale je nutno vždy příhlédnout ke konkrétnímu pacientu. Provedení splenektomie ze všech léčebných modalit vykazuje z dlouhodobého hlediska nejvyšší počet příznivých léčebných odpovědí a to u 60 až 70 % nemocných. Relaps ITP po provedení splenektomie, který vyžaduje léčbu, je možno očekávat u asi 15 % pacientů. U těchto pacientů je doporučeno pátrat po akcesorní slezině. Před splenektomií je doporučováno provedení testu přežívání destiček značených radioaktivním indiem. Provedení splenektomie je možno klasickou či laparoskopickou technikou s nízkou celkovou mortalitou zákroku. Nicméně morbidita zákroku nemusí být malá. Mezi komplikace po provedené splenektomii patří bronchopneumonie či trombembolické příhody. Pacienti jsou po provedené splenektomii ohroženi také infekcí opouzdřenými mikroby, tzv. overwhelming post-splenectomy infection (OPSI). Pacienti plánováni k splenektomii by měli nejpozději 2 týdny před splenektomií podstoupit očkování proti pneumokokům, meningokokům typu C a hemofilům typu B (25). Revakcinace proti pneumokokům se doporučuje každých 5 let po zákroku. Pokud je v době indikace splenektomie pacient léčen imunosupresivní terapií, lze pacienta očkovat až po provedení splenektomie po předchozím snížení imunosupresivní terapie. Co se týká podání antibiotik jako profylaxe infekce po splenektomii, nepanuje v tomto všeobecný konsensus. Některá pracoviště aplikují antibiotickou profylaxi 6 měsíců, jiná 3 roky, další doživotně (26).
2. Rituximab.
Monoklonální chimerická protilátka proti receptoru CD20 se váže na B lymfocyty a způsobuje FcR mediovanou B buněčnou lýzu cestou aktivace komplementu či cestou buněčné imunity (27). Rituximab působí snížení počtu B lymfocytů a tím následné snížení počtu produkovaných autoprotilátek, a dále i blokádu monocyto-makrofágového systému. Po léčbě rituximabem lze pozorovat přes 40–60 % kompletních léčebných odpovědí. Dlouhodobě zůstává v remisi asi 20 % nemocných (28). Provedené studie naznačují vyšší účinnost rituximabu aplikovaného brzy po propuknutí onemocnění, což pravděpodobně souvisí s normalizací T buněčné imunity, jež je iniciálně dependentní na B buňkách. Léčba rituximabem je většinou dobře tolerovaná, ale je nutno upozornit na možné závažné nežádoucí reakce při podávání této protilátky, k nimž náleží teplota, poruchy srdečního rytmu a vzácně i výskyt anafylaxe. Rituximab zvyšuje riziko aktivace latentních infekcí jako jsou hepatitida typu B či JC viróza (27–29).
Chronická refrakterní ITP je definována jako ztráta léčebné odpovědi nebo nulová odpověď na první a druhou linii léčby, nebo nutnost terapie neakceptovatelně vysokými dávkami kortikoidů k udržení bezpečné hladiny destiček. Celkový počet pacientů s chronickou ITP je od 11 až 35 % ze všech nemocných s ITP. Léčba těchto pacientů je obtížná a řídí se doporučeními expertních skupin (7). Pacienti s chronickou refrakterní ITP mohou mít prospěch z danazolu, imunosupresivních léků a trombopoetinových agonistů:
1. Danazol.
Danazol je slabý androgen. Patofyziologický mechanismus účinku spočívá pravděpodobně v ovlivnění Fc receptoru. Doporučené dávkování je 400–800 mg na den, ale dobré výsledky byly zaznamenány i při dávkování 100–200 mg danazolu denně. Celkově cca 60–70 % pacientů odpoví příznivě na léčbu. Léčba danazolem je obvykle dobře tolerována, z nežádoucích účinků je častá elevace jaterních testů, virilizující efekt, přírůstek hmotnosti a retence tekutin. Lék je vhodný především pro starší pacienty, kteří úvodně reagovali na kortikoidní léčbu a u nichž danazol umožní snížit celkovou dávku kortikoidů. Další vhodnou indikací jsou překryvné syndromy s autoimunitami typu lupus erytematodes nebo jako léčebná eventualita při kontraindikaci splenektomie (30). Lék je v současnosti v České republice k dispozici na mimořádný dovoz.
2. Azatioprin.
Prekurzor 6-merkaptopurinu, antimetabolitu, jež blokuje lymfocytární proliferaci. Obvyklé dávkování je 1–2 mg/kg/den. Z nežádoucích účinků je třeba především sledovat jaterní toxicitu. Léčebný efekt azatioprinu je dosahován postupně a selhání léčby by nemělo být konstatováno před uplynutím šestiměsíčního období terapie (31).
3. Mykofenolát mofetil
je předstupněm mykofenolové kyseliny, jež je nekompetitivním inhibibitorem inosin 50-monofosfát dehydrogenázy, klíčového enzymu v biosyntéze purinů. Dávkování je obvykle 1–2 g/den (32).
4. Cyklosporin A
je kalcineurinový inhibitor, potlačující proliferaci T lymfocytů. Obvyklé dávkování je 2–3 mg/kg/den. V léčbě je podáván obvykle v kombinaci s kortikoidy. Léčebné použití cyklosporinu A limitují jeho nežádoucí účinky jako je zvýšení krevního tlaku či nefrotoxicita (33).
5. Cyklofosfamid
je alkylující látka užívaná v indikaci imunosupresivní či cytostatické. Dávkování používané u pacientů s ITP je 1–2 mg/kg/den perorálně či v pulzech parenterálně (34).
6. Vinka alkaloidy
– dominantně vinkristin – jsou užívané v kombinační léčbě. Používaná dávka vinkristinu je 2 mg na týden, opakovaně ve 3–4 cyklech. Nejčastějším nežádoucím účinkem je neurotoxicita (35).
7. Trombopoetinoví agonisté
jsou nejnovější a velmi nadějnou léčebnou možností pacientů s chronickou ITP. Vzhledem k tomu se jim budeme věnovat v samostatné části.
Trombopoetinoví agonisté
Velmi zajímavou možností pro pacienty s chronickou ITP přestavuje podávání léků stimulujících trombopoézu. Trombopoetin (TPO, leukemia virus oncogene ligand, megakaryocyte growth and development factor) je glykoproteinový hormon, hematopoetický cytokin, produkovaný především v játrech a ledvinách. TPO reguluje zejména produkci krevních destiček. Stimuluje tvorbu a diferenciaci megakaryocytů. TPO působí už na kmenovou hematopoetickou buňku, dokonce časněji než granulocytární kolonie stimulující faktor (G-CSF). TPO je nezbytný k přeměně kmenové buňky v megakaryocyt. Receptorem TPO je c-mpl (36).
Produkce TPO je regulována negativní zpětnou vazbou – jeho efektor přímo reguluje hladinu hormonu. TPO je po navázání na povrchový destičkový receptor mpl (CD110) rozložen, takže, je-li jednou navázán na svůj receptor, nemůže už ovlivnit další megakaryocyty (36). Přes řadu studií, které zkoušely léčebné použití TPO, není vlastní TPO (rekombinantní TPO, TPO první generace) terapeuticky využíván. Využití rekombinantních TPO v hematologii negativně ovlivnilo to, že rekombinantní megakaryocytární růstový a diferenciační faktor (megakaryocyte growth and differentiation factor, MGDF) způsoboval někdy paradoxně trombocytopenii (stimuloval tvorbu anti-TPO protilátek) (37). Navíc dlouhodobé podávání velkých dávek TPO může vyvolat tvorbu retikulinové fibrózy kostní dřeně (38).
Klinické využití TPO bylo nejasné až do roku 2002, kdy byla publikována zpráva o překvapivě velmi dobrém efektu pegylovaného MGDF u pacientů s idiopatickou trombocytopenickou purpurou (ITP). U 4 z 5 nemocných, kterým byla podána jediná injekce MDGF, byla pozorována příznivá léčebná odpověď (39).
Zklamání z účinnosti rekombinantních TPO první generace vedlo k vývoji druhé generace trombopoetických látek. Tyto pak jsou zkoušeny především u ITP. Prvním z analogů TPO je romiplostim (AMG 531), druhým eltrombopag (SB-497115). Zkouší se i další látky s trombopoetickým účinkem: AKR-501 a SB-559448. Romiplostim je rekombinantní peptid, který stimuluje trombopoézu. Eltrombopag je malá molekula, která také stimuluje tvorbu trombocytů. Lze jej podávat perorálně. Obě tyto látky by měly mít menší spektrum nežádoucích účinků ve srovnání s rekombinantními TPO (žádná tvorba anti-TPO protilátek, žádné riziko fibrotizace kostní dřeně) (40). Výsledky studií s trombopoetickými látkami druhé generace ukazuje tabulka 2.
Tab. 2. Přehled studií s trombopoetickými látkami druhé generace. ITP – idiopatická trombocytopenická purpura. 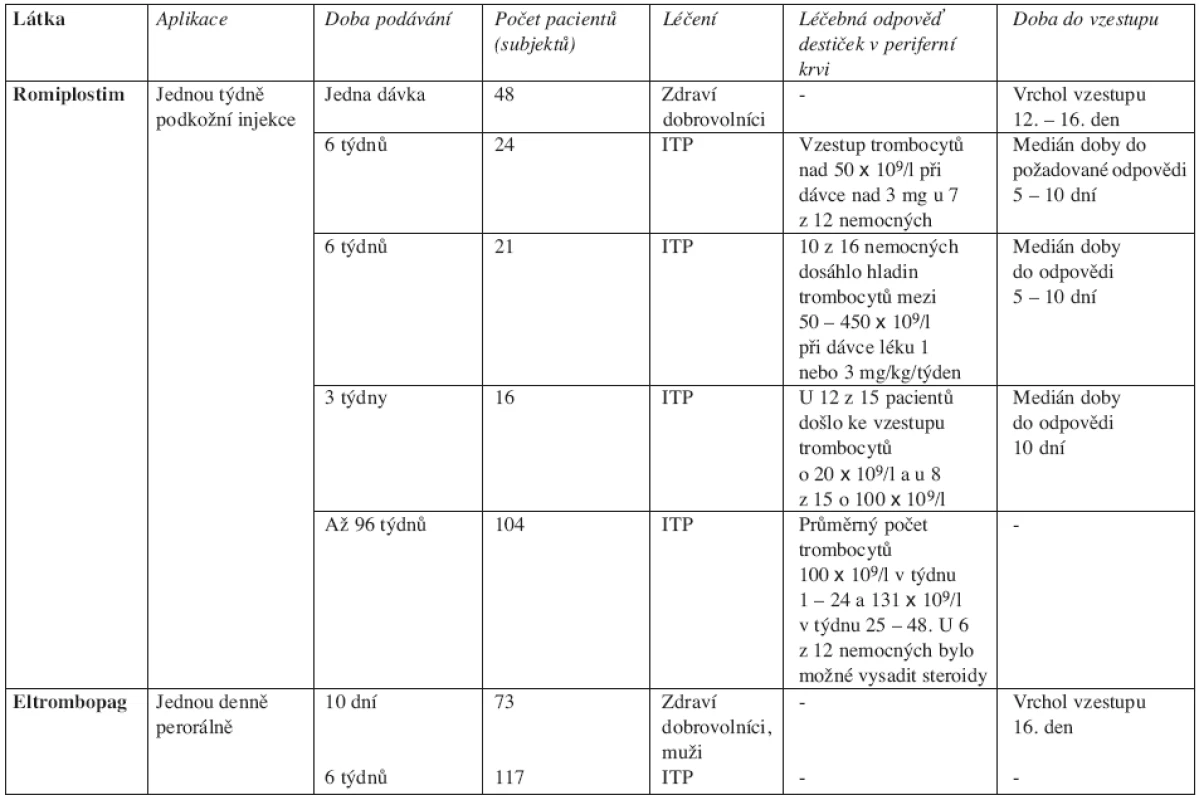
Shrnutí léčby
Efektivní léčba ITP zasahuje různá místa v patofyziologii nemoci, například snížení produkce autoprotilátek, modulace Fc receptoru nebo potlačení T či B buněčné imunitní reakce. Kortikoidy a IVIG představují základní pilíře léčby. Pro pacienty nedostatečně reagující na tuto terapii lze doporučit provedení splenektomie či léčbu rituximabem. Při progresi onemocnění do chronické refrakterní ITP je nutno vážit přínos medikamentózní terapie a snažit se pro pacienta najít léčbu jež bude při minimu vedlejších účinků přinášet pacientu maximální profit.
ITP v Jihomoravském kraji
V květnu 2008 jsme provedli dotazníkovou studii týkající se ITP u dospělých v Jihomoravském kraji (v jeho nových hranicích). Dotazníky jsme obeslali všech 18 specializovaných hematologických ambulancí pro dospělé (plus ambulance naše) v tomto regionu, který podle Českého statistického úřadu měl při posledním sčítání lidu 1 127 718 obyvatel (41). Ze všech ambulancí se nám dotazníky vrátily. Obsah dotazníků byl zaměřen na zjištění počtu pacientů s diagnózou ITP v daném regionu a dále na zjištění diagnostických a terapeutických preferencí lékařů. K datu analýzy bylo v Jihomoravském kraji dispenzarizováno 564 dospělých nemocných s ITP (většina samozřejmě s chronickou ITP). Podle toho čísla je tedy prevalence nemoci u lidí starších 18 let 50,3 případů na 100 000 obyvatel, námi zjištěná incidence činí 6 případů na 100 000 obyvatel nad 18 let, což odpovídá celosvětovým údajům (viz výše). Získaná data ukazují, že diagnostika ITP se na různých pracovištích řídí různými kritérii. Standardními pilíře léčby ITP jsou kortikoidy a splenektomie, u těhotných aplikace IVIG. V léčbě chronické ITP či chronické refrakterní ITP jsme zaznamenali především významné zastoupení cyklosporinu A a překvapivě i cyklofosfamidu. Naopak použití danazolu či rituximabu nebylo mimo naše centrum zjištěno, což jistě souvisí se malou dostupností těchto preparátů mimo centra specializované hematologické péče. Výsledky analýzy shrnují tabulky 3 a 4.
Tab. 3. Zastoupení pacientů s diagnózou idiopatické trombocytopenické purpury (ITP) na specializovaných hematologických ambulancích Jihomoravského kraje. 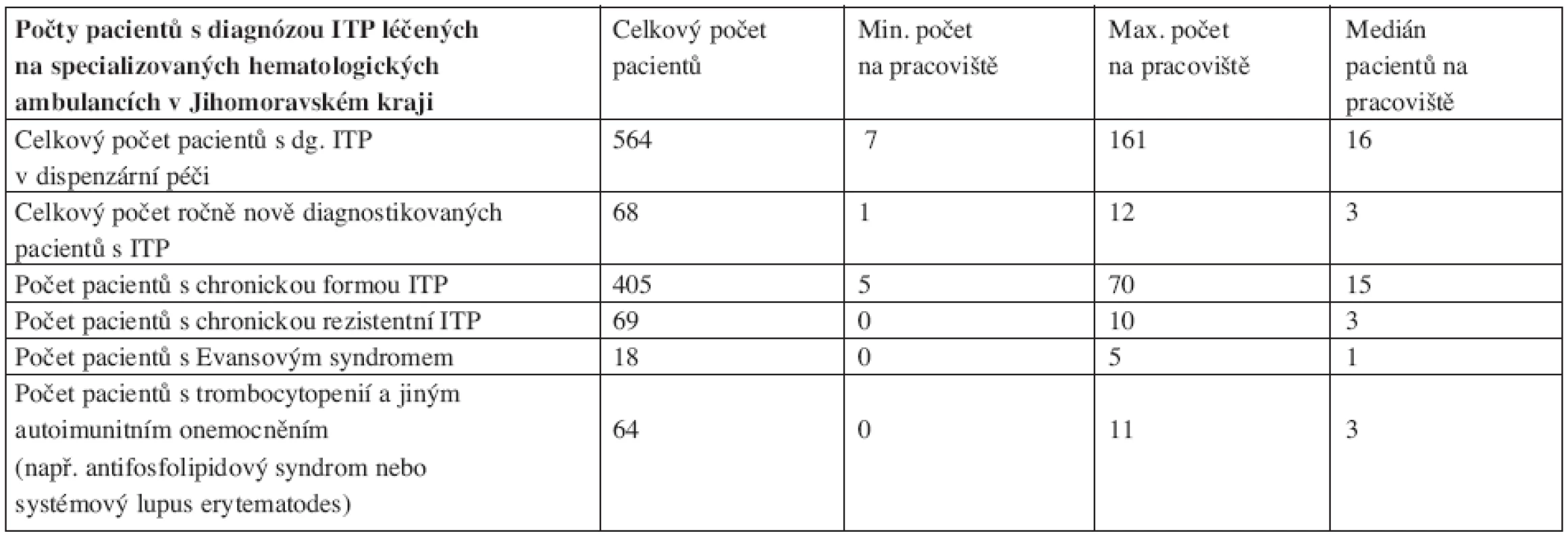
Tab. 4. Diagnostické a léčebné preference hematologů Jihomoravského kraje u pacientů s idipatickou trombocytopenickou purpurou (ITP). Mimo údajů z Interní hematoonkologické kliniky FN Brno. 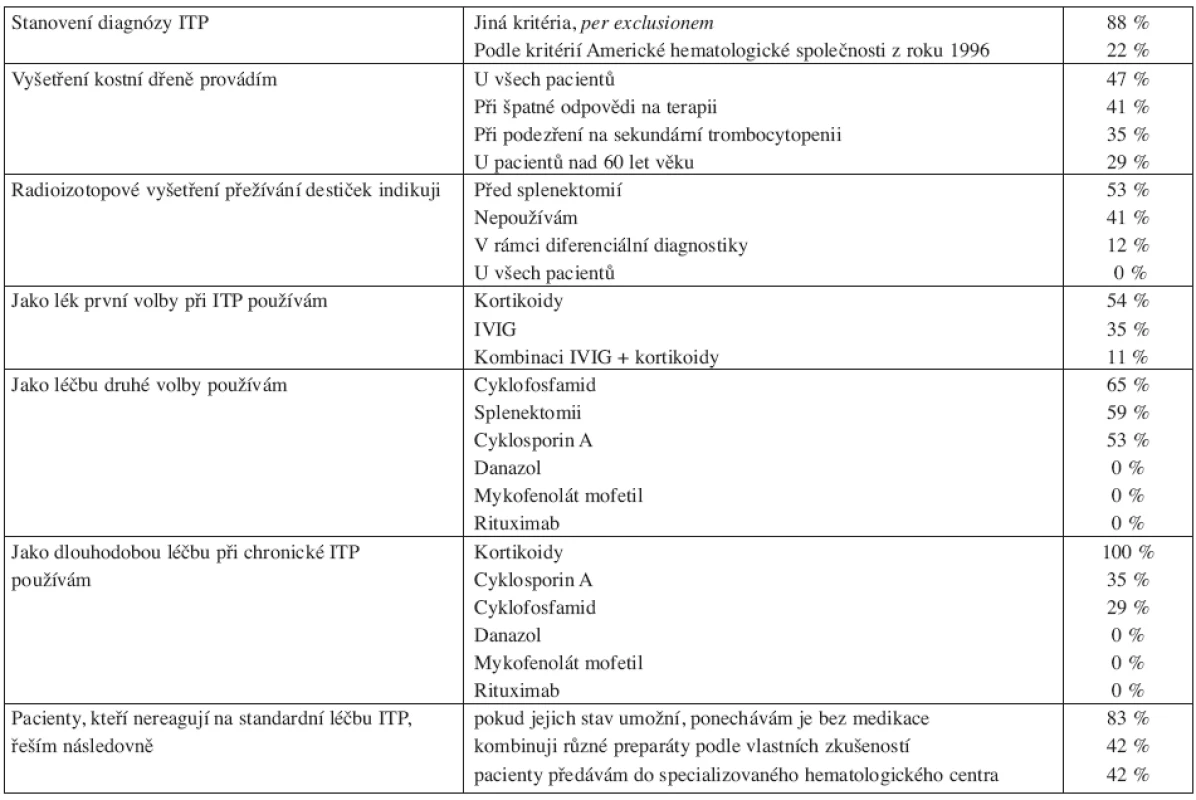
Závěr
Autoimunitní cytopenie představují poruchu imunity v oblasti krve. ITP je příkladem jednoduše sledovatelné poruchy imunitního systému, kdy jsme podle počtu destiček v periferní krvi schopni hodnotit aktivitu onemocnění či účinnost léčby. I přes tuto výhodu je v detailní patogenezi ITP, a z toho vyplývající léčebné strategii, stále mnoho nejasného. Ačkoli základními kameny léčby ITP jsou kortikoidy a splenektomie, léčba nemoci se do značné míry na různých pracovištích liší, jak ukazuje naše analýza situace v Jihomoravském kraji.
Poděkování
Za spolupráci při vyplnění dotazníků děkujeme těmto kolegům: MUDr. R. Bartošové, MUDr. A. Bulikové, PhD., prim. MUDr. V. Dostálové, MUDr. A. Gajovi, PhD., MUDr. H. Hájkové, MUDr. N. Hejlové, CSc., prim. MUDr. L. Ingrové, MUDr. P. Jajtnerovi, prim. MUDr. J. Jančovi, MUDr. R. Kelnarové, MUDr. E. Krahulcové, CSc., prim. MUDr. M. Maškové, prim. MUDr. I. Meluzínové, prim. MUDr. J. Peprlovi, MUDr. I. Ševčíkové, prim. MUDr. J. Simonidesovi, MUDr. N. Suché, MUDr. Š. Turkové, MUDr. H. Veselé, prim. MUDr. M. Závodné a prim. MUDr. M. Zvarové.
MUDr. Libor Červinek
Interní hematoonkologická klinika
FN Brno
Jihlavská 20
625 00 Brno
e-mail: cervinekl@fnbrno.cz
Doručeno do redakce: 25. 9. 2008
Přijato: 20. 11. 2008
Zdroje
1. Woods VL Jr, KurataY, Montgomery RR, et al. Autoantibodies against platelet glykoprotein Ib in patients with chronic immune trombocytopenic purpura. Blood 1984; 64: 156–160.
2. McMillan R. Therapy for adults with refractory chronic immune trombocytopenic purpura. Ann Internal Med 1997; 126 : 307–314.
3. Zeller B, Helgestad J, Hellenbostad M, et al. Immune trombocytopenic purpura in childhood in Norway: a prospective population-based registration. Pediatric Hematology and Oncology 2000; 174 : 551–558.
4. Fogarty PF, Segal JB. The epidemiology of immune thrombocytopenic purpura. Curr Opin Hematol 2007; 14 : 515–519.
5. Waters AH. Autoimmune trombocytopenia: clinical aspect. Semin Hematol 1992; 29 : 18–25.
6. Frederiksen H, Schmidt K. The incidence of idiopathic trombocytopenic purpura in adults increases with age. Blood 1999; 94 : 909–913.
7. Provan D, Newland A, Bolton-Maggs, et al. Guidelines for the investigation and management of idiopathic trombocytopenic purpura in adults, children and in pregnancy. Br J Haematol 2003; 120 : 575–596.
8. Saxon BR, Blanchette VS, Butchart S. Reticulated plateled counts in the diagnosis of acute immune trombocytopenic purpura. J Pediatr Hematoncol 1998; 20 : 44–48.
9. Gasbarrini A, Franceschi F, Tartaglione R. Regression of autoimmune trombocytopenia after eradication of Helicobacter pylori Lancet 1998; 352 : 878.
10. Werlhof PG. Disquisitio medica et philologica de variolis et anthracibus, signis differentiis, medelis disserit etc. Hannoverae, sumt. haered. Nicolai Foersteri, 1735; 4. díl, 28 s.
11. Kaznelson P. Verschwinden der Hamorrhagischen Diatese bei einem Falle von essentiele Trombopenie nach Miltz extirpation Wiener Klinische Wochenschrift 1916; 29 : 1451–1454.
12. Harrington WJ, Minnich V, Hollingsworth JW, et al. Demonstration of trombocytopenic factor in the blood of patiens with trombocytopenic purpura. J Lab Clin Med 1951; 38 : 1–10.
13. Cooper N, Bussel JB. The pathogenesis of immune trombocytopenic purpura. Br J Haematol 2006; 133 : 364–374.
14. McMillan R. The pathogenesis of chronic immune thrombocytopenic purpura. Semin Hematol 2007; 44 (Suppl. 5): S3–S11.
15. Andersson PO, Olsson A, Wadenvik H. Reduced transforming growth factor-beta 1 production by mononuclear cells from patients with chronic idiopathic trombocytopenic purpura. Br J Haematol 2002; 116 : 862–867.
16. Olsson B, Anderson PO, Jernas M, Jacobsson S. T-cell mediated cytotoxicity toward platelets in chronic idiopathic trombocytopenic purpura. Nature Med 2003; 9 : 1123–1124.
17. Heyns AP, Loter MG, Badenhorst PN, et al. Kinetics and sites of desctruction of 111-indium-oxine-labeled platlets in idiopathic trombocytopenic purpura. A quantitative study. Am J Hematol 1982; 12 : 167–177.
18. Portiejle JEA, Westendrop RGJ, et al. Morbidity and portality in aduldst with idiopathic thrombocytopenic purpura Blood 2001; 97 : 2549–2554
19. Donald MA, Kelton JG. Current options for the treatment of idiopathic trombocytopenic purpura. Semin Hematol 2007; 44 (Suppl. 5): S12–S23.
20. George JN, El-Harake MA. Chronic idiopathic thrombocytopenic purpura. N Engl J Med 1994; 331 : 1207–1211.
21. Imbach P, Barandun S, et al. High–dose intravenous gammaglobulin for idiopathic trombocytopenic purpura in childhood. Lancet 1981; 1(8232): 1228–1231.
22. Beck CE, Nathan PC, Parkin PC. Corticosteroids versus intravenous immune globulin for the treatment of acute immune thrombocytopenic purpura in children: a systematic review and metaanalysis of randomized controlled trials. J Pediatr 2005; 147 : 521–527.
23. Godeau B, Lesage S, Divine M, et al. Treatment of adult chronic autoimmune thrombocytopenic purpura with repeated high-dose intravenous immunoglobulin. Blood 1993; 82 : 1415–1421.
24. Scaradavou A, Woo B, Woloski BM, et al. Intravenous anti-D treatment of immune trombocytopenic purpura: experience in 272 patients. Blood 1997; 89 : 2689–2700.
25. BCSH Guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen. Working Party of the British Committee for Standards in Haematology Clinical Haematology Task Force. British Medical Journal 1996; 312 : 430–434
26. Ráčil Z. Prevence septických stavů u dospělých pacientů s funkčním hyposplenismem po splenektomii. Vnitř Lék 2001; 47 : 781–789.
27. Garvey B. Rituximab in the treatment of autoimmune haematological disorders. Br J Haematol 2008; 141 : 149–169.
28. Arnold DA, Dentali F, Crowther MA, et al. Efficacy and safety of rituximab for adults with idiopathic trombocytopenic purpura. Ann Intern Med 2007; 146 : 25–33.
29. Mayer J. Klinické využití chimerické monoklonální protilátky rituximab. Vydavatelství Masarykovy univerzity, Brno 2004, 72 s.
30. Maloisel F, Andres E, Zimmer J. Danazol therapy in patiens with chronic idiopathic thrombocytopenic purpura. Am J Med 2004; 116 : 590–594.
31. Vesely SK, Perdue JJ, Rizvi MA. Management of adult patients with perzistent idiopathic thrombocytopenic purpura following splenectomy. Ann. Intern. Med. 2003; 140 : 112–120.
32. Howard J, Hoffbrand AV, Prentice HG. Mycophenolate mofetil for the treatment of refractory auto-immune haemolytic anemia and autoimmune thrombocytopenic purpura. Br J Haematol 2002; 117 : 712–715.
33. Kappers-Klunne MC, van’t Veer MB. Cyclosporin A for the treatment of patients with chronic idiopathic thrombocytopenic purpura refractory to corticosteroids or splenectomy Br J Haematol 2001; 114 : 121–125.
34. Reiner A, Gernsheimer T, Schlichter SJ. Pulse cyclofosfamide therapy for refractory aumoimmune thrombocytopenic purpura. Blood 1995; 85 : 351–358.
35. Douglas BC, Bussel JB. How I treat idiopathic thrombocytopenic purpura. Blood 2005; 106 : 2244–2251.
36. Kaushansky K. Lineage-specific hematopoietic growth factors. N Engl J Med 2006; 354 : 2034–2045.
37. Basser RL, O’Flaherty E, Green M, et al. Development of pancytopenia with neutralizing antibodies to thrombopoietin after multicycle chemotherapy supported by megakaryocyte growth and development factor. Blood 2002; 99 : 2599–2602.
38. Douglas VK, Tallman MS, Cripe LD, et al. Thrombopoietin administered during induction chemotherapy to patients with acute myeloid leukemia induces transient morphologic changes that may resemble chronic myeloproliferative disorders. Am J Clin Pathol 2002; 117 : 844–850.
39. Nomura S, Dan K, Hotta T, et al. Effects of pegylated recombinant human megakaryocyte growth and development factor in patients with idiopathic thrombocytopenic purpura. Blood 2002; 100 : 728–730.
40. Doubek M. Trombopoetin a nové trombopoetické látky. Transf Hematol dnes 2008; 14 (suppl. 1): 102–104.
41. Sčítaní lidu, domů a bytů 2001. Jihomoravský kraj, NUTS 4: CZ0620.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek ÚVODNÍKČlánek Systémová mastocytóza
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2009 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Exprese reverzní telomerázy u pacientů s chronickou B-lymfocytární leukemií
- Mukozitida dutiny ústní po alogenní transplantaci krvetvorných buněk s přípravou fludarabinem a melfalanem FLU/MEL
- Denzita exprese cílového antigenu CD20 a CD52 ve vztahu k terapii monoklonální protilátkou u pacientů s chronickou lymfocytární leukemií
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivních mykotických infekcí u imunoalterovaných nemocných – doporučení odborných společností
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Systémová mastocytóza
- XVI. ČESKO-SLOVENSKÁ KONFERENCE O HEMOSTÁZE A TROMBÓZE s mezinárodní účastí
- Vývoj oboru klinické hematologie dospělých v Brně do devadesátých let minulého století (Vzpomínky klinického hematologa)
- Za prof. MUDr. Jaroslavem Vaňáskem, CSc., dr. h. c.
- O spolupráci mezi lékařskou odbornou veřejností a inovativním farmaceutickým průmyslem
- ÚVODNÍK
- 2009 – rok zásadních změn ve WHO nomenklatuře HLA systému
- Léčba invazivní kandidózy - doporučení odborných společností
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Systémová mastocytóza
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivní kandidózy - doporučení odborných společností
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



