-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
Therapy-related MDS/AML after autologous stem cell transplantation for lymphoma with BEAM as conditioning: our experience
Autologous stem cell transplantation (ASCT) is an important therapy for patients with Hodgkin’s lymphoma (HL) and non-Hodgkin’s lymphoma (NHL). Some reports in long-term survivors document the higher risk of secondary malignancies including myelodysplastic syndrome and acute leukemia. The incidence of therapy related myelodysplastic syndrome and acute leukemia (tMDS/AML) was reported from 2% to 12%. We analyzed group of patients with lymphoma who underwent ASCT with BEAM as conditioning between 1998–2005 with minimal follow up 6 months. Population studied consists of 112 patients (54 males, 58 females), 32 of them presented with HL and 80 with NHL. The median follow up after ASCT was 41 months (range 6–99 months), the median diagnosis to transplantation interval was 24 months (range 4–204 months) and the median age at transplantation was 43 years (range 18–69 years). The history of bone marrow involvement was documented in 26 patients (23%). All our patients received BEAM as the conditioning regimen and then peripheral blood stem cells as a graft. The therapy related MDS/AML occurred in 3 patients (2,5%) with the median time from transplantation to diagnosis tMDS/AML 24 months (range 14–61 months). The median age at transplantation in those patients was 56 years (range 53–57 years). In one case tMDS developed after radioimunochemotherapy for relapsing NHL. In two cases we diagnosed MDS type RCMD (refractory cytopenia with multilineage dysplasia) according to WHO classification and in the third case we diagnosed secondary acute myeloid leukemia with maturation (type M2 according FAB classification). In our single center retrospective analysis we detected low incidence of tMDS/AML after ASCT with BEAM as the conditioning regimen. The crude incidence was 2,5% and 5-year cumulative incidence was 3%.
Key words:
myelodysplastic syndrome, secondary leukemia, autologous stem cell transplantation
Autoři: P. Bělohlávková; A. Zavřelová; P. Žák; M. Cermanová; D. Belada; J. Voglová; L. Jebavý; J. Malý
Působiště autorů: II. interní klinika, oddělení klinické hematologie, Fakultní nemocnice a Lékařská fakulta v Hradci Králové
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 1, p. 19-23.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Autologní transplantace krvetvorných buněk (ASCT) má velký význam v léčbě pacientů s Hodgkinovými lymfomy (HL) a ne-Hodkinovými lymfomy (NHL). Některé studie však dokumentují u dlouhodobě přežívajících pacientů zvýšené riziko sekundárních malignit včetně sekundárního myelodysplastického syndromu a akutní leukemie (sMDS/AML). Retrospektivně jsme hodnotili soubor pacientů s lymfomy, kteří v letech 1998–2005 podstoupili na našem pracovišti ASCT s užitím přípravného režimu BEAM (carmustin, etoposid, cytosinarabinosid, melfalan). Zařazeni byli pacienti, kteří po ASCT dosáhli minimálního šestiměsíčního sledování. Náš soubor je tvořen 112 pacienty (54 mužů, 58 žen) a je zastoupen 32 pacienty s HL a 80 pacienty s NHL. Medián sledování po ASCT byl 41 měsíců (6–99 měsíců), medián intervalu od diagnózy k transplantaci byl 24 měsíců (4–204 měsíců) a medián věku v době transplantace byl 43 let (18–69 let). Postižení dřeně lymfomem v době diagnózy bylo prokázáno u 26 pacientů (23 %). U všech pacientů byl jako předtransplantační režim použit BEAM s následným převodem periferních kmenových buněk. Rozvoj sekundárního MDS/AML jsme prokázali u 3 pacientů (2,5 %) s mediánem intervalu od transplantace k diagnóze sMDS/AML 24 měsíců (14–61 měsíců). Medián věku těchto nemocných v době transplantace byl 56 let (53–57 let). U dvou pacientů jsme diagnostikovali MDS typu RCMD (refrakterní cytopenie s multilineární dysplazií) dle WHO klasifikace. Jeden z těchto pacientů byl po ASCT léčen pro relaps NHL radioimunoterapií, která se tak zřejmě spolupodílela na rozvoji sMDS. Ve třetím případě došlo u nemocného k rozvoji sekundární AML s vyzráváním dle WHO klasifikace (AML M2 dle FAB klasifikace). V našem souboru pacientů jsme zaznamenali velmi nízkou incidenci rozvoje sMDS/AML po prodělané ASCT pro lymfom s použitím přípravného režimu BEAM. Zjištěná hrubá incidence v souboru činí 2,5 % a 5letá kumulativní incidence 3 %.
Klíčová slova:
myelodysplastický syndrom, sekundární akutní leukemie, autologní transplantace periferních kmenových buněkÚvod
Autologní transplantace periferních kmenových buněk (ASCT) má velký význam v léčbě pacientů s Hodgkinovými a ne-Hodkinovými lymfomy, především u chemo-senzitivních relabujících forem, v některých případech je již součástí první linie léčby. Peritransplantační mortalita je velmi nízká (do 5 %) díky postupnému zkvalitnění podpůrné léčby. Dlouhodobé přežití po ASCT bez přítomnosti onemocnění je kolem 50 % (1). Mezi pozdní komplikace této léčby však patří rozvoj sekundárních malignit včetně sekundárního myelodysplastického syndromu a sekundární leukemie (sMDS/AML) a rozvoj sekundární malignity stojí u těchto pacientů na druhém místě v příčinách úmrtí. Udávaná incidence rozvoje sMDS/AML je v literatuře mezi 2 % až 12 % (1–13). Kumulativní rizika rozvoje sMDS/AML jsou velmi široká, od 1,1 % v 62 měsících do 24,3 % ve 43 měsících dle různých studií (1–17). Tato široká variace je dána velkou heterogenitou daných studií. Výsledky léčby sekundárního myelodysplastického syndromu a sekundární leukemie jsou obecně velmi špatné. Rozvoj sMDS/AML představuje tak pro nemocné často pozdní a zároveň fatální komplikaci po prodělané ASCT.
Zajímala nás incidence rozvoje sMDS/AML u našich pacientů léčených pro HL či NHL s následnou ASCT.
Tab. 1. Charakteristika souboru pacientů. 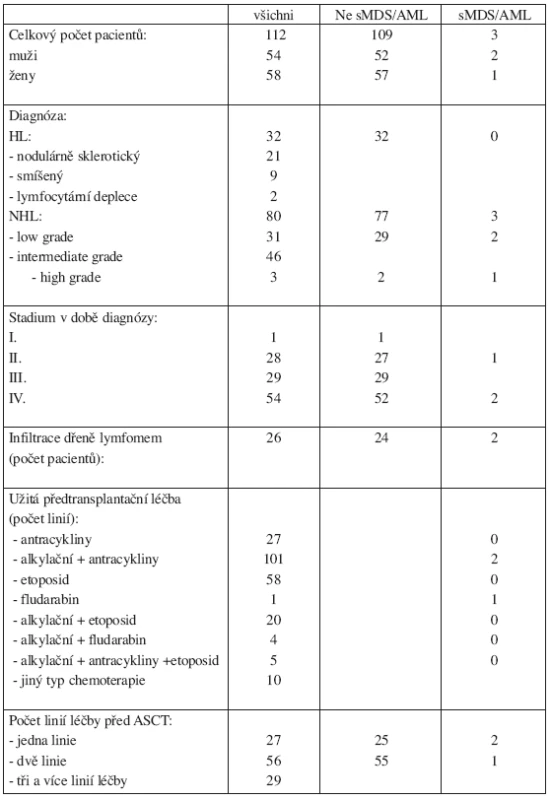
Soubor nemocných a metodika
Od ledna 1998 do prosince 2005 podstoupilo na našem oddělení 121 pacientů (58 mužů a 63 žen) s Hodgkinovým či ne-Hodgkinským lymfomem ASCT. Do výsledného hodnoceného souboru nebylo zařazeno devět pacientů, kteří zemřeli do šesti měsíců od provedení ASCT. Tři z hodnocených pacientů podstoupili ASCT dvakrát. Soubor nemocných byl hodnocen v červnu 2006. Výsledný hodnocený soubor je tedy tvořen 112 pacienty (54 mužů, 58 žen). Dle základní diagnózy bylo zastoupení nemocných následující: 32 pacientů s HL (21 pacientů s HL nodulárně sklerotický, 9 pacientů se smíšeným HL, 2 pacienti s HL chudým na lymfocyty) a 80 pacientů s NHL (31 pacientů s NHL low grade, 46 pacientů s NHL intermediate grade a 3 pacienti s high grade NHL). V době diagnózy se pouze u jednoho pacienta jednalo o stadium I., ve 28 případech o stadium II., ve 29 případech o stadium III., v 54 případech o stadium IV. Ve 26 případech (23 %) byla v době diagnózy NHL přítomna infiltrace kostní dřeně lymfomem. Medián intervalu sledování pacientů po prodělané ACST byl 41 měsíců (rozmezí 6–99 měsíců), medián věku v době transplantace byl 43 let (rozmezí 18–69 let). Naši nemocní byli předtransplantačně léčeni těmito druhy chemoterapií: režim s antracykliny byl použit ve 27 případech, kombinace alkylačního cytostatika s antracykliny ve 101 případech, kombinace alkylačního cytostatika s etoposidem ve 20 případech, kombinace alkylačního cytostatika s fludarabinem ve 4 případech, chemoterapie založena na etoposidu v 58 případech, kombinace alkylačního cytostatika, antracyklinu a etoposidu byla užita v 5 případech a u jednoho nemocného byl podán v monoterapii fludarabin. V 10 případech byl podán jiný druh chemoterapie (např. režim založený na podání metotrexátu či platinový režim). Před provedením ASCT podstoupilo 27 pacientů (24 %) jednu linii léčby, 56 pacientů (50 %) dvě linie léčby a 29 pacientů (26 %) tři linie léčby. Medián linií léčby na jednoho pacienta byl tedy 2 (1–3 linie). V souboru již nebyla zohledněna léčba případného relapsu lymfomu po ASCT. Radioterapii jako součást iniciální léčby lymfomu podstoupilo 51 (46 %) pacientů. U všech našich pacientů při provedení ASCT byl použit jako přípravný předtransplantační režim BEAM ve složení: D-6 carmustin 300 mg/m2, D-5 až D-2 cytosinarabinosid 200 mg/m2 2x denně, D-5 až D-2 etoposid 200 mg/m2 2x denně, D-1 melfalan 140 mg/m2s následným převodem periferních kmenových buněk jako štěpu v D0. Medián intervalu od diagnózy k transplantaci byl 24 měsíců (rozmezí 4–204 měsíců). V době transplantace bylo u 26 nemocných dosaženo l. CR (včetně uCR), u 47 nemocných 1. PR, u 6 nemocných 2. CR, u 29 nemocných bylo dosaženo 2. či 3. PR. V 7 případech se jednalo o relabující či refrakterní onemocnění. V době hodnocení výsledků zemřelo 28 pacientů (25 %) ze souboru. Nejčastější příčinou úmrtí, a to ve 23 případech (82 %), byla progrese základního onemocnění. Ve třech případech bylo úmrtí v důsledku septického šoku. V dalších případech došlo k úmrtí v důsledku trombotické trombocytopenické purpury, v důsledku krvácení do CNS (komplikace trombolytické léčby pro masivní embolii) a v posledním případě byl u pacienta příčinou úmrtí rozvoj glioblastomu. Diagnóza sMDS/AML byla stanovena na základě WHO kritérií (přetrvávající cytopenie, cytologický a histologický obraz dysplazie v kostní dřeni, přítomnost cytogenetických změn).
Tab. 2. Charakteristika souboru pacientů. 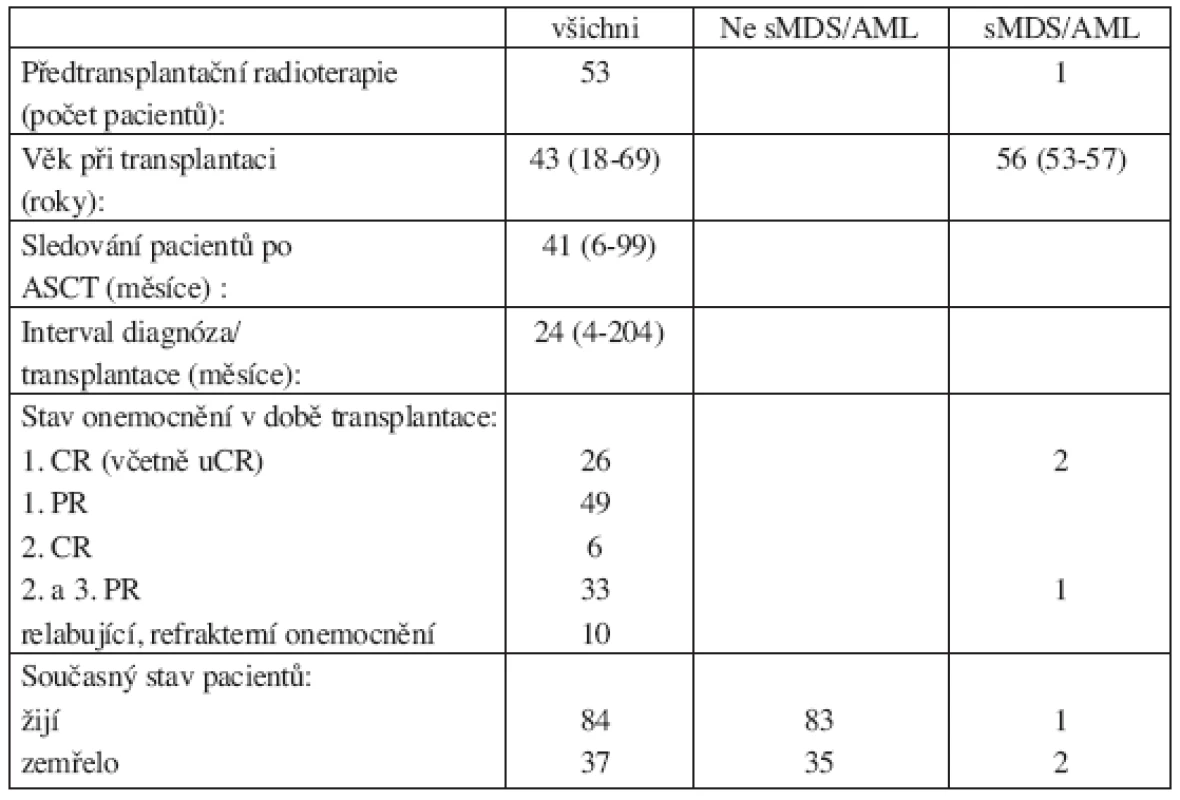
Výsledky
V našem souboru 112 pacientů, kteří podstoupili ASCT pro HL či NHL, jsme prokázali rozvoj sMDS/AML ve třech případech. Zjištěná hrubá incidence činila 2,5 %, 5letá kumulativní incidence je 3 %. Medián intervalu od transplantace k diagnóze sMDS/AML byl 24 měsíců (14–61 měsíců). Základním onemocněním u všech pacientů se stanovenou diagnózou sMDS/AML byl NHL: ve 2 případech NHL low grade a v l případě NHL high grade. Ve dvou případech v době diagnózy NHL se jednalo o stadium IV., v jednom případě o stadium II. Pouze u jednoho pacienta bylo iniciálně prokázáno postižení kostní dřeně lymfomem. Dva z těchto pacientů byli vstupně léčeni alkylačními cytostatiky s antracykliny a jeden nemocný v monoterapii fludarabinem. U dvou pacientů byla užita jedna linie léčby, u jednoho nemocného dvě linie léčby. Jeden pacient po iniciální léčbě s alkylačním a antracyklinovým režimem podstoupil následnou radioterapii. Z těchto výsledků vyplývá, že u žádného pacienta s rozvojem sMDS/AML nebyl iniciálně užit režim s etoposidem. Medián věku těchto nemocných v době transplantace byl o něco vyšší než v celém souboru, a to 56 let (53–57 let). Dva z těchto nemocných byli transplantováni v l. PR a poslední nemocný ve 2. PR. Ve dvou případech jsme diagnostikovali MDS typu RCMD dle WHO klasifikace. V jednom tomto případě byla zjištěna cytogenetická abnormalita delece 20q-. Jeden nemocný se sekundárním MDS po ASCT byl léčen pro relaps NHL radioimunoterapií, která se tak jistě mohla spolupodílet na rozvoji dysplastických změn. Tento pacient zemřel na progresi NHL. Druhý nemocný se sekundárním MDS je v dobrém klinickém stavu s remisí NHL a rovněž sMDS nevyžaduje léčbu. Ve třetím případě došlo k rozvoji sekundární AML s vyzráváním dle WHO klasifikace (typ M2 dle FAB klasifikace) bez přítomnosti cytogenetické abnormality. Tento nemocný zemřel na septický šok při bilaterální pneumonii po konsolidační chemoterapii.
Tab. 3. Tabulka charakteristiky pacientů sMDS/AML 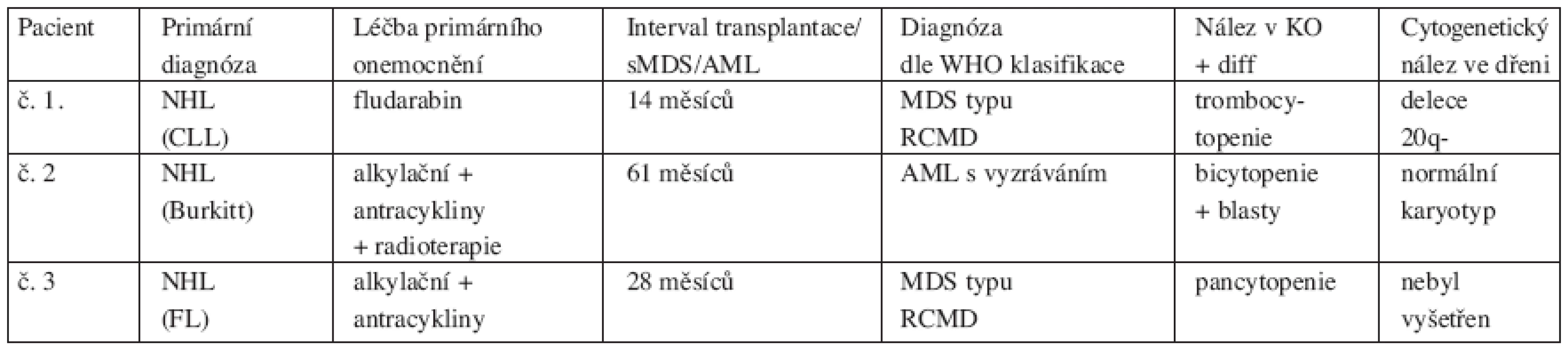
Vysvětlivky: CLL – chronická lymfatická leukemie, FL – folikulární lymfom Diskuse
Vysokodávkovaná chemoterapie s následnou ASCT je efektivní léčebnou metodou u vybraných pacientů s lymfoproliferativním onemocněním. S rozvojem ASCT od počátku 90. let začaly být rovněž publikovány první práce, které informovaly o vyšším riziku rozvoje sMDS/AML. V literatuře je publikováno několik velkých studií, které udávají incidenci rozvoje sMDS/AML po ASCT od 2 % do 12 % s mediánem sledování od 4 do 10 let (1–14).
Příčiny rozvoje sMDS/AML jsou jistě komplexní, ale dle závěrů těchto studií je shoda na některých nejzávažnějších rizikových faktorech. Patří k nim vyšší věk v době transplantace (nad 40 let), druh užité primární léčby včetně použití radiační terapie, použitý přípravný režim, typ použitého štěpu a počet transplantací (3, 4). V primární léčbě lymfomů jsou nejčastěji používána alkylační cytostatika, která mohou vést k chromozomálnímu poškození buněk. Bylo potvrzeno, že riziko rozvoje sMDS/AML je závislé na kumulativní dávce (1, 7). Dle řady studií je stejná rizikovost přisuzována i iniciální léčbě obsahující etoposid, avšak studie Metayera z roku 2003 tyto závěry nepotvrdila (8). V rámci iniciální léčby dále může zvýšit riziko rozvoje sMDS/AML užití fludarabinu (9) a v tomto případě je rovněž rozhodující kumulativní dávka užitá u pacienta. O leukemogenním potenciálu radioterapie není jistě sporu. Proto je zajímavé, že dosud pouze v jedné studii (5) bylo potvrzeno, že radioterapie na oblast pánve, která je součástí iniciální léčby, je významným rizikovým faktorem rozvoje sMDS/AML.
Na celou řadu rizikových faktorů není vyhraněný názor a závěry z různých studií jsou kontroverzní. Patří k nim například otázka histologického subtypu NHL či HL. Ve dvou studiích (4, 9) byla prokázána korelace mezi histologickým subtypem NHL a rizikovostí sMDS/AML. Častější rozvoj sMDS/AML byl v těchto studiích prokázán u nemocných s indolentními typy lymfomů. Vysvětlením je skutečnost, že tito nemocní častěji relabovali a byli tedy před ASCT léčeni více cykly chemoterapie než pacienti s agresivními typy lymfomů, kteří byli rychleji směřováni k provedení ASCT. Naopak v jiné studii (6) byla častější frekvence výskytu sMDS/AML u nemocných s HL oproti nemocným s NHL. Postižení kostní dřeně lymfomem je dalším z faktorů, u kterého je nejednotnost v názoru o jeho vztahu k sMDS/AML. Za rizikový jej například prokázala studie Micallefa z roku 2000 (9). Dle studie Milligana (4) je významným nezávislým rizikovým faktorem rozvoje sMDS/AML interval mezi diagnózou a transplantací, přičemž za rizikový byl prokázán interval delší než 5 let. Dle některých studií byl dalším rizikovým faktorem i nízký počet destiček v době provedení ASCT (5, 6). Dle třech publikovaných studií bylo zaznamenáno vyšší riziko rozvoje sMDS/AML při užití periferních kmenových buněk jako štěpu. Tato skutečnost je vysvětlována nutností užití stimulačních režimů a následně možným obsahem poškozených „preleukemických“ buněk ve štěpu (10, 12).
Velmi důležitým faktorem možného rizika sekundárního MDS či AML je druh užitého přípravného režimu. V mnoha studiích bylo opakovaně potvrzeno, že užití TBI v přípravném režimu patří k nejzásadnějším rizikovým faktorům rozvoje sMDS/AML (3, 4, 9). Toto se týká především při užití dávek nad 12 Gy. Za ještě více nebezpečnou je považována kombinace TBI s cyklofosfamidem či etoposidem v přípravném režimu. V Dana Farber Institutu (6) porovnávali skupinu pacientů s lymfomy, kteří obdrželi jako přípravný režim CBV (cyklofosfamid, carmustin, etoposid) oproti skupině nemocných s přípravným režimem TBI a cyklofosfamid. V první skupině byla prokázána incidence sMDS/AML 0,6 % a ve druhé skupině byla zjištěna incidence sMDS/AML 7,6 %. Na základě těchto publikovaných studií bylo již od použití TBI v přípravném režimu ASCT upuštěno. Incidence rozvoje sMDS/AML s užitím přípravného režimu BEAM dle studie Pedersena-Bjergaarda byla 4,1 % (7). Incidence rozvoje sMDS/AML u pacientů s lymfoproliferacemi, kteří byli léčeni pouze konvenční chemoterapií eventuálně v kombinaci s radioterapií, byla ve velkých studiích od 1,3 % do 3,1 % (1). Tato incidence je tedy velmi srovnatelná s incidencí rozvoje sMDS/AML po ASCT s užitím BEAM jako přípravného režimu.
V posledních letech byly publikovány výsledky tří randomizovaných studií, které se zabývaly užitím ASCT, která je součástí konsolidační léčby indolentních lymfomů. V roce 2003 byla publikována studie German Low-Grade Lymphoma Study Group, ve které byli pacienti s indolentními lymfomy po indukční léčbě randomizováni do dvou skupin. V první interferonové větvi bylo 5leté riziko rozvoje sekundárních malignit 0 %, oproti druhé větvi s provedením ASCT bylo prokázané riziko rozvoje sekundárních hematologických malignit 3,8 % (15). Vysoké riziko rozvoje sekundárních hematologických malignit, které dosáhlo 18,6 % v 5 letech, bylo zjištěno na základě výsledků studie GOELAMS (16). V této studii byl hodnocen benefit ASCT v první linii léčby versus standardní chemoterapie u pacientů s nově diagnostikovaným folikulárním lymfomem. Naproti tomu v podobně koncipované studii GELA nebyla prokázána zvýšená incidence sekundárních malignit včetně hematologických (17). Z výše uvedeného vyplývá, že rozvoj sekundárních malignit může významně snížit benefit ASCT, proto je nutno vysokodávkovanou chemoterapii s ASCT v první linii léčby u indolentních lymfomů ponechat pouze na určité podskupiny velmi rizikových nemocných. Vždy je nutno možné riziko rozvoje sMDS/AML brát na zřetel i při výběru indukční léčby a přípravného předtransplantačního režimu.
Závěr
V našem hodnoceném souboru 121 pacientů s lymfoproliferativním onemocnění typu HL či NHL, kteří podstoupili na našem pracovišti v letech 1998–2005 ASCT s přípravným režimem BEAM, jsme prokázali ve třech případech rozvoj sMDS/AML. Námi zjištěná hrubá incidence rozvoje sMDS/AML je 2,5 %, 5letá kumulativní incidence 3 %. Přípravný režim BEAM v tomto složení se tedy z hlediska rozvoje sMDS/AML jeví bezpečným režimem. Zjištěná incidence rozvoje sMDS/AML odpovídá riziku rozvoje sMDS/AML po konvenční chemoterapii. U pacientů, u kterých došlo ke vzniku sMDS/AML, jsme zaznamenali pouze vyšší věk v době transplantace oproti celé skupině pacientů. Toto zjištění je v souladu s publikovanými rizikovými faktory rozvoje sMDS/AML. Jistě bude zajímavé tento soubor nemocných dále sledovat a s časovým odstupem opět zhodnotit incidenci rozvoje sMDS/AML a ostatních sekundárních malignit.
Práce byla podpořena výzkumným záměrem MZO 00179906.
MUDr. P. Bělohlávková
II. interní klinika OKH FN a LF UK
Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: belohlavkova@fnhk.cz
Došlo do redakce: 18. 12. 2006
Přijato: 10. 1. 2008
Zdroje
1. Armitage JO, Carbone PO, Connors JM, et al. Treatment-related Myelodysplasia and acute Leukemia in non-Hodgkin’s Lymphoma Patients. J Clin Oncol 2003; 5 : 897 – 906.
2. Hosing C, Munsell M, Yazji S, et al. Risk of therapy-related myelodysplastic syndrome acute leukemia following high-dose therapy and autologous bone marrow transplantation for non-Hodgkin’s lymphoma. Annals of Oncol 2002; 13 : 450–459.
3. Darrington DL,Vose JM, Anderson JR, et al. Incidence and characterization of secondary myelodysplastic syndrome and acute myelogenous leukemia following high-dose chemoradiotherapy and autologous stem cell transplantation for lymphoid malignancies. J Clin Oncol 1994; 12 : 2527–2534.
4. Milligan DW, Ruiz de Elvira MC, Kolb HJ, et al. Secondary leukemia and myelodysplasia after autografting for lymphoma: Results from the EBMT – EBMT Lymphoma and Late Effects Working Parties. Br J Haematol 1999; 106 : 1020–1026.
5. Stone RM, Neuberg D, Soiffer R, et al. Myelodysplastic syndrome as a late complication following autologous bone marrow transplantation for non-Hodgkin lymphoma. J Clin Oncol 1994; 12 : 2535–2542.
6. Wheeler C, Khurshid A, Ibrahim J, et al. Low incidence of postransplant myelodysplastic/ acute leukemia in NHL patients autotransplanted after cyclophosphamid, carmustine and etoposide (CBV). Blood 1997; 385.
7. Pedersen-Bjergaard J, Pedersen M, Myhre J, et al. High risk of therapy-related leukemia after BEAM chemotherapy and autologous stem cell transplantation for previously treated lymphomas is mainly related to primary chemotherapy and not to the BEAM –transplantation procedure. Leukemia 1997; 11 : 1654–1660.
8. Metayer C, Curtis RE, Vose J. Myelodysplastic syndrome and acute myeloid leukemia after autrotransplantation for lymphoma: a multicenter case-control study. Blood 2003; 1 : 2015–2023.
9. Micallef INM, Lillington DM, Apostolidis J, et al. Therapy-related myelodysplasia and secondary acute myelogenous leukemia after high-dose therapy with autologous hematopoietic progenitor-cell support for lymphoid malignancies. J Clin Oncol 2000; 18 : 947–955.
10. Miller JS, Arthur DC, Litz CE et al. Myelodysplastic syndrome after autologous bone marrow transplantation: An additional late complication of curative cancer therapy. Blood 1994; 83 : 3780–3786.
11. Beauchamp-Nicoud A, Feneux D, Bayle Ch, et al. Therapy-related myelodysplasia and/or acute myeloid leukaemia after autologous heamatopoietic progenitor cell transplantation in a prospective single centre cohort of 221 patients. Br J Haematol 2003; 122 : 109–117.
12. Pedersen-Bjergaard J, Andersen MK, Christiansen DH. Therapy-related acute myeloid leukemia and myelodysplasia after high-dose chemotherapy and autologous stem cell transplantation. Blood 2000; 95 : 3273–3279.
13. Gilliland DG, Gribben JG. Evaluation of the Risk of Therapy-related MDS/AML after autologous stem cell transplantation. Biology of Blood and Marrow Transpl 2002; 8 : 9–16.
14. Howe R, Micallef INM, Inwards DJ, et al. Secondary myelodysplastic syndrome and acute myelogenous leukemia are significant complications following autologous stem cell transplantation for lymphoma. Bone Marrow Transpl 2003; 32 : 317–324.
15. Lenz G, Dreyling M, Schiegnitz E, et al. Myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission prolongs progression-free survival in follicular lymphoma: results of a prospective, randomized trial of the German Low-Grade Lymphoma Study Group. Blood 2004; 104 : 2667–2674.
16. Deconinck E, Foussard Ch, Milpied N, et al. High-dose therapy followed by autologous purged stem-cell transplantation and doxorubicin-based chemotherapy in patients with advanced follicular lymphoma: a randomized multicenter study by GOELAMS. Blood 2005; 105 : 3817–3823.
17. Sebban C, Belanger C, Brouse N, et al. Standard chemotherapy with interferon compared with CHOP followed by high-dose therapy with autologous stem cell transplantation in untreated patients with advanced follicular lymphoma: the GELF-94 randomized study from the Groupe d’Etude des Lymphomes de l’Adulte (GELA). Blood 2003; 102 : 104a.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Definice a klasifikace chronického onemocnění ledvin dle KDIGO
-
Všechny články tohoto čísla
- Sekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
- Plazmatické koncentrace solubilního endoglinu mají prognostický význam u nemocných s chronickou lymfocytární leukemií
- Klinické studie RNA vakcín
- Veno-okluzivní choroba jater (Sinusoidální obstrukční syndrom)
- OHD 2008
- Slovo úvodem
- Prenatální a postnatální imunohematologická vyšetření
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Veno-okluzivní choroba jater (Sinusoidální obstrukční syndrom)
- Prenatální a postnatální imunohematologická vyšetření
- Klinické studie RNA vakcín
- Sekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



