-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKlinické studie RNA vakcín
RNA vaccine – clinical studies
Immunotherapy using dendritic cells develops is considered as one of the possible treatments of patients with tumour diseases in the last years. These antigen presenting cells play important role in the induction of primary immune reaction on specific antigens. Data from in vitro studies of the efficiency of vaccines of dendritic cells loaded with individual tumour RNA provides promising information and the base for further dendritic cell vaccines development. Impact of RNA-transfected cell vaccine on T-cell immunity and preparation of therapeutic anticancer responses was first studied on murine models and acquired results subsequent clinical studies on humans. Following survey summarizes studies focused on the use of RNA vaccines in tumour patients.
Key words:
dendritic cell, RNA vaccine, transfection
Autoři: S. Dudová 1,2; J. Michálek 1,2,3; R. Hájek 1,2,4
Působiště autorů: Laboratoř experimentální hematologie a buněčné imunoterapie, Oddělení klinické hematologie, Fakultní nemocnice Brno, 2Lékařská fakulta Masarykovy Univerzity Brno, 3Fakultní nemocnice Brno, 4Interní hematoonkologická klinika Fakultní nemocnice Brno 1
Vyšlo v časopise: Transfuze Hematol. dnes,14, 2008, No. 1, p. 28-33.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Jako jedna z možností léčby pacientů s nádorovými onemocněními se v posledních letech rozvíjí imunoterapie s využitím dendritických buněk. Tyto antigen prezentující buňky hrají důležitou roli v indukci primární imunitní reakce na specifické antigeny. In vitro studie účinnosti vakcín dendritických buněk naložených individuálním antigenem ve formě nádorové RNA poskytují slibné údaje a základ pro další vývoj vakcín založených na dendritických buňkách. Vliv vakcinace RNA-transfekovanými buňkami na stimulaci T-buněčné imunity a terapeutických protinádorových odpovědí byl nejdříve studován u myších modelů a získané výsledky odůvodnily další klinické studie u lidí. Následující přehled shrnuje dosavadní studie zaměřené na použití RNA vakcín u pacientů s nádorovými onemocněními.
Klíčová slova:
dendritická buňka, RNA vakcína, transfekceVakcíny dendritických buněk naložených nádorovou RNA
Dendritické buňky (DB) jsou jedinečné antigeny prezentující buňky, které lze získat z prekurzorů periferní krve. Kultivací in vitro s nádorovými antigeny s přídavkem cytokinů získají DB schopnost zpracovat cizorodý antigen a předložit jej nezadaným T-lymfocytům, které tím získávají stimul k pomnožení, účinné obranné reakci a vytvoření paměťových buněk. Aplikace takto připravených DB nebo přímo cytotoxických T-lymfocytů (CTL) může vést k regresi maligního onemocnění. Jako nádorových antigenů se využívá peptidů, proteinů a extraktů z nádorových buněk, apoptotických tělísek nebo nukleových kyselin (1).
Pro přípravu vakcín je stále více využívána ribonukleová kyselina (RNA) kódující jednotlivé antigeny spojené s nádorem (tumor associated antigen, TAA) nebo celková nádorová RNA. Použití celkové nádorové RNA snižuje pravděpodobnost úniku nádorových buněk pomocí snížené exprese nebo kompletní ztráty individuálních nádorových antigenů (2, 3). Naproti tomu vakcína namířená proti 1 antigenu může působit pouze na některé nádorové buňky; určitý antigen může být exprimován jen malou skupinou nádorových buněk, zatímco ostatní buňky mají na svém povrchu významné, i když stále neidentifikované antigeny. Imunitní reakce vůči těmto sdíleným nádorovým antigenům není tak silná ve srovnání s individuálními antigeny a jejich podíl na celkové protinádorové odpovědi se může lišit u různých pacientů (4). Jiná studie ovšem uvádí, že použití DB s vnesenou nativní RNA izolovanou z nádoru nebo amplifikovanou nádorovou RNA vedlo k velmi nízké nebo žádné schopnosti reaktivovat T-lymfocyty v porovnání se specifickou RNA kódující určitý antigen (5). Potenciální nevýhodu použití celkové nádorové RNA představuje riziko autoimunity, kdy T-lymfocytům mohou být prezentovány vlastní peptidy, což může vyvolat imunitní odpověď na normální antigeny (4).
Stále ovšem není jisté, kolik DB a jaké množství RNA je nutné pro vyvolání imunitní odpovědi. Procento transfekovaných DB nepodává odpovídající informaci o schopnosti stimulace cytotoxických T-lymfocytů. Grunebach a kolektiv udávají i méně než 1 % transfekovaných DB jako dostatečné pro vyvolání tumor specifické CTL imunitní odpovědi (6). Jednotlivé druhy RNA se mohou chovat odlišně během jejich zpracování v závislosti na množství, sekvenci a velikosti. Dalším kritickým faktorem přípravy vakcíny může být odlišná účinnost transkripce různých mRNA molekul či různá rychlost odbourávání vzniklých proteinů (5, 7). Pozornost by také měla být věnována rozhodnutí, zda použít nativní nebo amplifikovanou nádorovou RNA.
Tab. 1. Vysvětlivky: T-buněčné odpovědi a léčebná účinnost představují počet reagujících z celkového počtu sledovaných pacientů, i.d. - intradermální podání vakcíny, i.v. – intravenózní podání vakcíny 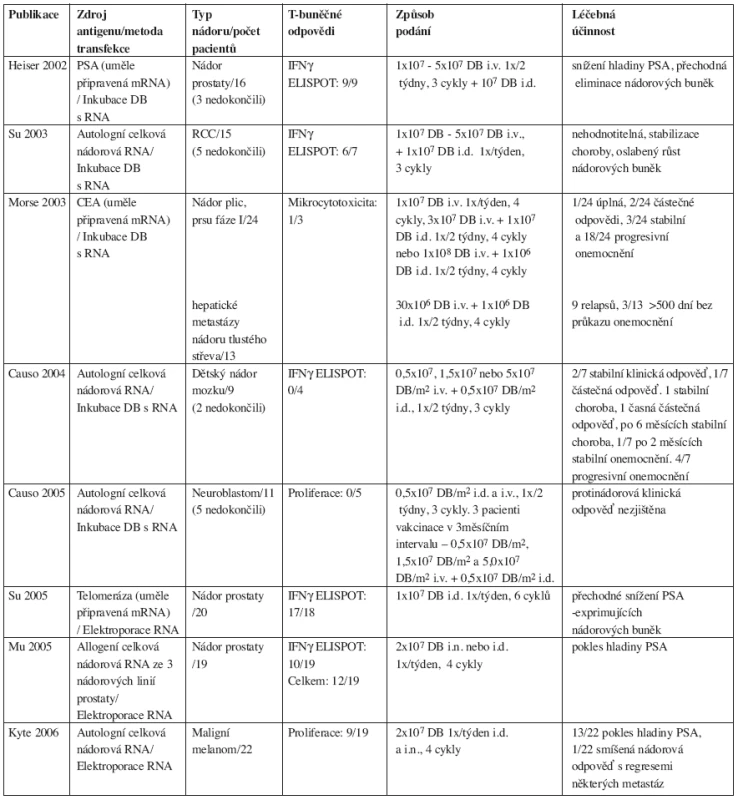
Klinické studie u pacientů s nádorovým onemocněním
Zatímco první pokusy s podáním protinádorových vakcín byly provedeny na myších v roce 1996 (8), vakcinační studie u lidí s využitím RNA-DB byla poprvé publikována Heiserem až v roce 2002 (9). Tato klinická studie fáze I sledovala bezpečnost a účinnost ve vyvolání T-buněčných odpovědí in vitro. Pro aplikaci RNA-transfekovaných DB byli vybrání pacienti s metastatickým nádorem prostaty. Rakovina prostaty je jedna z několika nádorových onemocnění, u kterých byl popsán vysoce specifický marker – prostata specifický antigen (PSA), který usnadňuje monitorování progrese onemocnění. Nezralé DB připravené z adherentních monocytů byly inkubovány s in vitro transkribovanou PSA RNA. Pacientům byly podávány geneticky modifikované DB ve zvyšujících se dávkách od 1x107 do 5x107 intravenózně a 107buněk intradermálně ve dvoutýdenních intervalech. Počty buněk byly vybrány na základě maximálního počtu buněk, které mohly být připraveny z dávky mononukleárních buněk periferní krve (MNPK) získaných během jednorázové leukaferézy. Vakcinace byla dobře snášena, byla pozorována pouze minimální toxicita omezená na kožní reakce stupně I a/nebo symptomy podobné chřipce. Prostatitida nebo zprostředkované autoimunitní onemocnění nebyly pozorovány. Pro stanovení, jestli podání PSA RNA-transfekovaných DB vede ke stimulaci T-buněčných odpovědí u léčených pacientů, autoři porovnávali počet PSA-specifických T - lymfocytů u vzorků MNPK před a po terapii s využitím IFN-γ ELISPOT eseje (10). Všichni pacienti měli po podání DB PSA-reaktivní INF-γ–sekretující T - buňky, zatímco před terapií nebyly INF - γ–sekretující T-buňky detekovatelné. U všech devíti testovaných pacientů bylo také zjištěno zvýšené zabíjení terčových buněk zprostředkované CD8+ T-buňkami HLA třídy I v porovnání se vzorky před vakcinací (test s uvolňujícím se chromem a PSA RNA-transfekovanými DB jako terčovými buňkami). Pro ověření vymizení nádorových buněk způsobené vakcinací byly pomocí real-time PCR hodnoceny hladiny PSA transkriptů v periferní krvi pacientů. Data od tří pacientů naznačují, že tři vakcinační cykly PSA RNA-transfekovaných DB byly spojeny s přechodnou eliminací nádorových buněk z periferního řečiště. U žádného z šesti sledovaných pacientů nebyly pozorovány klinické odpovědi (9).
Ve stejném roce byla publikována práce z Duke University Medical Center v Durhamu, NC, USA (11). Jeden pacient s metastazujícím adenokarcinomem v subkutánní tkáni a pulmonální uzlině byl ošetřen RNA-transfekovanými DB. DB byly modifikovány celkovou RNA izolovanou z autologních nádorových buněk pacienta, na rozdíl od předcházející studie, ve které byla použita samotná in vitro připravená PSA mRNA. Cílem tohoto postupu bylo vyvolání T-buněčných odpovědí proti různým antigenům namísto zacílení na jeden definovaný antigen. RNA byla vnesena do nezralých autologních DB lipofekcí. Pacient obdržel intravenózní infuzi 3x107 DB naložených autologní celkovou nádorovou RNA následovanou intradermální injekcí 1x106 buněk čtyři cykly po čtyřech týdnech vakcinace. Vakcinace byla dobře snášena, nebyla pozorována významná toxicita, ovšem klinická odpověď zjištěna nebyla, z důvodu pokračující progrese onemocnění. Autoři vyhodnocovali schopnost cytotoxických T-lymfocytů specificky in vitro lyzovat antigen-exprimující terčové buňky. MNPK použité pro testy cytotoxicity byly získány před imunizací, po imunizaci CEA RNA-transfekovanými DB (z jiné klinické studie) a po imunizaci celkovou nádorovou RNA-transfekovanými DB; jako terčové buňky byly použity DB transfekované celkovou nádorovou RNA a celkovou RNA z MNPK. MNPK získané po CEA RNA imunizaci a MNPK po imunizaci celkovou nádorovou RNA aktivovaly nádorově specifické CTL. Lytická aktivita MNPK získaných po imunizaci DB transfekovanými celkovou nádorovou RNA byla vyšší než aktivita MNPK získaných po imunizaci DB modifikovanými samotnou in vitro připravenou CEA RNA. Autoři předpokládají, že nádorové buňky exprimují vedle CEA také další proteiny, které slouží jako nádorové antigeny. Proto DB transfekované celkovou nádorovou RNA mohou vyvolávat odpovědi na různorodé a dosud neidentifikované antigeny, zatímco DB transfekované samotným CEA transkriptem stimulují pouze CEA-specifické odpovědi.
Studie fáze I byla provedena u pacientů s pokročilými nádory exprimujícími CEA antigen a byla následována fází II u pacientů s hepatickými metastázami nádoru tlustého střeva. Autoři použili nezralé DB naložené samotnou mRNA kódující CEA (12). I v této studii byly imunizace byly dobře snášeny, toxicita nebyla pozorována. Z 24 pacientů ve studii fáze I byla potvrzena 1 kompletní remise, 2 částečné odpovědi, 3 pacienti měli stabilní onemocnění a 18 progresivní chorobu. Vakcína CEA-DB byla podávána intravenózně i intradermálně. Vybraní pacienti byli v pokročilém stupni onemocnění; 1 pacient zemřel na komplikace spojené s myelodysplastickým syndromem, jehož přítomnost byla zpětně zjištěna již před zahájením léčby. U dalšího pacienta se zhoršila činnost jater masivní progresí hepatických metastáz během studie. U žádného pacienta se neobjevily klinické důkazy autoimunitního onemocnění. Ve studii fáze II 9 ze 13 pacientů relabovalo v období s mediánem 122 dní. Manifestace imunologických odpovědí byly prokázány pomocí biopsií v místě injekce DB a periferní krvi pacientů.
Dalším z nádorových onemocnění vybraných pro klinickou studii podání RNA-DB byl i karcinom ledvin (RCC, renal cell carcinoma). RCC je vysoce rezistentní na chemoterapii a dosud není standardní látka pro léčbu metastazujícího onemocnění. Avšak spontánní regrese RCC objevující se v některých případech naznačují, že nádorové buňky jsou citlivé na imunologické mechanismy (13). Su a kolektiv testovali přístup využívající RCC RNA-transfekované DB (14). V klinických zkouškách fáze I 10 pacientů s metastatickým RCC obdrželo nezralé zamražené DB, které byly transfekované celkovou RNA izolovanou z renální nádorové tkáně. Autoři nebyli schopni vyhodnotit potenciální vakcínou indukované klinické odpovědi, protože většina pacientů (8/10) dostávala sekundární terapii podávanou ve formě IL-2. Nicméně studie prokázala, že podání RCC RNA-transfekovaných DB je nejenom bezpečné a proveditelné, ale vedla také u 6 ze 7 pacientů k expanzi nádorově specifických polyklonálních T-buněk u léčených pacientů. Vakcínou vyvolané T-buněčné odpovědi byly namířeny proti několika odlišným antigenům včetně katalytické podjednotce telomerázy (hTERT), RCC-asociovanému antigenu G250 a onkofetálnímu antigenu (OFA), ale ne proti normálním buněčným antigenům exprimovaným normálními renálními tkáněmi. Pouze v jediném případě bylo prokázáno, že tumor specifické CTL lyzovaly autologní nádorové buňky. U dvou pacientů bylo prokázáno úplné vymizení metastatických lézí po přídatném chirurgickém zákroku nebo po podání adjuvans vysokodávkového IL-2, ale žádné po samotné vakcinaci. U přežívajících pacientů byla pozorována stabilizace choroby nebo oslabený růst nádorových buněk.
Telomerázová reverzní transkriptáza, hTERT, je reaktivována u většiny nádorů a proto představuje atraktivní cíl protinádorové imunoterapie. Klinické zkoušky fáze I byly provedeny u 20 pacientů s metastazujícím nádorem prostaty, kterým byly podány DB transfekované mRNA kódující chimerický protein hTERT/LAMP-1. LAMP-1 membránový protein asociovaný s lysozomem je odpovědný za současnou aktivaci hTERT-specifických CD4+ a CD8+ imunitních odpovědí. Šest injekcí 1x107modifikovaných DB bylo podáno intradermálně v týdenních intervalech. U devíti pacientů se po šesti cyklech vakcinace vyvinuly současně hTERT-specifické CD8+ a CD4+ T buněčné odpovědi. Podání bylo dobře tolerováno bez toxicity nebo autoimunitní odpovědi. V místech intradermálního podání po opakované vakcinaci byly zjištěny intenzivní infiltráty hTERT-specifických T buněk. U 19 z 20 pacientů byly sledovány expanze hTERT-specifických CD8+ T buněk v periferní krvi, jejichž hodnoty dosahovaly 0,9–1,8 % CD8+ T buněk vykazujících antigenní specifitu (15). Srovnatelných hodnot bylo dosaženo při vakcinaci proti infekčním patogenům (16).
Při transfekci DB lze využít jako zdroj RNA i alogenní buněčné linie nádoru prostaty. Modifikované buňky byly podány 20 pacientům, 19 z nich dokončilo vakcinaci. Každý pacient obdržel nejméně 4 injekce v týdenním intervalu obsahující 2x107 transfekovaných DB. Vakcína byla podávána intranodálně nebo intradermálně. Imunitní odpovědi byly měřeny testem oddáleného typu hypersenzitivity (delayed-type hypersensitivity, DTH) a in vitro imunotesty – ELISPOTem a stanovením T-buněčné proliferace ve vzorcích periferní krve před a po vakcinaci. Byly sledovány také hladiny sérového PSA. Podobně jako v jiných studiích nebyly pozorovány vážnější vedlejší účinky nebo toxicita. Celkem 12 pacientů si vytvořilo specifické imunitní odpovědi na podání DB transfekovaných nádorovou mRNA. U 13 subjektů byl prokázán pokles hladiny PSA, tento účinek byl podpořen pomocnými vakcinacemi. Klinický výsledek vakcinace byl v přímé souvislosti s imunitními odpověďmi (17).
Kyte a kolektiv použili jako vakcínu pro pacienty s maligním melanomem DB elektroporované autologní nádorovou mRNA a následně maturované. Cílem studie fáze I/II bylo zhodnocení vhodnosti a bezpečnosti vakcíny a schopnosti DB vyvolávat T-buněčné odpovědi u melanomových pacientů. Dále autoři porovnávali indradermální a intranodální aplikaci podání vakcíny. Bylo sledováno 22 pacientů, kterým byly podány 4 vakcíny s týdenním odstupem. Vakcínou vyvolaná specifická imunita byla zjištěna u 9 z 19 pacientů (hodnoceno pomocí testů proliferace, produkce IFN-γ T-buněk a ELISPOTu) a u 8 z 18 pacientů (hodnoceno reakcí hypersenzitivity opožděného typu). Rozdíl mezi způsobem podání vakcíny nebyl významný, u pacientů vakcinovaných intradermálně byla odpověď zjištěna u 7 z 10 sledovaných a u 3 pacientů z 12 vakcinovaných intranodálně (18).
Klinické zkoušky fáze I byly provedeny také u pediatrických pacientů a mladistvých s recidivou mozkového nádoru. Causo a kolektiv pro přípravu protinádorové vakcíny použili dendritické buňky naložené nádorovou RNA bez následné maturace DB. Pacientům byly podány nejméně tři vakcíny, každá představovala intravenózní a intradermální podání v dvoutýdenních intervalech. Po vakcinaci RNA-DB vykazovali 2 pacienti ze 7 stabilní klinickou odpověď a 1 částečnou odpověď. U 2 testovaných pacientů byly prokázány nádorově specifické imunitní odpovědi na RNA-DB. Vakcinace RNA-DB nevyvolala buněčnou nádorově specifickou imunitní reakci, i když došlo ke zvýšení buněčné odpovědi na nespecifické stimuly. V žádném z případů se neobjevily symptomy experimentální alergické encefalitidy (EAE) nebo jiných autoimunitních odpovědí. Tři pacienti vykazovali klinické odpovědi během léčby. Jeden pacient měl stabilní chorobu po 5 vakcínách a 21 měsících sledování, u 2. pacienta byla potvrzena časná částečná odpověď a po šesti měsících sledování stabilní choroba. Další pacient měl po dvou měsících sledování také stabilní onemocnění. U zbývajících čtyř pacientů bylo zjištěno progresivní onemocnění během studie (19).
V dalším roce byla publikována studie stejného kolektivu autorů, která sledovala vakcinaci 11 pediatrických pacientů s nově diagnostikovaným neuroblastomem stadia 4. Pacienti obdrželi dva cykly indukční léčby karboplatinou následované standardní chemoterapií, chirurgickou léčbou, radiací, vysoce dávkovanou terapií, podání kmenových buněk a RNA-DB vakcinační terapií. Vakcína DB byla podána 8 z 9 aferézovaným pacientům intradermálně a intravenózně v týdnech 0, 2 a 4 v množství 0,5x 107 buněk/m2. Tři pacienti se stabilním onemocněním byli zvoleni pro 3 následné vakcinace v 3měsíčním intervalu. Pro intravenózní podání byla použita zvyšující se dávka DB v množství 0,5x107 buněk/m2, 1,5x107 buněk/m2, a 5,0x107 buněk/m2. Intradermálně podané RNA-DB byly v množství 0,5x107 buněk/m2. U žádného ze 7 sledovaných pacientů nebyla pozorována léčebná odpověď. K progresi onemocnění, popř. smrti v souvislosti s onemocněním došlo u 10 z 11 pacientů s mediánem 14 a 19 měsíců od diagnózy. T-buněčné proliferační testy buněčné imunity nezjistily statisticky významné protinádorové odpovědi. Humorální protinádorová imunitní odpověď byla sledována pomocí metody ELISA. U dvou pacientů byly po třetím podání vakcíny zjištěny zvýšené hladiny specifických protilátek. U všech pacientů byly detekovány změny v poměru CD4+ a CD8+ T lymfocytů. Počty CD4+ buněk byly pod normální hladinou, zatímco CD8+ byly nad normálem. CD19+ buňky byly s výjimkou jednoho pacienta pod normální úrovní (20).
Namísto přípravy RNA od každého pacienta zvlášť může být použita RNA izolovaná z charakterizované vysoce imunogenní linie renálního karcinomu (RCC-26). Tyto DB byly schopné aktivovat efektorové a paměťové cytotoxické T-lymfocyty specificky zabíjející antigeny exprimované RCC-26 buněčnou liní. Tento postup může být použit u množství pacientů, navíc použitá linie je charakterizovaná a standardizovaná a může být dále použita pro monitorování stavu imunitního systému po vakcinaci (21).
Výhodu DB naložených RNA oproti užití autologních nádorových lyzátů či apoptotických nádorových buněk k naložení DB představuje možnost RNA amplifikace. Tato skutečnost je využitelná hlavně v případě malého množství nádorového materiálu. RNA templát lze dále modifikovat vnesením sekvencí, které zvyšují stabilitu a tak životnost RNA. Úpravy zahrnují například polyadenylaci nebo přidání sekvencí zlepšujících prezentaci antigenu zacílením translatovaného proteinu do specifických kompartmentů MHC. Vnesení RNA obsahující transkripty genů exprimovaných v nádorové buňce eliminuje potřebu selekce pacientů na základě HLA antigenů, což je omezení při použití antigenních peptidů. Další z výhod použití dendritických buněk naložených RNA představuje následné vyvolání jak CD4+, tak i CD8+ imunitní odpovědi po podání vakcíny.
U pacientů byly prokázány nádorově specifické T-buněčné odpovědi, což potvrzuje bioaktivitu těchto vakcín. Porovnání imunitních odpovědí a klinických odpovědí po podání vakcíny je ovšem rozporuplné. Ve většině studií byla pozorována prodloužená doba přežití pouze u některých pacientů. Tato zjištění naznačují prostor pro zlepšení vyhodnocovacích metod. Ve studiích byly prováděny imunoeseje na T-lymfocytech získaných z periferní krve. Je možné, že klinicky účinné T-buňky migrují do okolí nádoru a tyto T-buňky by potom měly být použity pro testy imunitní odpovědi. Nádorové vakcíny mohou stimulovat i nádorově specifické T-lymfocyty, které se nepodílí na eradikaci maligních buněk. Svou roli při neúspěchu v léčbě nádorového onemocnění hraje také omezený počet vakcinací a krátké očekávání přežití pacientů zařazených do studie.
Závěr
Preklinické in vitro a in vivo studie vyvolání antigen-specifických cytotoxických odpovědí s použitím den-dritických buněk transfekovaných definovanými tumor asociovanými antigeny nebo celkovou nádorovou RNA prokázaly použitelnost těchto metodik v léčbě nádorových onemocnění. Vakcíny byly využity v léčbě různých karcinomů jako například cervikální a kolorektální karcinom, karcinom prostaty, myelom, karcinom prsu, melanom, gliom, CLL, RCC nebo adenokarcinom. Ve všech klinických studiích bylo podání vakcíny dobře snášeno, bez závažné toxicity u pacientů, ale s minimální léčebnou účinností. Studie, které sledovaly účinnost vakcinační terapie RNA-transfekovaných DB naznačují směr pro léčbu pacientů s časnými stadii choroby, ovšem zůstává mnoho otázek včetně přípravy široce aplikovatelných klinických protokolů, nalezení optimálního zdroje DB pro klinické aplikace, účinného způsobu naložení DB antigeny či nejvhodnější způsob podání vakcíny. Úspěšná terapie nádorového onemocnění by měla vést k aktivaci nádorově specifických T-lymfocytů a její účinnost je dána typem a frekvencí těchto buněk. Tyto procedury vyžadují standardizaci pro usnadnění porovnání klinických výsledků v dalších in vivo studiích. Doposud patřily tyto experimentální postupy výhradně do rukou výzkumníků a nemůžou nahradit stávající léčebné metody.
Seznam použitých zkratek
CEA karcinoembryonální antigen
CTL cytotoxické T-lymfocyty
DB dendritická buňka
GFP zelený fluoreskující protein
GM-CSF granulocyty mikrofágy kolony stimulující faktor
hTERT telomerázová reverzní transkriptáza
i.d. intradermálně
i.v. intravenózně
IVT in vitro transkripce
MGUS monoklonální gamapatie nejasného významu
MM mnohočetný myelom
MNPK mononukleární buňky periferní krve
PSA prostata specifický antigen
RCC karcinom ledvin
RNA ribonukleová kyselina
Práce byla podpořena grantem IGA NR8945.
Mgr. Silvie Dudová
Kampus MU, ILBIT
Kamenice 5
625 00 Brno
sdudova@fnbrno.cz
Došlo do redakce: 23. 2. 2007
Přijato: 10. 1. 2008
Zdroje
1. Dudová S, Michálek J, Hájek R. RNA nádorové vakcíny na bázi dendritických buněk. Klinická onkologie 2005; 5 : 178-83.
2. Nair SK, Heiser A, Boczkowski D, et al. Induction of cytotoxic T cell responses and tumor immunity against unrelated tumors using telomerase reverse transcriptase RNA transfected dendritic cells. Nat Med 2000; 6(9): 1011–7.
3. Heiser A, Maurice MA, Yancey DR, et al. Human dendritic cells transfected with renal tumor RNA stimulate polyclonal T-cell responses against antigens expressed by primary and metastatic tumors. Cancer Res 2001; 61(8): 3388-93.
4. Gilboa, E. The risk of autoimmunity associated with tumor immunotherapy. Nat. Immunol. 2001; 2 : 789–792.
5. Javorovic M, Pohla H, Frankenberger B, et al. RNA transfer by electroporation into mature dendritic cells leading to reactivation of effector-memory cytotoxic T lymphocytes: a quantitative analysis. Mol Ther 2005; 12(4): 734-43.
6. Grunebach F, Muller MR, Nencioni A, et al. Delivery of tumor-derived RNA for the induction of cytotoxic T-lymphocytes. Gene Ther 2003; 10(5): 367-74.
7. Li X, Zhao X, Fang Y, et al. Generation of destabilized green fluorescent protein as a transcription reporter. J Biol Chem 1998; 273(52): 34970-5.
8. Boczkowski D, Nair SK, Snyder D, et al. Dendritic cells pulsed with RNA are potent antigen-presenting cells in vitro and in vivo. J Exp Med 1996; 184(2): 465-72.
9. Heiser A, Coleman D, Dannull J, et al. Autologous dendritic cells transfected with prostate-specific antigen RNA stimulate CTL responses against metastatic prostate tumors. J Clin Invest 2002; 109(3): 409-17.
10. Asai T, Storkus WJ, Whiteside TL, et al. Evaluation of the modified ELISPOT assay for gamma interferon production in cancer patients receiving antitumor vaccines. Clin Diagn Lab Immunol 2000; 7 : 145–154.
11. Nair SK, Morse M, Boczkowski D, et al. Induction of tumor-specific cytotoxic T lymphocytes in cancer patients by autologous tumor RNA-transfected dendritic cells. Ann Surg 2002; 235 : 540–549.
12. Morse MA, Nair SK, Mosca PJ, et al. Immunotherapy with autologous, human dendritic cells transfected with carcinoembryonic antigen mRNA. Cancer Invest 2003; 21(3): 341-9.
13. Glaspy JA. Therapeutic options in the management of renal cell carcinoma. Semin Oncol 2002; 29 : 41-46.
14. Su Z, Dannull J, Heiser A, et al. Immunological and clinical responses in metastatic renal cancer patients vaccinated with tumor RNA-transfected dendritic cells. Cancer Res 2003; 63(9): 2127-33.
15. Su Z, Dannull J, Yang BK, et al. Telomerase mRNA-Transfected Dendritic Cells Stimulate Antigen-Specific CD8+ and CD4+ T Cell Responses in Patients with Metastatic Prostate Cancer 2005, 174 : 3798-3807.
16. Wong P, Pamer EG. CD8 T cell responses to infectious pathogens. Annu Rev Immunol 2003; 21 : 29-70.
17. Mu LJ, Kyte JA, Kvalheim G, et al. Immunotherapy with allotumour mRNA-transfected dendritic cells in androgen-resistant prostate cancer patients. Br J Cancer 2005; 93(7): 749-56.
18. Kyte JA, Mu L, Aamdal S, et al. Phase I/II trial of melanoma therapy with dendritic cells transfected with autologous tumor-mRNA. Cancer Gene Ther 2006; 13(10): 905-18.
19. Caruso DA, Orme LM, Neale AM, et al. Results of a phase 1 study utilizing monocyte-derived dendritic cells pulsed with tumor RNA in children and young adults with brain cancer. Neuro-oncol 2004; 6(3): 236-46.
20. Caruso DA, Orme LM, Amor GM, et al. Results of a Phase I study utilizing monocyte-derived dendritic cells pulsed with tumor RNA in children with Stage 4 neuroblastoma. Cancer 2005; 103(6): 1280-91.
21. Geiger C, Regn S, Weinzierl A, et al. A generic RNA-pulsed dendritic cell vaccine strategy for renal cell carcinoma. J Transl Med 2005; 3 : 29.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek OHD 2008Článek Slovo úvodem
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2008 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Ferinject: správně indikovat, správně podat, správně vykázat
-
Všechny články tohoto čísla
- Sekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
- Plazmatické koncentrace solubilního endoglinu mají prognostický význam u nemocných s chronickou lymfocytární leukemií
- Klinické studie RNA vakcín
- Veno-okluzivní choroba jater (Sinusoidální obstrukční syndrom)
- OHD 2008
- Slovo úvodem
- Prenatální a postnatální imunohematologická vyšetření
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Veno-okluzivní choroba jater (Sinusoidální obstrukční syndrom)
- Prenatální a postnatální imunohematologická vyšetření
- Klinické studie RNA vakcín
- Sekundární MDS/AML po autologní transplantaci pro lymfom s použitím BEAM jako přípravného režimu: zkušenosti jednoho pracoviště
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



