-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
Steroid-refractory acute graft-versus-host disease (GVHD)
Graft-versus-host disease (GVHD) represents one of the main complications after performance of allogeneic hematopoietic stem cell transplantation. T-lymphocytes from the graft are responsible for GVHD. Acute GVHD (aGVHD) develops within the day +100 after allogeneic transplantation, aGVHD impacts usually skin, liver or mucosa of gastrointestinal tract. The clinical manifestation of aGVHD is various and it represents mostly combination of impairment of more organs. Corticosteroids in dose 2 mg/kg are the standard first-line treatment, however, they are effective in 50% of patients only. Corticosteroid-resistant aGVHD is difficult to manage, and it is associated with high morbidity and mortality. Definition of steroid-resistant aGVHD varied, it is usually no response to corticosteroids after 3-14 days of treatment. The article summaries treatment possibilities in steroid-refractory aGVHD, with inclusion of the results of clinical trials published on this topic. Treatment of steroid-refractory aGVHD can be divided into four groups. The non-specific elimination of T-lymfocytes is used in the first group, representative agents are antithymocyte globulin, antilymphocyte globulin, alemtuzumab, denileukin diftitox and monoclonal antibodies anti-CD2, anti-CD3, anti-CD147. The drugs influencing cytokines or their receptors are in the second group, such as daclizumab (antibody against receptor for interleukin-2), infliximab and etanercept (inhibitors of tumor necrosis factor). The third group includes cytostatics and immunosuppressive agents, such as cyclophosphamide, methotrexate, mycophenolate mofetil, pentostatin, sirolimus. The cell therapy and other possibilities, such as treatment with rituximab and extracorporeal photopheresis are discussed in the fourth group. All treatment approaches for steroid-refractory GVHD are only partially efficient. Steroid-refractory aGVHD remains a serious therapeutic problem.
Key words:
acute GVHD, steroid-refractory, treatment
Autoři: J. Mayer 1; P. Cetkovský 2; M. Krejčí 1
Působiště autorů: Interní hematoonkologická klinika FN Brno 1; Ústav hematologie a krevní transfúze Praha za organizaci Česká leukemická skupina – pro život, The CzEch Leukemia Study Group – for Life, CELL 2
Vyšlo v časopise: Transfuze Hematol. dnes,13, 2007, No. 4, p. 192-199.
Kategorie: Souhrnné práce, původní práce, kazuistiky
Souhrn
Reakce štěpu proti hostiteli (graft-versus-host disease, GVHD) představuje jednu z hlavních komplikací po provedení alogenní transplantace krvetvorných buněk. Za GVHD jsou odpovědny T-lymfocyty v transplantátu. K rozvoji akutní GVHD (aGVHD) dochází do dne +100 od provedení transplantace, aGVHD postihuje zpravidla kůži, játra nebo sliznice trávicího traktu, její klinický obraz je velmi pestrý a představuje většinou kombinaci postižení více orgánů. Standardní terapií první linie jsou kortikoidy v dávce 2 mg/kg, tato terapie je účinná asi u 50 % pacientů. Steroid-rezistentní GVHD je obtížně terapeuticky zvladatelná a je spojena s vysokou morbiditou i mortalitou. Za steroid-rezistentní je GVHD považována zpravidla tehdy, pokud nedojde k léčebné odpovědi na podání kortikosteroidů do 3–14 dní. Práce rekapituluje léčebné možnosti u steroid-rezistentní aGVHD, sumarizuje výsledky klinických studií, které byly dosud na toto téma publikovány. Terapii steroid-refrakterní aGVHD lze rozdělit do 4 skupin. Do první léčebné skupiny, využívající nespecifickou eliminaci T lymfocytů, patří antithymocytární globulin, antilymfocytární globulin, alemtuzumab, denileukin diftitox a protilátky proti CD2, CD3, CD147. Druhou skupinu tvoří preparáty ovlivňující cytokiny nebo jejich receptory, jedná se o daclizumab (protilátka proti receptoru pro interleukin 2), dále infliximab a etanercept (preparáty blokující tumor nekrotizující faktor). Třetí skupinu tvoří cytostatika a nespecifická imunosupresiva, jako například cyklofosfamid, metotrexát, mykofenolát mofetil, pentostatin, sirolimus. Poslední skupina zahrnuje buněčnou terapii a další postupy, jedná se o možné využití mesenchymálních kmenových buněk, rituximabu a extrakorporální fototerapie. Všechny uvedené terapeutické postupy vykazují pouze částečnou účinnost. Steroid-rezistentní aGVHD zůstává i nadále závažným terapeutickým problémem.
Klíčová slova:
akutní GVHD, steroid-rezistentní, terapieÚvod
Reakce transplantátu (štěpu) proti hostiteli (GVHD, graft-versus-host disease) je nedílnou součástí léčebné procedury transplantace krvetvorných buněk. Je jednoznačně spjata s pozitivní reakcí transplantátu proti leukemii (a obecně proti tumoru). Za GVHD jsou odpovědny lymfocyty v transplantátu. Odstranění lymfocytů, tzv. T-buněčná deplece, eliminuje GVHD, ale přináší zase další negativa: vyšší frekvenci selhání transplantátů (rejekcí) a relapsů. Toto jednoduché několikavěté vyjádření je ovšem výsledkem rozsáhlého poznávání zcela neznámých imunologických aspektů transplantací, obrovského množství experimentů a řady klinických studií. Můžeme říci, že výzkumy v této oblasti se odehrávají od 50. let 20. století (1, 2). Klasická práce na toto téma (3) tato fakta elegantně vyjadřuje graficky obrázek 1.
Obr. 1. Význam typu transplantátu a GVHD na frekvenci relapsů u nemocných s leukemiemi. Podle: Horowitz et al., Blood 1990 (3) 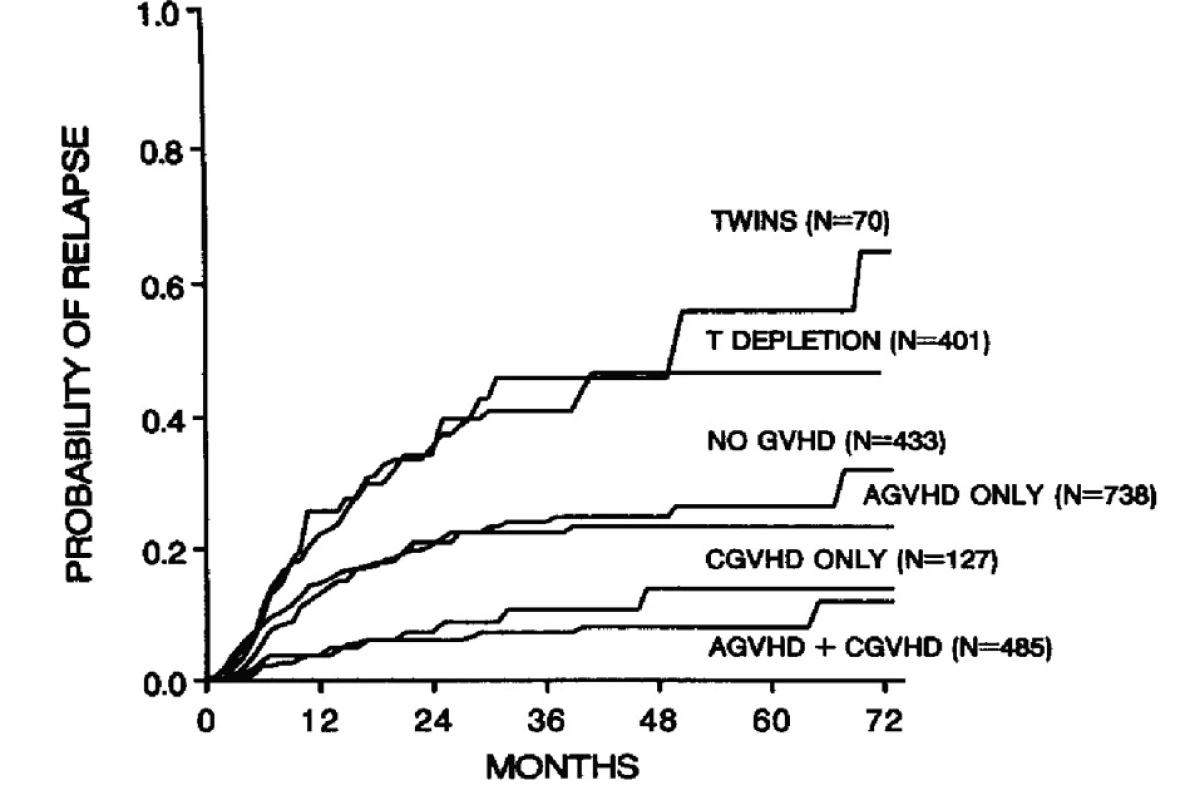
Dnes je frekvence GVHD různě modifikována podáváním anti-T-lymfocytárního globulinu (ATG) nebo alemtuzumabu (4), ale tyto principy zůstávají stále platné. Bez deplece T buněk je výskyt akutní GVHD v desítkách procent v závislosti na různých rizikových faktorech.
Akutní GVHD (aGVHD) zpravidla postihuje kůži, játra a/nebo střevo. Tyto orgány mohou být postiženy izolovaně nebo v různých kombinacích a různě intenzivně, od relativně lehkého postižení po extrémně závažné. Intenzita postižení jednotlivých orgánů se hodnotí jako stadium (stage) 1–4. Celkově se GVHD podle kombinace a stadia postižení jednotlivých orgánů hodnotí stupněm (grade) I-IV (5). Standardní terapií první linie jsou kortikoidy v dávce okolo 2 mg/kg prednisonu denně. Tato terapie je účinná, ale bohužel, jen asi u poloviny případů (6). Při neúspěchu této léčby hovoříme o steroid - -rezistenci a jedná se o mimořádně závažný stav. Nemocný je bezprostředně ohrožen na životě a může zemřít nejčastěji na progresi GVHD nebo nějakou závažnou infekci. Účelem tohoto sdělení je jednoduchým edukačním způsobem zmínit jaké jsou možnosti zvládání této mimořádně závažné potransplantační komplikace, jen velmi zřídka diskutované v české literatuře (7).
Steroid-rezistentní aGVHD
Data z poslední doby jasně hovoří o tom, že aGVHD obecně je mimořádně závažný stav. McMillan et al. (6) udávají přežití u 443 pacientů v jednom roce po zahájení terapie aGVHD steroidy jen 53 % s tím, že příčinami smrti bylo GVHD v 89 %, relaps v 6 % a spolupodíl infekce v 67 %. Také Van Lint et al. (8) udávají závažná data. Nemocní, kteří reagovali na iniciální terapii steroidy, měli 27% úmrtnost v souvislosti s provedením transplantace (transplant-related mortality, TRM) oproti 47 % u nereagujících nemocných a pětileté přežití se také signifikantně lišilo: 53 % oproti 35 %. Zbývá uvést, jak je vlastně steroid-rezistence, nebo-li potřeba zahájit terapii druhé linie, definována. Kupodivu, tato zásadní otázka není zcela jasná a jednoznačná. Jedním z aspektů je dávka steroidů, po níž není dosaženo léčebné odpovědi. Z jednoho průzkumu transplantačních center vyplynulo, že tato dávka je definována různě a kolísá od 1–2 mg/kg/den až po více než 20 mg/kg/den. Zpravidla se ale terapie aGVHD začíná dávkou okolo 2 mg/kg/den (9). Mimořádně důležité je i časové hledisko, za jak dlouho po nasazení steroidů se mají objevit známky léčebné odpovědi. Zde také čas velmi kolísá, zpravidla mezi 3–14 dny, a zohledňuje se i dynamika GVHD. Například:
- progrese GVHD kdykoliv po prvních 3 dnech po nasazení steroidů, nelepšení se GVHD stupně III a IV po 7 dnech terapie, nebo nelepšení se GVHD stupně II po 14 dnech terapie (10);
- GVHD beze známek léčebné odpovědi po 5 dnech terapie (8);
- GVHD beze známek léčebné odpovědi na kůži 7. den, progrese kožního nálezu nebo nelepšení se viscerální GVHD po 3 dnech terapie, progrese viscerálního nálezu po 2 dnech terapie, progrese do orgánového stadia 4 po 1 dni terapie (11);
- progrese aGVHD po alespoň 4 dnech terapie steroidy nebo nezlepšování po terapii trvající 7 dnů (12);
- progrese GVHD po alespoň 3 dnech terapie steroidy, beze změny po 7 dnech, méně než kompletní remise po 14 dnech, nebo návrat GVHD při snižování kortikoidů při dávce stále alespoň 50 mg/den (13);
- GVHD stupně II-IV při terapii steroidy 2 mg/kg/den 48 hodin beze známek zlepšování nebo dokonce se zhoršováním (14).
Jaké jsou tedy možnosti sekundární terapie aGVHD po selhání terapie steroidy, ať ji již definujeme jakkoliv? Paradoxně rozsáhlé, i velmi limitované. Rozsáhlé z toho úhlu pohledu, že existuje více než 20 možností, jak k tomuto problému přistoupit, a některé možnosti ani nejsou v ČR běžně dostupné. Na druhé straně, právě tato plejáda postupů ukazuje, že každý má asi své nedostatky a že de facto není nic spolehlivého, jak tuto mimořádně závažnou situaci zvládat. Principiálně lze sekundární imunitu ovlivňující léčebné metody didakticky rozdělit do několika kategorií:
- nespecifická eliminace T lymfocytů
- postupy ovlivňující cytokiny nebo jejich receptory
- cytostatika, nespecifická imunosupresiva
- buněčná terapie a další postupy
Absolutně zásadní a neopomenutelná je také mimořádně komplexní podpůrná léčba. Dá se říci, že nemocní se závažnou steroid-rezistentní GVHD jsou jedni z nejkomplikovanějších pacientů vůbec. Mimořádné nároky jsou kladeny zvláště na monitorování různých oportunních infekcí a na jejich léčbu. Tito nemocní jsou často dlouhodobě v zásadní hluboké imunosupresi a zápasí se s torpidními virovými (CMV, BKV, adenoviry) a mykotickými infekcemi (plísně).
Hodnocení léčebné odpovědi na terapii steroid-refrakterní GVHD je zpravidla jako kompletní remise (CR) a parciální remise (PR). Naprosto zásadní je ale přežití v určitém časovém období po zahájení terapie. Definice CR je evidentní, vymizení všech známek GVHD na všech postižených orgánech. PR se definuje jako zlepšení celkového GVHD skóre (grade) o 1 stupeň (15). Jiná definice zahrnuje zlepšení alespoň 1 orgánu o alespoň 1 stadium (stage) a nesmí přitom dojít ke zhoršení u jiného orgánu (16). Může se také definovat léčebná odpověď pro jednotlivé orgány a tam je PR definována jako zlepšení minimálně o 1 stupeň (stage) (16). Existuje i smíšená odpověď (mixed response), kdy dochází zároveň ke zlepšování i ke zhoršování u různých orgánů. Celková progrese znamená zhoršení alespoň u 1 orgánu bez zlepšení na jiném a stabilní choroba znamená celkovou stabilitu bez zhoršování nebo zlepšování u různých orgánů (17).
Během terapie steroid-rezistentní GVHD, se zpravidla ponechává úvodní imunosuprese, většinou kalcineurinové inhibitory (cyklosporin A, takrolimus) s kortikoidy, další lék se přidává. Konkrétní situaci ale řeší konkrétní protokoly na tom či onom pracovišti.
Nespecifická eliminace T lymfocytů
Sem můžeme zařadit několik postupů, například anti-thymocytární globulin (ATG), antilymfocytární globulin (ALG), alemtuzumab, protilátky proti CD2, CD3, CD147 a denileukin diftitox.
ATG/ALG
Jedná se o polyklonální přípravky obsahující zvířecí protilátky proti lidským lymfoidním buňkám. Jde o několik typů preparátů, které rozhodně nelze považovat za zaměnitelné. Každý se vyrábí jiným způsobem a imunizací jiných zvířat a proto je nutné vždy přesně udávat, o jaký jde preparát (18), což, bohužel, není někdy respektováno. Je s podivem, že přestože se s těmito preparáty pracuje již od 60. let 20. století (19) a jde tedy o jedny z nejstarších imunosupresiv, jejich role v profylaxi a terapii GVHD není dodnes zcela uspokojivě a jednoznačně vyřešena. V současné době jsou k dispozici tyto preparáty: Thymoglobulin (králičí), Lymphoglobuline (koňský), ATG Fresenius (S) (králičí) a Atgam (koňský). Poslední preparát není u nás registrován. ATG je dlouhodobě používán jako záchranná terapie aGVHD, léčebné odpovědi (CR+PR) jsou variabilní a kolísají v rozmezí 30–80 %. Přehled klinických studií testujících ATG v terapii steroid-rezistentní aGVHD je uveden v tabulce 1, jedná se většinou o menší soubory nemocných. Van Lint et al. (8) publikovali randomizovanou klinickou studii, v níž 61 pacientů se steroid-rezistentní aGVHD v rámci terapie druhé linie dostávalo vyšší dávku kortikoidů samostatně nebo spolu s ATG. Skupina s ATG dosáhla 55 % léčebných odpovědí (CR+PR), skupina bez ATG 48 %, ke zhoršení GVHD či úmrtí došlo u 26 % nemocných ve větvi s ATG a u 15 % ve větvi bez ATG, rozdíly mezi skupinami však nebyly statisticky významné. Další randomizovaná studie srovnávající ATG s preparátem ABX-CBL (monoklonální protilátka anti-CD147) v terapii steroid-rezistentní aGVHD u 95 pacientů uvádí následující výsledky: 57 % léčebných odpovědí a 45 % přežití po 18 měsících v rameni s ATG, 56 % léčebných odpovědí a 35 % přežití po 18 měsících v rameni s ABX-CBL (23).
Tab. 1. Výsledky některých větších studií testujících ATG pro terapii steroid-rezistentní aGVHD. 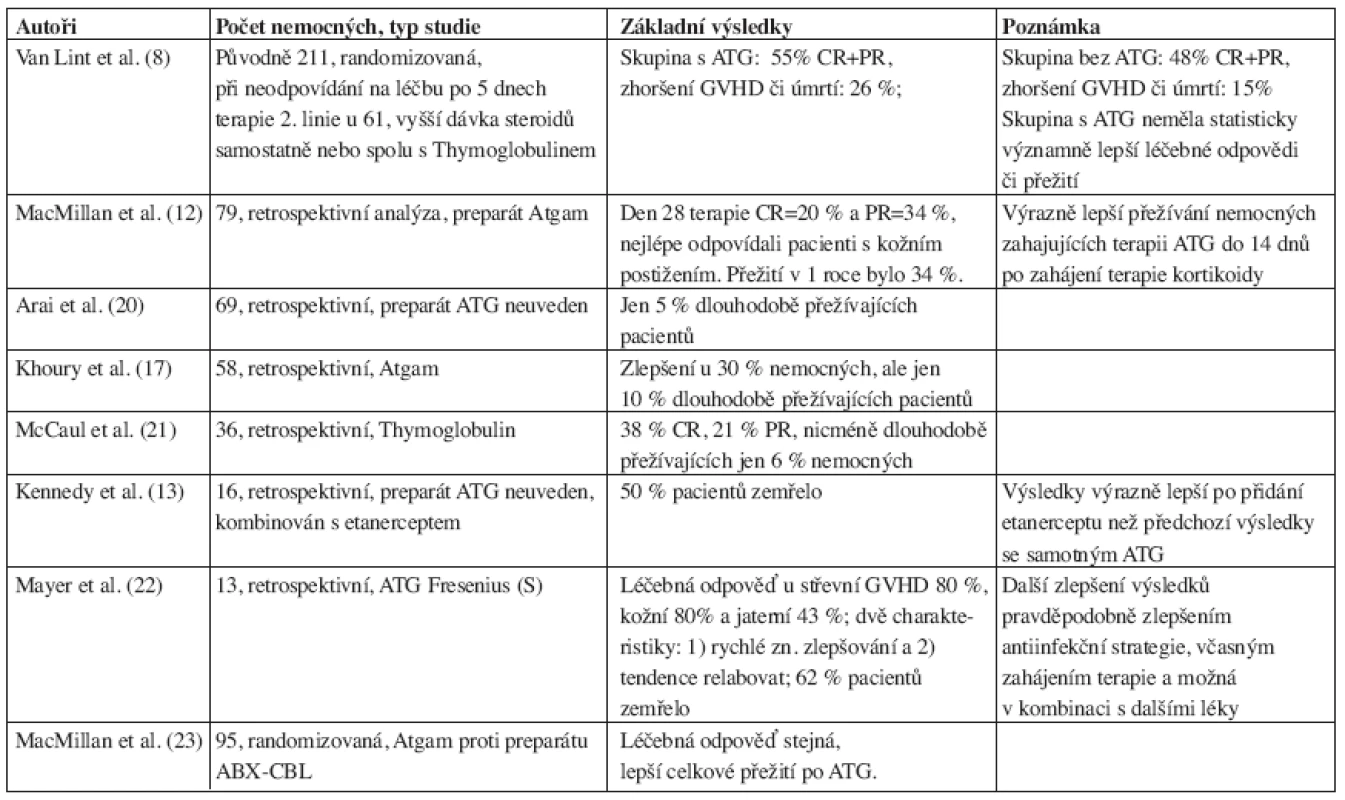
Anti-CD3 protilátky
Muromonab-CD3 (OKT3) je myší monoklonální protilátka proti struktuře CD3. Ze dvou větších studií se neukázala mimořádná účinnost. Knop et al. (24) udávají 69 % léčebných odpovědí a 12 % CR při použití ve 2. nebo další linii léčby. Medián přežití při použití ve 2. linii byl 146 dnů oproti 46 dnům při použití ve 3. linii. V randomizované studii zkoumající OKT3 plus vysoké dávky steroidů oproti vysokým dávkám steroidů v monoterapii jako léčby steroid-rezistentní GVHD se sice ukázala lepší léčebná odpověď kombinované terapie, ale ne celkové přežití (24).
Alemtuzumab
Přestože se jedná o potentní T buňky depletující látku (anti-CD52), která je poměrně hojně využívána v profylaxi GVHD, prací na použití alemtuzumabu pro terapii aGVHD je kupodivu velmi málo a jedná se buďto o kazuistiky, nebo velmi malé soubory nemocných (4). Správné dávkování není známo. Výsledky jsou rozporuplné, pozitivní (25-27) i smíšené (28). Asi největší soubor obsahoval 10 nemocných, z nichž 7 zemřelo (29). Tento postup jistě vyžaduje další klinický výzkum a stále se objevují nová data (30, 31). Lék je v ČR registrován (MabCampath).
Další látky
Jedná se zpravidla o menší studie a výsledky jsou shrnuty v tabulce 2. Tyto látky nejsou běžně k dispozici.
Tab. 2. Další látky eliminující imunokompetentní buňky v terapii steroid-rezistetní GVHD. 
Denileukin diftitox
Tato látka již částečně patří do další skupiny (viz další kapitola). Jde o rekombinantní fúzní protein kombinující difterický toxin a interleukin-2 (IL-2). Tato látka se preferenčně váže na vysokoafinitní receptor pro IL-2 aktivovaných T lymfocytů, po internalizaci se uvolní toxická část a zabíjí T lymfocyty. Preparát není v ČR registrován, vyrábí se v USA pod názvem Ontak. Existují 2 práce publikované in extenso testující denileukin diftitox pro terapii steroid-rezistentní GVHD (35, 36). První práce byla studie fáze I testující optimální dávku. Shaughnessy et al. (36) popisují léčebné zkušenosti u 22 nemocných. Časně bylo dosaženo léčebné odpovědi u 41 % nemocných, den 100 ale již jen u 27 %, docházelo k relapsům. Medián přežití byl 121 dnů. Autoři diskutují potenciální problémy této terapie, neboť se v poslední době jasně ukázalo, že existují také kriticky důležité imunoregulační T lymfocyty, které jsou CD4+/CD25+ a CD25 je receptor pro IL-2.
Postupy ovlivňující cytokiny nebo jejich receptory
Největší zkušenosti jsou s komerčně dostupnými preparáty blokujícími IL-2 nebo TNF. Byla publikována řada prací a ty větší zde rozebereme. Existují ale i další preparáty. Ani zde se nezdá, že některý z postupů by byl mimořádně účinný a převyšoval ostatní.
Blokace IL-2
Nejvíce se uplatňují monoklonální protilátky proti α řetězci receptoru pro IL-2. Jde o daclizumab, humanizovanou protilátku (Zenapax) a basiliximab, chimerickou protilátku (Simulect). Oba léky se používají především u transplantací solidních orgánů, kde snižují riziko akutních rejekcí, a jsou v ČR registrovány. Kupodivu, v profylaxi nebo v primární terapii GVHD se blokace receptoru pro IL-2 neosvědčila.
Daclizumab.
Zprávy o jeho využití pro terapii steroid-rezistentní GVHD jsou velmi protichůdné. První větší publikace se objevila v roce 2000 (16) a výsledky některých zásadnějších prací jsou uvedeny v tabulce 3. Na první pohled je patrná různorodost těchto výsledků. Je to pravděpodobně způsobeno rozdílnou definicí steroid-rezistentní GVHD a celkovým přístupem k této komplikaci. Další zajímavé uplatnění daclizumabu popisují Wolff et al. (41). Používali jej místo kalcineurinových inhibitorů (cyklosporin A, takrolimus) u nemocných s mikroangiopatickou hemolytickou anémií, která těmito inhibitory může být způsobena, přičemž většina nemocných měla také GVHD. Weisser et al. (42) uvádějí pozitivní zkušenosti s kombinací daclizumab a sirolimus u střevní GVHD (45% přežití ve 2 letech). V případě kombinace s postižením jater byla prognóza výrazně horší (5% přežití ve 2 letech). Upozorňují také na výrazné riziko oportunních infekcí.
Tab. 3. Přehled některých větších studií s daclizumabem u steroid-rezistentní GVHD. 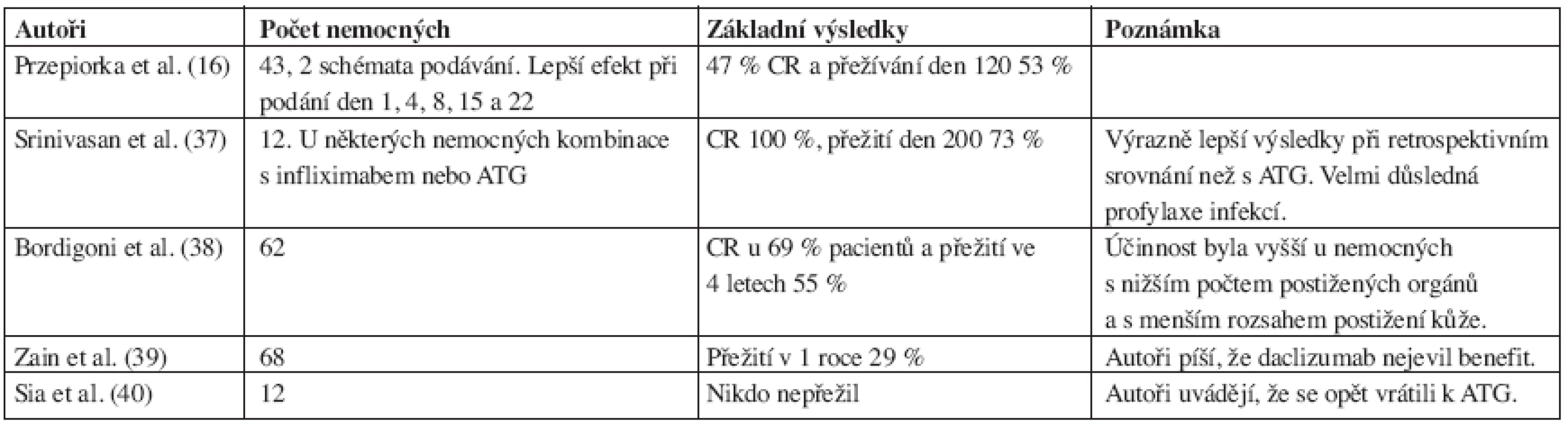
Basiliximab.
Výsledky 3 větších nerandomizovaných studií jsou podobné a jsou uvedeny v tabulce 4.
Tab. 4. Přehled studií s basiliximabem u steroid-rezistentní GVHD. 
Inolimomab.
Jde o myší monoklonální protilátku zaměřenou také proti α řetězci receptoru pro IL-2. Publikovaná data se nezdají být odlišná od výsledků s daclizumabem a basiliximabem (45, 46).
Blokace TNF (tumor necrosis factor α)
Zde se nejvíce uplatňují 2 preparáty, infliximab (Remicade) a etanercept (Enbrel). Oba jsou dostupné v ČR a jejich využití je hlavně v revmatologii a pro terapii Crohnovy choroby. Infliximab je chimerická mono-klonální protilátka proti TNFα, etanercept je genetickým inženýrstvím vytvořený fúzní protein kombinující receptor pro TNF a Fc část lidského IgG1. Etanercept váže a inaktivuje TNF.
Infliximab. Couriel et al. (47) referují o 21 nemocných, kteří dostali infliximab v monoterapii. Celková léčebná odpověď byla 67 % a přežití 38 % při mediánu sledování 8,7 měsíců. Velmi dobře odpovídalo postižení zažívacího traktu. Autoři ale upozorňují na vysokou incidenci infekcí. Deset nemocných (48 %) mělo 18 fungálních infekcí (7krát Aspergilus), 81 % nemocných bakteriální infekce a 67 % nemocných infekce virové.
Etanercept. Locatelli et al. (48) popisují celkovou léčebnou odpověď u 64 % nemocných, zvláště u postižení trávicího traktu. Také upozorňují na vysokou frekvenci oportunních infekcí. Kennedy et al. (13) upozorňují na výhodnost kombinace etanerceptu a ATG (tab. 1).
Kombinovaná blokáda TNFα/IL-2
Toto se jeví jako velmi nadějný přístup. Obě cytokinové dráhy mají zásadní význam v patogeneze GVHD, přičemž blokády jen jedné dráhy se nejeví jako dostatečně účinné. Dosavadní informace jsou ale poměrně omezené. Srinivasan et al. (49) uvádějí 14/16 CR (88 %) po terapii daclizumab a infliximab. Upozorňují ovšem na rizika oportunních infekcí, zvláště mykotických. Vysokou léčebnou odpověď této kombinace udávají i Rao et al. (50), a sice 10/13 (77 %) CR. Všichni pacienti dostávali antifungální profylaxi (AmBisome, voriconazol) a byli pravidelně monitorováni na výskyt oportunních virových infekcí. Naproti tomu kombinace daclizumabu a etanerceptu nedávala tak dobré výsledky (51). Možná i proto, že zde bylo evidováno 52 % fatálních oportunních infekcí včetně mykotických (aspergilus, kandida). Zajímavou ideu publikovali Racadot et al. (52). Léčbu GVHD zahájili kombinací anti-CD2 a anti-TNF mono-klonálními protilátkami a poté ještě protilátky proti receptoru pro IL-2 s cílem zabránit rekurenci GVHD. Bohužel, tento přístup se neukázal jako zcela funkční.
Blokáda IL-1
Tento cytokin z pokusů na zvířatech vyplýval jako velmi zásadní pro patogenezi GVHD. V klinice se uplatnil rekombinantní IL-1 receptor antagonista, anakinra. Studie s profylaktickým použitím u GVHD ale nevyzněla pozitivně. Pro terapii steroid-rezistentní GVHD jej použili Antin et al. (53). Přes velmi dobrou léčebnou odpověď zvláště u střevní GVHD bylo ale celkové přežívání pacientů nízké (3/17).
Cytostatika, nespecifická imunosupresiva
V rámci imunosuprese pro terapii steroid-rezistentní GVHD lze použití také řadu většinou klasických imunosupresiv. Kupodivu jsou stále mnohdy poměrně užitečná a jak je vidět, řada sofistikovaných moderních rekombinantních molekul nesplnila zcela očekávání v ně vkládaná.
Vyšší dávka kortikoidů
Jednou z možností je i navýšení dávky steroidů. Podle dat, která uvádějí Van Lint et al. (8), došlo při navýšení kortikoidů ze 2 na 5 mg/kg/den k CR u 24 % nemocných, k PR také u 24 % nemocných a u 38 % pacientů se choroba stabilizovala.
Cyklofosfamid
V léčbě steroid-rezistentní GVHD byl s úspěchem použit i pulzní cyklofosfamid v dávce 1 g/m2 jednorázově. Tento postup byl vyvinut českými autory (54). Cyklofosfamid se ukázal jako mimořádně účinný v terapii jaterní a kožní GVHD, jeho účinnost u střevní GVHD je ale malá. Na pracovišti autorů je nyní pulzní cyklofosfamid standardním krokem pro terapii steroid-rezistentní jaterní GVHD nesdružené se střevní GVHD a dlouhodobě přežívání těchto nemocných je 95 % (55). Cyklofosfamid je klasické imunosupresivum a v pulzním podání se osvědčil např. pro terapii systémového lupusu.
Metotrexát
Je další klasická látka a dodnes pilíř profylaxe GVHD (cyklosporin A + metotrexát). V poslední době využíván i pro terapii akutní a chronické GVHD v podobných schématech jako v revmatologii. Studií zatím není mnoho. Huang et al. (56) sice popisují vynikající výsledky u aGVHD, ale většina pacientů měla GVHD jen mírného stupně a předchozí terapie steroidy nebyla buďto žádná, nebo jen v malé dávce. De Lavallade et al. (57) udávají CR u 5 nemocných z 11 s aGVHD.
Mykofenolát mofetil
Mykofenolát mofetil je ester kyseliny mykofenolové. Ta inhibuje inosin monofosfát dehydrogenázu a tím syntézu guanosinových nukleotidů. Působí silněji na lymfocyty než na jiné buňky. V ČR je k dispozici preparát Cell Cept. Kim et al. (58) popisují větší efekt tohoto léku na chronickou než na akutní GVHD, což je v souladu i s naší vlastní prací (59). Fisher et al. (11) popisují určitou účinnost u steroid-rezistentní aGVHD, ale ne takovou, aby se látka zdála vhodná pro randomizovanou studii. Jejich protokol však obsahoval i záměnu cyklosporinu A za takrolimus (FK 506).
Pentostatin
Pentostatin (deoxycoformycin, preparát Nipent, není v ČR registrován) je potentní inhibitor adenosin deaminázy a blokace tohoto enzymu vede k eliminaci T lymfocytů. Bolanos-Meade (60) testovali tento lék u 23 nemocných s léčebnou odpovědí 76 %, přežívalo ale jen 6 nemocných. Podobné výsledky uvádějí i Klein et al. (61) se zdůrazněním dobré léčebné odpovědi u střevní GVHD.
Sirolimus
Sirolimus (rapamycin, Rapamune, registrován v ČR) má odlišný mechanismus účinku od jiných imunosupresiv a ve svém důsledku způsobuje inhibici proliferace (62). Využíván u transplantací solidních orgánů. Jeho použití v terapii steroid-rezistentní aGVHD v monoterapii je limitováno vedlejšími účinky (63, 64) a tak je jeho role spíše v profylaxi GVHD a v terapii chronické GVHD. Lék je dostupný jen v perorální podobě, může způsobovat mikroangiopatickou hemolytickou anémii a má řadu potenciálně závažných interakcí. Již výše jsme zmínili pozitivní výsledky studie s kombinací daclizumab a sirolimus (42).
Buněčná terapie a další postupy
Mezenchymální kmenové buňky
V posledních několika letech bylo zjištěno, že mesenchymální kmenové buňky mají určité imunomodulační vlastnosti. Tyto buňky se nenachází v kostní dřeni a mohou být podány i od nepříbuzných HLA neshodných dárců. Výzkum v této oblasti pokračuje a dosavadní zprávy jsou vcelku nadějné (65).
Rituximab
Rituximab, eliminující B lymfocyty, se kupodivu a překvapivě uplatňuje i v terapii GVHD. Několik dosavadních zpráv bylo o nemocných s chronickou GVHD. Jedna práce uvádí ale i zásadní zlepšení u 3 nemocných s akutní steroid-rezistentní GVHD (66).
Etrakorporální fototerapie
Při této terapeutické metodě jsou odebrány lymfocyty, inkubovány s psoralenem a ozářeny ultrafialovým zářením, což je zásadním způsobem ovlivní. Imunologické dopady jsou komplexní a ne zcela probádané. Tento typ léčby může mít pozitivní roli i pro terapii akutní steroid-rezistentní GVHD (67), i když více dat je pro léčbu chronické GVHD.
Závěr
Steroid-rezistentní akutní GVHD je jednou ze závažných komplikací po alogenní transplantaci krvetvorných buněk a představuje významný terapeutický problém, který zůstává i přes enormní úsilí ne zcela uspokojivě vyřešen. Překvapivě téměř všechny léčebné postupy vykazují zhruba stejnou účinnost a na první pohled není zřejmé, že by jeden zcela převyšoval jiný. Randomizované studie v této oblasti obvykle chybějí, publikovaná data představují většinou velmi malé soubory nemocných, které jsou navíc i velmi heterogenní. Jednotlivá pracoviště většinou používají určité postupy, u nichž zůstávají a sbírají s nimi zkušenosti. Z iniciativy České leukemické skupiny (The CzEch Leukemia Study Group – for Life, CELL) nyní vzniká pracovní tým, který se bude snažit některé aspekty tohoto závažného problému v rámci ČR sjednocovat.
Tato práce vznikla v rámci organizace Česká leukemická skupina - pro život, The CzEch Leukemia Study Group – for Life, CELL
Prof. MUDr. Jiří Mayer, CSc.
Interní hematoonkologická klinika FN Brno
Jihlavská 20
625 00 Brno
e-mail: jmayer@fnbrno.cz
Zdroje
1. van Bekkum DW, de Vries MJ. Radiation chimeras. Logos Press Ltd., London 1967, 275 s.
2. Brent L. A history of transplantation immunology. Academic Press, San Diego 1997, 482 s.
3. Horowitz MM, Gale RP, Sondel PM, et al. Graft-versus-leukemia after bone marrow transplantation. Blood 1990; 75 : 555–562.
4. Mayer J, Brychtová Y. Využití alemtuzumabu u transplantací krvetvorných buněk. Trans Hematol dnes 2006; 12 : 14–19.
5. Przepiorka D, Weisdorf D, Martin P, et al. Consensus conference on acute GvHD grading. Bone Marrow Transplant 1995; 15 : 825–828.
6. MacMillan ML, Weisdorf DJ, Wagner JE, et al. Response of 443 patients to steroids as primary therapy for acute graft-versus-host disease: comparison of grading systems. Biol Blood Marrow Transplant 2002; 8 : 387–394.
7. Cetkovský P. Akutní nemoc z reakce štěpu proti hostiteli. In: Cetkovský P et al.: Intenzivní péče v hematologii. Praha, Galén, 2004; 354–358.
8. Van Lint MT, Milone G, Leotta S, et al. Treatment of acute graft-versus-host disease with prednisolone: significant survival advantage for day +5 responders and no advantage for nonresponders receiving anti-thymocyte globulin. Blood 2006;107 : 4177–4181.
9. Ruutu T, Niederwieser D, Gratwohl A, Apperley JF. A survey of the prophylaxis and treatment of acute GVHD in Europe: a report of the European Group for Blood and Marrow Transplantation (EBMT). Bone Marrow Transplant 1997; 19 : 759–764.
10. Martin PJ, Schoch G, Fisher L, et al. A retrospective analysis of therapy for acute graft-versus-host disease: secondary treatment. Blood 1991; 77 : 1821–1828.
11. Fisher G, Rocha V, dos Santos M, et al. Mycophenolate mofetil with or without tacrolimus as a second line treatment for steroid-resistant acute graft-versus-host disease. The experience of Saint Louis Hospital. Blood 2006; 108 : 819a, abstract 2892.
12. MacMillan ML, Weisdorf DJ, Davies SM, et al. Early antithymocyte globulin therapy improves survival in patients with steroid-resistant acute graft-versus-host disease. Biol Blood Marrow Transpl 2002; 8 : 40–46.
13. Kennedy GA, Butler J, Western R, et al. Combination antithymocyte globulin and soluble TNF α inhibitor (etanercept) +/ - mycophenolate mofetil for treatment of steroid refractory acute graft-versus-host disease. Bone Marrow Transpl 2006; 37 : 143-1147.
14. Knop S, Hebart H, Gratwohl A, et al. Treatment of steroid-resistant acute GvHD with OKT3 and high-dose steroids versus high-dose steroids alone. Blood 2005; 106 : 45a, abstract 141.
15. Massenkeil G, Rackwitz S, Genvresse I, Rosen O, Dorken B, Arnold R. Basiliximab is well tolerated and effective in the treatment of steroid-refractory acute graft-versus-host disease after allogeneic stem cell transplantation. Bone Marrow Transplant 2002; 30 : 899–903.
16. Przepiorka D, Kernan NA, Ippoliti C, et al. Daclizumab, a humanized anti-interleukin-2 receptor alpha chain antibody, for treatment of acute graft-versus-host disease. Blood 2000; 95 : 83–89.
17. Khoury H, Kashyap A, Adkins DR, et al. Treatment of steroid-resistant acute graft-versus-host disease with anti-thymocyte globulin. Bone Marrow Transplant 2001; 27 : 1059-1064.
18. Bacigalupo A. Antilymphocyte/thymocyte globulin for graft versus host disease prophylaxis: efficacy and side effects. Bone Marrow Transpl 2005; 35 : 225-231.
19. van Bekkum DW, Ledney GD, Balner H, et al. Suppression of secondary disease following foreign bone marrow grafting with anti-lymphocyte serum. In.: Wolstenholme GEW, O’Connor M: Antilymphocyte serum. J.&A. Churchill, London 1967, 97–107.
20. Arai S, Margolis J, Zahurak M, et al. Poor outcome in steroid-refractory graft-versus-host disease with antithymocyte globulin treatment. Biol Blood Marrow Transplant 2002; 8 : 155–160.
21. McCaul KG, Nevill TJ, Barnett MJ, et al. Treatment of steroid-resistant acute graft-versus-host disease with rabbit antithymocyte globulin. J Hematother Stem Cell Res 2000; 9 : 367–374.
22. Mayer J, Kamelander J, Navrátil M, et al. Treatment of steroid-refractory acute GvHD with ATG Fresenius. Bone Marrow Transplant 2007; 39: Suppl. 1, abstract 1061.
23. MacMillan ML, Couriel D, Weisdorf DJ, et al. A phase 2/3 multicenter randomized clinical trial of ABX-CBL versus ATG as secondary therapy for steroid-resistant acute graft-versus-host disease. Blood 2007; 109 : 2657–2662.
24. Knop S, Hebart H, Gscheidle H, et al. OKT3 muromonab as second-line and subsequent treatment in recipients of stem cell allografts with steroid-resistant acute graft-versus-host disease. Bone Marrow Transplant 2005; 36 : 831–837.
25. Carella AM, Beltrami G, Scalzulli PR, et al. Alemtuzumab can successfully treat steroid-refractory acute graft-versus-host disease. Bone Marrow Transplant 2004; 33 : 131–132.
26. Wandroo F, Auguston B, Cook M, et al. Successful use of Campath-1H in the treatment of steroid refractory liver GvHD. Bone Marrow Transplant 2004; 34 : 285–287.
27. Busca A, Locatelli F, Lovisone E, et al. Treatment of severe refractory acute graft-versus-host disease of the gastrointestinal tract with campath-1H. Biol Blood Marrow Transpl 2005; 11 : 734–736.
28. Repp R, Claviez A, Gahn B, et al. Low dose alemtuzumab is effective in the treatment of severe steroid-refractory acute graft-versus-host disease. Bone Marrow Transplant 2006; 37: Suppl. 1, abstract P481.
29. Biersack H, Trenschel R, Peceny R, et al. Treatment of steroid refractory acute GvHD with Campath-1H. Bone Marrow Transplant 2004; 33: Suppl. 1, abstract P726.
30. Goméz-Almaguer D, Ruiz-Arguelles J, Gonzáles-Liano O, et al. Alemtuzumab in the treatment of steroid refractory acute graft-versus-host disease. Biol Bone Marrow Transplant 2007; 13: Suppl. 2, abstract 294.
31. Repp R, Claviez A, Schrauder A, et al. Succesful therapy of steroid-refractory acute graft-versus host disease with sequential alemtuzumab. Biol Bone Marrow Transplant 2007; 13: Suppl. 2, abstract 321.
32. Deeg HJ, Blazar BR, Bolwell BJ, et al. Treatment of steroid-refractory acute graft-versus-host disease with anti-CD147 monoclonal antibody ABX-CBL. Blood 2001; 98 : 2052–2058.
33. Carpenter PA, Lowder J, Johnston L, et al. A phase II multicenter study of visilizumab, humanized anti-CD3 antibody, to treat steroid-refractory acute graft-versus-host disease. Biol Blood Marrow Transplant 2005; 11 : 465–471.
34. Shapira MY, Resnick IB, Bitan M, et al. Rapid response to alefacept given to patients with steroid resistant or steroid dependent acute graft-versus-host disease: a preliminary report. Bone Marrow Transplant 2005; 36 : 1097–1101.
35. Ho VT, Zahrieh D, Hochberg E, et al. Safety and efficacy of denileukin diftitox in patients with steroid-refractory acute graft-versus-host disease after allogeneic hematopoietic stem cell transplantation. Blood 2004; 104 : 1224–1226.
36. Shaughnessy PJ, Bachier C, Grimley M, et al. Denileukin diftitox for the treatment of steroid-resistant acute graft-versus-host disease. Biol Blood Marrow Transplant 2005; 11 : 188–193.
37. Srinivasan R, Chakrabarti S, Walsh T, et al. Improved survival in steroid-refractory acute graft versus host disease after non-myeloablative allogeneic transplantation using a daclizumab-based strategy with comprehensive infection prophylaxis. Brit J Haematol 2004; 124 : 777–786.
38. Bordigoni P, Dimicoli S, Clement L, et al. Daclizumab, an efficient treatment for steroid-refractory acute graft-vesrus-host disease. Brit J Haematol 2006; 135 : 382–385.
39. Zain JM, Smith E, Palmer J, et al. The use of daclizumab for treatment of steroid refractory acute GVHD. A City of Hope experience. J Clin Oncol 2005; 23: abstract 6672.
40. Sia H, Hui CH, Mangos H, et al. Daclizumab has poor efficacy in steroid-refractory acute graft versus host disease: a single centre experience with 12 allograft patients. Haematologica 2006; 91: abstract 820.
41. Wolff D, Wilhelm S, Hahn J, et al. Replacement of calcineurin inhibitors with daclizumab in patients with transplantation-associated microangiopathy or renal insufficiency associated with graft-versus-host disease. Bone Marrow Transplant 2006; 38 : 445–451.
42. Weisser M, Goede V, Schiel X, et al. Steroid refractory GVHD of the gut can be treated effectively with daclizumab and sirolimus. Blood 2004; 104: abstract 1237.
43. Schmidt-Hieber M, Fietz T, Knauf W, et al. Efficacy of the interleukin-2 receptor antagonist basiliximab in steroid-refractory acute graft-versus-host disease. Br J Haematol 2005; 130 : 568–574.
44. Funke VAM, de Medeiros CR, Setúbal DC, et al. Therapy for severe refractory acute graft-versus-host disease with basiliximab, a selective interleukin-2 receptor antagonist. Bone Marrow Transplant 2006; 37 : 961–965.
45. Bay JO, Dhédin N, Goerner M, et al. Inolimomab in steroid-refractory acute graft-versus-host disease following allogeneic hematopoietic stem cell transplantation : retrospective analysis and comparison with other interleukin-2 receptor antibodies. Transplantation 2005; 80 : 782–788.
46. Pinana JL, Valcárcel D, Martino R, et al. Encouraging results with inolimomab (anti-IL-2 receptor) as treatment for refractory acute graft-versus-host disease. Biol Blood Marrow Transplant 2006; 12 : 1135–1141.
47. Couriel D, Saliba R, Hicks K C, et al. Tumor necrosis factor-αa blockade for the treatment of acute GVHD. Blood 2004; 104 : 649–654.
48. Locatelli F, Busca A, Dall’Omo A, et al. Salvage therapy with etanercept for patients with severe acute and chronic GvHD. Bone Marrow Transplant 2005; 35: Suppl 2, abstract P555.
49. Srinivasan R, Geller N, Dorrance C, et al. High response rate in acute steroid refractory graft-versus-host disease following combined tumor necrosis factor alpha and interleukin-2 blockade. Blood 2005; 106: abstract 1801.
50. Rao K, Rao A, Veys P, Amrolia P. Improved survival in steroid refractory GVHD using a combination of daclizumab and infliximab. Bone Marrow Transplant 2006; 37: Suppl 1, abstract P420.
51. Wolff D, Roessler V, Steiner B, et al. Treatment of steroid-resistant acute graft-versus-host disease with daclizumab and etanercept. Bone Marrow Transplant 2005; 35 : 1003–1010.
52. Racadot E, Milpied N, Bordigoni P, et al. Sequential use of three monoclonal antibodies in corticosteroid-resistant acute GVHD: a multicentric pilot study including 15 patients. Bone Marrow Transplant 1995; 15 : 669–677.
53. Antin JH, Weinstein HJ, Guinan EC, et al. Recombinant human interleukin-1 receptor antagonist in the treatment of steroid-resistant graft-versus-host disease. Blood 1994; 84 : 1342–1348.
54. Mayer J, Krejčí M, Doubek M, et al. Pulse cyclophosphamide for corticosteroid-refractory graft-versus-host disease. Bone Marrow Transplant 2005; 35 : 699–705.
55. Krejčí M, Mayer J, Doubek M. Surprisingly high efficacy and low toxicity of pulse cyclophosphamide in the treatment of corticosteroid-refractory liver GvHD. Bone Marrow Transplant 2007; 39: Suppl. 1, abstract P574.
56. Huang XJ, Jiang Q, Chen H, et al. Low-dose methotrexate for the treatment of graft-versus-host disease after allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant 2005; 36 : 343–348.
57. De Lavallade H, Mohty M, Faucher C, et al. Low-dose methotrexate as salvage therapy for refractory graft-versus-host disease after reduced-intensity conditioning allogeneic stem cell transplantation. Haematologica 2006; 91 : 1438–1440.
58. Kim JG, Sohn SK, Kim DH, et al. Different efficacy of mycophenolate mofetil as salvage treatment for acute and chronic GVHD after allogeneic stem cell transplant. Eur J Haematol 2004; 73 : 56–61.
59. Krejčí M, Doubek M, Brychtová Y, Mayer J. Mycophenolate mofetil for the treatment of acute and chronic steroid-refractory graft-versus-host disease. Ann Hematol 2005; 84 : 681–685.
60. Bolanos-Meade J, Jacobsohn DA, Margolis J, et al. Pentostatin in steroid-refractory acute graft-versus-host disease. J Clin Oncol 2005; 23 : 2661–2668.
61. Klein SA, Bug G, Wassmann B, et al. Outcome of patients treated with pentostatin as salvage therapy of steroid refractory acute intestinal graft-versus-host disease. Bone Marrow Transplant 2004; 33: Suppl 1, abstract P703.
62. Viklický O, Matl I. Rapamycin: nové imunosupresivum schopné potlačit rejekci? Čas Lék Čes 2001; 140 : 22–25.
63. Benito AI, Furlong T, Martin PJ, et al. Sirolimus (rapamycin) for the treatment of steroid-refractory acute graft-versus-host disease. Transplantation 2001; 72 : 1924–1929.
64. Pohlreich D, Vítek A, Válková V, et al. Use of sirolimus (rapamune) in the treatment of steroid-refractory GvHD. Bone Marrow Transplant 2005; 35: Suppl 2, abstract P576.
65. Ringdén O, Uzunel M, Rasmusson I, et al. Mesenchymal stem cells for treatment of therapy-resistant graft-versus-host disease. Transplantation 2006; 81 : 1390–1397.
66. Kamble R, Oholendt M, Carrum G, et al. Rituximab responsive refractory acute graft-versus-host disease. Biol Blood Marrow Transplant 2006; 12 : 1201–1202.
67. Greinix HT, Knobler RM, Worel N, et al. The effect of intensified extracorporeal photochemotherapy on long-term survival in patients with severe acute graft-versus-host disease. Haematologica 2006; 91 : 405–408.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2007 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vybrané odborné akce v roce 2008
- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vzdělávací akce IPVZ
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Vzdělávací akce IPVZ
- Imunoterapie rituximabem v kombinaci s dexametazonem následovaná podáním 90Y - ibritumomab tiuxetanu u předléčených nemocných s relabovaným folikulárním lymfomem
- Gratulujeme
- XV. ČESKO-SLOVENSKÝ HEMATOLOGICKÝ A TRANSFUZIOLOGICKÝ SJEZD 6.- 9. 9. 2008 IX. ČESKO–SLOVENSKÁ KONFERENCE LABORATORNÍ HEMATOLOGIE 5.- 6. 9. 2008
- Co se děje u našich sousedů v transfuzní službě
- OBSAH ROČNÍKU 13/2007 Transfuze a hematologie dnes
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Steroid-rezistentní akutní reakce štěpu proti hostiteli (GVHD)
- Vyšetrovacie metódy krvných doštičiek – stručný prehľad
- Vliv typu odběru krve a deleukotizace na kvalitu kryokonzervovaných erytrocytů
- Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



