-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNaše zkušenosti s transanální totální mezorektální excizí (TaTME) u tumorů středního a distálního rekta
Our experience with transanal total mesorectal excision (TaTME) procedures in middle and distal rectal tumors
Introduction: Transanal total mesorectal excision (TaTME) is a relatively new approach in surgical treatment of rectal cancer. There are no clear indications when to choose this strategy. It is a technically demanding procedure for the surgeon with a long learning curve, which should also be taken into account in evaluation of this method. The results of both oncological and postoperative complications must be properly evaluated to explore the benefit of TaTME. The aim of this study is to assess the potential benefit of TaTME compared to other alternatives in middle and distal rectal tumors.
Methods: Retrospective evaluation of patients undergoing TaTME procedure performed by one team of surgeons between October 2014 and June 2019. The authors analyzed demographic indicators of the group of patients, tumor characteristics, specimen quality, early postoperative complications and the possibility of stoma reversal.
Results: A total of 93 patients underwent TaTME procedure for middle and distal rectal cancer. Mean BMI was 27.6 (4.8). T3 or T4 tumor was found in 73 (78.5%) patients, 68 (73.1%) patients had positive lymph nodes and 12 (12.9%) patients were treated for synchronous metastatic rectal cancer. Neoadjuvant therapy was used in 80 (86%) patients. Conversion to open laparotomy was necessary in one case (1%). Stapled anastomosis was performed in 37 (39.7%) cases, handsewn in 56 (60.2%). A positive circumferential resection margin (CRM) was found in 10 (10.7%) cases. Distal resection margin (DRM) was positive in 3 (3.2%) patients. Pathological analysis showed a complete mesorectum in 18 patients (19.4%), nearly complete in 39 (41.9%) and an incomplete mesorectum in 36 (38.7%). Complications in the first 30 days after primary surgery were observed in 38 (40.8%) patients, mainly for anastomotic leak (19 patients, 20.4%). Reoperation was required in 7 (7.5%) patients. Permanent colostomy had to be performed in 4 (4.3%) cases. No patient died after surgery.
Conclusion: In a selected group of patients it is possible to perform resection using this approach with acceptable postoperative morbidity and quality of the specimen. We used TaTME procedure in patients expected to have difficult TME due to obesity, size and distal localization of tumor. The incidence of conversion to open surgery was very low. Further studies for long term oncological outcomes are needed.
Keywords:
complications – rectal cancer – transanal total mesorectal excision – circumferential resection margin
Autoři: V. Procházka 1
; T. Grolich 1
; M. Farkašová 1; V. Čan 1; R. Svatoň 1; M. Svoboda 2
; L. Ostřížková 3
; M. Eid 3
; L. Frola 4; Š. Bohatá 5; Z. Kala 1
Působiště autorů: Chirurgická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 1; Lékařská fakulta Masarykovy Univerzity v Brně 2; Interní hematologická a onkologická klinika Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 3; Ústav patologie Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 4; Klinika radiologie a nukleární medicíny Fakultní nemocnice Brno a Lékařské fakulty Masarykovy univerzity v Brně 5
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 3, s. 124-130.
Kategorie: Původní práce
doi: https://doi.org/10.33699/PIS.2020.99.3.124–130Souhrn
Úvod: Transanální totální mezorektální excize (TaTME) je relativně novým přístupem v operační léčbě karcinomu rekta. Nejsou zatím jasně známé indikace, pro které tuto strategii zvolit. Pro chirurga se jedná o technicky náročný výkon s dlouhodobou learning curve, což mimo jiné přispívá k problematice hodnocení této metody. Při zkoumání přínosu TaTME je nutné sledovat onkologické výsledky i pooperační komplikace. Cílem této práce je posouzení potenciálního benefitu TaTME u tumorů středního a distálního rekta.
Metody: Retrospektivní zhodnocení souboru pacientů operovaných od října 2014 do června 2019 jedním týmem chirurgů. Analyzovány byly demografické ukazatele souboru pacientů, staging nádoru před zahájením léčby, výsledky definitivního zhodnocení resekátu patologem, výskyt časných pooperačních komplikací a možnost zrušení stomie.
Výsledky: Hodnoceno bylo 93 pacientů po provedení TaTME s anastomózou pro nádorové postižení střední a distální třetiny rekta. Průměrné BMI bylo 27,6 (4,8). Vstupně mělo tumor T3 nebo T4 73 (78,5 %) pacientů, 68 (73,1 %) pacientů mělo pozitivní lymfatické uzliny a 12 (12,9 %) pacientů bylo léčeno pro synchronně metastazující karcinom rekta. Neoadjuvantní onkologickou léčbu podstoupilo 80 (86 %) pacientů. Konverze na výkon otevřený byla nutná v jednom případě (1 %). Staplerová anastomóza byla provedena ve 37 (39,7 %) případech, ručně šitá byla v 56 (60,2 %). Pozitivní cirkumferenční resekční okraj (CRM) byl nalezen v 10 (10,7 %) případech. Distální resekční okraj (DRM) byl pozitivní ve 3 (3,2 %) případech. Patologická analýza kvality TME prokázala kompletní mezorektum v 18 (19,4 %) případech, téměř kompletní v 39 (41,9 %) a inkompletní mezorektum v 36 (38,7 %) případech. Pooperační komplikace se v prvních 30 dnech vyskytly u 38 (40,8 %) pacientů. Nejčastější komplikací byl anastomotický leak – 19 případů (20,4 %). U sedmi (7,5 %) pacientů byla nutná reoperace. Trvalou kolostomii bylo v dalším průběhu nutné provést ve 4 (4,3 %) případech. Po operaci žádný pacient nezemřel.
Závěr: U selektovaného výběru pacientů je možné provedení resekce tímto přístupem, a to s akceptovatelnou pooperační morbiditou a kvalitou resekátu. TaTME jsme prováděli především s ohledem na obezitu, velikost a nízké uložení tumoru, kde se předpokládá obtížná TME. Velmi nízký je výskyt konverzí na výkony otevřené. Další studie jsou potřeba k hodnocení dlouhodobých onkologických výsledků.
Klíčová slova:
karcinom rekta – transanální totální mezorektální excize – cirkumferenční resekční okraj – komplikace
ÚVOD
Chirurgický resekční výkon je základní součástí terapeutického algoritmu karcinomu rekta. Pouze u časných forem, bez postižení uzlin, je možná lokální excize provedená chirurgicky nebo endoskopicky. V pokročilejších stadiích je nutná resekce s adekvátní lymfadenektomií. Pro karcinom střední (5–10 cm od análního okraje) a distální (0–5 cm od análního okraje) třetiny rekta je od konce 80. let 20. století uznávána jako standardní výkon totální mezorektální excize (TME). Podle stadia nádoru může být použita i v kombinaci s neoadjuvantní onkologickou léčbou [1]. Požadavek na výslednou kvalitu kompletní resekce mezorekta je dán vysokým rizikem lokální rekurence tumoru v případě nekompletní resekce [2]. Nároky na provedení chirurgického výkonu u rizikových pacientů s velkým nízko uloženým tumorem, s obezitou a předoperačním ozářením jsou značné. Do rutinní praxe se zavedly laparoskopické přístupy i u onkologických onemocnění. Kvalita provedení TME je při laparoskopických výkonech stejná jako při výkonech otevřených [3]. Onkologicky jsou tedy obě metody považovány za standardní s výhodou lepší tolerance pooperačního průběhu pacienty po výkonu miniinvazivním [4]. Rozvoj chirurgických metod umožnil omezit počet trvalých stomií u pacientů s indikací k TME s možností zachování svěračů nebo alespoň jejich částí. Podmínkou provedení TME je absence infiltrace levátorů a zevního svěrače při předoperačním stagingu [5]. Preparace v malé pánvi se stala zcela kruciální pro úspěšnost resekčního výkonu. Snaha o zlepšení vizualizace dolní části mezorekta a anorektálního přechodu vedla již v době otevřené chirurgie k vypracování techniky preparace transanálním přístupem, což umožnilo následující vývoj i v chirurgii miniinvazivní [6]. Zavedením speciální platformy do anu a insuflací medicinálního plynu je možné vytvořit dostatečný prostor v malé pánvi, preparovat od dna pánevního směrem nahoru, a tak uvolnit dolní část mezorekta od okolních tkání. Tato technika nazvaná transanální totální mezorektální excize (TaTME) rovněž umožňuje provedení operačního výkonu simultánně dvěma týmy, což významně zkracuje operační čas provedení TME [7]. Mezi potenciální výhody TaTME patří především zlepšení kvality TME, snížení četnosti R1 resekcí, nižší počet konverzí a zlepšení funkčních výsledků zejména u nízce uložených nebo objemných nádorů, úzké pánve a obézních pacientů. Hlavní pozornost je v literatuře věnována ověření onkologické bezpečnosti tohoto přístupu a kvalitě provedené resekce. V literatuře zatím neexistuje jednoznačná standardizace provedení TaTME, ale ani jasná indikační kritéria. Současná situace v Norsku, popsaná Larsenem a kol., kde je na TaTME kvůli nepřesvědčivým onkologickým výsledkům uvaleno moratorium, jasně dokazuje aktuálnost práce a potřebu přinést další data pro detailní zhodnocení dlouhodobého přínosu této metody [8].
METODY
Do retrospektivního zhodnocení výsledků byli zařazeni pacienti, u nichž byl na Chirurgické klinice Fakultní nemocnice Brno proveden v časovém rozmezí od října 2014 do června 2019 laparoskopický a transanální resekční výkon pro nádor střední a distální třetiny rekta. Indikaci přístupu k TME zvažujeme selektivně dle charakteristik tumoru i pacienta, dle rozhodnutí chirurga. Do hodnocení bylo zařazeno celkem 93 pacientů. Zahrnuti nebyli pacienti, u kterých bylo TaTME zvažováno jako možný postup, ale TME bylo možné provést čistě transabdominálním přístupem. Naopak u 14 (15 %) pacientů bylo k TaTME přistoupeno až v průběhu výkonu, protože transabdominálním přístupem nebylo možné dosáhnout kvalitního uvolnění distální části mezorekta. U 79 (84 %) pacientů bylo TaTME plánováno již předoperačně. U všech pacientů byla předoperačně vyloučena inkontinence a infiltrace zevního svěrače na magnetické rezonanci (MRI) jako kontraindikace sfinkter záchovné operace. Všichni pacienti byli poučeni o možných funkčních dopadech a preferovali výkon bez trvalé stomie. Všechny výkony provedl stejný operační tým. Sledovali jsme demografické ukazatele souboru pacientů, staging nádoru před zahájením léčby, výsledky definitivního zhodnocení resekátu patologem, výskyt časných pooperačních komplikací a možnost zrušení stomie.
Pro taktiku resekce a následné rekonstrukce je zásadní lokalizace tumoru. Při dostatečné vzdálenosti od anu je rektum pod nádorem uzavřeno cirkulárně založeným stehem a poté je operace prováděna cestou transanálně zavedené platformy pomocí insuflace medicinálního plynu. U níže lokalizovaných tumorů je nutné zahájit transanální fázi provedením intersfinkterické resekce (ISR). V případě nejasnosti o vzdálenosti distální resekční linie od tumoru provádíme kryobioptické vyšetření resekční linie. Teprve poté je možné pokračovat výše uvedeným způsobem. Anastomóza je provedena cirkulárním staplerem, je-li dostatek místa pro založení cirkulárního stehu na pahýlu rekta. V případě ISR provádíme ručně šitou koloanální anastomózu jednotlivými stehy. Preferujeme anastomózu stranou ke konci. Protektivní axiální ileostomie je standardní součástí výkonu u pacientů po předoperační neoadjuvantní onkologické léčbě. U pacientů s příznivým průběhem operace, nebo naopak výraznou obezitou, která by mohla komplikovat založení protektivní stomie, jsme provedli průvlekovou operaci vždy ve spojení s ISR. V těchto případech je tračník protažen transanálně a ponechán nadbytek asi 5 cm vně anu. Šestý pooperační den je provedeno zkrácení tračníku a našití anastomózy k původní resekční linii. Kontroly zhojení anastomózy provádíme endoskopicky u všech pacientů.
K hodnocení pooperačních komplikací byla použita metoda Clavien-Dindo [9]. Kvalita TME byla hodnocena Quirke protokolem [10]. Hodnocení distální resekční linie jako pozitivní je při přítomnosti nádorových buněk <1 mm od tumoru a cirkumferenční resekční linie je pozitivní při přítomnosti nádorových buněk <1 mm od tumoru.
Ve statistickém zpracování dat byl použit aritmetický průměr, směrodatná odchylka, medián, rozmezí, relativní četnosti a absolutní čísla.
Všechny postupy zahrnující lidské subjekty byly provedeny v souladu s etickými standardy institucionálního a/nebo národního výzkumného výboru a Helsinskou deklarací z roku 1964 a jejími pozdějšími změnami. Tento článek nezahrnuje žádné studie na zvířatech.
VÝSLEDKY
Demografická data ukazuje Tab. 1. Za pozornost stojí, že 80 (86 %) pacientů mělo předoperačně provedenou neoadjuvantní onkologickou léčbu indikovanou mezioborovou indikační komisí. U dvanácti (12,9 %) pacientů byl operován synchronně metastazující karcinom rekta, jedenáct z nich mělo před resekcí tumoru rekta podávanou i biologickou léčbu.
Tab. 1. Charakteristika souboru
Tab. 1. Group characteristics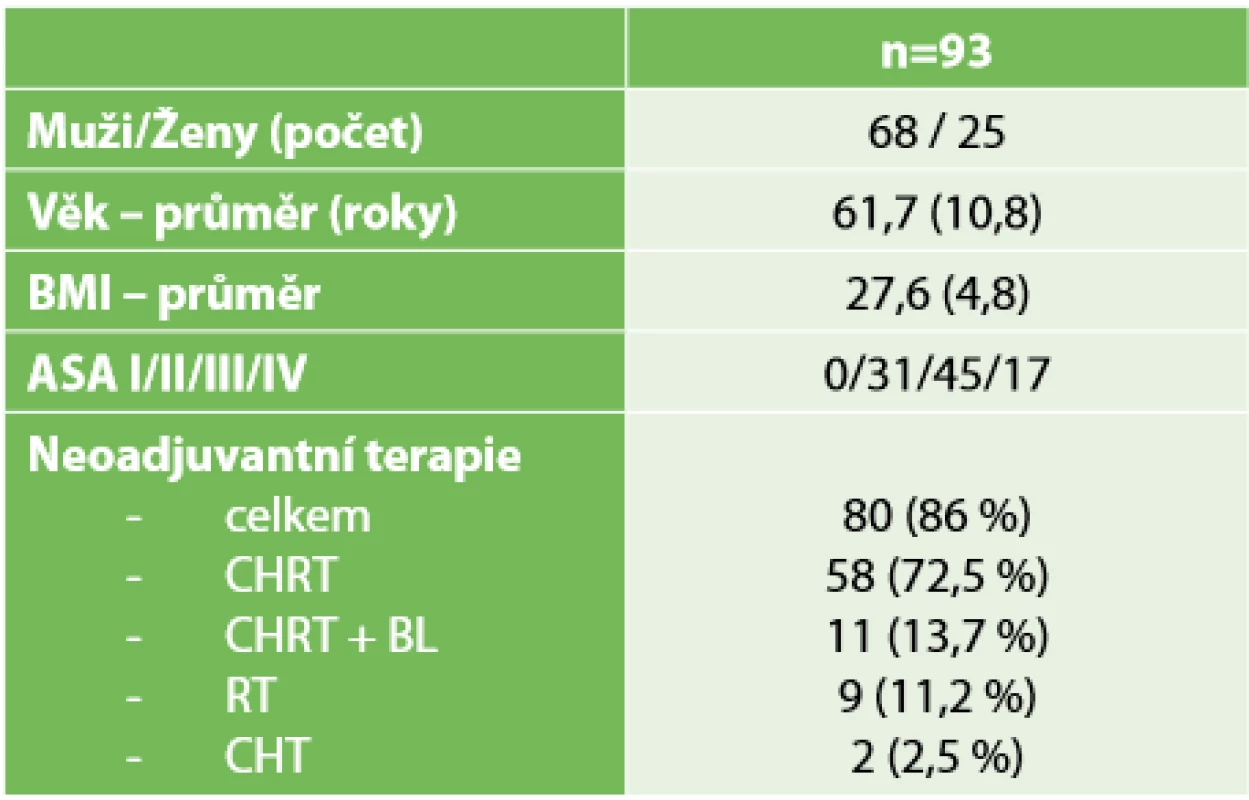
ASA – American Society of Anesthesiologists skóre, BMI – Body Mass Index, CHRT – chemoradioterapie, CHRT + BL – chemoradioterapie + biologická léčba, RT – radioterapie, CHT – chemoterapie) Další tabulka (Tab. 2) dokumentuje lokalizaci a staging nádorů dle zobrazovacích metod při vstupním vyšetření a dále staging nádoru po zhodnocení resekátu patologem. Pouze 25 (26,8 %) pacientů mělo předoperačně hodnoceno uzliny jako negativní a 73 (78,5 %) pacientů mělo nádor stadia T3-T4. U tří pacientů bez histologicky prokázaného karcinomu bylo podezření na malignitu z endoskopického nálezu a charakteru infiltrace na MRI. V pooperačním hodnocení je patrný výrazný posun k nižším stadiím tumoru včetně 10 (10,7 %) pacientů, u nichž byl nádor po předoperační neoadjuvanci hodnocen jako pT0 – tedy complete response. U tří pacientů pT0 byly prokázány vitální nádorové buňky v uzlinách.
Tab. 2. Charakteristika tumorů
Tab. 2. Tumor characteristics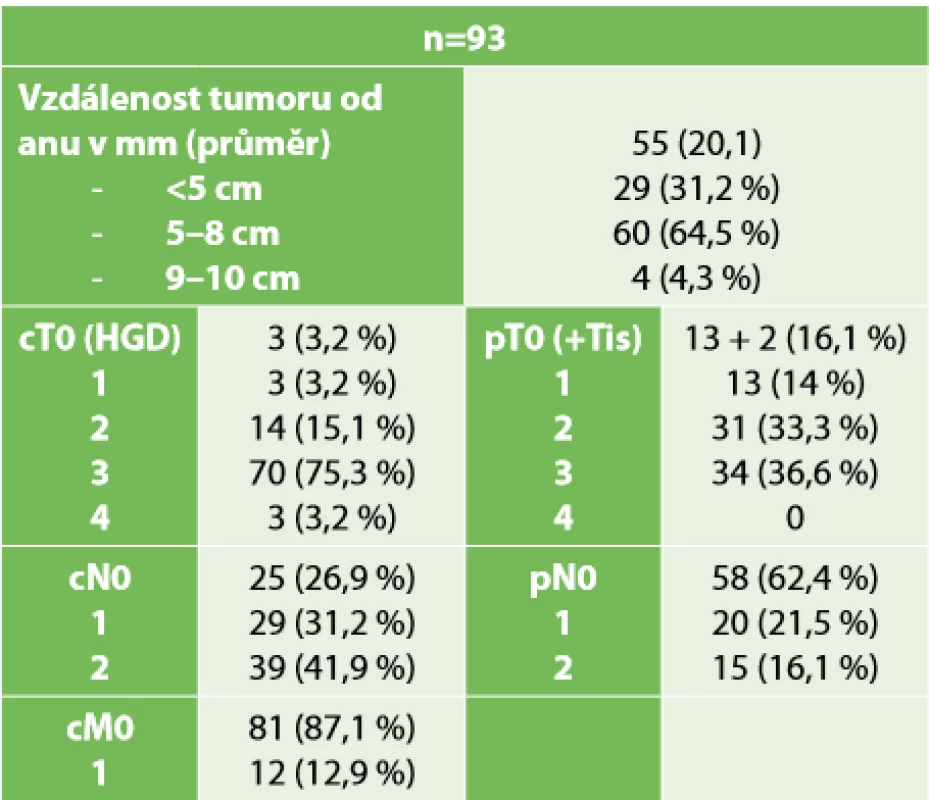
Poznámka: (Lokalizace tumoru – měřeno od anokutánní linie při MRI, cTNM hodnoceno dle zobrazovacích metod, pTN hodnoceno z definitivních resekátů, HGD – adenom s high grade dysplazií.) Ve třetí tabulce (Tab. 3) prezentujeme typy rekonstrukcí po resekci. V 86 (92 %) případech byla provedena anastomóza s protektivní ileostomií, eventuálně měli pacienti ileostomii založenou již před neoadjuvantní léčbou pro stenozující tumor rekta s poruchou pasáže. V jednom případě byla provedena staplerová anastomóza bez protektivní ileostomie. V šesti (6,4 %) případech byla provedena průvleková operace bez protektivní stomie. Výrazně vyšší tedy bylo zastoupení velmi nízkých resekcí s provedením ISR – 56 případů (60,2 %) – než resekcí se staplerovou anastomózou. Konverze laparoskopie byla nutná v jednom případě, a to pro špatnou toleranci kapnoperitonea v čase, kdy již byla dokončena transanální fáze resekce, ale nebyla ještě uvolněna lineální flexura.
Tab. 3. Charakteristika operací
Tab. 3. Operation characteristics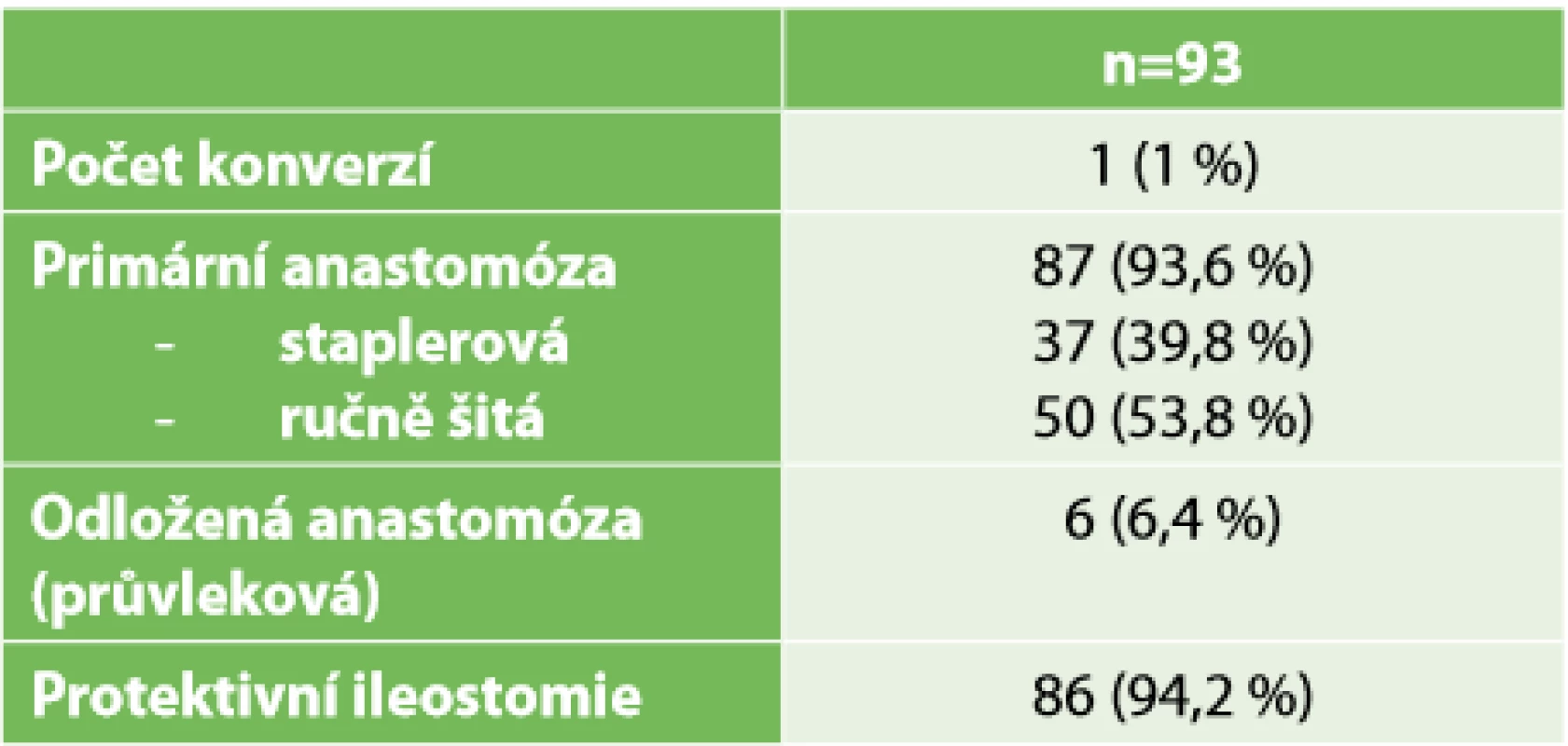
Tab. 4 ukazuje kvalitu TME dle hodnocení resekátu patologem. Ve třech (3,2 %) případech byla popsána pozitivní DRM. Ve všech případech se jednalo o pacienty s velmi nízko uloženým tumorem po provedení ISR. Ve dvou případech jsme stav řešili dokončením amputace rekta. V jednom případě pacientka amputaci rekta odmítla, podstoupila pooperační chemoradioterapii a je již 2 roky sledována bez známek lokální i celkové progrese onemocnění. Kvalita TME 3, tedy kompletní mezorektum, byla patologem popsána v 18 (19,4 %) případech, z toho ve 14 případech u pacientů s intersfinkterickou resekcí.
Tab. 4. Hodnocení kvality resekátů
Tab. 4. Evaluation of resection quality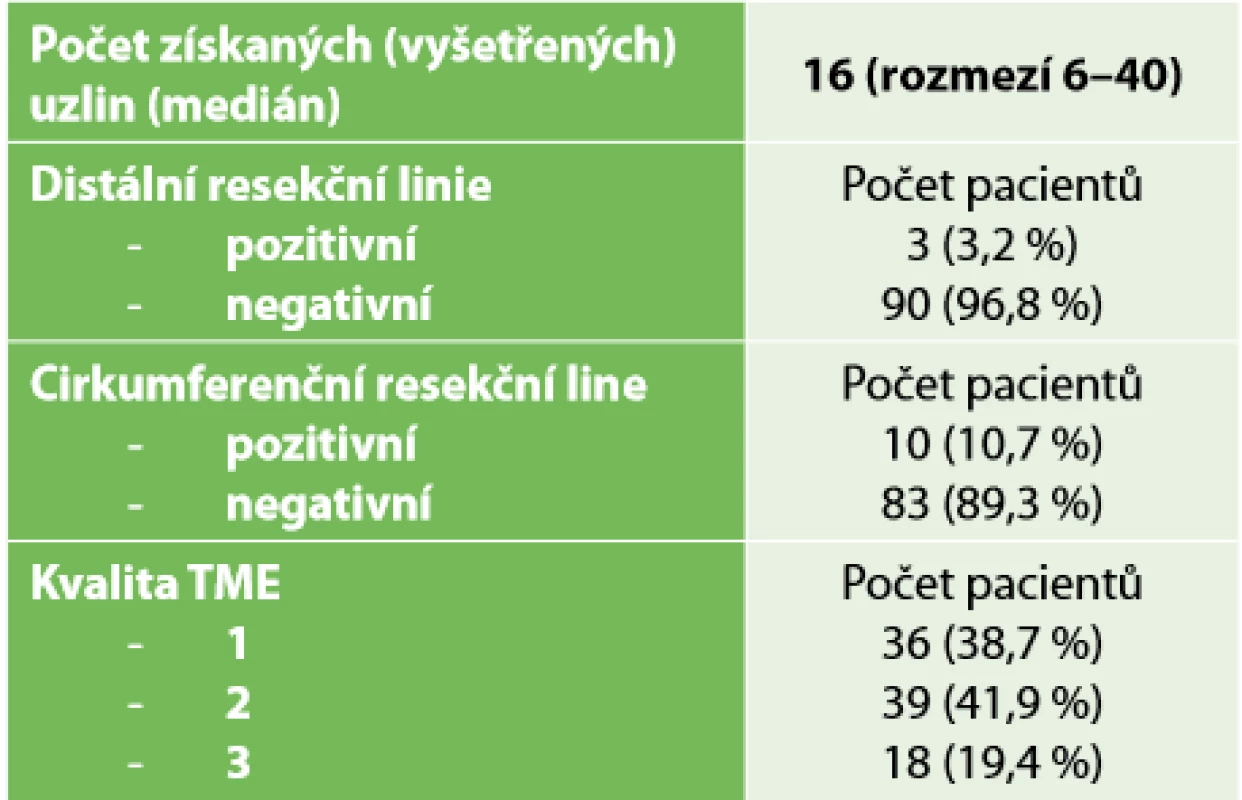
V poslední Tab. 5 jsou uvedeny pooperační komplikace, které jsme zaznamenali u 38 (40,8 %) operovaných. V souvislosti s operací nezemřel žádný pacient. Do 30 dnů od primární resekce byla nutná reoperace u 7 (7,5 %) pacientů. Pro rozsáhlou dehiscenci anastomózy s poruchou vitality střeva jsme ve dvou případech po provedení TaTME s ISR dokončili amputaci rekta. U jednoho z těchto pacientů byla současně pozitivní DRM dle histologie. V jednom případě jsme řešili defekt anastomózy laparoskopickým uvolněním tračníku a konstrukcí nové, ručně šité anastomózy. U tohoto pacienta bylo následně možné provést zrušení stomie. V jednom případě jsme provedli laparoskopickou drenáž presakrální kolekce s dobrým efektem. Ve dvou případech jsme provedli relaparoskopii pro ileózní stav při srůstech tenkého střeva. V jednom případě byla provedena laparotomie pro pooperační ileus na tenkém střevě s nutností úpravy ileostomie. Defekt v anastomóze jsme zaznamenali u 19 (20,4 %) pacientů, což tvoří polovinu všech komplikací. Zde je nutné zdůraznit, že všechny tyto pacienty pravidelně endoskopicky kontrolujeme jednou týdně, až do doby zrušení stomie. Kromě výše uvedených tří případů, které si vyžádaly reoperaci, jsme v dalších čtyřech případech stav řešili podtlakovou drenáží s dobrým efektem. U dalších dvanácti (12,9 %) pacientů se jednalo o drobné defekty bez poruchy vitality stěny střevní, které se zhojily bez nutnosti intervence.
Tab. 5. Komplikace
Tab. 5. Complications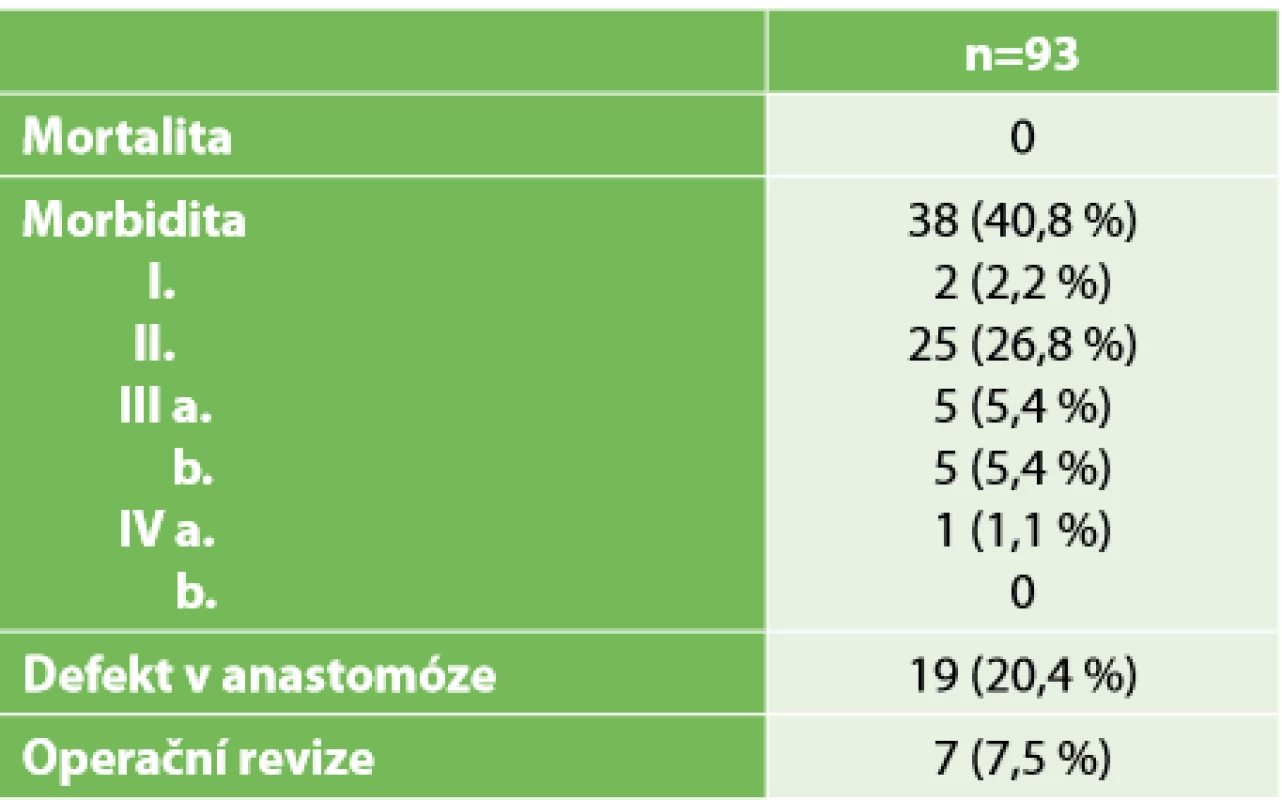
Provedení trvalé kolostomie bylo nutné provést ve čtyřech (4,3 %) případech z celkových 93 pacientů. Kromě výše popsaných případů jsme provedli amputaci rekta v jednom případě, a to 10 měsíců po primární resekci s ISR pro částečnou inkontinenci špatně tolerovanou pacientem. Stomie byla zrušena u 71 (82 %) z původně 86 založených stomií. Patnáct (17,4 %) pacientů má zatím protektivní stomii ponechanou, buď pro krátký čas od provedení resekce, odmítnutí zrušení stomie (3x), nebo pro progresi onemocnění s nutností onkologické léčby (4x). V rámci dlouhodobého dispenzárního sledování zemřelo doposud 6 pacientů z 93 operovaných (6,4 %), z toho tři pacienti měli primárně léčený synchronně metastazující tumor rekta. Ve dvou případech došlo k progresi onkologického onemocnění původně lokalizovaného na rektum do metastatického stadia, které bylo příčinou úmrtí. Jeden pacient zemřel tragicky před zrušením protektivní ileostomie.
DISKUZE
Cílem operační léčby karcinomu rekta je radikální odstranění tumoru s co nejlépe tolerovaným pooperačním průběhem, aby byl pacient dále schopen kvalitního života a případně i onkologické léčby v případě, že bude indikována. U TaTME je popsán kratší operační čas a menší krevní ztráty ve srovnání s laparoskopickou a otevřenou resekcí [11,12]. Při analýze souboru 762 pacientů byl zjištěn nižší výskyt pozitivity cirkumferenční resekční linie (CRM) a delší DRM ve skupině TaTME ve srovnání s laparoskopickou TME, tedy onkologicky příznivé výsledky [13]. Při srovnání laparoskopické a transanální resekce byla reziduální tkáň mezorekta nalezena při pooperačním vyšetření MRI u 3,1 % po TaTME a ve 46,9 % po laparoskopické TME [14]. Z důvodu selektování pacientů podstupujících TaTME pro níže lokalizované a objemnější tumory může být interpretace pooperačních výsledků obtížná. V práci z Tchaj-peje zjistili, že pacienti TaTME skupiny měli tumor lokalizovaný jednoznačně níže než pacienti ve skupině laparoskopických a otevřených TME [15]. V multicentrické studii z Holandska byli ve skupině TaTME významně častěji zastoupeni muži, měli větší výskyt nízko uložených tumorů a podle stagingové MRI častější ohrožení CRM než pacienti ve skupině laparoskopické TME [16]. Vedeme vzájemnou diskuzi s patology v otázce hodnocení kvality TME v případech, kde tumor zasahuje pod dolní část mezorekta, a tedy kolem něj logicky nemůže být mezorektální tuk. Z toho důvodu považujeme hodnocení v některých případech za sporné. Samozřejmě se na kvalitě TME podílí i vývoj learning curve operačního týmu. Selekce pacientů se projevuje i v našem souboru, kde mělo 86 % pacientů předoperačně indikovánu neoadjuvantní léčbu, jednalo se tedy o tumory rizikové pro R1 resekci. To může vysvětlovat relativně vysoký výskyt pozitivity CRM 10,7 % v našem souboru. Další selekční parametry byly dány především nízkou lokalizací, velikostí tumoru, ale také obezitou a úzkou pánví.
Přímá vizuální kontrola distální resekční linie je považována za jednu z hlavních výhod metody TaTME [7]. V našem souboru pacientů jsme zaznamenali pozitivní DRM ve třech případech. Vždy se jednalo o pacienty s velmi nízkým tumorem, kteří podstoupili intersfinkterickou resekci. U výše lokalizovaných tumorů je třeba tuto linii neposouvat více distálně, než je nutné pro onkologickou radikalitu, protože by to mohlo zhoršit problémy s kontinencí. Funkční výsledky po TME jsou velmi důležité a v případě komplikací mohou významně snižovat kvalitu života pacientů. Hlavní jsou problémy střevní, urologické a sexuální. Funkční problémy s vyprazdňováním postihují významnou část pacientů po TME, jsou nazývány syndrom nízké přední resekce (LARS) a samozřejmě se vyskytují i u pacientů po TaTME [17]. Na jejich vzniku se podílí více mechanismů: redukce objemu neorekta po resekci, poškození vegetativních nervů, poškození svěračů, ztráta rekto-análního inhibičního reflexu. Významnou roli hraje i výška provedení anastomózy a riziko poruchy kontinence narůstá u intersfinkterických resekcí. Delší DRM u TaTME než u výkonů provedených transabdominálně tak může potenciálně znamenat větší riziko výskytu LARS [18]. Prolongované zavedení transanální platformy a prodlužování času transanální části operace je rizikovým faktorem jak pro zachování kontinence, tak pro komplikace hojení anastomózy po TaTME [19].
Výskyt sexuálních a urologických dysfunkcí je vyšší po multimodální léčbě karcinomu rekta. Publikován je ve velmi širokém rozmezí případů s výskytem až v 76 %. Peroperační poškození je jednou z nejdůležitějších příčin vzniku. U části případů je možné se mu vyhnout při důsledném dodržování nerve-sparing operační techniky. V literatuře zatím nebyly popsány rozdílné funkční výsledky v závislosti na technice TME: laparoskopicky, roboticky, otevřeně [20]. Technika TaTME nabízí možnost dobré vizualizace pánevních neurovaskulárních pletení – tzv. neurovascular bundle of Walsh. Chouillard popsal jejich bezpečnou oboustrannou identifikaci v 78 % při TaTME, ale jen u 1/3 operovaných laparoskopicky. Navíc při transanálním, na rozdíl od transabdominálního, přístupu není nutná trakce proti oblasti semenných váčků, která se může na vzniku nervových poškození podílet [21]. Zejména v prvních fázích learning curve je u TaTME riziko, že preparace bude probíhat ve „snadné vrstvě“ více periferně, než je vrstva správná, což může vést k poškození nervů. Při správné orientaci však TaTME umožňuje preparaci ve správné vrstvě se zachováním vegetativních nervů i u anatomicky nepříznivých pacientů [22]. Problémem hodnocení funkčních výsledků je jejich stabilizace až po dlouhém čase po primární resekci, případně zrušení stomie. Proto je v této práci ještě nehodnotíme pro krátký časový odstup u významné části pacientů z našeho souboru.
Jednoznačnou výhodou TaTME ve srovnání s laparoskopickým výkonem je signifikantně nižší potřeba konverze na výkon otevřený: 0–1,5 % [11]. Při nutnosti konverze jsou signifikantně častější lokální rekurence tumoru, avšak jisté metaanalýzy poukazují na fakt, že toto tvrzení může být zpochybněno velkou heterogenitou souboru a zahrnutím pacientů jak s nádorem colon, tak i rekta [12,23]. Nízký výskyt konverzí je popisován i při robotickém provedení TME, které má však průměrně delší operační čas a vyšší finanční náklady [24]. I ve skupině pacientů z Holandska se hlavní benefit TaTME projevil v nižším výskytu konverzí na výkon otevřený: 1,5 % u TaTME vs. 8,6 % u laparoskopických TME [16]. V naší operační sestavě jsme byli nuceni provést konverzi pouze v jednom případě.
Výskyt anastomotického leaku po TME je popisován jako vyšší ve studiích, které se této problematice cíleně věnují. Jsou-li započítáni i pacienti asymptomatičtí, dosahuje při dlouhodobém sledování četnost leaků po TME až 26 %. Může to tedy znamenat, že výskyt leaků byl v literatuře podhodnocen [25]. Pozornost je této problematice samozřejmě věnována i při zavádění techniky TaTME. Naděje byly vkládány do jiné techniky provedení anastomózy, protože není třeba přerušovat rektum staplerem. Nejedná se tedy o double stapling techniku, u níž je známým rizikovým faktorem nutnost použití více nábojů k přerušení rekta. Zároveň pak při konstrukci anastomózy dochází ke křížení lineární staplerové linie se staplerovou linií cirkulárního stapleru [26]. Je-li dostatek rekta k provedení staplerové anastomózy, je rektum při TaTME uzavřeno „pouze“ tabáčkovým stehem a je provedena monostaplerová anastomóza. Zatím nebyl v literatuře potvrzen teoretický předpoklad nižšího výskytu leaku, patrně i s ohledem na jednoznačnou selekci pacientů indikovaných k TaTME v obtížnějších případech [16]. V souboru mezinárodního registru více než 1600 pacientů po TaTME nebyly zjištěny významnější rozdíly v rizikových faktorech pro leak z anastomózy po TaTME ve srovnání s dříve známými. Důležitým faktorem je narůstající délka trvání transanální fáze operace. Byl také zjištěn vyšší výskyt leaku u ručně šitých anastomóz ve srovnání se staplerovými [19]. Stejně tak to bylo v našem souboru pacientů. Zaznamenali jsme 20,4 % defektů anastomózy, ale opět v selektované skupině pacientů, kdy bylo 60 % anastomóz ručně šitých. Penna a kol. ve své studii z dat z mezinárodního registru TaTME uvádí incidenci selhání anastomózy v 15,7 % [19].
Transanální přístup byl původně vypracován s cílem usnadnění preparační fáze, umožnění snadnější manipulace v omezeném prostoru malé pánve s lepší přehledností jednotlivých anatomických vrstev. Minimálně invazivní přístupy v kolorektální chirurgii jsou přínosné nezávisle na věku pacientů, díky pozitivním krátkodobým výsledkům: menším bolestem, rychlejší rehabilitaci a rekonvalescenci [27]. Provedení krátké laparotomie k extrakci resekátu však tento přínos snižuje. Ještě před érou TaTME se objevily snahy o provádění extrakce resekátu přirozenými tělními otvory (NOSE). Jako první publikoval transanální extrakci resekátu rekta po TME a provedení anastomózy Person [28]. Při transanálním přístupu při resekční fázi je tedy možnost transanální extrakce snadným pokračováním, které umožňuje dále zlepšit krátkodobé výsledky: nižší bolesti, menší spotřebu analgetik a rychlejší návrat peristaltiky. Nepřítomnost laparotomie samozřejmě redukuje rizika infekce v ráně nebo vzniku kýly [29]. Obavy z možné kontaminace operačního pole při transanální extrakci resekátu vedly již dříve k analýze výskytu bakteriální kontaminace operačního pole. Ta byla zjištěna v 88 % při extrakci minilaparotomií, oproti 100 % u transanální extrakce, ale bez rozdílu ve výskytu klinicky průkazného infektu [30]. K prevenci vzniku implantačních metastáz lze při extrakci resekátu transanálně použít ochranný materiál podobně jako u minilaparotomie. Larsen a kol. popisují vzestup lokální rekurence nádoru z 3,4 % (u TME) na 9,5 % (u TaTME). Z těchto důvodů bylo na TaTME uvaleno v Norsku moratorium [8]. Naproti tomu však stojí Hol a kol., který uvádí dlouhodobější onkologické výsledky, a to lokální rekurenci nádoru po 3 letech 2 % a po 5 letech 4 % [31]. Technické problémy při transanální extrakci resekátu mohou nastat u obézních pacientů. Problémem zde může být objemné mezorektum a mezokolon. V některých studiích byl za kontraindikaci považován BMI >30. Stejně tak může být limitací transanální extrakce velikost tumoru. Za hraniční je uváděn průměr 65 mm [32]. Na našem pracovišti možnost transanální extrakce vždy kriticky zvažujeme a pouze u jedné čtvrtiny pacientů jsme resekát extrahovali transanálně.
Již výše zmíněný mezinárodní registr TaTME slouží k prospektivnímu sběru dat z více než 40 zemí a jeho cílem je adekvátní zhodnocení této metody. V současné době je pro implementaci TaTME k dispozici pouze mezinárodní konsenzus ze St. Gallen [33], na kterém se podílelo 37 kolorektálních chirurgů ze 20 zemí světa. Celková shoda byla více než 80%, což vypovídá o velké síle doporučení [34]. Musíme si také uvědomit, že tato studie může být zatížena nepřesnostmi stran heterogenního souboru a chybějící kontrolní skupiny.
ZÁVĚR
Ve srovnání s laparoskopickou TME má TaTME potenciální benefity. Umožňuje dobrou přehlednost operačního pole nízko v pánvi i u nepříznivých pacientů. Při přerušování rekta není použit stapler, a při konstrukci anastomózy tedy nedochází ke křížení staplerových linií jako u double stapling techniky v případě transabdominálního přístupu. V případě transanální extrakce resekátu není nutná žádná laparotomie, a redukuje se tedy riziko infekcí v ráně. Velmi nízký je výskyt konverzí na výkony otevřené, které mají další nepříznivé následky z hlediska krátkodobých i dlouhodobých komplikací. Díky dvěma operačním týmům se významně zkracuje délka operace. Funkční výsledky odpovídají rozsahu resekčního výkonu, a výskyt LARS je tedy poměrně častý. Benefit mají zejména pacienti, u kterých se pro obezitu, velikost a nízké uložení tumoru předpokládá obtížná TME. Selekce pacientů pro tento typ operačního výkonu je vhodná. Tímto pohledem je také nutné hodnotit výsledky souborů pacientů po TaTME, protože se často jedná o pacienty s technicky obtížnou resekcí. Až budou známé dlouhodobé onkologické i funkční výsledky, je možné, že dojde k přehodnocení indikací sfinkter šetřících výkonů.
Seznam zkratek:
ASA – skóre American Society of Anesthesiologists
BL – biologická léčba
BMI – body mass index
CRM – cirkumferenční resekční okraj
DRM – distální resekční okraj
HGD – high grade dysplazie
CHRT – chemoradioterapie
CHT – chemoterapie
ISR – intersfinkterická resekce
LARS – syndrom nízké přední resekce
MRI – magnetická rezonance
RT – radioterapie
TaTME – transanální totální mezorektální excize
TME – totální mezorektální excize
Podpořeno grantem AZV 16-31765 A
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Vladimír Procházka, Ph.D.
Chirurgická klinika, FN Brno Bohunice
Jihlavská 20
625 00 Brno
e-mail: Prochazka.Vladimir@fnbrno.cz
Zdroje
- Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986;1 : 1479–1482. doi:10.1016/s0140-6736(86)91510-2.
- Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Histopathological study of lateral tumor spread and surgical excision. Lancet 1986;2 : 996–999. doi:10.1016/s0140-6736(86)92612-7.
- Vennix S, Pelzers L, Bouvy N, et al. Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database of Systematic Reviews 2014;4:CD005200. doi:10.1002/14651858.CD005200.pub3.
- Bonjer HJ, Deijen CL, Abis GE, et al. COLOR II Study Group. A randomized trial of laparoscopic versus open surgery for rectal cancer. N Engl J Med 2015;372 : 1324–1332. doi:10.1056/NEJMoa1414882.
- Rullier E, Zerbib F, Laurent C, et al. Intersphincteric resection with excision of internal anal sphincter for conservative treatment of very low rectal cancer. Dis Colon Rectum 1999;42 : 1168–1175. doi:10.1007/bf02238569.
- Marks JH, Salem JF. From TATA to NOTES, how taTME fits into the evolutionary surgical tree. Tech Coloproctol. 2016;20 : 513–515. doi:10.1007/s10151-016-1504-9.
- Lacy AM, Tasende MM, Delgado S, et al. Transanal total mesorectal excision for rectal cancer: outcomes after 140 patients. J Am Coll Surg. 2015;221 : 415–423. doi:10.1016/j.jamcollsurg.2015.03.046.
- Larsen SG, Pfeffer F, Kørner H; Norwegian Colorectal Cancer Group. Norwegian moratorium on transanal total mesorectal excision. Br J Surg. 2019;106 : 1120–1121. doi:doi.org/10.1002/bjs.11287.
- Dindo D, Demartines N, Clavien PA. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg. 2004;240(2):205–213. doi:10.1097/01.sla.0000133083.54934.ae.
- Quirke P, Durdey P, Dixon MF, et al. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Histopathological study of lateral tumour spread and surgical excision. Lancet 1986;2 : 996–999. doi:10.1016/s0140-6736(86)92612-7.
- Perdawood SK, Thinggaard BS, Bjoern MX. Effect of transanal total mesorectal excision for rectal cancer: comparison of short-term outcomes with laparoscopic and open surgeries. Surg Endosc. 2018;32 : 2632–2642. doi:10.1007/s00464-017-5926-x.
- Xu W, Xu Z, Cheng H, et al. Comparison of short-term clinical outcomes between transanal and laparoscopic total mesorectal excision for the treatment of mid and low rectal cancer: A meta-analysis. Eur J Surg Oncol. 2016;42 : 1841–1850. doi:10.1016/j.ejso.2016.09.002.
- Jiang HP, Li Ys, Wang B, et al. Pathological outcomes of transanal versus laparoscopic total mesorectal excision for rectal cancer: a systematic review with meta-analysis. Surg Endosc. 2018;32 : 2632–2642. doi:10.1007/s00464-018-6103-6.
- Veltcamp Helbach M, Koedam TWA, et al. Residual mesorectum on postoperative magnetic resonance imaging following transanal total mesorectal excision (TaTME) and laparoscopic total mesorectal excision (LapTaTME) in rectal cancer. Surg Endosc. 2019;33 : 94–102. doi:10.1007/s00464-018-6279-9.
- Chen YI, Kiu KT, Chang TC. Comparison of the short-term outcomes in lower rectal cancer using three different surgical techniques: Transanal total mesorectal excision (TME), laparoscopic TME, and open TME. Asian J Surg. 2019;42 : 674–680. doi:10.1016/j.asjsur.2018.09.008.
- Detering R, Roodbeen SX, van Oostendorp SE, et al. Three year nationwide experience with transanal total mesorectal excision for rectal cancer in the Netherlands: A propensity score-matched comparison with conventional laparoscopic total mesorectal excision. J Am Coll Surg. 2019;228 : 235–244. doi:10.1016/j.jamcollsurg.2018.12.016.
- Bryant CL, Lunniss PJ, Knowles CH, et al. Anterior resection syndrome. Lancet Oncol. 2012;13:e403–408. doi:10.1016/S1470-2045(12)70236-X.
- Chen CC, Lai YL, Jiang JK, et l. Transanal total mesorectal excision versus laparoscopic surgery for rectal cancer receiving neoadjuvant chemoradiation: a matched case-control study. Ann Surg Oncol. 2016;23 : 1169–1176. doi:10.1245/s10434-015-4997-y.
- Penna M, Hompes R, Arnold S, et al. Incidence and risk factors for anastomotic failure in 1594 patients treated by transanal total mesorectal excision: Results from the International TaTME Registry. Ann Surg. 2018;269 : 700–711. doi:10.1097/SLA.0000000000002653.
- Celentano V, Cohen R, Warusavitarne J, et al. Sexual dysfunction following rectal cancer surgery. Int J Colorectal Dis. 2017;32 : 1523–1530. doi:10.1007/s00384-017-2826-4.
- Chouillard E, Regnier A, Vitte RL, et al. Transanal NOTES total mesorectal excision (TME) in patients with rectal cancer: is anatomy better preserved? Tech Coloproctol. 2016;20 : 537–44. doi:10.1007/s10151-016-1449-z.
- Koedam TWA, van Ramshorst GH, Deijen CL, et al. Transanal total mesorectal excision (TaTME) for rectal cancer: effects on patient-reported quality of life and functional outcome. Tech coloproctol. 2017;21 : 25–33. doi: 10.1007/s10151-016-1570-z.
- Allaix ME, Furnée EJ, Mistrangelo M, et al. Conversion of laparoscopic colorectal resection for cancer: What is the impact on short-term outcomes and survival? World J Gastroenterol. 2016;22 : 8304–8313. doi:10.3748/wjg.v22.i37.8304.
- Ki Young Lee, Jung Kyoung Shin, Yoon Ah Park, et al. Transanal endoscopic and transabdominal robotic total mesorectal excision for mid-to-low rectal cancer: Comparison of short-term postoperative and oncologic outcomes by using a case-matched analysis. Ann Coloproctol. 2018;34 : 29–35. doi: 10.3393/ac.2018.34.1.29.
- Hain E, Maggiori L, Manceau G, et al. Persistent asymptomatic anastomotic leakage after laparoscopic sphincter-saving surgery for rectal cancer: can diverting stoma be reversed safely at 6 months? Dis Colon Rectum 2016;59 : 369–376. doi:10.1097/DCR.0000000000000568.
- Ito M, Sugito M, Kobayashi A, et al. Relationship between multiple numbers of stapler firings during rectal division and anastomotic leakage after laparoscopic rectal resection. Int J Colorectal Dis. 2008;23 : 703–707. doi:10.1007/s00384-008-0470-8.
- Kasalický M, Martínek L, Penka I. Je laparoskopická kolorektální chirurgie bezpečná i u starších pacientů? Rozhl Chir. 2018;97 : 21–26.
- Person B, Vivas DA, Wexner SD. Totally laparoscopic low anterior resection with transperineal handsewn colonic J-pouch anal anastomosis for low rectal cancer. Surg Endosc. 2006;20 : 700–702. doi:10.1007/s00464-005-0581-z.
- Hu JH, Li XW, Wang CY, et al. Short-term efficacy of natural orifice specimen extraction surgery for low rectal cancer. World J Clin Cases 2019;26 : 122–129. doi:10.12998/wjcc.v7.i2.122.
- Constantino FA, Diana M, Wall J, et al. Prospective evaluation of peritoneal fluid contamination following transabdominal vs. transanal specimen extraction in laparoscopic left-sided colorectal resection. Surg Endosc. 2012;26 : 1495–1500. doi: 10.1007/s00464-011-2066-6.
- Hol JC, van Oostendorp SE, Tuynman JB, et al. Long-term oncological results after transanal total mesorectal excision for rectal carcinoma. Tech Coloproctol 2019;23 : 903-911. doi: https://doi.org/10.1007/s10151-019-02094-8.
- Izquierdo KM, Unal E, Marks JH. Natural orifice specimen extraction in colorectal surgery: patient selection and perspectives. Clinical and Experimental Gastroenterology 2018;11 : 265–279. doi:10.2147/CEG.S135331.
- International TaTME Registry [Internet] 2014. Available from: www.tatme.surgery.
- Adamina M, Buchs NC, Penna M, et al. St. Gallen Colorectal Consensus Expert Group. St. Gallen consensus on safe implementation of transanal total mesorectal excision. Surg Endosc. 2018;32 : 1091–1103. doi:10.1007/s00464-017-5990-2.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
-
Všechny články tohoto čísla
- „Quo vadis“ laparoskopická chirurgie… chirurgie 3.0?
- Laparoskopické resekce jater – state of art
- Pravostranná hemikolektomie – od laparoskopické asistence po robotickou intraabdominální anastomózu
- Perorální endoskopická pyloromyotomie (g-poem) v terapii gastroparézy – pilotní studie se středně dlouhým sledováním
- Naše zkušenosti s transanální totální mezorektální excizí (TaTME) u tumorů středního a distálního rekta
- Náhlé příhody břišní v těhotenství: retrospektivní studie gravidních pacientek hospitalizovaných pro bolesti břicha
- Perioperační akutní trombóza vnitřní karotidy po všeobecném chirurgickém výkonu
- Lumbální kýla − kazuistika
- Diskuze k editorialu „Můžeme vyřešit současné problémy regionálních chirurgických pracovišť?“ prof. MUDr. M. Rysky v Rozhledech chirurgie 2/2020.
- Profesor Eduard Albert: není Impakt jako „impact“.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pravostranná hemikolektomie – od laparoskopické asistence po robotickou intraabdominální anastomózu
- Náhlé příhody břišní v těhotenství: retrospektivní studie gravidních pacientek hospitalizovaných pro bolesti břicha
- Naše zkušenosti s transanální totální mezorektální excizí (TaTME) u tumorů středního a distálního rekta
- Lumbální kýla − kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



