-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaReimplantace AMI a akcesorní pravé AR u infrarenálního AAA a současný pohled na indikační kritéria k reimplantaci AMI
Replantation of IMA and Accessory Right RA during Infrarenal AAA Repair and a Current View on Indications for IMA Replanting
Introduction:
Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair is a measure which might prevent development of colon ischemia under certain circumstances. These circumstances and patients who would benefit from this procedure are not well defined.Case report:
64-year old man underwent an elective operation on infrarenal AAA at our institution in December 2009. From preoperative CT angiography we knew about the accessory right renal artery branching directly from AAA and bilateral occlusion of hypogastric arteries. We performed open resection of AAA with implantation of a bifurcated graft. Proximal anastomosis was situated below renal arteries, distal anastomoses were bilaterally constructed on external illiac arteries. The accessory right renal artery was anastomosed into the right limb of the graft and IMA was replanted into the body of the graft. Postoperative recovery of the patient was uneventful. His follow-ups 3 and 6 months after the operation have been showing good clinical state of the patient, absence of abdominal complaints and normal levels of urea and creatinine. CT angiography which was performed 3 months after the operation discovered an occlusion of the reimplanted IMA, but patent replanted accessory right renal artery.Discussion:
Assessment of collateral circulation of large intestine during infrarenal AAA repair is influenced by many preoperative and intraoperative factors. Most surgeons judge the adequacy of the collateral circulation by IMA backbleeding combined with inspection of sigmoid colon after restoring aortic flow. There have been numerous attempts to replace this subjective approach with more objective methods like intraoperative colon mucosal saturation measurement, laser Doppler flowmetry, IMA stump pressures, photophletyzmographic technique. Even though these methods describe conditions when a collateral circulation of rectosigmoid is inadequate after IMA ligature, they are unable to fully eliminate the occurrence of colon ischemia because of its multifactorial nature. Solving the problem of collateral circulation of the large intestine represents only a part of the obstacle presented by colon ischemia after infrarenal AAA repair.Conclusion:
IMA replantation during infrarenal AAA repair does not fully prevent an occurance of colon ischemia. On the other side, this moneuver does not increase perioperative morbidity, nor prolongs an operation significantly. Our policy is to replant IMA whenever we thing the circulation of large intestine is under threat or in borderline situations.Key words:
AAA repair – IMA replantation – colon ischemia
Autoři: E. Biroš; R. Staffa; Z. Kříž
Působiště autorů: II. chirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: prof. MUDr. R. Staffa, Ph. D.
Vyšlo v časopise: Rozhl. Chir., 2010, roč. 89, č. 9, s. 551-555.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Indikační kritéria k reimplantaci AMI jako možného preventivního prostředku k zamezení vzniku ischemické kolitídy u pacientů podstupujících elektivní resekční výkon pro infrarenální AAA nejsou dosud jednoznačně stanovena. I soudobá literatura se rozchází v definování populace pacientů, kteří by mohli z uvedeného výkonu profitovat.Kazuistika:
Autoři prezentují případ 64letého pacienta, který podstoupil elektivní resekci infrarenálního AAA. Předoperační CTA prokázalo odstup dolní pólové renální tepny vpravo přímo z aneuryzmatu a taky oboustranný uzávěr AII. Během operačního výkonu byla provedena resekce AAA s implantací aortobiiliakální protézy, kdy proximální anastomóza byla našita subrenálně a obě distální anastomózy na AIE. Dále byla provedena reimplantace dolní pólové pravé renální tepny do pravého ramene graftu a reimplantace AMI do těla graftu. Pooperační průběh byl nekomplikovaný. Kontrolní vyšetření pacienta s odstupem 3 a 6 měsíců od operace prokázala jeho dobrý klinický stav, nepřítomnost abdominálních obtíží a normální parametry renálních funkcí. Provedené kontrolní CTA prokázalo průchodnost replantované renální tepny ale nezobrazení tedy pravděpodobnou okluzi AMI.Diskuse:
Zhodnocení kolaterální cirkulace v povodí AMI během resekčních výkonů na infrarenální aortě je ovlivněno souborem předoperačních i peroperačních informací. Kromě klasického zhodnocení retrográdního krvácení z pahýlu AMI a inspekce sigmatu se zkoušel a nebo používá široký rozptyl různě sofistikovaných postupů (arteriální tlak v pahýlu AMI, Dopplerovská ultrasonografie stěny tlustého střeva, intraluminální měření pH tlustého střeva, peroperační kontrola saturace kyslíkem sliznice tlustého střeva a rekta, fotopletyzmografie, a jiné). I když většina uvedených postupů celkem jasně definuje situace, kdy kolateralizace oběhu rektosigmatu při podvazu AMI je nedostatečná, nelze od uvedených postupů očekávat plnou eliminaci problému jménem „ischemická kolitida“ po výkonech na abdominální aortě, vzhledem na jeho multifaktoriální etiologii, kdy problém kolaterální cirkulace představuje jenom část v jeho řešení.Závěr:
Reimplantace AMI nezamezí zcela vzniku IC u pacientů po operacích infrarenálních AAA. Je to však výkon, který nezvyšuje perioperační morbiditu, signifikantně neprodlužuje operační čas a nepředstavuje zvýšené riziko pro pacienta. Proto i my se kloníme k postupu, kdy při jakýchkoliv pochybnostech nebo hraničních situacích stran prokrvení tlustého střeva AMI reimplantujeme.Klíčová slova:
resekce AAA – reimplantace AMI – pooperační ischemická kolitidaÚVOD
Ischemická kolitida (IC) nepřestává být závažnou komplikací, která výrazně zvyšuje pooperační morbiditu a mortalitu pacientů po operacích aneuryzmat infrarenální břišní aorty (AAA) za elektivních i urgentních situací. Klasická klasifikace ischemické kolitidy [1] rozlišuje její 3 stupně:
Stupeň I: představuje postižení sliznice a submukózy ischemií, otokem a hemoragiemi, které vedou k odloučení epitelu sliznice. Průjem s příměsí krve nebo bez její příměsi během prvních 24–48 hodin po operaci představuje typickou formu klinické prezentace. Teplota nebývá povětšinou zvýšená. Uvedené změny jsou při správném konzervativním postupu plně reverzibilní, bez následků a s prakticky nulovou mortalitou [1].
Stupeň II: kdy kromě výše popsaných změn je současně přítomno i postižení muskulární vrstvy stěny colon. Klinická symptomatologie osciluje mezi I. a III. stupněm střevní ischémie. Změny jsou taky reverzibilní s možným důsledkem ve smyslu postischemické striktury střeva.
Stupeň III: je transmurální formou postižení střevní stěny s její nekrózou. Klinický obraz představuje kombinaci patologických projevů sepse, poruch vnitřního prostředí, hemodynamické instability nebo šoku. Můžou být vyjádřeny známky difuzní peritonitidy. Veškeré změny střevní stěny jsou ireverzibilní a tato forma postižení je zatížena 60–100% mortalitou. Takto vysoké procento úmrtnosti plně rozvinuté formy IC nás vede k potřebě vypracování především preventivních postupů za účelem zamezení jejího vzniku.
Klinicky signifikantní ischemie tlustého střeva komplikuje stonání 1–3 % pacientů operovaných elektivně [2, 3] a 10–36 % pacientů operovaných pro rupturu AAA (rAAA) [4, 5]. V případě zapojení endoskopického monitoringu a histologického vyšetření stěny tlustého střeva se incidence ischemické kolitidy zvyšuje až na úroveň 7 % u pacientů operovaných elektivně [6] a až 60 % u pacientů operovaných pro rAAA [7]. Rektosigma je částí tlustého střeva, které bývá nejčastěji postižené [8]. K prevenci vzniku této komplikace je nutno znát krevní zásobení sigmatu, rekta a pánve společně s četnými faktory, které hrají roli při jejím vzniku.
Cévní zásobení tlustého střeva a pánve vychází z bohaté sítě kolaterál mezi horní a dolní mezenterickou tepnou, vnitřními pánevními tepnami a hlubokými stehenními tepnami na obou dolních končetinách. Riolanova arkáda (v anglosaské literatuře používaný termín „meandering mesenteric artery of Moskowitz“) probíhající v oblasti baze mezentéria tlustého střeva společně s Drummondovou arkádou (anglosaský termín „marginal artery of Drummond“) probíhající v mezentériu tlustého střeva těsně při jeho stěně v celém jeho průběhu představují nejdůležitější kolaterální cirkulaci mezi AMS a AMI [9]. Colon sigmoideum může přijímat kolaterální cirkulaci i cestou arteria illica interna přes horní rektální tepnu nebo i cestou cirkumflexních femorálních tepen, majících původ v hluboké stehenní tepně, v případě okluze vnitřní pánevní tepny.
Resekce AAA může poškodit prokrvení rektosigmatu jednak ligací AMI nebo vnitřní pánevní tepny, embolizací aneuryzmatických hmot do těchto cév, protrahovanou hypotenzí (především v případě operací pro rAAA), nebo iatrogenního poranění kolaterálních cév retraktorem nebo manipulací během operace. Koncept reimplantace AMI ve snaze snížit incidenci IC vychází ze snahy eliminovat závislost pooperačního prokrvení rektosigmatu na kolaterálním prokrvení z AMS, ilických nebo hlubokých stehenních tepen. Dostatečnost této kolateralizace lze obtížně zhodnotit jak předoperačně z provedených zobrazovacích vyšetření tak i peroperačně za použití klinických nebo různě sofistikovaných pomocných vyšetření. V případě dále uvedené kazuistiky vycházela naše indikace k reimplantaci AMI z CTA prokázané oboustranné okluze AII potvrzené peroperačně, což jsme vyhodnotili jako faktor, který při prostém podvazu AMI může vést k nedostatečnému kolaterálnímu prokrvení rektosigmatu a tím i vzniku ischemické kolitidy v souladu s prácemi Zelenocka [7] nebo Connollyho [10].
KAZUISTIKA
V prosinci 2009 na II. chirurgické klinice LF MU a FN u sv. Anny v Brně podstoupil 64letý pacient elektivní operaci pro infrarenální AAA. Pacient byl muž, s BMI 33, s anamnézou ischemické choroby srdeční a stavu po aortokoronárním bypassu, hypertenze, hyperlipoproteinemie, hyperurikemie, ischemické nemoci dolních končetin stupně podle Fontaina IIb, stavu po apendektomii a revizi břišní dutiny pro úraz v minulosti. Předoperačně provedené CTA prokázalo infrarenální AAA průměru 5 cm a délky 8 cm přecházející oboustranně na AIC s jejich aneuryzmatickou dilatací vpravo 5,5 cm, vlevo 4 cm, s nepostižením AIE bilat. Dále obraz dolní pólové pravé renální tepny odstupující z těla aneuryzmatu. Vnitřní ilické tepny byly oboustranně uzavřené (Obr. 1). Na popliteálních tepnách byl nález konkomitantních aneuryzmat, vpravo šíře 3,5 cm, vlevo 2,6 cm. Předoperační laboratorní screening včetně hodnot renálních funkcí (urea, kreatinín) nevykazoval žádnou patologii. Pacient dne 14. 12. 2009 po standardní přípravě podstoupil transperitoneálním přístupem resekci AAA s implantací aorto-biilické bifurkační cévní protézy (RgbvK 8 x 15 mm, VÚP), s proximální anastomózou end to end protéza k subrenální aortě a distálním napojením end to end na zevní pánevní tepny oboustranně. AII bilat. i přes svoji okluzi byly ligovány. Dolní pólová pravá renální tepna byla reimplantována do pravého ramene graftu. AMI po sestřižení patentní, s dobrým zpětným krevním proudem, ale vzhledem na i peroperačně potvrzenou skutečnost okluze AII bilat. rozhodnuto o její replantaci do těla graftu (Obr. 2). Pooperační průběh byl nekomplikovaný, s hojením ran per primam, obnovou střevní pasáže 3. pooperační den a fyziologickými hodnotami urey (31 mmol/l) i kreatinínu (71 mmol/l). Pacient propuštěn do ambulantní péče desátý pooperační den. V průběhu jeho dispenzarizace 3 a 6 měsíců po operaci, nebyly shledány klinické komplikace, pacient byl bez abdominálních obtíží, jeho klaudikační interval se z předoperační hodnoty 50–100 m prodloužil na úroveň 200 pro obě dolní končetiny. Provedené kontrolní CTA s odstupem 3 měsíců prokázalo průchozí reimplantovanou dolní pólovou renální tepnu vpravo ale nezobrazilo reimplantovanou AMI (Obr. 3). Vzhledem na nepřítomnost břišních obtíží u pacienta, stabilizovanou váhu, nebyla indikace k dalšímu řešení uzávěru. Pacient je t.č. objednán k operačnímu řešení aneryzmatu popliteální arterie vpravo.
Obr. 1. Předoperační CTA pacienta se zobrazením AMI a akcesorní pravé pólové renální tepny Fig. 1. Preoperative CT angiography of the patient which demonstrates the accessory right renal artery and inferior mesenteric artery 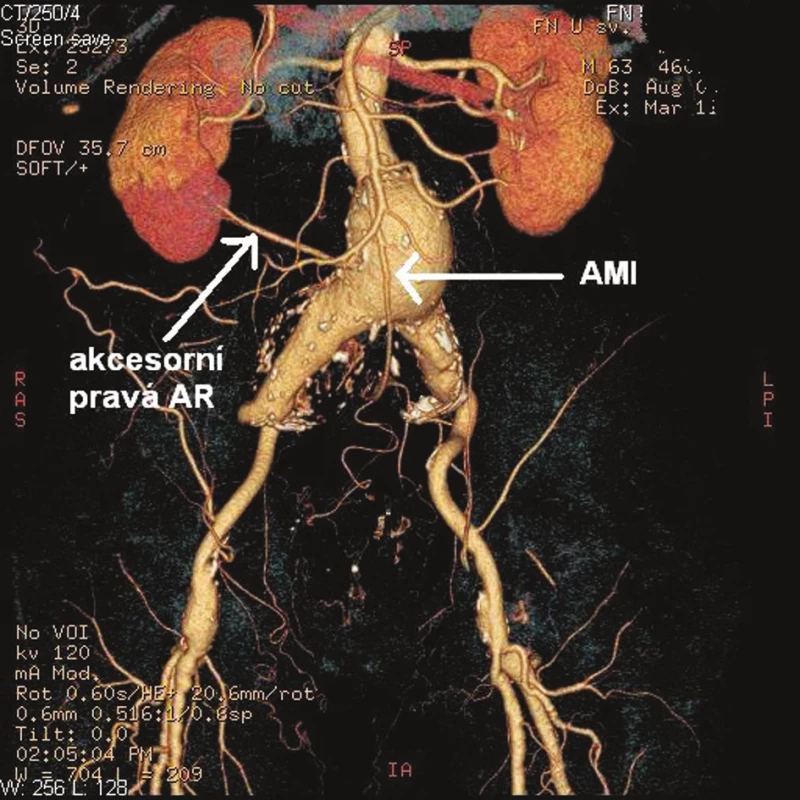
Obr. 2. Peroperační snímek aorto-biillické protézy s reimplantovanou AMI a akcesorní pravou AR Fig. 2. An intraoperative image showing bifurcated graft with reimplanted accessory right renal artery in the right limb of the graft and reimplanted IMA in the body of the graft 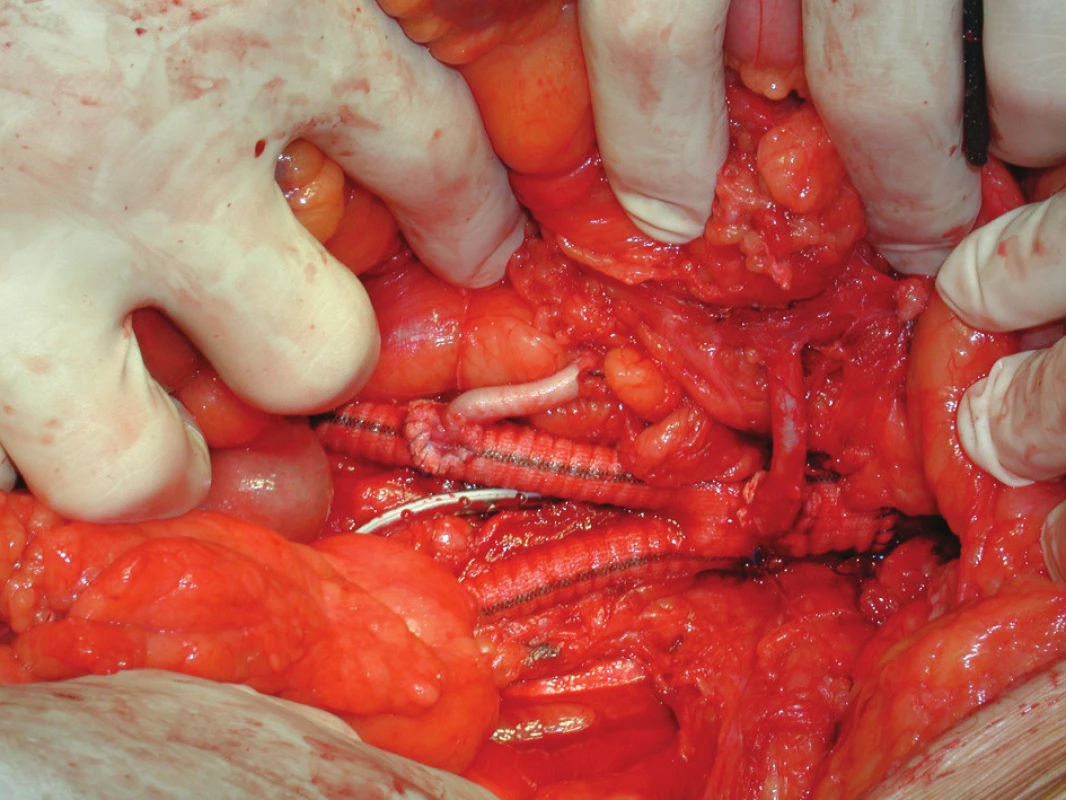
Obr. 3. Pooperační rekonstrukce CTA s nálezem průchodné reimplantované akcesorní AR a uzavřené AMI Fig. 3: Postoperative CTA with patent reimplanted accessory right renal artery (AR) and occluded reimplanted inferior mesenteric artery (AMI) 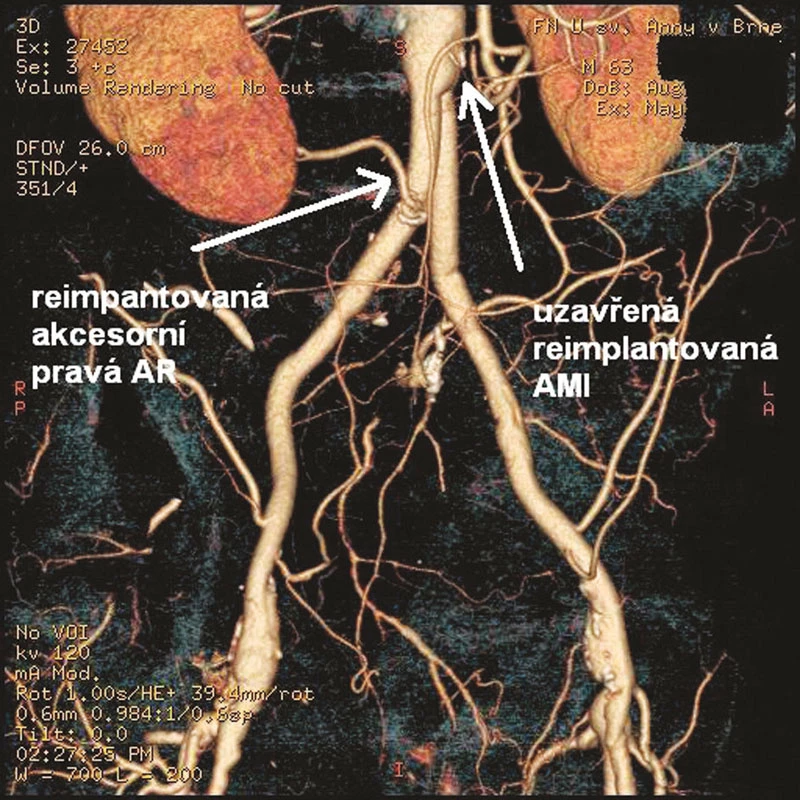
DISKUSE
První případ úspěšné resekce AAA byl popsán Dubostem v roce 1952 [11]. Dva roky poté, v roce 1954, popsal Moore případ pacienta s ischemií tlustého střeva po resekčním výkonu pro AAA. Od tohoto roku se vaskulární chirurgové snaží najít způsob jak této devastující komplikaci zabránit. Vzhledem na multifaktoriální povahu vzniku ischemie tlustého střeva je nutno připustit, že neexistuje jeden univerzální postup nebo doporučení, který by vznik uvedené komplikace bezpečně vyloučil. Cévní chirurg může aktivně během operačního výkonu vznik ischemické kolitidy sám ovlivnit, při zamezení vzniku embolizace, hypotenze rezultující z peroperačního krvácení nebo iatrogenního poranění, v podstatě jenom indikací nebo neindikací reimplantace AMI nebo rekonstrukce AII. Jistě, početné studie prokázaly, že ani standardní reimplantace AMI zcela nezamezí vzniku pooperační ischemické kolitídy [6, 12]. To ale neznamená, že nelze definovat populaci pacientů, kteří mohou z indikace uvedeného výkonu profitovat. Na základě prostudování dostupných prací s tematikou prevence IC bychom měli reimplantaci průchozí AMI silně zvažovat u těchto skupin pacientů:
- Pacienti s anamnézou resekčního výkonu na tlustém střevě, kdy v průběhu kolorektální operace mohlo dojít k přerušení přirozených kolaterálních cirkulací pro tlusté střevo.
- Pacienti po prodělané radioterapii pánve např. z důvodu nádoru prostaty, močového měchýře nebo dělohy [13].
- Pacienti s oboustrannou okluzí vnitřních pánevních tepen a z toho vyplývající limitující kolaterální cirkulací tlustého střeva [7, 10].
- Pacienti, kteří na základě předoperačních zobrazovacích vyšetření mají těžké postižení AMS/TC, u kterých lze často na předoperačních snímcích i prokázat přítomnost mohutných kolaterál derivujících krev z průchozí AMI do povodí AMS nebo TC.
- Pacienti s chronickým renálním selháním a hladinou kreatininu nad 200 mmol/l [5]. CHRI je spojená s těžkým postižením arterií středního a malého kalibru. Uvedená skutečnost je dobře patrná na tepenném systému dolních končetin a stejný koncept velice pravděpodobně platí i pro kolickou cirkulaci. Pacient s CHRI je kromě toho mnohem více ohrožen vznikem hemodynamické nestability během operačního výkonu, což je další faktor zodpovědný za vznik IC, především u pacientů s rAAA.
- Na základě randomizované studie podvazu nebo reimplantace AMI provedené Senekowitschem vyplývá, že z reimplantace mohou více profitovat starší pacienti nad 75 let, kteří jsou postiženi IC častěji než pacienti mladší 75 let [6].
Kromě předoperačních kritérií jsou to i peroperační faktory, které mohou poukázat na potřebu reimplantace průchozí AMI. Většina chirurgů zhodnocuje adekvátnost kolaterální cirkulace tlustého střeva pomocí dočasného clampingu průchozí AMI v době rekonstrukce aneuryzmatu a posléze subjektivním zhodnocením zpětného toku krve po obnově aortálního průtoku. Tento subjektivní odhad je ještě doplněn o inspekci vitality tlustého střeva. Přítomnost pulzního zpětného krevního toku z pahýlu AMI je obecně považována za bezpečnou možnost ligace AMS bez její reimplantace.V průběhu let se snaha více objektivně zhodnotit peroperační potřebu replantace AMI projevila v použití širokého spektra metod:
- Aplikace fotopletyzmografie společně s peroperačním monitoringem transkolonické saturace kyslíkem, kdy ztráta pulzního fotopletyzmografického signálu společně s neměřitelnou transkolonickou saturací byla Ourielem označena jako průkazná pro neadekvátnost cirkulace tlustým střevem s nutností rekonstrukce povodí AMI [14].
- Skupina z Mayo Clinic popsala v roce 1992 metodu intravenózní aplikace fluorosceinu a detekci jeho distribuce ve stěně tlustého střeva pod Woodsovou lampou [15].
- Technika měření arteriálního tlaku v pahýlu AMI popsaná Ernstem, kdy tlak nad 40 mm Hg v pahýlu AMI byl hodnocen jako dostatečný pro pooperační perfuzi sigmatu [16]. Obdobná práce z roku 2005 hodnotí potřebný tlak na úrovni 50 mm Hg [17].
- Peroperační kontrola saturace kyslíkem sliznice tlustého střeva a rekta navržená týmem z Kalifornské univerzity, používá spektroskopický oxymetr. Pokles saturací sliznice rekta pod 40 % hodnot na začátku výkonu byl uvedeným týmem hodnocen jako stav vyžadující rekonstrukci povodí AMI [18].
- Trvání operačního výkonu nad 4 hodiny, nebo peroperační krevní ztráta nad 2 litry jsou také v literatuře hodnoceny jako faktory, které by měly naše rozhodování naklonit ve prospěch reimplantace AMI [5].
- Laserová Dopplerovská flowmetrie, která hodnotí průtok erytrocytů stěnou sigmatu po revaskularizaci rAAA v podobě perfuzních jednotek. Při počtu perfuzních jednotek pod 50 je riziko rozvoje IC signifikatně zvýšeno a revaskularizace tlustého střeva by měla být provedena [19].
- Zhodnocení arteriálních toků v mesocolon po obnovení průtoku v aortě pomocí peroperační Doppler-sonografie je další z řady metod, které se snaží zhodnotit adekvátnost kolaterálního zásobení tlustého střeva. Prvně popsaná byla již v roce 1975 Wrightem a Hobsonem [20].
Soubor výše popsaných postupů můžeme považovat za určitá doporučení, která nám soudobá chirurgická literatura dává k dispozici, při řešení mnohdy velice komplexní otázky revaskularizace povodí AMI. I námi uváděná kazuistika, kdy reimplantovaná AMI při oboustranné okluzi AII je při kontrolním CTA obliterována bez klinické odezvy u pacienta, poukazuje na fakt, že tento problém není i přes řadu doporučení zatím plně vyřešen.
ZÁVĚR
Soudobé práce prokazují, že ani rutinní reimplantace AMI nevede k odstranění rizika vzniku pooperační IC u pacientů podstupujících resekci infrarenální AAA. Rutinní reimplantace AMI proto není v literatuře doporučena. Současně však většina autorů prokazuje, že vlastní reimplantace nezvyšuje perioperační morbiditu, signifikantně neprodlužuje operační čas a nepředstavuje zvýšené riziko pro pacienta. Proto i my se kloníme k postupu, kdy při jakýchkoliv pochybnostech nebo hraničních situacích AMI reimplantujeme.
Použité zkratky:
AAA – aneuryzma abdominální aorty
AIE – arteria illica externa
AMI, IMA – arteria mesenterica inferior
TC – truncus coeliacus
IC – ischemická kolitida
CTA – CT angiografie
AII – arteria illica interna
CHRI – chronická renální insuficience
rAAA – rupturovaná AAA
AR, RA – arteria renalis
MUDr. Ernest Biroš
Tišnovská 31
613 00 Brno-Černá Pole
e-mail: ernest.biros@fnusa.cz
Zdroje
1. Rutherford, R. Vascular Surgery. 6th edition, Saunders, 2005.
2. Kaiser, M. M., Wenk, H., Sassen, R., Müller, G., Bruch, H. P. Ischemic colitis after vascular surgery reconstruction of an abdominal aortic aneurysm. Chirurg, 1996, Apr; 67 (4): 380–386.
3. Cruz, C. P., Drouilhet, J. C., Southern, F. N., Eidt, J. F., Barnes, R. W., Moursi, M. M. Abdominal aortic aneurysm repair. Vasc. Surg., 2001 Sep-Oct; 35(5): 335–344.
4. Champagne, B. J., Darling, R. C. 3rd, Daneshmand, M., Kreienberg, P. B., Lee, E. C., Mehta, M., Roddy, S. P., Chang, B. B., Paty, P. S., Ozsvath, K. J., Shah, D. M. Outcome of aggressive surveillance colonoscopy in ruptured abdominal aortic aneurysm. J. Vasc. Surg., 2004 Apr; 39(4): 792–796.
5. Becquemin, J.-P., Majewski, M., Fermani, N., Marzelle, J. Colon ischemia following abdominal aortic aneurysm repair in the era of endovascular abdominal aortic repair. Journal of Vascular Surgery, 2008 Feb, 47(2): 258–263.
6. Senekowitsch, C., Assadian, A., Assadian, O., Hartleb, H., Ptakovsky, H., Hagmüller, G. W. Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair: influence on postoperative colon ischemia. J. Vasc. Surg., 2006 Apr; 43(4): 689–694.
7. Zelenock, G. B., Strodel, W. E., Knol, J. A., Messina, L. M., Wakefield, T. W., Lindenauer, S. M., Eckhauser, F. E., Greenfield, L. J., Stanley, J. C. A prospective study of clinically and endoscopically documented colonic ischemia in 100 patients undergoing aortic reconstructive surgery with aggressive colonic and direct pelvic revascularization, compared with historic controls. Surgery, 1989 Oct; 106(4): 771–779; discussion 779–780.
8. Björck, M., Berquist, D., Troeng, T. Incidence and clinical presentation of bowel ischemia after aortoiliac surgery – 2930 operations from a population based registry in Sweden. Eur. J. Vasc. Endovasc. Surg., 1996; 12 : 139–144.
9. Gourley, E. J., Gering, S. A. The Meandering Mesenteric Artery: A Historic Review and Surgical Implications. Diseases of the Colon & Rectum. New York: May 2005, Vol. 48, Iss. 5; p. 996.
10. Connolly, J. E., Ingegno, M., Wilson, S. E. Preservation of the pelvic circulation during infrarenal aortic surgery. Cardiovasc. Surg., 1996, 4 : 65.
11. Dubost, C., Allary, M., Oeconomos, N. Resection of an aneurysm of the abdominal aorta: reestablishment of the continuity by a preserved human arterial graft, with result after five months. Arch. Surg., 1952, 64 : 405–408.
12. Mitchell, K. M., Valentine, R. J. Inferior mesenteric artery reimplantation does not guarantee colon viability in aortic surgery. J. Am. Coll. Surg., 2002, 194 : 151–155.
13. Israeli, D., Dardik, H., Wolodiger, F., Silvestri, F., Scherl, B., Chessler, R. Pelvic radiation therapy as a risk factor for ischemic colitis complicating abdominal aortic reconstruction. J. Vasc. Surg., 1996 Apr; 23(4): 706–709.
14. Oriel, K., Fjord, W. M., Geary, J. E. Detection of occult colonic ischemia during aortic prodedures: Use of an intraoperative photoplethysmographic technique. J. Vasc. Surg., 1988, 7 : 5.
15. Begman, R. Z., Gloviczki, P., Welch, T. J., et al. The role of intravenous fluorescein in the detection of colon ischemia duringn aortic reconstruction. Ann. Vasc. Surg., 1992, 6 : 74.
16. Ernst, C. B., Hagihara, P. F., Daugherty, M. E., Griffen, W. O. Inferior mesenteric artery stump pressure: A reliable index for safe IMA ligation during abdominal aortic aneurysmectomy. Ann. Surg., 1978, 187 : 641.
17. Abromaitis, D., Antusevas, A. Prevention of intestinal ischemia after abdominal aortic reconstructive surgery. Medicina (Kaunas), 2005; 41(4): 295–304.
18. Lee, E. S., Bass A., Arko, F. R., Heikkinen M. Intraoperative colon mucosal oxygen saturation during aortic surgery. Journal of Surgical Research, 2006, Vol. 136, No 1.: 19–24.
19. Redaelli, C. A., Schilling, M. K., Carrel, T. P. Intraoperative aasessment of intestinal viability by laser Doppler flowmetry for surgery of ruptured abdominal aortic aneurysms. World J. Surg., 1998 Mar, 23 (3): 283–289.
20. Wright, C. B., Hobson, R. W. 2nd Prediction of intestinal viability using Doppler ultrasound technics. Am. J. Surg., 1975, 129 : 642–645.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2010 Číslo 9- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- 4. setkání hrudních chirurgů 3. 6. 2010 Plzeň
- Augmentace dekompresivní kraniektomie obvazovou textilií COM 30 v terapii refrakterní nitrolební hypertenze – kazuistika
- Paréza radiálního nervu způsobená pakloubem diafýzy humeru – kazuistika
- Lymfadenektomie u papilárního karcinomu štítné žlázy
- Hernia pľúc po limitovanej torakotómií
- Reimplantace AMI a akcesorní pravé AR u infrarenálního AAA a současný pohled na indikační kritéria k reimplantaci AMI
- Problematika embolizace větve portální žíly u nemocných s primárně neoperabilními nádory jater
- Neobvyklý přístup k resekci metastázy jater
- Poúrazová pseudocysta sleziny
- Prudká infekce kosti a měkkých tkání horní končetiny – kazuistika
- Fraktura proximálního humeru komplikovaná lézí arteria axillaris – kazuistika
- Laudatum k 60. narozeninám prim. MUDr. Jiřího Gaťka, Ph.D.
- Zápis z jednání schůze výboru ČCHS dne 21. 6. 2010
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prudká infekce kosti a měkkých tkání horní končetiny – kazuistika
- Lymfadenektomie u papilárního karcinomu štítné žlázy
- Poúrazová pseudocysta sleziny
- Paréza radiálního nervu způsobená pakloubem diafýzy humeru – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



