-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití 11C-methioninu pro PET/CT vyšetření pacientů s tumory mozku – soubor 16 pacientů
Assessment of 11C-methionine for PET/CT examination of patients with a brain tumor – group of 16 patients
Introduction:
FDG PET imaging of the brain is not ideal in patients with a brain tumor due to a high physiological accumulation of FDG in the brain tissue. These suboptimal results stimulated seeking for different radiopharmaceuticals for better imaging of brain tumors.
Goal:
To verify a possiblity of the use of 11C-methionine for evaluation of patients with brain tumors.
Method:
18 patients with brain tumors were included to the phase I clinical trial; 16 of them were evaluated, 12 had a glioblastoma, 2 an astrocytoma, 1 an oligodendroglioma and 1 a testicular tumor metastasis. PET acquisition of all patients was performed after injection of 11C-methionine at 5, 20 and 35 minutes post injection, respectively, to assess the accumulation in the tumors. Safety evaluation of injected tracer was a part of this study.
Results:
Increased accumulation of 11C-methionine in the tumor was detected in all evaluated patients; it reached 2.5fold higher values comparing to a normal brain tissue measured by a maximal value of standardized uptake value (SUVmax).
Conclusion:
11C-methionine is a useful radiopharmaceutical for the assessment of the brain tumor extent in patients with a high-grade gliomas or recurrent or progressive gliomas with a low grade in which a transformation to the high-grade gliomas can be considered.
Key words
: PET/CT, 11C-methionine, brain tumors
Autoři: J. Vašina 1; M. Svoboda 2
; R. Lakomý 2; T. Kazda 3; Ing. Jan Adam 4; Z. Řehák 1
Působiště autorů: Oddělení nukleární medicíny a PET centrum MOÚ, Brno, ČR 1; Klinika komplexní onkologické péče MOÚ, Brno, ČR 2; Klinika radiační onkologie MOÚ, Brno, ČR 3; Ústav jaderného výzkumu, Řež, ČR 4
Vyšlo v časopise: NuklMed 2018;7:62-68
Kategorie: Původní práce
Souhrn
Úvod:
FDG PET/CT vyšetření mozku neposkytuje u pacientů s tumory mozku optimální výsledky pro vysokou akumulaci FDG obvykle měřenou v mozku. Tyto suboptimální výsledky vedou k hledání a testování jiných radiofarmak pro lepší zobrazení tumorů mozku.
Cíl:
Ověření možnosti využití 11C-methioninu pro PET/CT vyšetření pacientů s tumory mozku.
Metoda
: Do klinické studie fáze I bylo zařazeno celkem 18 pacientů s tumory mozku, z toho hodnoceno bylo 16 pacientů, 12 s glioblastomem, 2 s astrocytomem, po jednom pacientu s oligodendrogliomem a metastázou testikulárního tumoru. Všichni pacienti podstoupili po aplikaci 11C-methioninu PET snímání v odstupu 5, 20 a 35 minut ke stanovení akumulace methioninu v tumoru. V rámci studie proběhlo i zhodnocení bezpečnosti aplikovaného přípravku.
Výsledky:
U všech hodnocených pacientů byla zobrazena zvýšená akumulace methioninu v tumoru s hodnotami 2,5x vyššími ež v normální mozkové tkáni měřenými pomocí maximální hodnoty “standardized uptake value” (SUVmax).
Závěr:
Methionin je vhodným radiofarmakem pro stanovení rozsahu postižení u pacientů s high-grade gliomy nebo rekurentními či progredujícími gliomy s nízkým stupněm gradingu, u kterých lze předpokládat transformaci do high grade gliomů.
Klíčová slova:
PET/CT, 11C-methionin, tumory CNS
ÚVOD
Incidence primárních tumorů centrálního nervového systému (CNS) je v České republice 7,8–8,5 případů na 100 000 obyvatel a rok. 1 Dle histologické klasifikace jsou nejčastějšími maligními primárními tumory CNS gliomy se 40 až 50 %. 2
2-eoxy-2-[18F]fluoro-D-glukóza (18F-FDG, FDG) je nejčastěji užívaným radiofarmakem v PET/CT diagnostice. V případě vyšetření CNS ale neposkytuje u pacientů s většinou typů primárních a sekundárních mozkových tumorů optimální výsledky. Jedním z důvodů těchto suboptimálních výsledků je vysoké metabolické pozadí aktivity FDG měřené v mozku, zvláště v šedé hmotě. 3 Distribuce akumulace FDG je závislá na lokální perfúzi mozkové tkáně a po přestupu přes buněčnou membránu i na intenzitě aerobní glykolýzy. FDG je po intracelulární fosforylaci zachycena uvnitř buněk a je proto nespecifický marker glykolytického metabolismu, nikoliv buněčné proliferace. Na rozdíl od normálních diferencovaných buněk je energetickým zdrojem pro většinu nádorových buněk aerobní glykolýza, jde o tzv. Warburgův efekt. Intenzita glykolýzy pak může korelovat s agresivitou tumoru. 4,5 Variabilní intenzita akumulace FDG může být přítomna u všech typů gliomů jak ve smyslu vzrůstu, tak poklesu její akumulace oproti nepostižené mozkové tkáni. Variabilita bývá zvláště významná u gliomů nízkého gradu (LGG), ze sekundárních tumorů CNS například také u karcinomu ledvin a jeho metastáz, testikulárních tumorů, ale i mozkových metastáz jiných malignit. Důsledkem variability akumulace FDG je snížená senzitivita a méně významně i specificita detekce mozkových metastáz pomocí FDG PET ve srovnání s MR/CT hlavy – například u malobuněčného karcinomu plic (senzitivita 46 % oproti 100 % pro MR, specificita 97 % oproti 100 % pro MR) 6, nebo v jiné studii udávaná senzitivita 45 % a specificita 80 % pro mozkové metastázy non-CNS tumorů bez rozlišení typu tumoru. 7 K vzrůstu akumulace FDG oproti šedé hmotě dochází zvláště u dediferencovaných tumorů a tumorů vysokého gradu – anaplastické oligodendrogliomy, astrocytomy nebo glioblastoma multiforme. Ze sekundárních tumorů pak nejčastěji u lymfomů nebo melanomu.
K překonání limitů FDG PET/CT zobrazení a pro přidání informace o proliferační aktivitě nebo jiných metabolických cestách je možné využít různých radiofarmak. 8 18F-fluorothymidin (FLT), analog thymidinu inkorporovaného do DNA při její replikaci, slouží k hodnocení proliferační aktivity a buněčného dělení. 9 18F-fluorocholin (FCh) je stavebním kamenem fosfolipidových buněčných membrán a může sloužit k hodnocení lipidového metabolismu, v omezené míře i buněčné proliferace. [18F]-O-(2-fluoroethyl)-L-tyrosine (FET) 10,11, 18F-fluorodihydroxyfenylalanin (FDOPA) a L[methyl-[11C]-methionin (methionin, MET) 12 jsou analogy aminokyselin a jejich akumulace odpovídá intenzitě proteosyntézy. Většinu mozkové tkáně tvoří buňky nepodstupující dělení, jejich úroveň proteosyntézy je nižší než v proliferujících buňkách tumorů. Důsledkem je pak nízká akumulace radioizotopem značených aminokyselin v normální mozkové tkáni (pozadí) oproti jejich zvýšené akumulaci v tumoru. Cílem naší studie bylo ověřit jednak možnost provedení vlastního vyšetření s MET, a jednak zhodnotit diagnostický výstup PET/CT vyšetření s MET.
METODA
Soubor pacientů
Soubor pacientů byl generován v rámci nerandomizované klinické studie I. fáze, která probíhala v MOÚ v období mezi říjnem 2012 a březnem 2014. Všichni pacienti podepsali informovaný souhlas se zařazením do klinické studie a byli do souboru zařazeni ve shodě s protokolem klinické studie. Zařazeno bylo celkem 18 pacientů, z toho u 16 byly výsledky plně hodnotitelné ve vztahu ke stanoveným cílům. V případě 1 subjektu nebylo z technických důvodů radiofarmakum vůbec aplikováno a vyšetření neproběhlo. U dalšího 1 pacienta nebylo možné vyhodnotit parametry akumulace radiofarmaka, neboť nádorové onemocnění, v daném případě renální karcinom metastazující do mozku, radiofarmakum nevychytávalo. Primárním cílem bylo prokázat akumulaci podaného 11C-methioninu v aktivitě 500 MBq v nádorové tkáni přítomné v mozku, sekundární cíle byly: 1. hodnocení bezpečnosti aplikovaného přípravku a 2. použití radiofarmaka v aktivitě 350 MBq a srovnání s vyšší aktivitou. Základním vstupním kritériem byl histologicky potvrzený primární mozkový nádor nebo extrakraniálně lokalizovaný primární nádor sekundárně postihující CNS a postižení mozku nádorovým procesem potvrzené MRI vyšetřením provedeným během 28 dnů před studiovým PET/CT. Z hlediska sledování bezpečnosti přípravku bylo u všech subjektů provedeno komplexní vstupní fyzikální a laboratorní vyšetření, včetně měření základních fyziologických funkcí. Toto bylo opakováno za 24 hod. po vyšetření, měření krevního tlaku, pulsu a teploty i za 15 min. po vyšetření.
Z 16 hodnocených pacientů v souboru bylo 5 žen (31 %) a 11 mužů (69 %), věk pacientů byl průměrně 53,4 roku (odchylka ±14,0 roku, medián 51,3 roku, rozpětí 37 až 80 roků). Histologicky bylo 12 pacientů s glioblastomem G4 (nález u 3 z nich byl podrobněji histologicky hodnocen jako glioblastom s rysy gliosarkomu), 2 pacienti měli astrocytom G2, 1 pacient byl s oligodendrogliomem G2 a jeden pacient s mozkovou metastázou smíšeného testikulárního tumoru (90 % embryonální karcinom, 5 % choriokarcinom, 5 % yolk sac tumor).
Z 15 pacientů s primárním mozkovým tumorem bylo u 2 pacientů (13 %) PET/CT vyšetření provedeno v rámci primárního stagingu při rozhodování o rozsahu léčby, 13 pacientů (87 %) bylo vyšetřeno pro recidivu již léčeného nádoru. Z těchto 13 předléčených pacientů byli 4 pacienti (31 %) po subtotální resekci tumoru, 1 pacient (7 %) po parciální resekci tumoru, 8 pacientů (62 %) bylo po provedené totální resekci tumoru. Všichni následně podstoupili minimálně jeden cyklus konkomitantní chemo-radioterapie. U všech byl dle kontrolní magnetické rezonance patrný relaps onemocnění nebo progrese poléčebného residua, z čehož vyplynula indikace pro provedení MET PET vyšetření.
Radiofarmakum
Pro vyšetření bylo použito radiofarmakum L-[methyl-11C]-methionin připravené na objednávku vždy pro konkrétního pacienta na pracovišti ÚJV Řež, a. s. – PET Centrum Brno v komerčně dostupných modulech GE TRACERlab FXC.
Příprava radiofarmaka byla cílena pro aktivitu 500 MBq u prvních 12 pacientů, u posledních 4 pacientů pak byla zvolena cílená aktivita 350 MBq. Vzhledem k praktickým možnostem přípravy radiofarmaka bylo u pacientů s cílenými 500 MBq skutečně aplikováno 545,1 MBq ± 37,4 MBq, medián 556 MBq a u pacientů s cílenými 350 MBq pak skutečná aktivita 389 MBq ± 15,5 MBq, medián 386 MBq MET. Při přepočtení na hmotnost pacientů byla aplikovaná aktivita průměrně 6,67 MBq/kg pro prvních 12 pacientů s vyšší aplikovanou aktivitou a 5,2 MBq/kg pro zbývající 4 pacienty s nižší aplikovanou aktivitou. V celém souboru je to pak průměrně 6,3 MBq/kg ± 1,45 MBq/kg, medián 6,28 MBq/kg.
Přístroj a akvizice
K akvizici dat byla použita kamera Siemens Biograph 64 (Siemens, Německo), vyhodnocení pak probíhalo na vyhodnocovacích konzolích Siemens se softwarem Siemens Syngo MultiModality WorkPlace (Siemens) s fúzí obrazových dat PET a low-dose CT. Pro všechny pacienty bylo také v nemocničním obrazovém archívu dostupné MR vyšetření mozku ne starší 1 měsíce, se kterým byla provedena fúze.
Pět minut po i. v. aplikaci radiofarmaka bylo zahájeno 12 minut trvající PET/CT snímání mozku, které bylo shodně zopakováno od 20. a 35. minuty po aplikaci. PET snímky mozku byly rekonstruovány iterativní metodou s 6 iteracemi, 21 subsety, image size 168, FWHM 4,0 mm. Snímání PET předcházela akvizice low-dose CT k anatomické orientaci a korekci atenuace v rozsahu shodném s rozsahem PET snímku s následujícími parametry snímání: 120 kV, 100 mAs, pitch 0,8, CARE Dose 4D vypnuta, rotation time 1 s, slice 5 mm. Rekonstrukce řezů proběhla standardní filtrovanou zpětnou projekcí.
Hodnocení
Hodnocena byla intenzita akumulace MET v patologickém ložisku pomocí SUVmax (maximální hodnoty “standardized uptake value” pro vybranou oblast zájmu), poměr intenzity akumulace MET v patologickém ložisku (T – tumour) vzhledem k pozadí (B – background). Za pozadí byla vždy vy-brána nepostižená oblast kontralaterálně k tumoru ve shodné topografické oblasti. V případě, že i kontralaterální oblast byla považována za patologickou, byla jako pozadí zvolena jiná dle MR nepostižená oblast mozku. Dále byla sledována změna intenzity akumulace MET při snímání mozku v 5., 20. a 35. minutě po aplikaci, měřeno pomocí SUVmax.
VýSLEDKY
Vyšetření pomocí MET proběhlo u všech pacientů bez komplikací, nebyly zaznamenány žádné nežádoucí účinky ani reakce po podání radiofarmaka.
U všech pacientů s primárním mozkovým tumorem bylo patrné zvýšení akumulace MET v patologickém ložisku určeném dle magnetické rezonance. Výsledky jednoho ze 2 pacientů s metastatickým mozkovým tumorem, jehož tkáň nevykazovala zvýšenou akumulaci MET, nebyly pro další hodnocení uvažovány. Mimo jiné také proto, že nebylo možné přesně stanovit adekvátní oblast měření SUVmax. Hodnoty sledovaných parametrů jsou vyjádřeny v tabulce č. 1. Akumulace methioninu i poměr akumulace v patologickém ložisku vzhledem k pozadí normální („zdravé“) mozkové tkáně nebyl v jednotlivých časech snímání odlišný v případě zhodnocení celého souboru.
Tab. 1. Intenzita akumulace MET v patologickém ložisku hodnocená pomocí SUVmax a poměr (T/B) akumulace v patologickém ložisku (T – tumour) vzhledem k normální mozkové tkáni (B – background) – celý soubor. 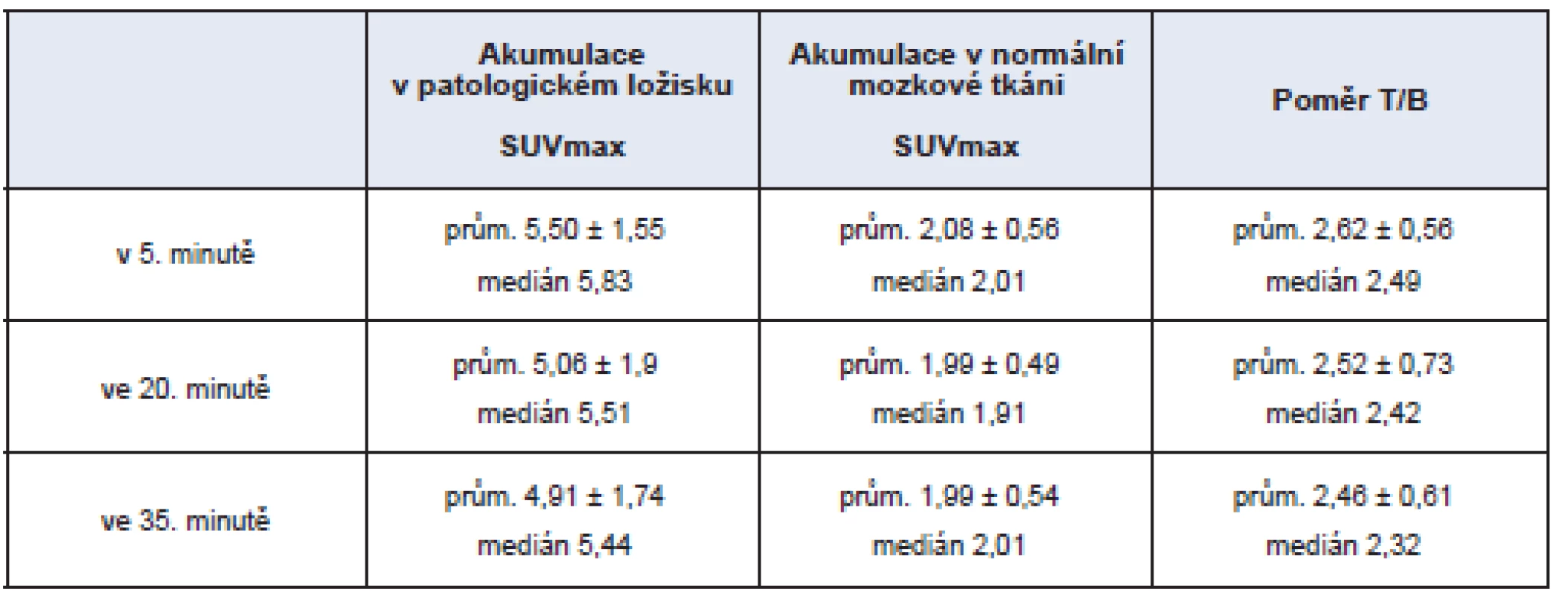
Tab. 2. Intenzita akumulace MET v patologickém ložisku hodnocená pomocí SUVmax a poměr akumulace v patologickém ložisku vzhledem k normální mozkové tkáni (background) – rozděleno dle diagnózy na skupinu s glioblastomem G4 a ostatní histologické typy. 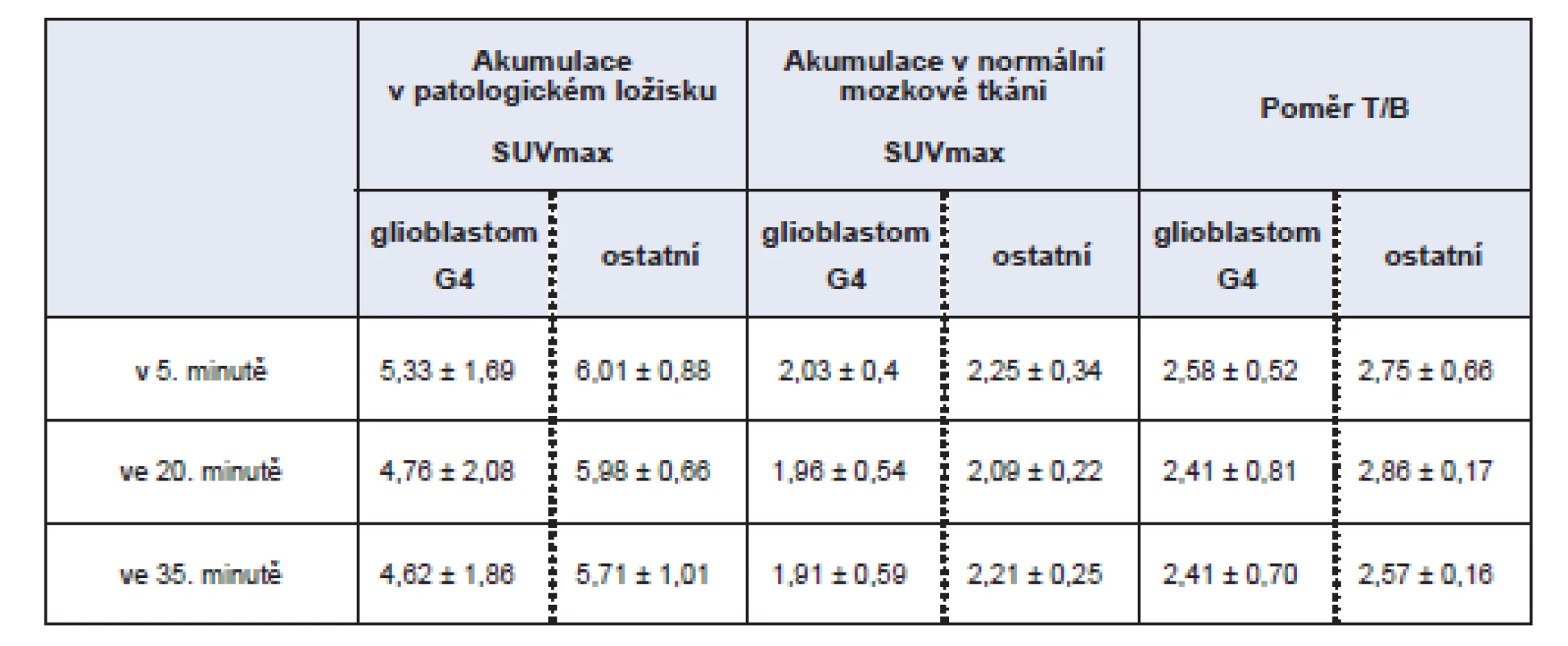
Při rozdělení souboru do skupiny s glioblastomem a s ostatními diagnózami jsou hodnoty uvedeny v tabulce č. 2.
Nebyl zaznamenán významný rozdíl v měřených hodnotách SUVmax mezi pacienty s aplikovanými 500 MBq a 350 MBq MET, ale pro statistické zpracování nebylo do souboru zařazeno dostatek pacientů.
DISKUZE
Methionin značený uhlíkem-11 je markerem syntézy proteinů a jako takový je možno jej využít k zobrazení patologických procesů v mozku, kde má v porovnání s glukózou (FDG) nižší metabolické pozadí. Pro tuto indikaci je používán již od 80. let minulého století. 13,14 Výraznějšímu rozšíření ale brání relativně krátký poločas rozpadu 20 minut pro uhlík-11 oproti 110 minutám pro fluor-18. Doprava radiofarmaka připraveného k aplikaci je možná k pacientovi v PET centru dostupném maximálně v řádu několika málo desítek minut od cyklotronu, nejlépe však v rámci jedné budovy.
Obr. 1. Pacient s astrocytomem G2 vlevo. V MET PET obrazu patrný přesah patologické akumulace přes střední čáru a větší rozsah než v MR obrazu. 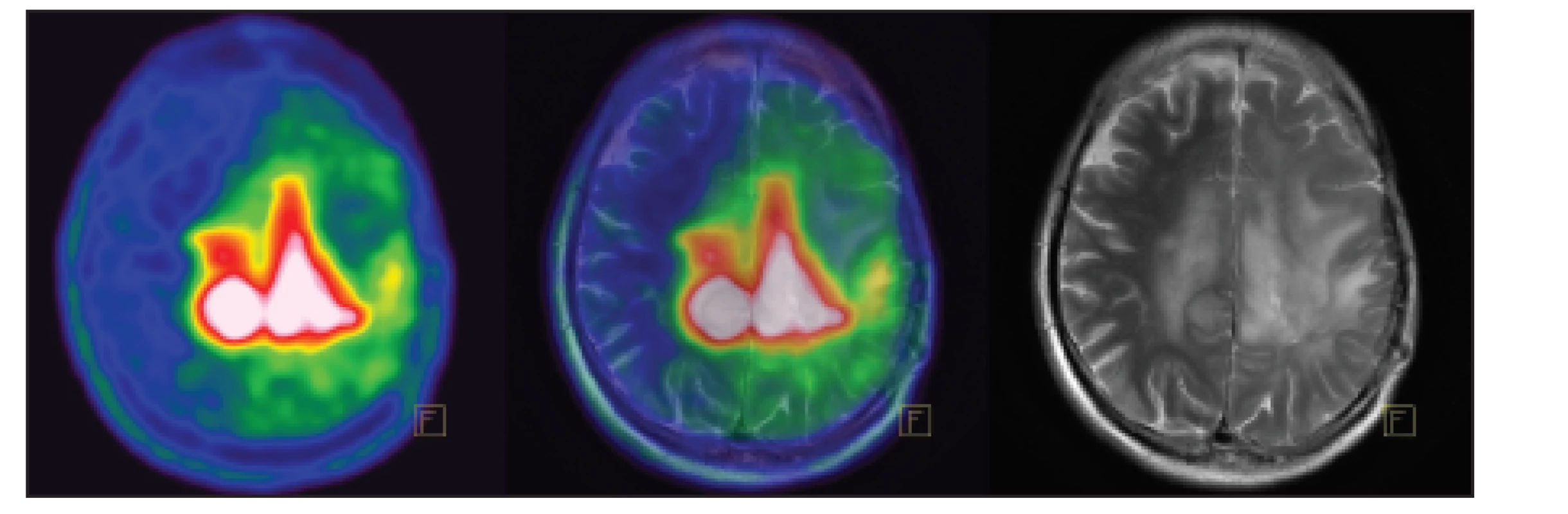
Obr. 2. Pacient s glioblastoma multiforme temporálního laloku vlevo, po resekci tumoru. Lokální recidiva s vysokou akumulací 11C-methioninu. 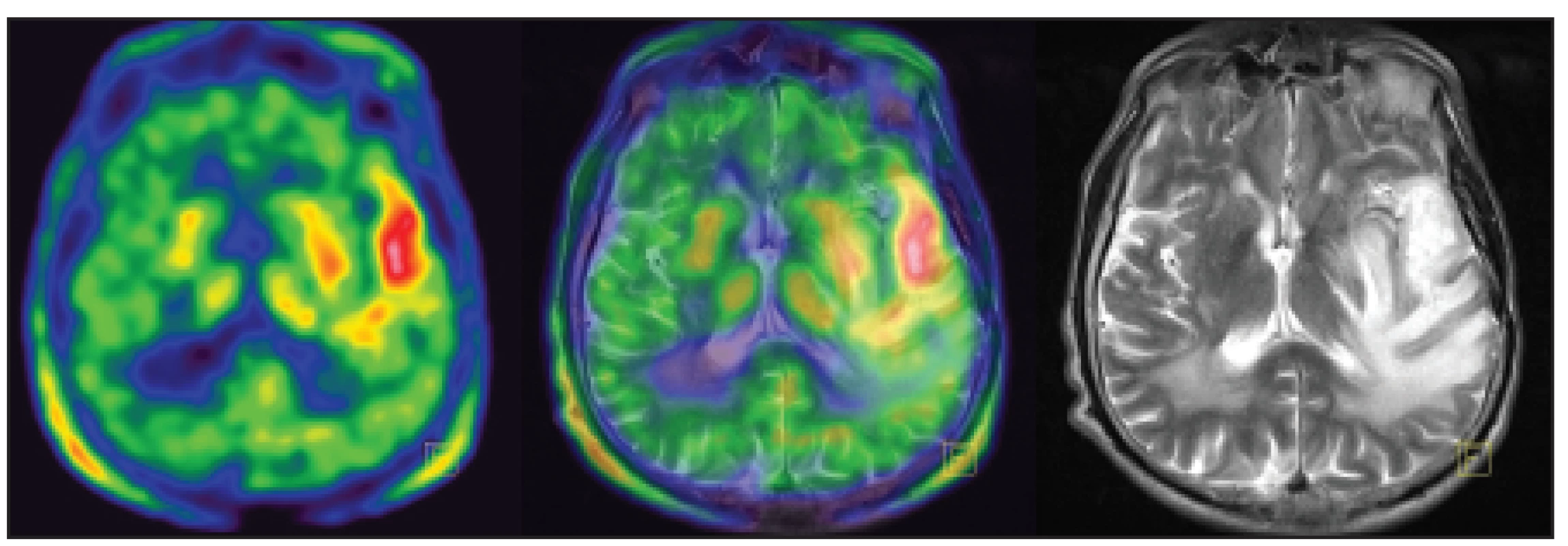
Výhodou 11C-methioninu je možnost přípravy radiofarmaka dle potřeby přímo pro jednotlivého pacienta dle požadavků indikujícího lékaře (a technických a technologických možností dodavatele). V takovém případě by bylo možno reagovat přímo na potřeby ošetřujícího lékaře v upřesnění nálezu u pacientů bez nutnosti odkládání léčby z důvodu dlouhé objednací doby – z pohledu nukleární medicíny a objednacích dob na 18F-FDG a zvláště 18F-FLT vyšetření by mohlo vyšetření 11 C-methioninem být prováděno takřka „akutně“. 18 F-FLT tuto možnost nemá; vzhledem k možnostem dodavatelů, ekonomickým podmínkám a relativně omezeným indikacím jsou objednací doby pro toto vyšetření spíše ve většině pracovišť v řádu týdnů až měsíců.
Akumulace MET v nádorových buňkách v mozku závisí na jeho koncentraci v krvi, na intracelulárním metabolismu aminokyselin a nepřímo i na stavu hematoencefalické bariéry. Tím nepřímo odpovídá proliferační aktivitě tumoru a může posloužit k neinvazivnímu stanovení gradingu tumoru a také potvrzení transformace LGG do agresivnější formy. 12,15 Porušení hematoencefalické bariéry není nutností pro zvýšení akumulace MET v tumoru, její poškození ale může akumulaci MET ovlivnit zvýšeným průsakem do extracelulárního prostoru. 16
Při vizuálním hodnocení obrazů byla patrná v případě použití methioninu lehce nižší ostrost snímků. 17 Tato lehká neostrost může být na vrub fyzikálním vlastnostem radioizotopu 11C a při jeho rozpadu vzniklém pozitronu. Pozitron vzniklý rozpadem fluoru-18 má takovou energii, že v měkkých tkáních doletí 50 % pozitronů do vzdálenosti 0,19 mm a 10 % pozitronů až 0,91 mm než dojde k anihilaci s elektronem a vzniku gama záření. Až toto sekundárně vzniklé gama záření je následně detekováno kamerou. V případě použití uhlíku-11 je energie vzniklého pozitronu vyšší a s tím souvisí i delší dolet v měkkých tkáních. 50 % pozitronů doletí do vzdálenosti až 0,28 mm a 10 % až 1,7 mm. Z tohoto srovnání je zřejmé, že zhruba o 50 % delší dolet pozitronu bude mít vliv na ostrost a prostorové rozlišení obrazu. Toto ovlivnění prostorového rozlišení obrazu je tím výraznější, čím lepší je prostorové rozlišení kamery dané její konstrukcí a technickými parametry. Jelikož pozitronová emisní tomografie principiálně nezobrazuje vznik pozitronu (a tedy přesnou lokalitu značeného radiofarmaka v buňkách/tkáních/organismech), ale až anihilaci takto vzniklého pozitronu s elektronem a následný vznik fotonů gama, je tato vlastnost fyzikálně neovlivnitelná a je atributem nikoliv použitého radiofarmaka (11C-methionin na jedné straně a 18F-FDG, 18F-FLT, 18F-FDOPA, 18F-FET na straně druhé), ale atributem použitého radioizotopu (zda je tracer označen uhlíkem [11C] nebo fluorem [18 F]). Toto ovlivnění obrazové ostrosti ale nijak nesnižuje možnost hodnocení MET PET obrazů, což potvrzuje i naše zkušenost.
Dle literatury je v MET PET obrazu rozsah tumorů s nízkým 18 i vysokým 19 radingem obvykle větší než v T1 vážených obrazech magnetické rezonance a přesněji odpovídá skutečnému rozsahu tumoru. Je proto také vhodným doplňkem MRI v plánování radioterapie, který přináší dodatečnou informaci v rámci multiparametrického vyšetření. 20,21 V našem souboru pacientů nebyl vztah mezi rozsahem tumoru v MET PET obrazu a v MRI obrazu sledován.
U všech pacientů byla v patologickém ložisku patrná zvýšená akumulace MET s hodnotami SUVmax okolo 5–5,5. Tyto hodnoty jsou nižší než absolutní hodnoty SUVmax obvyklé v případě PET vyšetření mozku s FDG, ale také je výrazně nižší akumulace MET v normální nepatologické mozkové tkáni. Měřené hodnoty akumulace MET v nepatologické mozkové tkáni („pozadí“) byly s SUVmax okolo 2,0.
Výsledkem je relativně vysoký poměr akumulace MET v tumoru vzhledem k pozadí – obrazový kontrast s hodnotami 2,5x vyššími pro tumor.
Vzhledem k malému počtu pacientů s LGG v našem souboru není možné statistické zhodnocení rozdílu kontrastu v LGG a glioblastomu (to ostatně ani nebylo cílem naší studie). 22 Nebyl ale patrný významný rozdíl v kontrastu mezi snímky z 5., 20. a 35. minuty. Chybění statisticky významného rozdílu v akumulaci MET gliomy s rozdílným gradem je uváděno i v literatuře. 23 Hodnocená oblast tumoru ale nebyla rozdělena na podoblasti, je tedy možné se zamýšlet na vývoji akumulace MET v jednotlivých oblastech tumoru a jejich vztahu k MRI obrazu.
Malý počet pacientů v souboru také neumožňuje statistické zhodnocení rozdílu obrazů mezi pacienty s aplikovanou aktivitou 350 MBq a 500 MBq MET. Dle nasnímaných obrazů 4 pacientů s nižší aplikovanou aktivitou ale není patrné významné zhoršení hodnotitelnosti. Je tedy možné zvážit použití nižší aktivity pro snížení radiační zátěže pacientů. V literatuře je uvedeno jak použití radiofarmaka s vyšší aktivitou 24, tak s aktivitou nižší 25 než námi zvolené hodnoty.
ZÁVĚR
11C-Methionin je vhodným radiofarmakem pro hodnocení rozsahu tumoru mozku před zvažovanou léčbou i při kontrole jejího efektu. Tak jak naše studie potvrzuje, jeho využití je přínosné jak u gliomů s nízkým, tak vysokým gradem. Limitem je dostupnost pouze na pracoviště s cyklotronem. Volba množství radiofarmaka při dolní hranici literárně uváděného rozmezí není na vrub zhoršení obrazové kvality a hodnotitelnosti provedeného vyšetření.
Podpořeno: MZ ČR – RVO (MOÚ, 00209805)
Zdroje
- Dušek L, Mužík J, Malúšková D, et al. Cancer Incidence and Mortality in the Czech Republic. Klin Onkol. 2014;27 : 406-423. doi:10.14735/amko2014406.
- Fadrus P, Lakomý R, Hübnerová P, et al. Intrakraniální nádory - diagnostika a terapie. Interní Med. 2010;12 : 376-381
- Segtnan EA, Hess S, Grupe P, Høilund-Carlsen PF. 18F-fluorode -oxyglucose PET/computed tomography for primary brain tumors. PET Clin. 2015;10 : 59-73. doi:10.1016/j.cpet.2014.09.005.
- Warburg O, Posener K, Negelein E VIII. The metabolism of cancer cells. Biochem Zool 1924;152 : 129–169
- Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 2009;324 : 1029-1033. doi: 10.1126/science.1160809
- Brink I, Schumacher T, Mix M et al. Impact of [18F]FDG-PET on the primary staging of small-cell lung cancer. Eur J Nucl Med Mol Imaging 2004;31 : 1614 [online]. [cit. 2018-08-22]. Dostupné na: https://doi.org/10.1007/s00259-004-1606-x
- Kitajima K, Nakamoto Y, Okizuka H et al. Accuracy of whole-body FDG-PET/CT for detecting brain metastases from non-central nervous system tumors. Ann Nucl Med 2008;22 : 595 [online]. [cit. 2018-08-22]. Dostupné na: https://doi.org/10.1007/s12149-008-0145-0
- Ferda J, Ferdová E, Baxa J, et al. Lekce z molekulárního zobrazování: hodnocení mozkových nádorů pomocí PET/MR. Ces Radiol, 2016;70 : 205-218
- Choi SJ, Kim JS, Kim JH, et al. [18F]3’-deoxy-3’-fluorothymidine PET for the diagnosis and grading of brain tumors. Eur J Nucl Med Mol Imaging. 2005;32 : 653-659
- Kratochwil C, Combs SE, Leotta K, et al. Intra-individual comparison of 18F-FET and 18F-DOPA in PET imaging of recurrent brain tumors. Neuro-Oncol. 2014;16 : 434-440. doi:10.1093/neu-onc/not199
- Filss CP, Galldiks N, Stoffels G, et al. Comparison of 18F-FET PET and perfusion-weighted MR imaging: a PET/MR imaging hybrid study in patients with brain tumors. J Nucl Med. 2014;55 : 540-545. doi:10.2967/jnumed.113.129007.
- Glaudemans AWJM, Enting RH, Heesters MAAM, et al. Value of 11C-methionine PET in imaging brain tumours and metastases. Eur J Nucl Med Mol Imaging. 2013;40 : 615-635. doi:10.1007/s00259-012-2295-5
- Bergström M, Collins VP, Ehrin E, et al. Discrepancies in brain tumor extent as shown by computed tomography and positron emission tomography using [68Ga]EDTA, [11C]glucose, and [11C]methionine. J Comput Assist Tomogr. 1983;7 : 1062-1066
- Ericson K, Lilja A, Bergström M, et al. Positron emission tomography with ([11C]methyl)-L-methionine, [11C]D-glucose, and [68Ga]EDTA in supratentorial tumors. J Comput Assist Tomogr. 1985;9 : 683-689
- Derlon JM, Bourdet C, Bustany P, et al. [11C]L-methionine uptake in gliomas. Neurosurgery. 1989;25 : 720-728
- Sasaki M, Kuwabara Y, Yoshida T, et al. A comparative study of thallium-201 SPET, carbon-11 methionine PET and fluorine-18 fluoro deoxyglucose PET for the differentiation of astrocytic tumours. Eur J Nucl Med. 1998;25 : 1261-1269
- Sánchez-Crespo A, Andreo P, Larsson SA. Positron flight in human tissues and its influence on PET image spatial resolution. Eur J Nucl Med Mol Imaging. 2004;31 : 44-51
- Smits A, Baumert BG. The Clinical Value of PET with Amino Acid Tracers for Gliomas WHO Grade II. Int J Mol Imaging. 2011;2011 : 372509. doi: 10.1155/2011/372509
- Kawai N, Maeda Y, Kudomi N, et al. Correlation of biological aggressiveness assessed by 11C-methionine PET and hypoxic burden assessed by 18F-fluoromisonidazole PET in newly diagnosed glioblastoma. Eur J Nucl Med Mol Imaging. 2011;38 : 441-450. doi:10.1007/s00259-010-1645-4
- Iuchi T, Hatano K, Uchino Y, et al. Clinical Investigation: Methionine Uptake and Required Radiation Dose to Control Glioblastoma. Int J Radiat Oncol Biol Phys. 2015;93 : 133-140. doi:10.1016/j.ijrobp.2015.04.044
- Lee IH, Piert M, Gomez-Hassan D, et al. Clinical Investigation: Association of 11C-Methionine PET Uptake With Site of Failure After Concurrent Temozolomide and Radiation for Primary Glioblastoma Multiforme. Int J Radiat Oncol Biol Phys. 2009;73 : 479-485. doi:10.1016/j.ijrobp.2008.04.050
- Lakomý R, Fadrus P, Slampa P, et al. Multimodal treatment of glioblastoma multiforme: results of 86 consecutive patients diagnosed in period 2003-2009. Klin Onkol. 2011;24 : 112-120
- Chung JK, Kim Y, Kim S et al. Usefulness of 11C-methionine PET in the evaluation of brain lesions that are hypo - or isometabolic on 18F-FDG PET. Eur J Nucl Med 2002;29 : 176 [online]. [cit. 2018-08-22]. Dostupné na: https://doi.org/10.1007/s00259-001-0690-4
- Harris SM, Davis JC, Snyder SE et al. Evaluation of the Biodistribution of 11C-Methionine in Children and Young Adults. J Nucl Med 2013;54 : 1902-1908 [online]. [cit. 2018-08-22]. Dostupné na: https://doi.org/10.2967/jnumed.112.118125
- Vander Borght T, Asenbaum S, Bartenstein P et al. EANM procedure guidelines for brain tumour imaging using labelled amino acid analogues. Eur J Nucl Med 2006;33 : 1374-1380 [online]. [cit. 2018-08-22]. Dostupné na: https://doi.org/10.1007/s00259-006-0206-3
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2018 Číslo 4- Kolorektální karcinom a jeho léčba v pokročilém stadiu dle aktuální Modré knihy ČOS
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
- Klíčová role HRCT v diagnostice idiopatické plicní fibrózy
- Metastazektomie při 2. linii paliativní chemoterapie metastatického kolorektálního karcinomu – kazuistika
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
Nejčtenější v tomto čísle- Využití 11C-methioninu pro PET/CT vyšetření pacientů s tumory mozku – soubor 16 pacientů
- Detekce Pagetovy choroby při scintigrafii značenými leukocyty – kazuistika
- Centrální žilní katetr imitující metastázu na kostní scintigrafii – význam hybridního zobrazení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



