-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaKvantitatívne profilovanie génov asociovaných s dráhami vzniku mozgových nádorov
Quantitative profiling of genes associated with cancer pathways in brain tumors
Background: Brain tumors are a heterogeneous group of malignancies characterized by inter - and intratumoral heterogeneity. Among them, the most aggressive and, despite advances in medicine, still incurable remains glioblastoma. One of the reasons is the high recurrence rate of the disease and resistance to temozolomide, a golden standard in chemotherapy of brain tumors. Therefore, mapping the pathways responsible for tumorigenesis at the transcriptional level may help to determine the causes and aggressive behavior among different glial tumors. Patients and methods: Biopsies from patients with astrocytoma (N = 6), glioblastoma (N = 22), and meningioma (N = 14) were included in the sample set. A control group consisted of RNA isolated from healthy human brain (N = 3). The reverse-transcribed cDNAs were analyzed using the Human Cancer PathwayFinder™ real-time PCR Array in a 96-well format. The expression of 84 genes belonging to 9 signaling pathways (angiogenesis, apoptosis, cell cycle and senescence, DNA damage and repair, epithelial-to-mesenchymal transition, hypoxia, overall metabolism, and telomere dynamics) was determined for each sample. Results: By determining the relative expression of selected genes, we characterized the transcriptomic profile of individual brain malignancies in the context of signaling pathways involved in tumorigenesis. We observed deregulation in 50, 52.4 and 53.6% % of the genes in glioblastomas, meningiomas and astrocytomas, respectively. The most pronounced changes with statistical significance compared to control were observed in the genes associated with epithelial-to-mesenchymal transition (CDH2, FOXC2, GSC, SNAI2, and SOX10), cellular senescence (BMI1, ETS2, MAP2K1, and SOD1), DNA repair (DDB2, ERCC3, GADD45G, and LIG4), and dynamic of telomeres (TEP1, TERF2IP, TNKS, and TNKS2). Conclusion: Based on the obtained data, we can conclude that individual diagnoses differ in transcriptomic profile. An individual molecular approach is therefore necessary in order to provide comprehensive and targeted therapy on multiple metabolic pathways in the diagnosis of brain tumors.
Keywords:
brain tumors – mRNA – profiling of tumorigenesis pathways
Autoři: Z. Majerčíková 1; K. Dibdiaková 1; M. Galanda 2; T. Galanda 2; R. Richterová 3; B. Kolarovszki 3; P. Račay 1; J. Hatok 1
Působiště autorů: Ústav lekárskej biochémie, Jesseniova lekárska fakulta UK v Martine, Martin, Slovenská republika 1; Neurochirurgická klinika SZU, Fakultná nemocnica s poliklinikou F. D. Roosevelta, Banská Bystrica, Slovenská republika 2; Neurochirurgická klinika, Jesseniova lekárska fakulta UK a UN v Martine, Martin, Slovenská republika 3
Vyšlo v časopise: Klin Onkol 2023; 36(3): 224-233
Kategorie: Původní práce
doi: https://doi.org/10.48095/ccko2023224Souhrn
Východiská: Mozgové nádory tvoria rôznorodú skupinu malignít charakterizovaných intertumorálnou aj intratumorálnou heterogenitou. Medzi najagresívnejší z nich radíme glioblastóm, ktorý je napriek pokrokom v súčasnej medicíne stále neliečiteľný. Jedným z dôvodov je vysoký stupeň rekurencie ochorenia a rezistencia na štandardne využívané chemoterapeutikum temozolomid. Preto mapovanie dráh zodpovedných za tumorigenézu na transkripčnej úrovni môže prispieť k determinovaniu príčin a stupňa agresivity medzi jednotlivými typmi gliálnych malignít. Súbor pacientov a metódy: Do súboru vzoriek boli zaradené biopsie od pacientov s astrocytómom (n = 6), glioblastómom (n = 22) a meningiómom (n = 14). Kontrolnú skupinu predstavovali RNA izolované zo zdravého ľudského mozgu (n = 3). Reverznou transkripciou získanú cDNA sme využili na kvantitatívnu analýzu pomocou Human Cancer PathwayFinder™ real-time PCR Array v 96 jamkovom formáte a pre každú vzorku sme stanovili expresiu 84 génov patriacich do 9 regulačných dráh (angiogenéza, apoptóza, bunkový cyklus a starnutie, poškodenie a oprava DNA, epiteliálno-mezenchymálny prechod, hypoxia, celkový metabolizmus a dynamika telomér). Výsledky: Určením relatívnej expresie vybraných génov sme charakterizovali profil jednotlivých mozgových malignít v kontexte signálnych dráh ovplyvňujúcich tumorigenézu. Zo všetkých sledovaných génov jednotlivých dráh sme zaznamenali dereguláciu u glioblastómov v 50 %, u meningiómov v 52,4 % a u astrocytómov v 53,6 %. Celkovo sme najvýraznejšie zmeny so štatistickou signifikanciou oproti kontrole zaznamenali u génov spájaných s epiteliálno-mezenchymálnou tranzíciou (CDH2, FOXC2, GSC, SNAI2 a SOX10), bunkovým starnutím (BMI1, ETS2, MAP2K1 a SOD1), opravou DNA (DDB2, ERCC3, GADD45G a LIG4) a dynamikou telomér (TEP1, TERF2IP, TNKS a TNKS2). Záver: Na základe získaných dát môžeme konštatovať, že jednotlivé diagnózy sa líšia v transkriptomickom profile. Prihliadnúc na tento fakt, je preto nevyhnutná potreba individuálneho molekulového prístupu s cieľom komplexnej a cielenej terapie na viacerých stupňoch nádorového metabolizmu.
Klíčová slova:
nádory mozgu – mRNA – profilovanie dráh tumorigenézy
Úvod
Mozgové nádory sa líšia stupňom malignity od pomaly rastúcich a liečiteľných nádorov po rýchlo proliferujúce, agresívne tumory charakterizované vysokou mierou heterogenity a invazívnosti. Podľa najnovšej klasifikácie mozgových nádorov vydanej v roku 2021 Svetovou zdravotníckou organizáciou sú klasifikované na základe histopatologických znakov, ako aj podľa zavedených molekulárnych parametrov [1]. Klinicky sú z glií odvodené tumory rozdelené do štyroch stupňov malignity, z ktorých najagresívnejší je glioblastóm (GBM, WHO IV). Glioblastóm sa vyznačuje svojou vysoko infiltračnou povahou často poškodzujúcou hematoencefalickú bariéru, aberantnou vaskularizáciou a odolnosťou voči multimodálnej liečbe [1–3]. Molekulové charakterizovanie nových terapeutických cieľov a spôsobov je kritické pre zvládnutie úspešnej klasifikácie a liečby tak neľahkej diagnózy akou mozgové nádory sú. Preto sme si stanovili za cieľ na molekulárnej úrovni charakterizovať rôzne typy mozgových nádorov (glioblastómy, astrocytómy a meningiómy ako zástupcov prevažne benígnych tumorov) a sledovať expresiu komerčne dostupných génov podieľajúcich sa na všeobecnom procese vzniku rakoviny pomocou polymerázovej reťazovej reakcie v reálnom čase (real-time polymerase chain reaction – RT PCR). Záverom možno konštatovať, že zistenia tejto štúdie poskytujú pohľad do patogenézy astrocytómov s dôrazom na glioblastóm a benígne meningiómy a môžu byť podkladom pre potenciálne terapeutické ciele ďalšieho výskumu.
Súbor pacientov a metódy
Pacientske vzorky pochádzajú z tkanivovej banky nášho pracoviska (tkanivové biopsie nádorov mozgu sme získali v spolupráci s Neurochirurgickou klinikou FNsP F. D. Roosevelta v Banskej Bystrici a Neurochirurgickou klinikou Univerzitnej nemocnice v Martine v rokoch 2018–2021). Do súboru boli zaradené bioptické vzorky od pacientov s glioblastómom (GBM; IV; n = 22), astrocytómom (AST; III; n = 6) a meningiómom (MNG; I – III; n = 14) ženského aj mužského pohlavia rôzneho veku v celkovom počte 42. Základná charakteristika súboru pacientov je uvedená v tab. 1. Kontrolnú skupinu tvorili komerčne dostupné RNA izolované zo zdravých ľudských mozgov (n = 3). Práca bola schválená Etickou komisiou Jesseniovej lekárskej fakulty v Martine pod číslom EK 75/2018. Pacienti boli oboznámení s účelom štúdie a podpísali informovaný súhlas.
Tab. 1. Charakteristika súboru pacientov. 
Spracovanie pacientskych biopsií
Nádorové tkanivo získané od pacientov uskladnené pri teplote −80 °C sme nechali rozmraziť na ľade, po rozmrazení sme do sterilných skúmaviek navážili 15–35 mg tkaniva, ktoré sme použili na izoláciu nukleových kyselín. Do každej vzorky sme pridali lyzačný roztok a homogenizovali 20 sekundovou sonifikáciou v ultrasonickom homogenizátore SONOPULS HD 3100 (Bandelin, Nemecko).
Izolácia celkovej RNA a prepis do cDNA
Celkovú RNA sme z tkanivových homogenátov izolovali použitím AllPrep® DNA/RNA Mini Kitu. Pre odstránenie zvyškovej DNA z RNA frakcie sme zmes inkubovali s DNázou podľa inštrukcií výrobcu. Koncentráciu a čistotu izolovanej RNA sme následne stanovili na spektrofotometri (Implen, Nemecko) pri vlnovej dĺžke 260 nm. RNA bola uskladnená po pridaní 96% etanolu pri −80 °C. Kvalitu izolovanej RNA sme určili pomocou čipovej elektroforézy MCE®-202 MultiNA (Shimadzu Biotech, Japonsko). Prepisom 2 µg izolovanej celkovej RNA sme metódou reverznej transkripcie nasyntetizovali cDNA s využitím RT2 First Strand Kitu na cykléri TProfessional TRIO (Biometra, Nemecko). Pripravená cDNA bola nariedená do celkového objemu 111 µl sterilnou dH2O bez nukleáz a uskladnená pri teplote −20 °C.
Real-time PCR array
Nasyntetizovanú cDNA sme zriedili na koncentráciu 50 ng/μl vo vode bez nukleáz a 40 μl takto zriedenej cDNA sme pridali do 1 340 μl RT2 SYBR® Green RoxTM qPCR Master Mixu (Qiagen, USA) a 1 290 μl sterilnej vody bez nukleáz. V 96-jamkovom formáte bola analyzovaná iba jedna vzorka. Pripravený premix sme jemne zamiešali a po 25 µl napipetovali do jednotlivých jamiek Human Cancer PathwayFinderTM PCR Array 96-jamkovej platničky (Qiagen, USA). Reakcia prebehla v cykléri ViiA 7 Real-Time PCR (Applied Biosystems, USA) s detekciou fluorescenčnej farbičky SYBR Green.
Analýza dát
Namerané Ct hodnoty boli analyzované na základe 2–DDCt metódy v online nástroji od firmy QIAGEN. Údaje boli normalizované k hodnotám priemeru endogénnych kontrol (housekeeping génom) ACTB (b-aktín), B2M (b-2-mikroglobulín), GAPDH (glyceraldehyd-3-fosfát dehydrogenáza) a RPLP0 (kyslý proteín P0 veľkej ribozomálnej podjednotky). Z normalizovaných hodnôt boli ďalej vypočítané násobné zmeny v regulácii expresie nádorových vzoriek oproti kontrolnej skupine. Hodnoty násobnej zmeny expresie väčšie ako 2 naznačujú zvýšenú expresiu (nadreguláciu); hodnoty < −2 vyjadrujú zníženú expresiu (podreguláciu). Štatistická významnosť je vyjadrená pomocou Studentovho t-testu p-hodnotou.
Výsledky
Na testovanie génov, ktoré pozitívne alebo negatívne ovplyvňujú tumorigenézu mozgových nádorov (meningiómov, glioblastómov a astrocytómov) sme využili komerčne dostupnú RT-PCR array od firmy Qiagen, USA. Celkovo sme stanovovali expresiu 84 génov zapojených do procesov angiogenézy, apoptózy, regulácie bunkového cyklu, starnutia a nesmrteľnosti, opráv poškodenej DNA, migrácie a invazívnosti cez epiteliálno-mezenchymálnu tranzíciu, odpovede na hypoxiu a regulácie energetického metabolizmu (tab. 2).
Tab. 2. Zoznam sledovaných génov a ich rozdelenie do metabolických dráh. 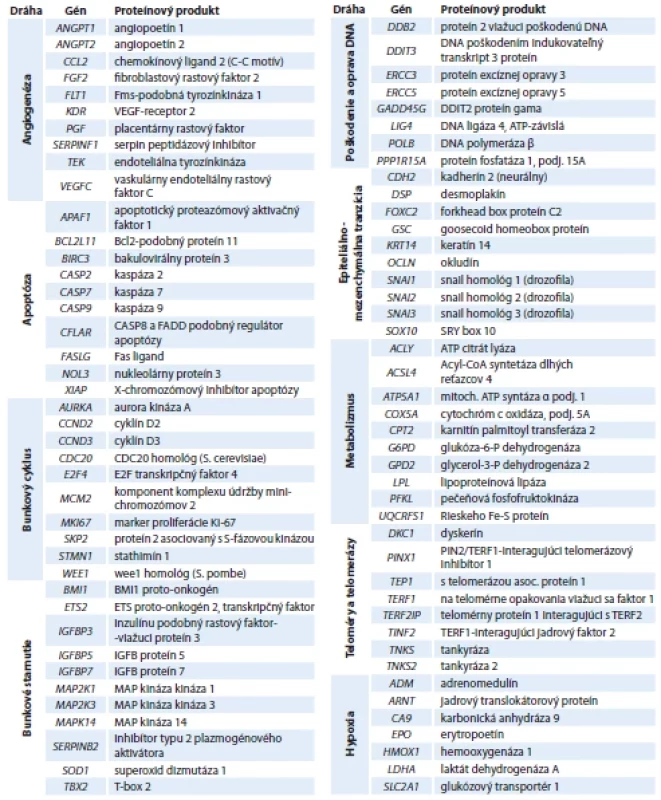
ATP – adenozíntrifosfát, Bcl-2 – B-cell lymphoma 2, CoA – koenzým A, FADD – Fas associated death domain, MAP – mitogen protein activated, VEGF – vaskulárny endoteliálny rastový faktor Angiogenéza
Adaptácia nádorových buniek na prostredie so slabým krvným zásobením, hypoxiou a obmedzeným prísunom živín procesom angiogenézy je jednou zo základných charakteristík nádorov. Na tomto procese sa podieľa široká škála angiogénnych faktorov zabezpečujúcich vývoj krvných ciev. Nadregulácia génu PGF sa ukázala byť prítomná vo všetkých nádorových skupinách, avšak iba u GBM je táto zmena štatisticky signifikantná (14,10; p < 0,05). Jediným významne podregulovaným je gén FLT1 (−4,20; p < 0,05) a iba u meningiómov (tab. 3).
Tab. 3. Násobky zmien regulácie génov. 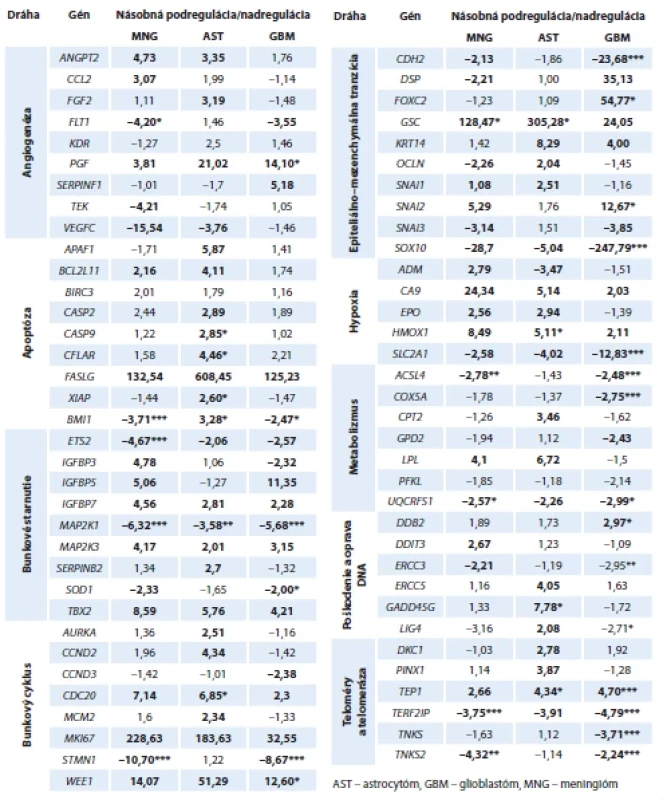
Deregulované gény jednotlivých typov nádorov korelované oproti kontrolnej skupine (n = 3) sú identifi kované hrubým písmom. Podregulované zmeny sú vyjadrené znamienkom „mínus“ pred číselnou hodnotou. Pri štatisticky významných rozdieloch je znázornená príslušná p-hodnota: * < 0,05; ** < 0,01 a *** < 0,001. Apoptóza
Apoptóza hrá kľúčovú úlohu v nádorových procesoch. Z 10 skúmaných apoptotických génov (tab. 3) sme najvýraznejšiu dereguláciu zaznamenali u astrocytómov. Zvýšená expresia bola zistená u 8 génov, z toho 3 sú štatisticky významné – gén kódujúci kaspázu 9 (CASP9), CASP8 a FADD podobný regulátor apoptózy (CFLAR) a gén pre X-chromozómový inhibítor apoptózy (XIAP). Bez signifikancie, no so stovkovými hodnotami nadregulácie sa prejavil Fas ligand (FASLG), gén patriaci do superrodiny TNF. Záporná regulácia nebola prítomná u žiadneho génu. U meningiómov ani glioblastómov nedošlo ku štatisticky signifikantnej zmene v regulácii expresie.
Bunkový cyklus
Nerovnováha v signalizácii DNA replikácie a regulácii zastavenia bunkového cyklu je dôležitá pre získanie malígneho fenotypu, preto musia byť tieto procesy prísne regulované. Spomedzi vyšetrovaných génov (n = 10), najvyšší nárast expresie (avšak bez štatistickej významnosti) sme zaznamenali pre proliferačný marker Ki-67 a to vo všetkých nádorových skupinách (tab. 3). Zníženú expresiu v géne STMN1 sme zaznamenali u MNG (−10,7; p < 0,001) a GBM (−8,67; p < 0,001) skupiny. Ďalším génom so štatisticky dôležitou zmenou expresie, konkrétne nadreguláciou, je u AST CDC20 a u GBM WEE1.
Bunkové starnutie
Starnutie buniek (bunková senescencia) možno interpretovať ako spontánnu počiatočnú bariéru v tumorigenéze. Hlavnou úlohou starnutia pri ochrane pred rakovinou je zabezpečiť, aby bunky stratili schopnosť trvalo sa množiť, hoci môžu byť metabolicky plne aktívne. Rozdielnu reguláciu expresie sme zaznamenali pri géne BMI1 – u MNG (−3,71; p < 0,001) a GBM (−2,47; p < 0,05) je tento gén podregulovaný, u AST je naopak jeho expresia oproti kontrolnej skupine zvýšená (3,28; p < 0,05). Okrem BMI1 sme identifikovali ďalšie 3 podregulované gény – ETS2, MAP2K1 a SOD1, z ktorých len u MAP2K1 bola zmena regulácie štatisticky významná u všetkých sledovaných skupín nádorov. Zmena expresie ostatných nadregulovaných génov nebola signifikantná (tab. 3).
Poškodenie a oprava DNA
Poškodenie DNA je jednou z prvých udalostí, ktoré prispievajú k progresii rakoviny. Nesprávna oprava DNA vedie ku genetickým aberáciám v onkogénoch a bunky prechádzajú malígnou transformáciou. U meningiómovej a glioblastómovej skupiny sme identifikovali dva podregulované gény (ERCC3 a LIG4), avšak signifikantná negatívna regulácia sa potvrdila iba u GBM. U AST skupiny bol ale gén LIG4 mierne nadregulovaný (2,08; p > 0,05). Gén DDB2 (2,97) u glioblastómov, DDIT3 (2,67) u meningiómov a gény ERCC5 (4,05) a GADD45G (7,78) u astrocytómov sme identifikovali ako nadregulované a to s rôznou hodnotou štatistickej významnosti (tab. 3).
Epiteliálno-mezenchymálna tranzícia
Epiteliálno-mezenchymálna tranzícia alebo prechod (EMT) je vysoko dynamický proces, ktorým epitelové bunky získavajú mezenchymálny fenotyp. Hoci bunky glioblastómu nie sú epitelové, môžu podstúpiť proces podobný EMT. Táto udalosť je taktiež spojená s metastatickou expanziou nádorových buniek s charakteristikami kmeňových buniek, čo v konečnom dôsledku ovplyvňuje odpoveď na terapiu a spôsobuje rezistenciu. Najvýraznejšie zmeny v expresii sme zaznamenali v génoch GSC a SOX10 (tab. 3). U meningiómov a astrocytómov sme zaznamenali vysoké hodnoty nadregulácie GSC so štatistickou významnosťou (128,47* a 305,28*). Expresia génu SOX10 bola výrazne podregulovaná (−247,79; p < 0,001) u glioblastómovej skupiny. Štatisticky významné deregulácie sme ďalej zaznamenali u génov CDH2, FOXC2 a SNAI2 všetky prítomné v skupine glioblastómov.
Hypoxia
Hypoxia je bežným znakom solídnych nádorov spojená so zvýšenou chemorádiorezistenciou a zlou prognózou pacienta. Bunky na hypoxiu odpovedajú prostredníctvom hypoxiou indukovateľných faktorov (HIF). HIF kontrolujú expresiu mnohých génov, zabezpečujúc tak ich prežívanie aj pri nízkych koncentráciách kyslíka. V súčasnosti bolo identifikovaných niekoľko alternatívnych dráh, ktoré prispievajú k celkovej reakcii a adaptácii na hypoxické prostredie. Zo siedmych vyšetrovaných génov sme identifikovali 2 štatisticky významné – HMOX1 (5,11; p < 0,05) u astrocytómov a SLC2A1 (−12,83; p < 0,001) u glioblastómov (tab. 3).
Metabolizmus
V tejto skupine sa nachádzajú reprezentatívne gény spojené s mitochondriálnou funkciou a metabolizmom glukózy a mastných kyselín. Vo väčšine sledovaných génov sme detegovali zníženie expresie (tab. 3) z toho medzi štatisticky významné gény patria ACSL4 (MNG a GBM), COX5A a UQCRFS1 (GBM). U žiadneho zo sledovaných génov bunkového metabolizmu, ktorého expresia bola zvýšená, nebola identifikovaná p-hodnota < 0,05.
Teloméry a telomerázy
Čo sa týka skupiny génov kódujúcich telomerázu a génov regulujúcich predlžovanie telomér, nadregulácia TEP1 génu bola zaznamenaná vo všetkých vyšetrovaných skupinách, u GBM a AST so šta - tistickou významnosťou (4,70; p < 0,001 a 4,34; p < 0,05). Naproti tomu expresia génov TERF2IP a TNKS2, pre MNG a GBM, ako aj glioblastómová TNKS, boli oproti kontrolnej skupine signifikantne znížené (tab. 3).
Diskusia
Glioblastóm je najrozšírenejšou formou primárneho mozgového nádoru a jeden z najsmrteľnejších ľudských nádorov [4], ktorý predstavuje maximálne štádium progresie astrocytómu klasifikovaného podľa histopatologických a molekulárnych charakteristík do štyroch stupňov malignity (I–IV) [1]. Zároveň, tento najčastejšie sa vyskytujúci gliálny nádor je asociovaný so zlou prognózou [5]. Napriek agresívnej multimodálnej terapii pozostávajúcej z chirurgickej resekcie, ožarovania a chemoterapie alkylačným činidlom temozolomid, je priemerná doba prežívania pacientov s GBM približne 12–15 mesiacov od diagnostikovania ochorenia [5,6]. Navzdory desaťročiam výskumu je neustále potrebné detailné pochopenie molekulárnych mechanizmov zapojených do tumorigenézy, invazívneho správania rakovinových buniek a progresie nádoru s možnosťou odhalenia potenciálnych markerov a prispenia k efektívnejšej terapii.
Cieľom našich experimentov bola vše - obecná charakterizácia mozgových nádorov na transkriptomickej úrovni. Testovanú skupinu tvorili biopsie od pacientov s histologicky potvrdeným meningiómom, glioblastómom a astrocytómom. Kontrolnú skupinu reprezentovali komerčne dostupné RNA izolované zo zdravých ľudských mozgov. Takto jednoznačne definovaná kontrolná skupina predstavovala výnimočnosť našej korelačnej analýzy oproti viacerým štúdiam, kde brali do úvahy RNA získanú od epileptických pacientov alebo astrocytovej línie [7,8]. Výber správnej biologickej kontroly je jedným z rozhodujúcich faktorov pri definovaní výsledkov transkriptomických analýz a selekcie deregulovaných génov, na čo sme poukázali aj nedávnou štúdiou na nádorových líniach mozgu [9]. Metódou kvantitatívnej RT-PCR sme pomocou array-e v 96-jamkovom formáte Cancer PathwayFinderTM sledovali relatívnu expresiu génov rozdelených do 9 signálnych dráh, ktorých deregulácia môže mať vplyv na tumorigenézu. Zo všetkých sledovaných génov sme zaznamenali dereguláciu v 44 génoch u meningiómov, v 42 génoch u glioblastómov a v 45 génoch u astrocytómov. Z nich deregulácia 23 % (MNG), 47 % (GBM) a 22 % (AST) génov bola aj štatisticky významná. Nadreguláciu sme identifikovali v 24 génoch u meningiómov, 20 (GBM) a 37 u AST, naopak zníženú expresiu sme zachytili u 20 (MNG), 22 (GBM) a 8 (AST) sledovaných prípadov.
Angiogenéza, ako jeden z charakteristických znakov rakoviny [2,10], hrá kľúčovú úlohu pri raste nádoru prostredníctvom aktivácie onkogénov a/alebo podregulácie tumor supresorových génov, čo v konečnom dôsledku vedie k nadregulácii angiogénnych dráh [11]. Spomedzi rôznych solídnych nádorov je glioblastóm jedným z vysoko angiogénnych a vyznačuje sa nadmernou vaskulárnou proliferáciou [12], čo však neplatí u gliómoch a meningiómoch nízkeho stupňa [13]. Na rozdiel od publikovaných výsledkov, kde identifikovali prevažne zvýšenú produkciu proteínov rodiny VEGF [14–16], sme potvrdili zníženie expresie génu VEGFC a to vo všetkých sledovaných skupinách nádorov. Vysoké hladiny mRNA pre VEGF boli pozorované práve v centrálnych oblastiach glioblastómov [17,18]. Na základe tohto zistenia by sme mohli predpokladať, že nami analyzované bioptické tkanivo pochádzalo z okrajovej časti nádoru a nie z jeho nekrotického jadra, resp. že do angiogenézy sú zapojené aj ďalšie proteíny z rodiny VEGF, ktorých expresiu sme nestanovovali. Na druhej strane expresia PGF bola konštantne zvýšená u všetkých sledovaných skupín, u GBM aj so štatistickou významnosťou. Výsledky sa zhodujú aj s prácou iných vedeckých skupín, ktoré identifikovali zvýšenú expresiu PGF u gliómov [19] a meningiómov [20], bez ohľadu na grading.
Rakovinové bunky v okolí nekrotického jadra trpia nedostatkom živín a kyslíka. Transkripčný faktor HIF-1 reguluje správanie nádoru za hypoxických podmienok ovplyvňujúc génovú expresiu rastových faktorov [21]. Jedným z mnohých génov, ktorých expresia je počas hypoxie indukovaná HIF-1 je HMOX1. Nakoľko činnosť HMOX1 indukuje angiogenézu, je tento enzým vhodným markerom neovaskularizácie gliómov [22,23]. Naše zistenia sú v súlade so súčasnou literatúrou [24,25], no štatistická významnosť bola preukázaná iba v prípade zvýšenej expresie HMOX1 u AST. Za hypoxických a v niektorých prípadoch aj normoxických podmienok rakovinové bunky preferujú ako zdroj energie molekuly ATP získané glykolýzou. Energetická bilancia glykolýzy je v porovnaní s oxidatívnou fosforyláciou veľmi nízka, rakovinové bunky preto potrebujú zvýšiť príjem glukózy a to nadprodukciou glukózových prenášačov, najmä GLUT1 a GLUT3, ktoré sú indukované hypoxiou [26,27]. Napriek preukázateľnej expresii génu SLC2A1 (kódujúci GLUT1) v mozgových nádoroch [28,29], sa nám nepodarilo identifikovať zvýšenú hladinu génu v našich vzorkách, dokonca sme so štatistickou významnosťou identifikovali pokles expresie génu u GBM; čo môže naznačovať aeróbnu tvorbu energie, pretože je známe, že nádorové bunky sú schopné voľne „prepínať“ medzi aeróbnym a anaeróbnym metabolizmom [28], či anaplerotické dopĺňanie metabolitov Krebsovho cyklu napr. z glutamínu [30]. Zaujímavou je štúdia Silvu a kolektívu, ktorí vo vzorkách meningiómov identifikovali znížené množstvo GLUT1 u žien v porovnaní s mužmi [31]. To môže podporovať naše výsledky, nakoľko väčšina bioptických vzoriek nášho súboru meningiómov pochádzala od pacientiek.
Väčšina úmrtí u pacientov súvisiacich s onkologickým postihnutím je spájaná s metastatickým charakterom nádoru [32]. U mozgových nádorov a GBM sú extrakraniálne metastázy zriedkavé [33]. Častejším javom je migrácia gliómových buniek do oblastí mozgu vzdialených od primárneho tumoru [3,34]. Epiteliálno-mezenchymálna tranzícia je proces, v ktorom epiteliálne bunky stratia epiteliálne charakteristiky získajúc mezenchymálny fenotyp vedúci ku zvýšenej mobilite a rezistencii [35]. Kadheríny tvoria skupinu transmembránových proteínov podieľajúcich sa na stavbe medzibunkových spojov [36]. Expresia génu CDH2 kódujúceho N-kadherín, proteín zabezpečujúci bunkovú adhéziu, bola u mNG, AST aj GBM znížená (u GBM štatisticky významne). Strata expresie CDH2 ale vedie ku polarizácii a abnormálnej pohyblivosti, čo významne zvyšuje migráciu a invazívny charakter nádorových buniek [37,38]. Na druhej strane, u arachnoidálnych buniek a meningiómov je prevažne exprimovaný CDH1 kódujúci E-kadherín [36], čo vysvetľuje nami zaznamenanú zníženú expresiu CDH2 v pacientskych biopsiách MNG. medzi transkripčné faktory zapojené do EMT-podobného procesu patria proteíny SNAI rodiny, najmä SNAI1 a SNAI2 [39,40], na rozdiel od SNAI3, ktorého schopnosť indukcie EMT je veľmi slabá [41]. Z vyšetrovaných SNAI génov sa nám podarilo identifikovať nadreguláciu génu SNAI1 a SNAI2 a podreguláciu SNAI3. Štatisticky významná zmena bola pozorovaná iba pri nadexpresii SNAI2 u GBM. Ďalším proteínom pozitívne ovplyvňujúcim EMT a invazívny charakter nádorových buniek je protoonkogénom kódovaný transkripčný faktor FOXC2. Zaujímavé zistenia publikovali Wang et al., ktorí RT-PCR metódou analyzovali expresiu FOXC2 u astrocytómov (I–III) a glioblastómov (IV). Ich výsledky naznačujú pozitívnu závislosť medzi stupňom malignity a vysokou expresiou FOXC2 [42]. Tieto zistenia korelujú s výsledkami našich analýz – u GBM sme identifikovali až 54-násobne zvýšenú (p < 0,05) expresiu FOXC2 oproti kontrolnej vzorke; u AST bola expresia výrazne nižšia (1,09-násobne vyššia na oproti kontrole).
Apoptóza je proces programovanej bunkovej smrti charakterizovanej nezápalovou bunkovou fragmentáciou. Proces apoptózy môže byť iniciovaný vnútornou alebo vonkajšou dráhou, čo vedie k proteolytickej aktivácii kaspáz a riadenej bunkovej smrti. Nádorové bunky si však vyvinuli mechanizmus na udržanie proliferačnej signalizácie a vyhýbanie sa bunkovej smrti [43]. Signifikantnú zmenu expresie prokaspázových génov sme zaznamenali iba v prípade CASP9 (2,85; p < 0,05) a výlučne u astrocytómov. Tirapelli et al. sledovali zmeny v expresii apoptotických génov v bioptickom tkanive meningiómov. U CASP9 nezachytili v zmenách žiadnu signifikanciu, naopak z antiapoptotických génov pozorovali nadexpresiu v XIAP [44]. XIAP, člen rodiny apoptotických inhibítorov, inhibuje apoptózu väzbou na kaspázu 9 a efektorové kaspázy 3 a 7 [45]. Murphy et al. identifikovali zníženú expresiu XIAP génu u pacientov s GBM a rôzne hladiny expresie v glioblastómových bunkových líniách [46]. Podreguláciu v géne XIAP sme identifikovali v GBM a MNG skupine, no u pacientov s astrocytómom bola expresia XIAP zvýšená viac ako dvojnásobne (2,60; p < 0,05). Rôznorodosť výsledkov môže vysvetľovať výber kontrolnej skupiny, ale aj fakt, že niektorí pacienti podstúpili pred operáciou liečbu, čo sa mohlo odraziť na odpovedi nádoru apoptózou. CFLAR je ďalším z mnohých antiapoptotických génov. Kóduje štruktúrny homológ iniciačnej kaspázy 8, čím zabraňuje šíreniu apoptotického signálu [47]. Nadreguláciu v tomto géne sme pozorovali vo všetkých skúmaných skupinách nádorov (AST 4,46; p < 0,05), čo naznačuje ochranu nádorových buniek pred apoptózou vyvolanou vonkajšími podnetmi na receptoroch smrti.
Starnutie bunky je ireverzibilný proces zastavenia rastu [48]. BMI1 pôsobí ako transkripčný represor génov regulujúcich bunkovú diferenciáciu a proliferáciu [49]. Jeho absencia má na tieto procesy negatívny dopad [50]. Expresia BMI1 je zvýšená u viacerých typov nádorov vrátane mozgových [51,52]. Nám sa však podarilo zachytiť nárast expresie iba u AST (3,28; p < 0,05). Ďalším transkripčným faktorom regulujúcim apoptotické, angiogénne a diferenciáciu zabezpečujúce gény je ETS2 [53]. Výsledky našej práce sa zhodujú s transkriptomickou analýzou Babalu et al., kde od pacientov s gliómom zaznamenali zníženú expresiu ETS2 a to bez ohľadu na stupeň malignity [54]. My sme navyše u mNG vzoriek potvrdili aj štatistickú významnosť (p < 0,001). Superoxid dizmutáza 1 kódovaná génom SOD1 je enzým premieňajúci voľné superoxidové radikály na telu menej škodlivý peroxid vodíka a kyslík [55]. U glioblastómov bol identifikovaný pokles v expresii SOD1, ktorý je spájaný s lepšou odpoveďou na rádioterapiu a prognózou pre pacientov [56,57]. Rovnaké výsledky sme analýzou získali aj my – expresia SOD1 bola u GBM oproti zdravému mozgovému tkanivu 2× znížená (p < 0,05). Mitogénom aktivovaná proteín kináza 1 (MAP2K1) je súčasťou Ras/MAPK dráhy, zohrávajúcou kľúčovú úlohu v prenose chemických signálov v rámci bunky [58]. Jej expresia bola vo všetkých vyšetrovaných vzorkách štatisticky významne znížená (MNG −6,32, p < 0,001; GBM −5,68, p < 0,001; AST −3,58, p < 0,01), čo koreluje aj s výsledkami na gliómoch s nižším stupňom malignity [58,59].
Hlavným cieľom bunkového cyklu je zabezpečenie presnej replikácie DNA v S fáze a konečné vytvorenie dvoch identických dcérskych buniek v mitotickej fáze. Deregulácie dráh bunkového cyklu sú charakteristické pre viaceré nádorové ochorenia. Vďaka tomu môžu rakovinové bunky uniknúť bunkovej smrti a starnutiu, čo sa prejaví nadmernou proliferáciou a rastom nádoru [60]. STMN1 je onkoproteín distribuovaný v cytoplazme buniek regulujúci kinetiku mikrotubulov [61]. Tým vplýva na riadenie bunkového cyklu, proliferácie a diferenciácie [62]. Mnohé štúdie poukazujú na zvýšenú expresiu STMN1 u rôznych ľudských malignít [63–65], ako aj u glioblastómov [66] a meningiómov. Autori Wang et al. korelovali expresiu STMN1 so stupňom malignity. V porovnaní s benígnymi meningiómami (WHO stupeň malignity I) bola expresia STMN1 u MNG II/III signifikantne zvýšená [67]. Našimi analýzami sme identifikovali signifikantnú podreguláciu STMN1 u MNG a GBM, čo naznačuje zníženú bunkovú proliferáciu a migráciu nádorových buniek. Ďalším kľúčovým regulátorom bunkového cyklu je Wee1 kináza. Jej hlavnou úlohou je zastavenie progresie bunkového cyklu na prechode z G2 do mitotickej fázy u buniek s poškodenou DNA [68]. Nadregulácia expresie WEE1 spojená so zhoršeným prežívaním pacientov [69,70] bola dokázaná aj u glioblastómov [71,72]. Naše zistenia potvrdzujú predchádzajúce poznatky – niekoľkonásobný nárast expresie WEE1 bol identifikovaný vo všetkých sledovaných nádorových skupinách.
Ľudské teloméry sú tandemové nukleotidové opakovania krátkej DNA sekvencie asociované s rôznymi teloméry-viažucimi proteínmi, ktoré majú zväčša ochrannú funkciu [73]. V bunkách vyžadujúcich nepretržitú obnovu (napr. v kmeňových bunkách) je dĺžka časom skracovaných telomér udržiavaná telomerázou. Telomeráza je neaktívna vo väčšine maturovaných buniek, avšak je často reaktivovaná u buniek rakovinových [74]. S telomerázou asociovaný proteín 1 (TEP1) sa považuje za štrukturálnu podjednotku telomerázy a je spájaný s jej aktiváciou. Vo vzorkách GBM, AST aj MNG sme identifikovali výrazne zníženú expresiu génu TEP1. Iní autori však nezaznamenali rozdiely v jeho expresii oproti zdravému tkanivu, či bunkám normálnych ľudských astrocytov [75]. Tankyrázy (TNKS, TNKS2) sú proteíny podieľajúce sa na udržiavaní dĺžky telomér [76], čo je spolu s reguláciou Wnt/b-katenín dráhy dôležité pre obnovu a prežívanie rakovinových buniek [77]. Shervington et al. pozorovali zvýšenú expresiu TNKS u glioblastómových bunkových línii v porovnaní s normálnymi ľudskými astrocytmi, pri bioptických vzorkách však rozdiely v expresii nestanovili, nakoľko TNKS bol exprimovaný u GBM aj v zdravom mozgovom tkanive [75]. Táto skutočnosť môže vysvetľovať prečo sme vo všetkých nádorových skupinách identifikovali zníženie expresie TNKS aj TNKS2.
Hlavnou úlohou DNA opravných mechanizmov je odpoveď na poškodenie DNA indukované vonkajšími faktormi prostredia [78]. Mutácie v týchto génoch môžu viesť k obmedzenej až defektnej schopnosti opravy DNA a akumulácii poškodenej DNA, čo v konečnom dôsledku zvyšuje riziko vzniku rakoviny. Na druhej strane, nádorové bunky nadmerne exprimujú gény DNA opravných mechanizmov, čo má za následok väčšiu opravnú kapacitu spojenú s rezistenciou na liečbu [79]. DDB2 je považovaný za tumor supresorový gén [80]. Jeho proteínový produkt DDB2 sa podieľa na mechanizme opravy DNA vytváraním medzivláknových krížových väzieb, ktorého funkčnosť je spájaná s dobrou prognózou u pacientov s glioblastómom. Naproti tomu nízka expresia DDB2 znamená zhoršenú prognózu [81,82]. Nami získané výsledky boli v súlade s údajmi v dostupnej literatúre, avšak štatisticky signifikantné násobné zvýšenie expresie DDB2 sme zaznamenali iba u glioblastómov (2,97; p < 0,05).
Jedným z charakteristických znakov nádorových ochorení je reprogramovanie metabolických dráh [83]. ACSL4 patrí do rodiny syntetáz acyl-CoA s dlhým reťazcom [84], ktorej primárnym substrátom je arachidonát [85]. Expresia ACSL4 sa v rôznych typoch nádorov líši – zatiaľ čo u nádorových ochorení močového mechúra, prsníka alebo pľúc je expresia znížená, u kolorektálnych karcinómov, myelómov či tumorov pečene je expresia výrazne zvýšená [86]. U mozgových nádorov je gén ACSL4 podregulovaný, čo je vo všeobecnosti spájané so zlou prognózou pre pacientov [86,87]. Výsledky získané našou analýzou sa zhodujú s poznatkami ostatných autorov, nakoľko u všetkých 3 skupín sme identifikovali pokles v expresii ACSL4, u AST a GBM aj so signifikanciou.
V nádorových bunkách je prítomná vysoká glykolytická aktivita aj za aeróbnych podmienok, pričom samotné glykolytické enzýmy sa môžu využívať ako terapeutické ciele pri liečbe glioblastómu [88]. Rozsiahlu štúdiu expresie vybraných metabolických génov zapojených do glukózového metabolizmu a oxidačnej fosforylácie u gliómov iba nedávno publikoval kolektív autorov Stanke, Wilson a Kidambi [89]. Glukóza-6-fosfát dehydrogenáza (G6PD) je enzým pentózového cyklu katalyzujúci redukciu NADP+ na NADPH. Expresia G6PD bola u GBM pacientov oproti kontrolnej skupine signifikantne znížená a v porovnaní s astrocytómami s nižším gradingom zas zvýšená. Naše výsledky korelujú so štúdiou Stankeho et al., avšak pravdepodobne kvôli nízkemu počtu vzoriek v jednotlivých skupinách nie sú pozorované zmeny signifikantné.
COX5A je jednou z troch podjednotiek cytochróm c oxidázy – komplexu IV dýchacieho reťazca kódovaných mitochondriálnou DNA [90]. COX5A aj gén kódujúci ďalšiu podjednotku komplexu III UQCRB, sú u pacientov s glioblastómom v porovnaní so zdravými jedincami podregulované. Naopak, pri porovnaní s expresiou u gliómov s nižším stupňom malignity je expresia COX5A u GBM signifikantne zvýšená a UQCRB na približne rovnakej úrovni. Znížená expresia bola tiež korelovaná so zlou prognózou [89]. Aj v našom súbore sme boli schopní identifikovať poklesy v expresii týchto génov a to vo všetkých skúmaných skupinách. Zvýšenie expresie génov glykolýzy, pentózového cyklu a dýchacieho reťazca u GBM naznačuje metabolické zmeny pri progresii z astrocytómov s nižším gradingom. Avšak pokles v expresii génov oxidačnej fosforylácie by mohol vysvetľovať prítomnosť hypoxických oblastí obklopených pseudopalisádovými bunkami hlavne u nádorov s vyšším stupňom malignity (GBM) naznačujúc, že cielenie na glykolytické enzýmy môže byť zaujímavou stratégiou pre liečbu agresívnych mozgových nádorov [88].
Záver
V ostatných rokoch bolo študovaných množstvo látok, ktoré vykazovali rôznu mieru úspešnosti v predklinických, či klinických testoch, avšak žiadna nepreukázala dostatočne pozitívne výsledky pre predĺženie života alebo zlepšenie jeho kvality u pacientov s mozgovými nádormi. Preto je dôležité neustále hľadať nové terapeutické ciele, ktorých inhibícia by mohla zamedziť invazívnemu charakteru a rastu mozgového nádoru a zlepšiť prežívanie pacientov. Najvýraznejšia zmena expresie bola zaznamenaná v génoch EMT, kedy sme zachytili zníženú expresiu v génoch CDH2 a SOX10 so štatistickou významnosťou v glioblastómovej skupine a štatisticky zvýšenú expresiu génov FOXC2 (u GBM), GSC (u AST a MNG) a SNAI2 (u GBM). Ďalšími génmi, u ktorých sme zaznamenali štatisticky významné zmeny v expresii sú gény regulujúce bunkové starnutie, dynamiku telomér a opravné mechanizmy DNA poškodenia. Našou kvantitatívnou analýzou sme poukázali na odlišne exprimované gény kódujúce proteíny, ktorých inhibícia by mohla mať vplyv na prežívanie mozgových rakovinových buniek a prispieť k personalizovanej terapii.
Podporujúca agentúra a sponzori
Táto práca bola podporovaná Agentúrou na podporu výskumu a vývoja na základe Zmluvy č. APVV-18-0088.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare that they have no potential confl icts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
doc. RNDr. Jozef Hatok, PhD.
Univerzita Komenského v Bratislave
Jesseniova lekárska fakulta v Martine
Ústav lekárskej biochémie
Malá Hora 11161/4D
036 01 Martin
Slovenská republika
e-mail: hatok@jfmed.uniba.sk
Obdržané/Submitted: 8. 6. 2022
Prijaté/Accepted: 13. 10. 2022Klin Onkol 2023; 36(3): 224 – 233
Zdroje
1. Louis DN, Perry A, Wesseling P et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol 2021; 23 (8): 1231–1251. doi: 10.1093/neuonc/noab106.
2. Nørøxe DS, Poulsen HS, Lassen U. Hallmarks of glioblastoma: a systematic review. ESMO Open 2017; 1 (6): e000144. doi: 10.1136/esmoopen-2016-000144.
3. Altieri R, Zenga F, Fontanella MM et al. Glioma surgery: technological advances to achieve a maximal safe resection. Surg Technol Int 2015; 27 : 297–302.
4. Agnihotri S, Burrell KE, Wolf A et al. Glioblastoma, a brief review of history, molecular genetics, animal models and novel therapeutic strategies. Arch Immunol Ther Exp (Warsz) 2013; 61 (1): 25–41. doi: 10.1007/s00005-012-0203-0.
5. Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med 2008; 359 (5): 492–507. doi: 10.1056/NEJMra0708126.
6. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996. doi: 10.1056/NEJMoa043330.
7. Blahovcova E, Richterova R, Kolarovszki B et al. Apoptosis-related gene expression in tumor tissue samples obtained from patients diagnosed with glioblastoma multiforme. Int J Mol Med 2015; 36 (6): 1677–1684. doi: 10.3892/ijmm.2015.2369.
8. Narsia N, Ramagiri P, Ehrmann J et al. Transcriptome analysis reveals distinct gene expression profiles in astrocytoma grades II-IV. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2017; 161 (3): 261–271. doi: 10.5507/bp.2017.020.
9. Majercikova Z, Dibdiakova K, Gala M et al. Different approaches for the profiling of cancer pathway-related genes in glioblastoma cells. Int J Mol Sci 2022; 23 (18): 10883. doi: 10.3390/ijms231810883.
10. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100 (1): 57–70. doi: 10.1016/s0092-8674 (00) 81683-9.
11. Takano S, Yamashita T, Ohneda O. Molecular therapeutic targets for glioma angiogenesis. J Oncol 2010; 2010 : 351908. doi: 10.1155/2010/351908.
12. Louis DN, Ohgaki H, Wiestler OD et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007; 114 (2): 97–109. doi: 10.1007/s00401-007-0243-4.
13. Siedlecki Z, Nowak K, Grzyb S et al. Angiogenesis in brain tumors: gliomas and meningiomas – a review. Eur J Mol Clin Med 2021; 8 (2): 2354–2359.
14. Winter RC, Antunes ACM, de Oliveira FH. The relationship between vascular endothelial growth factor and histological grade in intracranial meningioma. Surg Neurol Int 2020; 11 : 328. doi: 10.25259/SNI_528_2020.
15. Reszec J, Hermanowicz A, Rutkowski R et al. Expression of MMP-9 and VEGF in meningiomas and their correlation with peritumoral brain edema. Biomed Res Int 2015; 2015 : 646853. doi: 10.1155/2015/646853.
16. Loureiro LVM, Neder L, Callegaro-Filho D et al. The immunohistochemical landscape of the VEGF family and its receptors in glioblastomas. Surg Exp Pathol 2020; 3 (9). doi: 10.1186/s42047-020-00060-5.
17. Plate KH, Breier G, Weich HA et al. Vascular endothelial growth factor is a potential tumour angiogenesis factor in human gliomas in vivo. Nature 1992; 359 (6398): 845–848. doi: 10.1038/359845a0.
18. Phillips H, Armani M, Stavrou D et al. Intense focal expression of vascular endothelial growth-factor messenger-RNA in human intracranial neoplasms – association with regions of necrosis. Int J Oncol 1993; 2 (6): 913–919. doi: 10.3892/ijo.2.6.913.
19. Schneider K, Weyerbrock A, Doostkam S et al. Lack of evidence for PlGF mediating the tumor resistance after anti-angiogenic therapy in malignant gliomas. J Neurooncol 2015; 121 (2): 269–278. doi: 10.1007/s11060-014-1647-3.
20. Hess K, Spille DC, Adeli A et al. Occurrence of fibrotic tumor vessels in grade I meningiomas is strongly associated with vessel density, expression of VEGF, PlGF, IGFBP-3 and tumor recurrence. Cancers (Basel) 2020; 12 (10): 3075. doi: 10.3390/cancers12103075.
21. Liao D, Johnson RS. Hypoxia: a key regulator of angiogenesis in cancer. Cancer Metastasis Rev 2007; 26 (2): 281–290. doi: 10.1007/s10555-007-9066-y.
22. Nishie A, Ono M, Shono T et al. Macrophage infiltration and heme oxygenase-1 expression correlate with angiogenesis in human gliomas. Clin Cancer Res 1999; 5 (5): 1107–1113.
23. El Andaloussi A, Lesniak MS. CD4+ CD25+ FoxP3+ T-cell infiltration and heme oxygenase-1 expression correlate with tumor grade in human gliomas. J Neurooncol 2007; 83 (2): 145–152. doi: 10.1007/s11060-006-9314-y.
24. Sferrazzo G, Di Rosa M, Barone E et al. Heme oxygenase-1 in central nervous system malignancies. J Clin Med 2020; 9 (5): 1562. doi: 10.3390/jcm9051562.
25. Ye W, Liu Z, Liu F et al. Heme oxygenase-1 predicts risk stratification and immunotherapy efficacy in lower grade gliomas. Front Cell Dev Biol 2021; 9 : 760800. doi: 10.3389/fcell.2021.760800.
26. Airley RE, Mobasheri A. Hypoxic regulation of glucose transport, anaerobic metabolism and angiogenesis in cancer: novel pathways and targets for anticancer therapeutics. Chemotherapy 2007; 53 (4): 233–256. doi: 10.1159/000104457.
27. Pliszka M, Szablewski L. Glucose transporters as a target for anticancer therapy. Cancers (Basel) 2021; 13 (16): 4184. doi: 10.3390/cancers13164184.
28. van de Nes JA, Griewank KG, Schmid KW et al. Immunocytochemical analysis of glucose transporter protein-1 (GLUT-1) in typical, brain invasive, atypical and anaplastic meningioma. Neuropathology 2015; 35 (1): 24–36. doi: 10.1111/neup.12148.
29. Komaki S, Sugita Y, Furuta T et al. Expression of GLUT1 in pseudopalisaded and perivascular tumor cells is an independent prognostic factor for patients with glioblastomas. J Neuropathol Exp Neurol 2019; 78 (5): 389–397. doi: 10.1093/jnen/nly124.
30. Marie SK, Shinjo SM. Metabolism and brain cancer. Clinics (Sao Paulo) 2011; 66 (Suppl 1): 33–43. doi: 10.1590/s1807-59322011001300005.
31. Silva JM, Wippel HH, Santos MDM et al. Proteomics pinpoints alterations in grade I meningiomas of male versus female patients. Sci Rep 2020; 10 (1): 10335. doi: 10.1038/s41598-020-67113-3.
32. Xu W, Yang Z, Lu N. A new role for the PI3K/Akt signaling pathway in the epithelial-mesenchymal transition. Cell Adh Migr 2015; 9 (4): 317–324. doi: 10.1080/19336918.2015.1016686.
33. Johansen MD, Rochat P, Law I et al. Presentation of two cases with early extracranial metastases from glioblastoma and review of the literature. Case Rep Oncol Med 2016; 2016 : 8190950. doi: 10.1155/2016/8190950.
34. Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis. Science 2011; 331 (6024): 1559–1564. doi: 10.1126/science.1203543.
35. Armento A, Ehlers J, Schötterl S et al. (2017) Molecular mechanisms of glioma cell motility. In: De Vleeschouwer S (ed). Glioblastoma. Brisbane: Codon Publications 2017 : 73–93.
36. Noronha C, Ribeiro AS, Taipa R et al. Cadherin expression and EMT: a focus on gliomas. Biomedicines 2021; 9 (10): 1328. doi: 10.3390/biomedicines9101328.
37. Asano K, Duntsch CD, Zhou Q et al. Correlation of N-cadherin expression in high grade gliomas with tissue invasion. J Neurooncol 2004; 70 (1): 3–15. doi: 10.1023/b: neon.0000040811.14908.f2.
38. Camand E, Peglion F, Osmani N et al. N-cadherin expression level modulates integrin-mediated polarity and strongly impacts on the speed and directionality of glial cell migration. J Cell Sci 2012; 125 (Pt 4): 844–857. doi: 10.1242/jcs.087668.
39. Yang HW, Menon LG, Black PM et al. SNAI2/Slug promotes growth and invasion in human gliomas. BMC Cancer 2010; 10 : 301. doi: 10.1186/1471-2407-10-301.
40. Liu B, Dong H, Lin X et al. RND3 promotes Snail 1 protein degradation and inhibits glioblastoma cell migration and invasion. Oncotarget 2016; 7 (50): 82411–82423. doi: 10.18632/oncotarget.12396.
41. Gras B, Jacqueroud L, Wierinckx A et al. Snail family members unequally trigger EMT and thereby differ in their ability to promote the neoplastic transformation of mammary epithelial cells. PLoS One 2014; 9 (3): e92254. doi: 10.1371/journal.pone.0092254.
42. Wang YW, Yin CL, Zhang HY et al. High expression of forkhead box protein C2 is related to poor prognosis in human gliomas. Asian Pac J Cancer Prev 2014; 15 (24): 10621–10625. doi: 10.7314/apjcp.2014.15.24.10621.
43. Wong RS. Apoptosis in cancer: from pathogenesis to treatment. J Exp Clin Cancer Res 2011; 30 (1): 87. doi: 10.1186/1756-9966-30-87.
44. Tirapelli DP, Menezes SB, Franco IM et al. High expression of anti-apoptotic genes in grade I and II meningiomas. Arq Neuropsiquiatr 2017; 75 (4): 209–215. doi: 10.1590/0004-282X20170027.
45. Deveraux QL, Roy N, Stennicke HR et al. IAPs block apoptotic events induced by caspase-8 and cytochrome c by direct inhibition of distinct caspases. EMBO J 1998; 17 (8): 2215–2223. doi: 10.1093/emboj/17.8.2215.
46. Murphy ÁC, Weyhenmeyer B, Schmid J et al. Activation of executioner caspases is a predictor of progression-free survival in glioblastoma patients: a systems medicine approach. Cell Death Dis 2013; 4 (5): e629. doi: 10.1038/cddis.2013.157.
47. Irmler M, Thome M, Hahne M et al. Inhibition of death receptor signals by cellular FLIP. Nature 1997; 388 (6638): 190–195. doi: 10.1038/40657.
48. Sharpless NE, Sherr CJ. Forging a signature of in vivo senescence. Nat Rev Cancer 2015; 15 (7): 397–408. doi: 10.1038/nrc3960.
49. Schuringa JJ, Vellenga E. Role of the polycomb group gene BMI1 in normal and leukemic hematopoietic stem and progenitor cells. Curr Opin Hematol 2010; 17 (4): 294–299. doi: 10.1097/MOH.0b013e328338c439.
50. Molofsky AV, Pardal R, Iwashita T et al. Bmi-1 dependence distinguishes neural stem cell self-renewal from progenitor proliferation. Nature 2003; 425 (6961): 962–967. doi: 10.1038/nature02060.
51. Abdouh M, Facchino S, Chatoo W et al. BMI1 sustains human glioblastoma multiforme stem cell renewal. J Neurosci 2009; 29 (28): 8884–8896. doi: 10.1523/JNEUROSCI.0968-09.2009.
52. Vora P, Seyfrid M, Venugopal C et al. Bmi1 regulates human glioblastoma stem cells through activation of differential gene networks in CD133+ brain tumor initiating cells. J Neurooncol 2019; 143 (3): 417–428. doi: 10.1007/s11060-019-03192-1.
53. Fry EA, Inoue K. Aberrant expression of ETS1 and ETS2 proteins in cancer. Cancer Rep Rev 2018; 2 (3): 10.15761/CRR.1000151. doi: 10.15761/CRR.1000151.
54. Babal YK, Kandemir B, Kurnaz IA. Gene regulatory network of ETS domain transcription factors in different stages of glioma. J Pers Med 2021; 11 (2): 138. doi: 10.3390/jpm11020138.
55. Noor R, Mittal S, Iqbal J. Superoxide dismutase – applications and relevance to human diseases. Med Sci Monit 2002; 8 (9): RA210–RA215.
56. Gao Z, Sarsour EH, Kalen AL et al. Late ROS accumulation and radiosensitivity in SOD1-overexpressing human glioma cells. Free Radic Biol Med 2008; 45 (11): 1501–1509. doi: 10.1016/j.freeradbiomed.2008.08.009.
57. Lu WC, Xie H, Yuan C et al. Identification of potential biomarkers and candidate small molecule drugs in glioblastoma. Cancer Cell Int 2020; 20 : 419. doi: 10.1186/s12935-020-01515-1.
58. Zhou Z, Peng B, Li J et al. Integrative pan-cancer analysis of MEK1 aberrations and the potential clinical implications. Sci Rep 2021; 11 (1): 18366. doi: 10.1038/s41598-021-97840-0.
59. Cheaney B 2nd, Bowden S, Krause K et al. An unusual recurrent high-grade glioneuronal tumor with MAP2K1 mutation and CDKN2A/B homozygous deletion. Acta Neuropathol Commun 2019; 7 (1): 110. doi: 10.1186/s40478-019-0763-x.
60. Gousias K, Theocharous T, Simon M. Mechanisms of cell cycle arrest and apoptosis in glioblastoma. Biomedicines 2022; 10 (3): 564. doi: 10.3390/biomedicines10030564.
61. Ozon S, Maucuer A, Sobel A. The stathmin family – molecular and biological characterization of novel mammalian proteins expressed in the nervous system. Eur J Biochem 1997; 248 (3): 794–806. doi: 10.1111/j.1432-1033.1997.t01-2-00794.x.
62. Devred F, Tsvetkov PO, Barbier P et al. Stathmin/Op18 is a novel mediator of vinblastine activity. FEBS Lett 2008; 582 (17): 2484–2488. doi: 10.1016/j.febslet.2008.06.035.
63. Howitt BE, Nucci MR, Drapkin R et al. Stathmin-1 expression as a complement to p16 helps identify high - -grade cervical intraepithelial neoplasia with increased specificity. Am J Surg Pathol 2013; 37 (1): 89–97. doi: 10.1097/PAS.0b013e3182753f5a.
64. Hemdan T, Lindén M, Lind SB et al. The prognostic value and therapeutic target role of stathmin-1 in urinary bladder cancer. Br J Cancer 2014; 111 (6): 1180–1187. doi: 10.1038/bjc.2014.427.
65. Sun R, Liu Z, Wang L et al. Overexpression of stathmin is resistant to paclitaxel treatment in patients with non--small cell lung cancer. Tumour Biol 2015; 36 (9): 7195–7204. doi: 10.1007/s13277-015-3361-y.
66. Dong B, Mu L, Qin X et al. Stathmin expression in glioma-derived microvascular endothelial cells: a novel therapeutic target. Oncol Rep 2012; 27 (3): 714–718. doi: 10.3892/or.2011.1525.
67. Wang H, Li W, Wang G et al. Overexpression of STMN1 is associated with the prognosis of meningioma patients. Neurosci Lett 2017; 654 : 1–5. doi: 10.1016/j.neulet.2017.06.020.
68. Ghelli Luserna di Rorà A, Cerchione C, Martinelli G et al. A WEE1 family business: regulation of mitosis, cancer progression, and therapeutic target. J Hematol Oncol 2020; 13 (1): 126. doi: 10.1186/s13045-020-00959-2.
69. Magnussen GI, Holm R, Emilsen E et al. High expression of Wee1 is associated with poor disease-free survival in malignant melanoma: potential for targeted therapy. PLoS One 2012; 7 (6): e38254. doi: 10.1371/journal.pone.0038254.
70. Slipicevic A, Holth A, Hellesylt E et al. Wee1 is a novel independent prognostic marker of poor survival in post-chemotherapy ovarian carcinoma effusions. Gynecol Oncol 2014; 135 (1): 118–124. doi: 10.1016/j.ygyno.2014.07.102.
71. Lescarbeau RS, Lei L, Bakken KK et al. Quantitative phosphoproteomics reveals Wee1 kinase as a therapeutic target in a model of proneural glioblastoma. Mol Cancer Ther 2016; 15 (6): 1332–1343. doi: 10.1158/1535-7163.MCT-15-0692.
72. Tashnizi AH, Jaberipour M, Razmkhah M et al. Tumour suppressive effects of WEE1 gene silencing in neuroblastomas. J Cancer Res Ther 2016; 12 (1): 221–227. doi: 10.4103/0973-1482.165861.
73. Griffith JD, Comeau L, Rosenfield S et al. Mammalian telomeres end in a large duplex loop. Cell 1999; 97 (4): 503–514. doi: 10.1016/s0092-8674 (00) 80760-6.
74. Wang C, Meier UT. Architecture and assembly of mammalian H/ACA small nucleolar and telomerase ribonucleoproteins. EMBO J 2004; 23 (8): 1857–1867. doi: 10.1038/sj.emboj.7600181.
75. Shervington A, Patel R, Lu C et al. Telomerase subunits expression variation between biopsy samples and cell lines derived from malignant glioma. Brain Res 2007; 1134 (1): 45–52. doi: 10.1016/j.brainres.2006.11.093.
76. Canudas S, Houghtaling BR, Kim JY et al. Protein requirements for sister telomere association in human cells. EMBO J 2007; 26 (23): 4867–4878. doi: 10.1038/sj.emboj.7601903.
77. Clevers H, Loh KM, Nusse R. Stem cell signaling. An integral program for tissue renewal and regeneration: wnt signaling and stem cell control. Science 2014; 346 (6205): 1248012. doi: 10.1126/science.1248012.
78. Wood RD, Mitchell M, Sgouros J et al. Human DNA repair genes. Science 2001; 291 (5507): 1284–1289. doi: 10.1126/science.1056154.
79. Dizdaroglu M. Oxidatively induced DNA damage and its repair in cancer. Mutat Res Rev Mutat Res 2015; 763 : 212–245. doi: 10.1016/j.mrrev.2014.11.002.
80. Zhao R, Cui T, Han C et al. DDB2 modulates TGF-b signal transduction in human ovarian cancer cells by downregulating NEDD4L. Nucleic Acids Res 2015; 43 (16): 7838–7849. doi: 10.1093/nar/gkv667.
81. Batista LF, Roos WP, Christmann M et al. Differential sensitivity of malignant glioma cells to methylating and chloroethylating anticancer drugs: p53 determines the switch by regulating xpc, ddb2, and DNA double-strand breaks. Cancer Res 2007; 67 (24): 11886–11895. doi: 10.1158/0008-5472.CAN-07-2964.
82. Kun S, Duan Q, Liu G et al. Prognostic value of DNA repair genes based on stratification of glioblastomas. Oncotarget 2017; 8 (35): 58222–58230. doi: 10.18632/oncotarget.17452.
83. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011; 144 (5): 646–674. doi: 10.1016/j.cell.2011.02.013.
84. Soupene E, Kuypers FA. Mammalian long-chain acyl-CoA synthetases. Exp Biol Med (Maywood) 2008; 233 (5): 507–521. doi: 10.3181/0710-MR-287.
85. Lopes-Marques M, Cunha I, Reis-Henriques MA et al. Diversity and history of the long-chain acyl-CoA synthetase (Acsl) gene family in vertebrates. BMC Evol Biol 2013; 13 : 271. doi: 10.1186/1471-2148-13-271.
86. Chen WC, Wang CY, Hung YH et al. Systematic analysis of gene expression alterations and clinical outcomes for long-chain acyl-coenzyme A synthetase family in cancer. PLoS One 2016; 11 (5): e0155660. doi: 10.1371/journal.pone.0155660.
87. Cheng J, Fan YQ, Liu BH et al. ACSL4 suppresses glioma cells proliferation via activating ferroptosis. Oncol Rep 2020; 43 (1): 147–158. doi: 10.3892/or.2019.7419.
88. Sanzey M, Abdul Rahim SA, Oudin A et al. Comprehensive analysis of glycolytic enzymes as therapeutic targets in the treatment of glioblastoma. PLoS One 2015; 10 (5): e0123544. doi: 10.1371/journal.pone.0123544.
89. Stanke KM, Wilson C, Kidambi S. High expression of glycolytic genes in clinical glioblastoma patients correlates with lower survival. Front Mol Biosci 2021; 8 : 752404. doi: 10.3389/fmolb.2021.752404.
90. Bai X, Tan TY, Li YX et al. The protective effect of cordyceps sinensis extract on cerebral ischemic injury via modulating the mitochondrial respiratory chain and inhibiting the mitochondrial apoptotic pathway. Biomed Pharmacother 2020; 124 : 109834. doi: 10.1016/j.biopha.2020.109834.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2023 Číslo 3- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Waldenströmova makroglobulinemie, monoklonální gamapatie a Dr. Kyle
- Waldenströmova makroglobulinemie – klinické projevy a přehled léčby včera, dnes a zítra
- Etnické rozdiely v incidencii zhubných nádorov detí
- Skóre polygenního rizika (PRS) a jeho potenciál pro stratifikaci rizika karcinomu prsu
- Hypoplastická forma myelodysplastické neoplazie
- Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
- Kvantitatívne profilovanie génov asociovaných s dráhami vzniku mozgových nádorov
- Psychologická péče reflektující průběh a specifika virové infekce SARS-CoV-2 u onkologických pacientů s oxygenační poruchou – série kazuistik
- Efekt imunoterapie u mladého pacienta s mismatch repair deficientním karcinomem rekta – kazuistika
- Hepatosplenický T-lymfom s přítomností masivní splenomegalie a pancytopenie – kazuistika
- Nová naděje pro pacienty s metastatickým uveálním melanomem
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Waldenströmova makroglobulinemie – klinické projevy a přehled léčby včera, dnes a zítra
- Skóre polygenního rizika (PRS) a jeho potenciál pro stratifikaci rizika karcinomu prsu
- Molekulární testování karcinomu endometria – analýza prvních zkušeností z klinické praxe
- Hypoplastická forma myelodysplastické neoplazie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



