-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití PET/ CT s markerem hypoxie (18F-FMISO) v plánování radioterapie
Autoři: Tomáš Novotný 1; Zdeněk Řehák 2; Michal Budinský 3; Petr Dvořáček 4; Jiří Vašina 2; Pavel Šlampa 1; Marek Slávik 1
Působiště autorů: Klinika radiační onkologie LF MU a MOÚ, Brno 1; Oddělení nukleární medicíny, MOU Brno 2; Ústavní lékárna, MOÚ Brno 3; Oddělení radiologické fyziky, MOÚ Brno 4
Vyšlo v časopise: Klin Onkol 2021; 34(3): 241-243
Kategorie: Onkologie v obrazech
doi: https://doi.org/10.48095/ccko2021241Fluorem (18F) značený mizonidazol – 2-nitro-3-(1-18fluor-2-hydroxypropan-3-yl) imidazol – známý spíše pod zkratkou 18F-FMISO, je v současnosti nejrozšířenějším radiofarmakem pro PET z širší skupiny markerů nádorové hypoxie, kam patří také 18F-FAZA, 18F-EF5 a 64Cu-ATSM [1].
Jeho využití doporučujeme až následně po běžném vyšetření PET/ CT s 18F-fludeoxyglukózou (18F-FDG) [2].
Radiofarmakum 18F-FMISO je dostupné jako registrovaný léčivý přípravek od výrobce Radiomedic, s.r.o., Husinec, Řež, ČR. Vzhledem k tomu, že se jedná o radiofarmakum značené 18F, jeho zpracování je pro pracoviště, která běžně používají 18F, naprosto rutinní záležitostí. Na základě požadavku je radiofarmakum u dodavatele objednáno, po jeho dodání na pracoviště je pracovníky radiofarmaceutického úseku ústavní lékárny instrumentálně zpracováno do konečné lékové formy s vyžitím automatického dávkovacího zařízení µDDS-A (Tema Sinergie, Faenza, Itálie). Následně je předáno k aplikaci na oddělení nukleární medicíny.
V ČR je možné použití 18F-MISO v rámci Specifického léčebného programu [3]. Před vyšetřením není třeba speciální příprava ani monitorování glykémie, doporučuje se pouze dostatečná perorální hydratace pacienta před i po aplikaci radiofarmaka. Doporučená aplikovaná aktivita 18F-FMISO pro dospělé je 300–550 MBq (400 MBq pro pacienta s hmotností 70 kg). Radiofarmakum se aplikuje přímou intravenózní injekcí a PET zobrazení se provádí v delším odstupu, tj. za 2–3 hodiny po aplikaci.
18F-FMISO lze obecně využít pro stanovení hypoxie u celé řady tumorů, avšak nejčastější použití nachází u nádorů centrální nervové soustavy, zhoubných nádorů hlavy a krku (obr. 1), nemalobuněčného karcinomu plic a karcinomu děložního čípku.
Pacient ve věku 53 let s pokročilým tumorem orofaryngu, origo v oblasti levé tonzily, parafaryngeální šíření a pokročilou lymfadenopatií, T4 N1 M0, nízce diferencovaný, nekeratinizující dlaždicobuněčný karcinom v probatorní excizi – asociovaný s lidským papilomavirem.
Vzhledem k rozsahu se jedná o inoperabilní nález. Byla indikována konzervativní léčba – radioterapie v konkomitanci s chemoterapií.
V rámci stagingu bylo provedeno 18F-FDG PET/ CT vyšetření a následně druhé PET/ CT s markerem hypoxie 18F-FMISO. Obě vyšetření byla využita pro fúzi obrazových dat v plánovacím systému Aria. Oblast hypoxie se zobrazila jak v místě uzlinové metastázy, tak v místě primárního tumoru a tvořila přibližně šestinu objemu nádoru (18F-FMISO 14,8 cm3 × 18F-FDG 103 cm3).
Obr. 1. Porovnání diagnostických snímků s 18F-FMISO a 18F-FDG. 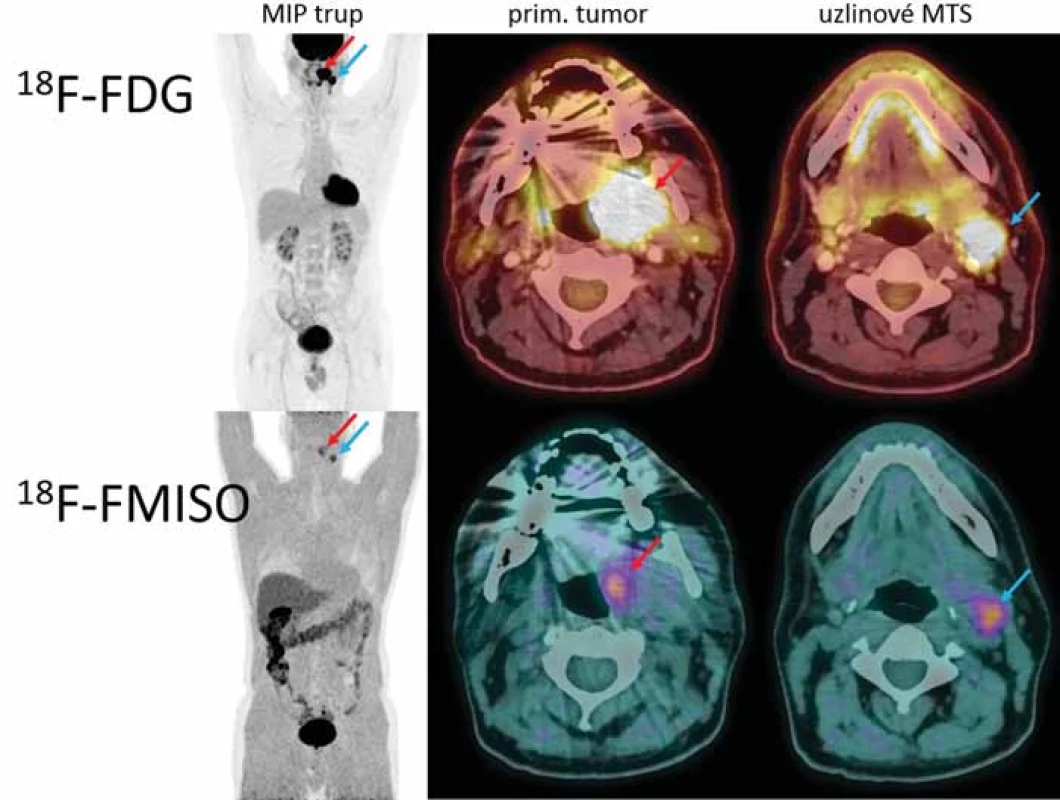
18F-FDG – 18F-fludeoxyglukóza, 18F-FMISO – 2-nitro-3-(1-18fl uor-2-hydroxypropan-3-yl) imidazol Obr. 2. Dávkové rozložení v místě primárního tumoru; vlevo dávka 77,0 Gy dle 18F-FMISO s izodózami 77 % (oranžová) a 50 % (fialová); vpravo dávka 70,0 Gy pokrývající oblast tumoru dle 18F-FDG; CT a MR s bezpečnostním lemem plánovacího objemu. 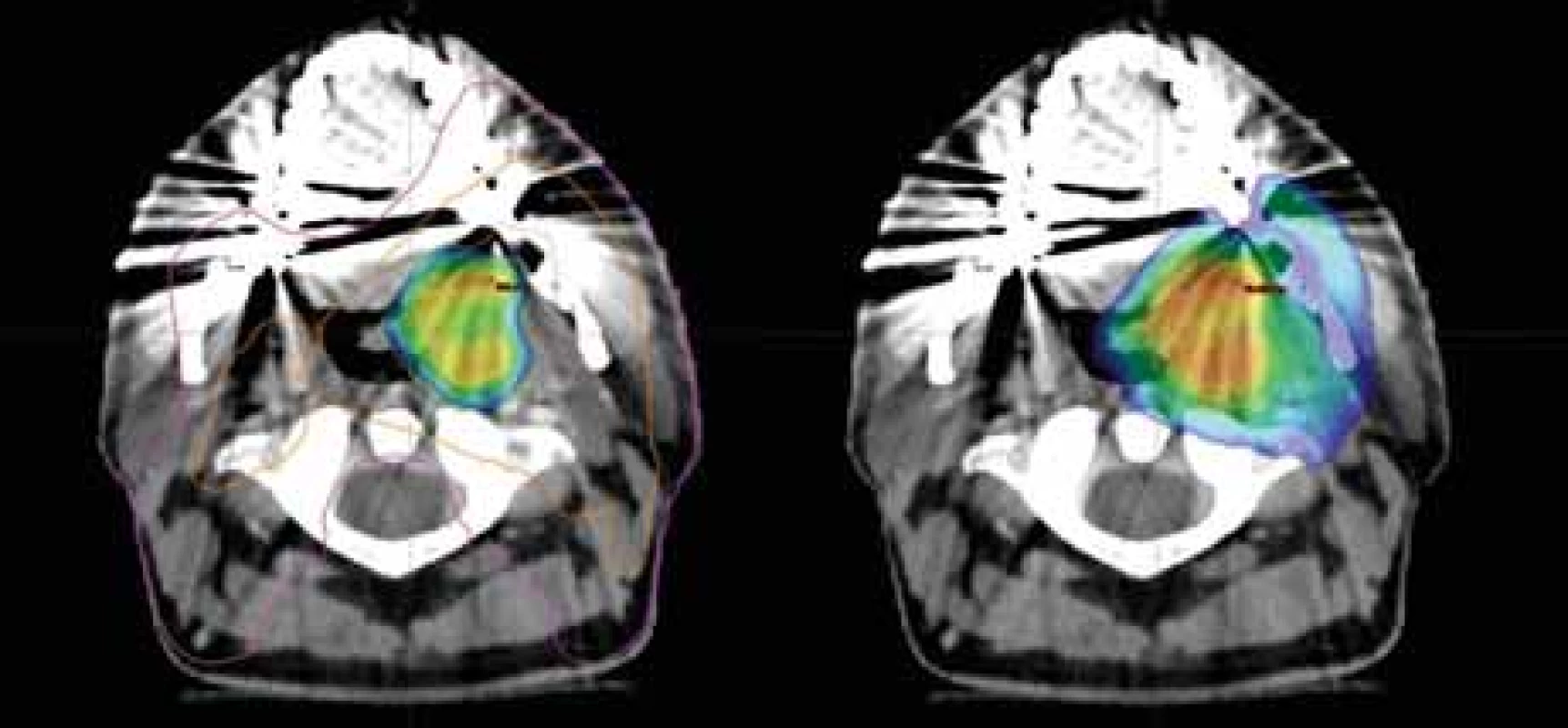
18F-FDG – 18F-fludeoxyglukóza, 18F-FMISO – 2-nitro-3-(1-18fl uor-2-hydroxypropan-3-yl) imidazol Obr. 3. Dávkové rozložení v místě uzlinové metastázy; vlevo dávka 77,0 Gy dle 18F- -FMISO s izodózami 77 % (oranžová) a 50 % (fialová); vpravo dávka 70,0 Gy pokrývající oblast metastázy dle 18F-FDG; CT a MR s bezpečnostním lemem plánovacího objemu. 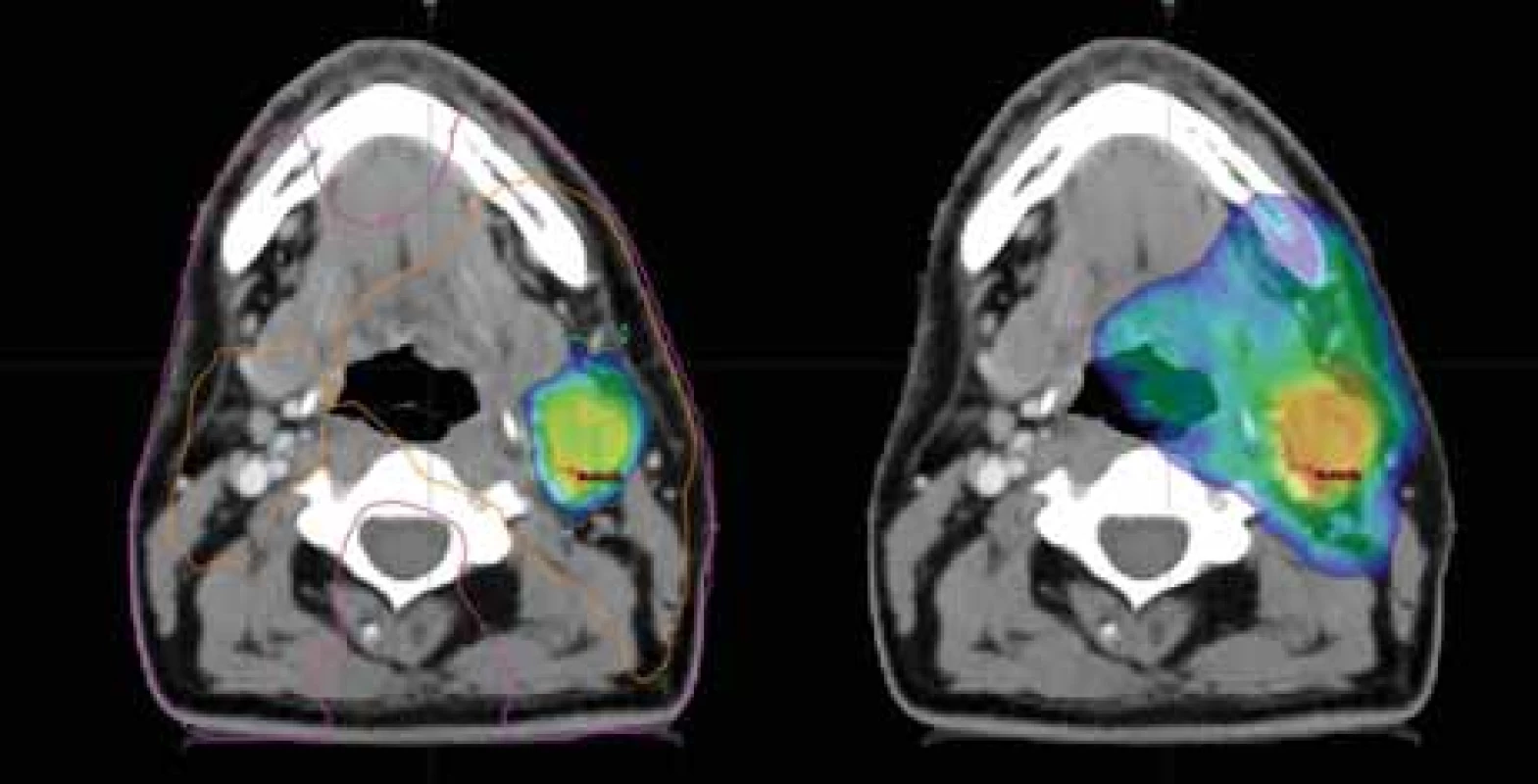
18F-FDG – 18F-fludeoxyglukóza, 18F-FMISO – 2-nitro-3-(1-18fl uor-2-hydroxypropan-3-yl) imidazol Byly zakresleny cílové objemy dle rizikovosti. Do oblasti hypoxie jsme eskalovali dávku na 77,0 Gy (35×2,2 Gy) dle podkladů studie Escalox [4]. Do 18F-FDG PET pozitivní oblasti byla aplikována standardní dávka 70,0 Gy (35×2,0 Gy). Další objemy zahrnovaly elektivní uzlinové oblasti. V blízkosti nebyly žádné důležité rizikové orgány, kromě mandibuly, která byla vyjmuta z této dávkové eskalace pro riziko vzniku osteoradionekrózy. V porovnání s klasickou normofrakcionací by dávková eskalace měla zvýšit 2letou lokální a regionální kontrolu o 15 % a kompenzovat radiorezistenci hypoxických oblastí nádoru (obr. 2, 3) [4].
Byly vypracovány dva plány; jeden s dávkovou eskalací, druhý bez ní. V plánu s dávkovou eskalací nedošlo k významnému zvýšení radiační zátěže sledovaných rizikových orgánů. Radioterapie probíhala fotonovým svazkem lineárního urychlovače o energii 6 MV technikou dynamického kyvu (volumetric modulated arc therapy – VMAT), režimem simultánního boostu. V konkomitanci byla podána cisplatina v monoterapii 40 mg/m2 týdně, celkem byly aplikovány čtyři cykly. Další nebyly podány pro hematologickou toxicitu.
Tolerance terapie byla dobrá, pacient dokončil léčbu v plánované dávce s přiměřenou toxicitou, která nevybočovala ze standardní úrovně toxicity (dle Radiation Therapy Oncology Group, slizniční G3, kožní G2, jícen G2, bez trizmu či lymfedému v akutní toxicitě). Do budoucna je nutné další sledování, monitorace pozdní toxicity a efektu terapie.
Díky radionuklidovému vyšetření s markerem hypoxie 18F-FMISO se nám otvírají možnosti cílené eskalace dávky VMAT technikou fotonového záření do rezistentních podobjemů bez významného zvýšení toxicity.
Obdrženo/Submitted: 1. 3. 2021
Přijato/Accepted: 9. 3. 2021MUDr. Tomáš Novotný
Klinika radiační onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: novotny@mou.cz
Zdroje
- Hodolič M, Fettich J, Kairemo K. Hypoxia PET tracers in EBRT dose planning in head and neck cancer. Curr Radiopharm 2015; 8(1): 32–37. doi: 10.2174/ 1874471008666150316222400.
- Watanabe S, Inoue T, Okamoto S et al. Combination of FDG-PET and FMISO-PET as a treatment strategy for patients undergoing early-stage NSCLC stereotactic radiotherapy. [online]. Available from: https:/ / ejnmmires.springeropen.com/ articles/ 10.1186/ s13550-019-0578-6.
- Specifické léčebné programy. [online]. Dostupné z: https:/ / www.radiomedic.cz/ produkty/ specificke-lecebne-programy/
- Pigorsch SU, Wilkens JJ, Kampfer S et al. Do selective radiation dose escalation and tumour hypoxia status impact the loco-regional tumour control after radio-chemotherapy of head & neck tumours? The ESCALOX protocol. Radiat Oncol 2017; 12(1): 45. doi: 10.1186/ s13014-017-0776-1.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2021 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Léčba nemetastatického kastračně rezistentního karcinomu prostaty
- Sociální faktory mají vliv na průběh a prognózu maligní nemoci
- Léčba nemetastatického kastračně refrakterního karcinomu prostaty
- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Mechanobiologie kancerogeneze
- COVID-19 a onkologické ochorenie
- Genetické a epigenetické základy radiorezistence nádorových buněk prostaty
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- Využití PET/ CT s markerem hypoxie (18F-FMISO) v plánování radioterapie
- Lipozomální irinotekan – nová možnost systémové léčby karcinomu pankreatu
- Aktuality z odborného tisku
- Životné jubileum doc. MU Dr. Juraja Kaušitza, CSc.
- Jubileum prvej dámy radiačnej onkológie na Slovensku – MUDr. Eva Siracká, DrSc.
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Indikace žilních vstupů v onkologii – doporučení národních odborných společností a současný stav v ČR
- Epiteloidní hemangioendoteliom v PET/ CT obraze
- COVID-19 a onkologické ochorenie
- Mechanobiologie kancerogeneze
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



