-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
Mitochondrial Processes in Targeted Cancer Therapy
Background:
During tumor initiation and progress, cellular functions adapt to the new needs of the transformed cells and mitochondrial processes are also affected. Mitochondria are less extensively used for supplying cells with energy; rather, cancer cells utilize glycolysis to a much greater extent, even under aerobic conditions. Mitochondria produce metabolites required for cellular growth and proliferation. Mutations and alterations in gene expression of citrate cycle enzymes can directly contribute to transformation through the production of oncometabolites. The apoptotic pathway in which mitochondria play a critical role is disrupted in cancer cells, resulting in cells that do not respond to programmed cell death signaling. These differences between mitochondrial processes in healthy and diseased cells suggest they could be used in mitochondria-targeted therapies. To date, many potential molecular targets have been identified, including enzymes, signaling molecules, and membrane transporters. Even though this field has been studied for years, the first drugs, venetoclax and enasidenib, were only approved in the last two years and are the result of two different research approaches. Venetoclax targets the apoptotic pathway and enasidenib targets metabolic processes. The discovery of these two compounds demonstrates that it is possible to develop mitochondria-targeted cancer treatments.
Purpose:
The purpose of this article is to provide an overview of research in the field of mitochondria-targeting therapies for cancer. The main areas of research and the main approaches for treatment development are summarized. Cellular components studied as potential targets for therapy and compounds that are considered exploitable are described, as well as already approved drugs.
Key words:
neoplasms – molecular targeted therapy – mitochondria – antineoplastic agents – research
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 3. 8. 2018
Autoři: Krejčíř Radovan; Valík Dalibor; Vojtěšek Bořivoj
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2018; 31(Supplementum 2): 14-20
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20182S14Souhrn
Východiska:
Při vzniku a vývoji nádoru dochází k adaptaci řady buněčných funkcí novým potřebám transformované buňky a k podstatným změnám dochází i v mitochondriích. Tato organela je částečně odstavena z energetického metabolizmu a nádorové buňky tak získávají významný podíl energie z glykolýzy i v aerobním prostředí. Mitochondrie je však intenzivně využívána k produkci metabolitů potřebných pro růst a proliferaci. Mutace a změny v expresi enzymů citrátového cyklu mohou navíc přímo přispívat k nádorové transformaci produkcí onkometabolitů. Apoptotická dráha, ve které hrají mitochondrie důležitou roli, je přerušena a buňka neodpovídá na signalizaci vedoucí k programované buněčné smrti. Tyto rozdíly ve fungování mitochondriálních procesů mezi zdravými a nádorovými buňkami vedly k myšlence cílit protinádorovou terapii na tuto organelu. Doposud se podařilo identifikovat řadu enzymů, signálních molekul a membránových přenašečů, které by mohly být pro vývoj terapie vhodnými cíli. Přestože výzkum v této oblasti probíhá již delší dobu, teprve v posledních letech byla úspěšně testována a schválena první léčiva pro klinickou praxi. Nová léčiva venetoklax a enasidenib jsou příkladem dvou odlišných přístupů, venetoklax cílí na apoptotickou dráhu a enasidenib na metabolické procesy. Obě látky však dokazují, že cílení na mitochondriální procesy je využitelné v terapii nádorových onemocnění.
Cíl:
Cílem této práce je poskytnout přehled o vývoji protinádorových léčiv zacílených na mitochondriální procesy. Práce se věnuje několika hlavním oblastem vývoje, v rámci kterých jsou zmíněny uplatňované výzkumné strategie. Popisuje buněčné komponenty, které jsou studovány jako vhodné cíle a také látky, které jsou potenciálně využitelné nebo již schválené pro použití v terapii nádorových onemocnění.
Klíčová slova:
nádory – cílená molekulární terapie – mitochondrie – protinádorové látky – výzkum
Úvod
Mitochondrie je organela, která je centrem energetického metabolizmu buňky. Uvnitř mitochondrie probíhá oxidativní fosforylace (oxidative phosphorylation – OXPHOS), která je součástí procesu buněčného dýchání. Buněčné dýchání umožňuje buňce efektivně zpracovávat glukózu a získávat z ní maximum využitelné energie. Součástí buněčného dýchání je i citrátový nebo také Krebsův cyklus (citrate cycle – CitC), cyklus enzymatických reakcí lokalizovaný v mitochondriální matrix, kde dochází k produkci redukovaných kofaktorů nezbytných k regeneraci adenozintrifosfátu (adenosine triphosphate – ATP). V CitC jsou dále vytvářeny metabolity, které slouží jako prekurzory pro syntézu aminokyselin, nukleotidů a lipidů. Mimo metabolické pochody má mitochondrie zásadní úlohu v procesu programované buněčné smrti, apoptóze.
Změny ve fungování mitochondriálních procesů mohou mít značný vliv na životaschopnost a chování buněk a jsou typické pro nádorové buňky [1]. Léčiva schválená pro klinické použití v posledních letech dokazují, že nádorové adaptace mitochondriálních funkcí je možné využít v cílené terapii nádorových onemocnění. Výzkum v této oblasti probíhá již delší dobu a vzešla z něj řada kandidátů pro klinické testy, první úspěchy však pocházejí až z nedávné doby. V současnosti jsou studovány možnosti cílení jednotlivých mitochondriálních procesů, mezi které patří apoptotická signalizace, energetický metabolizmus, CitC a také oxidačně-redukční rovnováha nádorových buněk (obr. 1).
Obr. 1. Přehled strategií pro cílení mitochondriálních procesů v terapii nádorů. 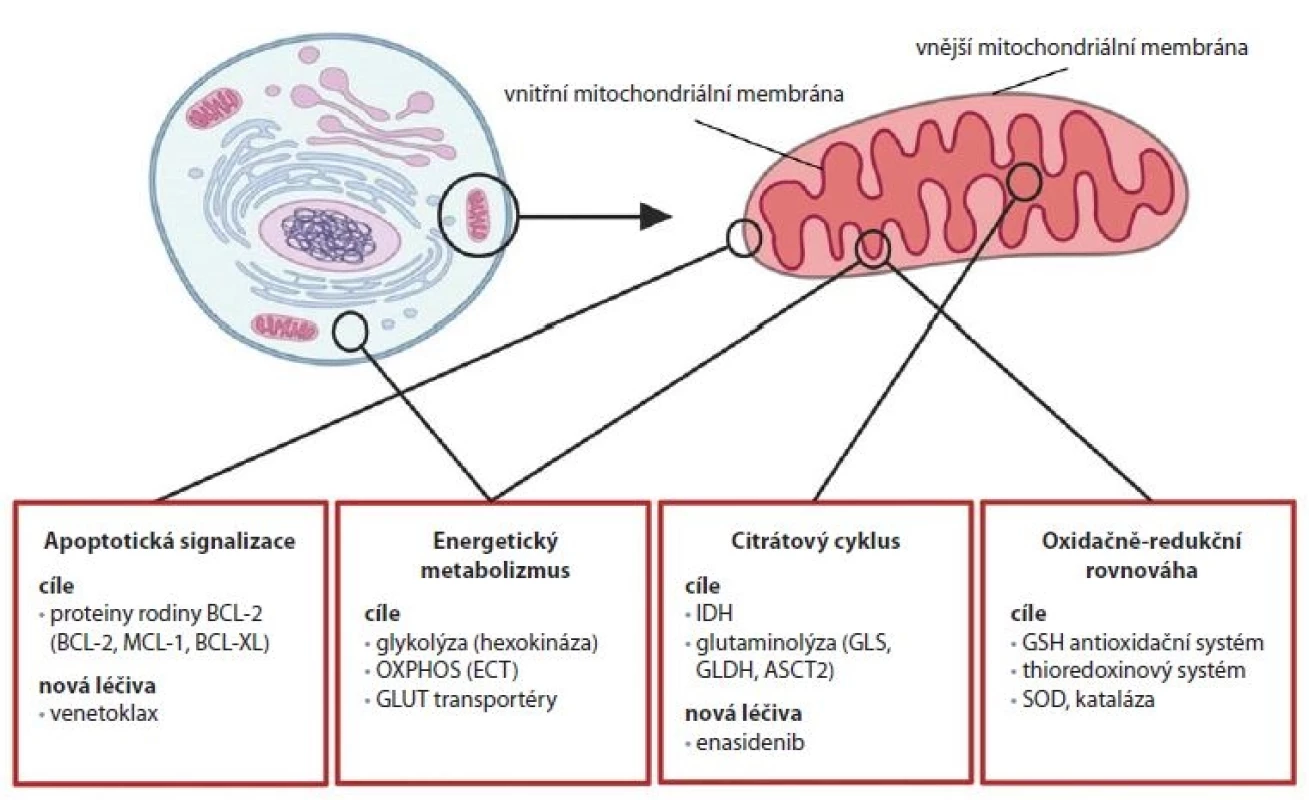
OXPHOS – oxidativní fosforylace, ECT – řetězec elektronového transportu, GLUT – glukózový transportér, IDH – izocitrátdehydrogenáza, GLS – glutamináza, GLDH – glutamát dehydrogenáza, ASCT2 – glutaminový transportér, GSH – glutathion, SOD – superoxiddismutáza Apoptotická signalizace
Apoptóza je základním typem programované buněčné smrti a pro lidský organizmus je jednou z přirozených bariér proti vzniku a rozvoji nádorových onemocnění. Úlohou apoptózy je odstranění nepotřebných nebo potenciálně nebezpečných buněk z organizmu. Aktivace apoptotické kaskády má za následek částečný rozklad buněčných komponent a fragmentaci buňky na tzv. apoptotická tělíska, která jsou pohlcena okolními buňkami. Při apoptóze proto nedochází (na rozdíl od nekrózy) k uvolnění buněčného obsahu do mezibuněčného prostoru a spuštění zánětlivé reakce. Během vývoje nádoru čelí nádorová buňka mnoha pokusům o vyvolání apoptózy. Rozlišujeme mezi tzv. vnitřní a vnější apoptotickou dráhou, které jsou spuštěny odlišnými mechanizmy. Vnější dráha je zahájena mezibuněčnou signalizací ze strany imunitních buněk, zatímco vnitřní dráhu spouští regulační mechanizmy buňky samotné. K rozhodnutí o spuštění vnitřní dráhy potom dochází na vnější mitochondriální membráně.
Molekulárním mechanizmem, který spouští vnitřní apoptotickou dráhu, je vychýlení rovnováhy mezi proapoptotickými a antiapoptotickými proteiny rodiny BCL-2 v cytosolu. Proteinová rodina BCL-2 tvoří systém, který integruje podněty z řady buněčných procesů a signálních drah a hladiny jednotlivých proteinů kolísají v závislosti na mnoha faktorech. Pokud je buňka v pořádku, převažuje signalizace pro přežití a antiapoptotické molekuly brání spuštění apoptózy. Pokud však dojde k dostatečné expresi proapoptotických proteinů označovaných jako „BH3-only“, antiapoptotické proteiny BCL-2, BCL-XL a MCL-1 jsou vyvázány z interakce s proteiny BAX a BAK. Uvolněné proteiny BAX a BAK poté oligomerizují a vytváří pór ve vnější mitochondriální membráně. V důsledku toho dochází k přesunu mitochondriálního proteinu cytochromu C do cytoplazmy, tvorbě apoptozomu a spuštění apoptotické kaskády [2].
Ke vzniku nádoru může dojít tehdy, pokud nádorová buňka dokáže obejít apoptotickou signalizaci a vyhnout se apoptóze. Nádorové buňky využívají různé způsoby, jak toho docílit, přičemž jedním z rozšířených mechanizmů je zvýšená exprese antiapoptotických proteinů rodiny BCL-2 [3]. Specifické inhibitory těchto proteinů jsou proto cílem vývoje protinádorové terapie a jsou známé jako BH3 mimetika, protože napodobují úlohu proapoptotických proteinů „BH3-only“ [4]. Výzkum v oblasti BH3 mimetik přinesl první úspěch v roce 2016, kdy nízkomolekulární látka venetoklax prošla úspěšně klinickým testováním a byla schválena Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration – FDA) [5]. Lék byl určen pacientům s chronickou lymfocytární leukemií a delecí krátkého raménka chromozomu 17, na kterém se nachází gen TP53 kódující nádorový supresor p53. V červnu 2018 byl potom venetoklax schválen v kombinaci s rituximabem i pro pacienty bez této delece. Venetoklax má za sebou zajímavý vývoj. Jeho předchůdcem byla jiná látka, navitoklax, která však musela být z klinického testování stažena, protože u pacientů způsobovala vážnou dávku limitující trombocytopenii. Později se ukázalo, že problém navitoklaxu spočíval v jeho nedostatečné specifitě. Navitoklax byl tzv. polyselektivním inhibitorem s afinitou ke dvěma antiapoptotickým proteinům BCL-2 a BCL-XL současně. Venetoklax byl proto navržen jako monoselektivní s afinitou pouze pro BCL-2. Tím vzniklo dostatečně široké terapeutické okno pro léčbu nádorových onemocnění s typicky zvýšenou expresí tohoto proteinu. Zdravé buňky, u kterých jsou antiapoptotické proteiny zastoupeny rovnoměrně jsou vůči inhibitoru méně citlivé než buňky závislé zejména na proteinu BCL-2. Monoselektivní inhibitory proteinů BCL-XL a MCL-1 jsou v současnosti ve fázi vývoje [4].
Energetický metabolizmus – glykolýza a příjem glukózy
Jednou z prvních známých vlastností nádorových buněk byla jejich zvýšená glykolytická aktivita. Nádorové buňky získávají velkou část energie z glykolýzy i za přítomnosti kyslíku. Důsledkem intenzivní glykolýzy v buňce je hromadění jejího koncového produktu, pyruvátu, který není dostatečně rychle odbouráván v CitC. Místo toho je pyruvát metabolizován na laktát, jehož hladina bývá v nádorové tkáni zvýšená. Tento jev je známý jako Warburgův efekt a byl popsán téměř před 100 lety [6]. Ve zdravých buňkách je glykolýza hlavním zdrojem energie pouze při nedostatku kyslíku, a nádorové buňky tak napodobují anaerobní metabolizmus. Warburgův efekt dal podnět k teorii, podle které byla ztráta funkčních mitochondrií primární příčinou nádorového bujení. Později se však ukázalo, že k úplné inhibici OXPHOS dochází v nádorech jen vzácně a k pochopení Warburgova efektu je potřeba brát v úvahu celý kontext metabolických změn v nádorové buňce [7,8]. Díky tomu, že zvýšená glykolytická aktivita je všeobecně rozšířenou vlastností nádorových buněk, stalo se zablokování glykolýzy zajímavým cílem pro vývoj onkologické léčby. Glykolýza samotná neprobíhá v mitochondriích, je však součástí energetického metabolizmu buňky a s mitochondriálními procesy je úzce spjatá.
Jednou z nejvíce studovaných možností, jak potlačit glykolýzu, je inhibice prvního enzymu glykolytické kaskády – hexokinázy (HK). HK fosforyluje glukózu za vzniku glukóza-6-fosfátu a patří mezi několik enzymů, jejichž aktivita je regulovaná a rozhoduje o celkovém výkonu glykolýzy. Inhibicí HK je možné zastavit celý proces a zabránit buňce v produkci ATP přeměnou glukózy na pyruvát. HK bývá v nádorech přítomná ve zvýšené míře, a to zejména v podobě izoenzymu HKII. Tato varianta se v dospělém lidském organizmu vyskytuje jen v některých tkáních a její unikátní vlastností je vazba na vnější mitochondriální membránu [9]. Vyšší exprese HK a dalších limitujících enzymů umožňuje nádorové buňce navýšit kapacitu glykolytické kaskády a v případě dostatečného množství glukózy získávat z glykolýzy více ATP. Podle některých studií mohou být nádorové buňky na HKII závislé a její inhibice by tak mohla být úspěšnou terapeutickou strategií [10]. Podařilo se objevit několik látek, které blokují glykolýzu prostřednictvím inhibice HK, ale žádná z nich nebyla úspěšně klinicky testována. Mezi ty nejzajímavější patří lonidamin a 3-bromopyruvát [11]. Účinek 3-bromopyruvátu pravděpodobně souvisí s jeho schopností blokovat vazbu HKII na mitochondriální membránu [12]. Dalšími vhodnými cíli pro inhibici glykolýzy jsou pyruvátkináza a fosfofruktokináza. Jejich aktivita patří podobně jako v případě HK k regulovaným krokům glykolytické kaskády, a také tyto enzymy bývají v nádorech přítomny jako určitá preferovaná varianta [7]. Ideálním inhibitorem by tak byla látka, která by dokázala specificky blokovat danou izoformu nebo izoenzym.
Glykolýza je energeticky méně efektivní způsob využití glukózy ve srovnání s OXPHOS, a nádorové buňky proto musí přijímat glukózu v mnohem větším množství. Na tuto situaci se adaptují zvýšenou expresí glukózových transportérů (GLUT, alt. SLC2A) na buněčné membráně [13]. Této vlastnosti se úspěšně využívá v diagnostice nádorů (pozitronová emisní tomografie) a objevily se pokusy o její využití ve vývoji terapie. V lidské buňce bylo popsáno čtrnáct různých glukózových transportérů, přičemž přesná úloha a výskyt v organizmu jsou známé jen u některých z nich [14]. V nádorových buňkách typicky dochází k navýšení transportéru GLUT1, který je přirozeně rozšířený napříč buněčnými typy, a méně také GLUT3, který je specifický pro neurony [15]. Pro využití v terapii byl testován glukózový analog 2-deoxyglukóza (2-DG). Tato látka je v buňce fosforylovaná HK za vzniku 2-deoxyglukóza-6-fosfátu, který je kompetitivním inhibitorem dalších enzymů glykolytické kaskády. Množství 2-DG přijaté buňkou je přitom přímo úměrné množství glukózových transportérů na membráně. Zajímavé výsledky z laboratoře se však nepotvrdily v klinických testech. Jedním z problémů 2-DG je nutný příjem velkého množství látky pro kompetitivní inhibici enzymů, jejichž přirozený substrát (glukóza) je v krvi přítomný v milimolárním množství [16]. Látka se ale jeví jako potenciálně zajímavá pro použití v kombinaci s dalšími léčivy. Snížené množství glukózy totiž navozuje klidový režim, při kterém buňka šetří zdroje energie. Byly publikovány studie, podle kterých by navození tohoto stavu ve zdravých buňkách mohlo přispět k jejich ochraně před cytotoxickými účinky jiných léčiv. Naopak nádorové buňky, které by nedokázaly v odpovědi na nedostatek glukózy zpomalit metabolizmus a zastavit proliferaci, by mohly být vůči těmto léčivům citlivější [17].
Energetický metabolizmus – oxidativní fosforylace
V kontextu energetického metabolizmu se výzkum protinádorových léčiv neomezuje pouze na glykolýzu, ale objevují se také studie zaměřené na OXPHOS a další fáze buněčného dýchání. Buněčné dýchání zahrnuje procesy glykolýzy, dekarboxylace pyruvátu komplexem enzymu pyruvátdehydrogenázy, CitC a OXPHOS. Souhrnným výtěžkem těchto procesů je až 38 molekul ATP, tedy téměř 20násobek výtěžku z glykolýzy samotné. Za aerobních podmínek zdravá buňka dále využívá pyruvát vzniklý glykolýzou, který je přeměněn na acetylkoenzym A (AcetA) a ten poté vstupuje do CitC. V CitC dochází sérií enzymatických procesů k produkci redukovaných kofaktorů NADH a FADH2, které jsou následně využity v řetězci elektronového transportu (electron transport chain – ETC). ETC je systém proteinových komplexů lokalizovaný na vnitřní mitochondriální membráně, který vytváří protonový gradient mezi vnitřní a vnější membránou této organely. Protonový gradient je následně využíván ATP syntázou ke tvorbě ATP.
Nejzajímavější látkou, která ovlivňuje fungování ETC a která je studována v souvislosti s rakovinou, je lék na diabetes mellitus 2. typu, metformin. Myšlenka na možné uplatnění metforminu v onkologii vzešla z epidemiologických studií na pacientech s diabetem. Tyto studie poukazují na nižší incidenci nádorových onemocnění (snížení o 31 %) u diabetiků léčených metforminem ve srovnání s diabetiky léčenými jiným způsobem [18]. Není dosud jasné, jaký je mechanizmus protektivního účinku této látky. Obecně je metformin považován za inhibitor komplexu I ETC, který narušuje proces OXPHOS. Jeho účinek na organizmus je však komplexní a látka působí na několika úrovních [19]. Působením metforminu dochází v buňce k aktivaci AMP-aktivované kinázy (AMPK). Ta je důležitým regulátorem buněčného metabolizmu a k její aktivaci dochází při snížení hladiny ATP. AMPK navozuje v buňce klidový stav, kdy buňka šetří energetické zdroje, dochází k potlačení růstu a navození autofagie. Jedním z možných vysvětlení protinádorového působení metforminu je proto útlum metabolizmu nádorových buněk. Na úrovni celého organizmu metformin potlačuje glukoneogenezi v játrech, snižuje koncentraci glukózy a hladinu inzulinu v krvi. Tyto účinky mohou vést k energetickému stresu nádorových buněk a také k omezení prorůstové signalizace u nádorů využívajících inzulin a inzulinu podobné růstové faktory (insuline-like growth factor – IGF) [20].
Citrátový cyklus a onkometabolity
Mezi základní vlastnosti nádorových buněk patří intenzivní růst a proliferace. Tyto procesy vyžadují dostatečný přísun živin a také celkové přizpůsobení buněčného metabolizmu. Nádorové buňky jsou metabolicky velmi aktivní a jejich metabolizmus je anabolicky orientovaný. Často vykazují změny v aktivitě metabolických enzymů a hladinách některých metabolitů jakožto produktů těchto enzymů. Relativně nedávno se podařilo popsat nádorově specifické mutované enzymy, které produkují tzv. onkometabolity. Jedná se o látky, které se ve zdravé buňce nevyskytují vůbec nebo jen v minimálním množství, ale díky aktivitě těchto enzymů se mohou hromadit v nádorech. Kvůli své podobnosti s přirozenými metabolity potom ovlivňují aktivitu dalších enzymů. Dlouhou dobu se mělo za to, že změny buněčného metabolizmu jsou adaptací nádorových buněk a vedlejším důsledkem nádorové transformace. Dnes však víme, že produkty metabolických drah mohou významnou měrou přímo přispívat k procesu onkogeneze [21]. Zablokování aktivity příslušných enzymů tedy představuje další strategii pro cílenou terapii nádorových onemocnění.
Nejznámějším onkometabolitem je 2-hydroxyglutarát (2-HG), produkt mutovaného enzymu isocitrátdehydrogenázy (IDH) [24,25]. IDH je jedním z enzymů CitC a existuje ve dvou variantách, rozlišujeme cytoplazmatický izoenzym IDH1 a mitochondriální IDH2. Onkometabolit 2-HG se může v buňce hromadit do vysokých koncentrací a působit jako inhibitor enzymů, které využívají jeho strukturní analog α-ketoglutarát (α-KG) jako substrát nebo kofaktor. Bylo zjištěno, že v důsledku produkce 2-HG dochází v nádorech k hypermetylaci genomu, která je způsobená kompetitivní inhibicí α-ketoglutarát-dependentních demetyláz [23,24]. Nadměrná metylace genomu je obecně jedním ze způsobů, jakým nádorové buňky překonávají aktivitu nádorových supresorů [26]. Mutace v genech IDH1 a IDH2 se objevují u řady nádorových onemocnění vč. gliomů nebo akutní myeloidní leukemie (AML) [27,28]. V souvislosti s leukemií byl prokázán vliv 2-HG na udržování nediferencovaného fenotypu krevních progenitorů [29]. Byly také publikovány studie, které poukazují na mutace IDH1 a IDH2 jako na vhodný prognostický marker [30]. Díky výše zmíněným účinkům 2-HG se IDH stala atraktivním cílem pro vývoj protinádorové terapie a v roce 2017 byl FDA schválen první inhibitor pro klinické použití. Jedná se o látku zvanou enasidenib, která je specifickým inhibitorem mitochondriální varianty enzymu IDH2. V klinických testech prokázal enasidenib pozitivní vliv na přežívání pacientů s AML, kteří byli nositeli mutace v genu IDH2 [31].
Z přirozených metabolitů byl prokázán onkogenní potenciál sukcinátu a fumarátu, pokud se hromadí v nefyziologických koncentracích. Příčinou hromadění jsou mutace v enzymech CitC (sukcinátdehydrogenáza, fumaráthydratáza) využívajících tyto metabolity jako substrát. Podařilo se identifikovat dva mechanizmy, kterými sukcinát a fumarát přispívají k nádorové transformaci. Ve vysokých koncentracích inhibují stejné α-ketoglutarát-dependentní demetylázy jako 2-HG a tím přispívají k hypermetylaci genomu [32]. Současně inhibují další enzymy zvané prolyl-hydroxylázy, které kontrolují aktivitu proonkogenu HIF [33]. Tento transkripční faktor zprostředkovává reakci buňky na hypoxické podmínky a jeho zvýšená aktivita může pomoci nádorové buňce přežít a dále prosperovat v organizmu [34]. Snížení hladiny sukcinátu a fumarátu v nádorové buňce by mohlo přinést podobný efekt jako v případě 2-HG a je proto zajímavé z terapeutického hlediska.
Zmíněné onkometabolity mají kromě nádorových onemocnění klinický význam i pro řadu metabolických onemocnění. Heterozygotní mutace v IDH2 vedoucí k hromadění 2-HG byly popsány u závažného vrozeného onemocnění D-2-hydroxyglutarové acidurie [35]. Inaktivující mutace v genech SDHA, SDHB, SDHC a SDHD kódujících sukcinátdehydrogenázu byly identifikovány v genomu pacientů trpících dědičným nádorovým syndromem zvaným Carney-Stratakis syndrom [36]. Je zajímavým zjištěním, že geny pro metabolické enzymy se mohou projevovat jako nádorové supresory.
Glutaminolýza
Díky intenzivnímu růstu odčerpávají nádorové buňky z CitC značné množství metabolitů, které slouží jako anabolické prekurzory pro syntézu biomakromolekul. Aby nedošlo k jejich úplnému vyčerpání a zablokování cyklu, dochází v některých nádorech k tzv. anapleróze, tedy kompenzaci chybějících metabolitů z náhradního zdroje. Tímto zdrojem je obvykle glutamin. Proces využívání glutaminu pro anaplerotickou kompenzaci CitC se nazývá glutaminolýza a je jedním z dlouho studovaných cílů pro vývoj protinádorové terapie [37,38]. Glutamin je vhodným zdrojem, jelikož je nejvíce zastoupenou volnou aminokyselinou v krevním oběhu a je také významným zdrojem dusíku pro syntézu nukleotidů. Pro některé buněčné typy je využívání glutaminolýzy do jisté míry fyziologické [39]. Nádorové buňky však mohou být na glutaminu zcela závislé a některé nádorové buněčné linie, jako např. HeLa, nepřežívají bez přísunu glutaminu v jinak nutričně bohatém médiu a glutamin je proto důležitou složkou kultivačních médií.
V procesu glutaminolýzy je glutamin sérií enzymatických reakcí zbaven obou dusíkatých skupin a je přeměněn na α-KG, který vstupuje do CitC. Výkon této enzymatické kaskády je podobně jako u glykolýzy závislý na aktivitě příslušných enzymů. Využívání glutaminolýzy a navýšení kapacity těchto enzymů může být vyvoláno přímo potřebou kompenzovat CitC, ale může být také důsledkem nadměrné exprese proonkogenu Myc. Transkripční faktor Myc zvyšuje expresi enzymu glutaminázy (glutaminase – GLS) a glutaminového transportéru ASCT2 (alanine, serine, cysteine-preferring transporter 2) [40]. Jako vhodné cíle pro terapii se nabízí právě GLS, dále enzym glutamát dehydrogenáza (GLDH) a také glutaminové transportéry. Léčba by byla vhodná pro nádory s vysokou spotřebou glutaminu a vhodným markerem by mohla být míra exprese proteinu Myc [41]. Zejména u Myc pozitivních nádorů by zablokování produkce α-KG z glutaminu mohlo vést k efektivní terapeutické odpovědi.
Pokusy o vývoj terapie zacílené na glutaminolýzu se objevily na začátku druhé poloviny minulého století, přesto bohužel dodnes nevedly k vývoji použitelného léčiva. Výzkum se ubírá obdobným směrem jako v případě inhibice glykolýzy a testují se jak nemetabolizovatelné analogy glutaminu, tak inhibitory katabolických enzymů GLS a GLDH [42]. Mezi nejzajímavější látky patří tzv. BPTES (Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl) ethyl sulfide) a od něj odvozené analogy, které působí jako inhibitory GLS. Látka působí dobře na nádorové buněčné linie in vitro, pro použití v praxi však není dostatečně účinná a rozpustná ve vodném prostředí [43]. Další látka zvaná DON (6-diazo-5-oxo - l-norleucin) patřila k prvním testovaným inhibitorům glutaminolýzy [44]. Tento glutaminový analog ale nebylo možné využít kvůli jeho vedlejším účinkům. V současné době se DON opět testuje a to v upravené formě, která se stává účinnou až po metabolizaci v některých tkáních [45]. Ve studiích se také objevují inhibitory aminokyselinových transportérů, jako je výše zmíněný ASCT2, který bývá ve zvýšené míře přítomen na membráně nádorových buněk [46].
Reaktivní kyslíkové radikály a oxidačně redukční rovnováha
Je dobře známo, že nádorové buňky produkují ve zvýšené míře reaktivní kyslíkové radikály (reactive oxygen species – ROS). Tímto souhrnným názvem označujeme skupinu vysoce reaktivních molekul zahrnující superoxid, singletový kyslík, hydroxylový radikál, peroxid vodíku a další. Nejvýznamnějším producentem ROS v buňce jsou mitochondrie a konkrétně ETC. Ke vzniku ROS dochází zejména tehdy, pokud přenos elektronů řetězcem neprobíhá optimálně a dochází k jejich úniku. ROS poškozují buněčné struktury vč. DNA a jsou známými mutageny. Kromě toho může vést větší množství ROS k aktivaci proonkogenních signálních drah. Tento vztah platí i naopak a onkoproteiny jako KRAS nebo Myc mohou stimulovat další produkci ROS [47]. Příliš vysoká hladina ROS je však pro buňku smrtící, a proto dochází v nádorech k přizpůsobení oxidačně redukční rovnováhy. Nádorová buňka produkuje větší množství ROS a současně je schopna kompenzovat jejich negativní dopady. Častým mechanizmem je zvýšená aktivace transkripčního faktoru Nrf2 (nuclear factor-erythroid 2-related factor-2), který je primárním zprostředkovatelem buněčné odpovědi na oxidativní stres [48].
Zatímco velmi vysoká hladina ROS vede k nekrotické smrti buňky, o něco nižší koncentrace jsou signálem pro spuštění apoptózy. V tomto kontextu je zajímavé, že klíčový antiapoptotický protein BCL-2 dokáže nejen potlačovat apoptózu, ale také regulovat hladinu ROS v buňkách. Tato regulační aktivita BCL-2 je nezávislá na antiapoptotické aktivitě proteinu (interakce s proteiny BAX a BAK) [49]. Z řady studií vyplývá, že protein BCL-2 snižuje hladinu ROS, pokud je příliš vysoká, ale za jiných okolností ji dokáže mírně navyšovat a tím přispívat k onkogenní signalizaci. Zatímco mírné prooxidační působení BCL-2 souvisí se stimulací OXPHOS, antioxidační působení je spíše sekundární reakcí buňky na zvýšenou expresi BCL-2. Vysoká exprese BCL-2 v buňkách koreluje se schopností odolávat oxidativnímu stresu. Stimulace exprese proteinu vede k navýšení hladiny některých klíčových antioxidačních molekul a svou roli hraje také klasická úloha proteinu, přímé potlačení apoptózy. Protein BCL-2 ale není přirozenou obranou proti oxidativnímu stresu a jeho antioxidační působení se proto uplatňuje zejména v nádorových buňkách s nefyziologicky zvýšenou expresí tohoto proteinu [50,51]. Inhibitory BCL-2, které by dokázaly potlačit jeho antioxidační účinek, by proto byly vhodným doplňkem léčby cytostatiky stimulujícími produkci ROS.
Cílení na antioxidační mechanizmy nádorové buňky představuje další strategii pro vývoj protinádorové terapie. Uplatňují se při ní dva odlišné přístupy, přičemž tím více využívaným je snaha o poškození nádorových buněk navýšením hladiny ROS. Předpokladem úspěchu tohoto přístupu je schopnost zdravých buněk lépe se vyrovnat s přechodně zvýšenou hladinou ROS. Méně studovanou možností je naopak inhibice produkce ROS, která by bránila nádorovým buňkám využívat jejich stabilně zvýšenou hladinu ve svůj prospěch. Některé zavedené metody léčby také uplatňují produkci ROS jako prostředek (nebo jeden z prostředků) k poškození nádorové buňky. Jedná se např. o radioterapii, která generuje ROS v ozářených buňkách nebo oxid arsenitý (ATO) jako jeden z příkladů zavedených cytostatik [52,53]. Mezi potenciální cíle terapie patří buněčné systémy, jejichž funkcí je obrana proti oxidativnímu stresu. Exprese řady proteinů zapojených do těchto systémů bývá v nádorech výrazně posílená, patří mezi ně např. superoxiddismutáza (SOD) a kataláza nebo thioredoxinový a glutathionový antioxidační systém. Další možností jsou enzymy metabolizmu jednouhlíkatých zbytků SHMT2 (serine hydroxymethyltransferase 2) a MTHFD2 (methylenetetrahydrofolate dehydrogenase (NADP+ dependent) 2), které napomáhají zásobování nádorových buněk redukčním kofaktorem NADPH nezbytným pro regeneraci glutathionu [47,52,53].
Množství inhibitorů těchto systémů se dostalo do fáze klinických testů, avšak testování zatím ani v jednom případě nebylo úspěšné a nevedlo k vývoji léčiva. Mezi látky, které se dostaly nejdál, patří např. inhibitor thioredoxin reduktáz motexafin gadolinium [54]. Další zajímavou látkou je b-lapachone, který v buňce produkuje superoxid po aktivaci oxidoreduktázou NQO1 (NAD (P) H quinone dehydrogenase 1) [55]. Inhibitor syntézy glutathionu L-buthionin-S-sulfoximin byl testován v kombinaci s cytostatikem melfalanem, jelikož zvýšená produkce glutathionu pravděpodobně přispívá k rezistenci buněk mnohočetného myelomu vůči tomuto léčivu [56]. Objevují se také pokusy o využití železa a tzv. Fentonovy reakce. Podstatou této reakce je katalytická přeměna peroxidu vodíku na hydroxylový radikál zprostředkovaná ionty železa. Díky produkci nejreaktivnější formy ROS je Fentonova reakce významným procesem, který hraje roli v některých patologických stavech, vč. kancerogeneze. Využití Fentonovy reakce by mohlo najít uplatnění v terapii nádorů, které mají nízkou úroveň exprese katalázy, která rozkládá molekuly peroxidu vodíku na vodu a kyslík. V buňkách těchto nádorů by mohlo vznikat významně větší množství hydroxylových radikálů než v buňkách zdravých [57].
Závěr
Snaha o cílení terapie nádorových onemocnění na mitochondriální procesy není novým fenoménem. Pokusy o potlačení metabolických procesů typicky spojených s nádory jsou starší než znalosti jejich významu pro nádorovou buňku. Jedná se zejména o glykolýzu a glutaminolýzu, což jsou dobře pozorovatelné procesy, jejichž souvislost s nádorovou fyziologií je známá již dlouho dobu. Naopak jiné přístupy, jako cílení na apoptotickou kaskádu a hromadění onkogenních metabolitů, jsou záležitostí poslední dekády nebo jen o málo starší. Přesto se právě tyto nové přístupy ukázaly jako perspektivní, když daly v posledních letech vzniknout dvěma úspěšně schváleným léčivům. Venetoklax, který patří mezi BH3 mimetika a blokuje antiapoptotickou aktivitu proteinu BCL-2 v nádorových buňkách je produktem cíleného výzkumu zaměřeného na konkrétní proces a molekulu v buňce. Stejným způsobem byl vyvinut i enasidenib, který blokuje enzym CitC isocitrátdehydrogenázu a brání tak hromadění onkometabolitu 2-HG v nádorových buňkách. V případě strategie zaměřené na narušení oxidačně-redukční rovnováhy nádorových buněk sice existují léčiva, která se uplatňují tímto způsobem, avšak nejsou produktem výzkumu cíleného na tento konkrétní mechanizmus. Výzkum se dále rozvíjí ve všech zmíněných oblastech, vč. těch, které doposud nebyly úspěšné. Můžeme doufat, že s rozvojem molekulární biologie se to brzy změní a dočkáme se dalších protinádorových léčiv cílených na mitochondriální procesy.
Práce byla podpořena projektem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Radovan Krejčíř
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: radovan.krejcir@mou.cz
Přijato: 3. 8. 2018
Zdroje
1. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell 2011; 144 (5): 646–674. doi: 10.1016/j.cell.2011.02.013.
2. Tait SW, Green DR. Mitochondria and cell death: outer membrane permeabilization and beyond. Nat Rev Mol Cell Biol 2010; 11 (9): 621–632. doi: 10.1038/nrm2 952.
3. Czabotar PE, Lessene G, Strasser A et al. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy. Nat Rev Mol Cell Biol 2014; 15 (1): 49–63. doi: 10.1038/nrm3722.
4. Ashkenazi A, Fairbrother WJ, Leverson JD et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors. Nat Rev Drug Discov 2017; 16 (4): 273–284. doi: 10.1038/nrd.2016.253.
5. Deeks ED. Venetoclax: first global approval. Drugs 2016; 76 (9): 979–987.
6. Warburg O, Wind F, Negelein E. The metabolism of tumors in the body. J Gen Physiol 1927; 8 (6): 519–530.
7. Hirschey MD, DeBerardinis RJ, Diehl AM et al. Dysregulated metabolism contributes to oncogenesis. Semin Cancer Biol 2015; 35 (Suppl): S129–S150. doi: 10.1016/j.semcancer.2015.10.002.
8. Kaňková K, Hrstka R. Nádory jako metabolická onemocnění a diabetes jako riziko nádorů? Klin Onkol 2012; 25 (Suppl 2): 26–31. doi: 10.14735/amko20122 S26.
9. Pedersen PL, Mathupala S, Rempel A et al. Mitochondrial bound type II hexokinase: a key player in the growth and survival of many cancers and an ideal prospect for therapeutic intervention. Biochim Biophys Acta 2002; 1555 (1–3): 14–20.
10. Patra KC, Wang Q, Bhaskar PT et al. Hexokinase 2 is required for tumor initiation and maintenance and its systemic deletion is therapeutic in mouse models of cancer. Cancer Cell 2013; 24 (2): 213–228. doi: 10.1016/j.ccr.2013.06.014.
11. Pelicano H, Martin DS, Xu RH et al. Glycolysis inhibition for anticancer treatment. Oncogene 2006; 25 (34): 4633–4646. doi: 10.1038/sj.onc.1209597.
12. Chen Z, Zhang H, Lu W et al. Role of mitochondria-associated hexokinase II in cancer cell death induced by 3-bromopyruvate. Biochim Biophys Acta 2009; 1787 (5): 553–560. doi: 10.1016/j.bbabio.2009.03.003.
13. Yamamoto T, Seino Y, Fukumoto H et al. Over-expression of facilitative glucose transporter genes in human cancer. Biochem Biophys Res Commun 1990; 170 (1): 223–230.
14. Thorens B, Mueckler M. Glucose transporters in the 21st century. Am J Physiol Endocrinol Metab 2010; 298 (2): E141–E145. doi: 10.1152/ajpendo.00712.2009.
15. Szablewski L. Expression of glucose transporters in cancers. Biochim Biophys Acta 2013; 1835 (2): 164–169. doi: 10.1016/j.bbcan.2012.12.004.
16. Zhang D, Li J, Wang F et al. 2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett 2014; 355 (2): 176–183. doi: 10.1016/j.canlet.2014.09.003.
17. El Mjiyad N, Caro-Maldonado A, Ramírez-Peinado S et al. Sugar-free approaches to cancer cell killing. Oncogene 2011; 30 (3): 253 Oncogene 2011; 30 (3): 253-264. doi: 10.1038/onc.2010.466.
18. Gandini S, Puntoni M, Heckman-Stoddard BM et al. Metformin and cancer risk and mortality: a systematic review and meta-analysis taking into account biases and confounders. Cancer Prev Res (Phila) 2014; 7 (9): 867–885. doi: 10.1158/1940-6207.CAPR-13-0424.
19. Luengo A, Sullivan LB, Heiden MG. Understanding the complex-I-ty of metformin action: limiting mitochondrial respiration to improve cancer therapy. BMC Biol 2014; 12 : 82. doi: 10.1186/s12915-014-0082-4.
20. Vander Heiden MG. Targeting cancer metabolism: a therapeutic window opens. Nat Rev Drug Discov 2011; 10 (9): 671–684. doi: 10.1038/nrd3504.
21. Sciacovelli M, Frezza C. Oncometabolites: Unconventional triggers of oncogenic signalling cascades. Free Radic Biol Med 2016; 100 : 175–181. doi: 10.1016/j.freeradbiomed.2016.04.025.
22. Ward PS, Patel J, Wise DR et al. The common feature of leukemia-associated IDH1 and IDH2 mutations is a neomorphic enzyme activity converting a-ketoglutarate to 2-hydroxyglutarate. Cancer Cell 2010; 17 (3): 225–234. doi: 10.1016/j.ccr.2010.01.020.
23. Dang L, White DW, Gross S et al. Cancer-associated IDH1 mutations produce 2-hydroxyglutarate. Nature 2009; 462 (7274): 739–744. doi: 10.1038/nature08617.
24. Chowdhury R, Yeoh KK, Tian Y-M et al. The oncometabolite 2-hydroxyglutarate inhibits histone lysine demethylases. EMBO Rep 2011; 12 (5): 463–469. doi: 10.1038/embor.2011.43.
25. Xu W, Yang H, Liu Y et al. Oncometabolite 2-hydroxyglutarate is a competitive inhibitor of a-ketoglutarate-dependent dioxygenases. Cancer Cell 2011; 19 (1): 17–30. doi: 10.1016/j.ccr.2010.12.014.
26. Figueroa ME, Abdel-Wahab O, Lu C et al. Leukemic IDH1 and IDH2 mutations result in a hypermethylation phenotype, disrupt TET2 function, and impair hematopoietic differentiation. Cancer Cell 2010; 18 (6): 553–567. doi: 10.1016/j.ccr.2010.11.015.
27. Choi C, Ganji SK, DeBerardinis RJ et al. 2-hydroxyglutarate detection by magnetic resonance spectroscopy in IDH-mutated patients with gliomas. Nat Med 2012; 18 (4): 624–629. doi: 10.1038/nm.2682.
28. Medeiros BC, Fathi AT, DiNardo CD et al. Isocitrate dehydrogenase mutations in myeloid malignancies. Leukemia 2017; 31 (2): 272–281. doi: 10.1038/leu.2016.275.
29. Wang F, Travins J, DeLaBarre B et al. Targeted inhibition of mutant IDH2 in leukemia cells induces cellular differentiation. Science 2013; 340 (6132): 622–626. doi: 10.1126/science.1234769.
30. Houdová Megová M, Drábek J, Dwight Z et al. Mutace isocitrátdehydrogenázy jsou lepší prognostický marker než metylace promotoru O6-metylguanin-DNA-metyltransferázy u glioblastomů – retrospektivní molekulárně genetická studie gliomů z jednoho centra. Klin Onkol 2017; 30 (5): 361–371. doi: 10.14735/amko2017361.
31. Nassereddine S, Lap CJ, Haroun F et al. The role of mutant IDH1 and IDH2 inhibitors in the treatment of acute myeloid leukemia. Ann Hematol 2017; 96 (12): 1983–1991. doi: 10.1007/s00277-017-3161-0.
32. Xiao M, Yang H, Xu W et al. Inhibition of a-KG-dependent histone and DNA demethylases by fumarate and succinate that are accumulated in mutations of FH and SDH tumor suppressors. Genes Dev 2012; 26 (12): 1326–1338. doi: 10.1101/gad.191056.112.
33. Sullivan LB, Gui DY, Heiden MGV. Altered metabolite levels in cancer: implications for tumour biology and cancer therapy. Nat Rev Cancer 2016; 16 (11): 680–693. doi: 10.1038/nrc.2016.85.
34. Schito L, Semenza GL. Hypoxia-inducible factors: master regulators of cancer progression. Trends Cancer 2016; 2 (12): 758–770. doi: 10.1016/j.trecan.2016.10.016.
35. Kranendijk M, Struys EA, Schaftingen E et al. IDH2 mutations in patients with d-2-hydroxyglutaric aciduria. Science 2010; 330 (6002): 336–336. doi: 10.1126/science.1192632.
36. Schaefer I-M, Hornick JL, Bovée JV. The role of metabolic enzymes in mesenchymal tumors and tumor syndromes: genetics, pathology, and molecular mechanisms. Lab Invest 2018; 98 (4): 414–426. doi: 10.1038/s41374-017-0003-6.
37. Fendt SM, Bell EL, Keibler MA et al. Reductive glutamine metabolism is a function of the a-ketoglutarate to citrate ratio in cells. Nat Commun 2013; 4 : 2236. doi: 10.1038/ncomms3236.
38. DeBerardinis RJ, Mancuso A, Daikhin E et al. Beyond aerobic glycolysis: transformed cells can engage in glutamine metabolism that exceeds the requirement for protein and nucleotide synthesis. Proc Natl Acad Sci 2007; 104 (49): 19345–19350. doi: 10.1073/pnas.0709747104.
39. DeBerardinis RJ, Cheng T. Q’s next: the diverse functions of glutamine in metabolism, cell biology and cancer. Oncogene 2010; 29 (3): 313–324. doi: 10.1038/onc.2009.358.
40. Wise DR, DeBerardinis RJ, Mancuso A et al. Myc regulates a transcriptional program that stimulates mitochondrial glutaminolysis and leads to glutamine addiction. Proc Natl Acad Sci 2008; 105 (48): 18782–18787. doi: 10.1073/pnas.0810199105.
41. Yuneva M, Zamboni N, Oefner P et al. Deficiency in glutamine but not glucose induces MYC-dependent apoptosis in human cells. J Cell Biol 2007; 178 (1): 93–105. doi: 10.1083/jcb.200703099.
42. Jin L, Alesi GN, Kang S. Glutaminolysis as a target for cancer therapy. Oncogene 2016; 35 (28): 3619–3625. doi: 10.1038/onc.2015.447.
43. Gross MI, Demo SD, Dennison JB et al. Antitumor activity of the glutaminase inhibitor CB-839 in triple-negative breast cancer. Mol Cancer Ther 2014; 13 (4): 890–901. doi: 10.1158/1535-7163.MCT-13-0870.
44. Ahluwalia GS, Grem JL, Hao Z et al. Metabolism and action of amino acid analog anti-cancer agents. Pharmacol Ther 1990; 46 (2): 243–271.
45. Rais R, Jančařík A, Tenora L et al. Discovery of 6-Diazo-5-oxo - l-norleucine (DON) prodrugs with enhanced CSF delivery in monkeys: a potential treatment for glioblastoma. J Med Chem 2016; 59 (18): 8621–8633. doi: 10.1021/acs.jmedchem.6b01069.
46. Schulte ML, Fu A, Zhao P et al. Pharmacological blockade of ASCT2-dependent glutamine transport leads to antitumor efficacy in preclinical models. Nat Med 2018; 24 (2): 194–202. doi: 10.1038/nm.4464.
47. Sabharwal SS, Schumacker PT. Mitochondrial ROS in cancer: initiators, amplifiers or an Achilles’ heel? Nat Rev Cancer 2014; 14 (11): 709–721. doi: 10.1038/nrc3 803.
48. DeNicola GM, Karreth FA, Humpton TJ et al. Oncogene-induced Nrf2 transcription promotes ROS detoxification and tumorigenesis. Nature 2011; 475 (7354): 106–109. doi: 10.1038/nature10189.
49. Low IC, Chen ZX, Pervaiz S. Bcl-2 modulates resveratrol-induced ROS production by regulating mitochondrial respiration in tumor cells. Antioxid Redox Signaling 2010; 13 (6): 807–819. doi: 10.1089/ars.2009.3050.
50. Krishna S, Low IC, and Pervaiz S. Regulation of mitochondrial metabolism: yet another facet in the biology of the oncoprotein Bcl-2. Biochem J 2011; 435 : 545–551. doi: 10.1042/BJ20101996.
51. Chong SJ, Low IC, Pervaiz S. Mitochondrial ROS and involvement of Bcl-2 as a mitochondrial ROS regulator. Mitochondrion 2014; 19 : 39–48. doi: 10.1016/j.mito.2014.06.002.
52. Weinberg SE, Chandel NS. Targeting mitochondria metabolism for cancer therapy. Nat Chem Biol 2015; 11 (1): 9–15. doi: 10.1038/nchembio.1712.
53. Glorieux C, Calderon PB. Catalase, a remarkable enzyme: targeting the oldest antioxidant enzyme to find a new cancer treatment approach. Biol Chem 2017; 398 (10): 1095–1108. doi: 10.1515/hsz-2017-0131.
54. Magda D, Miller RA. Motexafin gadolinium: A novel redox active drug for cancer therapy. Semin Cancer Biol 2006; 16 (6): 466–476. doi: 10.1016/j.semcancer.2006.09.002.
55. Bey EA, Bentle MS, Reinicke KE et al. An NQO1-and PARP-1-mediated cell death pathway induced in non-small-cell lung cancer cells by beta-lapachone. Proc Natl Acad Sci U S A 2007; 104 (28): 11832–11837. doi: 10.1073/pnas.0702176104.
56. Tagde A, Singh H, Kang MH et al. The glutathione synthesis inhibitor buthionine sulfoximine synergistically enhanced melphalan activity against preclinical models of multiple myeloma. Blood Cancer J 2014; 4: e229. doi: 10.1038/bcj.2014.45.
57. Toyokuni S. Role of iron in carcinogenesis: cancer as a ferrotoxic disease. Cancer Sci 2009; 100 (1): 9–16. doi: 10.1111/j.1349-7006.2008.01001.x.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Současné metody analýzy mikroRNA
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



