-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úloha proteínu HSF1 v nádorovej transformácii
The Role of HSF1 Protein in Malignant Transformation
Background:
The heat shock transcription factor, HSF1, is the main regulator of the proteotoxic stress response that orchestrates the adaptation of cells to stress conditions such as elevated temperature, oxidative stress, and proteotoxic stress. As such, HSF1 regulates a large number of stress response-related genes, primarily those encoding heat shock proteins (HSPs). HSPs are molecular chaperones involved in the acquisition of native protein conformations and the prevention of protein degradation, and they also contribute to the removal of denatured proteins via the proteasome. Representative members of the HSP family are HSP70 and HSP90. The stress response is a highly conserved mechanism across all eukaryotes, and HSF1 has been linked to a number of physiological processes (ribosomal biogenesis, translation, transcription, cell cycle, and metabolism) and pathological disorders (neurodegenerative disorders such as Parkinson´s and Alzheimer´s diseases). HSF1 activation is also prominent in different types of cancer (prostate, breast, colorectal carcinoma etc.) where it correlates with tumor aggressiveness and poor prognosis. HSF1 is therefore considered a diagnostic and prognostic marker and is currently being targeted to develop new cancer therapies. Several inhibitors of HSF1 have already been synthesized, but their molecular mechanism (s) of action, specificity those of HSF1, nontoxicity in healthy tissues, and their efficacy in targeting tumor cells remain to be elucidated.
Purpose:
This review summarizes known mechanisms of HSF1 regulation and activation, the role of HSF1 during malignant transformation, and the potential of designing small molecule HSF1 inhibitors for cancer therapy.
Key words:
HSF1 transcription factor – molecular chaperones – cellular stress – tumor transformation – cancer
This work was supported by the project MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Accepted: 10. 8. 2018
Autoři: Šimončík Oliver; Pastorek Michal; Vojtěšek Bořivoj; Müller Petr
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2018; 31(Supplementum 2): 55-62
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20182S55Souhrn
Východiská:
Transkripčný faktor HSF1 je esenciálny regulátor stresovej odpovede, ktorá slúži k rýchlej adaptácii organizmov na nepriaznivé podmienky, akými sú napr. zvýšená teplota alebo oxidatívny stres. HSF1 reguluje expresiu veľkého množstva génov primárne kódujúcich proteíny tepelného šoku (heat shock proteins – HSPs). Ide prevažne o molekulárne chaperóny, ktoré umožňujú udržiavať natívnu konformáciu proteínov, zabraňujú ich degradácii a podieľajú sa na odstraňovaní denaturovaných proteínov. K základným predstaviteľom molekulárnych chaperónov patria proteíny HSP70 a HSP90. Stresová odpoveď je vysoko konzervovaná u všetkých eukaryotických organizmov. HSF1 je ako hlavný regulátor tejto odpovede zapojený do množstva fyziologických procesov (ribozómová biogenéza, translácia, transkripcia, bunkový cyklus, metabolizmus) a patologických stavov (neurodegeneratívne poruchy, akými sú napr. Parkinsonova alebo Alzheimerova choroba). Zvýšená expresia HSF1 bola pozorovaná v rozvinutých štádiach ľudských nádorov (karcinóm prostaty, prsníka, kolorektálny karcinóm aj.), v ktorých koreluje s ich agresivitou a zlou prognózou pre pacienta. HSF1 ovplyvňuje množstvo procesov zapojených v karcinogenéze, a preto predstavuje významný diagnostický a prognostický marker. Dnes je predmetom výskumu pre potenciálnu protinádorovú terapiu. V súčasnosti je známych niekoľko inhibítorov HSF1, u ktorých zostáva objasniť molekulárne mechanizmy ich pôsobenia, potvrdiť špecifitu k HSF1, netoxicitu v zdravých tkanivách a ich účinnosť v zabíjaní cieľových nádorových buniek.
Cieľ:
Tento prehľadový článok sa zameriava na transkripčný faktor HSF1, zhrňuje základné mechanizmy jeho regulácie a aktivácie, úlohu HSF1 počas malígnej transformácie a možné protinádorové využitie nízkomolekulárnych inhibítorov HSF1 aktivity.
Kľúčové slová:
HSF1 transkripčný faktor – molekulárne chaperóny – bunkový stres – transformácia nádorov – rakovina
Úvod
Objav transkripčného faktora HSF1 predchádzali pozorovania zmeny štruktúry chromozómov a zvýšená expresia špecifických proteínov po vystavení bunky stresovým podmienkam. Taliansky genetik Feruccio Ritossa v roku 1962 publikoval, že v podmienkach zvýšenej teploty alebo vplyvom Dinitrofenolu (Dinitrophenol – DNP) dochádza u Drosophily k rozvoľneniu niektorých špecifických oblastí chomozómov [1]. Pozorovanie rozvoľnenia štruktúry, pripisované transkripčne aktívnym miestam, viedlo k identifikácii proteínov tepelného šoku (heat shock proteins – HSPs). Prvá zmienka o zvýšenej syntéze týchto proteínov po vystavení buniek Drosophily stresovým podmienkam vyvolaným tepelným šokom bola publikovaná v roku 1974 [2]. Odvtedy zaznamenal výskum stresovej odpovede významný posun. Bolo odhalené, že mnohé HSPs slúžia ako molekulárne chaperóny, ktoré umožňujú udržiavať natívnu konformáciu proteínov, zabraňujú ich degradácii a podieľajú sa na odstraňovaní denaturovaných proteínov v podmienkach proteotoxického stresu [3]. Všeobecne sa o nich dá povedať, že sa svojou aktivitou podieľajú na udržiavaní proteínovej homeostázy (proteostázy), a sú preto pre život eukaryotických organizmov nevyhnutné.
Expresia génov HSPs je regulovaná vysoko konzervovanou skupinou transkripčných faktorov tepelného šoku (heat shock transcription factors – HSFs). U Saccharomyces cerevisiae a Drosophila melanogaster bol charakterizovaný jediný, esenciálny HSF [4]. U stavovcov bolo popísaných niekoľko HSFs (HSF1-5, HSFY a HSFX) a niekoľko ďalších bolo popísaných u rastlín [5]. U väčšiny organizmov sú HSF gény exprimované konštitutívne, a preto sa vyvinulo množstvo mechanizmov, ktoré regulujú aktivitu HSF na úrovni proteínu [5].
HSF1
HSF1 je hlavný regulátor odpovede tepelného šoku. Úlohu transkripčného regulátora sprostredkováva cez väzbu na tzv. elementy tepelného šoku (heat shock element – HSE) – konzervované úseky promótorov cieľových génov [6]. HSF1 je známy ako transkripčný aktivátor chaperónov a ko-chaperónov, ktorý zohráva dôležitú úlohu v základných fyziologických procesoch, akými sú regulácia energetického metabolizmu, bunkové delenie alebo starnutie [7]. So zníženou expresiou HSF1 sú spojené niektoré patofyziologické deje, medzi ktoré patria neurodegeneratívne poruchy, ako napr. Parkinsonova a Alzheimerova choroba [8]. Na druhej strane, pokročilé štádiá rozličných typov nádorov sú spojené s jeho zvýšenou expresiou [9].
Štruktúra a aktivácia HSF1
K pochopeniu mechanizmov aktivácie HSF1 na molekulárnej úrovni je nevyhnutné detailné poznanie jeho štruktúry. HSF1 sa skladá z niekoľkých funkčných domén, ktoré sú naprieč eukaryotickými druhmi vysoko konzervované. Ľudský proteín HSF1 je usporiadaný do 4 funkčných domén s celkovou dĺžkou 529 aminokyselín (obr. 1). Na N-konci sa nachádza DNA väzbová doména (DNA-binding domain – DBD) [10], ktorá je zodpovedná za stabilizáciu oligomérnej štruktúry HSF1 a za väzbu na promótor cieľových génov. Za DBD sa nachádza trimerizačná doména, ktorá obsahuje krátke hydrofóbne opakovania (hydrophobic repeat – HR-A/B) majúce funkciu tzv. leucinového zipsu. Nasledujúce domény zahŕňajúce regulačnú doménu (RD), krátky hydrofóbny úsek (HR-C) a C-koncovú transaktivačnú doménu (TAD) sú cieľom pre kinázy/fosfatázy, ktoré kontrolujú úroveň aktivácie HSF1 prostredníctvom posttranslačných modifikácií (PTM) [11].
Obr. 1. Štruktúra HSF1. HSF1 je proteín zložený zo 4 funkčných domén – DNA väzbová doména, trimerizačná doména, regulačná doména a transaktivačná doména. Dĺžka ľudského HSF1 je 529 aminokyselín. P (S230, S320, S326) znázorňujú 3 najlepšie popísané fosforylácie, spojené s aktiváciou HSF1. 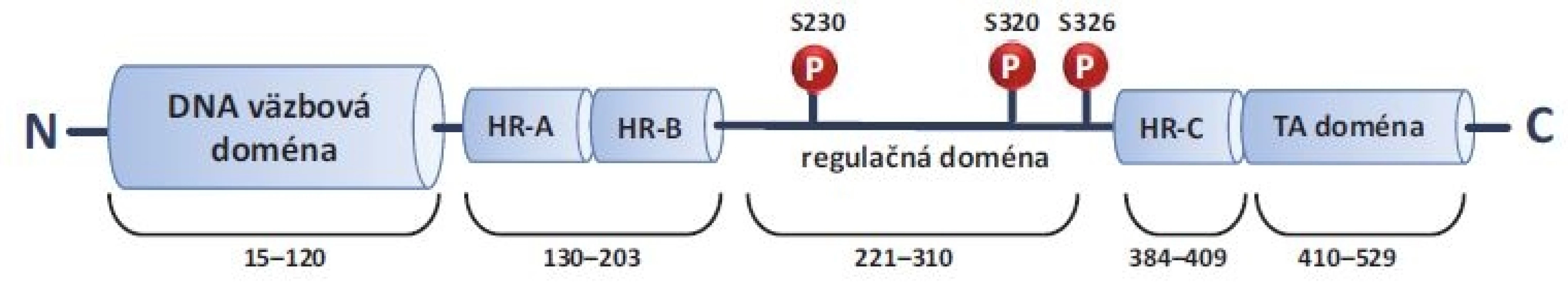
HSF1 – transkripčný faktor tepelného šoku 1, P – fosforylácia, HR – hydrofóbne opakovania , TA doména – transaktivačná doména Komplexnosť stresovej odpovede dotvárajú okrem PTM aj iné regulačné mechanizmy. V bazálnych podmienkach nestresovaných buniek sa HSF1 nachádza v jadre a cytoplazme v neaktívnej monomérnej konformácii v interakcii so chaperónovými komplexmi HSP70 a HSP90. V tomto stave vykazuje HSF1 nízku afinitu k cieľovým úsekom DNA. Po vystavení proteotoxickému stresu HSF1 formuje trimér prostredníctvom HR-A a HR-B domén, ktorý sa akumuluje v jadre, kde sa následne viaže na HSE motívy v promótoroch cieľových génov [11,12] (obr. 2).
Obr. 2. Aktivačno-utlmujúci cyklus HSF1. Pod vplyvom proteotoxického stresu dochádza k nesprávnemu skladaniu proteínov, ktoré súperia s HSF1 o väzbu molekulárnych chaperónov. Po disociácii chaperónových komplexov podlieha HSF1 trimerizácii, ktorá umožňuje DNA väzbovú aktivitu. Prostredníctvom aktivačných fosforylácií (mTORC1, PKA) dochádza k úplnej aktivácii HSF1. Pre iniciáciu transkripcie sú nevyhnutné ďalšie ko-aktivátory, akým je napr. p-TEFb. Po utlmení stresu je HSF1 acetylovaný (p300/CBP), stráca DNA väzbovú aktivitu a plynulo prechádza do monomérnej konformácie, ktorá je stabilizovaná väzbou chaperónových komplexov. 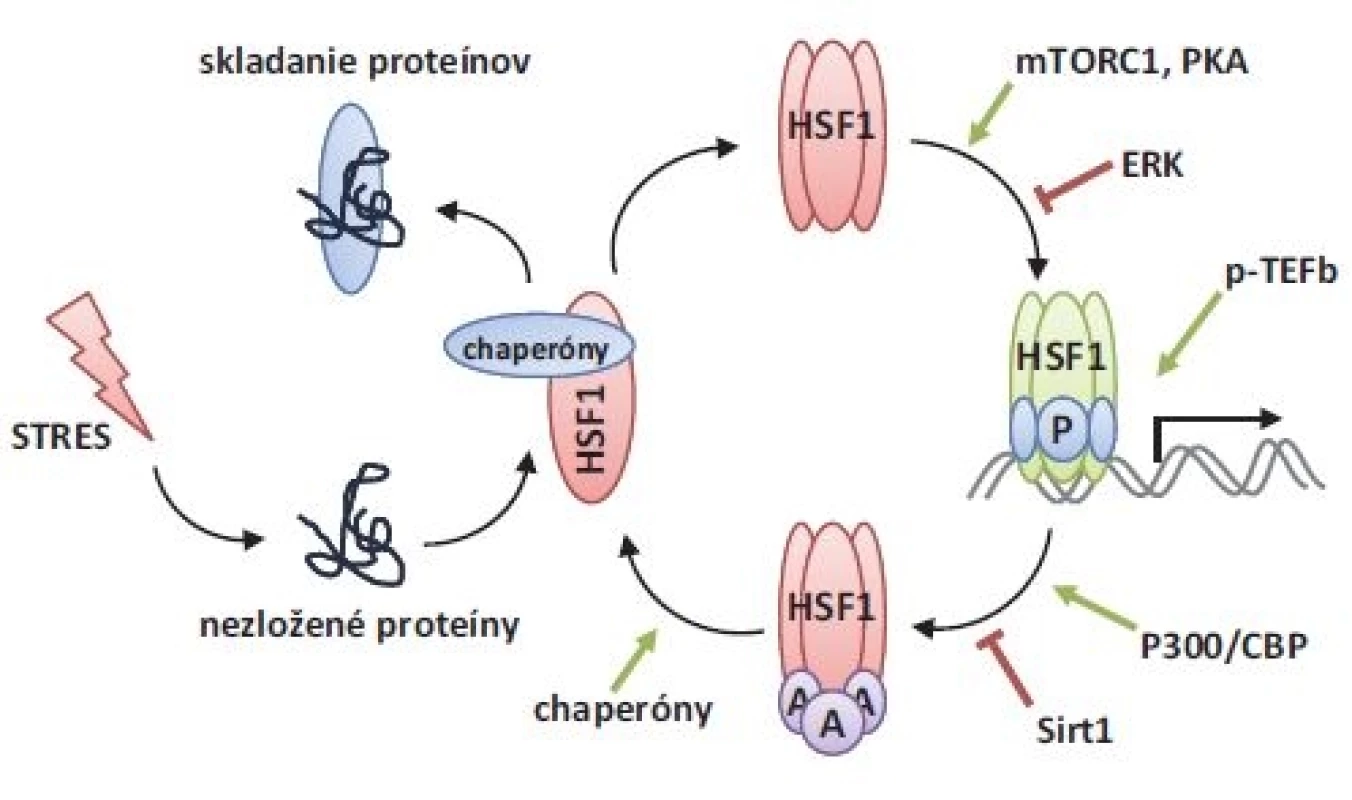
A – acetylácia, P – fosforylácia, HSF1 – transkripčný faktor tepelného šoku 1, mTORC1 – mTOR komplex 1, Sirt1 – Sirtuín 1 HSF1 je priamy senzor stresu, ktorý reaguje na rôzne stresové podmienky rozvoľnením monomérnej konformácie a formovaním stabilnej trimérnej konformácie. Otázkou dodnes zostáva mechanizmus brániaci spontánnej trimerizácii HSF1. Existujú tri modely, ktoré môžu byť za túto represiu zodpovedné.
Prvý model predstavuje intramolekulárna interakcia medzi hydrofóbnymi oblasťami HR-A/B a HR-C. Vystavením buniek zvýšenej teplote dochádza k rozvoľneniu tejto štruktúry, a tým aj k uľahčeniu prechodu HSF1 do energeticky výhodnejšieho stavu (trimérna konformácia). Tento mechanizmus bol podporený prácou popisujúcou purifikovaný rekombinantný proteín HSF1 ako priamy senzor zvýšenej teploty [13]. Práca však nevysvetľuje mechanizmus jeho priamej aktivácie pri odlišných typoch stresu.
Ďalší možný mechanizmus predstavuje väzba HSF1 s molekulárnymi chaperónmi, ktoré stabilizujú monomérnu konformáciu. Vplyvom HSP90 inhibítorov alebo iného proteotoxického stresu dochádza k disociácii HSF1 z komplexu molekulárnych chaperónov, k jeho trimerizácii a následnej aktivácii [14]. Po uplynutí stresu vedie zvýšená hladina voľných chaperónov k spätnoväzbovej inaktivácii HSF1 [15–17].
V bezstresových podmienkach predstavuje HSF1 monomérny fosfoproteín, ktorý je fosforylovaný na niekoľkých serínových zvyškoch [18]. PTM preto môžu prezentovať ďalší mechanizmus schopný ovplyvňovať úroveň aktivácie HSF1 v odlišných stresových podmienkach.
Väzba na DNA
Trimér HSF1 sa viaže na konzervované, kanonické oblasti HSE, ktoré sa nachádzajú v promótoroch veľkého množstva génov asociovaných so stresom. Štruktúra HSE sa môže mierne líšiť medzi jednotlivými génmi. HSE oblasti predstavujú invertované repetície s nGAAn sekvenciou (nTTCn|nGAAn|nTTCn|nGAAn), kde „n“ predstavuje ľubovoľný nukleotid. Každá DNA väzbová doména trimérneho HSF1 rozpoznáva jednu nGAAn sekvenciu, pričom tri striedavo orientované DBD domény sú nevyhnutné pre stabilnú väzbu HSF1 na DNA [7].
Posttranslačné modifikácie
Tvorba trimérnej konformácie, ktorá umožňuje DNA väzbovú aktivitu nezabezpečuje úplnú transkripčnú aktivitu. HSF1 preto podlieha PTM, ktoré zahŕňajú fosforylácie, acetylácie a sumoylácie. Medzi najlepšie preskúmané fosforylácie patria fosforylácie serínových zvyškov S121 (MK2) [19], S303 (GSK3) [20], S307 (ERK) [21] a S363 (PKC) [22], ktoré potláčajú aktivitu HSF1 a fosforylácie S230 (CaMKII) [23], S320 (PKA) [24] a S326 (mTORC1) [25], ktoré naopak podporujú transaktivačnú kapacitu HSF1. Ďalšie PTM, akými sú acetylácia a sumoylácia, sa podieľajú po uplynutí stresu na miere a dĺžke stresovej odpovede [26] (obr. 2).
Génová regulácia
Dôležitou charakteristikou stresovej odpovede je rýchlosť, akou bunka dokáže odpovedať na vzniknuté podnety prostredníctvom zvýšenej expresie adaptačných proteínov. Aktivácia HSF1 musí preto predstavovať veľmi rýchly proces. Aktivovaný HSF1 je lokalizovaný na cieľových promótoroch už niekoľko sekúnd po tepelnom šoku. Promótory génov HSPs sú prispôsobené k rýchlej aktivácii tým, že obsahujú neaktívnu RNA polymerázu II, ktorá sa nachádza približne 20 bp od počiatku transkripcie [27]. Vzájomná interakcia HSF1 s pozitívnym transkripčným elongačným faktorom 1 (p-TEFb) umožňuje naviazanie p-TEFb na cieľové promótory a P-TEFb následne sprostredkováva fosforyláciu C-koncovej domény RNA polymerázy II spojenú s aktiváciou, a tým spoločne s HSF1 zahajuje transkripciu [28].
Úloha HSF1 počas malígnej transformácie
Proteínová homeostáza je v nádorových bunkách často narušená dysregulovanou proteosyntézou, nerovnováhou proteínov spôsobenou aneuploídiou a nadmernou expresiou onkogénov.
To, že malígna transformácia je proces silno asociovaný s proteotoxickým stresom, podporujú pozorovania zvýšenej aktivity HSF1 u rozličných typov ľudských nádorov, akými sú napr. nádory prostaty [29], prsníka (breast cancer – BC) [30], kolorektálny karcinóm (colorectal carcinoma – CRC) [31], orálny skvamózny karcinóm [17] alebo hepatocelulárny karcinóm [32]. Zvýšená hladina HSF1 koreluje s agresivitou onkologického ochorenia, pozitívne ovplyvňuje invazivitu a rozvoj metastáz a je spojená so zlou prognózou pre pacienta [33]. Dôležitosť HSF1 v procese karcinogenézy podporuje znížené riziko tvorby nádorov u HSF1 deficientných myší, ktorých rast bol indukovaný mutáciou p53, onkoproteínom Ras alebo chemickými mutagénmi [33]. V ľudských nádorových líniách vedie utíšenie HSF1 k zníženej proliferácii a k zníženému prežívaniu bunkových kultúr [33]. Prvým vysvetlením tohoto fenoménu bolo, že HSF1 podporuje malignitu prostredníctvom expresie proteínov HSPs. Štúdie zamerané na interakcie HSF1 s chromatínom však ukázali, že HSF1 riadi počas malígnej transformácie odlišnú skupinu génov ako počas stresovej odpovede [9]. Aj napriek výraznej podpore karcinogenézy však HSF1 nepredstavuje klasický onkoproteín, pretože v ľudských nádoroch neboli pozorované žiadne somatické mutácie HSF1 a ani nadmerná expresia HSF1 neviedla k malígnej transformácii, ako je to v prípade iných onkoproteínov, akým je napr. Ras [33]. HSF1 podporuje karcinogenézu tým, že sa zúčastňuje na fyziologických procesoch, na ktorých sa stali nádorové bunky závislé.
HSF1 a HSPs
HSPs predstavujú skupinu molekulárnych chaperónov umožňujúcich udržiavať proteínovú homeostázu počas stresových podmienok [34]. Niektoré podtypy BC, nádorov prostaty či hrubého čreva sú spojené so zvýšenou expresiou týchto chaperónov, predovšetkým však HSP27, HSP70 a HSP90 [31,35]. Hoci za ich expresiu zodpovedá primárne HSF1, nie vždy bola pozorovaná asociácia medzi zvýšenou expresiou HSPs a HSF1. Podporuje to hypotézu, že HSF1 nespúšťa v nádorových bunkách klasickú stresovú odpoveď, ale reguluje expresiu iba niektorých špecifických HSPs a to v závislosti od typu a štádia ochorenia [9]. Napríklad u agresívnych HER2+ nádorov prsníka je knock-out HSF1 spojený so zníženou expresiou HSP27 a HSP70. U HER2+ myší viedol následne knock-out HSF1 k zníženej karcinogenéze prsníka, ako aj k zníženému výskytu pľúcnych metastáz [36,37]. Jednou z možností protinádorového efektu delécie HSF1 je práve znížená expresia týchto chaperónov. Keďže množstvo klientských proteínov HSPs predstavujú silné onkoproteíny, ich stabilizácia pomocou chaperónov je pre nádorové bunky nesmierne dôležitá. Okrem toho zvýšená proliferácia nádorových buniek spojená so zvýšenou produkciou proteínov kladie vysoké nároky na mechanizmy kontrolujúce kvalitu proteínov. HSPs hrajú preto v týchto procesoch nezastupiteľnú úlohu závislú na aktivite HSF1.
Jedným z klientov HSP70 je napr. proapoptický proteín p53. HSP70 interaguje s mutovaným p53 rovnako dobre ako s wild type p53 [38]. V prípade mutácie chaperón HSP70 stabilizuje mutovaný p53 a tým umožňuje propagáciu jeho onkogénnych vlastností.
Ďalším dôležitým chaperónom so zvýšenou expresiou u mnohých typov ľudských nádorov je HSP27. Zvýšená hladina HSP27 často koreluje s rezistenciou k chemoterapeutikám a so zlou prognózou [39]. HSP27 sa podieľa na regulácii prestavby aktínových filamentov počas bunkového pohybu. HSF1 tak môže prostredníctvom indukcie expresie a fosforylácie HSP27 podporovať migráciu a invazivitu nádorových buniek [32].
Tretím dôležitým chaperónom, ktorý sa zúčastňuje nádorovej transformácie, je HSP90. Jeho expresia je rovnako ako u predchádzajúcich chaperónov regulovaná aktivitou HSF1. HSP90 pri procese karcinogenézy stabilizuje viacero onkogénnych klientov, akými sú proteínkináza B (PKB), inhibičný faktor migrácie makrofágov (MIF) alebo samotný HSF1 [35].
V CRC bola hladina mRNA pre HSF1 zvýšená u 86 % pacientov. Zvýšená hladina HSF1 v CRC koreluje so zvýšenou expresiou chaperónov HSP27 a HSP90 a ko-chaperónu BAG-3. BAG-3 stabilizuje hladinu anti-apoptických členov rodiny Bcl-2 a tým umožňuje bunkám CRC prežiť aj v pro-apoptických podmienkach [40].
HSF1 a signálne dráhy
Vznik nádora, epiteliálno-mezenchymálna tranzícia (EMT), zvýšená migrácia a invazivita, výskyt metastáz alebo vznik rezistencie k apoptóze sú následkom mutácií, ktoré vedú k deregulácii signálnych dráh a metabolizmu bunky. HSF1 zohráva centrálnu úlohu v množstve signálnych dráh, ktoré sa zúčastňujú týchto procesov (obr. 3).
Obr. 3. Prehľad významných úloh HSF1 počas karcinogenézy. HSF1 reguluje expresiu HSPs, energetický metabolizmus a množstvo signálnych dráh. Reguláciou procesov, akými sú proliferácia, EMT, nádorová angiogenéza, invazivita, migrácia a tvorba metastáz zohráva dôležitú úlohu počas malígnej transformácie. 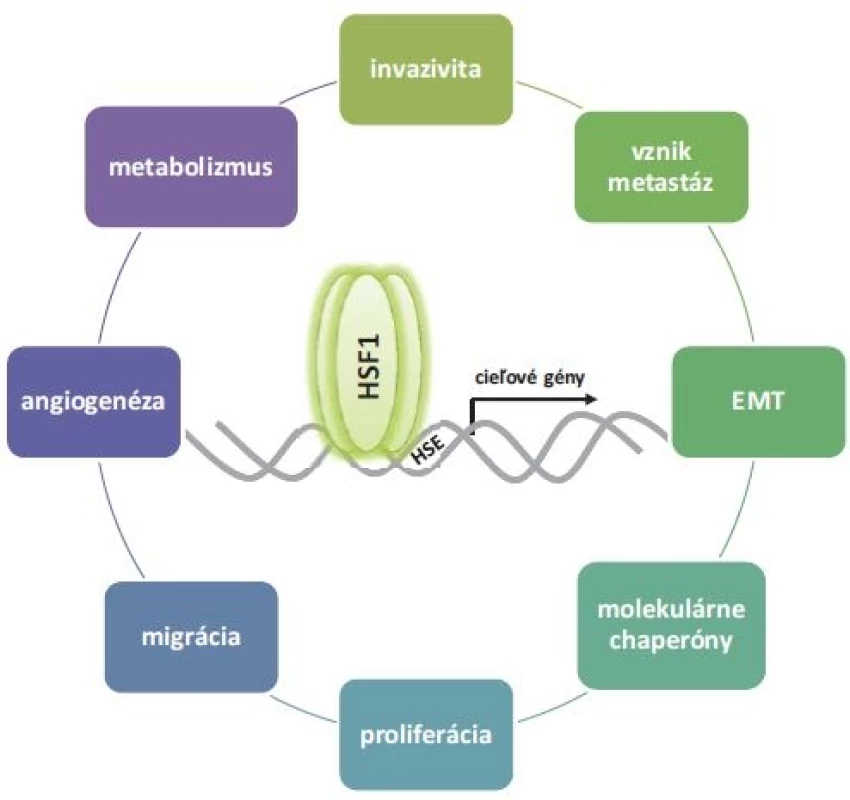
HSF1 – transkripčný faktor tepelného šoku 1, EMT – epiteliálno-mezenchymálna tranzícia, HSE – elementy tepelného šoku p53 a Ras
Tumor supresor TP53 a onkogén Ras sú dva najčastejšie mutované gény v ľudských nádoroch. V modelových myších organizmoch s mutáciou p53 bol pozorovaný zvýšený výskyt lymfómov, pričom simultánna delécia HSF1 a p53 viedla k poklesu tvorby lymfómov [33]. Dai et al ukázali, že delécia HSF1 dramaticky znižuje tvorbu nádorov u myší nesúcich dominantne negatívnu mutáciu génu Tp53. Naproti tomu, HSF1+/+ a HSF1+/ – myši nesúce dominantne negatívnu mutáciu génu Tp53 mali vyvinuté široké spektrum nádorov, zahŕňajúcich lymfómy, sarkómy aj karcinómy. Poukazuje to na významnú úlohu HSF1 pri p53 indukovanej karcinogenéze, ktorá bola potvrdená aj pri ďalších onkogénoch. Proteíny Ras ako aj PDGF-B sú silné mitogénne transduktory, ktorých aktivita vedie k nadmernému deleniu buniek. Myšie embryonálne fibroblasty (MEFs) s deléciou HSF1 však dokážu odolávať Ras-mediovaným mitogénnym signálom [33].
HSF1 a HIF-1
Jedným z možných následkov nadmernej proliferácie neoplázií je vznik nedostatočne vaskularizovaných hypoxických oblastí charakteristických zníženou hladinou kyslíka v nádorovom tkanive. Kľúčovým regulátorom hypoxickej odpovede je transkripčný faktor HIF-1 (hypoxia-inducible factor 1), ktorý po vytvorení heterokomplexu pozostávajúceho z podjednotiek HIF-1α a HIF-1β reguluje expresiu cieľových génov cez väzbu na špecifické responzivné elementy (hypoxia response element – HRE) sekvencie v DNA [41]. Adaptácia na hypoxiu je však okrem aktivácie HIF-1α podmienená viacerými faktormi všeobecne asociovanými so stresovou odpoveďou, akými sú napr. aktivácia dráhy opravujúcej poškodenie DNA, alebo antioxidačnej odpovede [42–44]. U viacerých eukaryotických organizmov bola počas hypoxie pozorovaná aj výrazne zvýšená expresia HSPs, ktorých expresia nebola spájaná s reguláciou HIF-1 [45,46], avšak sa ukázala ako dôležitá pre prežívanie v podmienkach so zníženou hladinou kyslíka. To poukazuje na dôležitosť aktivácie HSF1 signálnej dráhy počas hypoxickej odpovede [47,48]. Naopak Baird et al na modeli Drosophily melanogaster pozorovali po knock-oute HIF-1 výrazne zníženú expresiu HSPs spojenú s nižším prežívaním po vystavení hypoxii a reoxygenácii. Tieto pozorovania naznačujú, že HIF-1 signálna dráha by mohla regulovať aj expresiu HSPs, ktoré sú zapojené do fyziologickej odpovede na stres spôsobený nedostatkom kyslíku [49]. Na druhej strane bolo popísané, že chaperónová aktivita HSP70 a HSP90 je potrebná pre stabilizáciu HIF-1, a je teda kritická pre adaptáciu na hypoxiu a oxidatívny stres [50,51]. Môže teda aktivita HSF1 nepriamo regulovať hypoxickú signálnu dráhu cez expresiu HSPs stabilizujúcich HIF-1? Na myšom modeli progenitorových buniek kostnej drene spôsobil knock-out HSF1 nedostatočnú mieru angiogenézy asociovanej s utlmením HIF-1 signálnej dráhy [52]. Prepojenie medzi signálnymi dráhami regulovanými transkripčnými faktormi HIF-1 a HSF1 je z hľadiska protinádorovej terapie zaujímavým, avšak nie úplne objasneným fenoménom, ktorý si zasluhuje ďalšie skúmanie.
HSF1 a PI3K-AKT-mTOR
Receptor HER2 je okrem nádorov vaječníkov a žalúdka asociovaný hlavne so zvýšenou agresivitou ľudského BC [37,53]. Nadmerná expresia HER2 spôsobuje jeho spontánnu, na ligande nezávislú dimerizáciu, ktorá vedie k aktivácii signálnej dráhy PI3K/AKT [54]. Dráha PI3K-AKT-mTOR (mammalian target of rapamycin) je zapojená do regulácie rastu, prežívania a apoptózy a je často deregulovaná v ľudských nádoroch [55–57]. V HER2+ nádoroch prsníka je mTOR zodpovedný za konštitutívnu fosforyláciu HSF1 na S326, expresiu HSPs a stabilizáciu HSP90 klientov, akými sú napr. MIF, AKT, mutovaný p53 alebo samotný HSF1, ktoré podporujú rast HER2+ nádorových buniek [25,35]. V prítomnosti metabolického stresu AMP-aktivovaná proteínkináza (AMPK) dokáže potláčať aktivitu komplexu mTORC1 [58]. Týmto sa metabolický stres podieľa nepriamo na inaktivácii HSF1. EMT je bunkový proces podporujúci tvorbu metastáz [59]. Jedným z hlavných iniciátorov EMT je regulačný faktor Slug [60]. Prostredníctvom signalizácie HER2-PI3K-AKT-mTOR aktivovaný HSF1 je schopný indukovať expresiu proteínu Slug, podporovať EMT a podieľať sa na zvyšovaní malignity HER2+ nádorov [61].
HSF1 a energetický metabolizmus
Aby nádorové bunky spĺňali zvýšené nároky na rast a proliferáciu, je u nich výrazne zosilnený príjem živín, najmä glukózy [62]. Zdravé bunky sa spoliehajú primárne na mitochondriálnu oxidatívnu fosforyláciu na generovanie energie potrebnej pre bunkové procesy. Naproti tomu nádorové bunky často využívajú aeróbnu glykolýzu. Tento jav sa nazýva „Warburgov efekt“ a je pre nádorové bunky charakteristický [62,63]. Tie metabolizujú glukózu za vzniku pyruvátu, ktorý je však prostredníctvom zvýšenej katalytickej aktivity laktátdehydrogenázy A (LDH-A) redukovaný na laktát, a to aj v prítomnosti kyslíka (obr. 4). V porovnaní s oxidatívnou fosforyláciou ide o energeticky nevýhodný proces, a preto nádorové bunky zvyšujú príjem glukózy a stávajú sa „závislé na cukre“. Nádorové bunky majú tiež zvýšenú aktivitu LDH-A a utíšenie LDH-A u nich vyvoláva oxidatívny stres a inhibuje progresiu nádora [64,65].
Obr. 4. Metabolizmus glukózy v zdravých a nádorových bunkách. Nádorové bunky sú závislé na aeróbnej glykolýze (Warburgov efekt) [64]. Zvýšená hladina HSF1 v nádorových bunkách indukuje syntézu laktát dehydrogenázy, ktorá katalyzuje premenu pyruvátu na laktát [67]. ![Metabolizmus glukózy v zdravých a nádorových bunkách. Nádorové bunky sú závislé na aeróbnej glykolýze (Warburgov
efekt) [64]. Zvýšená hladina HSF1 v nádorových bunkách indukuje syntézu laktát dehydrogenázy, ktorá katalyzuje premenu pyruvátu
na laktát [67].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a501bf54fcbdffce9edc8acd92101a73.jpeg)
HSF1 – transkripčný faktor tepelného šoku 1, LDH – laktátdehydrogenáza, ATP – adenozíntrifosfát Štúdie interakcie HSF1 s chromatínom ukázali, že cicavčí HSF1 sa zúčastňuje na regulácii energetického metabolizmu [33,66]. Napríklad knock-out HSF1 u myších embryonálnych fibroblastov spôsobil, že sa tieto bunky ľahšie adaptovali na podmienky s nízkou glukózou a mali zníženú aktivitu LDH-A [33]. V HER2+ BC závisí aktivita LDH-A od HSF1, ktorý sa viaže na promótor génu LDHA a spúšťa jeho expresiu. Naopak knock-out HSF1 v týchto bunkách spôsobuje inhibíciu expresie génu LDHA, zníženú glykolýzu a chybný rast buniek [67].
HSF1 a AMPK
AMPK je hlavný senzor metabolického stresu, ktorý hrá dôležitú úlohu pri udržiavaní energetickej rovnováhy. Zvýšením pomeru adenozínmonofosfát (adenosine monophosphate – AMP) / adenozíntrifosfát (adenosine triphosphate – ATP) v podmienkach metabolického stresu dochádza prostredníctvom fosforylácie Thr172 k aktivácii AMPK [68]. Phospho-AMPK (P-AMPK) sa následne účastní na potláčaní procesov, ktoré spotrebovávajú ATP, akými sú napr. proteosyntéza alebo produkcia lipidov [68]. V podmienkach nedostatku ATP a zníženej proteosyntézy nie je pre bunku výhodné udržiavať vysokú expresiu chaperónov, ktorá je závislá od ATP [69]. P-AMPK preto v týchto podmienkach fosforyluje HSF1 na S121, inaktivuje ho a tým znižuje expresiu HSPs [70]. Zhou et al pozorovali v nádoroch pankreasu potlačenú aktivitu tumor-supresoru AMPK, ktorá korelovala so zlou prognózou pacientov. Knock-out AMPK v pankreatických nádorových líniách je asociovaný so zvýšenou aktivitou HSF1 a podporuje invazivitu a migráciu týchto buniek v miere závislej na HSF1 [70,71]. Identifikácia HSF1 ako substrátu AMPK poukazuje na vzťah medzi metabolickým a proteotoxickým stresom, čo by mohlo byť zaujímavé z hľadiska protinádorovej terapie. Príkladom možnej terapie zameranej na signalizáciu AMPK-HSF1 je metformín, ktorý je celosvetovo používaný k liečbe diabetes mellitus 2. typu. Metformín účinkuje ako metabolický stresor, ktorý inhibuje mitochondriálny dýchací reťazec, zvyšuje pomer AMP/ATP a tým sa podieľa na AMPK sprostredkovanej inhibícii HSF1 [58,72].
HSF1 ako cieľ protinádorovej terapie
Vďaka zvýšenej aktivite a expresii HSF1 a ním regulovaných chaperónov v nádorových bunkách predstavuje HSF1 potenciálny cieľ protinádorovej terapie. Znížená aktivita HSF1 v nádorových bunkách vedie k poklesu proliferácie a ku zvýšenej miere apoptózy [33]. Nízkomolekulárne inhibítory HSF1 by tak mohli byť potenciálne využívané ako súčasť protinádorovej terapie. Inhibítory HSF1 sa dajú rozdeliť na dve skupiny:
- Tzv. nepriame inhibítory, ktorých aplikácia zamedzí vzniku podmienok aktivujúcich HSF1. Podľa súčasných poznatkov je HSF1 aktivovaný v podmienkach zvýšenej expresie proteínov alebo následkom ich agregácie. Všeobecne teda platí, že podmienky destabilizujúce proteostázu indukujú aktiváciu HSF1 [73]. Naopak podmienky znižujúce produkciu proteínov vyvolané napr. inhibíciou translácie (cykloheximid, rocaglamid), inhibíciou mTOR a aktiváciou AMPK (salycilát) môžu slúžiť k inaktivácii HSF1. Skupinu spomenutých inhibítorov proteosyntézy teda môžeme klasifikovať ako nepriame inhibítory HSF1.
- Druhú skupinu reprezentujú inhibítory, ktoré potláčajú expresiu HSPs priamo cez väzbu na HSF1. Hovoríme teda o priamych inhibítoroch, ktoré zahŕňajú napr. KRIBB11, AptHSF-RA1 alebo IHSF115. Sľubné výsledky prinieslo testovanie inhibítora KRIBB11, ktorý v rôznych nádorových bunkových líniách znižuje proliferáciu a v myších modeloch znižuje rast nádorov, a to bez straty ich telesnej hmotnosti. KRIBB11 pôsobí prostredníctvom reverzibilnej väzby na HSF1, ktorou brání väzbe p-TEFb, nevyhnutného pre aktiváciu RNA polymerázy II, a zahájenie transkripcie [74]. Odlišným mechanizmom pôsobí RNA aptamér AptHSF-RA1, ktorý sa viaže na DNA väzbovú doménu HSF1, čím zamedzuje jeho naviazaniu na promótorové oblasti HSPs. U bunkovej línie HeLa bolo po transfekcii AptHSF1-RA1 oproti kontrolným vzorkám pozorované 9-násobné zvýšenie mortality v bunkovej kultúre [75,76]. IHSF115 je ďalším priamym inhibítorom HSF1, ktorý ovplyvňuje priamo jeho transaktivačnú funkciu. ATF1/CREB reguluje stresom-indukovanú odpoveď tepelného šoku pomocou tvorby transkripčného komplexu s HSF1 a umožňuje tak nasadnutie HSF1 na cieľové promótory. IHSF115 sa viaže na DNA väzbovú doménu HSF1 a výrazne znižuje interakciu HSF1-ATF1 [77]. Predpokladá sa preto, že IHSF115 interferuje s formovaním transkripčných komplexov nevyhnutných pre zahájenie HSF1-sprostredkovanej transkripcie.
Záver
HSF1 je transkripčným faktorom dvoch tvárí. Na jednej strane sa obecne podieľa na ochrane bunky pred proteotoxickým stresom, ale zároveň napomáha nádorovým bunkám prispôsobiť sa zvýšeným nárokom vyvolaných malígnou transformáciou. Všeobecne sa dajú jeho onkogénne úlohy rozdeliť na:
- a) reguláciu proteínov HSPs, ktoré ako molekulárne chaperóny stabilizujú veľké množstvo klientských proteínov esenciálnych pre prežitie nádorových buniek (napr. mutovaný p53);
- b) zapojenie v množstve signálnych dráh (AMPK, PI3K-AKT-mTOR), ktoré sú zodpovedné za proliferáciu, EMT, invazivitu, alebo migráciu;
- c) reguláciu energetického metabolizmu, ktorý predstavuje charakteristickú črtu nádorových buniek. Zvýšená hladina HSF1 koreluje so zvýšenou agresivitou onkologického ochorenia a so zlou prognózou pre pacienta. Vďaka jeho pleiotropnej úlohe je HSF1 nielen významným diagnostickým a prognostickým markerom, ale aj zaujímavým potenciálnym cieľom protinádorovej terapie.
Práca bola podporená projektom MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Oliver Šimončík
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7 656 53 Brno
e-mail: oliver.simoncik@mou.cz
Přijato: 10. 8. 2018
Zdroje
1. Ritossa F. A new puffing pattern induced by temperature shock and DNP in drosophila. Experientia 1962; 18 (12): 571–573.
2. Tissières A, Mitchell HK, Tracy UM. Protein synthesis in salivary glands of Drosophila melanogaster: relation to chromosome puffs. J Mol Biol 1974; 84 (3): 389–398.
3. Nollen EA, Morimoto RI. Chaperoning signaling pathways: molecular chaperones as stress-sensing “heat shock” proteins. J Cell Sci 2002; 115 (Pt 14): 2809–2816.
4. Nover L, Bharti K, Döring P et al. Arabidopsis and the heat stress transcription factor world: how many heat stress transcription factors do we need? Cell Stress Chaperones 2001; 6 (3): 177–189.
5. Pirkkala L, Nykänen P, Sistonen L. Roles of the heat shock transcription factors in regulation of the heat shock response and beyond. FASEB 2001; 15 (7): 1118–1131.
6. Westerheide SD, Raynes R, Powell C et al. HSF transcription factor family, heat shock response, and protein intrinsic disorder. Curr Protein Pept Sci 2012; 13 (1): 86–103.
7. Akerfelt M, Morimoto RI, Sistonen L. Heat shock factors: integrators of cell stress, development and lifespan. Nat Rev Mol Cell Biol 2010; 11 (8): 545–555. doi: 10.1038/nrm2938.
8. Muchowski PJ, Wacker JL. Modulation of neurodegeneration by molecular chaperones. Nat Rev Neurosci 2005; 6 (1): 11–22. doi: 10.1038/nrn1587.
9. Mendillo ML, Santagata S, Koeva M et al. HSF1 drives a transcriptional program distinct from heat shock to support highly malignant human cancers. Cell 2012; 150 (3): 549–562. doi: 10.1016/j.cell.2012.06.031.
10. Harrison CJ, Bohm AA, Nelson HC. Crystal structure of the DNA binding domain of the heat shock transcription factor. Science 1994; 263 (5144): 224–227.
11. Morimoto RI. Regulation of the heat shock transcriptional response: cross talk between a family of heat shock factors, molecular chaperones, and negative regulators. Genes Dev 1998; 12 (24): 3788–3796.
12. Trinklein ND, Murray JI, Hartman SJ et al. The role of heat shock transcription factor 1 in the genome-wide regulation of the mammalian heat shock response. Mol Biol Cell 2004; 15 (3): 1254–1261. doi: 10.1091/mbc.e03-10-0738.
13. Hentze N, Le Breton L, Wiesner J et al. Molecular mechanism of thermosensory function of human heat shock transcription factor Hsf1. Elife 2016; 5: pii: e11576. doi: 10.7554/eLife.11576.
14. Zou J, Guo Y, Guettouche T et al. Repression of heat shock transcription factor HSF1 activation by HSP90 (HSP90 complex) that forms a stress-sensitive complex with HSF1. Cell 1998; 94 (4): 471–480.
15. Ali A, Bharadwaj S, O’Carroll R et al. HSP90 interacts with and regulates the activity of heat shock factor 1 in Xenopus oocytes. Mol Cell Biol 1998; 18 (9): 4949–4960.
16. Neef DW, Jaeger AM, Gomez-Pastor R et al. A direct regulatory interaction between chaperonin TRiC and stress-responsive transcription factor HSF1. Cell Rep 2014; 9 (3): 955–966. doi: 10.1016/j.celrep.2014.09.056.
17. Ishiwata J, Kasamatsu A, Sakuma K et al. State of heat shock factor 1 expression as a putative diagnostic marker for oral squamous cell carcinoma. Int J Oncol 2012; 40 (1): 47–52. doi: 10.3892/ijo.2011.1178.
18. Hietakangas V, Ahlskog JK, Jakobsson AM et al. Phosphorylation of serine 303 is a prerequisite for the stress-inducible SUMO modification of heat shock factor 1. Mol Cell Biol 2003; 23 (8): 2953–2968.
19. Wang X, Khaleque MA, Zhao MJ et al. Phosphorylation of HSF1 by MAPK-activated protein kinase 2 on serine 121, inhibits transcriptional activity and promotes HSP90 binding. J Biol Chem 2006; 281 (2): 782–791. doi: 10.1074/jbc.M505822200.
20. Chu B, Zhong R, Soncin F et al. Transcriptional activity of heat shock factor 1 at 37 degrees C is repressed through phosphorylation on two distinct serine residues by glycogen synthase kinase 3 and protein kinases Calpha and Czeta. J Biol Chem 1998; 273 (29): 18640–18646.
21. Dai R, Frejtag W, He B et al. c-Jun NH2-terminal kinase targeting and phosphorylation of heat shock factor-1 suppress its transcriptional activity. J Biol Chem 2000; 275 (24): 18210–18218. doi: 10.1074/jbc.M000958200.
22. Kline MP, Morimoto RI. Repression of the heat shock factor 1 transcriptional activation domain is modulated by constitutive phosphorylation. Mol Cell Biol 1997; 17 (4): 2107–2115.
23. Holmberg CI, Hietakangas V, Mikhailov A et al. Phosphorylation of serine 230 promotes inducible transcriptional activity of heat shock factor 1. EMBO J 2001; 20 (14): 3800–3810.doi: 10.1093/emboj/20.14.3800.
24. Murshid A, Chou SD, Prince T et al. Protein kinase a binds and activates heat shock factor 1. PLoS One 2010; 5 (11): e13830. doi: 10.1371/journal.pone.0013830.
25. Chou SD, Prince T, Gong J et al. mTOR is essential for the proteotoxic stress response, HSF1 activation and heat shock protein synthesis. PLoS One 2012; 7 (6): e39679. doi: 10.1371/journal.pone.0039679.
26. Xu YM, Huang DY, Chiu JF et al. Post-translational modification of human heat shock factors and their functions: a recent update by proteomic approach. J Proteome Res 2012; 11 (5): 2625–2634. doi: 10.1021/pr201151a.
27. Core LJ, Lis JT. Transcription regulation through promoter-proximal pausing of RNA polymerase II. Science 2008; 319 (5871): 1791–1792. doi: 10.1126/science.1150843.
28. Ni Z, Schwartz BE, Werner J et al. Coordination of transcription, RNA processing, and surveillance by P-TEFb kinase on heat shock genes. Mol Cell 2004; 13 (1): 55–65.
29. Hoang AT, Huang J, Rudra-Ganguly N et al. A novel association between the human heat shock transcription factor 1 (HSF1) and prostate adenocarcinoma. Am J Pathol 2000; 156 (3): 857–864. doi: 10.1016/S0002-9440 (10) 64954-1.
30. Santagata S, Hu R, Lin NU et al. High levels of nuclear heat-shock factor 1 (HSF1) are associated with poor prognosis in breast cancer. Proc Natl Acad Sci U S A 2011; 108 (45): 18378–18383. doi: 10.1073/pnas.1115031 108.
31. Cen H, Zheng S, Fang YM et al. Induction of HSF1 expression is associated with sporadic colorectal cancer. World J Gastroenterol 2004; 10 (21): 3122–3126.
32. Fang F, Chang R, Yang L. Heat shock factor 1 promotes invasion and metastasis of hepatocellular carcinoma in vitro and in vivo. Cancer 2012; 118 (7): 1782–1794. doi: 10.1002/cncr.26482.
33. Dai C, Whitesell L, Rogers AB et al. Heat shock factor 1 is a powerful multifaceted modifier of carcinogenesis. Cell 2007; 130 (6): 1005–1018. doi: 10.1016/j.cell.2007.07.020.
34. Craig EA. The heat shock response. CRC Crit Rev Biochem 1985; 18 (3): 239–280.
35. Schulz R, Streller F, Scheel AH et al. HER2/ErbB2 activates HSF1 and thereby controls HSP90 clients including MIF in HER2-overexpressing breast cancer. Cell Death Dis 2014; 5: e980. doi: 10.1038/cddis.2013.508.
36. Meng L, Gabai VL, Sherman MY. Heat-shock transcription factor HSF1 has a critical role in human epidermal growth factor receptor-2-induced cellular transformation and tumorigenesis. Oncogene 2010; 29 (37): 5204–5213. doi: 10.1038/onc.2010.277.
37. Xi C, Hu Y, Buckhaults P et al. Heat shock factor Hsf1 cooperates with ErbB2 (Her2/Neu) protein to promote mammary tumorigenesis and metastasis. J Biol Chem 2012; 287 (42): 35646–35657. doi: 10.1074/jbc.M112.377481.
38. Wiech M, Olszewski MB, Tracz-Gaszewska Z et al. Molecular mechanism of mutant p53 stabilization: the role of HSP70 and MDM2. PLoS One 2012; 7 (12): e51426. doi: 10.1371/journal.pone.0051426.
39. Ciocca DR, Calderwood SK. Heat shock proteins in cancer: diagnostic, prognostic, predictive, and treatment implications. Cell Stress Chaperones 2005; 10 (2): 86–103.
40. Jacobs AT, Marnett LJ. HSF1-mediated BAG3 expression attenuates apoptosis in 4-hydroxynonenal-treated colon cancer cells via stabilization of anti-apoptotic Bcl-2 proteins. J Biol Chem 2009; 284 (14): 9176–9183. doi: 10.1074/jbc.M808656200.
41. Wang GL, Jiang BH, Rue EA et al. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci U S A 1995; 92 (12): 5510–5514.
42. Bindra RS, Schaffer PJ, Meng A et al. Alterations in DNA repair gene expression under hypoxia: elucidating the mechanisms of hypoxia-induced genetic instability. Annals of the New York Academy of Sciences 2005; 1059 (1): 184–195. doi: 10.1196/annals.1339.049.
43. Piret J-P, Cosse J-P, Ninane N et al. Hypoxia protects HepG2 cells against etoposide-induced apoptosis via a HIF-1-independent pathway. Exp Cell Res 2006; 312 (15): 2908–2920. doi: 10.1016/j.yexcr.2006.05.018.
44. Um JH, Kang CD, Bae JH et al. Association of DNA-dependent protein kinase with hypoxia inducible factor-1 and its implication in resistance to anticancer drugs in hypoxic tumor cells. Exp Mol Med 2004; 36 (3): 233–242. doi: 10.1038/emm.2004.32.
45. Shen C, Nettleton D, Jiang M et al. Roles of the HIF-1 hypoxia-inducible factor during hypoxia response in Caenorhabditis elegans. J Biol Chem 2005; 280 (21): 20580–20588. doi: 10.1074/jbc.M501894200.
46. Liu G, Roy J, Johnson EA. Identification and function of hypoxia-response genes in Drosophila melanogaster. Physiol Genomics 2006; 25 (1): 134–141. doi: 10.1152/physiolgenomics.00262.2005.
47. Nakano M, Mann DL, Knowlton AA. Blocking the endogenous increase in HSP 72 increases susceptibility to hypoxia and reoxygenation in isolated adult feline cardiocytes. Circulation 1997; 95 (6): 1523–1531.
48. Kabakov AE, Budagova KR, Bryantsev AL et al. Heat shock protein 70 or heat shock protein 27 overexpressed in human endothelial cells during posthypoxic reoxygenation can protect from delayed apoptosis. Cell Stress Chaperones 2003; 8 (4): 335–347.
49. Baird NA, Turnbull DW, Johnson EA. Induction of the heat shock pathway during hypoxia requires regulation of heat shock factor by hypoxia-inducible factor-1. J Biol Chem 2006; 281 (50): 38675–38681. doi: 10.1074/jbc.M608013200.
50. Zhou J, Schmid T, Frank R et al. PI3K/Akt is required for heat shock proteins to protect hypoxia-inducible factor 1alpha from pVHL-independent degradation. J Biol Chem 2004; 279 (14): 13506–13513. doi: 10.1074/jbc.M310164200.
51. Minet E, Mottet D, Michel G et al. Hypoxia-induced activation of HIF-1: role of HIF-1alpha-Hsp90 interaction. FEBS Lett 1999; 460 (2): 251–256.
52. Kubo M, Li T-S, Kurazumi H et al. Heat shock factor 1 contributes to ischemia-induced angiogenesis by regulating the mobilization and recruitment of bone marrow stem/progenitor cells. PLoS One 2012; 7 (5): e37934. doi: 10.1371/journal.pone.0037 934.
53. Slamon DJ, Godolphin W, Jones LA et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science 1989; 244 (4905): 707–712.
54. Di Fiore PP, Pierce JH, Kraus MH et al. erbB-2 is a potent oncogene when overexpressed in NIH/3T3 cells. Science 1987; 237 (4811): 178–182.
55. Nahta R. Molecular mechanisms of trastuzumab-based treatment in HER2-overexpressing breast cancer. ISRN Oncol 2012; 2012 : 428062. doi: 10.5402/2012/428 062.
56. Zhang Y, Chou SD, Murshid A et al. The role of heat shock factors in stress-induced transcription. Methods Mol Biol Clifton NJ 2011; 787 : 21–32. doi: 10.1007/978-1-61779-295-3_2.
57. Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control. Nat Rev Mol Cell Biol 2009; 10 (5): 307–318. doi: 10.1038/nrm2672.
58. Wang Y, Xu W, Yan Z et al. Metformin induces autophagy and G0/G1 phase cell cycle arrest in myeloma by targeting the AMPK/mTORC1 and mTORC2 pathways. J Exp Clin Cancer Res 2018; 37 (1): 63. doi: 10.1186/s13046-018-0731-5.
59. De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression. Nat Rev Cancer 2013; 13 (2): 97–110. doi: 10.1038/nrc3447.
60. Hajra KM, Chen DY, Fearon ER. The SLUG zinc-finger protein represses E-cadherin in breast cancer. Cancer Res 2002; 62 (6): 1613–1618.
61. Carpenter RL, Paw I, Dewhirst MW et al. Akt phosphorylates and activates HSF-1 independent of heat shock, leading to Slug overexpression and epithelial-mesenchymal transition (EMT) of HER2-overexpressing breast cancer cells. Oncogene 2015; 34 (5): 546–557. doi: 10.1038/onc.2013.582.
62. Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 2009; 324 (5930): 1029–1033. doi: 10.1126/science.1160809.
63. Chen Z, Lu W, Garcia-Prieto C et al. The Warburg effect and its cancer therapeutic implications. J Bioenerg Biomembr 2007; 39 (3): 267–274. doi: 10.1007/s10863-007-9086-x.
64. Kim J, Dang CV. Cancer’s molecular sweet tooth and the warburg effect. Cancer Res 2006; 66 (18): 8927–8930. doi: 10.1158/0008-5472.CAN-06-1501.
65. Le A, Cooper CR, Gouw AM et al. Inhibition of lactate dehydrogenase A induces oxidative stress and inhibits tumor progression. Proc Natl Acad Sci U S A 2010; 107 (5): 2037–2042. doi: 10.1073/pnas.0914433107.
66. Hahn JS, Thiele DJ. Activation of the Saccharomyces cerevisiae heat shock transcription factor under glucose starvation conditions by Snf1 protein kinase. J Biol Chem 2004; 279 (7): 5169–5176. doi: 10.1074/jbc.M311005 200.
67. Zhao YH, Zhou M, Liu H et al. Upregulation of lactate dehydrogenase A by ErbB2 through heat shock factor 1 promotes breast cancer cell glycolysis and growth. Oncogene 2009; 28 (42): 3689–3701. doi: 10.1038/onc.2009.229.
68. Hardie DG. AMP-activated protein kinase—an energy sensor that regulates all aspects of cell function. Genes Dev 2011; 25 (18): 1895–1908. doi: 10.1101/gad.17420111.
69. Welch WJ. The role of heat-shock proteins as molecular chaperones. Curr Opin Cell Biol 1991; 3 (6): 1033–1038.
70. Dai S, Tang Z, Cao J et al. Suppression of the HSF1-mediated proteotoxic stress response by the metabolic stress sensor AMPK. EMBO J 2015; 34 (3): 275–293. doi: 10.15252/embj.201489062.
71. Chen K, Qian W, Li J et al. Loss of AMPK activation promotes the invasion and metastasis of pancreatic cancer through an HSF1-dependent pathway. Mol Oncol 2017; 11 (10): 1475–1492. doi: 10.1002/1878-0261.12 116.
72. Foretz M, Guigas B, Bertrand L et al. Metformin: from mechanisms of action to therapies. Cell Metab 2014; 20 (6): 953–966. doi: 10.1016/j.cmet.2014.09.018.
73. Shah SP, Nooka AK, Jaye DL et al. Bortezomib-induced heat shock response protects multiple myeloma cells and is activated by heat shock factor 1 serine 326 phosphorylation. Oncotarget 2016; 7 (37): 59727–59741. doi: 10.18632/oncotarget.10847.
74. Yoon YJ, Kim JA, Shin KD et al. KRIBB11 Inhibits HSP70 synthesis through inhibition of heat shock factor 1 function by impairing the recruitment of positive transcription elongation factor B to the HSP70 promoter. J Biol Chem 2011; 286 (3): 1737–1747. doi: 10.1074/jbc.M110.179440.
75. Salamanca HH, Fuda N, Shi H et al. An RNA aptamer perturbs heat shock transcription factor activity in Drosophila melanogaster. Nucleic Acids Res 2011; 39 (15): 6729–6740. doi: 10.1093/nar/gkr206.
76. Salamanca HH, Antonyak MA, Cerione RA et al. Inhibiting heat shock factor 1 in human cancer cells with a potent RNA aptamer. PLoS one 2014; 9 (5): e96330. doi: 10.1371/journal.pone.0096330.
77. Vilaboa N, Boré A, Martin-Saavedra et al. New inhibitor targeting human transcription factor HSF1: effects on the heat shock response and tumor cell survival. Nucleic Acids Res 2017; 45 (10): 5797–5817. doi: 10.1093/nar/gkx 194.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo Supplementum 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Proteogenomická platforma na identifikáciu nádorovo špecifických antigénov
- Využití mitochondriálních procesů v cílené terapii nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Význam membránových proteinů v léčbě nádorových onemocnění a možnosti jejich dalšího studia
- Vliv metylace DNA na vznik nádorových onemocnění
- Úloha proteinu HSP70 v nádorech a jeho využití jako terapeutický cíl
- Variabilita buněčné populace solidních nádorů a její význam pro diagnostiku a terapii nádorových onemocnění
- Úloha proteínu HSF1 v nádorovej transformácii
- Proteíny HDM2 a HDMX v ľudských nádoroch
- Prima-1 a APR-246 v léčbě nádorových onemocnění
- Acetylsalicylová kyselina a její potenciál v chemoprevenci kolorektálního karcinomu
- Exprese a funkční charakterizace miR-34c u karcinomu děložního hrdla
- Subpopulace cirkulujících myeloidních supresových buněk u pacientů s kolorektálním karcinomem – explorativní analýza jejich potenciálu jako biomarkeru
- Současné metody analýzy mikroRNA
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vliv metylace DNA na vznik nádorových onemocnění
- Ferroptóza jako nový typ buněčné smrti a její role v léčbě rakoviny
- Možnosti využití p63 v bioptické diagnostice
- Současné metody analýzy mikroRNA
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



