-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
Current Status of Checkpoint Inhibitors in the Treatment of Esophageal and Gastric Tumors – Overview of Studies
Background:
Despite recent advances in oncological treatment, gastric and esophageal cancer remain neoplastic diseases with poor prognoses. The only potential curative treatment is surgical resection with adjuvant or neoadjuvant chemotherapy/chemoradiotherapy. Targeted therapy of metastatic disease unfortunately does not provide better outcomes than for other tumor types, with the exception of trastuzumab and ramucirumab, which have relatively limited efficacy. Immunotherapy is a rapidly evolving treatment that has influenced the treatment guidelines for many tumors. In the present review, we summarize clinical trials of checkpoint inhibitors for the treatment of gastric and esophageal cancer, including published results and the perspectives of ongoing trials.Results and Discussion:
Gastric and esophageal cancer are tumors with high mutation loads that have attracted considerable attention since the beginning of interest in immunotherapy. Phase I clinical trials (Keynote 012, Javelin, KEYNOTE 028) have demonstrated efficacy and acceptable toxicity. These studies were followed by phase II clinical trials (KEYNOTE 059, CheckMate 032, JapicCTI-No.142422), which showed about a 10–30% overall tumor response rate and confirmed the predictive role of PD-L1 expression. Ongoing phase III clinical trials (CheckMate 648, KEYNOTE 181, KEYNOTE 590, CheckMate 577) should finally confirm whether checkpoint inhibitors have a role to play in a palliative and adjuvant setting.Conclusion:
Checkpoint inhibitors are perspective treatment modalities for gastric and esophageal tumors.Key words:
stomach neoplasms – esophageal neoplasms – immunotherapySubmitted:
19. 9. 2017Accepted:
22. 10. 2017
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Autoři: David Vrána; Marcel Matzenauer; Bohuslav Melichar
Působiště autorů: Onkologická klinika LF UP a FN Olomouc
Vyšlo v časopise: Klin Onkol 2018; 31(1): 35-39
Kategorie: Přehled
doi: https://doi.org/10.14735/amko201835Souhrn
Východiska:
Nádory žaludku a jícnu představují i přes současné pokroky v onkologické léčbě onemocnění se špatnou prognózou. Jedinou potencionálně kurativní léčbu představuje stále chirurgická resekce doplněná neoadjuvantní či adjuvantní chemoterapií/chemoradioterapií. U generalizovaného onemocnění, na rozdíl od jiných nádorů, cílená terapie bohužel dosud nepřinesla větší posun s výjimkou trastuzumabu a ramucirumabu, jejichž účinnost je však relativně omezená. Imunoterapie přestavuje rychle se rozvíjející léčebnou modalitu, která se dostala do standardních léčebných postupů u řady malignit. V našem přehledovém článku shrnujeme dosavadní klinické studie s checkpoint inhibitory u nádorů žaludku a jícnu, dosud publikované výsledky a perspektivy probíhajících studií.Výsledky a diskuze:
Karcinomy žaludku a jícnu patří mezi malignity s největší mutační náloží, což již od počátku přitahovalo zájem o imunoterapii u těchto typů nádorů. Prvotní studie fáze I (KEYNOTE 012, Javelin, KEYNOTE 028) upozornily na efektivitu a přijatelnou toxicitu checkpoint inhibitorů u nádorů žaludku a jícnu. Následovaly studie fáze II (KEYNOTE 059, CheckMate 032, JapicCTI-No.142422), které ukázaly odpověď nádoru v 10–30 % případů a potvrdily prediktivní roli exprese PD-L1. Probíhající studie fáze III (CheckMate 648, KEYNOTE 181, KEYNOTE 590, CheckMate 577) by měly definitivně potvrdit efektivitu checkpoint inibitorů a jejich postavení v paliativních i adjuvantních režimech.Závěr:
Checkpoint inhibitory představují perspektivní léčebnou modalitu u nádorů žaludku a jícnu.Klíčová slova:
nádory žaludku – nádory jícnu – imunoterapieÚvod
Karcinomy jícnu a žaludku představují bohužel stále onemocnění s všeobecně špatnou prognózou. Jedinou potenciálně kurativní léčbou zůstává chirurgický výkon doplněný neoadjuvantní či adjuvantní chemoterapií/chemoradioterapií, i když o nezbytnosti chirurgického výkonu po chemoradioterapii se stále diskutuje. V léčbě generalizovaného onemocnění představuje paliativní chemoterapie založená na platinovém derivátu 5-fluorouracilu nebo taxanech po mnoho let stále zlatý standard. Z cílených léků se do běžné praxe dostaly pouze transtuzumab (anti-HER2) a ramucirumab (anti-VEGFR2) u adenokarcinomu žaludku a gastroezofageální junkce [1,2]. V případě spinocelulárních nádorů jícnu se širšího uplatnění žádná cílená terapie zatím nedočkala. Původně slibné výsledky anti-EGFR léčby s gefitinibem nebyly potvrzeny ve studiích fáze III [3]. Imunoterapie se v posledních letech etablovala jako základní léčebná modalita v systémové léčbě řady malignit vč. maligního melanomu (MM), plicního karcinomu či karcinomu ledviny. Postavení imunoterapie v případě nádoru horního gastrointestinálního traktu (GIT) je však zatím mnohem méně jasné.
V této přehledové práci bychom rádi shrnuli současné studie s imunoterapií u nádorů žaludku a jícnu se zaměřením na checkpoint inhibitory.
Nádory žaludku a jícnu patří k nádorům s největší mutační náloží (po MM, plicních nádorech a tumorech močového měchýře) a i z toho důvodu se dostaly do centra zájmu stran možné efektivity imunoterapie [4]. Vysoká mutační nálož způsobuje prezentaci řady neontigenů a tím zvyšuje šanci na imunitní odpověď a zlepšuje možnou účinnost imunoterapie. Tento teoretický předpoklad byl potvrzen v řadě studií [5]. Další šance na zvýšení imunogenity nádoru představuje možná kombinace imunoterapie s radioterapií, chemoterapií či cílenou léčbou, která dále svým cytotoxickým mechanizmem zvyšuje prezentaci nádorového antigenu. Opačným problémem imunoterapie zejména v případě kombinace s radioterapií je však možnost indukce tzv. hyperprogrese vlastního nádorového onemocnění, která se vyskytuje v přibližně 9 % případů a zdaleka tedy nejde o zanedbatelné riziko s ohledem na skutečnost, že dlouhodobou odpověď na imunoterapii můžeme očekávat u 25–30 % pacientů [6]. Dalším rizikem jsou samozřejmě autoimunitně podmíněné nežádoucí účinky imunoterapie.
Imunoterapii je možné obecně rozdělit na imunoterapii specifickou či nespecifickou, dále na imunoterapii aktivní nebo pasivní. Již zmíněné protilátky je možné považovat za pasivní specifickou imunoterapii. Jejím mechanizmem je kromě vlastní blokády receptorů růstových faktorů také aktivace komplementu a buněčné cytotoxicity závislé na protilátkách (antibody dependent cell-mediated cytotoxicity – ADCC). Nejrychleji se v tomto ohledu však jednoznačně rozvíjí aktivní nespecifická imunoterapie cílící na receptory nebo ligandy lymfocytů ovlivňující jejich aktivitu či přežívání – CTLA-A (cytotoxic T lymphocyte associated Antigen 4), PD-1 (programmed cell death receptor), PD-L1 (programmed cell death ligand 1). Adoptivní imunoterapie založená na dendritických buňkách, tumor infiltrujících lymfocytech nebo CAR (chimeric antigen receptor) T lymfocytech zatím bohužel nepřinesla zásadnější posun v případě nádorů horního GIT [7].
Exprese PD-L1 u nádorů žaludku a jícnu je popisována v poměrně širokém rozmezí 2–63 %, což je dáno jednak rozdílnou hodnotou cut-off, jednak rozdílným druhem použité protilátky. Výrazně vyšší je však exprese PD-L1 na imunitních buňkách v nádorovém mikroprostředí [8].
Nádory gastroezofageální (GE) junkce jsou střídavě zařazovány ve studiích s karcinomy žaludku i s karcinomy jícnu, nicméně v posledních studiích jsou nádory Siewert I řazeny ke karcinomům jícnu a karcinomy Siewert II + III obvykle již k nádorům žaludku.
Tabulka 1 shrnuje studie s publikovanými výsledky, v tab. 2 jsou uvedeny vybrané současně probíhající studie.
Tab. 1. Zveřejněné výsledky studií s checkpoint inhibitory u karcinomu žaludku a jícnu. 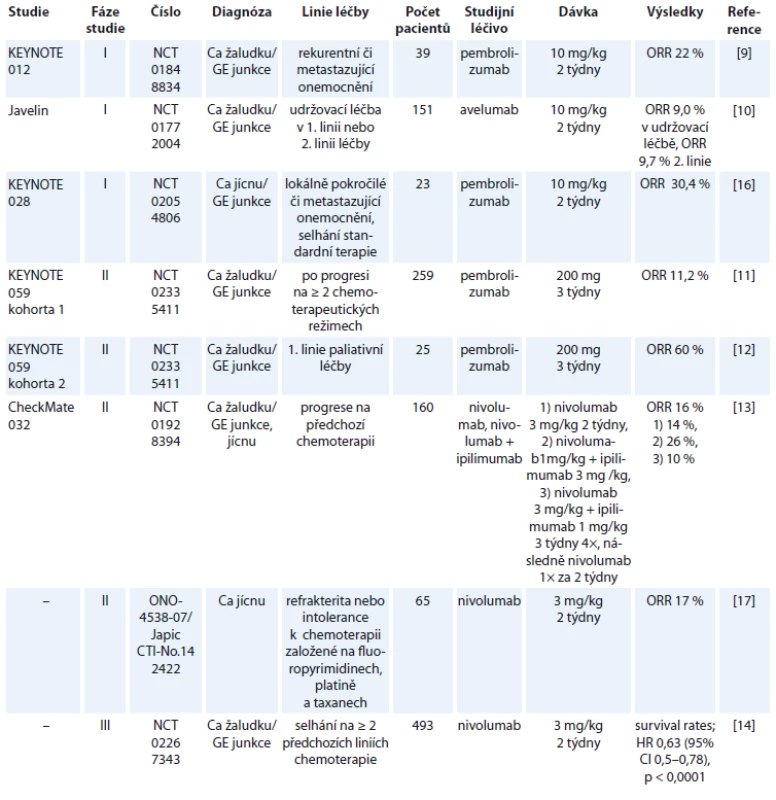
Ca – karcinom žaludku, GE junkce – gastroezofageální junkce Tab. 2. Vybrané probíhající studie. 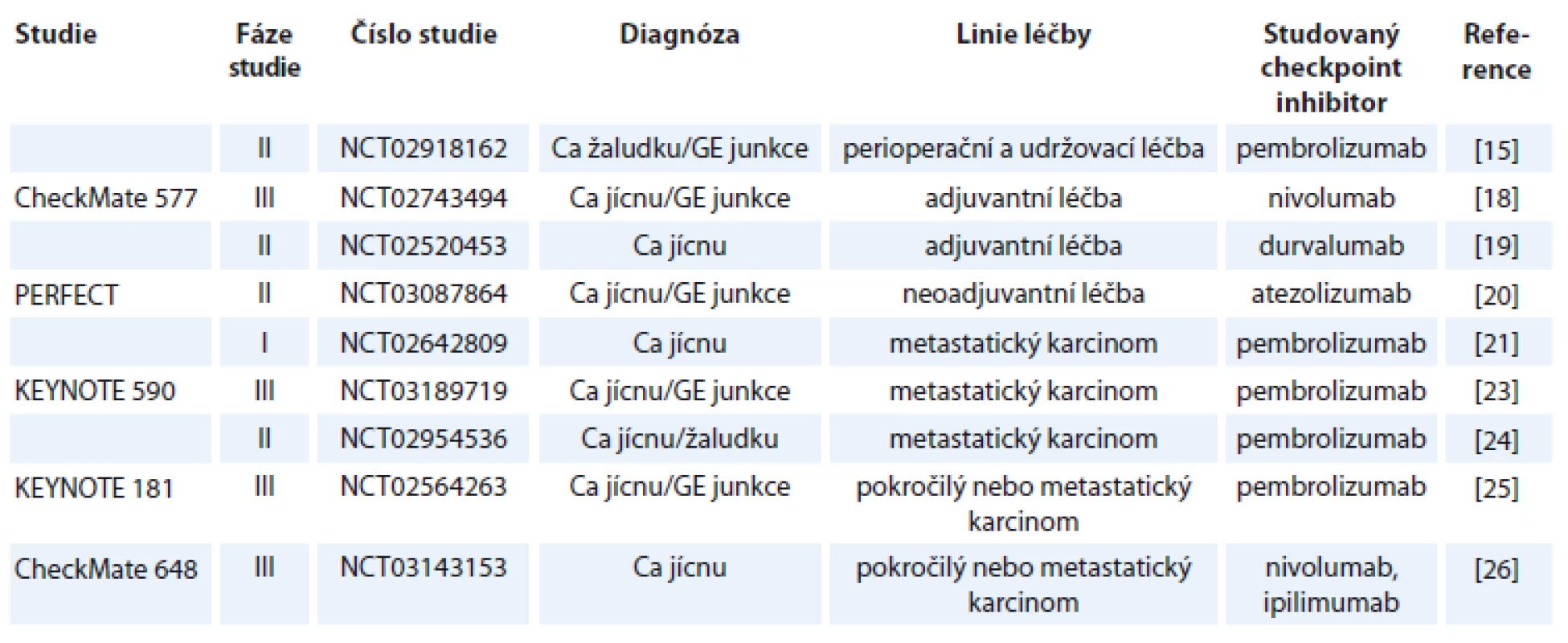
GE junkce – gastroezofageální junkce, Ca jícnu – karcinom jícnu Nádory žaludku
Studie fáze I prokázaly efektivitu imunoterapie u nádorů vč. karcinomu žaludku. Muro et al publikovali výsledky studie fáze Ib (KEYNOTE 012, NCT01848834), které prokázaly efektivitu pembrolizumabu při dávkování 10 mg/kg 1× za 2 týdny u adenokarcinomu žaludku/GE junkce s expresí PD-L1 s mírou celkové odpovědi (overall reponse rate – ORR) 22 %. Ve 13 % případů se vyskytla toxicita G3 nebo G4 bez jakéhokoli případu úmrtí pacienta [9]. Podobně studie fáze I Javelin (NCT01772004), ve které byl podáván avelumab (anti-PD-L1) jako udržovací léčba po indukční chemoterapii oxaliplatina s 5-fluorouracilem (5-FU) /kapecitabinem v 1. linii nebo jako 2. linie paliativní léčby prokázala ORR 9,0, resp. 9,7 % ve 2. linii. V celé studii došlo k jediné toxicitě G5 a toxicita G3 nebo vyšší se objevila v 9,9 % případů [10]. Tyto studie, které prokázaly slibnou efektivitu checkpoint inhibitorů spolu s přijatelnou toxicitou léčby, byly následovány studiemi fáze II. KEYNOTE 059 (NCT02335411) byla studie, která zařazovala pacienty s karcinomem žaludku/ GE junkce po alespoň 2 liniích paliativní léčby, přičemž asi 1/2 pacientů byla léčena jako 3. linie (51,7 %) a druhá polovina (48,3 %) jako 4. nebo vyšší linie paliativní léčby. ORR byla ve studii 11,2 %, přičemž odpověď pacientů ve 3. linii byla dvojnásobná (14,9 %) ve srovnání se 4. a vyšší linií léčby (7,2 %). Rozdíl v odpovědi mezi PD-L1 pozitivními a negativními nádory byl přibližně trojnásobný (15,5 vs. 5,5 %). Studie tedy potvrdila prediktivní význam PD-L1 exprese u nádorů žaludku. Toxicita stupně ≥ 3 se vyskytla v 16,6 % případů [11]. Součástí této studie byla také podskupina pacientů (kohorta 2), u nichž byla léčba pembrolizumabem podávána v 1. linii spolu s cisplatinou a 5-FU, odpověď u této podskupiny byla téměř v 60 % případů. Současně s vysokou odpovědí na kombinovaný režim byla však pozorovaná vysoká toxicita (stupeň 3–4 v 76 % případů), i když pouze u tří pacientů bylo nutné z důvodu toxicity přerušit léčbu. Odpověď u PD-L1 pozitivních pacientů byla téměř dvojnásobná ve srovnání s nádory bez exprese PD-L1 [12]. Další logickou možností léčby je kombinace checkpoint inhibitorů. Studie CheckMate 032 (NCT01928394) byla studie, která zařazovala předléčené pacienty s adenokarcinomy žaludku, jícnu a GE junkce. Pacienti byli léčeni ve třech ramenech:
- nivolumabem 3 mg/kg;
- nivolumabem 3 mg/kg a ipilimumabem 1 mg/kg;
- nivolumabem 1 mg/kg a ipilimumabem 3 mg/kg.
Do studie bylo zařazeno celkem 160 pacientů, přičemž ORR bylo v první skupině 14 %, v druhé skupině 10 % a ve třetí skupině 26 %. Podobně toxicita léčby G3 a G4 se vyskytla nejčastěji v třetím rameni, a to v 78 % [13]. Je třeba dodat, že většina toxicit ve výše uvedených studiích byla velmi dobře klinicky zvládnutelná. Tyto povzbudivé výsledky ze studií fáze II vedly k iniciaci dalších studií fáze III. Kang et al prezentovali na ASCO kongresu výsledky studie NCT02267343 u pacientů s adenokarcinomy žaludku či GE junkce, kteří byli předléčeni alespoň 2 liniemi paliativní léčby. Tito pacienti byli randomizováni do skupiny léčených nivolumabem a skupiny pacientů pouze s placebem. Studie prokázala statisticky signifikantní zlepšení celkového přežití ve skupině pacientů léčených nivolumabem (HR 0,63; 95% CI 0,5–0,78; p < 0,0001) s ORR 11,2 % [14]. Ze současně probíhajících studií s otevřeným náborem je nutno zmínit studii NCT02918162. Studie kombinuje pembrolizumab spolu s peroperační chemoterapií a následně pokračuje v udržovací léčbě pembrolizumabem [15]. Ani předběžné výsledky nejsou v současnosti k dispozici.
Nádory jícnu
Studií s imunoterapií u karcinomu jícnu je ještě podstatně méně, než je to v případě nádorů žaludku. KEYNOTE 028 (NCT02054806) byla studie hodnotící benefit pembrolizumabu u pacientů se spinocelulárním karcinomem či adenokarcinomem jícnu nebo GE junkce po selhání předchozí léčby. Studie prokázala efektivitu pembrolizumabu, když dosáhla 30,4% ORR [16]. Kudo et al publikovali studii fáze II (ONO-4538-07/JapicCTI-No.142422) hodnotící pacienty se spinocelulárním karcinomem, adenoskvamózním karcinomem nebo adenokarcinomem jícnu, kteří byli předléčeni platinovým derivátem, fluoropyrimidiny a taxany (event. je netolerovali). Tito pacienti byli léčení nivolumabem, přičemž objektivní odpověď byla pozorována u 17 % pacientů. Ani v jednom případě nedošlo k úmrtí v souvislosti s toxicitou léčby [17]. V současnosti probíhá několik dalších zajímavých studií. S ohledem na skutečnost, že nedosažení kompletní patologické odpovědi po neoadjuvantní chemoradioterapii u karcinomu jícnu a GE junkce je považováno za jeden z nejdůležitějších negativních prognostických faktorů, byla iniciována studie CheckMate 577 (NCT02743494). Tato studie fáze III randomizuje pacienty stadia II/III po neoadjuvantní chemoradioterapii a chirurgické resekci jícnu, kteří nedosáhnou kompletní remise (complete remission – CR) po neoadjuvanci, do skupiny léčených adjuvantně nivolumabem a léčených adjuvantně pouze placebem [18]. Ani předběžné výsledky studie nejsou bohužel v současnosti k dispozici. Podobný design má probíhající studie fáze II s adjuvantním podáváním durvalumabu (NCT02520453) [19]. Další zajímavou probíhající studií u adenokarcinomu jícnu a GE junkce je studie PERFECT (NCT03087864). Tato studie fáze II hodnotí neoadjuvantní chemoradioterapii s karboplatinou a paklitaxelem a současně podávaným atezolizumabem. Primárním cílem studie je tolerovatelnost chemoradioterapie s atezolizumabem a v sekundárních cílích je hodnoceno samozřejmě procento dosažených kompletních odpovědí po neoadjuvantní léčbě, procento R0 resekcí a toxicita léčby [20]. Jak je uvedeno výše, dosažení CR po neoadjuvantní léčbě je zásadním prognostickým faktorem po léčbě karcinomu jícnu/GE junkce. Stále častěji se diskutuje otázka, zda je chirurgická resekce jícnu po neoadjuvantní chemoradioterapii v případě dosažení CR nezbytná a nezatěžuje pacienta pouze nezanedbatelnou morbiditou a mortalitou. V některých západních zemích byla dokonce chirurgická resekce jícnu po neoadjuvantní chemoradioterapii zcela opuštěna. Nicméně v současnosti bohužel neexistují prediktivní faktory dosažení kompletní odpovědi po chemoradioterapii, které by vyselektovaly podskupinu pacientů, která nebude profitovat z operačního výkonu. Zajímavou probíhající studií je studie NCT02642809. Jde o studii s metastatickým karcinomem jícnu, kde pacienti budou léčeni dvěma frakcemi brachyterapie následované pembrolizumabem. Vlastní brachyterapie má za cíl kromě zmírnění dysfagie současně možnou indukci abskopálního efektu [21]. Abskopální efekt radioterapie poprvé popsaný v roce 1953 (R. J. Mole) je dlouho diskutovaným problémem v léčbě imunoterapií. Podstatou abskopálního efektu je prezentace nádorového antigenu po ozáření tumoru a indukce imunitní odpovědi. Výsledkem je tedy regrese nejen vlastního ozářeného ložiska, ale současně i ložisek mimo ozářenou oblast [22]. Dalšími probíhajícími studiemi jsou KEYNOTE 590 hodnotící pembrolizumab v 1. linii paliativní léčby spolu s cisplatinou a 5-FU [23]. NCT02954536 studie s HER2+ adenokarcinomem žaludku, jícnu nebo GE junkce hodnotící pembrolizumab spolu s trastuzumabem a standardní chemoterapií v 1. linii paliativní léčby [24], KEYNOTE 181 (NCT 02564263) studie fáze III hodnotící pembrolizumab ve 2. linii paliativní léčby ve srovnání s chemoterapií (paklitaxel, docetaxel, irinotekan) [25]. Možností kombinace checkpoint inhibitorů u karcinomu jícnu se zabývá studie CheckMate 648 (NCT03143153) – studie fáze III, která randomizuje pacienty s karcinomem jícnu do ramene s kombinací nivolumab + ipilimumab, nivolumab + chemoterapie a samostatná chemoterapie [26]. Výsledky těchto studií bohužel nejsou v současné době k dispozici.
Závěr
Počet studií hodnotících imunoterapii u karcinomu jícnu/žaludku je i přes teoretické předpoklady o potenciální efektivitě imunoterapie u těchto typů nádorů ve srovnání s jinými nádory poměrně malý. Z prezentovaných dat je zřejmá efektivita, současně zvládnutelná toxicita imunoterapie u nádorů žaludku, jícnu a GE junkce, nicméně tyto slibné výsledky musí být potvrzeny v probíhajících studiích fáze III.
Obdrženo: 19. 9. 2017
Přijato: 22. 10. 2017
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. David Vrána, Ph.D.
Onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 185/6
Nová ulice
779 00 Olomouc
e-mail: david.vrana@fnol.cz
Zdroje
1. Bang YJ, Van Cutsem E, Feyereislova A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010; 376 (9742): 687–697. doi: 10.1016/S0140-6736 (10) 61121-X.
2. Wilke H, Muro K, Van Cutsem E et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol 2014; 15 (11): 1224–1235. doi: 10.1016/S1470-2045 (14) 70420-6.
3. Dutton SJ, Ferry DR, Blazeby JM et al. Gefitinib for oesophageal cancer progressing after chemotherapy (COG): a phase 3, multicentre, double-blind, placebo-controlled randomised trial. Lancet Oncol 2014; 15 (8): 894–904. doi: 10.1016/S1470-2045 (14) 70024-5.
4. Alexandrov LB, Nik-Zainal S, Wedge DC et al. Signatures of mutational processes in human cancer. Nature 2013; 500 (7463): 415–421. doi: 10.1038/nature12477.
5. Rizvi NA, Hellmann MD, Snyder A et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer. Science 2015; 348 (6230): 124–128. doi: 10.1126/science.aaa1348.
6. Champiat S, Dercle L, Ammari S et al. Hyperprogressive disease (HPD) is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1. Clin Cancer Res 2017; 23 (8): 1920–1928. doi: 10.1158/1078-0432.CCR-16-1741.
7. Toomey PG, Vohra NA, Ghansah T et al. Immunotherapy for gastrointestinal malignancies. Cancer control 2013; 20 (1): 32–42. doi: 10.1177/107327481302000106.
8. Jin Z, Yoon HH. The promise of PD-1 inhibitors in gastro-esophageal cancers: microsatellite instability vs. PD-L1. J Gastrointest Oncol 2016; 7 (5): 771–788. doi: 10.21037/jgo.2016.08.06.
9. Muro K, Chung HC, Shankaran V et al. Pembrolizumab for patients with PD-L1-positive advanced gastric cancer (KEYNOTE-012): a multicentre, open-label, phase 1b trial. Lancet Oncol 2016; 17 (6): 717–726. doi: 10.1016/S1470-2045 (16) 00175-3.
10. Chung HC, Arkenau HT, Wyrwicz L et al. Avelumab (MSB0010718C; anti-PD-L1) in patients with advanced gastric or gastroesophageal junction cancer from JAVELIN solid tumor phase Ib trial: Analysis of safety and clinical activity. J Clin Oncol 2016; 34 (Suppl 15): abstr. 4009.
11. Fuchs CS, Doi T, Jang RW et al. KEYNOTE-059 cohort 1: Efficacy and safety of pembrolizumab (pembro) monotherapy in patients with previously treated advanced gastric cancer. J Clin Oncol 2017; 35 (Suppl 15): abstr. 4003.
12. Bang YJ, Muro K, Fuchs CS et al. KEYNOTE-059 cohort 2: Safety and efficacy of pembrolizumab (pembro) plus 5-fluorouracil (5-FU) and cisplatin for first-line (1L) treatment of advanced gastric cancer. J Clin Oncol 2017; 35 (Suppl 15): abstr. 4012.
13. Janjigian YY, Bendell JC, Calvo E et al. CheckMate-032: Phase I/II, open-label study of safety and activity of nivolumab (nivo) alone or with ipilimumab (ipi) in advanced and metastatic (A/M) gastric cancer (GC). J Clin Oncol 2016; 34 (Suppl 15): abstr. 4010.
14. Kang YK, Satoh T, Ryu MH et al. Nivolumab (ONO-4538/BMS-936558) as salvage treatment after second or later-line chemotherapy for advanced gastric or gastroesophageal junction cancer (AGC): A double-blinded, randomized, phase III trial. J Clin Oncol 2017; 35 (Suppl 4): abstr. 2.
15. Perioperative chemo and pembrolizumab in gastric cancer. ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/record/NCT02918162.
16. Doi T, Piha-Paul SA, Jalal SI et al. Updated results for the advanced esophageal carcinoma cohort of the phase Ib KEYNOTE-028 study of pembrolizumab (MK-3475). J Clin Oncol 2016; 34: (Suppl 4): abstr. 7.
17. Kudo T, Hamamoto Y, Kato K et al. Nivolumab treatment for oesophageal squamous-cell carcinoma: an open-label, multicentre, phase 2 trial. Lancet Oncol 2017; 18 (5): 631–639. doi: 10.1016/S1470-2045 (17) 30181-X.
18. An investigational immuno-therapy study of nivolumab or placebo in patients with resected esophageal or gastroesophageal junction cancer (CheckMate 577). ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/record/NCT02743494.
19. Adjuvant durvalumab for esophageal cancer. ClinicalTrials.gov. [online]. Bethesda (MD): National Library of Medicine (US). Available from: https: //clinicaltrials.gov/ct2/show/NCT02520453.
20. PDL-1 targeting in resectable oesophageal cancer (PERFECT). ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/record/NCT03087864.
21. Pembrolizumab with locally delivered radiation therapy for the treatment of metastatic esophageal cancers. ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02642809.
22. Demaria S, Ng B, Devitt ML et al. Ionizing radiation inhibition of distant untreated tumors (abscopal effect) is immune mediated. Int J Radiat Oncol Biol Phys 2004; 58 (3): 862–870. doi: 10.1016/j.ijrobp.2003.09.012.
23. First-line esophageal carcinoma study with chemo vs. chemo plus pembrolizumab (MK-3475-590/KEYNOTE-590). ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT03189719.
24. Phase II trial of pembrolizumab with trastuzumab and chemotherapy in advanced HER2 positive esophagogastric (EG) cancer. ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/record/NCT02954536.
25. Study of pembrolizumab (MK-3475) versus investigator‘s choice standard therapy for participants with advanced esophageal/esophagogastric junction carcinoma that progressed after first-line therapy (MK-3475-181/KEYNOTE-181). ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT02564263.
26. A study to evaluate efficacy in subjects with esophageal cancer treated with nivolumab and ipilimumab or nivolumab combined with fluorouracil plus cisplatin versus fluorouracil plus cisplatin (CheckMate 648). ClinicalTrials.gov. [online]. Available from: https: //clinicaltrials.gov/ct2/show/NCT03143153.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2018 Číslo 1- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Kurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
- Kontroverze protonové terapie u nádorů centrálního nervového systému
- Protinádorovou léčbou indukované změny renálních funkcí u pacientů s tumory – update aktuálních poznatků
- Editorial
- Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
- Nemelanómové zhubné nádory kože – klinicko-patologická štúdia pacientov s bazocelulárnym karcinómom a skvamocelulárnym karcinómom
- Chirurgická léčba ampulárního adenokarcinomu – zkušenosti jednoho centra a přehled literatury
- Pacientka se třemi EGFR mutacemi – postupný rozvoj rezistence na předchozí cílenou léčbu
- Stopkované laloky jako jedna z možností rekonstrukce hlavy a krku
-
Organizace a hodnocení kvality onkologické péče v České republice
Věstník Ministerstva zdravotnictví České republiky 2017; 13: 83–92 - Aktuality z odborného tisku
- prof. MUDr. Juraj Švec, DrSc. (16. 1. 1938–17. 2. 2017) K nedožitým 80. narodeninám emeritného prednostu Onkologickej kliniky LF UK v Bratislave
- Testování varianty androgenového receptoru AR-V7 pro výběr pacientů s kastračně refrakterním metastazujícím karcinomem prostaty k léčbě novými hormonálními léky
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chirurgická léčba ampulárního adenokarcinomu – zkušenosti jednoho centra a přehled literatury
- Kurkumin (Kurkumovník dlouhý – Curcuma longa) jako podpůrný fytoterapeutický prostředek v onkologii
- Stopkované laloky jako jedna z možností rekonstrukce hlavy a krku
- Současné postavení checkpoint inhibitorů v léčbě nádorů jícnu a žaludku – přehled studií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



