-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaExprese a purifikace proteinů
Protein Expression and Purification
Production of recombinant proteins is essential for many applications in both basic research and also in medicine, where recombinant proteins are used as pharmaceuticals. This review summarizes procedures involved in recombinant protein expression and purification, including molecular cloning of target genes into expression vectors, selection of the appropriate expression system, and protein purification techniques. Recombinant DNA technology allows protein engineering to modify protein stability, activity and function or to facilitate protein purification by affinity tag fusions. A wide range of cloning systems enabling fast and effective design of expression vectors is currently available. A first choice of protein expression system is usually the bacteria Escherichia coli. The main advantages of this prokaryotic expression system are low cost and simplicity; on the other hand this system is often unsuitable for production of complex mammalian proteins. Protein expression mediated by eukaryotic cells (yeast, insect and mammalian cells) usually produces properly folded and posttranslationally modified proteins. However, cultivation of insect and, especially, mammalian cells is time consuming and expensive. Affinity tagged recombinant proteins are purified efficiently using affinity chromatography. An affinity tag is a protein or peptide that mediates specific binding to a chromatography column, unbound proteins are removed during a washing step and pure protein is subsequently eluted.
Key words:
recombinant protein – molecular cloning – purification – expression system
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/ 2.1.00/ 03.0101) and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
22. 1. 2014Accepted:
20. 3. 2014
Autoři: E. Růčková; P. Müller; B. Vojtěšek
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 92-97
Souhrn
Metody exprese a purifikace rekombinantních proteinů umožňují produkci a detailní charakterizaci proteinů v základním výzkumu během in vitro experimentů, ale také přípravu proteinů s terapeutickým využitím. Publikace shrnuje základní postupy od přípravy expresních vektorů až po techniku afinitní purifikace. Dále pojednává o vlastnostech různých prokaryotických a eukaryotických expresních systémů a možnostech jejich využití. Molekulární klonování, které slouží k přípravě expresních vektorů pro rekombinantní proteiny, umožňuje cíleně modifikovat vlastnosti těchto proteinů tak, aby byla usnadněna jejich purifikace a také pozměněna jejich stabilita, aktivita nebo funkce. V současné době je k dispozici široká škála metodických přístupů, jež umožňují rychlou a efektivní přípravu expresních vektorů. Zvolený produkční organizmus a způsob purifikace rekombinantního proteinu určují výběr expresního vektoru. První volbou často bývá expresní systém využívající bakterii Escherichia coli, jehož přednostmi jsou zejména technická, časová i finanční nenáročnost. Tento expresní systém není příliš vhodný pro produkci komplexních savčích proteinů, pro které jsou optimální expresní systémy založené na využití eukaryotických organizmů (kvasinky, hmyzí buňky nebo savčí buňky). Kultivace hmyzích a savčích buněk je však technicky i finančně náročná. Rekombinantní proteiny jsou purifikovány nejčastěji metodou afinitní chromatografie využívající specifickou interakci peptidu nebo proteinu s afinitní matricí. Tyto peptidy či proteiny jsou fúzovány s N ‑ nebo C ‑ koncem purifikovaného proteinu. Purifikace probíhá ve třech krocích, kdy je rekombinantní protein prostřednictvím afinitních značek specificky zachycen na matrici chromatografické kolony, dále následuje promývací krok, po kterém je uvolněn z kolony čistý protein.
Klíčová slova:
rekombinantní protein – molekulární klonování – purifikace – expresní systémÚvod
Purifikované proteiny mají v současné době široké využití nejen v základním výzkumu, ale i v aplikovaném výzkumu jako terapeutické látky pro léčbu různých onemocnění od hemofilie po komplexní protinádorovou terapii nebo výrobu vakcín. Proteiny využívané v medicíně musí splňovat přísná kritéria (např. je omezeno použití antibiotik a jiných toxických látek), a proto jsou pro jejich produkci vyvíjeny speciální expresní systémy. Předkládaná publikace je tudíž zaměřena na popis obecných metod purifikace proteinů využívaných v základním výzkumu.
Purifikace proteinů je obecně sled procesů vedoucích k získání jediného proteinu z komplexní směsi. Izolovat čisté proteiny je nezbytné pro řadu in vitro experimentů, mezi něž patří charakterizace jejich funkce, struktury a vzájemných interakcí, a které dále dovolují objasnit jejich úlohu v biologických systémech. Ve většině případů jsou pro účely purifikace připravovány rekombinantní proteiny metodou molekulárního klonování, která umožňuje protein podle potřeby modifikovat. Geny kódující požadované proteiny jsou vloženy do expresních vektorů a ty jsou vpraveny do různých prokaryotických nebo eukaryotických buněk, jež poté zajistí syntézu rekombinantních proteinů. Purifikaci těchto proteinů usnadňuje připojení afinitních značek (tagů) a použití metod afinitní chromatografie, které jsou založeny na specifické vazbě těchto značek na chromatografickou kolonu. Na kvalitu i kvantitu purifikovaných proteinů jsou kladeny vysoké nároky, a proto jsou neustále vyvíjeny nové metodické přístupy.
Historický přehled
Proteiny jsou studovány a purifikovány už více než 200 let. Již v roce 1789 izoloval Antoine Fourcroy z rostlin látky, které se svými vlastnostmi podobaly vaječnému bílku. Avšak až o téměř 50 let později, v roce 1838, tyto látky blíže popsal chemik Gerhardus Johannes Mulder a v témže roce pro ně navrhl Jöns Jacob Berzelius název protein (vycházející z řeckého slova proteos – první v řadě). Do začátku 20. století byly jediné známé metody separace proteinů filtrace, precipitace či krystalizace, přičemž některé z těchto technik jsou používány dodnes. Takto např. Felix Hoppe ‑ Seyler v roce 1840 připravil první krystaly hemoglobinu nebo Franz Hofmeister v roce 1889 opakovanou krystalizací purifikoval ovalbumin. První separace proteinů na koloně byla provedena v roce 1903 botanikem Mikhailem Tswettem, který na matrici z uhličitanu vápenatého separoval rostlinné pigmenty a následně v roce 1906 pro tuto metodu zavedl pojem chromatografie. Další technika separace proteinů, centrifugace, byla vyvinuta Theodorem Svedbergem v roce 1924. V následujících letech byl vynalezen princip elektroforézy, afinitní chromatografie a iontově výměnné chromatografie (ion exchange chromatography – IEX). Od 50. let 20. století následoval intenzivní vývoj různých typů hydrofilních chromatografických matricí. Nejprve byl využit škrob či upravený dextran Sephadex pro rozlišení proteinů podle velikosti [1]. Později byly připraveny další hydrofilní materiály pro elektroforézu a chromatografii, jako např. polyakrylamid [2], metakrylát [3], agaróza [4] nebo porézní křemík [5]. Výrobu moderních matricí pro afinitní chromatografii umožnil objev metody navázání ligandů k polysacharidům (např. v agaróze) kovalentní vazbou [6]. V průběhu následujících let byl vyvinut velký počet chromatografických médií a souběžně také různé techniky purifikace proteinů včetně automatizovaných chromatografických systémů, jako třeba FPLC (fast protein liquid chromatography).
Zpočátku byly proteiny purifikovány z jejich přirozených zdrojů, což bylo technicky i finančně náročné. Proto se počáteční analýzy soustředily na proteiny, které mohou být purifikovány ve velkých množstvích, a to např. z krve, vaječného bílku, nebo trávicí enzymy získané ze zvířat na jatkách. Takto byl koncem 50. let firmou Armour & Co., jež působila v masném průmyslu, purifikován kilogram bovinní pankreatické ribonukleázy (RNázaA), který byl věnován pro vědecké účely. Snadno a rychle dostupná RNázaA se stala základním proteinem pro biochemické analýzy, na jejichž základě byla dokonce Christianu Anfinsenovi, Stanfordu Mooreovi a Williamu H. Steinovi udělena v roce 1972 Nobelova cena za chemii.
Mohutný nárůst technologií purifikace proteinů nastal po objevu metody přípravy rekombinantní DNA na počátku 70. let 20. století [7 – 9]. Molekulární klonování tak umožnilo heterologní expresi zvoleného proteinu v hostitelském organizmu (expresním systému), nejčastěji v bakterii Escherichia coli (E. coli). Touto technologií lze vytvářet také fúzní (chimérické) proteiny s přidanými afinitními značkami (tagy), které výrazně usnadňují purifikaci a zvyšují výtěžek a čistotu za použití univerzálních purifikačních postupů. Dále lze přidávat reportérové sekvence, např. fluorescenční proteiny, jež umožňují sledovat expresi proteinů in vivo přímo v buňce. Díky těmto expresním systémům je dosažena mnohem vyšší koncentrace studovaného proteinu, než jaká se v buňce přirozeně nachází.
Příprava expresních vektorů
Vektory v molekulární biologii slouží k přepravě cizorodé DNA do hostitelské buňky, kde je tato DNA replikována a/ nebo exprimována. Nejběžnější typ vektoru jsou plazmidy, cirkulární molekuly extrachromozomální DNA, které se v bakteriální buňce autonomně množí a přenášejí se při dělení do následujících generací. Často jsou využívány také virové vektory, což jsou rekombinantní viry, jež mají část genomu nahrazenu expresní kazetou, která po infekci (transdukci) hostitelských buněk zajistí produkci rekombinantního proteinu. Alternativou ke klasickým klonovacím systémům, ve kterých je vložení cizorodé DNA založeno na restrikčním štěpení a následné ligaci, jsou systémy založené na rekombinaci, jež umožňují snadné a efektivní klonování požadovaných genů. K dispozici je několik komerčně dostupných expresních systémů využívajících rekombinaci, třeba Gateway (Life Technologies, USA) a Creator (Clontech, USA). Expresní systém Gateway využívá rekombinaci mezi dvěma heterologními sekvencemi, která je zprostředkována enzymy pocházejícími z bakteriofága lambda. Ty rozeznávají specifické signální sekvence ohraničující cílový gen (nazývané att sekvence) [10]. V prvním kroku je připraven univerzální vstupní vektor, který slouží jako základ pro vytvoření libovolných expresních vektorů (obr. 1). Mezi další mechanizmy klonování náleží např. TOPO klonování (Life Technologies, USA) nebo klonování nezávislé na ligaci LIC (ligation independent cloning) (dodávají různé firmy, jako třeba New England Biolabs, USA nebo Merck, Germany).
Obr. 1. Schematické znázornění principu klonovacího systému Gateway. Sekvence klonovaného genu je rekombinací zprostředkovanou BP klonázou vložena do donorového vektoru, čímž vznikne univerzální vstupní vektor. Sekvence klonovaného genu může být vložena do destinačního vektoru reakcí zprostředkovanou LR klonázou. Sekvence, mezi kterými probíhá rekombinace, jsou znázorněny červeně. Upraveno dle [24]. ![Schematické znázornění principu klonovacího systému Gateway.
Sekvence klonovaného genu je rekombinací zprostředkovanou BP klonázou vložena do donorového vektoru, čímž vznikne univerzální vstupní vektor. Sekvence klonovaného genu může být vložena do destinačního vektoru reakcí zprostředkovanou LR klonázou. Sekvence, mezi kterými probíhá rekombinace, jsou znázorněny červeně. Upraveno dle [24].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/85a1808d966cce66f776cd9754e6fa75.jpg)
Typy expresních systémů
Obecně je prvním krokem pro expresi v prokaryotických i eukaryotických buňkách vpravení vektoru, který obsahuje gen pro syntézu rekombinantního proteinu, do buňky. Dále následuje kultivace, během níž dochází k transkripci a translaci kódující DNA. Buňky jsou následně lyzovány a protein je purifikován. Vlastnosti jednotlivých expresních systémů jsou shrnuty v tab. 1.
Tab. 1. Shrnutí vlastností jednotlivých expresních systémů. 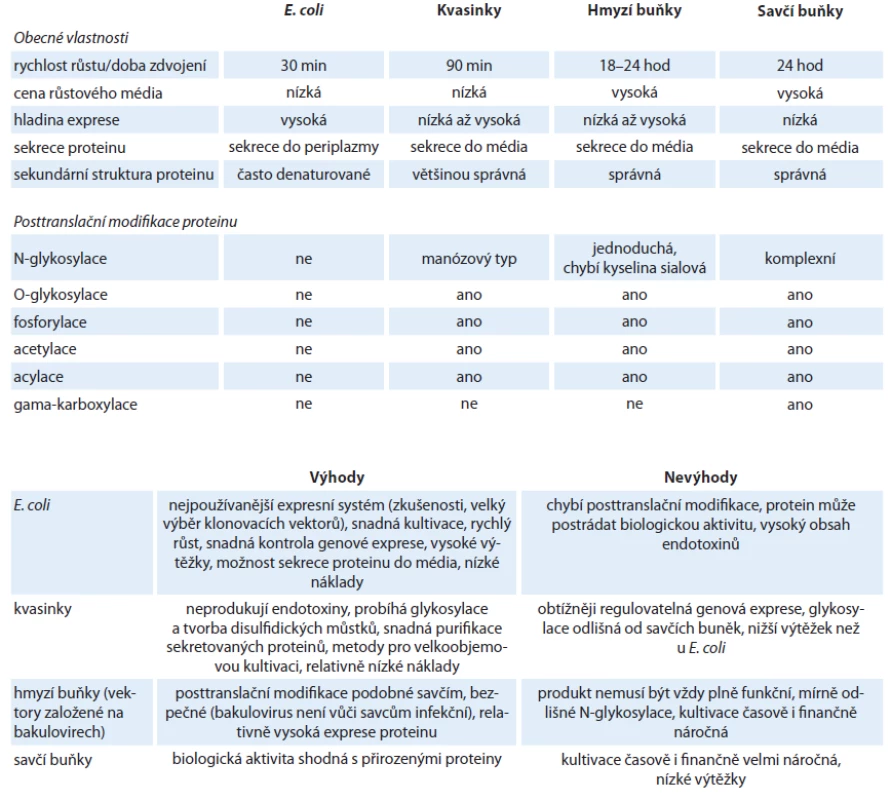
Nejčastěji používaným expresním systémem jsou bakterie E. coli, protože se snadno kultivují, rychle se množí a umožňují získat vysoké výtěžky rekombinantních proteinů. Velkou výhodou jsou nízké náklady na kultivační média. Pro expresi proteinů existuje široký výběr komerčních expresních vektorů, které umožňují použití řady N ‑ i C ‑ koncových tagů, stejně jako dostatek různých expresních kmenů optimalizovaných pro speciální aplikace. Exprese rekombinantních proteinů může být u E. coli řízena několika promotory. Nejčastěji je využíván silný promotor T7,dále pak lambda P1, trc nebo arabinózový promotor. Bakteriální expresní systém má však také mnoho nevýhod. Například problém s nedostatkem tRNA pro některé kodony převažující u eukaryotické mRNA byl vyřešen vytvořením expresních kmenů bakterií, které nesou plazmidy kódující tyto vzácné tRNA. Jedná se např. o kmeny BL21(DE3) CodonPlus (Stratagene, USA) nebo Rosetta (Merck, Germany). Závažnější omezení jako neexistující posttranslační úpravy a aparát molekulárních chaperonů, jež eukaryotickým proteinům zajišťují biologickou aktivitu, lze zatím řešit pouze částečně. Pracuje se na vytvoření kmenů, které zprostředkovávají alespoň jednoduchou glykosylaci [11,12] a chybějící chaperony je možno doplnit jejich ko ‑ expresí s požadovaným proteinem (Clontech, USA). Přes veškeré úsilí jsou zvláště velké multi‑doménové eukaryotické proteiny náchylné k denaturaci a vytváří nerozpustná inkluzní tělíska. Pro jejich solubilizaci jsou vyžadovány speciální postupy, mezi které patří úplná denaturace a následná renaturace.
Nejjednodušší eukaryotický expresní systém využívá kvasinky, jednobuněčné organizmy, které lze snadno kultivovat v suspenzi podobně jako E. coli. Jejich výhodou je schopnost provádět jednoduché posttranslační modifikace, možnost kultivace do vysokých hustot a nízké náklady na kultivační média. Nejčastěji jsou využívány kmeny Saccharomyces cerevisiae a Pichia pastoris.
Expresní systém využívající hmyzí buňky infikované bakuloviry poskytuje proteiny, které jsou posttranslačně modifikovány podobně jako v savčích buňkách. Replikace bakulovirů není závislá na pomocném viru, mohou být kultivovány i v suspenzních hmyzích buňkách a lze dosáhnout vysoké multiplicity infekce. Nevýhodou hmyzích buněk jsou ale vyšší náklady na kultivaci a větší náročnost na čas i odbornou manipulaci. Existuje několik typů expresních systémů lišících se ve způsobu přípravy rekombinantního bakuloviru, např. homologní rekombinací, transpozicí nebo technologií Gateway. Posledně jmenovaná metoda je využita v systému BaculoDirect (Life Technologies, USA), který umožňuje vložení požadovaného genu přímo do virového genomu, čímž se výrazně zkracuje doba pro vytvoření infekčního viru. Exprese genu je řízena silným polyhedrinovým promotorem, jenž zajišťuje vysokou hladinu rekombinantního proteinu.
Savčí buňky produkují rekombinantní proteiny, které jsou ve většině případů plně funkční a posttranslačně modifikované. Tento systém nabízí velkou metodickou variabilitu ve výběru produkční linie i ve způsobu vnesení expresního vektoru do buňky. Mezi často používané linie patří třeba HEK 293 (human embryonal kidney) a CHO (chinese hamster ovary), které se vyznačují vysokou rychlostí růstu a schopností snadno přijímat heterologní DNA. Exprese rekombinantních proteinů je řízena konstitutivně aktivními promotory. Nejčastěji se jedná o promotory odvozené z viru SV40 (simian virus 40) nebo CMV (cytomegalovirus) a méně jsou využívány nevirové promotory např. elongačního faktoru EF ‑ 1 α. Vyšší hladiny exprese lze dosáhnout u sekretovaných proteinů, zatímco exprese vnitrobuněčných proteinů je výrazně nižší. Využití plazmidových vektorů pro tranzientní expresi je nejrychlejší metoda produkce rekombinantních proteinů, neboť k jejich syntéze dochází ihned po vnesení vektoru do jádra. Plazmidové vektory lze také využít pro přípravu stabilních buněčných linií, které mají cizorodou DNA začleněnu ve své genomové DNA, a tudíž trvale exprimují rekombinantní protein. Příprava virových vektorů je časově i technicky náročná a navíc podléhá vyššímu stupni bezpečnostní kontroly. Výhodou jsou pak vysoké výtěžky rekombinantních proteinů a možnost použití pro velkoobjemové kultivace.
Adenovirové vektory [13] patří mezi oblíbené expresní systémy, které jsou dostupné v mnoha modifikacích metody přípravy rekombinantního virového genomu. Jedná se např. o komerčně dostupné systémy ViraPower (Life Technologies, USA), jenž je kompatibilní s klonovacím systémem Gateway, AdEasy (Agilent Technologies, USA) nebo AdenoX (Clontech, USA). Adenoviry jsou jednoduché viry s neobalenou ikozaedrální kapsidou a jejich genom je tvořen dvouřetězcovou lineární DNA. Genom adenovirů bylo možno upravit na klonovací vektor tak, že skupiny genů rané fáze exprese E1 a E3 byly deletovány a na místo genů E1 byla vložena expresní kazeta. Delecí genů E1 a E3 ztratil adenovirus schopnost replikace a pro vytvoření virového potomstva musí být tato funkce komplementována tzv. pomocnými buňkami. Jako pomocná linie je využívána třeba buněčná linie HEK 293,která tyto geny získala díky tomu, že byla vytvořena transformací embryonálních buněk ledvin adenovirovou DNA [14]. Pro expresi rekombinantního proteinu je vhodná jakákoli buněčná linie, jež neobsahuje geny E1 a E3. Po transdukci tak nedochází k replikaci viru a následné lýze hostitelské buňky, a produkce rekombinantního proteinu proto může v buňce neomezeně probíhat.
Expresní vektory vycházející z retrovirů [15], a zejména z rodu Lentivirus, umožňují vkládat cizorodé geny do genomu hostitelských buněk a zajistit tak stabilní expresi rekombinantního proteinu. Retroviry jsou RNA viry, avšak v průběhu jejich životního cyklu vzniká intermediát tvořený dvouřetězcovou DNA, který je následně začleněn do genomu hostitelské buňky. Využití retrovirových a lentivirových vektorů sahá od základního výzkumu až po genovou terapii [16].
In vitro (bezbuněčná) syntéza proteinů využívá schopnost buněčných extraktů syntetizovat proteiny, neboť obsahují složky nutné pro transkripci, translaci a dokonce posttranslační modifikace. Mezi tyto složky patří hlavně RNA polymeráza, transkripční faktory, ribozomy a tRNA. Po přidání templátu (a kofaktorů a nukleotidů) je protein během několika hodin syntetizován. Přestože jsou výtěžky proteinů nízké, má tento systém několik výhod, např. pro značení proteinů modifikovanými aminokyselinami nebo pro syntézu proteinů toxických pro biologické systémy. Také odpadá zdlouhavá kultivace hostitelských organizmů, což usnadňuje expresi mnoha různých proteinů zároveň (třeba pro screening mutací).
Chemická syntéza proteinů je využívána např. pro inkorporaci nepřírodních aminokyselin nebo značení proteinů na specifických místech. Syntetizovaný protein je velmi čistý, ale metoda je limitována počtem aminokyselin, nízkým výtěžkem a rovněž vysokými náklady.
Metody purifikace proteinů
Proces purifikace je výrazně usnadněn, pokud je cílový protein opatřen afinitní značkou. Prvním krokem je v tom případě afinitní chromatografie, při níž je protein díky své afinitní značce specificky zachycen na chromatografické koloně. Nenavázané proteiny jsou v promývacím kroku odmyty a čistý protein uvolněn specificky přidáním kompetitivního ligandu nebo nespecificky změnou pH, iontové síly či polarity (obr. 2).
Obr. 2. Schéma afinitní purifikace. V prvním kroku afinitní purifikace je proteinová směs nanesena na kolonu, kde se cílový protein specificky a reverzibilně váže na ligandy zachycené na chromatografické matrici. V další fázi jsou během promývacího kroku nenavázané proteiny odmyty. Cílový protein je poté uvolněn změnou podmínek prostředí, tak aby bylo preferováno uvolnění komplexu protein-ligand. 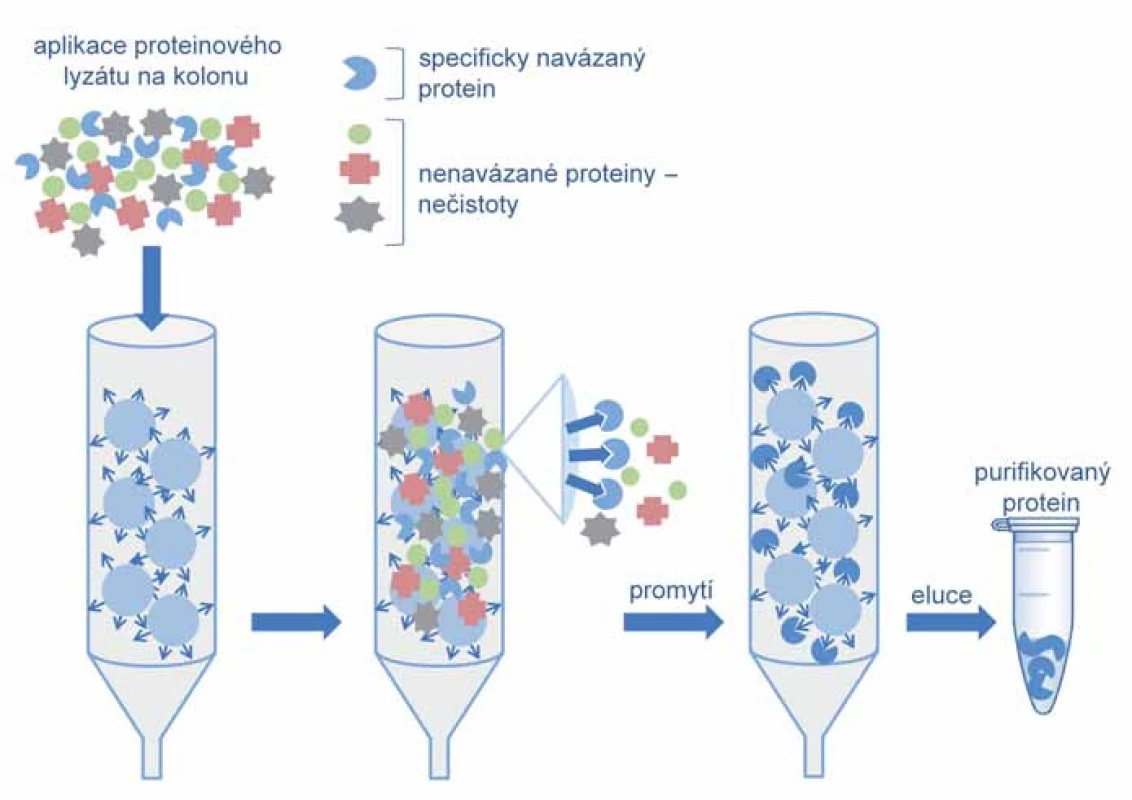
Purifikační metoda je určena výběrem afinitní značky, tagu. Tyto afinitní tagy umožňují použití univerzálních purifikačních metod, neboť na chromatografické koloně je protein zachycen právě svou afinitní značkou. Mezi nejpoužívanější afinitní značky patří glutathion S ‑ transferáza (GST) [17] a polyhistidin (His6) [18], dále se využívají např. Strep ‑ tag [19], SBP ‑ tag (streptavidin binding peptide) [20] a MBP ‑ tag (maltose binding protein) [21]. GST‑tag je proteinová afinitní značka o velikosti 27 kDa, což může negativně ovlivňovat hladinu exprese rekombinantních proteinů. Na druhou stranu však byl pozorován pozitivní vliv na solubilitu některých rekombinantních proteinů [22]. Vazebná kinetika GST‑tagu ke glutathionové chromatografické matrici je pomalá, a proto se prodlužuje nanášení vzorku na kolonu, což je limitující faktor pro purifikaci proteinu z velkých objemů. His ‑ tag je naopak velmi malý, neovlivňuje sekundární strukturu rekombinantních proteinů a jeho vazba ke chromatografické matrici IMAC (immobilised metal affinity chromatography) je rychlá, avšak méně specifická než v případě GST‑tagu. Pro dosažení vysoké čistoty proteinu je často využíváno tandemové zařazení afinitních značek pro purifikaci ve dvou následných krocích. Přítomnost afinitní značky může v mnoha směrech ovlivnit vlastnosti rekombinantního proteinu, a proto se hojně využívá jeho enzymatického odštěpení. Na trhu je k dispozici několik proteáz (např. TEV proteáza, PreScission proteáza, Enterokináza, Faktor Xa nebo trombin), jejichž cílové rozpoznávací sekvence mohou být vloženy mezi afinitní značku a vlastní protein. Štěpení může být provedeno v roztoku proteinu, nebo přímo na chromatografické koloně. Proteáza může být také označena afinitní značkou a po ukončení inkubace spolu s odštěpenou značkou odstraněna na chromatografické koloně.
V případě nedostatečné čistoty proteinu po afinitní purifikaci je možné zahrnout dodatečné purifikační kroky, které separují proteiny podle specifických vlastností. Metoda gelové filtrace (GF)dokáže separovat molekuly podle velikosti, hydrofobní interakční chromatografie (HIC) a reverzně fázová chromatografie (RPC) podle rozdílů jejich hydrofobicity, iontově výměnná chromatografie (IEX) podle povrchového náboje nebo chromatofokusace podle izoelektrického bodu.
Metoda afinitní chromatografie, která využívá schopnosti bakteriálních receptorů nazvaných Protein A a Protein G vázat imunoglobuliny, začala být intenzivně používána po objevu technologie přípravy monoklonálních protilátek. Tato technologie umožňuje vytvoření stabilních fúzních buněčných linií, jež produkují jeden typ selektované protilátky [23]. Tak bylo získáno velké množství specifických protilátek, které se následně staly významným nástrojem pro vědu i farmaceutický průmysl.
Závěr
Díky neustále se zvyšujícím požadavkům na kvalitu i kvantitu purifikovaných proteinů a také na zjednodušení a zrychlení procesu jejich přípravy dochází k dynamickému rozvoji technologií pro expresi a purifikaci rekombinantních proteinů. Široká škála expresních systémů využívajících prokaryotické i eukaryotické produkční organizmy umožňuje zvolit systém pro produkci proteinu splňujícího požadovaná kritéria. Při výběru vhodného expresního systému je potřeba zohlednit několik faktorů. V prvé řadě záleží na tom, zda je zvolený protein eukaryotického nebo prokaryotického původu. V případě exprese savčího proteinu v expresních systémech jiných organizmů musíme počítat s rizikem nesolubility proteinu a možností odlišných nebo dokonce chybějících posttranslačních modifikací. Dále je potřeba zvážit požadované množství purifikovaného proteinu, časovou náročnost metody, finanční hledisko a v případě virových expresních systémů také legislativní a bezpečnostní požadavky.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/ 2.1.00/ 03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Eva Růčková
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e‑mail: ruckova@mou.cz
Obdrženo: 22. 1. 2014
Přijato: 20. 3. 2014
Zdroje
1. Porath J, Flodin P. Gel filtration: a method for desalting and group separation. Nature 1959; 183(4676): 1657 – 1659.
2. Raymond S, Weintraub L. Acrylamide gel as a supporting medium for zone electrophoresis. Science 1959; 130(3377): 711.
3. Curtain CC. Chromatography of proteins and peptides on diethylaminoethyl methacrylate gels. Anal Biochem 1963; 6 : 512 – 519.
4. Hjerten S. The preparation of agarose spheres for chromatography of molecules and particles. Biochim Biophys Acta 1964; 79 : 393 – 398.
5. Weetall HH. Preparation and characterization of an arylsulphatase insolubilized on porous glass. Nature 1971; 232(5311): 473 – 474.
6. Axén R, Porath J, Ernback S. Chemical coupling of peptides and proteins to polysaccharides by means of cyanogen halides. Nature 1967; 214(5095): 1302 – 1304.
7. Jackson DA, Symons RH, Berg P. Biochemical method for inserting new genetic information into DNA of Simian Virus 40: circular SV40 DNA molecules containing lambda phage genes and the galactose operon of Escherichia coli. Proc Natl Acad Sci USA 1972; 69(10): 2904 – 2909.
8. Lobban PE, Kaiser AD. Enzymatic end‑to end joining of DNA molecules. J Mol Biol 1973; 78(3): 453 – 471.
9. Cohen SN, Chang AC, Boyer HW et al. Construction of biologically functional bacterial plasmids in vitro. Proc Natl Acad Sci USA 1973; 70(11): 3240 – 3244.
10. Landy A. Dynamic, structural, and regulatory aspects of lambda site ‑ specific recombination. Annu Rev Biochem 1989; 58 : 913 – 949.
11. Wacker M, Linton D, Hitchen PG et al. N‑linked glycosylation in Campylobacter jejuni and its functional transfer into E. coli. Science 2002; 298(5599): 1790 – 1793.
12. Valderrama‑Rincon JD, Fisher AC, Merritt JH et al. An engineered eukaryotic protein glycosylation pathway in Escherichia coli. Nat Chem Biol 2012; 8(5): 434 – 436. doi: 10.1038/ nchembio.921.
13. Berkner KL. Expression of heterologous sequences in adenoviral vectors. Curr Top Microbiol Immunol 1992; 158 : 39 – 66.
14. Graham FL, Smiley J, Russell WC et al. Characteristics of a human cell line transformed by DNA from human adenovirus type 5. J Gen Virol 1977; 36(1): 59 – 74.
15. Stephenson JR, Khan AS, van de Ven WJ et al. Type Cretroviruses as vectors for cloning cellular genes with probable transforming function. J Natl Cancer Inst 1979; 63(5): 1111 – 1119.
16. Cavazzana ‑ Calvo M, Hacein‑Bey S, de Saint Basile G et al. Gene therapy of human severe combined immunodeficiency (SCID) - X1 disease. Science 2000; 288(5466): 669 – 672.
17. Smith DB, Johnson KS. Single‑step purification of polypeptides expressed in Escherichia coli as fusions with glutathione S ‑ transferase. Gene 1988; 67(1): 31 – 40.
18. Hochuli E. Purification of recombinant proteins with metal chelate adsorbent. Genet Eng (NY) 1990; 12 : 87 – 98.
19. Schmidt TG, Skerra A. One ‑ step affinity purification of bacterially produced proteins by means of the “Strep tag” and immobilized recombinant core streptavidin. J Chromatogr A 1994; 676(2): 337 – 345.
20. Keefe AD, Wilson DS, Seelig B et al. One ‑ step purification of recombinant proteins using a nanomolar ‑ affinity streptavidin‑binding peptide, the SBP ‑ Tag. Protein Expr Purif 2001; 23(3): 440 – 446.
21. Chen GQ, Gouaux JE. Overexpression of bacterio ‑ opsin in Escherichia coli as a water ‑ soluble fusion to maltose binding protein: efficient regeneration of the fusion protein and selective cleavage with trypsin. Protein Sci 1996; 5(3): 456 – 467.
22. Braun P, LaBaer J. High throughput protein production for functional proteomics. Trends Biotechnol 2003; 21(9): 383 – 388.
23. Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256(5517): 495 – 497.
24. Hunt I. From gene to protein: a review of new and enabling technologies for multi‑parallel protein expression. Protein Expr Purif 2005; 40(1): 1 – 22.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



