-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaModerní zobrazovací techniky pro antracyklinová cytostatika – literární přehled
Modern Imaging Techniques for Anthracycline Cytostatics – Review of the Literature
Anthracycline cytostatics can be observed at the level of organelles, cells and whole organisms due to their fluorescent properties. Imaging techniques based on detection of fluorescence can be used not only for observation of drug interaction with tumor cells, but also for targeting therapy of tumors with nanoparticles containing anthracycline cytostatics. Doxorubicin and daunorubicin, enclosed in liposomes, as representatives of nanoparticles suitable for targeted therapy, are used in clinical practice. The main advantage of liposomal drugs is to reduce the side effects due to differences in pharmacokinetics and distribution of the drug in the body. Due to the fact that all biological mechanisms of action of anthracycline drugs are not still fully understood, modern imaging techniques offer tool for in vivo studies of these mechanisms.
Key words:
nanomedicine – cytostatic agents – drug delivery systems – doxorubicin – liposomes
Autoři: I. Blažková 1; M. Ryvolová 1,2; S. Křížková 1,2; E. Jílková 1; P. Kopel 1,2; T. Eckschlager 3; M. Stiborová 4; V. Adam 1,2; R. Kizek 1,2
Působiště autorů: Ústav chemie a biochemie, Agronomická fakulta Mendelovy univerzity v Brně2 CEITEC – Středoevropský technologický institut, VUT v Brně3 Klinika dětské hematologie a onkologie 2. LF UK a FN v Motole, Praha4 Katedra biochemie, Přírodovědecká fakulta UK v 1
Vyšlo v časopise: Klin Onkol 2013; 26(4): 239-244
Kategorie: Přehledy
Souhrn
Antracyklinová cytostatika lze pozorovat na úrovni organel, buněk i celých organizmů díky jejich fluorescenčním vlastnostem. Zobrazovací techniky na bázi detekce fluorescence mohou být použity nejen pro pozorování interakce léčiva s nádorovými buňkami, ale také mohou sloužit pro cílení léčby nádorů nanočásticemi s obsahem antracyklinového cytostatika. V klinické praxi je využíván doxorubicin a daunorubicin uzavřený do lipozomů jako zástupce nanočástic vhodných pro cílenou léčbu. Hlavní výhodou lipozomálních preparátů je omezení nežádoucích účinků v důsledku rozdílné farmakokinetiky a distribuce léku v organizmu. Vzhledem k tomu, že stále nejsou prozkoumány všechny biologické mechanizmy účinku antracyklinových léčiv, nabízejí moderní zobrazovací techniky nástroj pro in vivo studium těchto mechanismů.
Klíčová slova:
nanomedicína – cytostatika – doprava léčiv – doxorubicin – lipozomyÚvod
Nanomedicína je moderní obor zabývající se medicínskými aplikacemi nanotechnologií. Je založena na třech vzájemně se překrývajících oblastech, především na: 1. nanostrukturních materiálech s potenciálem pro konstrukci diagnostických nanosenzorů; 2. prostředcích pro cílenou distribuci léčiv a vývoji inteligentních léků; 3. molekulární medicíně a vývoji molekulárních strojů, které umožní rychlou diagnostiku následovanou odstraněním defektu (likvidací patogenu, opravou chromozomu, nanochirurgickými zákroky). Nejpropracovanější aplikace nanomedicíny je možné najít v oblastech diagnostických senzorů, zobrazovacích metod, v chirurgických oborech a farmakoterapii [1,2].
Klinicky ověřovaná léčiva na bázi nanotechnologií
V oblasti základního i aplikovaného výzkumu probíhá intenzivní vývoj nanoléčiv (léků enkapsulovaných v nanočásticích nebo absorbovaných na jejich povrchu). Převážně z technologických důvodů je nejrozšířenější enkapsulace léčiv v lipozomech. Autoři přehledového článku [3] uvádějí, že je k dispozici pět cytostatických preparátů na bázi lipozomů, z toho ve třech případech je účinnou látkou doxorubicin, v jednom daunorubicin a v jednom cytosin arabinosid. V České republice a na Slovensku jsou registrovány čtyři přípravky na bázi nanotechnologií, a to doxorubicin a cytarabin enkapsulované v lipozomech (Caelyx, Myocet a DepoCyte) a paclitaxel navázaný na albuminové nanočástice (Abraxane), viz údaje v databázích Státního ústavu pro kontrolu léčiv (www.sukl.cz) a Štátného ústavu pre kontrolu liečiv (www.sukl.sk). Další léčiva jsou ve fázi klinických studií, z toho je účinnou látkou doxorubicin, cisplatina a analog cis-platiny L ‑ NDDP. Intenzivně se testují další cytostatické látky: paclitaxel, mitoxantron, vincristin, tretinoin, campthotecin, lurtotecan, vinorelbin, topotecan, annamycin, cytarabin a aktivní metabolit irinotecanu SN ‑ 38. Kromě protinádorových léků jsou využívány i jiné lipozomální preparáty (lipozomální amfotericin B, mifamurtid, morfin k epidurální aplikaci nebo některé virové vakcíny) [3]. Dále je pod názvem Abraxane dostupný paclitaxel navázaný na albumin pomocí technologie NaB (Nanoparticle albumin‑bound technology). Tento lék je v některých státech registrován pro léčbu karcinomu prsu při selhání chemoterapie na bázi antracyklinů. Ve fázi klinických studií je preparát docetaxelu na bázi polymerních nanočástic (Genexol ‑ PM) [4].
Nanočástice pro cílený transport doxorubicinu
Vzhledem k faktu, že doxorubicin patří mezi nejpoužívanější cytostatika (akutní myeloidní i lymfoidní leukemie, neuroblastom, Hodgkinův lymfom, karcinomy prsu, plic, močového měchýře a další) [5 – 7], je upravován za využití nanotechnologií s cílem snížit toxické účinky. Je dobře známo, že použití doxorubicinu je limitováno jeho vysokou kardiotoxicitou. Při překročení kumulativní dávky, která je 400 mg/ m2 (některé zdroje udávají i 450 mg/ m2 [8] nebo 570 mg/ m2 [9]), se výrazně zvyšuje riziko vzniku kardiomyopatie. Proto je při dosažení této kumulativní dávky nutné volit jinou, mnohdy méně efektivní léčbu [10 – 12]. Jednou z možností snížení kardiotoxicity doxorubicinu jsou různé metody jeho cíleného transportu.
Enkapsulace doxorubicinu
Nově připravené nanomateriály umožnily zkoumání pasivní i aktivní cílené strategie využitelné pro léčbu nádorů [13 – 15]. Specifické nosiče by měly dopravit léčivo do konkrétního místa působení, a zacílit tak léčbu jen na danou tkáň, soubor buněk, jednotlivou buňku či na buněčné kompartmenty [8,16]. Cílenou léčbou lze účinně omezit nežádoucí účinky terapie a potlačit některé ze známých mechanizmů rezistence nádorových buněk.
Lipozomální formy doxorubicinu
Mezi perspektivní lékové formy využitelné při řízeném uvolňování a cílené distribuci léčiv patří komplexy léčiv s polymery (obr. 1), jako jsou biologicky rozložitelné mikročástice, dendrimery, lipozomální lékové formy, nosiče na bázi bílkovin a další [9,10]. Lipozomy jsou váčky tvořené z dvojvrstvy složených lipidů (fosfolipidů), přičemž jejich polární část je orientována do vodné fáze. Mohou být jednovrstevné nebo vícevrstevné a jejich velikost se pohybuje od 400 nm do 2,5 µm [11]. Farmakokinetika a biodistribuce lipozomů závisí na jejich velikosti, náboji na povrchu a složení membrány [12]. Selektivitu lze zvýšit navázáním protilátek proti antigenu specifickému pro nádor nebo peptidů vážících se na nádorové endotelie na povrch lipozomů [17]. Lipozomy umožňují delší setrvání doxorubicinu v krevním oběhu, zlepšují jeho stabilitu a dostupnost pro nádorovou tkáň [18]. Lipozomální doxorubiciny dodávané pod firemním názvem Myocet a Doxil byly první nanočástice s cytostatiky schválené pro klinické účely. Tyto preparáty se liší přítomností polyetylenglykolové vrstvy (PEG) u Doxilu a fosfatidylcholinu z vaječného žloutku (EPC/ Chol) u Myocetu [3,19,20]. Z klinických studií vyplývá, že obě tato léčiva mají delší poločas cirkulace v krvi v porovnání s volnou látkou, přičemž Doxil jej má delší než Myocet. Srovnání volného doxorubicinu a Myocetu u pacientek s metastazujícím karcinomem prsu neprokázalo rozdíl v léčebných výsledcích. Přežití v prvním roce bylo 64 % ku 69 % a průměrné přežití bez progrese 3,8 ku 4,3 měsíce. Výhodou je nízký výskyt kardiotoxicity u Myocetu oproti volnému doxorubicinu (13 % v porovnání s 29 %) [3]. V současnosti jsou lipozomální cytostatika registrována pro léčbu Kaposiho sarkomu, karcinomu ovarií a prsu [4,21 – 23].
Obr. 1. Schéma vybraných nosičů na bázi nanočástic: lipozomy, magnetizovatelné částice, apoferitin, uhlíkové nanomateriály (A – nanotrubice, B – fullereny, C – grafen), virové vektory. 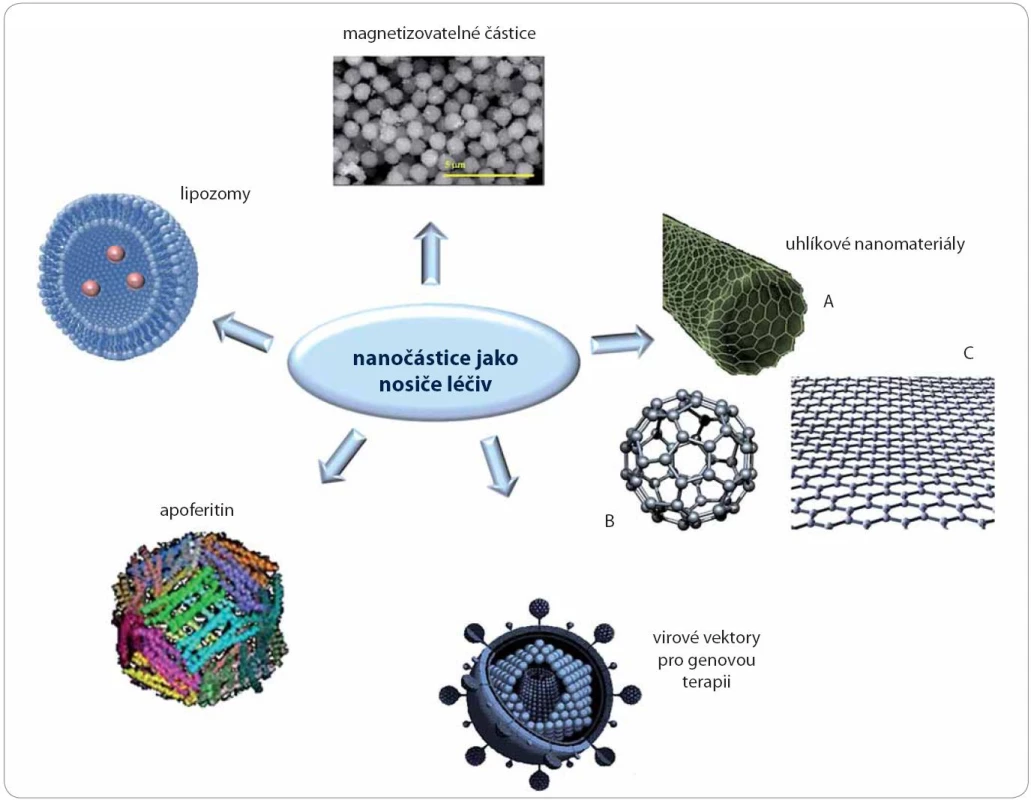
Apoferitinové formy doxorubicinu
Další, zatím experimentální možností je enkapsulace doxorubicinu feritinem. Feritin je bílkovina běžně se vyskytující v buňkách a tělních tekutinách, která ve své struktuře váže železo ve formě hydroxid-oxidu železitého [24]. Je tvořen 24 bílkovinnými jednotkami uspořádanými do tvaru koule. Uvnitř této struktury se nachází dutina o velikosti 8 nm, do které se může v organizmu uložit až 4 500 atomů železa, které je tak udržováno v rozpustné formě [25,26]. Bez přítomnosti iontů železa se protein nazývá apoferitin (obr. 2) a do jeho dutiny lze uzavřít jinou látku. Strukturu apoferitinu lze jednoduše ovlivňovat změnami pH, a tím řídit enkapsulaci látek do jeho dutiny, stejně jako jejich uvolnění [26], jak je schematicky zobrazeno na obr. 2.
Obr. 2. A. Schéma vlivu pH na strukturu apoferitinu. Obr. 2 B. Chemický vzorec doxorubicinu (7S,9S)-7-[(2R,4S,5S,6S)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7H-tetracene-5,12-dione. ![A. Schéma vlivu pH na strukturu apoferitinu. Obr. 2 B. Chemický vzorec doxorubicinu (7S,9S)-7-[(2R,4S,5S,6S)-4-amino-5-hydroxy-6-methyloxan-2-yl]oxy-6,9,11-trihydroxy-9-(2-hydroxyacetyl)-4-methoxy-8,10-dihydro-7H-tetracene-5,12-dione.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/6bd4584cd2cd0c0005026c7978909c49.jpg)
Uhlíkové nanočástice pro doxorubicin
Uhlíkové nanotrubice (CNTs) jsou duté grafitové nanomateriály (2 – 20 nm v průměru), které mohou být tvořeny jednou nebo více stěnami (SWCNT, MWCNT) [27]. V oblastech biomedicíny jsou CNTs velmi užitečné v diagnostice (Raman, fluorescenční a radiologické zobrazování) [28,29]. Mají vynikající strukturní, optické a elektrické vlastnosti a díky snadnému pronikání přes buněčnou membránu se zdají být dobrým nástrojem pro vývoj pokročilých nosičů léčiv [27,30 – 32]. Doxorubicin navázaný na povrch či do dutiny uhlíkové nanočástice (π ‑ π interakce) může být s daleko větší účinností selektivně dopraven do nádorových buněk [32,33]. Vazba doxorubicinu na uhlíkové nanotrubice je možná za běžných podmínek, oproti tomu k jejich uvolnění je nutné nízké pH [34]. Nová léčiva na bázi doxorubicinu vázaného na CNTs vykazují zvýšený terapeutický efekt ve srovnání s nemodifikovaným doxorubicinem nebo doxilem, proto mohou uhlíkové nanotrubice konjugované s lipozomálním doxorubicinem sloužit jako další platforma pro cílenou aplikaci léčiva do buněk [27]. Na druhou stranu je třeba počítat s relativně problematickým uvolňováním léčiva z povrchu CNTs [35]. Díky stejnému principu interakce lze stejným způsobem využít i adsorpci léčiva na uhlíkový materiál s obdobnou strukturou – grafen [36].
Z dalších uhlíkových materiálů vhodných pro enkapsulaci je nutné zmínit použití fullerenů [37]. Fullereny jsou „kulovité“ (často mnohostěnné) molekuly tvořené 20 a více atomy uhlíku. Pro své vlastnosti (velmi malá velikost molekuly, elektrické, antioxidační či antibakteriální vlastnosti) byly fullereny studovány pro potenciální biomedicínské aplikace [38]. Fullereny jsou schopny proniknout neporušenou kůží, a proto jsou vhodné jako nanoaplikace v buněčném a genovém transportu [39]. V současné době byly navrženy a jsou intenzivně zkoumány konjugáty fullerenů s běžně používanými cytostatiky, jako jsou doxorubicin, daunorubicin či paclitaxel [40]. Předběžné studie naznačují, že konjugát fullerenů s paclitaxelem je schopen dodávat větší množství paclitaxelu než běžně používané léčivo Abraxane®. Zvýšené množství paclitaxelu tak sníží infuzní čas a zvýší protinárodovou účinnost [41].
In vivo nanomedicínské zobrazování v onkologii
Fluorescenční mikroskopie a průtoková cytometrie
Fluorescenční mikroskopie a průtoková cytometrie jsou základními metodami používanými pro zobrazování na úrovni buněk. Doxorubicin v koncentraci 5 µM můžeme v buněčných strukturách zobrazit díky emisi červeného záření s maximem o vlnové délce okolo 555 – 600 nm (emitovaná vlnová délka se liší podle rozpouštědla, obr. 3) po excitaci světlem o vlnové délce mezi 470 a 550 nm [42].
Obr. 3. Fotografie fibroblastů (HFF) vystavených působení doxorubicinu (inkubace buněk s doxorubicinem o koncentraci 2 mg/ml po dobu 45 minut), pořízena za použití fluorescenčního mikroskopu při excitaci 520–550 nm a emisi 580 nm, 400krát zvětšeno. Jádra fibroblastů jsou vyznačena bílou barvou. Fluorescence byla pozorována pomocí fluorescenčního mikroskopu Olympus IX 71 (Japonsko). 
Ve spojení s přenašeči doxorubicinu na bázi nanomateriálů, jako jsou nanočástice s povrchem modifikovaným komplexem polyetylen glykolu a galaktózy [43] nebo folátem modifikované chitosan/ doxorubicin poly(butyl)kyanoakrylátové nanočástice [44], byla potvrzena endocytóza nanočástic jak pomocí galaktózového receptoru HepG2 buněk, tak prostřednictvím folátového receptoru buněk MCF ‑ 7. Pro duální cílený transport doxorubicinu pomocí magnetických nanočástic a uhlíkových nanotrubic s využitím kyseliny folové byla použita jak vlastní fluorescence doxorubicinu, tak fluorescence fluoresceinu jako druhé fluorescenční značky [45]. Měření fluorescence doxorubicinu v buňkách in vitro se využívá také k hodnocení chemorezistence vyvolané transportem cytostatika z buňky proteiny ze skupiny ATP ‑ vážících transportérů (ABC proteiny) a k testování inhibitorů těchto transportních mechanizmů [46]. Význam tohoto vyšetření i použití inhibitorů transportérů ze skupiny ABC proteinů pro klinickou praxi je bohužel značně omezený [47,48].
In vivo fluorescenční zobrazování
Cílený transport doxorubicinem modifikovaných přenašečů pomocí různých druhů nanočástic [49 – 51] může být navíc zefektivněn použitím ultrazvuku [52]. Fluorescenci doxorubicinu lze využít k zobrazení doxorubicinu navázaného na magnetizovatelné částice, v buňkách in vitro (obr. 3), ale i v živém laboratorním zvířeti (obr. 4). U bezsrstých myší (nu/ nu) lze velice dobře pozorovat distribuci doxorubicinu v těle zvířete. Velikým problémem u fluorescenčního in vivo zobrazování je silná autofluorescence tkání [53,54] a velký rozptyl záření při průchodu tkání. Z těchto důvodů fluorescence doxorubicinu není dostatečná pro detekci v hlubších vrstvách tkání. Možností, jak zajistit dostatečnou fluorescenci, a výrazně tak zvýšit citlivost jeho detekce, je konjugace s kvantovými tečkami (quantum dots – QDs), které poskytují vynikající optické vlastnosti [55].
Obr. 4. Myš s injekčně aplikovaným cytostatikem doxorubicinem o koncentraci 2 mg/ml do levého stehenního svalu (2 mm pod povrch). Fotografie byla pořízena při excitaci 480 nm a emisi 600 nm, teplota 37 ºC, myš udržována po celou dobu v anestezii. Analýza byla provedena přístrojem In Vivo Xtreme (Care stream, USA). 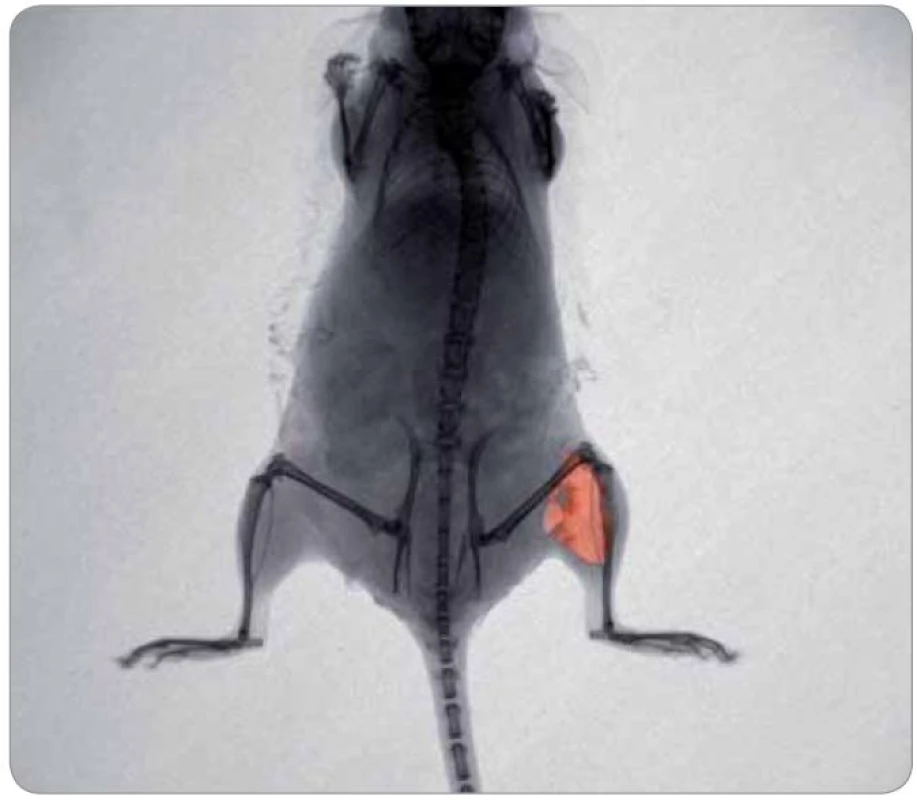
Novým trendem v in vivo zobrazování jsou takzvané aktivovatelné sondy [56 – 58]. Tyto sondy se skládají ze dvou částí: 1. fluorescenční část, 2. odštěpitelná část. Fluorescenční značka nevykazuje fluorescenci až do doby, kdy dojde k odštěpení odštěpitelné části, a tím k aktivaci sondy. Hlavní výhodou tohoto druhu sond je velmi nízké fluorescenční pozadí, a to z toho důvodu, že nevykazují fluorescenci během transportu krevním řečištěm, čímž odpadá časová prodleva nutná k vyloučení nenavázané sondy z organizmu. Pouze po interakci v požadovaném místě fungování dojde k aktivaci spojené s emisí záření. Aktivaci sondy lze provést enzymaticky [59] nebo změnou pH [60].
Závěr
Široce používané cytostatikum doxorubicin lze díky jeho fyzikálním vlastnostem velmi dobře pozorovat pomocí fluorescenčních zobrazovacích metod ve tkáních. Tyto metody nám otevírají nové možnosti nejen ve sledování interakce léčiva s nádorovými buňkami, ale také pro cílenou léčbu zhoubných nádorů.
Práce byla podpořena granty Liga proti rakovině Praha 2012 (Ryvolová), CYTORES GA ČR P301/10/0356, IGA IP22/2013 a projektem koncepčního rozvoje výzkumné organizace 00064203.
This study was supported by League against Cancer Prague 2012 (Ryvolová), CYTORES GA CR P301/10/0356, IGA IP22/2013 and the project for conceptual development of research organization 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. Ing. René Kizek, Ph.D.
Ústav chemie a biochemie
Agronomická fakulta
Mendelova univerzita v Brně
Zemědělská 1
613 00 Brno
e-mail: kizek@sci.muni.cz
Obdrženo: 30. 12. 2012
Přijato: 28. 5. 2013
Zdroje
1. Cabane E, Zhang X, Langowska K et al. Stimuli ‑ Responsive polymers and their applications in nanomedicine. Biointerphases 2012; 7(1 – 4): 1 – 27.
2. Samarasinghe RM, Gibbons J, Kanwar RK et al. Nanotechnology based platforms for survivin targeted drug discovery. Expert Opin Drug Discov 2012; 7(11): 1083 – 1092.
3. Chang HI, Yeh MK. Clinical development of liposome‑based drugs: formulation, characterization, and therapeutic efficacy. Int J Nanomed 2012; 7 : 49 – 60.
4. Keller AM, Mennel RG, Georgoulias VA et al. Randomized phase III trial of pegylated liposomal doxorubicin versus vinorelbine or mitomycin C plus vinblastine in women with taxane ‑ refractory advanced breast cancer. J Clin Oncol 2004; 22(19): 3893 – 3901.
5. Poljakova J, Frei E, Eckschlager T et al. Comparison of the cytotoxicity of and DNA adduct formation by the anticancer drug ellipticine in human breast adenocarcinoma, leukemia and neuroblastoma cells. Chem Listy 2007; 101(14): s253 – s255.
6. Hynek D, Krejcova L, Zitka O et al. Electrochemical Study of Doxorubicin Interaction with Different Sequences of Single Stranded Oligonucleotides, Part I. Int J Electrochem Sci 2012; 7(1): 13 – 33.
7. Stiborova M, Poljakova J, Eckschlager T et al. Analysis of covalent ellipticine ‑ and doxorubicin‑derived adducts in DNA of neuroblastoma cells by the P ‑ 32 - postlabeling technique. Biomed Pap Olomouc 2012; 156(2): 115 – 121.
8. Yong KT, Wang Y, Roy I et al. Preparation of quantum dot/ drug nanoparticle formulations for traceable targeted delivery and therapy. Theranostics 2012; 2(7): 681 – 694.
9. Chomoucka J, Drbohlavova J, Huska D et al. Magnetic nanoparticles and targeted drug delivering. Pharmacol Res 2010; 62(2): 144 – 149.
10. Kizek R, Adam V, Hrabeta J et al. Anthracyclines and ellipticines as DNA ‑ damaging anticancer drugs: recent advances. Pharmacol Ther 2012; 133(1): 26 – 39.
11. Malam Y, Loizidou M, Seifalian AM. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci 2009; 30(11): 592 – 599.
12. Hofheinz RD, Gnad ‑ Vogt SU, Beyer U et al. Liposomal encapsulated anti‑cancer drugs. Anticancer Drugs 2005; 16(7): 691 – 707.
13. Allen TM. Ligand ‑ targeted therapeutics in anticancer therapy. Nat Rev Cancer 2002; 2(10): 750 – 763.
14. Maeda H. The enhanced permeability and retention (EPR) effect in tumor vasculature: The key role of tumor ‑ selective macromolecular drug targeting. In: Weber G (ed). Advances in Enzyme Regulation. Oxford: Pergamon ‑ Elsevier Science Ltd 2001 : 189 – 207.
15. Yu MK, Park J, Jon S. Targeting strategies for multifunctional nanoparticles in cancer imaging and therapy. Theranostics 2012; 2(1): 3 – 44.
16. Grobmyer SR, Zhou G, Gutwein LG et al. Nanoparticle delivery for metastatic breast cancer. Nanomed Nanotechnol Biol Med 2012; 8: S21 – S30.
17. Pastorino F, Brignole C, Di Paolo D et al. Targeting liposomal chemotherapy via both tumor cell ‑ specific and tumor vasculature‑specific ligands potentiates therapeutic efficacy. Cancer Res 2006; 66(20): 10073 – 10082.
18. Drummond DC, Meyer O, Hong K et al. Optimizing liposomes for delivery of chemotherapeutic agents to solid tumors. Pharmacol Rev 1999; 51(4): 691 – 743.
19. Maurer N, Fenske DB, Cullis PR. Developments in liposomal drug delivery systems. Expert Opin Biol Ther 2001; 1(6): 923 – 947.
20. Wang AZ, Langer R, Farokhzad OC. Nanoparticle delivery of cancer drugs. Annu Rev Med 2012; 63 : 185 – 198.
21. Alba E, Ruiz ‑ Borrego M, Margeli M et al. Maintenance treatment with Pegylated liposomal doxorubicin versus observation following induction chemotherapy for metastatic breast cancer: GEICAM 2001 - 01 study. Breast Cancer Res Treat 2010; 122(1): 169 – 176.
22. Chan S, Davidson N, Juozaityte E et al. Phase III trial of liposomal doxorubicin and cyclophosphamide compared with epirubicin and cyclophosphamide as first‑line therapy for metastatic breast cancer. Ann Oncol 2004; 15(10): 1527 – 1534.
23. Sparano JA, Makhson AN, Semiglazov VF et al. Pegylated liposomal doxorubicin plus docetaxel significantly improves time to progression without additive cardiotoxicity compared with docetaxel monotherapy in patients with advanced breast cancer previously treated with neoadjuvant ‑ adjuvant anthracycline therapy: results from a randomized phase III study. J Clin Oncol 2009; 27(27): 4522 – 4529.
24. Friedman A, Arosio P, Finazzi D et al. Ferritin as an important player in neurodegeneration. Parkinsonism Relat Disord 2011; 17(6): 423 – 430.
25. Brissot P, Ropert M, Le Lan C et al. Non ‑ transferrin bound iron: a key role in iron overload and iron toxicity. Biochim Biophys Acta 2012; 1820(3): 403 – 410.
26. Kilic MA, Ozlu E, Calis S. A novel protein‑based anticancer drug encapsulating nanosphere: apoferritin‑doxorubicin complex. J Biomed Nanotechnol 2012; 8(3): 508 – 514.
27. Karchemski F, Zucker D, Barenholz Y et al. Carbon nanotubes‑liposomes conjugate as a platform for drug delivery into cells. J Control Release 2012; 160(2): 339 – 345.
28. Schnorr JM, Swager TM. Emerging applications of carbon nanotubes. Chem Mat 2011; 23(3): 646 – 657.
29. Vashist SK, Zheng D, Pastorin G et al. Delivery of drugs and biomolecules using carbon nanotubes. Carbon 2011; 49(13): 4077 – 4097.
30. Bianco A, Kostarelos K, Prato M. Applications of carbon nanotubes in drug delivery. Curr Opin Chem Biol 2005; 9(6): 674 – 679.
31. Gu YJ, Cheng J, Jin J et al. Development and evaluation of pH ‑ responsive single‑walled carbon nanotube ‑ doxorubicin complexes in cancer cells. Int J Nanomed 2011; 6 : 2889 – 2898.
32. Zhang X, Meng L, Lu Q et al. Targeted delivery and controlled release of doxorubicin to cancer cells using modified single wall carbon nanotubes. Biomaterials 2009; 30(30): 6041 – 6047.
33. Ali ‑ Boucetta H, Al ‑ Jamal KT, McCarthy D et al. Multiwalled carbon nanotube ‑ doxorubicin supramolecular complexes for cancer therapeutics. Chem Commun 2008; 28(4): 459 – 461.
34. Zhu J, Liao L, Bian X et al. pH ‑ controlled delivery of doxorubicin to cancer cells, based on small mesoporous carbon nanospheres. Small 2012; 8(17): 2715 – 2720.
35. Wang Y, Yang ST, Wang Y et al. Adsorption and desorption of doxorubicin on oxidized carbon nanotubes. Colloid Surf B ‑ Biointerfaces 2012; 97 : 62 – 69.
36. Yang XY, Zhang XY, Liu ZF et al. High‑Efficiency Loading and Controlled Release of Doxorubicin Hydrochloride on Graphene Oxide. J Phys Chem C 2008; 112(45): 17554 – 17558.
37. Lu F, Haque SA, Yang ST et al. Aqueous compatible fullerene ‑ doxorubicin conjugates. J Phys Chem C 2009; 113(41): 17768 – 17773.
38. Cataldo F, Iglesias ‑ Groth S, Garcia ‑ Hernandez DA et al. Determination of the integrated Molar Absorptivity and Molar Extinction Coefficient of Hydrogenated Fullerenes. Fullerenes Nanotube Carbon Nanostructures 2013; 21(5): 417 – 428.
39. Ryman ‑ Rasmussen JP, Riviere JE, Monteiro‑Riviere NA.Penetration of intact skin by quantum dots with diverse physicochemical properties. Toxicol Sci 2006; 91(1): 159 – 165.
40. Zakharian TY, Seryshev A, Sitharaman B et al. A fullerene ‑ paclitaxel chemotherapeutic: synthesis, characterization, and study of biological activity in tissue culture. J Am Chem Soc 2005; 127(36): 12508 – 12509.
41. Partha R, Conyers JL. Biomedical applications of functionalized fullerene‑based nanomaterials. Int J Nanomed 2009; 4 : 261 – 275.
42. Karukstis KK, Thompson EH, Whiles JA et al. Deciphering the fluorescence signature of daunomycin and doxorubicin. Biophys Chem 1998; 73(3): 249 – 263.
43. Gu JL, Su SS, Zhu MJ et al. Targeted doxorubicin delivery to liver cancer cells by PEGylated mesoporous silica nanoparticles with a pH ‑ dependent release profile. Microporous Mesoporous Mat 2012; 161 : 160 – 167.
44. Duan JH, Liu MJ, Zhang YD et al. Folate ‑ decorated chitosan/ doxorubicin poly(butyl)cyanoacrylate nanoparticles for tumor ‑ targeted drug delivery. J Nanopart Res 2012; 14(4): 1 – 9.
45. Lu YJ, Wei KC, Ma CC et al. Dual targeted delivery of doxorubicin to cancer cells using folate ‑ conjugated magnetic multi‑walled carbon nanotubes. Colloid Surf B ‑ Biointerfaces 2012; 89 : 1 – 9.
46. Wang EJ, Casciano CN, Clement RP et al. Active transport of fluorescent P ‑ glycoprotein substrates: Evaluation as markers and interaction with inhibitors. Biochem Biophys Res Commun 2001; 289(2): 580 – 585.
47. Prochazka P, Libra A, Zemanova Z et al. Mechanisms of ellipticine ‑ mediated resistance in UKF ‑ NB ‑ 4 neuroblastoma cells. Cancer Sci 2012; 103(2): 334 – 341.
48. Weaver JL, Pine PS, Aszalos A et al. Laser scanning and confocal microscopy of daunorubicin, doxorubicin and rhodamine 123 in multidrug‑resistant cells. Exp Cell Res 1991; 196(2): 323 – 329.
49. Cheng Y, Yu SL, Wang JJ et al. In vitro and in vivo Antitumor Activity of Doxorubicin‑Loaded Alginic ‑ Acid ‑ Based Nanoparticles. Macromol Biosci 2012; 12(10): 1326 – 1335.
50. Prados J, Melguizo C, Ortiz R et al. Doxorubicin‑Loaded Nanoparticles: New Advances in Breast Cancer Therapy. Anti‑Cancer Agents Med Chem 2012; 12(9):1058 – 1070.
51. Wu JL, Liu CG, Wang XL et al. Preparation and characterization of nanoparticles based on histidine ‑ hyaluronic acid conjugates as doxorubicin carriers. J Mater Sci Mater Med 2012; 23(8): 1921 – 1929.
52. Yudina A, Lepetit ‑ Coiffe M, De Smet M et al. In vivo temperature controlled ultrasound ‑ mediated intracellular delivery of cell ‑ impermeable compounds. J Control Release 2012; 161(1): 90 – 97.
53. Ntziachristos V, Bremer C, Weissleder R. Fluorescence imaging with near ‑ infrared light: new technological advances that enable in vivo molecular imaging. Eur Radiol 2003; 13(1): 195 – 208.
54. Rao JH, Dragulescu ‑ Andrasi A, Yao HQ. Fluorescence imaging in vivo: recent advances. Curr Opin Biotechnol 2007; 18(1): 17 – 25.
55. Chakravarthy KV, Davidson BA, Helinski JD et al. Doxorubicin‑conjugated quantum dots to target alveolar macrophages and inflammation. Nanomed Nanotechnol Biol Med 2011; 7(1): 88 – 96.
56. Achilefu S. Rapid response activatable molecular probes for intraoperative optical image ‑ guided tumor resection. Hepatology 2012; 56(3): 1170 – 1173.
57. Lacivita E, Leopoldo M, Berardi F et al. Activatable Fluorescent Probes: A New Concept in Optical Molecular Imaging. Curr Med Chem 2012; 19(28): 4731 – 4741.
58. Li JB, Chen K, Liu HG et al. Activatable near ‑ infrared fluorescent probe for in vivo imaging of fibroblast activation protein‑alpha. Bioconjug Chem 2012; 23(8): 1704 – 1711.
59. Thorek DL, Grimm J. Enzymatically activatable diagnostic probes. Curr Pharm Biotechnol 2012; 13(4): 523 – 536.
60. Zhou KJ, Liu HM, Zhang SR et al. Multicolored pH ‑ Tunable and activatable fluorescence nanoplatform responsive to physiologic pH stimuli. J Am Chem Soc 2012; 134(18): 7803 – 7811.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2013 Číslo 4- Vliv regulace pH na snížení výskytu peristomálních komplikací a bolesti
- INFOGRAFIKA: Inovace v péči o kůži – síla regulace pH v reálné praxi
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
- Jaké bylo ASCO 2013
- Moderní zobrazovací techniky pro antracyklinová cytostatika – literární přehled
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Karcinom pankreatu a faktory životního stylu
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Synchronní bilaterální testikulární tumor ze zárodečných buněk: kazuistika a přehled literatury
- Je ten istý tyrozín- kinázový inhibítor efektívny aj po vzniku mozgových metastáz? Kazuistika
- Týdenní vs dvoutýdenní aplikace cetuximabu v léčbě metastatického kolorektálního karcinomu – aktuální klinická data
- Zajímavé případy z nutriční péče v onkologii
- Dimenze onkochirurgie
-
Onkologie v obrazech
Giant Metastatic Testicular Tumor
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Registr neuroendokrinních nádorů (NET) v ČR po třech letech sběru dat
- Degradace proteinů ubikvitin‑proteazomovou dráhou
- Současné trendy adjuvantní chemoterapie u nemalobuněčného karcinomu plic
- Cytogenetické vyšetření lymfocytů periferní krve po stimulaci IL‑2 a CpG oligonukleotidem DSP30 u pacientů s chronickou lymfocytární leukemií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



