-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba pacientů s relabovaným/refraktérním Hodgkinovým lymfomem
Treatment of Patients with Relapsed/Refractory Hodgkin Lymphoma
Backgrounds:
This retrospective study evaluated treatment outcomes in patients undergoing autologous stem cell transplantation (ASCT) for relapsed/refractory Hodgkin lymphoma (HL).Patients and Methods:
Overall, 194 HL patients treated with ASCT between 2000 and 2009 were analyzed. Survival was calculated using Kaplan-Meier method and differences in survival between subgroups with log-rank test.Results:
Best responses observed after ASCT: 124 complete and 35 partial remissions, 2 patients with stable disease and 33 relapses/progressions. During a median follow-up of 44 months, seventy patients after ASCT progressed/relapsed. Thirty-seven patients received salvage chemotherapy only with or without radiotherapy, 25 underwent allogeneic stem cell transplantation (SCT), 4 the second ASCT and 4 refused treatment. 5-year overall survival after ASCT was 71% and progression-free survival 54%. Median survival of the 70 patients relapsing after ASCT was 16.9 months. Median survival in patients after allogeneic SCT was 31.8 months and 12.4 months in patients treated with other modalities (p = 0.21). Overall mortality was 26.3% (51/194 patients): 13.4% progressions/relapses of HL and 12.9% non-relapse mortality.Conclusion:
Efficacy of ASCT was confirmed in 54% progression-free survivors. Median survival after ASCT failure is relatively short. There is a slightly longer overall survival after allogeneic SCT, although not statistically significant when compared to other approaches.Key words:
Hodgkin lymphoma – relapse – salvage therapy – stem cell transplantation
Autoři: H. Mociková 1; R. Pytlík 2; L. Raida 3; A. Sýkorová 4; J. Marková 1; Z. Král 5; P. Jindra 6; K. Steinerová 6; V. Válková 7; M. Trnková 8; B. Vacková 2; M. Trněný 2,7; K. Indrák 3; D. Belada 4; J. Mayer 5; V. Koza 6; T. Kozák 1
Působiště autorů: Oddělení klinické hematologie, FN Královské Vinohrady Praha 1; I. interní klinika VFN Praha 2; Hematoonkologická klinika, FN Olomouc 3; Klinika hematoonkologie, FN Hradec Králové 4; Interní hematoonkologická klinika, FN Brno 5; Oddělení hematoonkologie, FN Plzeň 6; Ústav hematologie a krevní transfuze, Praha 7; Národní registr kmenových buněk ČR-datacentrum 8
Vyšlo v časopise: Klin Onkol 2011; 24(2): 121-125
Kategorie: Původní práce
Souhrn
Východiska:
Tato retrospektivní studie hodnotila výsledky léčby u relabovaných/refrakterních pacientů s Hodgkinovým lymfomem (HL), u kterých byla provedena autologní transplantace periferních kmenových buněk (ASCT).Soubor pacientů a metody:
Analyzovali jsme 194 pacientů s HL léčených ASCT v letech 2000–2009. Přežití bylo hodnoceno Kaplan-Meierovou metodou. Rozdíly v přežití mezi podskupinami byly srovnávány log-rank testem.Výsledky:
Nejlepší dosažené odpovědi po ASCT: 124 kompletních a 35 parciálních remisí, 2 stabilní nemoci a 33 pacientů relabovalo/progredovalo. V mediánu sledování 44 měsíců po ASCT 70 pacientů progredovalo/relabovalo. 37 z nich bylo léčeno záchrannou chemoterapií s radioterapií nebo bez radioterapie, u 25 pacientů byla provedena alogenní transplantace kmenových buněk (SCT), 4 pacienti podstoupili druhou ASCT a 4 další léčbu odmítli. 5leté celkové přežití po ASCT bylo 71 % a přežití bez progrese/relapsu 54 %. Medián přežití 70 relabujících pacientů po ASCT byl 16,9 měsíce. Medián přežití pacientů po alogenní SCT byl 31,8 měsíce a u pacientů léčených jinými modalitami 12,4 měsíce (p = 0,21). Celková úmrtnost byla 26,3 % (51/194 pacientů): Na progresi/relaps HL zemřelo 13,4 % pacientů a 12,9 % pacientů zemřelo z jiného důvodu.Závěr:
Účinnost ASCT byla potvrzena u 54 % přežívajících pacientů bez relapsu/progrese. Medián přežití po selhání ASCT je relativně krátký. Statisticky nesignifikantně je prodloužené celkové přežití po alogenní SCT ve srovnání s ostatními léčebnými metodami.Klíčová slova:
Hodgkinův lymfom – relaps – záchranná léčba – transplantace kmenových buněkÚvod
Hodgkinův lymfom je ve většině případů vyléčen první linií léčby; v počátečních stadiích HL s příznivými prognostickými faktory jsou relapsy vzácné [1], ale u pacientů s nepříznivými prognostickými faktory se relapsy vyskytují v 10–15 % [2]. V pokročilých stadiích HL při dlouhodobém sledování je výskyt relapsů 20 % [3]. Ve srovnání s klasickou chemoterapií je ASCT účinnější a představuje standardní léčbu u relabovaných/refrakterních pacientů s HL. K selhání ASCT dochází přibližně v 50 % případů [4,5]. Optimální léčba relapsu HL po ASCT je nejasná. Léčebné možnosti pacientů s relapsem po ASCT zahrnují záchrannou chemoterapii a/nebo radioterapii, druhou ASCT, alogenní SCT a léčbu nově vyvinutými léky v rámci klinických studií. V literatuře jsou publikovány studie s různými chemoterapeutickými režimy nebo s imunoterapií, ale vzhledem k malému počtu pacientů nelze na jejich základě dělat definitivní závěry [6–8]. Role radioterapie v relapsu HL po ASCT je omezená, protože většina pacientů již byla ozářena v rámci první linie léčby. Radioterapii je možné aplikovat u relapsů v místech, která předtím nebyla ozářena [9]. Ve srovnání s chemoterapií může alogenní transplantace prodloužit přežití vysoce rizikových pacientů s HL [10]. Alogenní SCT u opakovaných relapsů HL je nadále předmětem diskuze kvůli vysoké peritransplantační úmrtnosti (TRM) [11]. Slibné jsou výsledky s použitím režimů s redukovanou intenzitou [12]. Tato retrospektivní studie hodnotila výsledky léčby pacientů s HL, kteří byli léčeni autologní transplantací v 7 transplantačních centrech v České republice.
Soubor pacientů a metody
Soubor pacientů
Do retrospektivní analýzy bylo zařazeno 194 hodnotitelných pacientů s relapsem/refrakterním HL, u kterých byla provedena ASCT v letech 2000–2009; všichni pacienti podepsali informovaný souhlas. Charakteristiky pacientů jsou uvedeny v tab. 1. U pacientů s relapsem byly pro účely této studie vyhodnoceny prognostické faktory podle prognostického skóre navrženého německou studijní skupinou pro Hodgkinův lymfom – German Hodgkin Study Group (GHSG) [13]: relaps do 12 měsíců od ukončení první linie léčby, klinické stadium a hladina hemoglobinu v relapsu. Definice primárně refrakterního HL zahrnovala následující kritéria: regrese nemoci < 50 % po 4–6 cyklech chemoterapie s antracyklinem a progresi nemoci v průběhu indukční léčby nebo do 90 dnů po ukončení první linie léčby [14]. 12 (6,2 %) pacientů splňovalo kritéria primárně refrakterního HL. Na základě zkušeností jednotlivých transplantačních center byl zvolen typ a počet cyklů záchranného režimu před ASCT (tab. 1). Odpověď na záchrannou léčbu a na transplantaci kmenových buněk byla ve všech případech hodnocena pomocí počítačové tomografie (CT), viz tab. 2. 76 (39 %) pacientů bylo vyšetřeno pozitronovou emisní tomografií (PET) po záchranné chemoterapii před ASCT s dosažením PET negativity u 56 z nich. Jedna ASCT byla provedena u 184 pacientů. Přípravný režim: BEAM (karmustin, etoposid, cytarabin, melfalan) [5] byl podán 179 pacientům, režim melfalan a mitoxantron dostali dva pacienti. U dvou dalších pacientů ve věku nad 60 let byl použit modifikovaný BEAM a u jednoho pacienta cyklofosfamid s busulfanem. Do programu tandemové ASCT bylo zařazeno celkem 10 pacientů: První přípravný režim obsahoval melfalan s mitoxantronem a druhý přípravný režim BEAM. Tři (1,5 %) pacienti byli ozářeni před ASCT a 50 (25,8 %) pacientů po ASCT. Nejlepší dosažené odpovědi po ASCT jsou uvedeny v tab. 2.
Statistika
Celkové přežití (OS) a přežití bez relapsu/progrese (PFS) od data ASCT byly hodnoceny Kaplan-Meierovou metodou. Přežití pacientů v relapsu po ASCT bylo hodnoceno od data relapsu. Různé způsoby záchranné léčby po selhání ASCT a jejich vliv na přežití byly srovnány pomocí log-rank testu. Ke zpracování dat byl použit software SPSS13.0.
Výsledky
Typy záchranných režimů a počet jejich cyklů se v jednotlivých centrech lišily, ale rozdíl v odpovědi na různé záchranné režimy (hodnocené pomocí CT) byl statisticky nesignifikantní (p = 0,7). Celkem 11 (55 %) z 20 PET pozitivních pacientů a 14 (25 %) z 56 pacientů PET negativních před ASCT relabovalo po ASCT. V univariační analýze by zjištěn statisticky signifikantní rozdíl ve 2letém OS a PFS mezi PET negativními a PET pozitivními pacienty (OS: 90,3 % vs 61,4 %, p = 0,009, PFS: 72,7 % vs 36,1 %, p = 0,01).
Medián sledování pacientů byl 44 měsíců (rozsah 3–108). Výsledky 194 pacientů po ASCT jsou následující: 5leté OS bylo 71 % (95% interval spolehlivosti, confidence interval [CI], 4–79 %, medián nedosažen) a PFS 54 % (95% CI, 46–62 %, medián 86 měsíců), obr. 1. 5leté OS a PFS po jedné ASCT se statisticky signifikantně nelišilo ve srovnání s tandemovou ASCT (OS: 72 % vs 50 %, p = 0,16; PFS: 54 % vs 40 %, p = 0,28).
Obr. 1. Přežití pacientů s HL po autologní transplantaci. 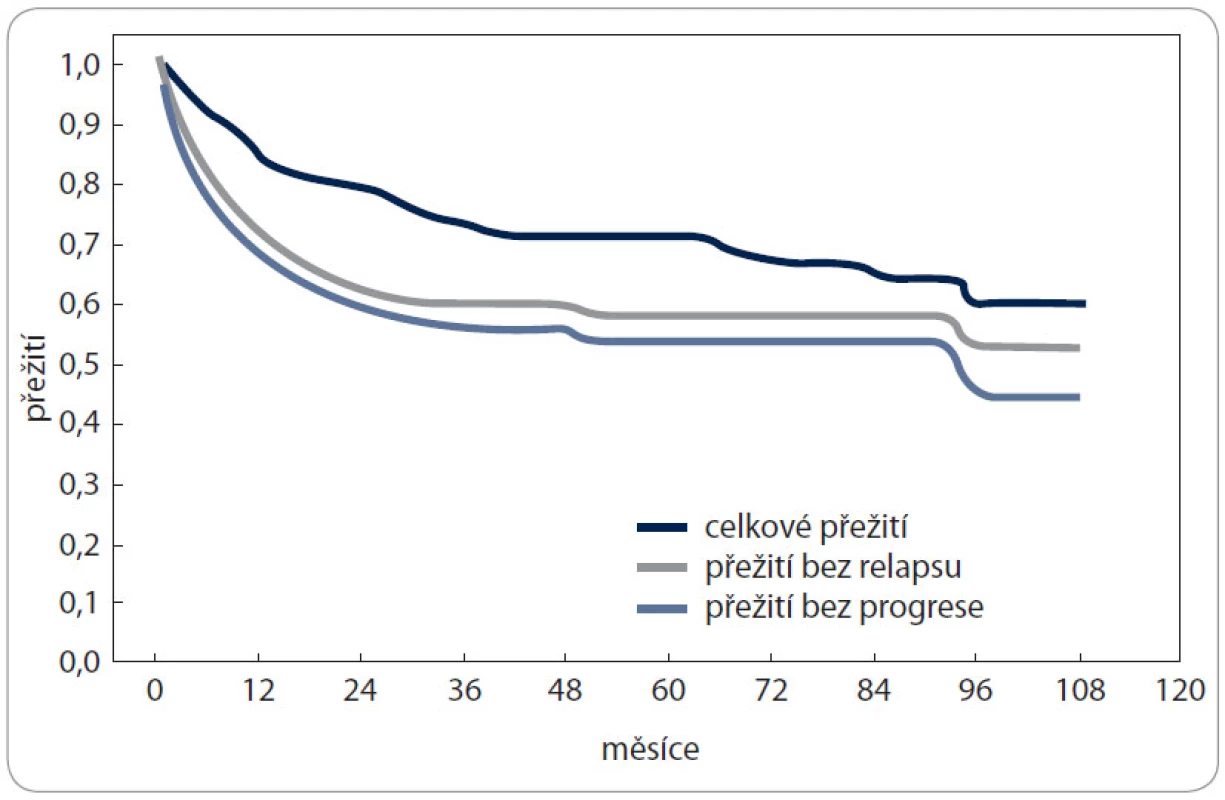
U 86 pacientů ASCT selhala: 10/194 pacientů zemřelo do 100 dní po ASCT na toxicitu léčby, 6 pacientů zemřelo na jiné příčiny v pozdějším období: 3 infekce, 1 kardiální selhání, 1 embolizace do plic, 1 cévní mozková příhoda. 70 pacientů relabovalo/progredovalo po ASCT s mediánem doby do progrese/relapsu 5,4 měsíce po ASCT (rozsah 0,3–95,4). Celkově zemřelo 51/194 (26,3 %) pacientů. Medián OS 70 pacientů od relapsu po ASCT byl 16,9 měsíce (obr. 2).
Obr. 2. Medián přežití u relabovaných nebo progredujících pacientů s HL po autologní transplantaci. 
Léčba pacientů v relapsu po ASCT
Čtyři pacienti odmítli jakoukoliv další léčbu a dva z nich zemřeli na progresi HL. Dva pacienti žijí s aktivním HL. Různé záchranné chemoterapeutické režimy (rozsah 2–4 cykly) byly použity u 66 pacientů [15–17]. Záchrannou chemoterapii bez následné transplantace podstoupilo 37 pacientů: 27 progredovalo (73 %), ale 10 zůstalo bez progrese (27 %). Čtyři pacienti byly chemosenzitivní na záchrannou léčbu a po přípravném režimu BEAM dostali druhou ASCT. Všichni jsou naživu, dva bez progrese onemocnění a dva s aktivním HL.
25 pacientů bylo léčeno alogenní SCT: 23 dostalo přípravný režim s redukovanou intenzitou (fludarabin a melfalan 12, fludarabin a cyklofosfamid 7, fludarabin a busulfan 1, fludarabin s cyklofosfamidem a celotělovým ozářením 1, fludarabin s celotělovým ozářením 1, cyklofosfamid 1) a 2 pacienti byli léčeni myeloablativním režimem (busulfan a cyklofosfamid) [11,18–20]. 21 relabovaných pacientů bylo ozářeno po záchranné léčbě nebo po alogenní SCT. Čtyři pacienti v následném relapsu/progresi byli léčeni dárcovskými lymfocytárními infuzemi (DLI) v rozsahu 1–6 bez dosažení odpovědi.
Medián OS od relapsu po ASCT u pacientů léčených s alogenní SCT nebo bez ní byl 31,8, resp. 12,4 měsíce, rozdíl nebyl statisticky signifikantní (p = 0,21). Medián PFS od relapsu po ASCT u pacientů léčených alogenní transplantací nebo bez ní byl 12,4, resp. 9,2 měsíce (p = 0,14), rozdíl nebyl statisticky signifikantní.
Diskuze
Záchranná chemoterapie s následnou ASCT je standardní léčbou u relabujících/refrakterních pacientů, ale vyléčení je dosaženo pouze u poloviny z nich [4,5]. V naší studii jsme analyzovali výsledky ASCT u 194 pacientů a následnou léčbu při dalším relapsu/progresi. Účinnost ASCT byla v naší skupině potvrzena u 54% pacientů bez následného relapsu/progrese. Tyto výsledky jsou shodné s literárními daty. Odpověď na záchrannou chemoterapii před ASCT je nejdůležitějším prognostickým faktorem, který ovlivňuje další osud pacientů po ASCT [5,21]. Podle literárních údajů je odpověď na záchranné režimy 60–88% [5,15–17,21–24]. Účinnost záchranných režimů ve druhé linii léčby dosud nebyla v randomizovaných studiích porovnávána. Nepřítomnost všeobecně uznaného standardu ve druhé linii léčby vedla k variabilitě záchranných režimů, které 7 transplantačních center v České republice použilo podle svých zkušeností. Celková dosažená odpověď na záchrannou léčbu byla 63–100%.
Podle studie Jabboura et al negativní PET po záchranné léčbě před ASCT předpovídá snížené riziko relapsu po ASCT [25]. Předtransplantační pozitivita PETu byla v našem souboru pacientů statisticky signifikantní pro 2leté celkové přežití i přežití bez relapsu/progrese po transplantaci. ASCT ve srovnání s předtransplantační záchrannou léčbou nevedla u našich pacientů k vyššímu počtu celkových odpovědí (kompletní a parciální remise), ale významný počet pacientů s parciální remisí dosáhl kompletní remise po ASCT. Radioterapie může zlepšit léčebné výsledky a dlouhodobé přežití u pacientů, kteří předtím nebyli ozářeni v místech relapsu [24,26]. Relativně vysoký počet, 24 (45 %) z 53 pa-cientů ozářených buď před, nebo po ASCT, následně relaboval. Na základě našich výsledků nelze jednoznačně potvrdit účinnost radioterapie v této indikaci. U vysoce rizikových pacientů (chemorezistentní nebo pacienti s ≥ 2 rizikovými faktory: relaps/progrese ≤ 12 měsíců, stadium III nebo IV v relapsu, relaps v místě ozáření) je vhodné zvážit tandemovou ASCT [27]. Naše skupina vysoce rizikových pacientů indikovaných k tandemové ASCT zahrnovala 3 chemorefrakterní pacienty a 6 pacientů s ≥ 2 rizikovými faktory. Jen jeden z 10 pacientů měl jeden nepříznivý prognostický faktor. Výsledky pacientů po tandemové ASCT nebyly statisticky signifikantně odlišné ve srovnání s pacienty s jednou ASCT. Toto pozorování může být ovlivněno nízkým počtem tandemových transplantací v našem souboru. Význam tandemové ASCT je nutné ověřit v prospektivní studii na větším souboru pacientů s jasnou definicí prognostických faktorů včetně PET a jednotně stanovenými režimy pro první a druhou ASCT u relabovaných/refrakterních pacientů s Hodgkinovým lymfomem. 70 pacientů relabovalo/progredovalo po ASCT a medián jejich celkového přežití byl relativně krátký – 16,9 měsíce. Podle literárních údajů se udává medián přežití pacientů, u kterých selhala ASCT, v rozpětí 12–25 měsíců [28,29]. 29 (41 %) pacientů se podrobilo druhé transplantaci: 4 autologní a 25 alogenní. Data týkající se druhé, autologní transplantace jsou omezená. Druhá ASCT má nižší peritransplantační úmrtnost (11 %) ve srovnání s alogenní transplantací a může se zvážit u pacientů, kteří relabují v dlouhodobém odstupu od první ASCT, jsou v celkově dobrém stavu, zůstávají chemosenzitivní při další linii záchranné chemoterapie a nemají vhodného dárce pro alogenní SCT [30]. U pacientů refrakterních na záchrannou chemoterapii není druhá ASCT účinná. Všichni 4 pacienti z našeho souboru byli chemosenzitivní na záchrannou léčbu, podstoupili druhou autologní transplantaci a žijí (2 v remisi a 2 s aktivním HL). Z této malé skupiny pacientů nelze vyvozovat definitivní závěry ohledně účinnosti druhé ASCT.
Role alogenní SCT u pacientů s relapsem/refrakterním HL zatím není jasně určena. Výsledky alogenní SCT s režimy s redukovanou intenzitou jsou slibné (PFS 20–31 %, OS 37–59 %) a podporují teorii o protinádorovém působení štěpu proti HL [12,31,32]. Relaps/progrese HL nadále zůstávají hlavním problémem dokonce i po alogenní transplantaci. Pacienti, kteří dostali méně linií předchozí léčby a dosáhli kompletní remise, mají signifikantně nižší riziko progrese [20]. Po alogenní transplantaci byl zjištěn trend lepšího PFS a OS v relapsu po ASCT ve srovnání s relabovanými pacienty, kteří nebyli znovu transplantováni (medián PFS 12,4 vs 9,2 měsíce a medián OS 31,8 vs 12,4 měsíce), ale tyto rozdíly nebyly statisticky signifikantní (p = 0,14 a p = 0,21). Tento výsledek je pravděpodobně ovlivněn malým počtem pacientů a rizikovými faktory před alogenní transplantací: 14/25 progresí/relapsů do 6 měsíců po ASCT a 15/25 chemorefrakterních HL. Podle literatury mohou dárcovské lymfocytární infuze navozením reakce štěpu vůči HL zlepšit celkový výsledek alogenní transplantace [33,34]. Podání dárcovských lymfocytárních infuzí našim 4 pacientům v relapsu po alogenní transplantaci nevedlo k dosažení odpovědi.
Závěr
Naše data potvrdila účinnost ASCT u 54 % pacientů s HL, kteří nerelabovali po autologní transplantaci. Medián přežití po selhání ASCT je relativně krátký: 16,9 měsíce. Po alogenní transplantaci je patrný trend delšího přežití, který je ale statisticky nesignifikantní ve srovnání s ostatními konvenčními záchrannými postupy. Na základě našich výsledků se nelze vyjádřit k roli druhé autologní transplantace. Nové léky, jako jsou SGN-35, inhibitory m-TOR a inhibitory histon deacetylázy, se v současnosti zkoušejí v klinických studiích u relabovaných/refraktérních pacientů s HL.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Heidi Mociková, Ph.D.
Oddělení klinické hematologie
FN Královské Vinohrady
Šrobárova 50
100 34 Praha 10
e-mail: heidi.mocikova@seznam.cz
Obdrženo/Submitted: 11. 8. 2010
Přijato/Accepted: 2. 12. 2010
Zdroje
1. Sieniawski M, Franklin J, Nogova L et al. Outcome of patients experiencing progression or relapse after primary treatment with two cycles of chemotherapy and radiotherapy for early-stage favorable Hodgkin’s lymphoma. J Clin Oncol 2007; 25(15): 2000–2005.
2. Fermé C, Eghbali H, Meerwaldt JH et al. Chemotherapy plus involved-field radiation in early-stage Hodgkin’s disease. N Engl J Med 2007; 357(19): 1916–927.
3. Diehl V, Franklin J, Pfreundschuh M et al. Standard and increased-dose BEACOPP chemotherapy compared with COPP-ABVD for advanced Hodgkin’s disease. N Eng J Med 2003; 348(24): 2386–2395.
4. Linch DC, Winfield D, Goldstone AH et al. Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin’s disease: results of a BNLI randomised trial. Lancet 1993; 341(8852): 1051–1054.
5. Schmitz N, Pfistner B, Sextro M et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet 2002; 359(9323): 2065–2071.
6. Venkatesh H, Di Bella N, Flynn TP et al. Results of a phase II multicenter trial of single-agent gemcitabine in patients with relapsed or chemotherapy-refractory Hodgkin’s lymphoma. Clin Lymphoma 2004; 5(2): 110–115.
7. Spencer A, Reed K, Arthur C. Pilot study of an outpatient-based approach for advanced lymphoma using vinorelbine, gemcitabine and filgrastim. Intern Med J 2007; 37(11): 760–766.
8. Oki Y, Pro B, Fayad LE et al. Phase 2 study of gemcitabine in combination with rituximab in patients with recurrent or refractory Hodgkin lymphoma. Cancer 2008; 112(4): 831–836.
9. Brice P. Managing relapsed and refractory Hodgkin lymphoma. Br J Haematol 2008; 141(1): 3–13.
10. Castagna L, Sarina B, Todisco E et al. Allogeneic stem cell transplantation compared with chemotherapy for poor-risk Hodgkin lymphoma. Biol Blood Marrow Transplant 2009; 15(4): 432–438.
11. Gajewski JL, Phillips GL, Sobocinski KA et al. Bone marrow transplants from HLA-identical siblings in advanced Hodgkin’s disease. J Clin Oncol 1996; 14(2): 572–578.
12. Sureda A, Robinson S, Canals C et al. Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2008; 26(3): 455–462.
13. Josting A, Franklin J, May M et al. New prognostic score based on treatment outcome of patients with relapsed Hodgkin’s lymphoma registered in the database of the German Hodgkin’s Lymphoma Study Group. J Clin Oncol 2002; 20(1): 221–230.
14. Josting A, Reiser M, Rueffer U et al. Treatment of primary progressive Hodgkin’s and aggressive non-Hodgkin’s lymphoma: is there a chance for cure? J Clin Oncol 2000; 18(2): 332–339.
15. Santoro A, Magagnoli M, Spina M et al. Ifosfamide, gemcitabine and vinorelbine: a new induction regimen for refractory and relapsed Hodgkin’s lymphoma. Haematologica 2007; 92(1): 35–41.
16. Todd T, Raj S, Camilleri D et al. Intermediate dose gemcitabine-cisplatin combination chemotherapy without treatment delay for cytopenia followed by autografting-a new standard of care in relapsed or refractory Hodgkin lymphoma? Ann Hematol 2009; 88(11): 1107–1112.
17. Validire P, Fermé C, Brice P et al. A multicenter study of gemcitabine-containing regimen in relapsed or refractory Hodgkin’s lymphoma patients. Anticancer Drugs 2008; 19(3): 309–315.
18. Anderlini P, Saliba R, Acholonu S et al. Fludarabine-melphalan as a preparative regimen for reduced-intensity conditioning allogeneic stem cell transplantation in relapsed and refractory Hodgkin’s lymphoma: the updated M.D. Anderson Cancer Center experience. Haematologica 2008; 93(2): 257–264.
19. Khouri IF, Keating M, Körbling M et al. Transplant-lite: induction of graft-versus-malignancy using fludarabine-based nonablative chemotherapy and allogeneic blood progenitor cell transplantation as treatment for lymphoid malignancies. J Clin Oncol 1998; 16(8): 2817–2824.
20. Robinson SP, Sureda A, Canals C et al. Reduced intensity conditioning allogeneic stem cell transplantation for Hodgkin’s lymphoma: identification of prognostic factors predicting outcome. Haematologica 2009; 94(2): 230–238.
21. Josting A, Rudolph C, Mapara M et al. Cologne high--dose sequential chemotherapy in relapsed and refractory Hodgkin lymphoma: results of a large multicenter study of the German Hodgkin Lymphoma Study Group (GHSG). Ann Oncol 2005; 16(1): 116–123.
22. Bishton MJ, Lush RJ, Byrne JL et al. Ifosphamide, etoposide and epirubicin is an effective combined salvage and peripheral blood stem cell mobilisation regimen for transplant-eligible patients with non-Hodgkin lymphoma and Hodgkin disease. Br J Haematol 2007; 136(5): 752–761.
23. Moskowitz CH, Nimer SD, Zelenetz AD et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood 2001; 97(3): 616–623.
24. Schellong G, Dörffel W, Claviez A et al. Salvage therapy of progressive and recurrent Hodgkin’s disease: results from a multicenter study of the pediatric DAL/GPOH-HD study group. J Clin Oncol 2005; 23(25): 6181–6189.
25. Jabbour E, Hosing C, Ayers G et al. Pretransplant positive positron emission tomography/gallium scans predict poor outcome in patients with recurrent/refractory Hodgkin lymphoma. Cancer 2007; 109(12): 2481–2489.
26. Josting A, Nogova L, Franklin J et al. Salvage radiotherapy in patients with relapsed and refractory Hodgkin’s lymphoma: a retrospective analysis from the German Hodgkin Lymphoma Study Group. J Clin Oncol 2005; 23(7): 1522–1529.
27. Morschhauser F, Brice P, Fermé C et al. Risk-adapted salvage treatment with single or tandem autologous stem-cell transplantation for first relapse/refractory Hodgkin’s lymphoma: results of the prospective multicenter H96 trial by the GELA/SFGM study group. J Clin Oncol 2008; 26(36): 5980–5987.
28. Crump M. Management of Hodgkin lymphoma in relapse after autologous stem cell transplant. Hematology Am Soc Hematol Educ Program 2008 : 326–333.
29. Moskowitz AJ, Perales MA, Kewalramani T et al. Outcomes for patients who fail high dose chemoradiotherapy and autologous stem cell rescue for relapsed and primary refractory Hodgkin lymphoma. Br J Haematol 2009; 146(2): 158–163.
30. Smith SM, van Besien K, Carreras J et al. Second autologous stem cell transplantation for relapsed lymphoma after a prior autologous transplant. Biol Blood Marrow Transplant 2008; 14(8): 904–912.
31. Burroughs LM, O’Donnell PV, Sandmaier BM et al. Comparison of outcomes of HLA-matched related, unrelated, or HLA-haploidentical related hematopoietic cell transplantation following nonmyeloablative conditioning for relapsed or refractory Hodgkin lymphoma. Biol Blood Marrow Transplant 2008; 14(11): 1279–1287.
32. Devetten MP, Hari PN, Carreras J et al. Unrelated donor reduced-intensity allogeneic hematopoietic stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Biol Blood Marrow Transplant 2009; 15(1): 109–117.
33. Peggs KS, Sureda A, Qian W et al. Reduced-intensity conditioning for allogeneic haematopoietic stem cell transplantation in relapsed and refractory Hodgkin lymphoma: impact of alemtuzumab and donor lymphocyte infusions on long-term outcomes. Br J Haematol 2007; 139(1): 70–80.
34. Thomson KJ, Peggs KS, Smith P et al. Superiority of reduced-intensity allogeneic transplantation over conventional treatment for relapse of Hodgkin’s lymphoma following autologous stem cell transplantation. Bone Marrow Transplant 2008; 41(9): 765–770.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2011 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Avastin v léčbě karcinomu prsu
- Prehľad potenciálnych onkomarkerov detekcie skorých fáz rakoviny vaječníkov
- Výsledky multimodální léčby glioblastoma multiforme: Konsekutivní série 86 pacientů diagnostikovaných v letech 2003–2009
- Léčba pacientů s relabovaným/refraktérním Hodgkinovým lymfomem
- Incidencia a mortalita na karcinóm prostaty vo vybraných krajinách strednej Európy
- Angiomyofibroblastóm krčku maternice: kazuistika
- Metastázujúci choriokarcinóm u 26-ročnej ženy – kazuistika
- Překonávají klinické studie fáze 0 stagnující vývoj protinádorových léčiv?
- Terapeutická ekvivalence a účinnost přípravku Binocrit® (HX575) u pacientů se symptomatickou anémií navozenou chemoterapií
- Comments on the TNM Classification of Malignant Tumours – 7th Edition
- Průběh a závěry mezioborového setkání „Winter GLIO TRACK Meeting“ 2011
- Zápis ze schůze výboru České onkologické společnosti dne 22. 2. 2011 v MOÚ BRNO
- Vzpomínka na MUDr. Olgu Přibylovou, Ph.D.
- Zpřesněme indikaci podávání inhibitorů kinázové aktivity EGFR
- Adjuvantní terapie u karcinomu rekta
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prehľad potenciálnych onkomarkerov detekcie skorých fáz rakoviny vaječníkov
- Metastázujúci choriokarcinóm u 26-ročnej ženy – kazuistika
- Adjuvantní terapie u karcinomu rekta
- Comments on the TNM Classification of Malignant Tumours – 7th Edition
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





