-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
Pathobiochemistry of inhibin A and its use in the screening of congenital developmental defects.
Inhibins are glycoproteins which belong to the transforming growth factor beta family (TGF-β), which contains more than 60 proteins as well as activins, which are structurally similar but differ in terms of function. Inhibins in women are formed in the ovarian granulosa cells, inhibin A is also produced during pregnancy by the yellow body and the placenta. Inhibins play an important role in the regulation of folliculogenesis and oocyte maturation. In males, inhibins are predominantly produced in the testicular Sertoli cells and in a smaller quantity also in the Leydig cells. Their synthesis is stimulated by the effects of androgens but is primarily regulated by spermatogenesis. Currently, it is also clear that the function of inhibins include a much broader spectrum of effects, which are not only related to the reproductive system. In pregnancy, the source of inhibin A is the yellow body and later the placenta. Inhibin (and also activin) have a paracrine and autocrine function in the human placenta and locally affect the production of hormones in the placenta, cellular immunity, cell growth and differentiation of the placenta and embryo. Placental cytotrophoblast and syncytiotrophoblast secrete inhibin A, which inhibits the placental secretion hCG and progesterone. In some cases, biochemical markers that are produced by the placenta during pregnancy are used as markers for Down syndrome screening. It has been discovered that an increase in the level of inhibin A is to some degree associated with the presence of Down syndrome and may be used in combination with other biochemical markers produced by the fetoplacental unit as a biochemical screening marker.
Keywords:
inhibin A – Down syndrome – prenatal screening
Autoři: J. Loucký 1,2; R. Průša 2
Působiště autorů: Vaše laboratoře s. r. o., U Lomu 638, Zlín, 760 01 1; Ústav lékařské chemie a klinické biochemie, 2. LF UK a FN Motol, V úvalu 84, Praha 5, 150 06 2
Vyšlo v časopise: Klin. Biochem. Metab., 28, 2020, No. 1, p. 5-10
Souhrn
Inhibiny jsou glykoproteiny patřící do rodiny transformujícího růstového faktoru beta (TGF-β), která čítá více než 60 proteinů a zahrnuje dále také aktiviny, které jsou podobné strukturálně, liší se ale po stránce funkční. Inhibiny u žen vznikají v granulózových buňkách vaječníků, inhibin A je v průběhu těhotenství produkován také žlutým tělískem a placentou. Inhibiny mají důležitou roli v regulaci folikulogeneze a zrání oocytu. U mužů se inhibiny majoritně tvoří v Sertoliho buňkách varlat, v menší míře pak také v Leydigových buňkách. Jejich syntéza je stimulována působením androgenů, avšak primárně ji reguluje spermatogeneze. V současnosti je ovšem také zřejmé, že funkce inhibinu zahrnuje mnohem širší spektrum účinků, které se netýkají jenom reprodukčního systému. Zdrojem inhibinu A je v těhotenství žluté tělísko a později placenta. Inhibin (a také aktivin) fungují v lidské placentě parakrinně i autokrinně a lokálně ovlivňují tvorbu hormonů v placentě, buněčnou imunitu, růst buněk a diferenciaci placenty a embrya. Placentální cytotrofoblast a syncytiotrofoblast secernuje inhibin A, který inhibuje placentální sekreci hCG a progesteronu. Biochemické látky, které jsou v průběhu těhotenství produkovány placentou, jsou v některých případech využívány jako markery Downova syndromu při provádění screeningu tohoto genetického onemocnění. Bylo zjištěno, že zvýšení hladiny inhibinu A je s určitou pravděpodobností asociováno s přítomností Downova syndromu a je možné jej využít v kombinaci s dalšími biochemickými látkami produkovanými fetoplacentární jednotkou jako biochemický screeningový marker.
Klíčová slova:
inhibin A – Downův syndrom – prenatální screening
Vznik a funkce inhibinů
Inhibiny jsou glykoproteiny patřící do rodiny transformujícího růstového faktoru beta [1], která čítá více než 60 proteinů a zahrnuje dále také aktiviny, které jsou podobné strukturálně, liší se ale po stránce funkční. Do této rodiny látek patří např. také AMH (Anti-Mülleriánský hormon). Inhibin byl poprvé popsán v roce 1923 [2] a je charakterizován jako pohlavní hormon, jehož významnou funkcí je regulace produkce folikulo-stimulačního hormonu (FSH) v buňkách adenohypofýzy [3, 4]. Inhibiny u žen vznikají v granulózových buňkách vaječníků, inhibin A je v průběhu těhotenství produkován také žlutým tělískem a placentou. Inhibiny mají důležitou roli v regulaci folikulogeneze a zrání oocytu. Zatímco inhibin B je produkovaný především malými antrálními folikuly, inhibin A je hormon zralých forem oocytů a těhotenství. Jeho působením dochází ke snížení produkce FSH. V současnosti je ovšem také zřejmé, že funkce inhibinu zahrnuje mnohem širší spektrum účinků, které se netýkají jenom reprodukčního systému. Jakožto jeden z hlavních reprodukčních hormonů je zapojen do parakrinní regulace folikulogeneze (obr. 1), steroidogeneze a ovlivňuje biochemické procesy i v dalších orgánech [5]. U mužů se inhibiny majoritně tvoří v Sertoliho buňkách varlat, v menší míře pak také v Leydigových buňkách (obr. 2). Jejich syntéza je stimulována působením androgenů, avšak primárně ji reguluje spermatogeneze. V krevním oběhu se vyskytuje pouze inhibin B, který negativní zpětnou vazbou tlumí tvorbu FSH v hypofýze.
Obr. 1. The Hypothalamic-Pituitary-Ovarian Axis in women (adopted from [6]) ![The Hypothalamic-Pituitary-Ovarian Axis in women
(adopted from [6])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/57c6ab915c207d6fcbdf698912bc95f0.jpeg)
Obr. 2. The Hypothalamic-Pituitary-Gonadal Axis in men (adopted from [7]) ![The Hypothalamic-Pituitary-Gonadal Axis in men
(adopted from [7])](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/223af156ec06d7cfa8974a394f9f9d08.jpeg)
Struktura inhibinů
Ze strukturálního hlediska jsou inhibiny tvořeny dimerickými glykoproteiny, které se vyskytují ve formě α podjednotky a podjednotek βA a βB (obr. 3). Podjednotka α je společná pro obě molekuly inhibinů a specifičnost je dána přítomností podjednotky βA nebo podjednotky βB. Podjednotka α má molekulovou hmotnost zhruba 20 kDa a je připojena disulfidickou vazbou na jednu ze dvou možných podjednotek β (molekulová hmotnost 13 kDa). β podjednotka se vyskytuje ve dvou modifikacích – βA a βB. Inhibin se tedy vyskytuje ve dvou izoformách. Pokud se spojí do dimeru pouze podjednotky β, vznikne molekula aktivinu, která může existovat ve třech izoformách.
Obr. 3. Schematic diagram of the structures of inhibin and activin 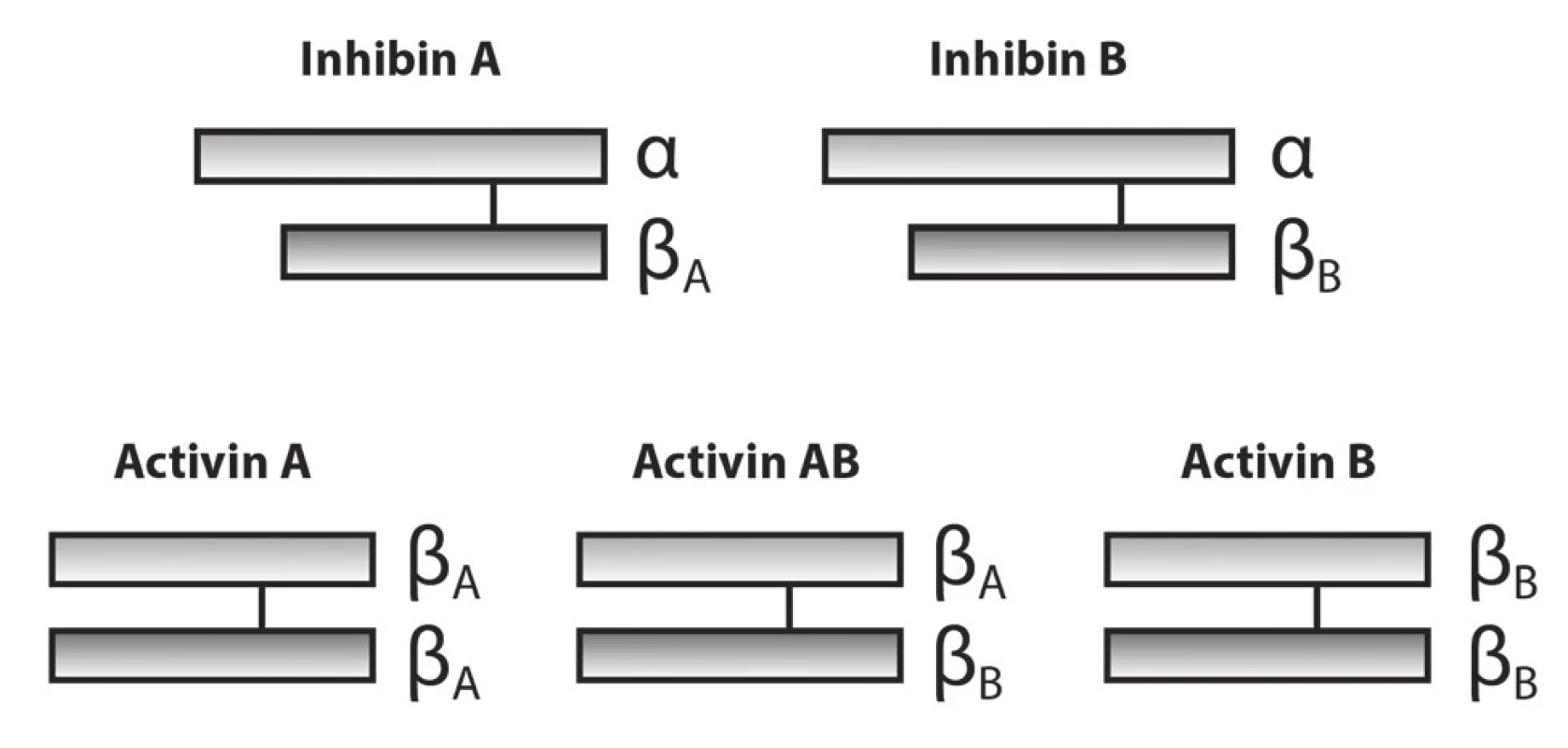
Celkem bylo nalezeno nejméně devět biologicky aktivních forem inhibinu [8, 9]. Tyto formy se liší svou molekulovou hmotností, která je ovlivněna prodloužením řetězce aminokyselin na podjednotkách a tím pádem i větší glykosylací na C - terminálním konci alfa podjednotky [10]. Inhibin je kódován třemi geny, které jsou zodpovědné za produkci tří uvedených peptidů, peptidu α, peptidu βA a βB. Alfa podjednotka inhibinu je u lidí lokalizovaná na chromozomu 2 (2q33-q36) [11], podjednotky βA a βB jsou lokalizovány na chromozomech 7 (7p15-p13), resp. 2 (2cen-q13) [12]. Pouze heterodimerní podjednotky αβA a αβB, které jsou spojené kovalentně disulfidickým můstkem, tvoří aktivní formy inhibinů A a B. Obě formy inhibinu nejen potlačují sekreci FSH v hypofýze, ale také mají lokální modulační efekt na gonadální steroidogenezi [13, 14]. Zralé inhibiny jsou rychle odplaveny z cirkulace, jejich biologický poločas je zhruba 3-6 minut (inhibin A) [15] a asi tři minuty (inhibin B) [15]. Při pokusu s radiačně značeným inhibinem A bylo zjištěno, že se akumuluje ve slezině, nadledvině, kostní dřeni a ováriu [16].
Mechanismus působení inhibinů
Inhibiny i aktiviny jsou členy rodiny TGF-β a mají také společný vazebný membránový protein ActR II [24], (aktivinový receptor typu II), který má vysokou afinitu pro aktivin A a B, s menší afinitou váže také inhibin, který působí jako antagonista aktivinu (jeho navázání blokuje vznik receptorového komplexu). Aktivinové receptory jsou dimery Ser/Thr kinázových podjednotek. Aktivinový receptor typu I - ActR I váže pouze aktivin, po jehož navázání dochází k připojení ActR II za vzniku membránového komplexu a k transfosforylaci podjednotek ActR I. Takto aktivovaný receptorový komplex spouští fosforylační kaskádu zahrnující cytoplasmatické SMAD proteiny, které slouží jako přenašeče extracelulárních signálů ligandů z rodiny TGF-β do jádra [17], kde ovlivňují transkripci příslušných genů. SMAD proteiny dělíme do několika tříd:
- R-SMAD: receptorem regulované SMAD proteiny (SMAD 1, 2, 3, 5, 8/9)
- Co-SMAD: interagují s R-SMAD při přenosu signálu (pouze SMAD 4)
- I-SMAD: inhibují ostatní SMAD proteiny (SMAD 6, 7)
Inhibin se rovněž váže na receptor p120 (inhibinový receptor, protein o molekulové hmotnosti 120 kDa), který je specifický pro inhibin B a vyskytuje se v hypofýze a v Leydigových i Sertolliho buňkách. Dále se inhibin váže na TGF-βR III (receptor typu III pro transformující růstový faktor beta), jiným názvem β-Glykan, který působí jako ko-receptor inhibinu a zvyšuje jeho afinitu k vazbě na ActRII. Tím inhibuje stimulační efekt aktivinu cestou tohoto receptoru.
Degradace inhibinů
Degradace inhibinů probíhá, podobně jako u jiných peptidových hormonů, za pomoci receptory zprostředkované endocytózy [18]. V místě vzniku komplexu inhibin-receptor dochází k postupnému vchlípení plazmatické membrány (invaginaci) a vzniku váčku (endozomu), který se následně spojí s lysozomem obsahujícím proteolytické enzymy. Vzniklé fragmenty jsou dále chemicky modifikovány jaterními enzymy a malé peptidy jsou vyloučeny močí. Tímto mechanismem dochází vlastně k modulaci účinku inhibinu, neboť se snižuje koncentrace hormonu v krvi i počet receptorů v cílových buňkách. Na vzniku endozomu se podílí protein klathrin, který vytváří polymerní prostorové struktury v místě invaginace a přes tzv. adaptorové proteiny interaguje cytoplazmatickými doménami receptorů. Díky GTPáze dynaminu dochází pak k odštěpení vezikulu od cytoplazmatické membrány. Klathrinový plášť je poté uvolněn za pomocí auxilinu nebo heat shock cognate proteinu 70 a vezikul fúzuje s časným endozomem [19].
Existují také mechanismy endocytózy nezávislé na klathrinu, např. kaveolární endocytóza, při níž vznikají tzv. kaveoly (vchlípeniny plasmatické membrány) obsahující proteiny kaveoliny, které v membráně asociují s cholesterolem a se sfingolipidy. I v této dráze hraje důležitou roli při odštěpení vezikulu GTPáza dynamin, vzniklé váčky mohou splývat s tzv. kaveozomy (speciální endozomy bohaté na kaveoliny), ale také s klasickými časnými endozomy. Z časného endozomu jsou pohlcené látky tříděny do různých lokalit. Vezikuly jsou recyklovány zpět na plazmatickou membránu a ostatní náklad může být transportován do lysozomu. Důležitým krokem na cestě mezi časným endozomem a lysozomem je tvorba multivezikulárních tělísek, do nichž jsou transportovány především receptory značené ubiquitinem, které jsou určeny k degradaci. V případě, že má dojít k recyklaci receptorů, slouží endocytóza k dočasnému snížení počtu receptorů na plazmatické membráně. Endocytóza také může vést k odstranění ligandů z povrchu buňky (ligand je degradován, receptor je recyklován).
Účinek inhibinu A v těhotenství a jeho využití
Zdrojem inhibinu A je v těhotenství žluté tělísko a později placenta. Inhibin (a také aktivin) fungují v lidské placentě parakrinně i autokrinně a lokálně ovlivňují tvorbu hormonů v placentě, buněčnou imunitu, růst buněk a diferenciace placenty a embrya. Inhibin A navíc vstupuje do mateřské cirkulace a může mít endokrinní efekt během těhotenství. Sérové změny těchto proteinů reflektují změny v placentální syntéze a sekreci [6]. Právě během těhotenství je jedním z hlavních cirkulujících proteinů inhibin A [20; 21]. Jeho sérová hladina klesá zhruba od 8. do 16. týdne gestace. Hladina zůstává nižší během druhého trimestru, poté se ale zvyšuje až pětinásobně během třetího trimestru a dosahuje maxima ve 36. týdnu gestace [6]. Většina inhibinu detekovatelného v séru je pravděpodobně placentárního původu [22; 20]. Funkce inhibinu A během těhotenství není zatím objasněna, pravděpodobně má ale autokrinní i parakrinní vliv na úrovni placenty a corpus luteum [23]. Placentální cytotrofoblast a syncytio-trofoblast secernuje inhibin A, který inhibuje placentální sekreci hCG a progesteronu. Biochemické látky, které jsou v průběhu těhotenství produkovány placentou, jsou v některých případech využívány jako markery Downova syndromu při provádění screeningu tohoto genetického onemocnění. Bylo zjištěno, že zvýšení hladiny inhibinu A je s určitou pravděpodobností asociováno s přítomností Downova syndromu a je možné jej využít v kombinaci s dalšími biochemickými látkami produkovanými fetoplacentární jednotkou [14].
Současný stav screeningu vrozených vývojových vad a role inhibinu A
Obecným problémem všech screeningových programů využívaných v lékařské praxi jsou falešně pozitivní výsledky hledaných onemocnění tam, kde reálně onemocnění není přítomno. Stejným problémem jsou také případy, kdy onemocnění je přítomno, ale screeningovým testem není odhaleno, tedy situace, kdy výsledek screeningu je falešně negativní. Pokud je určitý test nebo vyšetření zvažováno pro využití v medicínském screeningu, tak musí být zřejmé, jaké onemocnění hledáme a s jakou frekvencí se vyskytuje ve zkoumané populaci, s jakou pravděpodobností jej odhalíme a s jakou pravděpodobností se nám to nepodaří. Pokud je screeningový test založen na vyšetření jednoho konkrétního parametru, tak se jedná o jednoduchý systém, jehož efektivita je zpravidla jednoduše stanovitelná. V případě prenatálního screeningu, zaměřeného na přítomnost Downova syndromu u nenarozených plodů, je situace komplikovanější. Vychází to ze skutečnosti, že je k dispozici několik biochemických parametrů, které mohou být vyšetřovány v různých stadiích těhotenství. Každý z těchto biochemických parametrů má svou vlastní senzitivitu a pravděpodobnostní koeficient [24], který určuje, s jakou pravděpodobností samostatně provedený test zachytí hledané onemocnění. Při využití více parametrů je celková pravděpodobnost dána součinem jednotlivých pravděpodobnostních koeficientů. Pokud provádíme biochemická vyšetření v 1. trimestru, tak si navíc musíme být vědomi, že v průběhu zhruba čtyř týdnů, kdy může být vyšetření provedeno, se efektivita jednotlivých vyšetření mírně mění [25]. V prvním trimestru těhotenství, tedy při gestačním stáří plodu mezi 10. týdnem a nultým dnem až 13. týdnem a šestým dnem, je ovšem nejlepším samostatně prováděným screeningovým vyšetřením měření nuchální translucence (NT) (FMF–Fetal Medicine Foundation). Vzhledem k tomu, že se jedná o ultrazvukové měření, jehož výsledkem je reálné číslo, tak je možno s ním statisticky pracovat stejným způsobem jako s výsledky biochemických vyšetření. Při porovnání biochemických výsledků a výsledků získaných při UZ měřeních je třeba si uvědomovat naprosto zásadní rozdíl z pohledu kontroly kvality. U biochemických měření se zpravidla jedná o výsledky, u kterých je zaručena vysoká míra reprodukovatelnosti, což vychází z provádění těchto testů na automatizovaných systémech. Kvalita ultrazvukových měření je daleko více závislá na konkrétním operátorovi a značný vliv má erudice ultrazvukového specialisty. Z praxe je patrné, že ani u jednoho konkrétního operátora nelze zaručit, že výsledek měření u jednoho těhotenství, provedený několikrát po sobě bude identický, resp. bude splňovat požadavky na přijatelnou reprodukovatelnost. V tomto případě ovšem může hrát roli nejen subjektivní vjem odečtu měření, ale také poloha plodu a tzv. ultrazvuková viditelnost, která je ovlivněna např. hmotností těhotné ženy. Z výše uvedeného je patrné, že ačkoliv jsou výsledky biochemických testů používaných pro screening Downova syndromu u plodu o něco méně efektivní než měření NT, tak jejich dobrá reprodukovatelnost je činí při provádění tohoto typu screeningu nezastupitelnými.
V prvním trimestru se rutinně používají dva biochemické markery PAPP-A (specifický těhotenský protein A) a free β-hCG (volná β podjednotka hCG). V posledních letech se objevil další nadějný biochemický test, který je možno vyšetřovat v prvním trimestru a tím je PlGF (placentární růstový faktor). Využití PlGF je ovšem ve větší míře spojeno se stanovením rizika vzniku preeklampsie [26]. Určitou organizační komplikací při provádění kombinovaného testu (kombinovaný test - způsob provádění screeningu vrozených vývojových vad v 1. trimestru těhotenství, založený na kombinaci biochemických a ultrazvukových parametrů) s využitím PlGF je skutečnost, že je vhodné vzorek krve těhotné ženy vyšetřovat až v probíhajícím 14. týdnu [27], a tak by bylo potřeba provést dva odběry krve. V případě PAPP-A a free β-HCG je v optimálním případě doporučován odběr v 11. nebo 12. týdnu těhotenství. Načasování doby odběru prvotrimestrálních biochemických látek vychází ze stanovení nejvyšších senzitivit těchto markerů vzhledem ke gestačnímu stáří plodu. Z pohledu těhotné ženy je kombinovaný test výhodným screeningovým testem, protože se výsledek screeningu dozví už v časnějším stádiu těhotenství. Na druhé straně je třeba vzít do úvahy, že určitým omezujícím faktorem je dostupnost kvalitního UZ vyšetření a zejména zajištění porovnatelnosti těchto ultrazvukových měření mezi jednotlivými pracovišti (operátory). V minulých letech byla efektivita kombinovaného testu v porovnání s výsledky z reálné praxe mírně nadhodnocována. Reálnou situaci zřejmě dobře dokumentují výsledky získané v rámci tzv. NEXT Study [28], kdy byla porovnávána efektivita kombinovaného testu a neinvazivního testu Harmony. Na souboru téměř dvaceti tisíc těhotných se prokázalo, že senzitivita kombinovaného testu nedosáhla ani 80 %. Dalším faktorem, který je třeba při hodnocení efektivity kombinovaného testu vzít do úvahy je fakt, že zhruba jedna třetina těhotenství nesoucí plod postižený Downovým syndromem, samovolně zanikne mezi prvním a druhým trimestrem těhotenství [29]. Tato skutečnost statisticky ovlivňuje posouzení skutečné efektivity screeningu, která by samozřejmě měla být vztažena k těhotenství, které je ukončeno porodem.
Poněkud jiná situace je ve druhém trimestru těhotenství, kdy pro účely screeningu Downova syndromu jsou rutinně využívány pouze biochemické látky. V České republice se už od první poloviny devadesátých let stanovují AFP (α1-fetoprotein), uE3 (nekonjugovaný es-triol) a hCG (lidský choriový gonadotropin) v rámci tzv. triple testu (způsob provádění screeningu vrozených vývojových vad ve 2. trimestru těhotenství, založený na testování výše uvedených biochemických parametrů). Je zajímavé, že ačkoliv v mnoha zemích světa (např. Velká Británie, USA, Německo a Itálie) se stanovuje jako čtvrtý parametr inhibin A (takto prováděný screening vývojových vad bývá označován jako kvadruple test), tak v České republice se tento test nikdy nestal standardní součástí biochemického prenatálního testování, a to i přes skutečnost, že efektivitu screeningu zvyšuje. Testování biochemických parametrů ve druhém trimestru může být ovšem také součástí tzv. integrovaného testu. Integrovaný test statisticky společně vyhodnocuje výsledky parametrů testovaných jak v 1., tak ve 2. trimestru těhotenství do jednoho výsledného rizika a je nejefektivnější konvenční screeningovou strategií, tedy screeningem neprováděným na bázi NIPT (Non-invasive prenatal testing – neinvazivní prenatální testování, způsob provádění screeningu vrozených vývojových vad založený na sekvenování fragmentů volné DNA plodu v krevním oběhu matky).
Jak už bylo řečeno výše, posuzování efektivity screeningového protokolu se provádí srovnáním senzitivity, falešné pozitivity, ev. vyjádřením pozitivní prediktivní hodnoty screeningového testu. Screeningem by mělo být objeveno co možná nejvíce těhotenství, která mají postižený plod s hledaným onemocněním, ale na druhé straně je žádoucí, aby se zbytečně neprováděla další vyšetření na základě falešně pozitivních výsledků. Právě vysoké procento falešně pozitivních výsledků je nežádoucím jevem při provádění jakéhokoliv screeningu [24]. V roce 2019 byla publikována studie [30], která ukazovala, že využití inhibinu A jako dalšího biochemického parametru má významný vliv na distribuci kalkulovaných rizik přítomnosti Downova syndromu jak u triple testu, tak u integrovaného testu. Významnou roli při vyhodnocování výsledků screeningu hraje také nastavení rozhodovacích limitů u jednotlivých screeningových programů. Snížení počtu falešně pozitivních výsledků příznivě ovlivňuje kvalitu prenatálního testování. V prvním případě může dojít ke snížení počtu zbytečně provedených invazivních zákroků (CVS, amniocentéza). Pokud by konvenční screeningový test byl použit v kombinaci s neinvazivním DNA testováním, tak lepší stratifikace rizika postižení plodu může přispět k efektivnějšímu využití NIPT. Celkové objektivní posouzení efektivity inhibinu A ve screeningových protokolech bylo provedeno ve dvou multicentrických studiích [31, 32] na velkém počtu těhotných žen, kdy byly vyhodnoceny informace o přítomnosti, či nepřítomnosti hledaného genetického onemocnění u plodů.
V roce 2012 byl do praxe uveden první screeningový test založený na sekvenaci extracelulární DNA plodu v krvi nastávající matky (NIPT) [33]. Efektivita tohoto typu testování je v porovnání se všemi konvenčními screeningovými postupy výrazně vyšší, ale existuje několik důvodů, proč zřejmě v nejbližších letech nedojde k nahrazení konvenčních screeningových postupů za NIPT. Dostupnost tohoto typu testování je v porovnání s běžným biochemickým a ultrazvukovým vyšetřením omezenější, což vychází zejména z požadavků na přístrojové vybavení a erudici provádějících pracovníků. Dalším důvodem je také mnohem vyšší cena tohoto vyšetření v porovnání s běžnými biochemickými parametry. Alternativním způsobem využití NIPT je jeho začlenění do konvenčních screeningových postupů tak, aby došlo ke zlepšení základních charakteristik screeningu a přitom nedošlo k neúměrnému zvýšení nákladů na celkový screeningový proces [34].
Z výše uvedených důvodů lze usuzovat, že zavedení inhibinu A do screeningového protokolu triple testu a integrovaného testu má stále svůj význam i v dnešní době, kdy jsou k dispozici sekvenační techniky. Zavedení inhibinu A do screeningového protokolu by se dle údajů Registru laboratoří zabývajících se screeningem VVV týkalo přibližně kolem 50 % těhotných žen v České republice [35], tedy těch, které absolvují integrovaný test nebo triple test.
Střet zájmů: Autoři prohlašují, že nejsou ve střetu zájmů.
Do redakce došlo 27. 8. 2019
Adresa pro korespondenci
RNDr. Jaroslav Loucký, Ph.D.
Hořejší 5399
760 01 Zlín
Zdroje
1. Mason, A. J., Hayflick, J. S., Ling, N., Esch, F., Ueno, N., Ying, S.-Y., Guillemin, R., Niall, H. and Seeburg, P. H. Complementary DNA sequences of ovarian follicular fluid inhibin show precursor structure and homology with transforming growth factor-β. Nature 1985, 318(6047), p. 659–663.
2. McCullagh, D. R. Dual endocrine activity of the testes. Science (New York, N.Y.), 1932, 76(1957), p. 19–20.
3. De Jong, F. H. and Sharpe, R. M. Evidence for inhibin-like activity in bovine follicular fluid. Nature, 1976, 263(5572), p. 71–72.
4. Ledger, W. L. and Muttukrishna, S. Inhibin, Activin and Follistatin in Human Reproductive Physiology. Edi-ted by S. Muttukrishna. London: Imperial College Press, 2014
5. Woodruff, T. K., Lyon, R. J., Hansen, S. E., Rice, G. C. and Mather, J. P. Inhibin and activin locally regulate rat ovarian folliculogenesis. Endocrinology, 1990, 127(6), p. 3196–3205.
6. Gupta, M. K. and Chia, S.-Y. Ovarian hormones: structure, biosynthesis, function, mechanism of action, and laboratory diagnosis. in Clinical Reproductive Medicine and Surgery, New York, NY, 2013, p. 1–30.
7. Kiserud, C. E., Magelssen, H., Fedorcsak, P. and Fosså, S. D. Gonadal function after cancer treatment in adult men. Tidsskrift for den Norske laegeforening: tidsskrift for praktisk medicin, ny raekke, 2008, 128(4), p. 461–465.
8. Good, T., Weber, P. S., Ireland, J. L., Pulaski, J., Padmanabhan, V., Schneyer, A. L., Lambert-Messerlian, G., Ghosh, B. R., Miller, W. L. and Groome, N. Isolation of nine different biologically and immunologically active molecular variants of bovine follicular inhibin. Biology of reproduction, 1995, 53(6), p. 1478–88.
9. Robertson, D., Burger, H. G., Sullivan, J., Cahir, N., Groome, N., Poncelet, E., Franchimont, P., Woodruff, T. and Mather, J. P. Biological and immunological characterization of inhibin forms in human plasma. Journal of Clinical Endocrinology and Metabolism, 1996, 81(2), p. 669–676.
10. Sugino, K., Kurosawa, N., Nakamura, T., Takio, K., Shimasaki, S., Ling, N., Titani, K. and Sugino, H. Molecular heterogeneity of follistatin, an activin-binding protein. Higher affinity of the carboxyl-terminal truncated forms for heparan sulfate proteoglycans on the ovarian granulosa cell. The Journal of biological chemistry, 1993, 268(21), p. 15579–87.
11. Barton, D. E., Yang-Feng, T. L., Mason, A. J., Seeburg, P. H. and Francke U. Mapping of genes for inhi-bin subunits α, βa, and βB on human and mouse chromosomes and studies of jsd mice. Genomics, 1989, 5(1), p. 91–99.
12. Mason, A. J., Niall, H. D. and Seeburg, P. H. Structure of two human ovarian inhibins. Biochem. Biophys. Res. Commun., 1986, 135, p. 957–964.
13. Baird, D. T. and Smith, K. B. Inhibin and related peptides in the regulation of reproduction. Oxford reviews of reproductive biology, 1993, 15, p. 191–232.
14. Wald, N. J., Densem, J. W., George, L., Muttukrishna, S. and Knight, P. G. Prenatal screening for Down’s syndrome using inhibin-A as a serum marker. Prenatal diagnosis, 1996, 16(2), p. 143–53.
15. Makanji, Y., Temple-Smith, P. D., Walton, K. L., Harrison, C. A. and Robertson, D. M. Inhibin b is a more potent suppressor of rat follicle-stimulating hormone release than inhibin a in vitro and in vivo. Endocrinology, 2009, 150(10), p. 4784–4793.
16. Woodruff, T. K., Krummen, L. A., Chen, S. A., Lyon, R., Hansen, S. E., DeGuzman, G., Covello, R., Mather, J. and Cossum, P. Pharmacokinetic profile of recombinant human (rh) inhibin A and activin A in the immature rat. II. tissue distribution of [125i]rh-inhibin A and [125i]rh-activin A in immature female and male rats. Endocrinology, 1993b, 132(2), p. 725–34.
17. Stenvers, K. L. and Findlay, J. K. Inhibins: from reproductive hormones to tumor suppressors. Trends in endocrinology and metabolism. Elsevier, 2010, 21(3), p. 174–80.
18. Doherty, G. J. and McMahon, H. T. Mechanisms of endocytosis. Annual review of biochemistry, 2009, 78, p. 857–902.
19. Barth, D. G. and Miyuki, S. Intracellular trafficking. WormBook, ed. The C. Elegans Research Community, 2006, [online] Available at: http://www.wormbook.org/chapters/www.intracellulartrafficking/intracellulartrafficking.html [Accessed: 28-11-2018].
20. Muttukrishna, S., George, L., Fowler, P. A., Groome, N. P. and Knight, P. G. Measurement of serum concentrations of inhibin-A (alpha-beta A dimer) during human pregnancy. Clinical endokrinology, 1995, 42(4), p. 391–7.
21. Fowler, P., Evans, L. W., Groome, N. P., Templeton, A. and Knight, P. G. A longitudinal study of maternal serum inhibin-a, inhibin-b, activin-a, activin-ab, pro-alphac and follistatin during pregnancy. Human reproduction (Oxford, England), 1998, 13(12), p. 3530–6.
22. McLachlan, R. I., Healy, D. L., Robertson, D. M., Burger, H. G. and de Kretser, D. M. Circulating immunoactive inhibin in the luteal phase and early gestation of women undergoing ovulation induction. Fertility and sterility, 1987, 48(6), p. 1001–5.
23. Petraglia, F., Sawchenko, P., Lim, T., Rivier, J. and Vale, W. Localization, secretion, and action of inhibin in human placenta. Science (New York, N.Y.), 1987, 237(4811), p. 187–189.
24. Leck, I. and Wald, N. J. Antenatal and neonatal scree-ning. Oxford: Oxford University Press, 2000.
25. Palomaki, G. E., Lambert-Messerlian, G. M. and Canick, J. A. A summary analysis of Down syndrome markers in the late first trimester. Advances in clinical chemistry, 2007, 43, p. 177–210.
26. Verlohren, S., Herraiz, I., Lapaire, O., et al. The sFlt-1/PlGF ratio in different types of hypertensive pregnancy disorders and its prognostic potential in preeclamptic patients. Am. J Obstet. Gynecol., 2012, 206(1), 58.e1-8
27. Wald, N. J., Bestwick, J. P., Huttly, W. J. Improvements in antenatal screening for Down’s syndrome. J Med Screen, 2013, (20), p. 7–14
28. Norton, M. E., Jacobsson, B., Swamy, G. K, Laurent, L. C., Ranzini, A. C., Brar, H., Tomlinson, M. W., Pereira, L., Spitz, J. L., Hollemon, D., Cuckle, H., Musci, T. J., Wapner, R. J. Cell-free DNA Analysis for Noninvasive Examination of Trisomy: The New England Journal of Medicine, 2015, 372(17), p. 1589-1597
29. Macintosh, M. C., Wald, N. J., Chard, T., Hansen, J., Mikkelsen, M., Therkelsen, A. J., Petersen, G. B., Lundsteen, C. Selective miscarriage of Down’s syndrome fetuses in women aged 35 years and older. Br J Obstet. Gynaecol., 1995, 102(10), p. 798-801.
30. Loucky, J., Belaskova, S., Prusa, R., Kotaska, K. The effect of inhibin A on prenatal screening results for down syndrome in the high risk Czech pregnant women, Clin. Lab., 2019, 65, p. 707-716
31. Wald, N. J., Rodeck, C., Hackshaw, A. K. and Rudnicka, A. SURUSS in perspective. BJOG: An International Journal of Obstetrics and Gynaecology, 2004, 111(6), p. 521–531.
32. Malone, F. D., Canick, J. A., Ball, R. H., Nyberg, D. A., Comstock, C. H., Bukowski, R., Berkowitz, R. L., Gross, S. J., Dugoff, L., Craigo, S. D., Timor-Tritsch, I. E., Carr, S. R., Wolfe, H. M., Dukes, K., Bianchi, D. W., Rudnicka, A. R., Hackshaw, A. K., Lambert-Messerlian, G., Wald, N. J. et al. First-trimester or se-cond-trimester screening, or both, for Down’s syndrome. The New England journal of medicine, 2005, 353(19), p. 2001–11.
33. Palomaki, G. E., Kloza, E. M., Lambert-Messerlian, G. M., Haddow, J. E., Neveux, L. M., Ehrich, M., van den Boom, D., Bombard, A. T., Deciu, C., Grody, W. W., Nelson, S. F. and Canick, J. A. DNA sequencing of maternal plasma to detect down syndrome: an international clinical validation study. Genetics in medicine: official journal of the American College of Medical Gene-tics, 2011, 13(11), p. 913–20.
34. Wald, N. J. Prenatal reflex dna screening for trisomy 21, 18 and 13. Expert review of molecular diagnostics.: Taylor & Francis, 2018, 18(5), p. 399–401.
35. Registr laboratoří zabývajících se screeningem VVV. (2018, December 21). Retrieved from: http://www1.lf1.cuni.cz/~dbezd/
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek Doporučení ČSKBČlánek RNDr. Ivan Bilyk
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2020 Číslo 1- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Efektivita léčby a možné indikace liraglutidu v gynekologii
-
Všechny články tohoto čísla
- Progresivní familiární intrahepatální cholestáza v dospělosti: 60leté sledování
- Nefrokalcinóza po transplantaci ledviny jako vzácný projev karcinomu příštítných tělísek
- RNDr. Ivan Bilyk
- Zpráva o biotinu a jeho interferencích u imunoanalytických metod
- Doporučení České společnosti klinické biochemie k jednotkám výsledků měření
- Doporučení České společnosti klinické biochemie a České myelomové skupiny k laboratorní diagnostice monoklonálních gamapatií
- Doporučení ČSKB
- Doporučení: Systém externího hodnocení kvality (EHK)
- Nový koronavirus 2019. Pár základních informací a jejich dostupnost.
- Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Doporučení: Systém externího hodnocení kvality (EHK)
- Doporučení ČSKB
- Doporučení České společnosti klinické biochemie k jednotkám výsledků měření
- Patobiochemie inhibinu A a jeho využití ve screeningu vrozených vývojových vad.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



