-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBorrelia miyamotoi – další emergentní patogen přenášený klíšťaty
Borrelia miyamotoi – another emerging tick-borne pathogen
Borrelia miyamotoi is an emerging tick-borne pathogen phylogenetically belonging to spirochaetes causing relapsing fever. It is primarily transmitted by ticks from the Ixodes ricinus complex, similarly to borreliae causing Lyme borreliosis. Small rodents can serve as reservoir hosts. It is widespread in mild climate areas of the northern hemisphere, with constant low prevalence in ticks, in the range of units of percent. To date more than 200 human cases have been described including five cases of meningoencephalitis in immunocompromised patients. Clinical features of illness are non-specific, characterized by fever, fatigue, chills, headaches, muscles and joint pains. It can be treated with antibiotics. The diagnostic approach includes mainly PCR and serological methods. This review summarizes current knowledge on B. miyamotoi with an emphasis on taxonomy, ecology of vectors and reservoir hosts, geographical distribution, diagnosis and treatment of the disease. The review also highlights the need for an accurate determination of the etiology of the disease and its differentiation from Lyme borreliosis and human granulocytic anaplasmosis.
Keywords:
Borrelia miyamotoi – Borrelia burgdorferi – Ixodes – relapsing fever – Lyme borreliosis – vector – reservoir
Autoři: R. Kejíková 1,2; I. Rudolf 1,2
Působiště autorů: Ústav biologie obratlovců AV ČR, v. v. i., Brno 1; Ústav experimentální biologie, Přírodovědecká fakulta, Masarykova univerzita, Brno 2
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 70, 2021, č. 2, s. 118-130
Kategorie: Souhrnné sdělení
Souhrn
Borrelia miyamotoi patří mezi emergentní patogeny přenášené klíšťaty a fylogeneticky náleží mezi spirochety způsobující tzv. návratné horečky. Je primárně přenášena klíšťaty komplexu Ixodes ricinus podobně jako borrelie způsobující Lymeskou borreliózu. Hostiteli jsou především drobní hlodavci. Je široce rozšířena v mírném pásu severní polokoule s konstantní nízkou prevalencí v klíšťatech v řádu jednotek procent. Dosud byly popsány více než dvě stovky humánních případů onemocnění včetně pěti případů meningoencefalitidy u imunokompromitovaných pacientů. Onemocnění se vyznačuje nespecifickými příznaky, především horečkou, únavou, zimnicí, bolestmi hlavy, svalů a kloubů. Léčba je antibiotická. Diagnostika zahrnuje především PCR a sérologické metody. Přehledová práce přináší současné poznatky o taxonomii, ekologii vektorů a rezervoárových hostitelů, geografickém rozšíření, diagnostice a léčbě onemocnění způsobené spirochetou B. miyamotoi. Práce současně zdůrazňuje potřebu správné etiologie onemocnění a upozorňuje na možnou záměnu s lymeskou borreliózou či lidskou granulocytární anaplazmózou.
Klíčová slova:
Borrelia miyamotoi – Borrelia burgdorferi – Ixodes – návratná horečka – lymeská borrelióza – vektor – rezervoár
ÚVOD
Nemoci přenášené klíšťaty představují významné riziko pro veřejné zdraví. Spektrum těchto onemocnění v našem regionu je velmi široké – od virových (klíšťová encefalitida), přes početné bakteriální (Lymeská borrelióza, lidská granulocytární anaplazmóza, tularémie) až po nákazy protozoární (babezióza). Mnohdy se jedná o tzv. emergentní nákazy, jež byly popsány v posledních dekádách a z pohledu epidemiologického jde vesměs o opomíjená či podhlášená onemocnění. Podle některých studií se riziko výskytu těchto nákaz zvyšuje se změnami environmentálními (např. klimatu – zvýšená aktivita klíšťat, posun klíštěcích vektorů do severních zeměpisných šířek, introdukce nových vektorů z jižních oblastí) či socioekonomických (pobyt lidí v přírodě, suburbanizace či reforestace krajiny) [1–3].
Mezi nedávno popsané patogeny přenášené klíšťaty náleží i Borrelia miyamotoi (dále jen B. miyamotoi), která byla objevena v klíštěti Ixodes persulcatus v roce 1995 v Japonsku [4], posléze detekována v roce 2001 v USA a o rok později i v Evropě (Švédsko) [5, 6]. První případy onemocnění B. miyamotoi u člověka byly popsány v ruském Jekatěrinburgu při testování souboru 302 pacientů s podezřením na Lymeskou borreliózu. U 46 z nich potvrdili infekci B. miyamotoi. Kritéria zahrnovala potvrzené sání klíštětem, příznaky podobné lymeské borrelióze (horečka, únava a bolest svalů), detekci B. miyamotoi v krvi pomocí PCR (gen pro 16S rRNA) a detekci specifického anti-borreliálního IgM. Pacienti infikovaní B. miyamotoi vykazovali známky akutního horečnatého onemocnění, které mělo pomalejší nástup než lymeská borrelióza. Laboratorní nálezy také ukázaly změny krevního obrazu a jaterních testů (leukopenie, trombocytopenie, zvýšené hodnoty ALT a AST). U 4 pacientů byla zaznamenána erythema migrans (EM), ale koinfekce s B. burgdorferi s. l nebyla potvrzena. Celkem 5 pacientů zaznamenalo relaps horečky, typický pro onemocnění návratnou horečkou. Pacienti byli léčení ceftriaxonem intravenózně nebo doxycyklinem perorálně. U 7 pacientů byla zaznamenána Jarisch-Herxheimerova reakce po podání ATB [7].
Dosud byly kromě Ruska popsány případy onemocnění u člověka v USA, Kanadě, Japonsku, Číně, Nizozemí či Německu včetně komplikovaných případů meningoencefalitidy u imunokompromitovaných pacientů [8–15]. Nově byl zaznamenán i případ u pacienta v Rakousku [16].
Spirocheta B. miyamotoi náleží v rámci rodu Borrelia mezi skupinu borrelií způsobujících návratnou horečku. Zatímco většina medicínsky významných zástupců (např. B. duttoni, B. hermsii či B. hispanica) je přenášena výhradně klíšťáky čeledi Argasidae (rody Argas a Ornithodoros), B. miyamotoi je přenášená klíšťaty rodu Ixodes [4, 17–20].
Cílem souhrnné práce bylo podat ucelený obraz spirochety B. miyamotoi – popsat přenašeče (vektory), rezervoáry, hostitele, geografické rozšíření, ale také klinické charakteristiky onemocnění způsobené tímto patogenem a možnost jeho diagnostiky a léčby. Důraz byl kladen i na výskyt agens v České republice a riziko nákazy B. miyamotoi včetně nástinu preventivních opatření a surveillance.
FYLOGENETICKÉ POSTAVENÍ B. MIYAMOTOI
B. miyamotoi náleží do rodu Borrelia, čeledi Borreliaceae a kmene Spirochaetes. Rod Borrelia je podle současné klasifikace členěn na 3 skupiny – tzv. ‚RF borrelie‘ (‚relapsing fever borreliae‘), ‚LD borrelie‘ (‚Lyme disease borreliae‘) a také na nově objevené ‚REP borrelie‘ (‚reptile - associated borrreliae‘), přičemž se spekuluje i o čtvrté skupině tzv. ‚echidna-associated borrelií (izolovány z klíšťat Bothriocroton concolor sajících na australských ježurách). Spirocheta B. miyamotoi je řazena mezi ‚RF borrelie‘, a současně tvoří skupinu s ostatními ‚RF borreliemi‘, které jsou přenášeny klíšťaty čeledi Ixodidae – tj. B. lonestari přenášená Amblyomma americanum a B. theileri, jejímž vektorem je Rhipicephalus microplus [4, 17, 21–24]. V současné době se živě spekuluje o problematice diverzity v rámci rodu Borrelia. V roce 2014 byl rod validně rozdělen na dva samostatné – na rod Borrelia, kam náleží ‚RF borrelie‘ a na rod Borreliella, kam byly přeřazeny ‚LD borrelie‘ [25, 26, 27]. Proti tomu se však ohradila celá řada vědců působících ve výzkumu borrelií a spekuluje se o tom, zda toto rozdělení je adekvátní a dostatečně postihuje rozmanitost rodu Borrelia [28–31]. V březnu roku 2020 bylo navrženo toto rozdělení zrušit, protože panují obavy, že nové pojmenování Borreliella může způsobit diagnostickou nejistotu především v lékařských kruzích. Název Borreliella má tak aktuálně status synonyma [32]. V rámci vnitrodruhové rozmanitosti rozlišujeme u B. miyamotoi tři geograficky odlišitelné genotypy – asijský genotyp (B. miyamotoi sensu stricto), nejčastěji přenášený I. persulcatus, dále evropský genotyp, typicky přenášený I. ricinus, a nakonec genotyp americký, přenášený nejčastěji I. scapularis a I. pacificus. Zvažuje se i zařazení dalšího genotypu přenášeného klíštětem I. ovatus v Japonsku [18, 19, 33, 34, 35, 38].
PŘENAŠEČI (VEKTORY) B. MIYAMOTOI
Jedná se o zatím jediné agens skupiny návratných horeček, které je přenášeno klíšťaty rodu Ixodes (tab. 1) [36, 37]. V Evropě a části Asie je hlavním vektorem Ixodes ricinus, v Asii jsou vektory I. persulcatus (v pásu zahrnujícím Baltské země až po Dálný východ), I. ovatus (jihovýchodní Asie), I. pavlovskyi (v pásu zahrnující západní Sibiř až po Dálný východ) a v Severní Americe I. scapularis (středovýchodní a středozápadní část USA), I. pacificus (západní pobřeží USA) a I. dentatus (východní část USA) [20]. V posledních letech však přibývají i nálezy u dalších zástupců čeledi Ixodidae – klíšťat rodu Dermacentor a Haemaphysalis. Jedná se ovšem o ojedinělé nálezy a dosud není jasné, zda jsou tyto druhy klíšťat kompetentním vektorem pro B. miyamotoi [12, 43–48]. Charakteristickou vlastností B. miyamotoi je schopnost jak transovariálního přenosu (TOP), tak i transstadiálního přenosu (TSP). TOP u B. miyamotoi poprvé popsali Scoles et al. v roce 2001, kdy 2 z 52 infikovaných samiček přeneslo B. miyamotoi na potomstvo, přičemž míra filiální infekce (podíl infikovaného potomstva) byl velmi variabilní: 6–73 %. Podobná variabilita byla dokumentována i v dalších pracech (Han et al. 2019 – podíl infikovaného potomstva byl 36–100 %) [5, 49, 50]. Schopnost TOP také odlišuje B. miyamotoi od B. burgdorferi s. l., u které TOP nebyl dosud jednoznačně prokázán. Některé starší práce dokumentují výskyt B. burgdorferi u larev, avšak metody, které byly použity (fluorescenční mikroskopie s využitím polyklonálního séra) vykazují zkřížené reakce s B. miyamotoi. Druhým možným vysvětlením je fakt, že larvy, ve kterých byla detekována B. burgdorferi, byly již částečně nasáté [50–54].
Tab. 1. Přehled druhů klíšťat, ve kterých byla B. miyamotoi dosud detekována
Table 1. Detections of B. miyamotoi in ixodid ticks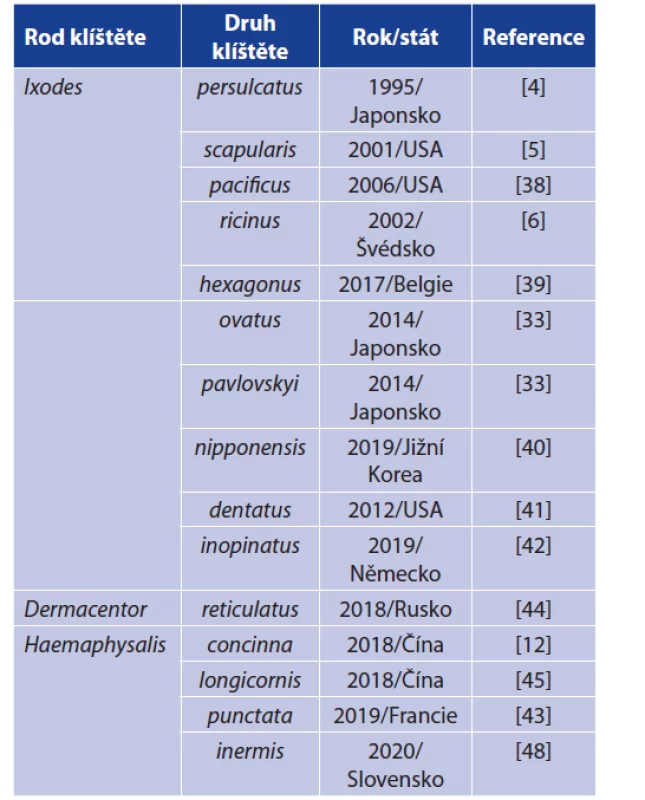
Poznámka: Jsou uvedeny vždy první záchyty v daném druhu klíštěte.
Remark: Only first findings are recorded in particular tick species.Druhým mechanismem napomáhajícím přenosu a udržovaní B. miyamotoi ve vektorech a hostitelích je TSP. Scoles et al. [5] poprvé experimentálně dokumentovali kompletní TSP (do dospělců byla B. miyamotoi přenesena z 61 % nymf). Lynn et al. [55] ve své práci uvádějí, že pouze 1 ze 4 nymf, které se vyvinuly z nakažených larev, zůstala infikována B. miyamotoi. Ačkoliv TOP ani TSP neprobíhají s maximální účinností, přesto představují významný nástroj pro šíření B. miyamotoi, především TOP je efektivní strategií pro udržování stabilní prevalence i bez dostupnosti nakažených hostitelů, tj. klíště se stává i rezervoárem infekce [50, 55].
HOSTITELÉ A REZERVOÁRY B. MIYAMOTOI
B. miyamotoi byla dosud nalezena v široké škále obratlovců (tab. 2). Jedná se především o drobné savce, zejména hlodavce, ale také ptáky, což koresponduje s vývojovými cykly klíštěte komplexu I. ricinus. Zajímavá je i detekce B. miyamotoi v krvi divokých krocanů (Meleagris gallopavo) v USA, kde byla zjištěna 58% prevalence, což je vůbec nejvyšší prevalence B. miyamotoi v jakékoliv populaci volně žijících obratlovců [62].
Tab. 2. Přehled obratlovců, ve kterých byla B. miyamotoi dosud detekována
Table 2. Detections of B. miyamotoi in vertebrate hosts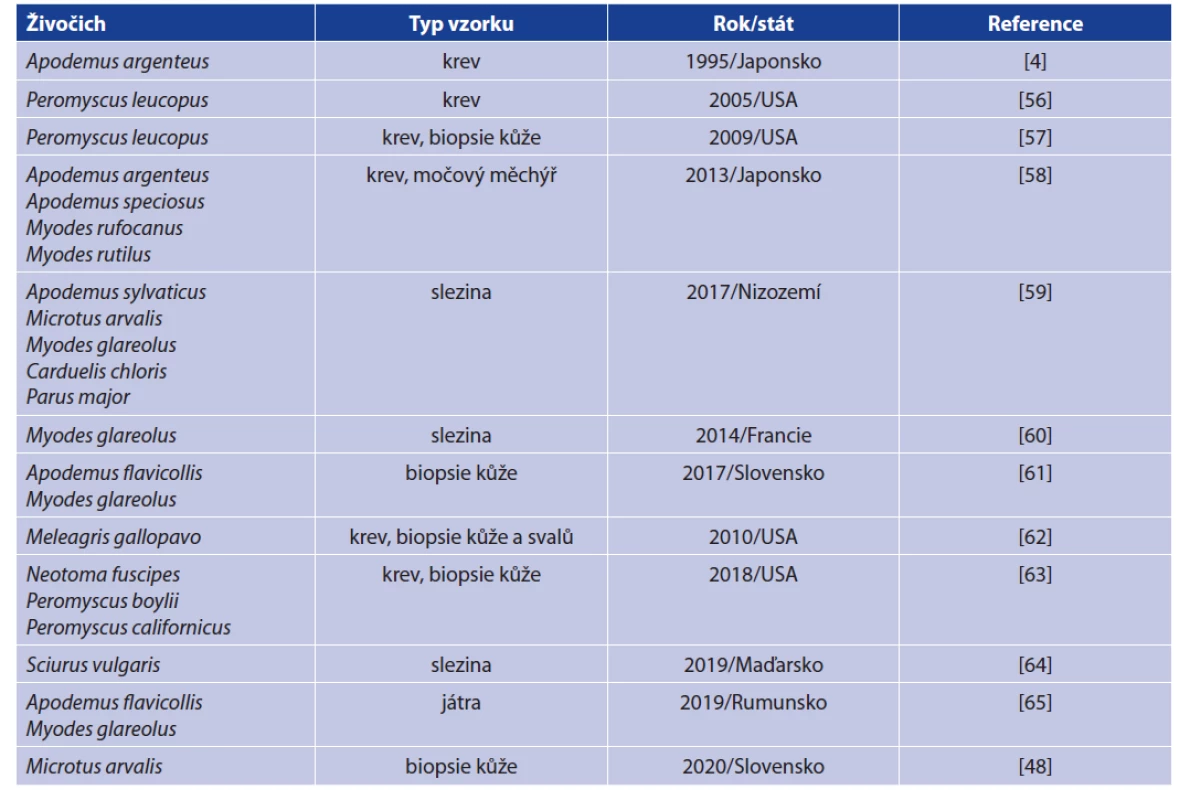
V případě některých drobných hlodavců byla studována jejich kompetence pro přenos B. miyamotoi, tzn. schopnost být patogenem nakažen, ale současně jej přenést na sající klíšťata. Tato vlastnost byla prokázána pomocí xenodiagnostiky u myšice lesní (Apodemus flavicollis) a norníka rudého (Myodes glareolus) v Evropě a křečíka bělonohého (Peromyscus leucopus) v USA. Je pravděpodobné, že kompetentní rezervoáry bude představovat více druhů drobných savců (viz tab. 2), především pak i jiné druhy rodu Apodemus a Myodes [4, 57–61, 66].
B. miyamotoi byla také detekována v klíšťatech, jež sála na různých druzích obratlovců (savců a ptáků), může se jednat o hostitele či potenciální rezervoáry. Ze savců lze uvést prase divoké (Sus scrofa), srnce obecného (Capreolus capreolus) [67], jelena lesního (Cervus elaphus) [70], jelena běloocasého (Odocoileus virginianus) [68, 69], ježka západního (Erinaceus europaeus) [39] či domácí psy [54]. U klíšťat sňatých z ptáků potom kosa černého (Turdus merula) [67], dále kardinála červeného (Cardinalis cardinalis), drozda rezavoocasého (Catharus guttatus) a drozda stěhovavého (Turdus migratorius) [41]. Kromě přímých průkazů byla B. miyamotoi detekována také sérologicky v jelenovi milu (Elaphurus davidianus) v Číně [45]. Ačkoliv je spektrum hostitelů a rezervoárů B. miyamotoi podobné jako u B. burgdorferi s. l., ukazuje se, že tyto spirochety využívají rozdílných strategií při cirkulaci v obratlovčím hostiteli. Mezi nejdůležitější rozdíly patří skutečnost, že B. miyamotoi se vyskytuje ve vyšší denzitě v krvi obratlovce ve srovnání s B. burgdorferi s. l., jejíž výskyt je hojnější v kůži. B. miyamotoi vyskytovala v krvi až v 5krát vyšších počtech než v kůži, zatímco B. burgdorferi s. l. byla 40krát hojnější v kůži než v krvi hlodavců. B. burgdorferi s. l. je tak schopná ve svých hostitelích dlouhodobě perzistovat, kdežto výskyt B. miyamotoi v hostiteli je omezen jen na dobu akutní bakterémie [36, 57, 58].
GEOGRAFICKÉ ROZŠÍŘENÍ B. MIYAMOTOI A JEJÍ VÝSKYT V KLÍŠTĚTI V POROVNÁNÍ S B. BURGDORFERI
Spirocheta byla dosud dokumentována v mnoha oblastech Asie, Evropy i Severní Ameriky a a její výskyt je striktně vázán na oblasti výskytu vektorů – tzn. na oblast mírného pásma severní polokoule (výskyt v mírném pásmu jižní polokoule dosud zaznamenán nebyl) [36, 37].
Prevalence B. miyamotoi v klíšťatech v jednotlivých zemích shrnují tabulky 3 a 4. Pro prevalenci B. miyamotoi je typické, že je stabilně nízká v řádu jednotek procent. Dosud nejvyšší prevalenci dokumentovali Rar et al. v roce 2019 (8,9 % v klíštěti I. persulcatus a 6,4 % v klíštěti I. pavlovskyi). Prevalence B. burgorferi s. l. je oproti B. miyamotoi mnohdy až desetinásobná, což je překvapivé, uvážíme-li, že tyto dvě spirochety sdílí vek - tory a mnohé hostitele a navíc B. miyamotoi má výhodu TOP [36, 57, 84]. Tato nižší prevalence B. miyamotoi oproti B. burgdorferi s. l. bude mít patrně několik příčin. Jak již bylo zmíněno, B. miyamotoi ve svých hostitelích dlouhodobě neperzistuje a schopnost nakazit klíště je tedy omezena jen na fázi akutní bakterémie. Spekuluje se také o možném negativním vlivu spirochéty na životaschopnost klíšťat. To vše jen podtrhuje důležitost TOP pro cirkulaci B. miyamotoi [37, 57, 58, 61]. Skutečnosti, že B. miyamotoi a B. burgdorferi nevyužívají stejné strategie či mechanismy přežití může napovědět i míra koinfekce v klíšťatech. Některé práce dokumentují nižší počet koinfekcí při náhodné distribuci, jiné zase uvádějí statisticky významný počet koinfekcí, zůstává tedy otázkou, zda jsou koinfekce náhodné či ne [20, 59, 81, 121].
Tab. 3. Prevalence B. miyamotoi v klíšťatech v Severní Americe a Asii
Table 3. Prevalence of B. miyamotoi in ixodid ticks from North America and Asia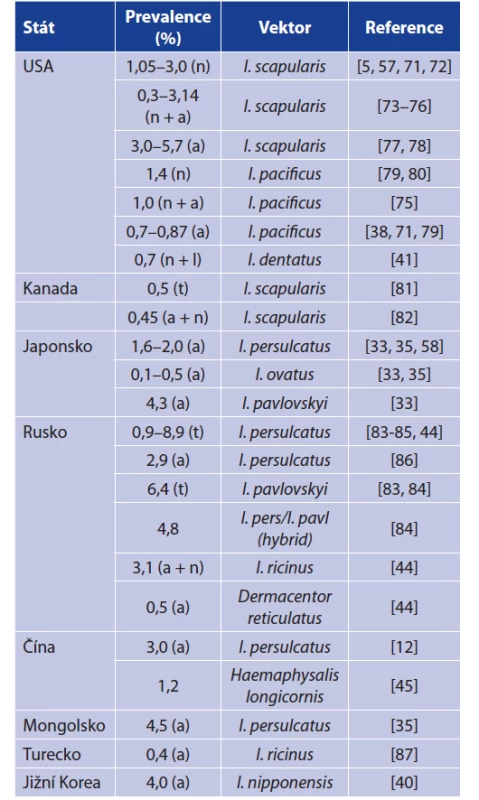
Vysvětlivky: l = larva, n = nymfa, a = dospělec, t = celková prevalence
Explanations: l = larva, n = nymph, a = adult, t = overall prevalenceTab. 4. Prevalence B. miyamotoi v klíšťatech I. ricinus v jednotlivých státech Evropy, mimo Českou republiku
Table 4. Prevalence of B. miyamotoi in Ixodes ricinus ticks from Europe, the Czech Republic excluded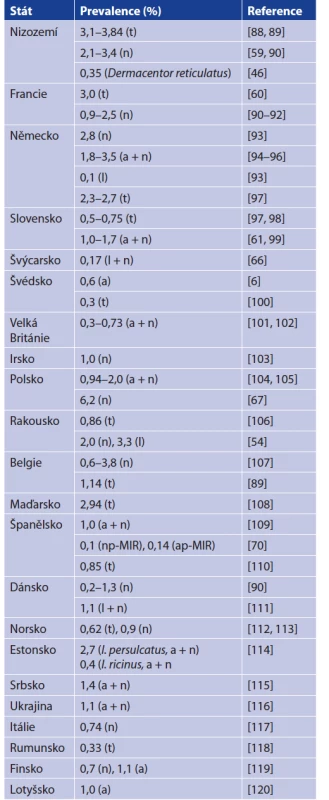
Vysvětlivky: l = larva, n = nymfa, a = dospělec, t = celková prevalence, lp = larva pool, np = nymfa pool, ap = pool dospělců, MIR = minimální prevalence
Explanations: l = larva, n = nymph, a = adult, t = overall prevalence, lp = larva pool, np = nymph pool, ap = adult pool, MIR = minimal prevalenceVÝSKYT B. MIYAMOTOI V ČESKÉ REPUBLICE
První zmínka o B. miyamotoi v ČR pochází z roku 2007, kdy tým dr. Hulínské detekoval B. miyamotoi ve 2 nymfách. Tato klíšťata však byla sejmuta ze ženy, která se právě vrátila z Magnitogorsku z Ruska, nedá se tedy hovořit o detekci B. miyamotoi na českém území [122].
Skutečné detekce B. miyamotoi v klíšťatech z ČR znázorňuje tabulka 5, přičemž poprvé byla B. miyamotoi zaznamenána v klíšťatech I. ricinus ve Vranově nad Dyjí. Další nálezy pocházejí především z jižních Čech. Míra prevalence pak koresponduje s nálezy v jiných evropských zemích a nijak se tomuto trendu nevymyká. Je pravděpodobné, že B. miyamotoi se vyskytuje v klíšťatech na více místech ČR, nicméně více studií zabývajících se prevalencí B. miyamotoi v ČR zatím nebylo publikováno [54, 95, 123, 124]. Na základě údajů EPIDAT publikovaných Státním zdravotním ústavem nebyl v České republice dosud popsán jediný případ lidské infekce způsobené B. miyamotoi. Pilotní studie zaměřená na detekci B. miyamotoi u volně žijících hlodavců tyto spirochéty neprokázala (Rudolf et al., ústní sdělení).
Tab. 5. Detekce B. miyamotoi v klíšťatech I. ricinus na území České republiky
Table 5. Detection of B. miyamotoi in Ixodes ricinus ticks from the Czech Republic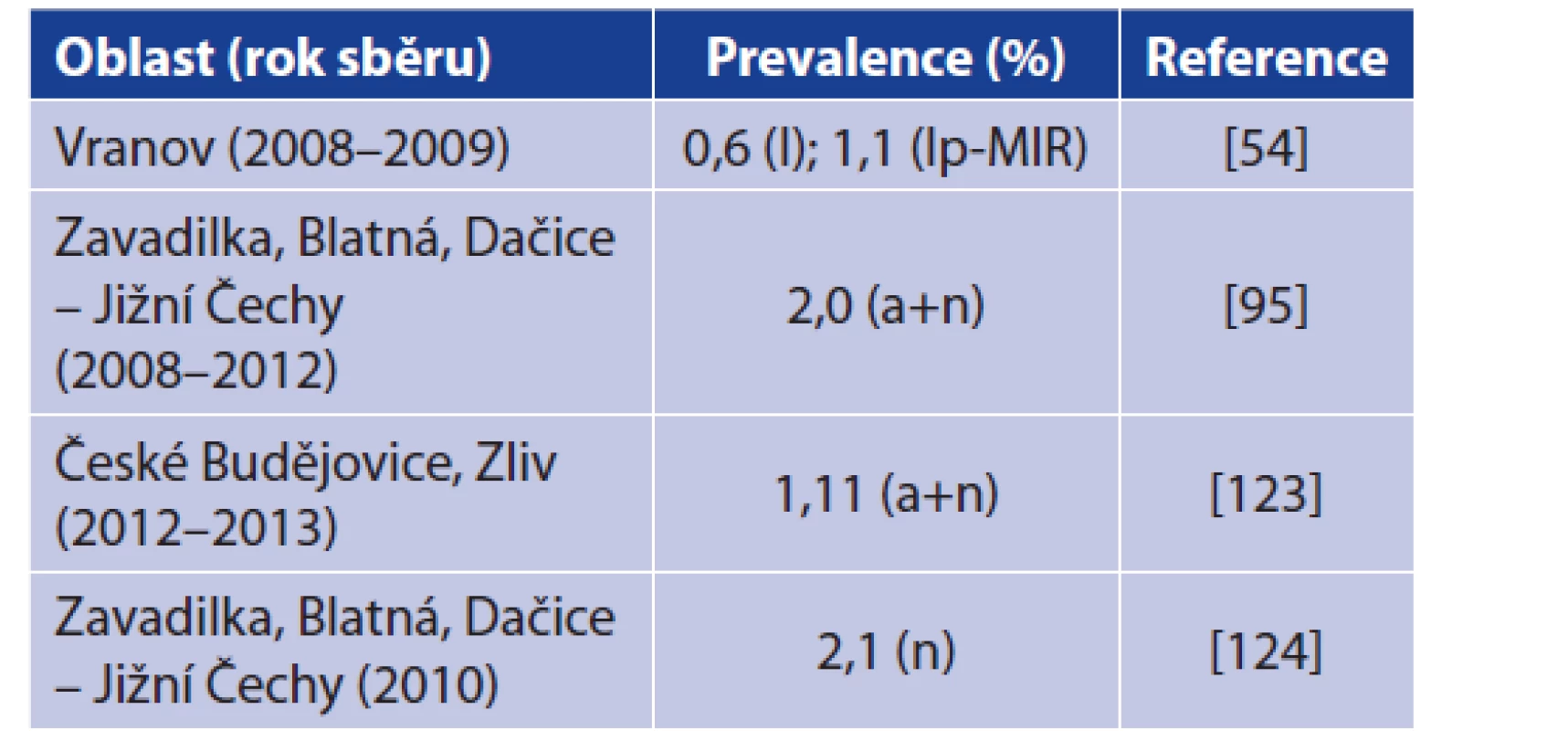
Vysvětlivky: n = nymfy; a = dospělec; l = larva; lp = larva pool; MIR = minimální prevalence
Explanations: n = nymph; a = adult; l = larva; lp = larva pool; MIR = minimal prevalenceLIDSKÉ ONEMOCNĚNÍ ZPŮSOBENÉ B. MIYAMOTOI
Ačkoliv je B. miyamotoi řazena mezi ‚RF borrelie‘ a hovoří se o ní jako o agens návratné horečky, bývá onemocnění odlišováno jako samostatná nozologická jednotka, neboť se od ‚klasické‘ návratné horečky v některých ohledech liší. V literatuře se tak můžeme setkat s několika termíny jako ‚BMD‘ (B. miyamotoi disease), ‚HTBRF‘ (hard tick-borne relapsing fever) či ‚relapsing fever - like‘ (onemocnění podobné návratné horečce) [94, 125, 126]. Popsané případy onemocnění B. miyamotoi u člověka včetně diagnostiky dokumentuje tabulka 6.
Tab. 6. Souhrn případů onemocnění způsobených B. miyamotoi včetně provedené diagnostiky a léčby
Table 6. Human clinical cases caused by B. miyamotoi including diagnostic approach and treatment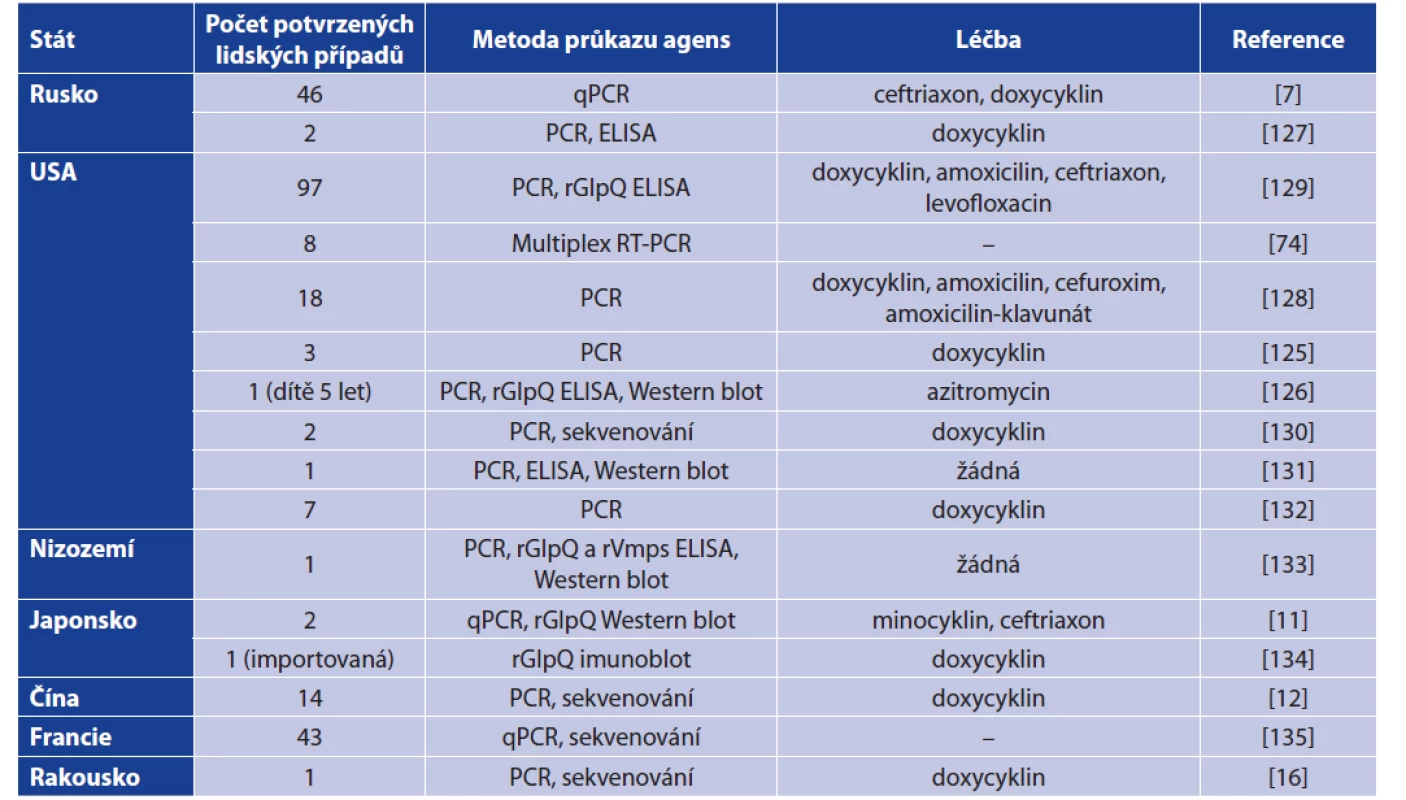
Poznámka: ‚–‘ údaje o léčbě nejsou známy, rGlpQ – rekombinantní protein GlpQ, rVmps – rekombinantní Vmp proteiny
Remark: ‚–‘ -data on treatment are not available, rGlpQ – recombinant protein GlpQ, rVmps – recombinant Vmp proteinsObvykle se jedná o horečnaté onemocnění s nespecifickými příznaky, přičemž mezi ty nejčastější patří horečka, zimnice, vyčerpanost, bolesti hlavy, svalů a kloubů, onemocnění je výjimečně provázené vyrážkou. Horečnaté stavy mohou doprovázet v tzv. relapsy, jedná se o vlastnost typickou pro ‚RF borrelie‘ – díky změnám ve Vmps (‚Variable major proteins‘) může docházet k návratům horečky, která je výsledkem imunitní reakce na nový sérotyp. Nejčastěji dokumentovanými laboratorními nálezy jsou leukopenie, trombocytopenie a zvýšené hladiny jaterních enzymů (AST a ALT). U některých pacientů byla dokumentována přítomnost EM, je však považována za netypický příznak pro onemocnění B. miyamotoi a bývá připisována spíše koinfekcím s B. burgdorferi s. l. [7, 11, 12, 36, 125, 128, 129, 134].
Onemocnění B. miyamotoi je tedy svými příznaky podobné dalším klíšťaty přenášeným bakteriálním infekcím (tab. 7). Byl dokumentován vyšší výskyt onemocnění B. miyamotoi u pacientů vykazujících příznaky lidské granulocytární anaplazmózy (HGA) [10, 130]. Řada séroprevalenčních studií potom potvrzuje přítomnost specifických protilátek u lidí právě z endemických oblastí výskytu Lymeské borreliózy či HGA (tab. 8). V souvislosti s onemocněním B. miyamotoi bylo dosud popsáno celkem 5 případů meningoencefalitidy (tab. 9). Předpokládá se, že k propuknutí meningoencefalitidy dochází u imunokompromitovaných pacientů. Nově je však dokumentována meningoencefalitida i u imunokompetentní pacientky [13, 14, 15, 141]. Při vyšetřování mozkomíšního moku u těchto případů byla dokumentována především pleocytóza (leukocyty, monocyty), zvýšená hladina proteinů, albuminu a laktózy. Tyto laboratorní nálezy poukazovaly na charakter aseptické meningitidy [13, 14, 15, 141].
Tab. 7. Srovnání klinických příznaků lymeské borreliózy, návratné horečky, lidské granulocytární anaplazmózy a onemocnění způsobené B. miyamotoi [37, 136]
Table 7. Comparison of clinical symptoms between Lyme borreliosis, human granulocytic anaplasmosis and disease caused by B. miyamotoi [37, 136]![Srovnání klinických příznaků lymeské borreliózy, návratné horečky, lidské granulocytární anaplazmózy a onemocnění
způsobené B. miyamotoi [37, 136]<br>
Table 7. Comparison of clinical symptoms between Lyme borreliosis, human granulocytic anaplasmosis and disease caused by
B. miyamotoi [37, 136]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/88e5a93488c5ae755d060da42573f3d1.png)
Tab. 8. Vybrané seroprevalenční studie detekující B. miyamotoi u různých skupin pacientů
Table 8. Seroprevalence studies concerned on selected groups of patients with antibodies to B. miyamotoi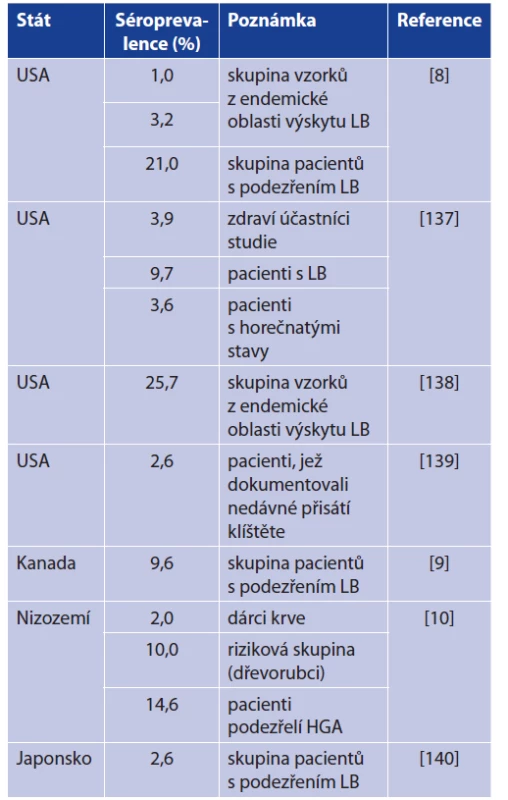
Poznámka: LB = Lymeská borrelióza, HGA = lidská granulocytární anaplazmóza
Remark: LB = Lyme borreliosis, HGA = human granulocytic anaplasmosisTab. 9. Klinické případy meningoencefalitidy způsobené B. miyamotoi
Table 9. Clinical cases of meningoencephalitis caused by B. miymotoi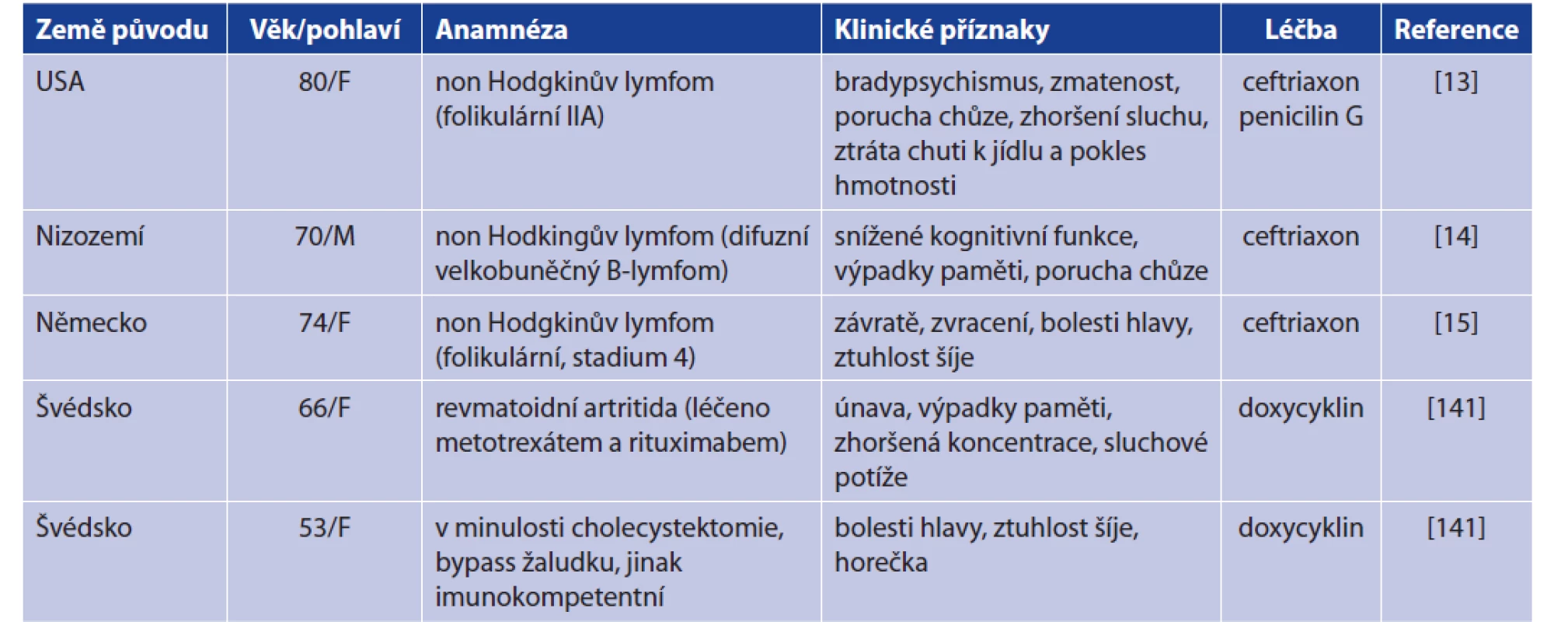
Vysvětlivky: F = žena, M = muž
Explanations: F = female, M = maleAčkoliv nebyl dosud popsán žádný případ nákazy krevní transfuzí, někteří autoři poukázali na riziko možného přenosu onemocnění krevní transfuzí či krevními deriváty. Bylo dokumentováno úspěšné přežívání B. miyamotoi v uskladněné myší krvi a touto krví dokonce došlo k nákaze imunokompromitované i imunokompetentní myši. Experimentálně byla prokázána schopnost B. miyamotoi přežívat i v uskladněné lidské krvi [142, 143].
Objevují se také spekulace o souvislosti onemocnění způsobeném B. miyamotoi s tzv. perzistentním polymorfickým syndromem po sání klíštěte. Jedná se o soubor příznaků, které u pacientů přetrvávají po dlouhé roky – např. celková tělesná slabost, závratě, bolesti kloubů, poruchy spánku či neurokognitivní poruchy. Franck et al. poprvé dali do souvislosti tyto příznaky s B. miyamotoi, kdy ji detekovali u pacientů, u nichž perzistentní polymorfický syndrom přetrvával celé roky a současně byli negativní na Lymeskou borreliózu [135].
LÉČBA ONEMOCNĚNÍ ZPŮSOBENÉ B. MIYAMOTOI
Léčba onemocnění způsobené B. miyamotoi bývá volena empiricky na základě zkušeností s léčbou Lymeské borreliózy a používá se tedy podobný léčebný režim. Lékem volby jsou tetracykliny (doxycyklin), následované penicilinovou řadou (amoxicilinem, peniciliem G), popř. cefalosporiny (ceftriaxonem), které byly nasazovány především u případů meningoencefalitidy. Citlivost B. miyamotoi na antibiotika byla dosud studována pouze in vitro. Koetsveld et al. (2017) prokázali vyšší citlivost vůči doxycyklinu a azithromycinu, podobnou citlivost k ceftriaxonu a relativní rezistenci k amoxicilinu u B. miyamotoi v porovnání s B. burgdorferi s. l [144, 145]. Tabulky 6 a 9 dokumentují antibiotickou léčbu u jednotlivých případů onemocnění B. miyamotoi. Při léčbě onemocnění B. miyamotoi je nutné brát v potaz možné riziko Jarisch-Herxheimerovy reakce, která byla pozorována např. u pacientů v Rusku či v USA [7, 13].
DIAGNOSTIKA ONEMOCNĚNÍ ZPŮSOBENÉ B. MIYAMOTOI A METODY DETEKCE V KLÍŠŤATECH
Mikroskopie
Borrelie lze v klinických vzorcích detekovat mikroskopickými metodami, nejčastěji z krve či z mozkomíšního moku (v případě neuroinfekce). Mezi běžná doporučení lze zařadit mikroskopii tenkých či tlustých krevních roztěrů barvené podle Giemsy či dle Wrighta. Telford et al. ve své studii poukazují na nedostatečnou citlivost pro detekci B. miyamotoi, ačkoliv se tato metoda s úspěchem využívá pro detekci klasických ‚RF borrelií‘, kde však dosahuje vyšší citlivosti než u B. miyamotoi (patrně z důvodu rozdílné míry bakterémie) [36, 142, 146]. Mezi další metody patří mikroskopie v temném poli (‚dark-field microscopy‘) nebo vizualizace pomocí fluorescenčně značených protilátek (z důvodu zkřížených reakcí často poskytuje pouze orientační výsledek). Obecně však platí, že dané mikroskopické metody dovolují pouze zobrazit spirochety ve vyšetřovaném vzorku a zhodnotit jejich morfologii. Určení druhu spirochety se pak opírá o klinickou manifestaci onemocnění či výsledky PCR nebo sérologie [13, 36, 50, 142].
Kultivace B. miyamotoi in vitro
Kultivace spirochet patří mezi důležité nástroje pro studium bakterií, má však omezený význam pro jejich diagnostiku. Kultivace borrelií je časově náročná, neboť spirochety vyžadují specifická média a kultivační podmínky (mikroaerofilní růst). Pro úspěšnou kultivaci borrelií se rutinně používá BSK médium (Barbour-Stoener - Kelly), stejně jako jeho varianty – BSK-II, BSK-H, či MKP (modified Kelly-Pettenkofer) [147, 148]. B. miyamotoi byla poprvé kultivována při své primoizolaci v roce 1995 právě na médiu BSK-II na základě zkušeností s kultivací jiných ‚LD‘ či ‚RF borrelií‘ [4]. Dalším často užívaným médiem je právě MKP. Jedná se o médium složité na přípravu, mnohé jeho složky mohou být obměňovány. Mezi jeho složky patří želatina, telecí fetální sérum, CMRL, králičí sérum, BSA (hovězí sérový albumin), HEPES, glukóza, neopepton, hydrogenuhličitan sodný, citrát sodný, pyruvát sodný a N-acetyl glukosamin [149, 150]. Optimalizací podmínek pro kultivaci B. miyamotoi se ve své práci zabývali Margos et al. Nejoptimálněji B. miyamotoi rostla na MKP s 30–50 % lidského séra, při 33 ºC, 6 % CO2 po dobu 7–9 dní. Prokázali také, že užití lidského séra namísto králičího, vykazuje vyšší stimulaci růstu v případě B. miyamotoi [148]. Kultivace B. miyamotoi zůstává výhradně nástrojem pro výzkum. Koetsveld et al. prokázali, že B. miyamotoi lze kultivovat i z humánního klinického materiálu (krve), ale diagnostická hodnota není příliš vysoká, z důvodu omezené doby bakterémie a z důvodu jejího vymizení mezi horečnatými epizodami [151].
PCR a sekvenování
Mezi další hojně užívané přímé metody detekce B. miyamotoi patří i PCR, která bývá hojně využívána pro detekci v klíšťatech, avšak v menší míře se uplatňuje i v diagnostice humánních onemocnění B. miyamotoi. Nejčastěji užívanými cíli PCR jsou kupříkladu geny pro ribozomální podjednotky, jejich jednotlivé úseky či mezerníky (16S rRNA, 16S-23S rRNA IGS, 5S-23S rRNA IGS), flaB (gen pro flagellin), recG (gen pro DNA helikázu), purB (gen pro adenylosukcinát lyázu) a nakonec glpQ (gen pro glycerolfosfodiester fosfodiesterázu), jež má při detekci B. miyamotoi výsadní postavení. Jedná se totiž o gen, který se v rámci rodu Borrelia nachází pouze u ‚RF borrelií‘. Gen pro GlpQ tudíž představuje specifický cíl především u detekce B. miyamotoi v klíšťatech, neboť se jedná o jedinou dosud popsanou ‚RF borrelii‘ nalezenou v klíšťatech rodu Ixodes. Nevýhodou však může být nižší senzitivita. Pro detekci B. miyamotoi lze použít i další varianty PCR (multiplex PCR, real-time PCR, nested-PCR) či sekvenování nové generace (NGS) [7, 11, 35, 36, 41, 57, 71, 74, 80, 81, 97, 152]. Pro klinickou diagnostiku má však PCR omezené využití, B. miyamotoi lze totiž detekovat pouze v raném stadiu onemocnění, tj. při akutní bakterémii v krvi (v prvních 4–6 dnech) a následně při relapsech onemocnění [7, 37, 125, 153]. Po samotné amplifikaci často následuje sekvenování za účelem porovnání sekvence a určení identity daného úseku, ať už za účelem diagnostiky onemocnění či fylogenetických studií. V současné době je kompletně sekvenován chromozom B. miyamotoi (americký typ – kmen LB-2001) přístupný v GenBank/EMBL/DDBJ pod kódem CP006647. Dále byly sekvenovány kmeny CT13 - -2396 (americký typ, CP017126), CA17-2241 (americký typ, CP021872) a kompletní genomy 6 klinických izolátů B. miyamotoi, přičemž všechny vykazovaly příslušnost k asijskému typu (CP024390, CP024205, CP024371, CP024351, CP024333, CP024316) [91, 154 až 157]. Z evropských kmenů jsou k dispozici izoláty NL-IR-1 (CP044783) a NL-IR-2 (CP044625) z Nizozemí či kompletní sekvence genomu CZ-F1E (CP046389) a CZ-F190E (CP046388) z České republiky, které Janeček et al. (2020) získali z vajíček klíštěte Ixodes ricinus [158, 159].
Sérologické metody
Sérologické metody jsou hojně využívány pro diagnostiku onemocnění B. miyamotoi. Významným sérologickým markerem pro B. miyamotoi je již zmiňovaný glycerolfosfodiester fosfodiesteráza (GlpQ, resp. jeho rekombinantní varianta). V současnosti se pak doporučuje i kombinace GlpQ s Vmps (Variable major proteins), tedy soubor proteinů typický pro ‚RF borrelie‘. Sérologie založená na kombinaci rGlpQ a několika druhů rVmps vykazuje vyšší citlivost než použití samotné rGlpQ. Všechny tyto antigenní markery umožňují selektivní detekci B. miyamotoi a odlišení od infekce B. burgdorferi s. l. zvláště v oblastech, kde není běžný výskyt ostatních ‚RF borrelií‘ [141, 152, 160–163].
V sérologické diagnostice B. burgdorferi s. l. se rutinně používá tzv. dvoustupňový test (v prvním kroku se provádí ELISA s využitím celobuněčného a filtrovaného sonikátu, obsahujícím několik druhů antigenů B. burgdorferi (především různé typy Osp proteinů), v případě pozitivity následuje Western blot (WB) pro potvrzení daného antigenu. Je-li vzorek pozitivní na B. miyamotoi podroben tomuto dvoustupňovému testu, často vykazuje pozitivitu v ELISA s následně negativním WB. Důvodem je zkřížená reaktivita některých antigenů – například C6-peptidu, pro který byla prokázána vysoká míra homologie s některými Vmp proteiny u B. miyamotoi pomocí in silico analýz. Pozitivita ELISA testu spolu s negativním WB s přihlédnutím ke klinickým příznakům tedy může být důležitým vodítkem pro zvažování onemocnění B. miyamotoi [36, 125, 131, 164–167].
ZÁVĚR
Spirocheta B. miyamotoi je u člověka původcem horečnatého onemocnění a z pohledu veřejného zdraví představuje hrozbu zejména pro imunosuprimované pacienty, u nichž může vyvolat meningoencefalitidu [7, 13, 14, 15]. Bohužel povědomí o B. miyamotoi a o onemocnění, jež způsobuje je u laické veřejnosti i medicínské komunity velmi nízké. Současně nejsou k dispozici žádné široce rozšířené možnosti rutinního klinického testování [20] zejména jednotné diagnostické testy specifické pro B. miyamotoi navržené výhradně pro specifické markery, které umožní B. miyamotoi odlišit od agens Lymeské borreliózy (GlpQ, Vmps). Spirocheta B. miyamotoi vykazuje zkřížené reakce v rámci sérologických reakcí prováděných na detekci protilátek proti B. burgdorferi s. l., především pak v prvním stupni (ELISA). Z pohledu současné diagnostiky tedy může docházet k záměně za Lymeskou borreliózu a vzhledem k podobnosti klinických příznaků i za lidskou granulocytární anaplazmózu [7, 36, 125, 130]. Další diagnostickou komplikací je fakt, že v případě podezření na Lymeskou borreliózu či HGA dochází často k empirickému nasazení ATB, které zabírají i na případné onemocnění B. miyamotoi, a nedojde tedy k následnému zjištění původce nákazy [20, 125]. Séroprevalenční studie provedené v USA [8] či Nizozemí [10] však ukazují, že lidé jsou běžně exponováni B. miyamotoi. Je tedy pravděpodobné, že mnoho lidí onemocnění způsobené B. miyamotoi prodělá pod obrazem nespecifického horečnatého onemocnění či dojde k asymptomatické nákaze. Protože jde o poměrně nového patogena, existuje řada nezodpovězených otázek jak z oblasti základního výzkumu (distribuce rozdílných genetických variant B. miyamotoi v přírodě, ekologie spirochéty v přírodním ohnisku nákazy, perzistence v klíštěti, koinfekce s ostatními patogenními zástupci), tak z klinického pohledu (virulence kmenů, riziko nákazy u imunokompetentních obyvatel, riziko přenosu transfuzí, přesná diagnostika a bezpečný terapeutický režim) [20].
Do redakce došlo dne 24. 9. 2020.
Adresa pro korespondenci:
doc. RNDr. Ivo Rudolf Ph.D.
Ústav biologie obratlovců AV ČR, v.v.i. Květná 170/8 603 00 Brno-střed-Pisárky
e-mail: rudolf@ivb.cz
Zdroje
1. Bouchard C, Dibernardo A, Koffi J, et al. Increased risk of tickborne diseases with climate and environmental changes. Can Commun Dis Rep, 2019;45 : 83–89.
2. Heyman P, Cochez Ch, Hofhuis A, et al. A clear and present danger: tick-borne diseases in Europe. Expert Rev Anti-Infect Ther, 2010;8 : 33–50.
3. Randolph SE. The shifting landscape of tick-borne zoonoses: tick-borne encephalitis and Lyme borreliosis in Europe. Philos Trans R Soc Lond B-Biol Sci, 2001;356 : 1045–1056.
4. Fukunaga M, Takanashi Y, Tsuruta Y, et al. Genetic and phenotypic analysis of Borrelia miyamotoi sp. nov., isolated from the ixodid tick Ixodes persulcatus, the vector for Lyme disease in Japan. Int J Syst Bacteriol, 1995;45 : 804–810.
5. Scoles GA, Papero M, Beati L, et al. A relapsing fever group spirochete transmitted by Ixodes scapularis ticks. Vector-Borne Zoonotic Dis, 2001;1 : 21–34.
6. Fraenkel CJ, Garpmo U, Berglund J. Determination of novel Borrelia genospecies in Swedish Ixodes ricinus ticks. J Clin Microbiol, 2002;40 : 3308–3312.
7. Platonov AE, Karan LS, Kolyasnikova NM, et al. Humans infected with relapsing fever spirochete Borrelia miyamotoi, Russia. Emerg Infect Dis, 2011;17 : 1816–1823.
8. Krause PJ, Narasimhan S, Wormser GP, et al. Human Borrelia miyamotoi infection in the United States. N Engl J Med, 2013;368 : 291 – 293.
9. Kadkhoda K, Dumouchel C, Brancato J, et al. Human seroprevalence of Borrelia miyamotoi in Manitoba, Canada, in 2011–2014: a cross-sectional study. CMAJ Open, 2017;5:E690–E693.
10. Jahfari S, Herremans T, Platonov AE, et al. High seroprevalence of Borrelia miyamotoi antibodies in forestry workers and individuals suspected of human granulocytic anaplasmosis in the Netherlands. New Microbes New Infect, 2014;2 : 144–149.
11. Sato K, Takano A, Konnai S, et al. Human infections with Borrelia miyamotoi, Japan. Emerg Infect Dis, 2014;20 : 1391–1393.
12. Jiang BG, Jia N, Jiang JF, et al. Borrelia miyamotoi infections in humans and ticks, Northeastern China. Emerg Infect Dis, 2018;24 : 236–241.
13. Gugliotta JL, Goethert HK, Berardi VP, et al Meningoencephalitis from Borrelia miyamotoi in an immunocompromised patient. N Engl J Med, 2013;368 : 240–245.
14. Hovius JW, de Wever B, Sohne M, et al. A case of meningoencephalitis by the relapsing fever spirochaete Borrelia miyamotoi in Europe. Lancet, 2013;382 : 658.
15. Boden K, Lobenstein S, Hermann B, et al. Borrelia miyamotoi-associated neuroborreliosis in immunocompromised person. Emerg Infect Dis, 2016;22 : 1617–1620.
16. Tobudic S, Burgmann H, Stanek G, et al. Human Borrelia miyamotoi Infection, Austria. Emerg Infect Dis, 2020;26 : 2201–2204.
17. Gupta SR, Mahmood S, Adeolu M. A phylogenomic and molecular signature based approach for characterization of the phylum Spirochaetes and its major clades proposal for a taxonomic revision of the phylum. Front Microbiol, 2013;4 : 1–17.
18. Barbour AG. Phylogeny of a relapsing fever Borrelia species transmitted by the hard tick Ixodes scapularis. Infect Genet Evol, 2014;27 : 551–558.
19. Bunikis J, Tsao J, Garpmo U, et al. Typing of Borrelia relapsing fever group strains. Emerg Infect Dis, 2004;10 : 1661–1664.
20. Cutler S, Vayssier-Taussat M, Estrada-Peña A, et al. A new Borrelia on the block: Borrelia miyamotoi – a human health risk? Euro Surveill, 2019;24(18).
21. Takano A, Goka K, Une Y, et al. Isolation and characterization of a novel Borrelia group of tick-borne borreliae from imported reptiles and their associated ticks. Environ Microbiol, 2010;12 : 134–146.
22. Takano A, Fujita H, Kadosaka T, et al. Characterization of reptile - associated Borrelia sp. in the vector tick, Amblyomma geoemydae, and its association with Lyme disease and relapsing fever Borrelia spp. Environ Microbiol Rep, 2011;3 : 632–637.
23. Trinachartvanit W, Hirunkanokpun S, Sudsangiem R, et al. Borrelia sp. phylogenetically different from Lyme disease and relapsing fever-related Borrelia spp. in Amblyomma varanense from Python reticulatus. Parasites Vectors, 2016;9 : 359.
24. Loh SM, Gofton AW, Lo N, et al. Novel Borrelia species detected in echidna ticks, Bothriocroton concolor, in Australia. Parasites Vectors, 2016;9 : 339.
25. Adeolu M, Gupta RS. A phylogenomic and molecular marker based proposal for the division of the genus Borrelia into two genera: the emended genus Borrelia containing only the members of the relapsing fever Borrelia, and the genus Borreliella gen. nov. containing the members of the Lyme disease Borrelia (Borrelia burgdorferi sensu lato complex). Antonie Van Leeuwenhoek, 2014;105 : 1049–1072.
26. Barbour AG, Adeolu M, Gupta RS. Division of the genus Borrelia into two genera (corresponding to Lyme disease and relapsing fever groups) reflects their genetic and phenotypic distinctiveness and will lead to a better understanding of these two groups of microbes (Margos et al. (2016) There is inadequate evidence to support the division of the genus Borrelia. doi: 10.1099/ ijsem.0.001717). Int J Syst Evol Microbiol, 2017;67 : 2058–2067.
27. Gupta RS. Distinction between Borrelia and Borreliella is more robustly supported by molecular and phenotypic characteristics than all other neighbouring prokaryotic genera: Response to Margos‘ et al. „The genus Borrelia reloaded“ (PLoS One 13(12): e0208432). PLoS One, 2019;14:e0221397.
28. Margos G, Marosevic D, Cutler S, et al. There is inadequate evidence to support the division of the genus Borrelia. Int J Syst Evol Microbiol, 2017;67 : 1081–1084.
29. Margos G, Gofton A, Wibberg D, et al. The genus Borrelia reloaded. PLoS One, 2018;13:e0208432.
30. Margos G, Fingerle V, Oskam C, et al. Comment on: Gupta, 2019, distinction between Borrelia and Borreliella is more robustly supported by molecular and phenotypic characteristics than all other neighbouring prokaryotic genera: Response to Margos‘ et al. „The genus Borrelia reloaded“ (PLoS One 13(12): e0208432). PLoS One 14(8): e0221397. Ticks Tick-Borne Dis, 2020;11 : 101320.
31. Estrada-Peña A, Cabezas-Cruz A. Phyloproteomic and functional analyses do not support a split in the genus Borrelia (phylum Spirochaetes). BMC Evol Biol, 2019;19 : 54.
32. Margos G, Castillo-Ramirez S, Cutler S, et al. Rejection of the name Borreliella and all proposed species comb. nov. placed therein. Int J Syst Evol Microbiol, 2020;70 : 3577–3581.
33. Takano A, Toyomane K, Konnai S, et al. Tick surveillance for relapsing fever spirochete Borrelia miyamotoi in Hokkaido, Japan. PLoS One, 2014;9:e104532.
34. Mukhacheva TA, Salikhova II, Kovalev SY. Multilocus spacer analysis revealed highly homogeneous genetic background of Asian type of Borrelia miyamotoi. Infect Genet Evol, 2015;31 : 257–262.
35. Iwabu-Itoh Y, Bazartseren B, Naranbaatar O, et al. Tick surveillance for Borrelia miyamotoi and phylogenetic analysis of isolates in Mongolia and Japan. Ticks Tick-Borne Dis, 2017;8 : 850–857.
36. Krause PJ, Fish D, Narasimhan S, et al. Borrelia miyamotoi infection in nature and in humans. Clin Microbiol Infect, 2015;21 : 631 – 639.
37. Wagemakers A, Staarink PJ, Sprong H, et al. Borrelia miyamotoi: a widespread tick-borne relapsing fever spirochete. Trends Parasitol, 2015;31 : 260–269.
38. Mun J, Eisen RJ, Eisen L, et al. Detection of a Borrelia miyamotoi sensu lato relapsing-fever group spirochete from Ixodes pacificus in California, J Med Entomol, 2006;43 : 120–123.
39. Jahfari S, Ruyts SC, Frazer-Mendelewska E, et al. Melting pot of tick-borne zoonoses: the European hedgehog contributes to the maintenance of various tick-borne diseases in natural cycles urban and suburban areas. Parasites Vectors, 2017;10 : 134.
40. Kim CM, Seo JW, Kim DM, et al. Detection of Borrelia miyamotoi in Ixodes nipponensis in Korea. PLoS One, 2019;14:e0220465.
41. Hamer SA, Hickling GJ, Keith R, et al. Associations of passerine birds, rabbits, and ticks with Borrelia miyamotoi and Borrelia andersonii in Michigan, U.S.A. Parasites Vectors, 2012;5 : 231.
42. Hauck D, Springer A, Pachnicke S, et al. Ixodes inopinatus in northern Germany: occurrence and potential vector role for Borrelia spp., Rickettsia spp., and Anaplasma phagocytophilum in comparison with Ixodes ricinus. Parasitol Res, 2019;118 : 3205 – 3216.
43. Grech-Angelini S, Stachurski F, Vayssier-Taussat M, et al. Tickborne pathogens in ticks (Acari: Ixodidae) collected from various domestic and wild hosts in Corsica (France), a Mediterranean island environment. Transbound Emerg Dis, 2020;67 : 745–757.
44. Livanova NN, Fomenko NV, Akimov IA, et al. Dog survey in Russian veterinary hospitals: tick identification and molecular detection of tick-borne pathogens. Parasites Vectors, 2018;11 : 591.
45. Yang Y, Yang Z, Kelly P, et al. Borrelia miyamotoi sensu lato in Père David Deer and Haemaphysalis longicornis Ticks. Emerg Infect Dis, 2018;24 : 928–931.
46. Sprong H, Fonville M, Docters van Leeuwen A, et al. Detection of pathogens in Dermacentor reticulatus in northwestern Europe: evaluation of a high-throughput array. Heliyon, 2019;5:e01270.
47. Kohn M, Krücken J, McKay-Demeler J, et al. Dermacentor reticulatus in Berlin/Brandenburg (Germany): Activity patterns and associated pathogens. Ticks Tick-Borne Dis, 2019;10 : 191–206.
48. Heglasová I, Rudenko N, Golovchenko M, et al. Ticks, fleas and rodent-hosts analyzed for the presence of Borrelia miyamotoi in Slovakia: the first record of Borrelia miyamotoi in a Haemaphysalis inermis tick. Ticks Tick-Borne Dis, 2020;11 : 101456.
49. Han S, Lubelczyk C, Hickling GJ, et al. Vertical transmission rates of Borrelia miyamotoi in Ixodes scapularis collected from whitetailed deer. Ticks Tick-Borne Dis, 2019;10 : 682–689.
50. Rollend L, Fish D, Childs JE. Transovarial transmission of Borrelia spirochetes by Ixodes scapularis: a summary of the literature and recent observations. Ticks Tick-Borne Dis, 2013;4 : 46–51.
51. Hamer SA, Tsao JI, Walker ED, et al. Invasion of the lyme disease vector Ixodes scapularis: implications for Borrelia burgdorferi endemicity. Ecohealth, 2010;7 : 47–63.
52. Hubálek Z, Halouzka J. Prevalence rates of Borrelia burgdorferi sensu lato in host-seeking Ixodes ricinus ticks in Europe. Parasitol Res, 1998;84 : 167–172.
53. van Duijvendijk G, Coipan C, Wagemakers A, et al. Larvae of Ixodes ricinus transmit Borrelia afzelii and B. miyamotoi to vertebrate hosts. Parasites Vectors, 2016;9 : 97.
54. Richter D, Debski A, Hubalek Z, et al. Absence of Lyme disease spirochetes in larval Ixodes ricinus ticks. Vector-Borne Zoonotic Dis, 2011;12 : 21–27.
55. Lynn GE, Breuner NE, Eisen L, et al. An immunocompromised mouse model to infect Ixodes scapularis ticks with the relapsing fever spirochete, Borrelia miyamotoi. Ticks Tick-Borne Dis, 2019;10 : 352–359.
56. Bunikis J, Barbour AG. Third Borrelia species in white-footed mice. Emerg Infect Dis, 2005;11 : 1150–1151.
57. Barbour AG, Bunikis J, Travinsky B, et al. Niche partitioning of Borrelia burgdorferi and Borrelia miyamotoi in the same tick vector and mammalian reservoir species. Am J Trop Med Hyg, 2009;81 : 1120–1131.
58. Taylor KR, Takano A, Konnai S, et al. Borrelia miyamotoi infections among wild rodents show age and month independence and correlation with Ixodes persulcatus larval attachment in Hokkaido, Japan. Vector-Borne Zoonotic Dis, 2013;13 : 92–97.
59. Wagemakers A, Jahfari S, de Wewer B, et al. Borrelia miyamotoi in vectors and hosts in the Netherlands. Ticks Tick-Borne Dis, 2017;8 : 370–374.
60. Cosson JF, Michelet L, Chotte J, et al. Genetic characterization of the human relapsing fever spirochete Borrelia miyamotoi in vectors and animal reservoirs of Lyme disease spirochetes in France. Parasites Vectors, 2014;7 : 223.
61. Hamšíková Z, Coipan C, Mahríková L, et al. Borrelia miyamotoi and co-infection with Borrelia afzelii in Ixodes ricinus ticks and rodents from Slovakia. Microb Ecol, 2017;73 : 1000–1008.
62. Scott MC, Rosen ME, Hamer SA, et al. High-prevalence Borrelia miyamotoi infection among wild turkeys (Meleagris gallopavo) in Tennessee. J Med Entomol, 2010;47 : 1238–1242.
63. Salkeld DJ, Nieto NC, Bonilla DL, et al. Borrelia miyamotoi Infections in Small Mammals, California, USA. Emerg Infect Dis, 2018;24 : 2356–2359.
64. Szekeres S, Docters van Leeuwen A, Tóth E, et al. Road-killed mammals provide insight into tick-borne bacterial pathogen communities within urban habitats. Transbound Emerg Dis, 2019;66 : 277–286.
65. Kalmár Z, Sándor AD, Matei IA, et al. Borrelia spp. in small mammals in Romania. Parasites Vectors, 2019;12 : 461.
66. Burri C, Schumann O, Schumann C, et al. Are Apodemus spp. mice and Myodes glareolus reservoirs for Borrelia miyamotoi, Candidatus Neoehrlichia mikurensis, Rickettsia helvetica, R. monacensis and Anaplasma phagocytophilum? Ticks Tick-Borne Dis, 2014;5 : 245–251.
67. Wodecka B, Rymaszewska A, Skotarczak B. Host and pathogen DNA identification in blood meals of nymphal Ixodes ricinus ticks from forest parks and rural forests of Poland. Exp Appl Acarol, 2014;62 : 543–555.
68. Han S, Hickling GJ, Tsao JI. High Prevalence of Borrelia miyamotoi among adult blacklegged ticks from white-tailed deer. Emerg Infect Dis, 2016;22 : 316–318.
69. Han S, Lubelczyk C, Hickling GJ, et al. Vertical transmission rates of Borrelia miyamotoi in Ixodes scapularis collected from whitetailed deer. Ticks Tick-Borne Dis, 2019;10 : 682–689.
70. Díaz P, Remesar S, Venzal JM, et al. Occurrence of Borrelia and Borreliella species in Ixodes ricinus collected from roe deer in northwestern Spain. Med Vet Entomol, 2019;33 : 427–430.
71. Graham ChB, Pilgard MA, Maes SE, et al. Paired real-time PCR assays for detection of Borrelia miyamotoi in North American Ixodes scapularis and Ixodes pacificus (Acari: Ixodidae). Ticks Tick - Borne Dis, 2016;7 : 1230–1235.
72. Johnson TL, Graham CB, Maes SE, et al. Prevalence and distribution of seven human pathogens in host-seeking Ixodes scapularis (Acari: Ixodidae) nymphs in Minnesota, USA. Ticks Tick - Borne Dis, 2018;9 : 1499–1507.
73. Tokarz R, Tagliafierro T, Cucura DM, et al. Detection of Anaplasma phagocytophilum, Babesia microti, Borrelia burgdorferi, Borrelia miyamotoi and Powassan virus in ticks by a multiplex real-time reverse transcription-PCR assay. mSphere, 2017;2:e00151–17.
74. Wroblewski D, Gebhardt L, Prusinski MA, et al. Detection of Borrelia miyamotoi and other tick-borne pathogens in human clinical specimens and Ixodes scapularis ticks in New York State, 2012-2015. Ticks Tick-Borne Dis, 2017;8 : 407–411.
75. Xu G, Pearson P, Dykstra E, et al. Human-Biting Ixodes Ticks and Pathogen Prevalence from California, Oregon, and Washington. Vector-Borne Zoonotic Dis, 2019;19 : 106–114.
76. Edwards MJ, Russell JC, Davidson EN, et al. A 4 – Yr Survey of the Range of Ticks and Tick-Borne Pathogens in the Lehigh Valley Region of Eastern Pennsylvania. J Med Entomol, 2019;56 : 1122–1134.
77. Tokarz R, Tagliafierro T, Sameroff S, et al. Microbiome analysis of Ixodes scapularis ticks from New York and Connecticut. Ticks Tick-Borne Dis, 2019;10 : 894–900.
78. Sanchez-Vicente S, Tagliafierro T, Coleman JL, et al. Polymicrobial Nature of Tick-Borne Diseases. MBio, 2019;10:e02055–19.
79. Padgett K, Bonilla D, Kjemtrup A, et al. Large scale spatial risk and comparative prevalence of Borrelia miyamotoi and Borrelia burgdorferi sensu lato in Ixodes pacificus. PLoS One, 2014;9:e110853.
80. Lynn GE, Graham CB, Horiuchi K, et al. Prevalence and geographic distribution of Borrelia miyamotoi in host-seeking Ixodes pacificus (Acari: Ixodidae) nymphs in Mendocino County, California. J Med Entomol, 2018;55 : 711–716.
81. Dibernardo A, Cote T, Ogden NH, et al. The prevalence of Borrelia miyamotoi infection and co-infection with other Borrelia spp. in Ixodes scapularis ticks collected in Canada. Parasites Vectors, 2014;7 : 183.
82. Kulkarni M, Kryuchkov R, Statculescu A, et al. Ixodes scapularis tick distribution and infection rates in Ottawa, Ontario, 2017. Can Commun Dis Rep, 2018;44 : 237–242.
83. Rar V, Livanova N, Tkachev S, et al. Detection and genetic characterization of a wide range of infectious agents in Ixodes pavlovskyi ticks in western siberia, Russia. Parasites Vectors, 2017;10 : 258.
84. Rar V, Livanova N, Sabitova Y, et al. Ixodes persulcatus/pavlovskyi natural hybrids in Siberia: Occurrence in sympatric areas and infection by a wide range of tick-transmitted agents. Ticks Tick - Borne Dis, 2019;10 : 101254.
85. Pukhovskaya NM, Morozova OV, Vysochina NP, et al. Prevalence of Borrelia burgdorferi sensu lato and Borrelia miyamotoi in ixodid ticks in the Far East of Russia. Int J Parasitol Parasites Wildl, 2019;8 : 192–202.
86. Khasnatinov MA, Danchinova GA, Takano A, et al. Prevalence of Borrelia miyamotoi in Ixodes persulcatus in Irkutsk city and its neighboring territories, Russia. Ticks Tick-Borne Dis, 2016;7 : 394–397.
87. Sakakibara K, Sen E, Sato K, et al. Detection and characterization off the emerging relapsing fever pathogen, Borrelia miyamotoi, from the Ixodes ricinus tick in the rural Thrakya (Thrace) region of northwest Turkey. Vector-Borne Zoonotic Dis, 2016;16 : 797–799.
88. Fonville M, Friesema IHM, Hengeveld PD, et al. Human exposure to tickborne relapsing fever spirochete Borrelia miyamotoi, the Netherlands. Emerg Infect Dis, 2014;20 : 1244–1245.
89. Cochez C, Heyman P, Heylen D, et al. The presence of Borrelia miyamotoi, a relapsing fever spirochaete, in questing Ixodes ricinus in Belgium and in The Netherlands. Zoonoses Public Health, 2015;62 : 331–333.
90. Michelet L, Delannoy S, Devillers E, et al. High-throughput screening of tick-borne pathogens in Europe. Front Cell Infect Microbiol, 2014;4 : 103.
91. Vayssier-Taussat M, Moutailler S, Michelet L, et al. Next generation sequencing uncovers unexpected bacterial pathogens in ticks in western Europe. PLoS One, 2013;8:e81439.
92. Nebbak A, Dahmana H, Almeras L, et al. Co-infection of bacteria and protozoan parasites in Ixodes ricinus nymphs collected in the Alsace region, France. Ticks Tick-Borne Dis, 2019;10 : 101241.
93. Szekeres S, Lügner J, Fingerle V, et al. Prevalence of Borrelia miyamotoi and Borrelia burgdorferi sensu lato in questing ticks from a recreational coniferous forest of East Saxony, Germany. Ticks Tick-Borne Dis, 2017;8 : 922–927.
94. Richter D, Schlee DB, Matuschka FR. Relapsing fever-like spirochetes infecting European vector tick of Lyme disease agent. Emerg Infect Dis, 2003;9 : 697–701.
95. Crowder ChD, Carolan HE, Rounds MA, et al. Prevalence of Borrelia miyamotoi in Ixodes ticks in Europe and the United States. Emerg Infect Dis, 2014;20 : 1678–1682.
96. Blazejak K, Raulf MK, Janecek E, et al. Shifts in Borrelia burgdorferi (s.l.) genospecies infections in Ixodes ricinus over a 10-year surveillance period in the city of Hanover (Germany) and Borrelia miyamotoi specific Reverse Line Blot detection. Parasites Vectors, 2018;11 : 304.
97. Venczel R, Knoke I, Pavlovic M, et al. A novel duplex real-time PCR permits simultaneous detection and differentiation of Borrelia miyamotoi and Borrelia burgdorferi sensu lato. Infection, 2015;4 : 47–55.
98. Vaculová T, Derdáková M, Špitalská E, et al. Simultaneous Occurrence of Borrelia miyamotoi, Borrelia burgdorferi Sensu Lato, Anaplasma phagocytophilum and Rickettsia helvetica in Ixodes ricinus Ticks in Urban Foci in Bratislava, Slovakia. Acta Parasitol, 2019;64 : 19–30.
99. Subramanian G, Sekeyova Z, Raoult D, et al. Multiple tick-associated bacteria in Ixodes ricinus from Slovakia. Ticks Tick-Borne Dis, 2012;3 : 405–409.
100. Wilhelmsson P, Fryland L, Börjesson S, et al. Prevalence and diversity of Borrelia species in ticks that have bitten humans in Sweden. J Clin Microbiol, 2010;49 : 481.
101. Layzell SJ, Bailey D, Peacey M, et al. Prevalence of Borrelia burgdorferi and Borrelia miyamotoi in questing Ixodes ricinus ticks from four sites in the UK. Ticks Tick-Borne Dis, 2017;2 : 217–224.
102. Hansford KM, Fonville M, Jahfari S, et al. Borrelia miyamotoi in host-seeking Ixodes ricinus ticks in England. Epidemiol Infect, 2015;143 : 1079–1087.
103. Lambert JS, Cook MJ, Healy JE, et al. Metagenomic 16S rRNA gene sequencing survey of Borrelia species in Irish samples of Ixodes ricinus ticks. PLoS One, 2019;14:e0209881.
104. Kiewra D, Stanczak J, Richter M. Ixodes ricinus (Acari, Ixodidae) as a vector of Borrelia burgdorferi sensu lato and Borrelia miyamotoi in Lower Silesia, Poland – preliminary study. Ticks Tick-Borne Dis, 2014;5 : 892–897.
105. Kubiak K, Dziekońska-Rynko J, Szymańska H, et al. Questing Ixodes ricinus ticks (Acari, Ixodidae) as a vector of Borrelia burgdorferi sensu lato and Borrelia miyamotoi in an urban area of north-eastern Poland. Exp Apl Acarol, 2019;78 : 113–126.
106. Reiter M, Schötta AM, Müller A, et al. A newly established real - time PCR for detection of Borrelia miyamotoi in Ixodes ricinus ticks. Ticks Tick-Borne Dis, 2015;6 : 303–308.
107. Ruyts SC, Tack W, Ampoorter E, et al. Year-to-year variation in the density of Ixodes ricinus ticks and the prevalence of the rodent-associated human pathogens Borrelia afzelii and B. miyamotoi in different forest types. Ticks Tick-Borne Dis, 2018;9 : 141–145.
108. Szerekes S, Coipan EC, Rigó K, et al. Eco-epidemiology of Borrelia miyamotoi in a popular hunting and recreational forest area in Hungary. Parasites Vectors, 2015;8 : 309.
109. Diaz P, Arnal LJ, Remesar S, et al. Molecular identification of Borrelia spirochetes in questing Ixodes ricinus from northwest Spain. Parasites Vectors, 2017;10 : 615.
110. Remesar S, Díaz P, Venzal JM, et al. Longitudinal Study of Infection with Borrelia spp. in Questing Ticks from North-Western Spain. Vector-Borne Zoonotic Dis, 2019;19 : 785–792.
111. Klitgaard K, Højgaard J, Isbrand A, et al. Screening for multiple tick-borne pathogens in Ixodes ricinus ticks from birds in Denmark during spring and autumn migration seasons. Ticks Tick - Borne Dis, 2019;10 : 546–552.
112. Kjelland V, Rollum R, Korslund L, et al. Borrelia miyamotoi is widespread in Ixodes ricinus ticks in southern Norway. Ticks Tick - Borne Dis, 2015;6 : 516–521.
113. Kjelland V, Paulsen KM, Rollum R, et al. Tick-borne encephalitis virus, Borrelia burgdorferi sensu lato, Borrelia miyamotoi, Anaplasma phagocytophilum and Candidatus Neoehrlichia mikurensis in Ixodes ricinus ticks collected from recreational islands in southern Norway. Ticks Tick-Borne Dis, 2018;9 : 1098–1102.
114. Geller J, Nazarova L, Katargina O, et al. Detection and genetic characterization of relapsing fever spirochete Borrelia miyamotoi in Estonian ticks. PLoS One, 2012;7:e51914.
115. Potkonjak A, Kleinerman G, Gutiérrez R, et al. Occurence of Borrelia burgdorferi sensu lato in Ixodes ricinus ticks with first identification of Borrelia miyamotoi in Vojvodina, Serbia. Vector-Borne Zoonotic Dis, 2016;16 : 631–635.
116. Rogovskyy A, Batool M, Gillis DC, et al. Diversity of Borrelia spirochetes and other zoonotic agents in ticks from Kyiv, Ukraine. Ticks Tick-Borne Dis, 2018;9 : 404–409.
117. Ravagnan S, Tomassone L, Montarsi F, et al. First detection of Borrelia miyamotoi in Ixodes ricinus ticks from northern Italy. Parasites Vectors, 2018;11 : 130.
118. Andersson MO, Marga G, Banu T, et al. Tick-borne pathogens in tick species infesting humans in Sibiu County, central Romania. Parasitol Res, 2018;117 : 1591–1597.
119. Sormunen JJ, Klemola T, Hänninen J, et al. The importance of study duration and spatial scale in pathogen detection - -evidence from a tick-infested island. Emerg Microbes Infect, 2018;7 : 189.
120. Namina A, Capligina V, Seleznova M, et al. Tick-borne pathogens in ticks collected from dogs, Latvia, 2011–2016. BMC Vet Res, 2019;15 : 398.
121. Hamer SA, Hickling GJ, Walker ED, et al. Increased diversity of zoonotic pathogens and Borrelia burgdorferi strains in established versus incipient Ixodes scapularis populations across the Midwestern United States. Infect Genet Evol, 2014;27 : 531–542.
122. Hulínská D, Votýpka J, Kríz B, et al. Phenotypic and genotypic analysis of Borrelia spp. isolated from Ixodes ricinus ticks by using electrophoretic chips and real-time polymerase chain reaction. Folia Microbiol, 2007;52 : 315–324.
123. Hájková H. Výskyt klíšťat a analýza jimi přenášených druhů borelie v rekreačních zónách v Českých Budějovicích a okolí. Mapovaní výskytu B. miyamotoi v klíšťatech z vybraných regionů Jižních Čech. Bakalářská práce, Jihočeská univerzita v Českých Budějovicích, České Budějovice. 2014; 26 s.
124. Honig V, Carolan HE, Vavruskova Z, et al. Broad-range survey of vector-borne pathogens and tick host identification of Ixodes ricinus from Southern Czech Republic. FEMS Microbiol Ecol, 2017;93 : 1–13.
125. Telford SR, Goethert HK, Molloy PJ, et al. Borrelia miyamotoi disease: neither Lyme disease nor relapsing fever. Clin Lab Med, 2015;35 : 867–882.
126. Krause PJ, Schwab J, Narasimhan S, et al. Hard tick relapsing fever caused by Borrelia miyamotoi in a child. Pediatr Infect Dis J, 2016;35 : 1352–1354.
127. Sarksyan DS, Platonov AE, Karan LS, et al. Probability of spirochete Borrelia miyamotoi transmission from ticks to humans. Emerg Infect Dis, 2015;21 : 2273–2274.
128. Fiorito TM, Reece R, Flanigan TP, et al. Borrelia miyamotoi polymerase chain reaction positivity on a tick-borne disease panel in an endemic region of Rhode Island: a case series. Infect Dis Clin Pract, 2017;25 : 250–254.
129. Molloy PJ, Telford SR 3rd, Chowdri HR, et al. Borrelia miyamotoi disease in the northeastern United States: a case series. Ann Intern Med, 2015;163 : 91–98.
130. Chowdri HR, Gugliotta JL, Berardi VP, et al. Borrelia miyamotoi infection presenting as human granulocytic anaplasmosis: a case report. Ann Intern Med, 2013;159 : 21–27.
131. Sudhindra P, Wang G, Schriefer ME, et al. Insights into Borrelia miyamotoi infection from an untreated case demonstrating relapsing fever, monocytosis and positive C6 Lyme serology. Diagn Microbiol Infect Dis, 2016;86 : 93–96.
132. Jobe DA, Lovrich SD, Oldenburg DG, et al. Borrelia miyamotoi Infection in Patients from Upper Midwestern United States, 2014–2015. Emerg Infect Dis, 2016;22 : 1471–1473.
133. Hoornstra D, Koetsveld J, Sprong H, et al. Borrelia miyamotoi Disease in an Immunocompetent Patient, Western Europe. Emerg Infect Dis, 2018;24 : 1770–1772.
134. Oda R, Kutsuna S, Sekikawa Y, et al. The first case of imported Borrelia miyamotoi disease concurrent with Lyme disease. J Infect Chemother, 2017;23 : 333–335.
135. Franck M, Ghozzi R, Pajaud J, et al. Borrelia miyamotoi: 43 Cases Diagnosed in France by Real-Time PCR in Patients With Persistent Polymorphic Signs and Symptoms. Front Med (Lausanne), 2020;7 : 55.
136. Siński E, Welc-Falęciak R, Zajkowska J. Borrelia miyamotoi: A human tick-borne relapsing fever spirochete in Europe and its potential impact on public health. Adv Med Sci, 2016;61 : 255 – 260.
137. Krause PJ, Narasimhan S, Wormser GP, et al. Borrelia miyamotoi sensu lato seroreactivity and seroprevalence in the northeastern United States. Emerg Infect Dis, 2014;20 : 1183–1190.
138. Krause PJ, Carroll M, Fedorova N, et al. Human Borrelia miyamotoi infection in California: serodiagnosis is complicated by multiple endemic Borrelia species. PLoS One, 2018;13:e0191725.
139. Smith RP Jr., Elias SP, Cavanaugh CE, et al. Seroprevalence of Borrelia burgdorferi, B. miyamotoi, and Powassan Virus in Residents Bitten by Ixodes Ticks, Maine, USA. Emerg Infect Dis, 2019;25 : 804–807.
140. Sato K, Sakakibara K, Masuzawa T, et al. Case control study: Serological evidence that Borrelia miyamotoi disease occurs nationwide in Japan. J Infect Chemother, 2018;24 : 828–833.
141. Henningsson AJ, Asgeirsson H, Hammas B, et al. Two Cases of Borrelia miyamotoi Meningitis, Sweden, 2018. Emerg Infect Dis, 2019;25 : 1965–1968.
142. Krause PJ, Hendrickson JE, Steeves TK, et al. Blood transfusion transmission of the tick-borne relapsing fever spirochete Borrelia miyamotoi in mice. Transfusion, 2015;55 : 593–597.
143. Thorp AM, Tonnetti L. Distribution and survival of Borrelia miyamotoi in human blood components. Transfusion, 2016;56 : 705–711.
144. Koetsveld J, Draga ROP, Wagemakers A, et al. In vitro susceptibility of the relapsing-fever spirochete Borrelia miyamotoi to antimicrobial agents. Antimicrob Agents Chemother, 2017;61:e00535–17.
145. Koetsveld J, Manger A, Hoornstra D, et al. In Vitro Antimicrobial Susceptibility of Clinical Isolates of Borrelia miyamotoi. Antimicrob Agents Chemother, 2018;62:e00419–18.
146. Telford SR, Goethert HK, Molloy PJ, et al. Blood Smears Have Poor Sensitivity for Confirming Borrelia miyamotoi Disease. J Clin Microbiol, 2019;57:e01468–18.
147. Barbour AG. Isolation and cultivation of Lyme disease spirochaetes. Yale J Biol Med, 1984;57 : 521–525.
148. Margos G, Stockmeier S, Hizo-Teufel C, et al. Long-term in vitro cultivation of Borrelia miyamotoi. Ticks Tick-Borne Dis, 2015;6 : 181–184.
149. Stone BL, Brissette CA. Laboratory cultivation and maintenance of Borrelia miyamotoi. Curr Protoc Microbiol, 2016;42 : 12F.1.1 – 12F.1.6.
150. Wagemakers A, Oei A, Fikrig MM, et al. The relapsing fever spirochete Borrelia miyamotoi is cultivable in a modified Kelly-Pettenkofer medium, and is resistant to human complement. Parasites Vectors, 2014;7 : 418.
151. Koetsveld J, Kolyasnikova NM, Wagemakers A, et al. Development and optimization of an in vitro cultivation protocol allows for isolation of Borrelia miyamotoi from patients with hard tickborne relapsing fever. Clin Microbiol Infect, 2017;23 : 480–484.
152. Schwan TG, Schrumpf ME, Hinnebusch BJ, et al. GlpQ: an antigen for serological discrimination between relapsing fever and Lyme borreliosis. J Clin Microbiol, 1996;34 : 2483–2492.
153. Karan L, Makenov M, Kolyasnikova N, et al. Dynamics of Spirochetemia and Early PCR Detection of Borrelia miyamotoi. Emerg Infect Dis, 2018;24 : 860–867.
154. Hue F, Langeroudi AG, Barbour AG. Chromosome sequence of Borrelia miyamotoi, an uncultivable tick-borne agent of human infection. Genome Announc, 2013;1:e00713–13.
155. Kingry LC, Replogle A, Batra D, et al. Toward a Complete North American Borrelia miyamotoi Genome. Genome Announc, 2017;5:e01557–16.
156. Kingry LC, Replogle A, Dolan M, et al. Chromosome and Large Linear Plasmid Sequences of a Borrelia miyamotoi Strain Isolated from Ixodes pacificus Ticks from California. Genome Announc, 2017;5:e00960–17.
157. Kuleshov KV, Koetsveld J, Goptar IA, et al. Whole-Genome Sequencing of Six Borrelia miyamotoi Clinical Strains Isolated in Russia. Genome Announc, 2018;6:e01424–17.
158. Kuleshov KV, Hoornstra D, Sprong H, et al. Draft Whole-Genome Sequences of Two Western European Borrelia miyamotoi Isolates. Microbiol Resour Announc, 2019;8:e01314–19.
159. Janeček J, Nováková M, Oppelt J, et al. Complete Chromosomal Sequences of Two Borrelia miyamotoi Samples Obtained from Ixodes ricinus Eggs in Czechia. Microbiol Resour Announc, 2020;9:e01504–19.
160. Wagemakers A, Koetsveld J, Narasimhan S, et al. Variable Major Proteins as Targets for Specific Antibodies against Borrelia miyamotoi. J Immunol, 2016;196 : 4185–4195.
161. Koetsveld J, Kolyasnikova NM, Wagemakers A, et al. Serodiagnosis of Borrelia miyamotoi disease by measuring antibodies against GlpQ and variable major proteins. Clin Microbiol Infect, 2018;24 : 1338.e1–1338.e7.
162. Jahfari S, Sarksyan DS, Kolyasnikova NM, et al. Evaluation of a serological test for the diagnosis of Borrelia miyamotoi disease in Europe. J Microbiol Methods, 2017;136 : 11–16.
163. Tokarz R, Tagliafierro T, Caciula A, et al. Identification of immunoreactive linear epitopes of Borrelia miyamotoi. Ticks Tick-Borne Dis, 2020;11 : 101314.
164. Lee SH, Vigliotti JS, Vigliotti VS, et al. Detection of borreliae in archived sera from patients with clinically suspect Lyme disease. Int J Mol Sci, 2014;15 : 4284–4298.
165. Molloy PJ, Weeks KE, Todd B, et al. Seroreactivity to the C6 Peptide in Borrelia miyamotoi Infections Occurring in the Northeastern United States. Clin Infect Dis, 2018;66 : 1407–1410.
166. Koetsveld J, Platonov AE, Kuleshov K, et al. Borrelia miyamotoi infection leads to cross-reactive antibodies to the C6 peptide in mice and men. Clin Microbiol Infect, 2019;26 : 513.e1–513.e6.
167. Hulínská D, Kybicová K. Diagnostika lymeské borreliózy v NRL LB [online] 2008-05-14 [cit. 2020-01-26]. Dostupné na www: http:// www.szu.cz/tema/prevence/diagnostika-lymeske-borreliozy-v - -nrl-lb.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2021 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Prokalcitonin: marker vhodný pro diagnostiku sepse i hodnocení antimikrobiální léčby
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Séroprevalence protilátek proti spalničkám u zaměstnanců Fakultní nemocnice Olomouc před přeočkováním a po přeočkování – pilotní studie
- Populační analýza Streptococcus pneumoniae sérotypu 19A metodou sekvenace celého genomu v České republice a Evropě po jeho zařazení do pneumokokové konjugované vakcíny
- Borrelia miyamotoi – další emergentní patogen přenášený klíšťaty
- Necholerová vibria – výskyt nejen v Evropě v posledních letech
- Vyšla první ucelená monografie oboru praktický lékař pro děti a dorost
- Riziko latentnej tuberkulózy u pacientov s reumatoidnou artritídou na Slovensku
- Epidemiologické šetření a analýza epidemického výskytu akutních gastroenteritid mezi zaměstnanci dvou sousedních institucí sdílejících jídelnu v Praze v roce 2019
- Užívání návykových látek a návykové chování se během opatření proti covid-19 zvýšilo u intenzivních uživatelů: výsledky online studie v obecné populaci České republiky
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Necholerová vibria – výskyt nejen v Evropě v posledních letech
- Borrelia miyamotoi – další emergentní patogen přenášený klíšťaty
- Séroprevalence protilátek proti spalničkám u zaměstnanců Fakultní nemocnice Olomouc před přeočkováním a po přeočkování – pilotní studie
- Užívání návykových látek a návykové chování se během opatření proti covid-19 zvýšilo u intenzivních uživatelů: výsledky online studie v obecné populaci České republiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



