-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAntibiotická rezistence Streptococcus pneumoniae a Streptococcus pyogenes v letech 1996–2009
Urbášková P., Žemličková H., PSMR: Antibiotic Resistance of Streptococcus pneumoniae and Streptococcus pyogenes in 1996–2009
Study objectives:
To analyze trends in the resistance of Streptococcus pneumoniae to penicillin and acrolides and of S. pyogenes to macrolides over a 14-year period and to determine serotypes and molecular characteristics in a selected group of S. pneumoniae strains resistant to these antibiotics.Material and ethods:
Susceptibility to antibiotics was tested by the participating laboratories by the disk diffusion method in isolates of both bacterial species from the lower and upper respiratory tract from 1996–2009. The National Reference Laboratory for Antibiotics NRL/ATB) determined the minimal inhibitory concentrations of penicillin and erythromycin for invasive pneumococcal isolates from 2000–2009 and performed multilocus sequence analysis of selected resistant strains.Results:
Over the 14-year period monitored, penicillin resistance of S. pneumoniae isolates from the upper and lower respiratory tract showed a slightly downward trend similarly to blood isolates monitored since 2000. Resistance to macrolides in S. pneumoniae isolates was lower than penicillin resistance, regardless of the sample origin until 2005, but became higher than penicillin resistance in 2006 to follow a continuously upward trend since then. In 2009, the penicillin resistance rates of S. pneumoniae isolates from the upper respiratory tract, lower respiratory tract and blood were 3.5%, 5.1% and 4.7%, respectively, while the respective erythromycin resistance rates reached 8.4%, 12.2% and 5.5%. When using the new clinical breakpoints for pneumococci from pneumonia cases depending on penicillin dose and administration interval, only two (0.1%) of 1528 strains from the blood were confirmed as penicillin resistant (MIC 4 mg/l). Resistance of S. pyogenes to macrolides, reported in 16.5% of strains in 2001, sharply decreased to 9% in 2003 as a result of an intervention to promote the use of penicillin for the treatment of tonsillopharyngitis, and reached 11.1% in 2009. Among penicillin resistant strains of S. pneumoniae, the spread of clone Spain9V-3 (ST156) was confirmed, and among S. pneumoniae strains resistant to erythromycin alone, the spread of clones Poland6B-20 (ST315) and England9V-14 (ST9) was found.Conclusions:
The favourable low prevalence of penicillin resistance among S. pneumoniae strains, which in addition is negligible in the light of the new clinical breakpoints for penicillin resistance in strains from patients with pneumonia, contrasts with the ever increasing resistance of this species to macrolides. The highest rates of resistance to macrolides found in the strains isolated mainly from the sputum of adult patients confirm the preference for macrolides over the drugs of choice amoxicillin or penicillin G in the treatment of adults with pneumococcal pneumonia. Further spread of successful multiresistant clones of S. pneumoniae, the presence of which has been revealed in the Czech Republic, can only be prevented by a radical reduction in overuse or misuse of antibiotics.Keywords:
Streptococcus pneumoniae – Streptococcus pyogenes – antibiotic resistance – typing.
Autoři: P. Urbášková; H. Žemličková; Pracovní Skupina Pro Monitorování Rezistence (psmr) *
Působiště autorů: Národní referenční laboratoř pro antibiotika, Centrum laboratorních činností, Státní zdravotní ústav Praha
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 60, 2011, č. 1, s. 10-20
Souhrn
Cíl práce:
Analyzovat trendy antibiotické rezistence u Streptococcus pneumoniae k penicilinu a k makrolidům a u S. pyogenes k makrolidům za období 14 let a zjistit sérotypy a molekulární charakter vybraného souboru kmenů S. pneumoniae rezistentních k těmto antibiotikům.Materiál a metodiky:
Citlivost k antibiotikům diskovou difuzní metodou u obou druhů bakterií izolovaných ze vzorků od pacientů z dolních a horních dýchacích cest vyšetřovaly v období let 1996–2009 zúčastněné laboratoře, v NRL/ATB byly vyšetřeny minimální inhibiční koncentrace penicilinu a erytromycinu u invazivních kmenů pneumokoků izolovaných v období let 2000–2009 a byla provedena multilokusová sekvenace vybraných rezistentních kmenů.Výsledky:
V průběhu 14 let sledování rezistence u S. pneumoniae pozvolna klesala rezistence k penicilinu u kmenů izolovaných ze vzorků z horních a dolních cest dýchacích, stejně jako u kmenů z krve sledovaných od roku 2000. Rezistence k makrolidům, která byla u S. pneumoniae bez ohledu na původ vzorku až do roku 2005 nižší než rezistence k penicilinu, v roce 2006 převýšila rezistenci k penicilinu a od té doby trvale roste. V roce 2009 byla rezistence kmenů S. pneumoniae z horních cest dýchacích, dolních cest dýchacích a z krve k penicilinu 3,5%, 5,1% , respektive 4,7% a k erytromycinu 8,4%, 12,2% a 5,5%. Při použití nových klinických breakpointů pro pneumokoky z pneumonií podle výše dávky a intervalu podávání penicilinu byly v souboru 1528 kmenů z krve potvrzeny jen dva kmeny (0,1 %) rezistentní k penicilinu (MIC 4 mg/l). Rezistence k makrolidům u S. pyogenes, která v roce 2001 byla zjištěna u 16,5 % kmenů, v důsledku intervence ve prospěch penicilinu pro léčbu tonzilofyryngitidy prudce poklesla (na 9% v roce 2003) a v roce 2009 byla 11,1%. Mezi kmeny S. pneumoniae rezistentními k penicilinu bylo potvrzeno rozšíření klonu Spain9V-3 (ST156) a mezi kmeny rezistentními pouze k erytromycinu klony Poland6B-20 (ST315) a England9V-14 (ST9).Závěry:
Příznivá situace v nízké prevalenci rezistence kmenů S. pneumoniae k penicilinu, která je navíc při aplikaci nových klinických breakpointů penicilinu pro kmeny od pacientů s pneumonií zanedbatelná, je v kontrastu s trvale rostoucí rezistencí tohoto druhu k makrolidům. Nejvyšší frekvence rezistence k makrolidům, zjištěná u kmenů izolovaných ze sputa převážně dospělých pacientů, potvrzuje preferenci léčby dospělých pacientů s pneumokokovou pneumonií makrolidy před léky volby amoxicilinem nebo penicilinem G. Další rozšíření úspěšných multirezistentních klonů S. pneumoniae, jejichž přítomnost byla v ČR prokázána, může omezit pouze radikální snížení zbytečně podávaných nebo nesprávně volených antibiotik.Klíčová slova:
Streptococcus pneumoniae – Streptococcus pyogenes – antibiotická rezistence – typizace.*Členové PSMR v roce 2009: MUDr. N. Bartoníková, Baťova nemocnice Zlín; MUDr. M. Bártová, FTN Praha; MUDr. E. Bendová, FNKV Praha; MUDr. T. Bergerová, FN Plzeň; MUDr. Z. Bohunová, Nemocnice Liberec; MUDr. E. Čápová, Okresní nemocnice Tábor; MUDr. M. Dovalová, Slezská nemocnice Opava; MUDr. M. Glasnák, Nemocnice Benešov; MUDr. M. Hanslianová, FN Brno-Bohunice; RNDr. V. Hásková, Laboratoře lékařské mikrobiologie Hořovice; MUDr. B. Heinigeová, Okresní nemocnice Jindřichův Hradec; MUDr. B. Horová, FN Bulovka Praha; MUDr. M. Horníková, Nemocnice České Budějovice; RNDr. E. Chmelařová, ZÚ Ostrava; MUDr. J. Janečková, Nemocnice Litomyšl; MUDr. A. Jedličková, VFN Praha; MVDr. P. Ježek, Oblastní nemocnice Příbram; MUDr. V. Jindrák, NNH Praha; prof. MUDr. M. Kolář, Ph.D., FN Olomouc; MUDr. D. Krčková, IFCOR-99 Brno; MUDr. P. Linhart, Nemocnice Havlíčkův Brod; RNDr. M. Machučová, P+R Lab, Nový Jičín; MUDr. D. Malotová, Laboratoře klinické mikrobiologie Šternberk; MUDr. J. Miklová, Nemocnice Uherské Hradiště; MUDr. M. Mlynaříková, Nemocnice Most; RNDr. H. Nedvědová, ZÚ Klatovy; RNDr. J. Niemczyková, ZÚ Havířov; MUDr. O. Nýč, FN Motol, Praha; MUDr. E. Paterová, FN Hradec Králové; MUDr. V. Petkov, IKEM Praha; MUDr. Z. Pokorná, Bio-Plus Brno; RNDr. J. Pomykal, Oblastní nemocnice Kolín; MUDr. B. Puchálková, Nemocnice Karlovy Vary; MUDr. M. Rumlerová, ZÚ Kladno; MUDr. L. Ryšková, Ústav klinické mikrobiologie Hradec Králové; MUDr. A. Sekáčová, Nemocnice Vsetín; MUDr. J. Scharfen, Oblastní nemocnice Trutnov; MUDr. H. Skáčaniová, Nemocnice Jihlava; MUDr. A. Steinerová, Klinlab Praha; RNDr. E. Šťastná, Nemocnice Přerov; PharmDr. E. Šimečková, Okresní nemocnice Strakonice; MUDr. M. Štolbová, Masarykova nemocnice, Ústí nad Labem; MUDr. R. Tejkalová, FN u sv. Anny, Brno; MUDr. V. Tomášková, Lékařské laboratoře Praha; MUDr. L. Trojan, Nemocnice Třebíč; MUDr. E. Veselá, Oblastní nemocnice Náchod; MUDr. E. Zálabská, Krajská nemocnice Pardubice; MUDr. D. Zamazalová, Nemocnice Nové Město na Moravě.
Úvod
Nejčastější příčinou podávání antibiotik v humánní medicíně jsou infekce dýchacích cest, přestože většinu z nich u dětí [1] i dospělých [2] způsobují viry. Studie provedená u nás před deseti lety ukázala zbytečné podání antibiotik u 40 % dětí s virovou infekcí dýchacích cest [3]. Další významnou příčinou nadbytečného používání antibiotik je polypragmazie, kdy zejména pro léčbu pneumonií se volí kombinace dvou až tří širokospektrých antibiotik bez snahy o laboratorní průkaz původce a léčbu antibiotikem volby.
Hlavním bakteriálním původcem komunitních bakteriálních pneumonií i ostatních infekcí dýchacích cest včetně bakteremických komplikací je Streptococcus pneumoniae (pneumokok), který je také nejčastějším původcem meningitidy [4]. Lékem volby pro infekce způsobené pneumokoky je penicilin. Unikátní vlastnosti penicilinu, zejména jeho nízká toxicita a výborná snášenlivost vysokých koncentrací, umožňují jeho intenzivní nitrožilní aplikaci u závažných případů pneumokokových pneumonií [5, 6, 7] včetně těch, které jsou způsobeny kmeny se sníženou citlivostí k penicilinu [8]. V léčbě infekcí horních dýchacích cest způsobených pneumokoky je pro výhodnou farmakokinetiku a farmakodynamiku preferován perorální amoxicilin [1, 5, 9]. V rutinní léčbě infekcí způsobených pneumokoky však jsou tato antibiotika často nahrazována alternativními makrolidy [3, 10], k nimž velmi rychle vzrůstá rezistence [10, 11, 12]. Penicilin je lékem volby i pro tonzilofaryngitidu a ostatní infekce způsobené Streptococcus pyogenes (streptokoky sk. A) pro jejich bezvýhradnou citlivost k tomuto antibiotiku [5], jak dokládají i hodnoty minimálních inhibičních koncentrací (MIC) penicilinu, které se průběhem času u streptokoků A nemění [13]. Podle výsledků studie provedené u nás je však penicilin u zhruba 39 % dětí s tonzilofaryngitidou nahrazován makrolidy [3]. Prudký vzestup spotřeby makrolidů, zaznamenaný u nás počátkem 90. let minulého století [14], byl následován exponenciálním nárůstem rezistence streptokoků sk. A k těmto antibiotikům [15, 16]. Nejčastější chyby, jako je podávání antibiotik pacientům s virovými infekcemi včetně masivní profylaxe bakteriálních komplikací chřipky [17], používání širokospektrých antibiotických kombinací a alternativních antibiotik tam, kde je původce infekce citlivý k antibiotiku volby, jsou hlavními příčinami vzestupu rezistence u původců bakteriálních respiračních infekcí [11, 18, 19]. Rychlost selekce rezistentních bakterií a frekvenci jejich výskytu významně akceleruje množství a složení antibiotik používaných v dané oblasti země nebo světa [11, 19, 20, 21]. Antibiotická rezistence bakteriálních původců komplikuje výběr antibiotik, ohrožuje úspěch léčby a zvyšuje léčebné náklady. Je proto nutno podrobně znát stav citlivosti původců infekcí v dané zemi pro predikci pozice antibotik volby.
Antibiotickou rezistenci nejvýznamnějších bakteriálních původců infekčních onemocnění v České republice (ČR) sleduje Pracovní skupina pro monitorování rezistence (PSMR) ustavená v roce 1990 při Národní referenční laboratoři pro antibiotika (NRL/ATB) [22]. PSMR sdružuje pracovníky z mikrobiologických laboratoří, jejichž spádová oblast zahrnuje zhruba 82 % populace ČR [23]. Primárním cílem PSMR v problematice pneumokoků je průběžně získávat aktuální národní údaje o stavu citlivosti těchto bakterií k penicilinu včetně vyšetření hodnot MIC k posouzení jejich distribuce v populaci a zaznamenávat případné změny v čase k posouzení validity penicilinu jako léku volby. Dále sledovat rezistenci pneumokoků a streptokoků sk. A také k alternativním makrolidovým antibiotikům, a kmeny pneumokoků rezistentní k penicilinu nebo erytromycinu podrobit molekulární analýze. Nejvýznamnější získané výsledky u těchto dvou druhů bakterií jsou uvedeny v této práci.
Materiál a metodiky
Uspořádání studie a zúčastněné laboratoře. Rezistenci pneumokoků k penicilinu a erytromycinu sleduje PSMR ve dvou projektech. V projektu Respirační patogeny (RP), zahájeném v roce 1996, zaznamenávají zúčastněné laboratoře každý rok ve třech měsících respirační sezony (říjen až prosinec) do předepsaného excelového formátu poskytnutého NRL/ATB rezistenci pneumokoků izolovaných z dýchacích cest a streptokoků sk. A izolovaných z krku. Vzorky, z nichž jsou kmeny izolovány, jsou odebírány praktickými lékaři. Kromě výsledků vyšetření citlivosti obsahují protokoly údaje o věkové skupině pacienta a druhu odebraného vzorku. V projektu EARSS (European Antimicrobial Resistance Surveillance System), od roku 2010 nazývaný EARS-Net, (European Antimicrobial Resistance Surveillance Network), kterého se ČR (CZ-EARS-Net) účastní od roku 2000, se zaznamenávají průběžně po dobu celého roku výsledky vyšetření citlivosti v kvantitativních hodnotách (MIC nebo průměr inhibiční zóny) u 7 druhů invazivních bakterií. U invazivních pneumokoků (izolátů z krve nebo mozkomíšního moku) se elektronicky do podrobného protokolu zaznamenávají demografické údaje o pacientech a příslušné lokalitě, odkud pocházejí, dále výsledky vyšetření citlivosti k antibiotikům, u penicilinu v hodnotách MIC [24]. V roce 2009 sdružovala PSMR celkem 48 mikrobiologických laboratoří, v projektu RP participovalo 38 laboratoří a v CZ-EARS-Net 46 laboratoří.
Bakterie. Kultivaci vzorků z dýchacích cest a identifikaci pneumokoků a streptokoků sk. A prováděly zúčastněné laboratoře podle svých rutinních postupů. Do studie byly zahrnuty pouze kmeny izolované z validních vzorků odebraných z horních cest dýchacích (hnis z ucha, dutin, oka, výtěr z krku pouze při průkazu streptokokové tonzilitidy) a dolních cest dýchacích (sputum, bronchoalveolární laváž), krve nebo mozkomíšního moku. Dobrou kvalitu identifikace v mikrobiologických laboratořích ČR potvrzuje pravidelné Externí hodnocení kvality (EHK). Kmeny pneumokoků zaslané do NRL/ATB byly ověřeny testem rozpustnosti v 10% desoxycholátu sodném, u kmenů streptokoků sk. A byl prokazován antigen A latexovou aglutinací (SLIDEX Strepto Plus, bioMérieux). Sérotypizace pneumokoků necitlivých k penicilinu (MIC > 0,063 mg/l) pomocí Pneumotest latex (Statens Serum Institute, Kodaň) [25] a jejich subtypizace Quellungovou reakcí byla provedena v NRL pro streptokoky a pneumokoky. U 35 kmenů sérotypů 9V (n = 25), 14 (n = 6) a 6B (n = 4) byl stanoven sekvenační typ (ST) pomocí metody MLST – multilokusové sekvenace [26]. Alely a ST byly určeny prostřednictvím databáze S. pneumoniae dostupné na www.mlst.net.
Vyšetření antibiotické citlivosti a interpretace výsledků. V projektu RP vyšetřovaly zúčastněné laboratoře citlivost izolátů z dýchacích cest difuzní diskovou metodou [27]. Kmeny pneumokoků, které vytvářely kolem disku s 1 μg oxacilinu inhibiční zónu o průměru ≥ 20 mm, byly označeny za citlivé k penicilinu a platí pro ně, že jsou inhibovány koncentrací < 0,063 mg/l penicilinu [8]. Pro vyšetření citlivosti k makrolidům u pneumokoků i streptokoků skupiny A byl použit disk s 15 μg erytromycinu, kolem kterého citlivé kmeny vytvářely inhibiční zónu o průměru ≥ 21 mm [28]. Kmeny s inhibiční zónou o menším průměru byly označeny jako rezistentní. Výsledky získané vyšetřením erytromycinu jsou bezvýhradně platné také pro klaritromycin a azitromycin a tato tři antibiotika jsou v textu označena jako makrolidy. Kmeny s nejasným výsledkem citlivosti byly zasílány do NRL/ATB k vyšetření MIC a výsledek byl případně upraven. Invazivní kmeny pneumokoků získané v rámci CZ-EARSS byly zasílány do NRL/ATB, kde byla vyšetřena MIC penicilinu a erytromycinu bujonovou diluční mikrometodou v Mueller-Hinton bujonu s 3% lyzátem koňské krve [27]. Za citlivé k penicilinu byly označeny kmeny s MIC < 0,063 mg/l, k erytromycinu s MIC < 0,25 mg/l [8]. Izoláty pneumokoků z krve s MIC penicilinu > 0,063 mg/l, které byly dříve pokládány za intermediárně rezistentní (MIC 0,125–1 mg/l) nebo rezistentní k penicilinu (MIC > 1 mg/l) byly dále kategorizovány podle nových klinických breakpointů (hodnoty koncentrací antibiotika pro označení citlivosti, rezistence, případně intermediární rezistence). Nové klinické breakpointy pro penicilin u pneumokoků zohledňují typ infekce, MIC penicilinu, výši dávky a interval podávání tohoto antibiotika [8].
Zpracování dat. Protokoly vyplněné v rámci projektu RP byly po vždy po ukončení tříměsíčního sběru dat zaslány do NRL/ATB, kde byla data manuálně zpracována. Údaje získané v rámci CZ-EARS-Net byly vyhodnoceny automaticky.
Výsledky
Lokalizace laboratoří na území ČR, kterou ilustruje obrázek 1, splňuje nároky na geografickou odlišnost poskytovaných údajů a kmenů zasílaných k vyšetření do NRL/ATB.
Obr. 1. Lokalizace laboratoří sdružených v PSMR na území České republiky v roce 2009 PSMR: Pracovní skupina pro monitorování antibiotické rezistence bakterií. Laboratoře jsou označeny čísleným kódem. Fig. 1. Location of laboratories participating in the Working Group on Antibiotic Resistance Surveillance in the Czech Republic in 2009 PSMR: Working Group on Antimicrobial Resistance Surveillance. Laboratories are number coded. 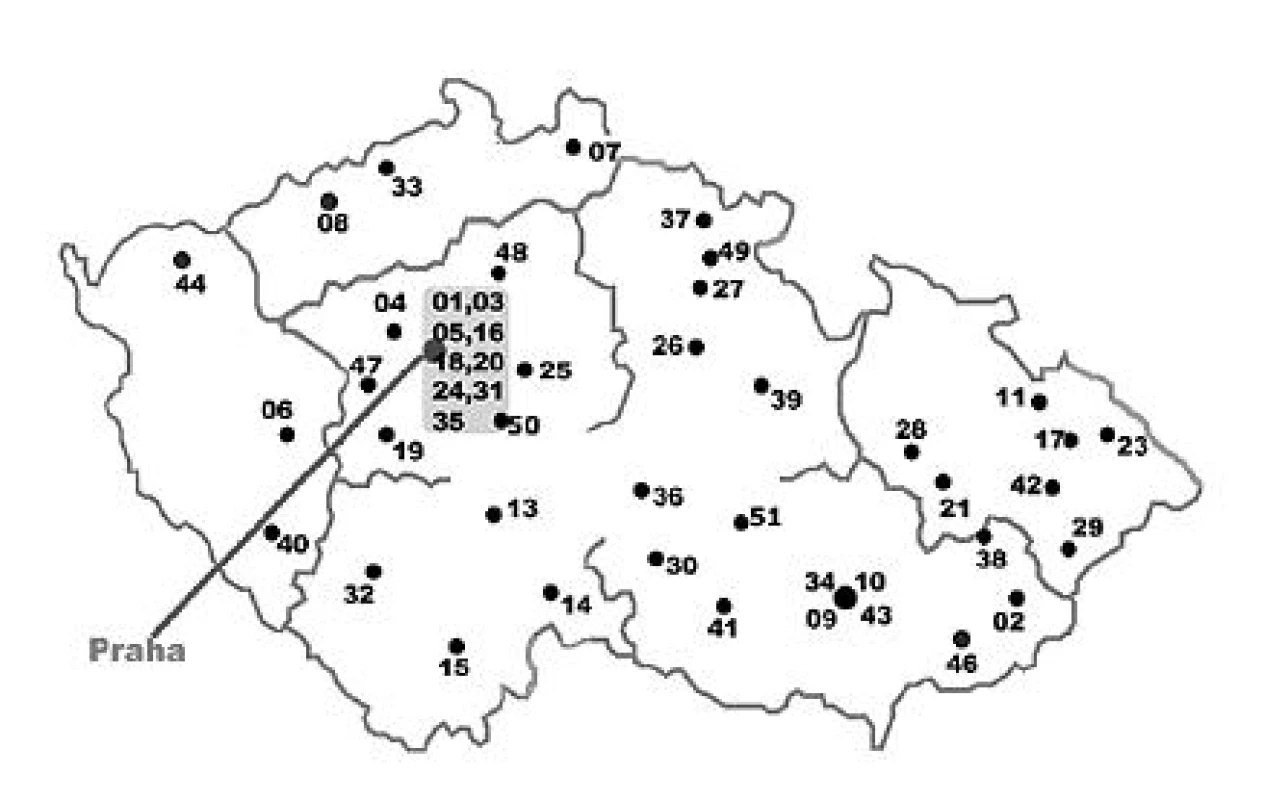
V projektu RP byla v období let 1996–2009 vyšetřena citlivost k penicilinu a erytromycinu celkem u 12 909 kmenů pneumokoků, z toho bylo 8 882 kmenů z horních cest dýchacích a 4027 kmenů z dolních cest dýchacích. V NRL/ATB bylo vyšetřeno celkem 1910 invazivních kmenů pneumokoků izolovaných laboratořemi v rámci CZ-EARS-Net v období let 2000–2009, z nichž 1528 bylo izolováno z krve a 382 z mozkomíšního moku. Grafy 1, 2, 3 a 4 ilustrují trendy rezistence k penicilinu a makrolidům podle původu pneumokoků. Všechny kmeny pneumokoků, označené v grafech 1–4 jako rezistentní k penicilinu, zahrnují kmeny inhibované vyššími koncentracemi tohoto antibiotika (MIC > 0,063 mg/l) bez ohledu na použitou metodu vyšetření citlivosti.
Graf 1. Trendy rezistence (%) k penicilinu* a k makrolidům u 8882 kmenů Streptococcus pneumoniae izolovaných ze vzorků** od pacientů s infekcí horních cest dýchacích v období let 1996–2009 *MIC penicilinu: > 0,063 mg/l; **hnis z ucha, dutiny, oka; n = počet kmenů Graph 1. Trends in the resistance (%) to penicillin * and macrolides in 8882 strains of Streptococcus pneumoniae isolated from specimens** from patients with upper respiratory tract infection in 1996–2009 * penicillin MIC: > 0.063 mg/l; **pus from the ear, sinuses, and eye; n = number of strains 
Graf 2. Trendy rezistence k penicilinu* a k makrolidům u 4027 kmenů Streptococcus pneumoniae izolovaných ze vzorků** od pacientů s infekcí dolních cest dýchacích v období let 1996–2009 *MIC penicilinu: > 0,063 mg/l; **sputum, bronchoalveolární laváž; n = počet kmenů Graph 2. Trends in the resistance to penicillin* and macrolides in 4027 strains of Streptococcus pneumoniae isolated from specimens ** from patients with lower respiratory tract infection in 1996–2009 * penicillin MIC: > 0.063 mg/l; **sputum and bronchoalveolar lavage fluid; n = number of strains 
Graf 3. Trendy rezistence (%) k penicilinu* a k makrolidům u 1528 kmenů Streptococcus pneumoniae izolovaných z krve pacientů v období let 2000–2009 *MIC penicilinu: > 0,063 mg/l; n = počet kmenů Graph 3. Trends in the resistance (%) to penicillin* and macrolides in 1528 strains of Streptococcus pneumoniae isolated from the blood of patients in 2000–2009 *penicillin MIC: > 0.063 mg/l; n = number of strains 
Graf 4. Trendy rezistence (%) k penicilinu* u 382 kmenů Streptococcus pneumoniae izolovaných z mozkomíšního moku pacientů v období let 2000–2009. *MIC penicilinu: > 0,063 mg/l; n = počet kmenů Graph 4. Trends in the resistance (%) to penicillin* in 382 strains of Streptococcus pneumoniae isolated from the cerebrospinal fluid in 2000–2009. *penicillin MIC: > 0.063 mg/l; n = number of strains 
Po období velmi vyrovnaného trendu rezistence k penicilinu u kmenů pneumokoků ze vzorků z horních cest dýchacích, který v období 1996–2005 kolísal v rozmezí necelého procenta (4,6–5,3 %), následoval prudký pokles počtu rezistentních kmenů na 1,8 % v roce 2006 (viz graf 1). Ve stejném souboru kmenů od roku 1996 postupně narůstala rezistence k erytromycinu z počáteční hodnoty 1,3 % na 8,4 % v roce 2009 a od roku 2006 je trvale vyšší než rezistence k penicilinu (viz graf 1).
U kmenů ze vzorků z dolních cest dýchacích v období let 1996–2005 rezistence k makrolidům (rozmezí 1,5–7,3 %) zhruba kopírovala frekvenci rezistence k penicilinu (rozmezí 3,1–7,5 %) – viz graf 2. V roce 2006 převýšila makrolidová rezistence rezistenci k penicilinu a od té doby je trvale vyšší. Nejvyšší počet kmenů rezistentních k makrolidům se vyskytl v roce 2009 a činil 12,2 %, zatímco ve stejném roce byla rezistence k penicilinu 5,1% (viz graf 2).
Rezistence k penicilinu u kmenů izolovaných z krve, pocházejících převážně od pacientů s pneumokokovou pneumonií, byla nejvyšší v roce 2002 a od té doby se trvale snižuje (viz graf 3). V roce 2000 nebyl zjištěn žádný kmen z krve rezistentní k makrolidům, od té doby však rezistence postupně vzrůstá, v roce 2006 dostihla (shodně 3 %),v roce 2007 předstihla (5,6 %) rezistenci k penicilinu a od té doby je trvale vyšší (viz graf 3).
U kmenů z mozkomíšního moku není uvedena rezistence k makrolidům, neboť tato antibiotika nejsou pro léčbu meningitidy vhodná. Velké rozdíly ve výskytu rezistentních kmenů v rozmezí jednotlivých let jsou způsobeny poměrně malým počtem kmenů (v jednotlivých letech vyšetřeno 26–52 kmenů).
Grafy 5 a 6 ilustrují distribuci MIC penicilinu u invazivních pneumokoků a aplikaci původních a nových klinických breakpointů. Distribuce MIC penicilinu u pneumokoků izolovaných z krve a z mozkomíšního moku je téměř identická (viz graf 5). Na grafu jsou označeny šipkami koncentrace penicilinu s původními breakpointy pro pneumokoky citlivé (rozmezí MIC < 0,008 až 0,063 mg/l), intermediárně rezistentní (rozmezí MIC 0,125–1 mg/l) a rezistentní k penicilinu (MIC > 1 mg/l). Podle nich bylo 3,7 % kmenů z krve a 3,4 % kmenů z mozkomíšního moku intermediárně rezistentních k penicilinu a rezistentních bylo 0,6 %, respektive 0,5 % těchto kmenů (viz graf 5). Původní breakpointy zůstaly v platnosti jen pro kmeny pneumokoků neznámého původu nebo pro kmeny s MIC penicilinu < 0,063 mg/l izolované z méně závažných infekcí dýchacích cest, které lze léčit penicilinem V.
Graf 5. Distribuce MIC penicilinu (%) u kmenů Streptococcus pneumoniae izolovaných z krve (n = 1528) nebo mozkomíšního moku (n = 382) v období let 2000–2009 Šipky označují původní rozmezí MIC pro kmeny citlivé (SH, MIC < 0,063 mg/l), intermediárně rezistentní (IR, MIC 0,125-1 mg/l) a rezistentní (R > 1 mg/l) k penicilinu. Graph 5. Distribution of penicillin MIC (%) in strains of Streptococcus pneumoniae isolated from the blood (n = 1528) or cerebrospinal fluid (n = 382) in 2000–2009 Arrows indicate the initial penicillin MIC ranges for susceptible strains (SH, MIC < 0.063 mg/l), intermediately resistant strains (IR, MIC 0.125-1 mg/l) and resistant strains (R > 1 mg/l). 
Graf 6. Distribuce MIC penicilinu (%) u Streptococcus pneumoniae izolovaných z krve (n = 1528) a aplikace nových klinických breakpointů penicilinu pro citlivé kmeny z pneumonií [8] Šipky vymezují kmeny citlivé k penicilinu podle MIC, výše dávky a intervalu podávání. Dávky a intervaly podání penicilinu G u pneumokokových pneumonií podle MIC penicilinu: MIC < 0,5 mg/l: 1,2 g každých 6 hodin; MIC 1 mg/l: 2,4 g každých 6 hodin; MIC 2 mg/l: 2,4 g každé 4 hodiny. Graph 6. Distribution of penicillin MIC (%) in strains of Streptococcus pneumoniae isolated from the blood (n = 1528) and new clinical breakpoints for penicillin in susceptible strains from pneumonia [8] Arrows indicate strains susceptible to penicillin according to MIC, dose and administration interval. Penicillin G doses and administration intervals in pneumococcal pneumonia according to penicillin MIC: MIC < 0.5 mg/l: 1.2 g every 6 hours; MIC 1 mg/l: 2.4 g every 6 hours; MIC 2 mg/l: 2.4 g every 4 hours. ![Distribuce MIC penicilinu (%) u Streptococcus pneumoniae izolovaných z krve (n = 1528) a aplikace nových klinických breakpointů penicilinu pro citlivé kmeny z pneumonií [8]
Šipky vymezují kmeny citlivé k penicilinu podle MIC, výše dávky a intervalu podávání.
Dávky a intervaly podání penicilinu G u pneumokokových pneumonií podle MIC penicilinu: MIC < 0,5 mg/l: 1,2 g každých 6 hodin; MIC 1 mg/l: 2,4 g každých 6 hodin; MIC 2 mg/l: 2,4 g každé 4 hodiny.
Graph 6. Distribution of penicillin MIC (%) in strains of Streptococcus pneumoniae isolated from the blood (n = 1528) and new clinical breakpoints for penicillin in susceptible strains from pneumonia [8]
Arrows indicate strains susceptible to penicillin according to MIC, dose and administration interval.
Penicillin G doses and administration intervals in pneumococcal pneumonia according to penicillin MIC: MIC < 0.5 mg/l: 1.2 g every 6 hours; MIC 1 mg/l: 2.4 g every 6 hours; MIC 2 mg/l: 2.4 g every 4 hours.](https://pl-master.mdcdn.cz/media/image/351a38cd383929c863e5a985564b9776.jpg?version=1537793434)
Na soubor pneumokoků izolovaných z krve byly aplikovány i nové klinické breakpointy pro pneumokoky izolované od pacientů s pneumonií (viz graf 6). V závislosti na výši dávky a intervalu podávání penicilinu G (na grafu označeno šipkami) se snižuje počet rezistentních kmenů na 1,9 %, respektive 0,6 %, a zůstávají rezistentní jen dva s MIC penicilinu 4 mg/l (0,1 %) ze souboru 1528 kmenů, které vzdorují i aplikaci nejvyšších terapeutických dávek penicilinu.
Výsledky dlouhodobého sledování rezistence k makrolidům u streptokoků sk. A jsou v grafu 7. Šipkou je označeno zahájení intervenčních aktivit (období 2001–2002) v pediatrické praxi, s cílem používat pro léčbu streptokokové tonzilofaryngitidy lék volby penicilin místo alternativních makrolidů. Po poklesu makrolidové rezistence z 16,5 % v roce 2001 na 9, 0 % v roce 2003 se rezistence opět pozvolna zvyšuje, v roce 2009 dosáhla 11,7 % (viz graf 7).
Graf 7. Trend rezistence k makrolidům u 51026 kmenů Streptococcus pyogenes, izolovaných z výtěrů krku od pacientů s tonzilofaryngitidou v období let 1996–2006. Šipka označuje zahájení aktivit České lékařské společnosti JEP pro uvážlivé podávání antibiotik v pediatrické praxi [3]. Graph 7. Trends in the resistance to macrolides in 51026 strains of Streptococcus pyogenes isolated from throat swabs from patients with tonsillopharyngitis in 1996–2006. Arrow indicates the beginning of the activities of the J.E Purkyne Czech Medical Association towards reasonable antibiotic prescription policy in pediatric practice [3]. ![Trend rezistence k makrolidům u 51026 kmenů Streptococcus pyogenes, izolovaných z výtěrů krku od pacientů s tonzilofaryngitidou v období let 1996–2006.
Šipka označuje zahájení aktivit České lékařské společnosti JEP pro uvážlivé podávání antibiotik v pediatrické praxi [3].
Graph 7. Trends in the resistance to macrolides in 51026 strains of Streptococcus pyogenes isolated from throat swabs from patients with tonsillopharyngitis in 1996–2006.
Arrow indicates the beginning of the activities of the J.E Purkyne Czech Medical Association towards reasonable antibiotic prescription policy in pediatric practice [3].](https://pl-master.mdcdn.cz/media/image/3b94aa0852d90a5135ddc28de4aa02e1.jpg?version=1537793546)
Sérotyp byl zjištěn u 73 kmenů invazivních pneumokoků rezistentních k penicilinu a u 32 kmenů rezistentních k erytromycinu, avšak citlivých k penicilinu. Tyto kmeny zaslaly do NRL/ATB laboratoře v rámci projektu CZ--EARS-Net v letech 2000–2009. Celkem bylo identifikováno 10 sérotypů pneumokoků rezistentních k penicilinu (6A, 6B, 9N, 9V, 14, 15B, 19A, 19F, 22F a 23F), většina izolátů však náležela jen ke dvěma sérotypům 9V (n = 43; 58,9 %) a 14 (n = 11; 15 %). Molekulární analýza pomocí MLST sérotypů 9V (23 kmenů) a 14 (6 kmenů) prokázala vysoce efektivní rozšíření klonu Spain9V-3 (ST156), a to nejen u sérotypu 9V, ale i u sérotypu 14. Celkem bylo zjištěno 6 různých sekvenačních typů identických nebo vysoce příbuzných tomuto klonu: ST156 (n = 24), ST2025 (n = 8), ST557 (n = 3), ST143 (n = 2), ST2545 (n = 1) a ST2636 (n = 1). U kmenů rezistentních k makrolidům, ale citlivých k penicilinu bylo identifikováno 7 sérotypů (6B, 8, 14, 19A, 19F a 23F). Nejčastěji převažovaly sérotypy 6B (n = 9; 28,1 %) a 9V (n = 6; 18,7 %). U čtyř izolátů sérotypu 6B a dvou izolátů sérotypu 9V byly pomocí MLST detekovány 2 mezinárodní klony sdružené s makrolidovou rezistencí: Poland6B-20 (ST315) a England9V-14 (ST9).
Diskuse
Pro antibiotickou léčbu bakteriálních infekcí dýchacích cest existuje na světě velké množství značně odlišných návodů, vydávaných odbornými společnostmi nebo farmaceutickými firmami, mnohým z nich však chybí dostatečně robustní lokální databáze údajů o stavu antibiotické citlivosti původců těchto infekcí [29]. Tyto údaje jsou však pro doporučení antibiotické léčby v dané lokalitě, např. území státu a u většího území určitá oblast, nepostradatelné. Předchozí výsledky sledování rezistence u hlavních původců infekcí horních a dolních cest dýchacích v geograficky odlišných lokalitách ČR, zahrnujících druhy S. pneumoniae, S. pyogenes, Haemophilus influenzae a Moraxella catarrhalis prokázaly velmi nízkou frekvenci rezistence těchto druhů k antibiotikům volby [30, 31]. Tyto vlastní výsledky byly podkladem pro vypracování doporučeného postupu, který uvádí amoxicilin jako lék volby pro léčbu respiračních infekcí jevících klinické známky bakteriálního původu včetně komunitních pneumonií nevyžadujících hospitalizaci [9]. Spektrum účinku amoxicilinu, na rozdíl od penicilinu, zahrnuje také H. influenzae, druhého nejčastějšího původce respiračních bakteriálních infekcí. Rezistence netypovatelných kmenů H. influenzae, které způsobují infekce dýchacích cest, se u nás vyskytuje zhruba u 7 % kmenů [32]. Amoxicilin má také výhodnou farmakokinetiku a v doporučených dávkách [5] inhibuje, podobně jako příslušné dávky parenterálně aplikovaného penicilinu G, i kmeny pneumokoků se sníženou citlivostí k penicilinu [28].
Dobrý stav citlivosti k penicilinu u invazivních izolátů S. pneumoniae byl opakovaně ověřen i v dalších letech [33, 34]. Na mapě, ilustrující rezistenci k penicilinu u invazivních izolátů pneumokoků na území Evropy, patří ČR trvale od roku 2000 mezi země s nejnižší frekvencí výskytu rezistentních kmenů [15, 16].
Výsledky získané v této práci ukazují, že v průběhu 14 let sledování (1996–2009) byl nejvyšší výskyt rezistentních kmenů pneumokoků (MIC penicilinu > 0,063 mg/l) z infekcí horních cest dýchacích 5,3 % (v roce 2004) a z dolních cest dýchacích 7,7 % (v roce 2006). U invazivních izolátů pneumokoků z krve a z mozkomíšního moku byl v období let 2000–2009 zaznamenán nejvyšší výskyt kmenů rezistentních k penicilinu v roce 2002 (7,3 %), respektive v roce 2008 (9,4 %). Je třeba zdůraznit, že tato čísla zahrnují kromě kmenů pneumokoků rezistentních i kmeny intermediárně rezistentní (s výjimkou kmenů z mozkomíšního moku), inhibovatelné koncentracemi penicilinu, dosaženými v těle pacienta při aplikaci vyšších dávek. V roce 2010 byly zveřejněny nové klinické break-pointy penicilinu pro pneumokoky, které vycházejí z farmakokinetických a farmakodynamických parametrů penicilinu a jsou založeny na MIC penicilinu vyšetřovaného kmene, typu infekce, výši dávky penicilinu a intervalu jeho podávání [8]. Pneumokoky způsobující meningitidu (v našem souboru jsou reprezentovány izoláty z mozkomíšního moku), u nichž byla zjištěna MIC penicilinu vyšší než 0,063 mg/l, jsou podle nových klinických breakpointů rezistentní k penicilinu pro nestabilní průnik tohoto antibiotika přes hematoencefalickou bariéru [8]. Podle původního limitního breakpointu 0,063 mg/l bylo v naší práci rezistentních 4,3 % kmenů z krve (které téměř výlučně pocházejí od pacientů s pneumonií), podle nových klinických breakpointů pro penicilin u pneumokokové pneumonie při aplikaci maximálních dávek penicilinu [8] však jejich počet poklesl až na 0,1 %. Znamená to, že v průběhu 10 let se u nás vyskytly mezi 1528 pneumokoky z krve pouze dva skutečně rezistentní kmeny, inhibované 4 mg/l penicilinu.
Trvale nízká prevalence pneumokoků rezistentních k penicilinu v naší zemi, jejíž hodnoty u kmenů z pneumonií podle nových breakpointů poklesly na minimum, je v kontrastu se stále narůstající rezistencí k makrolidům. Trendy rezistence k těmto antibiotikům jsou u izolátů z dýchacích cest i z krve velmi podobné. Bez ohledu na původ kmene byla rezistence k makrolidům až do roku 2005 nižší než rezistence k penicilinu, a poté prudce akcelerovala, v roce 2006 převýšila rezistenci k penicilinu, a v roce 2009 dosáhla nejvyšších hodnot za celé sledované období. Nárůst rezistence k makrolidům a následné převýšení frekvence rezistence k penicilinu makrolidovou rezistencí byly pozorovány již dříve v některých zemích Evropy [23] a jsou v přímé souvislosti s rostoucí oblibou makrolidů pro léčbu různých infekcí v komunitě, většinou podávaných jako nezdůvodněná náhrada antibiotik volby [11, 12, 20, 21]. V roce 2009 byla u nás zjištěna nejvyšší frekvence rezistence k makrolidům (12,5 %) u pneumokoků z dolních cest dýchacích, které byly izolovány téměř výlučně ze vzorků sputa od dospělých pacientů. V této souvislosti lze poukázat na významný pokles rezistence k makrolidům u streptokoků sk. A izolovaných z krku převážně dětských pacientů s tonzilofaryngitidou, který následoval po intervenčních aktivitách organizovaných ČLS JEP s cílem léčit dětské bakteriální infekce antibiotiky volby (obvykle penicilinem, respektive amoxicilinem) a nikoli alternativními antibiotiky [3]. Lze tedy předpokládat, že dospělým pacientům jsou makrolidy častěji předepisovány než v dětské populaci, podrobná data o spotřebě podle věku pacientů antibiotik však nejsou k dispozici. Pro indikace makrolidů existuje podrobné konsenzuální doporučení [35], garantované ČLS JEP podobně, jako je tomu u penicilinových antibiotik [5], a doporučený postup pro léčbu komunitních bakteriálních infekcí zahrnuje i dospělé pacienty [9], podle vzestupu rezistence k makrolidům u pneumokoků z pneumonií však lze usuzovat, že praktickými lékaři pro dospělé je nedostatečně respektováno.
Molekulární typizace kmenů reprezentativního souboru pneumokoků rezistentních k penicilinu (MIC > 0,063 mg/l), makrolidům nebo ke všem těmto antibiotikům prokázala rozšíření a dominantní postavení klonu Spain9V-3 (ST 156) v České republice. Mezi kmeny rezistentními jen k makrolidům byly prokázány i další dva klony, Poland6B-20 a England9V-14. Mezinárodní rozšíření omezeného počtu multirezistentních klonů je potvrzováno opakovaně, stejně jako schopnost těchto klonů měnit svůj sérotyp v důsledku horizontální rekombinace specifických kapsulárních genů [36]. Je nutno zdůraznit, že šíření multirezistentních klonů podporuje celkové množství antibiotik aplikovaných na daném území [12, 19, 21, 29].
Závěr
Příznivá situace v nízké prevalenci rezistence kmenů S. pneumoniae k penicilinu, která je navíc při aplikaci nových klinických breakpointů penicilinu pro kmeny od pacientů s pneumonií zanedbatelná, je v kontrastu s trvale rostoucí rezistencí tohoto druhu k makrolidům. Nejvyšší frekvence rezistence k makrolidům, zjištěná u kmenů izolovaných ze sputa převážně dospělých pacientů, potvrzuje preferenci léčby dospělých pacientů s pneumokokovou pneumonií makrolidy před léky volby amoxicilinem nebo penicilinem G. Další rozšíření úspěšných multirezistentních klonů S. pneumoniae, jejichž přítomnost byla v ČR prokázána, může omezit pouze radikální snížení zbytečně podávaných nebo nesprávně volených antibiotik.
Poděkování: Autorky děkují laboratořím sdruženým v PSMR a EARS-Net za dlouhodobou spolupráci na těchto projektech a Jitce Motlové (NRL pro streptokoky a pneumokoky) za spolupráci při sérotypizaci pneumokoků. Studie byla podpořena sub-projektem A/CZ0046/2/0007 (FM EHP a Norska) a výzkumným projektem IGA 9643-4 Interní grantové agentury MZd ČR.
Do redakce došlo dne 19. 11. 2010.
Adresa pro korespondenci:
MUDr. Pavla Urbášková
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: purbaskova@centrum.cz
Zdroje
1. Dowell, S. F., Marcy, S. M., Phillips, W. R. et al. Principles of judicious use of antimicrobial agents for pediatric upper respiratory tract infections. Pediatrics, 1998, 101,1 (Suppl), p. 16315–184.
2. Gonzales, R., Bartlett, J. G., Besser, R. E. et al. Principles of appropriate antibiotic use for treatment of acute respiratory tract infections in adults: Background, specific aims and methods. Ann. Intern. Med., 2001, 134, 6, p. 478–529.
3. Jindrák, V., Marek, J., Vaniš, V. et al. Improvements in antibiotic prescribing by community paediatricians in the Czech Republic. Eurosurveillance, 2008, Euro Surveill., 2008, 13, 46, p. 19040. Dostupné na www: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19040
4. Musher, D. Streptococcus pneumoniae. In Mandell, G. L., Bennet, J. E., Dolin, R. (eds), Principles and Practice in Infectious Diseases (7th ed), Churchill Livingstone, 2010, p. 2623–2642.
5. Hoza, J., Jindrák, V., Marešová, V. et al. Konsenzus používání antibiotik I. Penicilinová antibiotika. Prakt. Lék., 2002, 82, p. 247–306.
6. Lim, W. S., Baudouin, S. V., George, R. C. et al. Guidelines for management of community acquired pneumonia in adults: update 2009. Thorax, 2009, 64, Suppl. III, p. 55.
7. Mandell, L. A., Wunderink, R. G., Anzueto, A. et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community – acquired pneumonia in adults. Clin. Infect. Dis., 2007, 44, Suppl 2, p. S27–72.
8. European Committee on Antimicrobial Susceptibility Testing Breakpoint tables for interpretation of MICs and zone diameters. Version 1, April 2010 (online). Dostupné na www: http://www.eucast.org/ clinical_breakpoints/
9. Bébrová, E., Jindrák, V., Kolář, M., Marešová, V., Urbášková, P. Doporučený postup pro antibiotickou léčbu respiračních infekcí v primární péči. Prakt. Lék., 2003, 83, p. 502–515.
10. Baquero, F. Evolving resistance patterns of Streptococcus pneumoniae: A link with long-acting macrolide consumption? J. Chemother., 1999, 11, Suppl 1, p. 35–43.
11. Baquero, F. Trends in antibiotic resistance of respiratory pathogens: an analysis and commentary on a collaborative surveillance study. J. Antimicrob. Chemother., 1996, Suppl. A, p. 117–132.
12. Baquero, F., Baquero-Artigao, G., Cantón, R., García-Rey, C. Antibiotic consumption and resistance selection in Streptococcus pneumoniae. J. Antimicrob. Chemother., 2002, 50, Suppl S2, p. 27–37.
13. Jelínková, J., Urbášková, P., Motlová, J., Jelínek J. Sensitivity of Streptococcus pyogenes to penicillin over a period of fourthy years. J. Chemother., 1993, Suppl I, 5, p. 297–298.
14. Dvořák, P., Urbášková, P., Štika, L., Macková, B., Bíba, V. Používání antibiotik v ambulantní péči v České republice. Prakt. Lék., 2004, 84, p. 369–374.
15. Urbášková, P., Pracovní skupina pro monitorování rezistence Vzestup rezistence Streptococcus pyogenes k makrolidovým antibiotikům v České republice. Prakt. Lék., 1999, 79, p. 636–640.
16. Urbášková, P., Jakubů, V., Pracovní skupina pro monitorování antibiotické rezistence Rezistence k makrolidům u druhu Streptococcus pyogenes v České republice v období let 1996–2003. Epidemiol. Mikrobiol. Imunol., 2004, 53, p. 196–202.
17. Barlow, G. D., BSAC Council Swine flu and antibiotics. J. Antimicrob. Chemother., 2009, 64, p. 889–894.
18. Akkerman, A. E., Kuyvenhoven, M. M., Wouden, J. C., Verheij, TJ. M. Determinants of antibiotic overprescribing in respiratory tract infections in general practice. J. Antimicrob. Chemother., 2005, 56, p. 930–936.
19. Goossens, H., Ferech, M., Vander Stichele, R., Elseviers, M. Outpatient antibiotic use in Europe and association with resistance: a cross national database study. Lancet, 2005, 365, p. 579–587.
20. Furuya, E. Y., Lowy, F. D. Antimicrobial-resistant bacteria in the community setting. Nat. Rev. Microbiol., 2006, 4, p. 36–45.
21. Sande-Bruinsma, N., Grundmann, H., Verloo, D. et al. Antimicrobial drug use and resistance in Europe. Emerg. Infect. Dis., 2008, 14, p. 1722–1730.
22. Urbášková, P. Pracovní skupina pro monitorování rezistence. Zprávy CEM, 1997, 6, p. 22.
23. European Antimicrobial Surveillance Resistance System. EARSS Annual Report 2008, (Czech Republic s.116–117). Dostupné na www: http://www.ecdc.europa. eu/ens/activities/surveillance/EARS-Net/Documents/ 2008_EARSS_Annual_Report.pdf
24. EARSS Manual 2005. National Institute for Public Health and the Environment (RIVM), 2005.
25. Sorensen, U. B. Typing of pneumococci by using 12 pooled antisera. J. Clin. Microbiol., 1993, 31, p. 2097–2100.
26. Enright, M. C., Spratt, B. G. A multilocus sequence typing scheme for Streptococcus pneumoniae: identification of clones associated with serious invasive disease. Microbiology, 1998, 144, p. 3049–3060.
27. Urbášková, P. Rezistence bakterií k antibiotikům. Vybrané metody. Praha: Trios 1998. ISBN 80-238-3106-2.
28. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing, twentieth informational supplement. CLSI Document M100-S20. Clinical and Laboratory Standards Institute, USA, Pa, 2010.
29. Ball, P., Baquero, F., Cars, O. et al. Antibiotic therapy of community respiratory tract infections: strategies for optimal outcomes and minimized resistance emergence. J. Antimicrob. Chemother., 2002, 49, p. 31–40.
30. Urbášková, P. Rezistence k antibiotikům u Streptococcus pneumoniae, Streptococcus pyogenes, Haemophilus influenzae a Moxarella catarrhalis v České republice v roce 1996 a 1997. Klin. Mikrobiol. Inf. Lék., 1998, 4, p. 292–298.
31. Urbášková, P., Pracovní skupina pro monitorování rezistence Trendy rezistence izolátů Streptococcus pneumoniae, Haemophilus influenzae a Streptococcus pyogenes z dýchacích cest v České republice v průběhu tří let (1996–1998). Klin. Mikrobiol. Inf. Lék., 1999, 5, p. 311–319.
32. Urbášková, P., Wunschová, M., Lebedová, V., Křížová, P. Rezistence k 10 antibiotikům u invazivních izolátů Haemophilus influenzae, izolovaných v období 1999 – 2002 v České republice. Prakt. Lék., 2004, 84, 12, p. 705–709.
33. Urbášková, P. Rezistence k antibiotikům u kmenů Streptococcus pneumoniae ze závažných infekcí v České republice, 1996–1998. Klin. Mikrobiol. Inf. Lék., 1999, 5, p. 49–54.
34. Urbášková, P., Motlová, J., Žemličková, H., CZ‑EARSS Antibiotická rezistence invazivních pneumokoků a jejich sérotypy v České republice. Čas. Lék. čes., 2004, 143, p. 178–183.
35. Urbášková, P., Marešová, V., Jindrák, J. et al. Konsenzus používání antibiotik II. Makrolidová antibiotika. Prakt. Lék., 2003, 83, p. 563–571.
36. Coffey, T. J., Daniels, M., Enright, M. C., Spratt, B. G. Serotype 14 variants of the Spanish penicillin-resistant serotype 9V clone of Streptococcus pneumoniae arose by large recombinational replacements of the cpsA-pbp1a region. Microbiology, 1999, 45, p. 2023–2031.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2011 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Antibiotická rezistence Streptococcus pneumoniae a Streptococcus pyogenes v letech 1996–2009
- Lůžková péče o uživatele a závislé na návykových látkách v ČR ve zdravotnické statistice od r. 1959
- PF 2011
- Laboratórna diagnostika pandemickej chrípky na Odbore lekárskej mikrobiológie Regionálneho úradu verejného zdravotníctva so sídlom v Banskej Bystrici v sezóne 2009/2010
- Novinky na poli poliomyelitidy – krátké sdělení
- Hrabák J., Žemličková H., Bergerová T., Urbášková P.: Interpretation of the Susceptibility Test Results in Enterobacteria Producing 3rd- and 4th-Generation Cephalosporin- or Carbapenem-Hydrolyzing β-Lactamases
- Účinnost tří nových odvšivovacích přípravků na veš dětskou (Pediculus capitis L.) v in vitro testech – krátké sdělení
- Lymská borelióza a demyelinizačné ochorenie CNS
-
Medzinárodné zdravotné predpisy.
Teória – legislatíva – implementácia – súvislosti
Cyril Klement a kolektív
Banská Bystrica: PRO, 2009, 1. vyd., s. 438, ISBN 978-80-89057-24-5 - MUDr. Rudolf Benda, CSc. – in memoriam
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antibiotická rezistence Streptococcus pneumoniae a Streptococcus pyogenes v letech 1996–2009
- Lymská borelióza a demyelinizačné ochorenie CNS
- Hrabák J., Žemličková H., Bergerová T., Urbášková P.: Interpretation of the Susceptibility Test Results in Enterobacteria Producing 3rd- and 4th-Generation Cephalosporin- or Carbapenem-Hydrolyzing β-Lactamases
- Laboratórna diagnostika pandemickej chrípky na Odbore lekárskej mikrobiológie Regionálneho úradu verejného zdravotníctva so sídlom v Banskej Bystrici v sezóne 2009/2010
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



