-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulárno-biologická a fenotypová charakterizácia humánnych izolátov Salmonella enterica serovar Paratyphi B dT+, alebo Salmonella Java
Molecular Biological and Phenotypical Characterization of Human Isolates of Salmonella Enterica Serovar Paratyphi B dT+ or Salmonella Java
Objective:
Salmonella Paratyphi B dT⁺ (or Salmonella Java) is an emerging public health problem. The study objective was to characterize phenotypically and genotypically 13 human isolates from sporadic cases of infection.Material and Methods:
Phenotypic characteristics of 13 human isolates were determined by phage typing, disk diffusion method for testing antimicrobial susceptibility to 11 antibiotics and screening for selected virulence markers, i.e bacterial adherence to xylene, motility and biofilm formation. Genotypic characteristics of the study isolates were determined by PCR with primers for the detection of class 1 integrons, plasmid profile analysis and PFGE for the study of genetic diversity.Results:
The study isolates were classified into different phage types, with 3aI or 3aI variant being the most common (61.5%). All study isolates were resistant to streptomycin and sulfisoxazole, two of them were multiresistant (to streptomycin, sulfisoxazole, ampicillin and nalidixic acid). The study isolates showed low hydrophobicity, except for one isolate (2/08), and 5 isolates exhibited motility of ≥ 50 mm. High biofilm formation was detected in 5 isolates. Class 1 integrons were not detected in any isolate and plasmid profile analysis revealed the presence of a 90-kb plasmid in 8 isolates. XbaI PFGE analysis differentiated the isolates into 6 pulsotypes (X1, X2, X2a, X3, X4,X5).Conclusion:
Although the study set of S. Paratyphi B dT⁺ (S. Java) was small, the increasing emergence of this serovar in the human population in Slovakia is noteworthy. The results of gene analysis in PFGE suggest clonal diversity as well as a clonal link between strains of the predominant phage type. In view of possible increase in antimicrobial resistance and the spread of certain clones, continuous surveillance of strains of S. Paratyphi B dT⁺is needed.Key words:
Salmonella Paratyphi B dT⁺, Salmonella Java, phage type, antibiotic susceptibility, virulence, plasmids, PFGE.
Autoři: Ľ. Majtánová; V. Majtán
Působiště autorů: Oddelenie mikrobiológie, NRC pre fagotypizáciu salmonel, Slovenská zdravotnícka univerzita, Bratislava
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 58, 2009, č. 1, s. 25-30
Souhrn
Cieľ práce:
Salmonella Paratyphi B dT⁺ (alebo Salmonella Java) predstavuje v súčasnosti objavujúci sa problém verejného zdravotníctva. Cieľom štúdie bolo charakterizovať 13 humánnych izolátov zo sporadických prípadov ochorení určením ich fenotypových a genotypových vlastností.Materiál a metódy:
Z fenotypových vlastností sa v súbore 13 izolátov identifikoval ich fágotyp, citlivosť na 11 antibiotík diskovou difúznou metódou a vybrané markery virulencie – bakteriálna adherencia na xylén, motilita a tvorba biofilmu. Z genotypových vlastností sa pomocou primerov metódou PCR určili integróny triedy 1, ďalej sa zistil plazmidový profil a v PFGE genetická diverzita študovaných izolátov.Výsledky:
Študované kmene predstavovali rôzne fágotypy s dominanciou fágotypu 3aI resp. 3aI variant (61,5%). Všetky izoláty boli rezistentné na streptomycín a sulfizoxazol, dva z nich vykazovali multirezistenciu (okrem streptomycínu a sulfizoxazolu aj voči ampicilínu a nalidixovej kyseline). Testované izoláty sa vyznačovali nízkou hydrofóbnosťou, okrem jedného izolátu (2/08) a 5 izolátov prejavilo motilitu ≥ 50 mm. U 5 izolátov sa detekovala silná tvorba biofilmu. U kmeňov sa nezistila prítomnosť integrónov triedy 1 a plazmidová analýza ukázala prítomnosť 90-kb plazmidu u 8 kmeňov. XbaI PFGE analýza diferencovala izoláty do 6 pulzotypov (X1, X2, X2a, X3, X4,X5).Záver:
Hoci vyšetrovaný súbor kmeňov S. Paratyphi B dT⁺(S. Java) bol malý, pozoruhodné je objavenie a postupný nárast kmeňov tohto sérovaru v humánnej populácii na Slovensku.
Výsledky génovej analýzy v PFGE naznačili klonálnu diverzitu ako aj klonálny možný vzťah medzi kmeňmi dominantného fágotypu. Z dôvodu možného nárastu rezistencie na antibiotiká ako aj šírenia sa určitých klonov je potrebné kontinuálne monitorovanie výskytu kmeňov S. Paratyphi B dT⁺.Kľúčové slová:
Salmonella Paratyphi B dT⁺ - Salmonella Java – fágotyp – citlivosť na antibiotiká – virulencia – plazmidy – PFGE.Zoonotické sérovary Salmonella enterica patria medzi najvýznamnejšie príčiny potravou prenášaných infekcií na celom svete. Z nich iba niektoré dominujú v určitom čase v populácii zvierat, alebo v krajine. V súčasnosti medzi sérovary s globálnym výskytom patria S. Enteritidis a S. Typhimurium [7]. Avšak z času na čas sa objavia aj menej časté sérovary, ktoré môžu zapríčiniť ochorenia ľudí a zvierat.
Jedným zo vzácnych sérovarov je sérovar Paratyphi B, ktorý môže byť diferencovaný na základe utilizácie d-tartarátu. Klasický sérovar Paratyphi B je d-tartarát negatívny (dT-), je virulentný a patrí medzi humánne patogénny. D-tartarát pozitívna varianta (dT+) je označovaná aj ako sérovar Java a je príčinou gastroenteritídy u ľudí a zvierat. Sérovar Java sa v r. 2006 neobjavil medzi 15 najčastejšími sérovarmi salmonel na základe údajov Enter-net, ale v r. 2007 sa výskyt tohto sérovaru v členských štátoch EÚ zvýšil. V r. 2007 NRC pre fagotypizáciu salmonel obdržalo 13 humánnych izolátov S. Paratyphi B dT+ (S. Java), izolovaných zo sporadických prípadov ochorení.
Cieľom tejto štúdie bolo charakterizovať kmene tejto varianty určením ich fenotypových (fágotyp, citlivosť na antibiotiká, vybrané faktory virulencie) ako aj genotypových (plazmidový profil, analýza DNA, PFGE) vlastností.
Materiál a metódy
Bakteriálne kmene: 13 kmeňov S. Paratyphi B dT+ (S. Java) bolo izolovaných z klinického materiálu pacientov (v 9 prípadoch od detí do 5 rokov) s gastroenteritídou. Kmene boli izolované v r. 2007 v rôznych regiónoch SR a boli zaslané Oddeleniami klinickej mikrobiológie pri nemocniciach ako aj súkromnými laboratóriami v SR.
Fenotypové metódy
Fágová typizácia izolovaných kmeňov bola vykonaná podľa typizačnej schémy [1] použitím fágov WHO Refererenčného centra pre fágovu typizáciu Health Protection Agency, Colindale, Londýn. Typizačná schéma sa používa aj na typizáciu S. Paratyphi B dT-.
Citlivosť na antibiotiká: Všetky kmene boli testované na ich citlivosť voči 11 antibiotikám agarovým difúznym testom podľa CLSI [17]. Použité disky antibiotík: ampicilín (A 20 μg), ceftriaxon (CRO 30 μg), chloramfenikol (C 30 μg), ciprofloxacín (Cip 5 μg), gentamicín (G 10 μg), streptomycín (S 10 μg), tetracyklín (T 30 μg), trimetoprím (TMP 5 μg) sufizoxazol (Su 250 μg), trimetoprim-sulfametoxazol (SxT 1,25/23,7 μg), nalidixová kyselina (NA 30 μg). Escherichia coli ATCC 25922 bol použitý ako referenčný kmeň.
Bakteriálna adherencia na hydrokarbón – xylén (BATH) – povrchová hydrofóbnosť bola hodnotená metódou adherencie na xylén podľa Rosenberga et al. [21]. Testovaný kmeň bol hodnotený ako hydrofóbny, keď jeho adsorbcia na xylén bola 35%.
Motilita kmeňov bola určená v polotuhom agarovom médiu (0,35%) podľa Braga et al. [4]. Platne sa inkubovali pri 37 °C, počas 6 hod a hodnotili sa priemery rastových zón z 3 nezávislých experimentov. Výsledok rastovej zóny ≥ 50 mm bol hodnotený ako pozitívny.
Tvorba biofilmu: Metóda bola vykonaná ako popísali Stepanovic et al. [23, 24] použitím mikrotitračných platničiek. Po 24 h inkubácii bakteriálnych kultúr pri 37 °C, adherované baktérie boli fixované metanolom. Platničky boli farbené 2% (w/v) roztokom kryštálovej violeti. Po naviazaní farbiva, adherované bunky boli solubilizované v 33% (v/v) ľadovej kyseline octovej OD pri 570 nm bolo merané použitím spektrofotometra (Bio-Rade, Laboratories, USA). Na základe priemerných hodnôt OD produkovaných bakteriálnym filmom študovaných kmeňov, boli kmene klasifikované do štyroch kategórií (žiadny producent biofilmu, slabý, mierny a silný), ako popísali Stepanovic et al. [24]. Každé meranie bolo vykonané trikrát.
Genotypové metódy
Polymerazová reťazová reakcia (PCR) pre detekciu integrónov triedy 1. – Pre detekciu integrónov boli použité primery, ktorých sekvencie tvorili zhodné sekvencie s integrónmi triedy 1: (int1-F[5ę-GGC ATC CAA GCA GCA AGC-3ę] a int 1-B[5ę-AAG CAG ACT TGA CCT GAT-3ę]) [10]. Amplifikácia bola vykonaná v 25 μl objeme obsahujúcom 250 μM deoxynucleotid trifosfát a páry primerov v koncentráciách 0,6 μM a 0,18 μl (0,36 U) Taq DNA polymerázy (Finnzymes, Espoo, Fínsko). Cyklické podmienky pre amplifikáciu pri 94 °C počas 2 min boli 34 cyklov pri 90 °C počas 30 s, pri 54 °C počas 30 s a pri 72 °C počas 1 min. Konečná extenzia prebiehala počas 2 min a 30 s pri 72 °C.
Analýza plazmidového profilu: Plazmidová DNA bola izolovaná metódou alkalickej lýzy podľa Birnboim a Doly [2]. Všetky kmene sa kultivovali na krvnom agare pri 37 °C cez noc. Plná bakteriologická kľučka bakteriálnej kultúry sa použila na izoláciu plazmidovej DNA. 7.7 M octan amónny sa použil na neutralizáciu a extrakcia s fenol-chloroformom sa vynechala. Vzorky boli analyzované elektroforézou v Trisborátovom-EDTA pufri (1xTBE – 89 mM Tris-base, 89 mM kyselina boritá, 2 mM EDTA) pri 150 V 1 h v 0.7% agarózovom géli a potom farbené v roztoku ethidium bromidu. Veľkosť plazmidov bola určená podľa výsledkov analýzy DNA referenčného kmeňa Salmonella Typhimurium LT2.
Restrikčná analýza metódou elektroforézy v pulznom poli (PFGE): Analýza v PFGE bola vykonaná použitím modifikovanej metódy popísanej Ridley et al. [20]. Agarózové bločky obsahujúce chromozomálnu DNA sa inkubovali cez noc v 100 μl pufru obsahujúceho 5-10 U restrikčnej endonukleázy XbaI (BIO-RAD Laboratories, USA). Restrikčné fragmenty boli separované v 1,2% agarózovom géli v 0,5xTBE pufri (44,5 mM Tris-base, 44,5 mM kyselina boritá, 1 mM EDTA)použitím CHEF-Dr III Systems (BIO-RAD Laboratories, USA). Elektroforéza bola prevedená pri 5,5 V/cm počas 26 h s meniacim sa pulzným časom 5-50 s pri 14 °C. Gély boli farbené ethidium bromidom a fotografované s digitálnym aparátom EPSON Photo PC 850Z. Ako štandard veľkosti DNA bol použitý bakteriofág lambda ladder (BIO-RAD Laboratories, USA). Zoskupenie profilov do skupín (pulzotypov) bolo vykonané na základe vizuálneho hodnotenia prítomných fragmentov podľa Tenovera et al. [25].
Výsledky a diskusia
V tabuľke 1 sú uvedené výsledky fágovej typizácie 13 izolátov S. Paratyphi B dT+ (S. Java), ako aj ich antibiogram a plazmidový profil. Hoci išlo o sporadické izoláty z rôznych oblastí SR, až 8 kmeňov z 13 patrilo k dominantnému fágotypu 3aI (resp. v 3 prípadoch k jeho variantu). Po jednom izoláte boli zastúpené fágotypy Jersey variant, 1 a 1 variant 8. Jeden kmeň reagoval zo štandardnými fágmi atypicky (ALR) a jeden kmeň bol netypovateľný (NT). Literárne údaje týkajúce sa fágovej typizácie kmeňov d-tartarát pozitívnej varianty S. Paratyphi B sú obmedzené. Chart [9] a Threlfall et al. [27] uvádzajú vo svojích štúdiách ako najčastejšie fágotypy 1 variant 3, Dundee, 3b variant 3 a Worksop. V tejto súvislosti Chart zvažoval použitie fágovej typizácie ako prostriedku na diferenciáciu kmeňov S. Paratyphi B dT- a dT+. Na základe podobnosti fágotypov naznačil, že kmene dT+ (S. Java) sú pravdepodobne d-tartarát utilizujúce varianty S. Paratyphi B. Podľa záznamov fágovej typizácie kmeňov S. Paratyphi B (paratýfus) kmene fágotypu 3aI a jeho varianty patria tiež medzi najčastejšie identifikované fágotypy.
Tab. 1. Fágotyp, citlivosť na antibiotiká a plazmidový profil kmeňov S. Paratyphi B dT+ (S. Java). Table 1. Phage types, antimicrobial susceptibility and plasmid profiles of strains of S. Paratyphi B dT+ (S. Java) 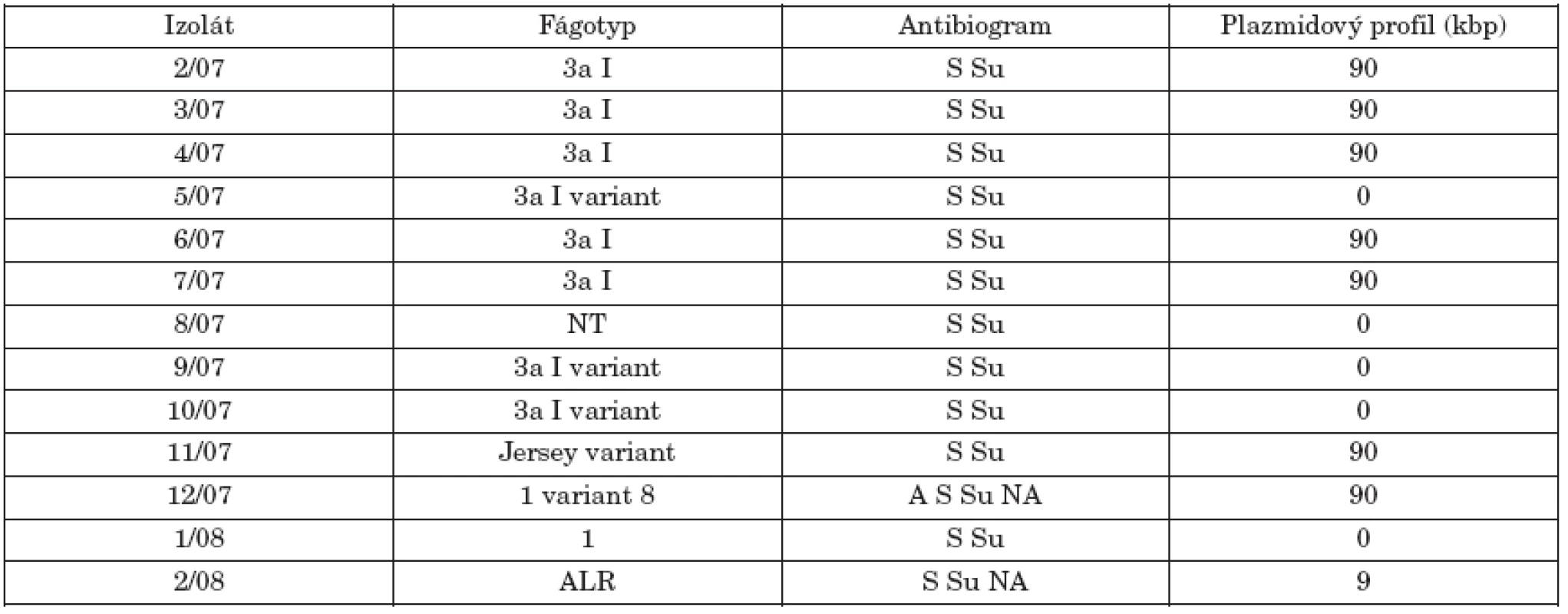
NT – netypovateľný kmeň, ALR – kmeň atypických lytických reakcií, S – streptomycín, Su – sulfizoxazol, A – ampicilín, NA – nalidixová kyselina, 0 – bezplazmidový kmeň NT – non-typeable , ALR – atypical lytic reaction, S – streptomycin, Su – sulfisoxazole, A – ampicillin, NA – nalidixic acid, 0 – no plasmid I keď sa v posledných rokoch zaznamenáva zvýšená rezistencia na antibiotiká u rôznych sérovarov salmonel, izoláty študovaného súboru boli všetky rezistentné najmenej na dva antibiotiká, streptomycín a sulfizoxazol. Dva kmene (12/07, 2/08) boli navyše rezistentné na nalidixovú kyselinu a jeden kmeň (12/07) aj na ampicilín. Izoláty S. Java zistené u hydiny v Holandsku [28] a v Škótsku [5] sa vyznačovali multirezistenciou na antibiotiká. V škótskej štúdií sa však medzi humánnymi izolátmi zistili aj kmene plne citlivé na vyšetrované antibiotiká.
Threlfall et al. [26, 27] popísali kmene S. Java s chromozomálne integrovanou multirezistenciou (ACSSuT) podobné kmeňom S. Typhimurium DT104, ktoré nesúviseli s hydinou v Holandsku a Škótsku a boli príčinou humánnych infekcií v Anglicku. Kmene S. Paratyphi B dT+ s takou istou multirezistenciou popísali aj Mulvey et al. [16] v Kanade. Multirezistencia je kódovaná na Salmonelovom genomickom ostrove (SGI 1), čo je 43-kb štruktúra lokalizovaná na chromozóme, obsahujúca integróny v ktorých sú lokalizované gény multirezistencie. Integróny triedy 1 nesúce kazety génov rezistencie sme v študovaných kmeňoch nezistili. Han et al. [8] u piatich multirezistentných kmeňov S. Java z 12 kmeňov ich súboru detekovali SGI 1 u 3 kmeňov. V našom súbore kmeňov sme nezistili multirezistentné kmene s fenotypom ACSSuT a ani u jedného sa nepotvrdila prítomnosť integrónov triedy 1. Weill et al. [29] popísali u S. Paratyphi B dT+ prítomnosť rôznych variant SGI 1 u kmeňov s iným fenotypom rezistencie a možno predpokladať, že aj naše izoláty môžu obsahovať varianty tohto ostrova. To bude predmetom ďalšieho štúdia.
Plazmidová analýza odhalila prítomnosť 90-kbp plazmidu u 8 kmeňov a 5 kmeňov bolo bezplazmidových (tab. 1, obr.1). Kmene fágotypu 3aI sa prejavili identickým profilom, čo by naznačovalo ich podobnosť. Brown et al. [5] detekovali v dvoch izolátoch zo súboru 44 kmeňov tiež plazmid molekulovej hmotnosti 90-kbp. Jeden kmeň bol humánneho pôvodu a jeden bol izolovaný z hydiny.
Obr. 1. Plazmidový profil kmeňov S. Paratyphi B dT+ (S. Java). Fig. 1. Plasmid profiles of strains of S. Paratyphi B dT+ (S. Java) 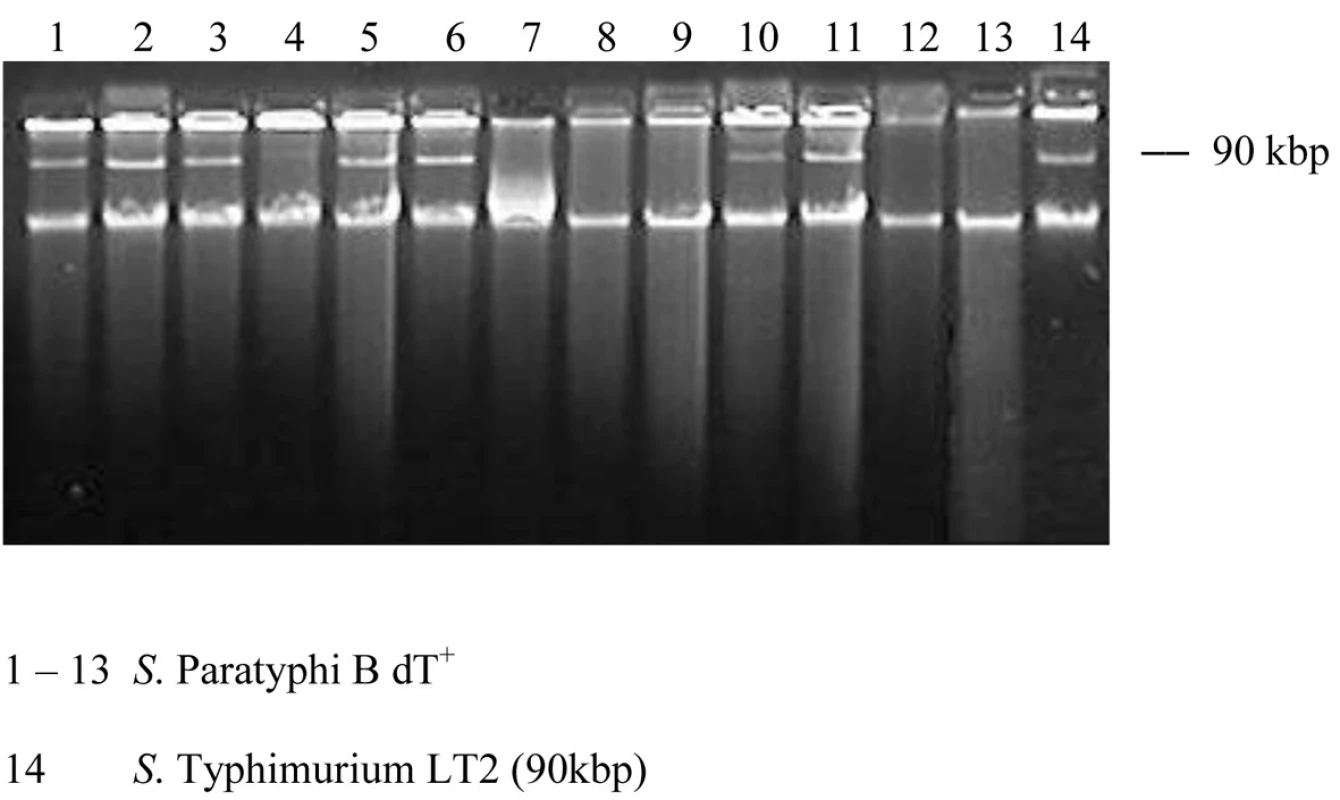
Povrchové vlastnosti baktérií, hlavne ich hydrofóbnosť, sú všeobecne považované za významné faktory virulencie v bakteriálnych infekciách. Fenomén bakteriálnej adherencie a tvorby biofilmov je v korelácii s týmito vlastnosťami. Tab. 2. uvádza hodnotené markery virulencie študovaných kmeňov. V porovnaní s našími predchádzajúcimi štúdiami s kmeňmi S. Enteritidis a S. Typhimurium [11, 12, 13], sa kmene S. Paratyphi B dT+ vyznačovali nižšou hydrofóbnosťou. Motilita baktérií je tiež spojená s patogénnym procesom, pretože jej inhibícia redukuje možnosť tvorby nových kolónií a šírenia infekcie. Päť kmeňov prejavilo pohyblivosť ≥ 50 mm po 6 hod. kultivácii v polotuhom agarovom médiu.
Tab. 2. Hodnotené markery virulencie kmeňov S. Paratyphi B dT+ (S. Java). Table 2. Selected virulence markers in strains of S. Paratyphi B dT+ (S. Java) 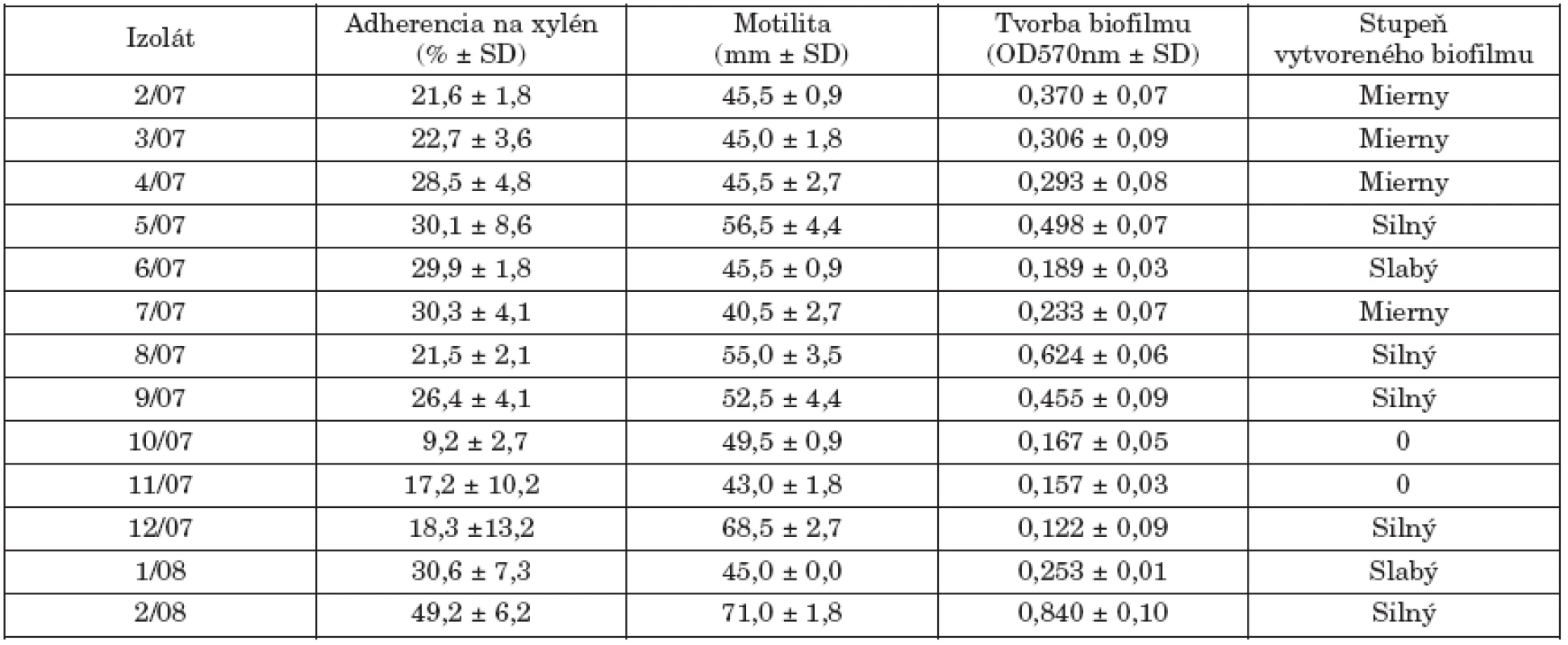
% Adherencie na xylén > 35% - pozitívna hydrofóbnosť, Motilita > 50 mm - pozitívna reakcia, 0 - žiadna produkcia biofilmu Adherence to xylene > 35% - positivity for hydrophobicity, Motility > 50 mm - positivity, 0 - no biofilm formation Okrem planktonickej formy existencie, salmonely tvoria biofilmy, ako významnú stratégiu pre prežívanie za rôznych stresových environmentálnych podmienok. Biofilm je definovaný ako „štrukturované spoločenstvo bakteriálnych buniek v mikrokolóniách, ktoré sú uzavreté v matrixe tvorenom extracelulárnym polymerickým materiálom“ [6, 22]. Salmonely tvoria biofilmy na rôznych povrchoch a proces tejto tvorby predstavuje perzistujúci zdroj infekcie a koreluje s virulenciou salmonel. Podľa Bonafonteho et al. [3] len najvirulentnejšie kmene S. Enteritidis boli schopné produkovať biofilm in vitro. Silnú produkciu biofilmu u kmeňov S. Typhimurium DT104 ale aj non-DT104 popísali Majtán et al. [14] a Ngwai et al. [18]. V našom súbore len 5 kmeňov sa vyznačovalo vysokou adherenciou na plast (5/07-3aI variant, 8/07-NT, 9/07-3aI variant, 12/07-1 variant 8, 2/08-ALR).
Produkcia biofilmu, ako aj bakteriálna adherencia na xylén a motilita vo všeobecnosti nesúviseli s fágotypom jednotlivých kmeňov. U 2 kmeňov sa tvorba biofilmu nezistila.
Genetická analýza študovaných kmeňov bola detekovaná PFGE typizáciou s použitím restrikčnej endonukleázy XbaI. Tento enzým chromozomálnu DNA kmeňov diferencoval do 10-19 fragmentov a bol schopný zaradiť kmene do 6 pulzotypov (X1, X2, X2a, X3, X4, X5) podľa doporučení Tenovera et al. [25]. Identifikovaný PFGE profil je sumarizovaný v tabuľke 3. Päť kmeňov fágotypu 3aI bolo reprezentovaných pulzotypom X1, čo naznačuje genetickú podobnosť kmeňov a ich klonálne šírenie. Ich podobnosť bola naznačená aj identickým plazmidovým profilom. 3 kmene fágotypu 3aI variant a jeden kmeň fágotypu 1 tvorili pulzotyp 2 a kmeň s fágotypom Jersey variant sa líšil len dvoma fragmentmi od pulzotypu 2 a bol označený ako pulzotyp 2a. Kmene 8/07 (NT), 12/07 (1 variant 8) a 2/08 (ALR) predstavovali odlišné pulzotypy (X3, X4, X5).
Tab. 3. Makrorestrikčná analýza študovaných kmeňov S. Paratyphi B dT+ (S. Java) v pulznom elektrickom poli Table 3. Macrorestriction analysis of strains of S. Paratyphi B dT+ (S. Java) in pulsed-field gel electrophoresis 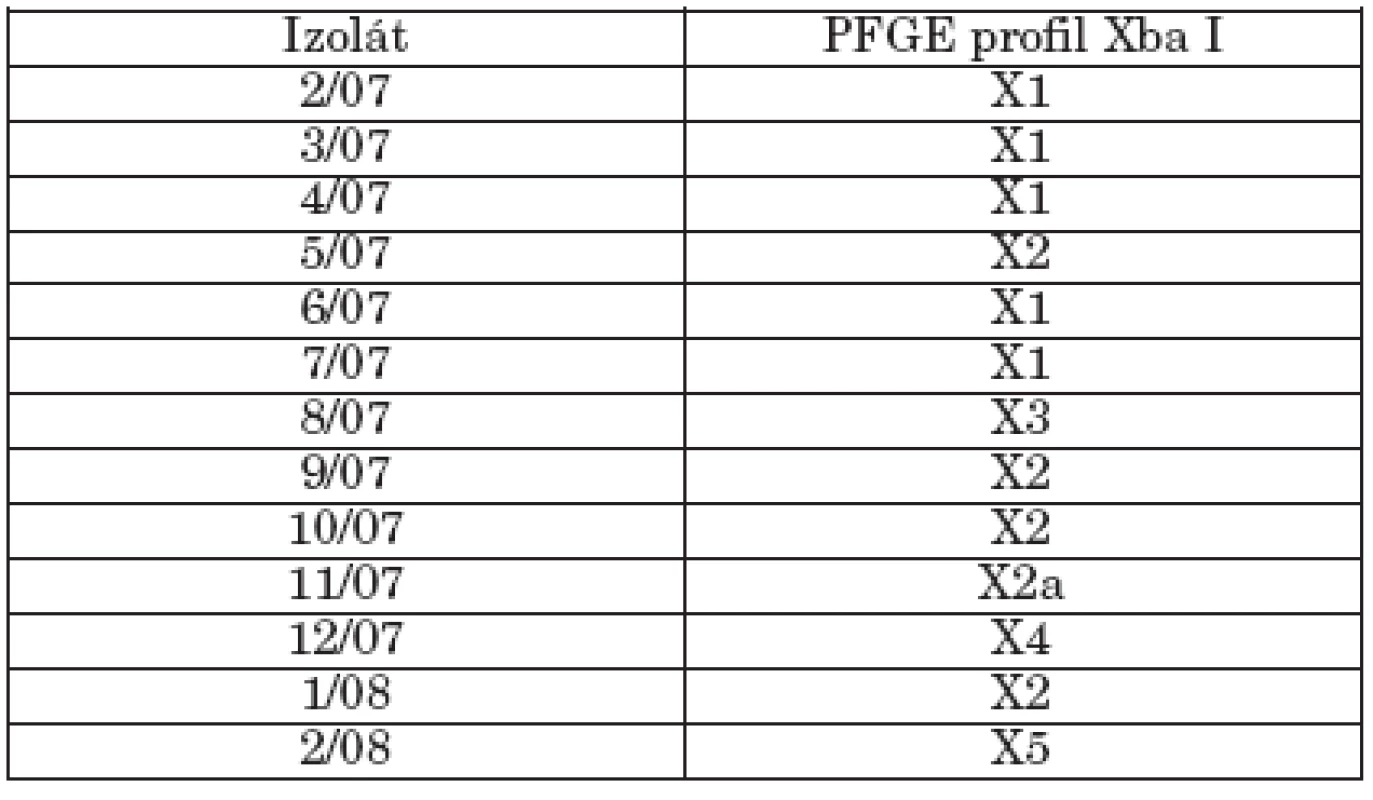
Prezentované údaje PFGE analýzy poukazujú na genetickú diverzitu kmeňov S. Paratyphi B dT+, berúc do úvahy, že vyšetrovaný súbor kmeňov bol malý. Miko et al. [15] popísali genetickú diverzitu v skupine kmeňov tohto sérovaru citlivých na antibiotiká a všeobecne bez plazmidu, naznačujúc existenciu koexistujúcich klonov. Súčasne sa objavili v Nemecku, Holandsku a Škótsku kmene Paratyphi B dT+ izolované hlavne z hydiny, ale aj od ľudí, vyznačujúce sa multirezistenciou a súčasne novými klonmi [15, 28].
Závery
Hoci vyšetrovaný súbor kmeňov S. Paratyphi B dT+ (S. Java) bol malý, pozoruhodné je objavenie a postupný nárast kmeňov tohto sérovaru v humánnej populácii aj v SR. I keď kmene, okrem dvoch boli pomerne citlivé na antibiotiká, na základe údajov z niektorých štátov západnej Európy možno predpokladať nárast rezistentných kmeňov. Výsledky molekulárnej analýzy naznačili klonálnu diverzitu a klonálne šírenie kmeňov uvedeného sérovaru. Všetky nové prípady S. Paratyphi B dT+ v humánnej populácii je potrebné kontinuálne monitorovať. Z dôvodov podobnosti šírenia sa určitých klonov ako aj rezistencie na antibiotiká, by bolo zaujímavé analyzovať situáciu tiež vo veterinárnej praxi.
Táto práca bola podporovaná Ministerstvom zdravotníctva Slovenskej republiky v rámci projektu „Molekulárna analýza antibiotickej rezistencie netýfusových sérovarov salmonel.
Poďakovanie
Za technickú spoluprácu autori ďakujú Mgr. A. Ofukanej, Z. Cintulovej a J. Zaťkovej.
Do redakce došlo 15.9.2008
PharmDr. L. Majtánová
Slovenská zdravotnícka univerzita
Oddelenie mikrobiológie
Limbová 12
833 03 Bratislava
Slovenská republika
e-mail: lubica.majtanova@szu.sk
Zdroje
1. Anderson, E.S. The phage typing of salmonellae other than S. Typhi. In E. van Oye (ed). The world problem of salmonellosis. Dr. W. Junk Publishers, The Hague, The Netherlands, 1964, 89-110.
2. Birnboim, H.C., Doly, J. A rapid alkaline extraction procedure for screening recombinant plasmid DNA. Nucleic Acids Res., 1979, 7, 1513-1523.
3. Bonafonte, M.A., Solano, C., Sesma, B., Alvarez, M. et al. The relationship between glycogen synthesis biofilm formation and virulence in Salmonella Enteritidis FEMS Microbiol. Lett., 2000, 191, s. 31-36.
4. Braga, P.C., Dal Sasso, M., Maci, D., Reggio, S., et al. Influence of subinhibitory concentrations of brodimoprim and trimethoprim on the adhesiveness hydrophobicity hemaglutinating and motility of Escherichia coli. Chemotherapy, 1995,41, 50-58.
5. Brown, D.J., Mather, H., Browning, L.M., Cora, J.E. Investigation of human infections with Salmonella enterica serovar Java in Scotland and possible association with imported poultry. Eurosurveillance, 2003, 8, 35-40.
6. Costerton, J.W., Lewandowski, Z., DeBeer, D., Caldwell, D. et al. Biofilms, the customized microniche. J Bacteriol, 1994, 176, 2137-2142.
7. Gill, N., Threlfall, J. Enter-net quaterly Salmonella report April-June 2007/2.
8. Han, K.H., Choi, S.Z., Lee, J.H., Lee, H. et al. Isolation of Salmonella enterica subspecies enterica serovar Paratyphi B dT+, or Salmonella Java, from Indonesia and elteration of the d-tartarate formation phenotype by disrupting of ORF STM 3356. J Med Microbiol, 2006, 55, 1661-1665.
9. Chart, H. The pathogenicity of strains of Salmonella Paratyphi B and Salmonella Java. J Appl Microbiol, 2003, 94, 340-348.
10. Lévesque, C., Piche, L., Larose, C., Roy, P.H. PCR mapping of integrons reveals several novel combinations of resistance genes. Antimicrob Agents Chemother, 1995, 39, 185-191.
11. Majtán, J., Majtán, V. Phagetypes, antimicrobial resistance and biological properties of Salmonella Typhimurium clinical isolates from the Slovak Republic. Biologia, 2003, 58, 387-394.
12. Majtán, V. Majtánová, Ľ., Szaboová, M. The virulence markers of Salmonella enterica serovar Typhimurium different phage-types strains isolated in Slovakia. Folia Microbiol, 2005, 50, 519-523.
13. Majtánová, Ľ., Majtán, V. Fágotypy a markery virulencie klinických izolátov Salmonella Enteritidis. Epidemiol Mikrobiol Immunol, 2006, 55, 87-91.
14. Majtán, J., Majtánová, L., Xu, M., Majtán, V. In vitro effect of subinhibitory concentrations of antibiotics on biofilm formation by clinical strains of Salmonella enterica serovar Typhimurium isolated in Slovakia. J Appl Microbiol, 2008, 104, s. 1294-1301.
15. Miko, A., Guerra, B., Schroeter, A., Dorn, Ch. et al. Molecular characterization of multiresistant d-tartarate-positive Salmonella enterica serovar Paratyphi B isolates. J Clin Microbiol, 2002, 40, 3184-3191.
16. Mulvey, M.R., Boyd, D., Cloeckaert, A., Ahmed, R. et al. and the Provincial Public Health Lab. Emergence of multidrug-resistant Salmonella Paratyphi B B dT+, Canada. Emerg Infect Dis, 2004, 10, 1307-1310.
17. National Committe for Clinical Laboratory Standards, Methods for Dilution Antimicrobial Susceptibility Test for bacteria that Grow Aerobically, 6th edn. Approved Standard M7-A6, Wayne, P.A. National Committe for Clinical Laboratory Standards, 2003.
18. Ngwai, Z.B., Adachi, Z., Ogava, Y., Hara, H. Characterization of biofilm-forming abilities of antibiotic-resistant Salmonella Typhimurium DT104 on hydrophobic abiotic surfaces. J Microbiol Immunol Infect, 2006, 39, 278-291.
19. Popoff, M.Y., Minor, L.L. Antigenic formulas of the Salmonella serovars. WHO Collaborating Centre for Reference and Research on Salmonella, Institute Pasteur, Paris, 1997, France.
20. Ridley, A., Threlfall, E.J., Rowe, B. Genotypic characterization of Salmonella Enteritidis types by plasmid analysis, ribotiping and pulsed-field gel electrophoresis. J Clin Microbiol , 1998, 36, 2314-2321.
21. Rosenberg, M., Gutnick, D., Rosenberg, E. Adherence of bacteria to hydrocarbons: a simple method for measuring cell-surface hydrophobicity, FEMS Microbiol Lett, 1980, 9, 29-33.
22. Starkey, M., Gray, K.A., Chang, S.I., Parsek, M.R. A sticky business the extracellular polymeric substance matrix of bacterial biofilms. In Ghannoum, N. and OęToole, G.A. (ed). Microbial biofilms ASM Press, Washington D.C., 2004, 174-191.
23. Stepanovic, S., Cirkovic, I., Mijac, M., Svabic-Vlachovic, M. Influence of the incubation temperature, atmosphere and dynamic conditions on biofilm formation by Salmonella spp. Food Microbiol, 2003, 20, 339-343.
24. Stepanovic, S., Cirkovic, I., Ranin, L., Svabic-Vlachovic, M. Biofilm formation by Salmonella spp. And Listeria monocytogenes on plastic surface. Lett Appl Microbiol, 2004, 38, 428-432.
25. Tenover, F.C., Arbeit, R.D., Goering, R.V., Mickelsen, P.A., et al. Interpreting chromosomal DNA restruction patterns produced by pulsed field gel electrophoresis: Criteria for bacterial strains typing. J Clin Microbiol, 1995, 33, 2233-2239.
26. Threlfall, E.J. Epidemic Salmonella Typhimurium DT104 - a truly international multiresistant clone. J Antimicrob Chemother, 2000, 46, 7-10.
27. Threlfall, J., Levent, B., Hopkins, K.Z., de Pinna, E. et al. Multidrug resistant Salmonella Java. Emerg Infect Dis, 2005, 11, 1092.
28. van Pelt, W., van der Zee, H., Wannet, W.J.B., van de Giessen, A.W., et al. Explosive increase Salmonella Java in poultry in the Netherlands. Consequences for public health. Eurosurveillance, 2003, 8, 31-35.
29. Weill, F.X., Fabre, L., Grandry, B., Grimont, P.A.D. et al. Multiple-antibiotic resistance in Salmonella enterica serotype Paratyphi B isolates collected in France between 2000 and 2003 is due mainly to strains harboring Salmonella genomic islands 1, 1-B, and 1-C. Antimicrob. Agents Chemother, 2005, 49, 2793-2801.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2009 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Detection of Antibodies to Chlamydophila pneumoniae by Immunoblotting in Patients with Cardiovascular Diseases
- Onychocola canadensis: prvé izoláty z onychomykóz na Slovensku
- Molekulárno-biologická a fenotypová charakterizácia humánnych izolátov Salmonella enterica serovar Paratyphi B dT+, alebo Salmonella Java
- Systémový lupus erythematosus – súčasný pohľad na genetickú determináciu, imunopatogenézu a liečbu
- Výskyt a charakteristika salmonel ve vybraných lokalitách České republiky – porovnání epidemiologických a laboratorních dat
- Srovnání citlivosti spor Bacillus subtilis a spor českých kmenů Clostridium difficile vůči dezinfekčním prostředkům
- Zpráva z Celostátního sjezdu mikrobiologie a epidemiologie 2008
- Dovětek výboru Společnosti pro epidemiologii a mikrobiologii ČLS JEP
- Plán akcí Společnosti pro epidemiologii a mikrobiologii v roce 2009
- TEST
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Systémový lupus erythematosus – súčasný pohľad na genetickú determináciu, imunopatogenézu a liečbu
- Výskyt a charakteristika salmonel ve vybraných lokalitách České republiky – porovnání epidemiologických a laboratorních dat
- Srovnání citlivosti spor Bacillus subtilis a spor českých kmenů Clostridium difficile vůči dezinfekčním prostředkům
- Molekulárno-biologická a fenotypová charakterizácia humánnych izolátov Salmonella enterica serovar Paratyphi B dT+, alebo Salmonella Java
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



