-
Články
- Vzdělávání
- Časopisy
Top články
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Rezistence enterobakterií ke karbapenemům
Carbapenem Resistance in Enterobacteria
Carbapenems are the drugs of choice in the treatment of serious infections caused by multiresistant Gram-negative bacteria. Clinically and epidemiologically, resistance to these β-lactams poses the highest risk. In enterobacteria, two common mechanisms can cause the resistance to carbapenems: 1) hydrolysis of carbapenems by β-lactamases and 2) outer membrane impermeability. The focus is on types of carbapenemases described so far, detection methods, epidemiology of and therapeutic options for infections caused by carbapenemase-producing enterobacteria. Attention is also paid to the mechanisms involved in the control of outer membrane permeability, i.e. reduced porin expression or changes in the porin structure that prevent carbapenems from entering the Gram-negative bacterial periplasmic space.
Key words:
carbapenems – resistance – enterobacteria – ESBL – AmpC – MBL.
Autoři: J. Hrabák; E. Chudáčková
Působiště autorů: Ústav mikrobiologie Lékařské fakulty UK v Plzni
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 57, 2008, č. 4, s. 125-136
Souhrn
Karbapenemy patří mezi antibiotika volby u infekcí způsobených multirezistentními gramnegativními bakteriemi. Proto je rezistence k těmto β-laktamům hodnocena jako klinicky a epidemiologicky nejzávažnější. U enterobakterií se uplatňují dva základní mechanismy rezistence – hydrolýza molekuly karbapenemu β-laktamázami a snížení permeability vnější buněčné stěny. V článku jsou shrnuty dosud popsané typy karbapenemáz, možnosti jejich detekce, epidemiologie a možnosti léčby infekcí způsobených producenty těchto enzymů. Dále jsou zde popsány mechanismy vedoucí ke změně permeability vnější buněčné stěny na základě snížení exprese, resp. strukturální změny porinů zajišťujících prostup karbapenemu do periplazmového prostoru bakterie.
Klíčová slova:
karbapenemy – rezistence – enterobakterie – ESBL – AmpC – MBL.1. Úvod
Označení enterobakterie je používáno pro skupinu glukózu fermentujících, fakultativně anaerobních gramnegativních tyček, přítomných v gastrointestinálním traktu, spadajících do čeledi Enterobacteriaceae [43]. Tato čeleď v sobě zahrnuje klinicky významné druhy podmíněně patogenních bakterií, jako jsou Escherichia coli, Klebsiella spp., Citrobacter spp., Proteus spp., atd. [43]. Žádný z těchto druhů není přirozeně rezistentní ke karbapenemům [59, 106].
Karbapenemy jsou používány při léčbě závažných infekcí způsobených multirezistentními kmeny enterobakterií, především produkujících širokospektré β-laktamázy (ESBL) [11, 39, 46] a β-laktamázy AmpC [47, 48], často zároveň rezistentní k fluorochinolonům, aminoglykosidům, atp. [46, 47, 63, 92, 98, 113, 115]. Rezistenci ke karbapenemům lze tedy z klinického a epidemiologického hlediska považovat za nejzávažnější. Proto by při infekcích způsobených kmeny rezistentními ke karbapenemům měla být ve zdravotnických zařízeních přijímána stejná opatření jako v případě infekce MRSA [9, 18]. Tento souborný článek shrnuje současné poznatky o rezistenci enterobakterií ke karbapenemům, včetně epidemiologie a detekce tohoto typu rezistence.
Mechanismy rezistence ke karbapenemům mohou obecně zahrnovat enzymatickou degradaci amidové vazby β-laktamového kruhu molekuly antibiotika, snížení permeability vnější buněčné stěny, eflux antibiotika z buňky, resp. produkci modifikovaných transpeptidáz (penicilin vázajících proteinů – PBP) [18, 26, 62, 63, 65, 89]. U enterobakterií se uplatňují především první dva typy [39, 63, 90, 112].
2. Enzymatický typ rezistence
K enzymatické degradaci antibiotika dochází β-laktamázami. Tyto enzymy hydrolyzují amidovou vazbu β-laktamového kruhu karbapenemu, přičemž donorem molekuly vody potřebné pro reakci může být buď serinový zbytek [2, 13, 14] (serinové β-laktamázy – skupina 1 a 2 podle Bush et al. [13], resp. A, C, D podle Amblera [2]), resp. 1-2 zinkové kationty vázané většinou na histidinovém zbytku [18, 35, 82, 97, 102, 116] (metalo-β-laktamázy – skupina 3 podle Bush et al. [13], popř. B podle Amblera [2]).
2.1. Terminologické pojmy
Nejednotné zatím zůstává obecné označení enzymů hydrolyzujících karbapenemy. Někteří autoři používají termín enzymy/β-laktamázy hydrolyzující karbapenemy (carbapenem-hydrolyzing enzymes/β-lactamases), zahrnující v sobě skutečnost, že tyto β-laktamázy nehydrolyzují pouze karbapenemy, ale obvykle zároveň ostatní β-laktamy (peniciliny, cefalosporiny a aztreonam) [90, 99]. Přesto se v literatuře stále častěji, pro svoji jednoduchost, objevuje termín karbapenemázy [79, 90], který upřednostňují i autoři tohoto článku.
V následujícím textu je použito běžné členění a značení β-laktamáz. Metalo-β-laktamázy se označují zkratkou MBL, pro serinové karbapenemázy skupiny 2f podle Bush et al. (část skupiny AmpA podle Amblera) se dosud nevžilo žádné označení. Karbapenemázy skupiny 2d (AmpD) se obvykle označují jako OXA podle své schopnosti hydrolyzovat oxacilin.
V české literatuře je někdy pro enzymy kódované geny horizontálně se šířícími v bakteriálních populacích používáno označení „plazmidové β-laktamázy“. Tento termín je však zcela nevhodný, vzhledem k tomu, že může zpětně dojít k transpozici integronu, či transpozonu nesoucího gen β-laktamázy, resp. nedokonalé transpozici inzerční sekvence společně s genem β-laktamázy do chromozomu (často popisováno v případě MBL [18, 28], ale i u ESBL β - nedávno např. u typu CTX-M-15 [19]). Přenositelnost na plazmidu je tedy vlastností nikoliv β-laktamázy, ale genetického uspořádání okolí genu β-laktamázy (přítomnost na mobilních elementech DNA). Proto je v následujícím textu preferováno označení „získaná β-laktamáza“, jako analogie anglického termínu „acquired β-lactamase“, resp. „plazmidově přenositelná β-laktamáza“ jako ekvivalent termínu „plasmid-mediated β-lactamase“. Autoři tohoto textu se domnívají, že by zmíněné termíny, z důvodu logické správnosti, měly nahradit dosud používaný nesprávný pojem „plazmidová β-laktamáza“.
2.2. Metalo-β-laktamázy (MBL)
Metalo-β-laktamázy jsou inherentně přítomné v genomu některých bakterií, jako např. Bacillus cereus [90], B. anthracis [90], Bradyrhizobium japonicum [103], Stenotrophomonas maltophilia [75], Aeromonas hydrophila [66, 97, 102], atd. U těchto bakterií se obvykle nachází další serinové β-laktamázy, které u nich způsobují vysoký stupeň rezistence k β-laktamům [75]. Produkce obou skupin enzymů může být inducibilní se stejným mechanismem indukce jako u AmpC produkujících enterobakterií [75]. Zmíněné bakterie naštěstí nejsou častými původci infekcí.
Podle molekulárního členění se MBL rozdělují do tří základních skupin (B1, B2, B3), které se liší především strukturou aktivního místa [35, 112]. Do skupiny B1 spadají MBL detekované u B. cereus, Bacteroides fragilis, Elizabethkingia meningoseptica (dříve Chryseobacterium meningosepticum) a získané MBL (IMP, VIM, GIM, SPM, SIM) [35, 90, 112]. Do skupiny B2 jsou řazeny MBL nalezené u Aeromonas spp. a Serratia fonticola [35, 90, 112]. Ve skupině B3 se nachází enzymy produkované S. maltophilia (L1, GOB-1), Legionella gormanii, atd. [35, 90, 112].
Enzymy skupin B1 a B3 obvykle hydrolyzují všechny β-laktamy (včetně karbapenemů) kromě monobaktamů. Ve skupině B2 se nachází β-laktamázy, jejichž substrátová specificita je omezena striktně na karbapenemy [90, 112].
Geny v současnosti nejvíce rozšířených MBL u klinických izolátů spadajících do skupin VIM, IMP, GIM, a SIM jsou obvykle lokalizovány na integronech (obvykle třídy 1). Pokud dojde k transpozici integronu na konjugativní plazmidy, dochází k jejich horizontálnímu přenosu. Tím došlo k akvizici genů MBL pseudomonádami, acinetobaktery a enterobakteriemi [90, 112].
První získaná MBL byla detekována u P. aeruginosa v Japonsku v roce 1990 [80]. I když výskyt získaných MBL je nejčastější u pseudomonád a acinetobakterů [18, 28, 30, 38, 40, 51, 57, 61, 62, 63, 83, 90, 94, 112, 120], jejich záchyt u enterobakterií začíná být stále významnější [18, 31, 32, 33, 34, 37, 51, 55, 63, 71, 72, 88, 90, 94, 110, 112, 117].
Tab. 1. Získané metalo-β-laktamázy a jejich první záchyt Table 1. Acquired metallo-β-lactamases and their first description 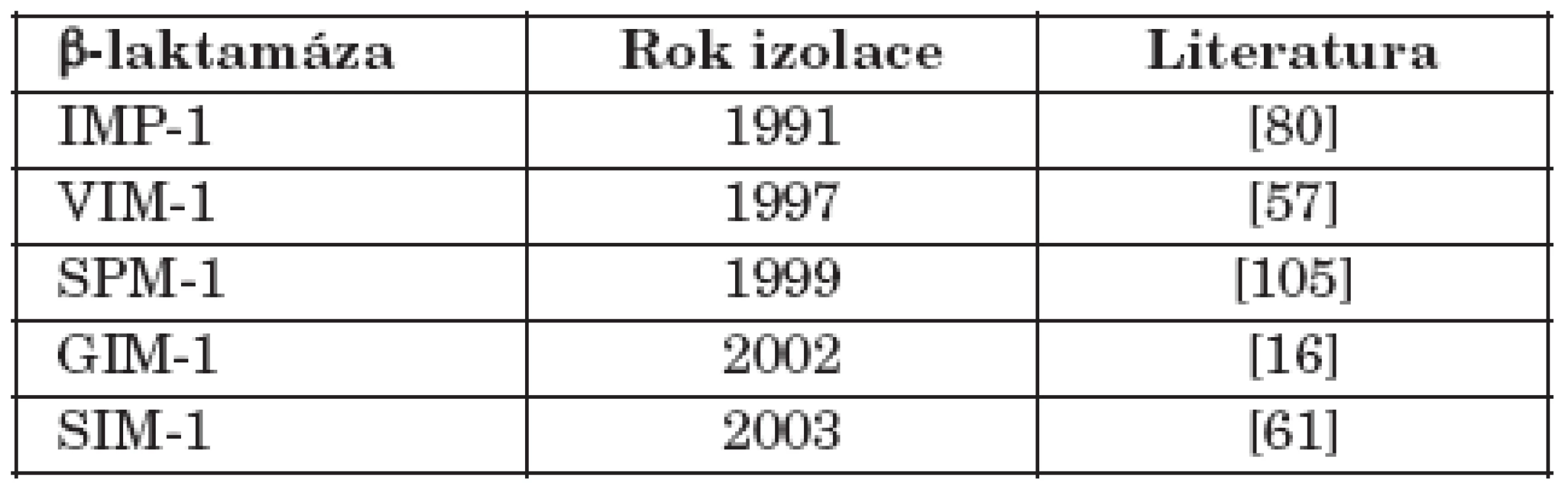
2.2.1. Epidemiologie MBL
Vzhledem k tomu, že MBL jsou nejčastěji popisovány u gramnegativních nefermentujících tyčinek, je epidemiologie producentů MBL nejlépe zdokumentována u P. aeruginosa [28, 38, 40, 94, 95, 120]. Díky odolnosti tohoto bakteriálního druhu vůči dezinfekčním prostředkům, vyschnutí a ostatním fyzikálním a chemickým vlivům jsou takové kmeny někdy označovány jako „gramnegativní MRSA“ [18]. Podobně tomu je i v případě acinetobakterů produkujících MBL [18].
V poslední době však narůstá počet zdokumentovaných případů MBL produkujících enterobakterií, včetně popisů rozsáhlých nemocničních epidemií [34, 37, 45, 51, 55, 110, 117]. Nejvíce zdokumentovaných případů produkce MBL je u druhu K. pneumoniae, kde mohou být kombinovány i s ostatními klinicky významnými β-laktamázami (ESBL, AmpC, 2f) [31, 55, 73]. Epidemiologie producentů MBL je v těchto případech shodná s ESBL a AmpC produkujícími enterobakteriemi – mezi rizikové faktory patří především pobyt na jednotkách intenzivní péče, umělá plicní ventilace, katetrizace, předchozí užívání β-laktamových antibiotik, atd. [11, 18, 21, 53, 119].
Daikos et al. [21] provedl prospektivní studii s cílem charakterizace integronů u enterobakterií způsobujících infekce krevního řečiště. Autoři této studie prokázali, že 13,4 % u komunitních a 40,7 % u nozokomiálních infekcí krevního řečiště bylo způsobeno patogeny, jež ve svém genomu nesly integrony. Na těchto integronech byly kódovány geny způsobující rezistenci k různým skupinám antibiotik, včetně genů MBL.
Práci zabývající se sdruženou rezistencí k fluorochinolonům provedl Wu et al. [115]. Autoři této studie se zabývali proteiny Qnr u druhu E. cloacae v tchajwanských nemocnicích. Tyto proteiny způsobují rezistenci k fluorochinolonům tím, že chrání DNA gyrázu před jejich účinkem. Geny proteinů Qnr bývají kódovány na mobilních elementech [92, 113, 115]. Z tohoto důvodu může velmi snadno docházet k horizontálnímu šíření těchto determinant rezistence v bakteriálních populacích. Bylo prokázáno, že 44 z 56 izolátů (78,6 %) produkujících MBL typu IMP-8 zároveň exprimovalo protein Qnr. U většiny případů byl zjištěn společný přenos obou genů kódovaných na stejném konjugativním plazmidu. Podobnou situaci popsali Galani et al. [33], kteří u kmenů E. cloacae produkujících enzym VIM-1 zjistili gen aac(6’)-IIc – acetyltransferázy modifikující molekulu některých aminoglykosidů. Tento gen byl přítomen na stejných mobilních elementech. Výsledky citovaných prací jsou z epidemiologického hlediska velice závažné, neboť v takových případech podávání fluorochinolonů či aminoglykozidů vede k selekci rezistence ke karbapenemům.
Popsané případy rovněž ukazují na postavení pokročilých molekulárně-epidemiologických metod, které umožňují sledovat sdruženou selekci rezistence v bakteriálních populacích bez použití statistických metod, které jsou v těchto aplikacích téměř neinterpretovatelné.
2.2.2. Klinický význam MBL
Data z relevantních klinických studií o použití antibiotik při infekcích způsobených producenty MBL jsou dosud nedostatečná. Klinickým významem kmenů P. aeruginosa produkujících MBL se zabývá celá řada studií [118, 119, 120]. Bylo prokázáno, že infekce způsobené takovými kmeny se vyznačují vyšší mortalitou. Ta je obvykle způsobena nikoliv vyšší virulencí, ale neadekvátní iniciální léčbou dané infekce [118].
Pokud nejsou prováděny doplňkové testy pro průkaz MBL, nemusí být u enterobakterií standardním stanovením citlivosti [17, 106] produkce MBL zachycena [3, 26, 29]. U těchto kmenů se však projevuje efekt inokula, kdy při zvýšení koncentrace bakterií dochází k nárůstu MIC [81]. Zmíněná práce řeckých autorů se zabývala rovněž stanovením křivek letálního účinku β-laktamů u producentů enzymu VIM-1 [81]. U všech karbapenemů byla prokázána nižší schopnost inhibice oproti kontrolnímu kmenu neprodukujícímu MBL. Po dvou hodinách docházelo u většiny kmenů k inhibici růstu, poté však opět k nárůstu. Získané výsledky jsou však obtížně interpretovatelné a do klinické praxe nepřevoditelné. Současně s karbapenemy byl v citované práci testován aztreonam, který není známými MBL štěpen. U tohoto antibiotika nebyl pozorován významnější efekt inokula a rovněž inhibice byla shodná s kmenem neprodukujícím MBL.
V případech, je-li vyloučena současná produkce ostatních β-laktamáz hydrolyzujících aztreonam (ESBL, AmpC), lze tedy o podání aztreonamu při infekci způsobené MBL produkujícími enterobakteriemi uvažovat [18, 81].
Pokud se jedná o kmen současně produkující ESBL, resp. AmpC, je nutné pro léčbu použít antibiotika jiných skupin (viz tabulka 2) [18, 42]. Lékem volby v některých případech může zůstat pouze kolistin [18, 54, 95, 104]. Některé studie rovněž naznačují možnosti synergie u různých skupin antibiotik, prokázané jak in vitro, tak in vivo [104].
Tab. 2. Možnosti léčby infekcí způsobených producenty MBL (podle [18]) Table 2. Antibiotic therapy of infections caused by MBL-producers [18] ![Možnosti léčby infekcí způsobených producenty MBL (podle [18])
Table 2. Antibiotic therapy of infections caused by MBL-producers [18]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/94d3ec609b74a349ab02933afddbec15.png)
2.2.3. Laboratorní diagnostika MBL
Laboratorní diagnostika MBL využívá biochemické vlastnosti těchto enzymů a schopnost některých látek je inhibovat. Metodika pro detekci MBL včetně výběrových kritérií pro podezřelé kmeny použitelná v rutinních laboratořích klinické mikrobiologie byla v ČR popsána dříve [49].
Obr. 1. Průkaz metalo-β-laktamáz pomocí SDT s inhibicí EDTA. Synergie je patrná mezi všemi indikátorovými β-laktamy a inhibitorem (1 – disk s EDTA, 2 – imipenem, 3 – meropenem, 4 – ceftazidim) Fig. 1. Synergy disk test with EDTA for metallo-β-lactamase detection. Synergy can be observed between inhibitor and all β-lactams (1 – disk with EDTA, 2 – imipenem, 3 – meropenem, 4 – ceftazidime) 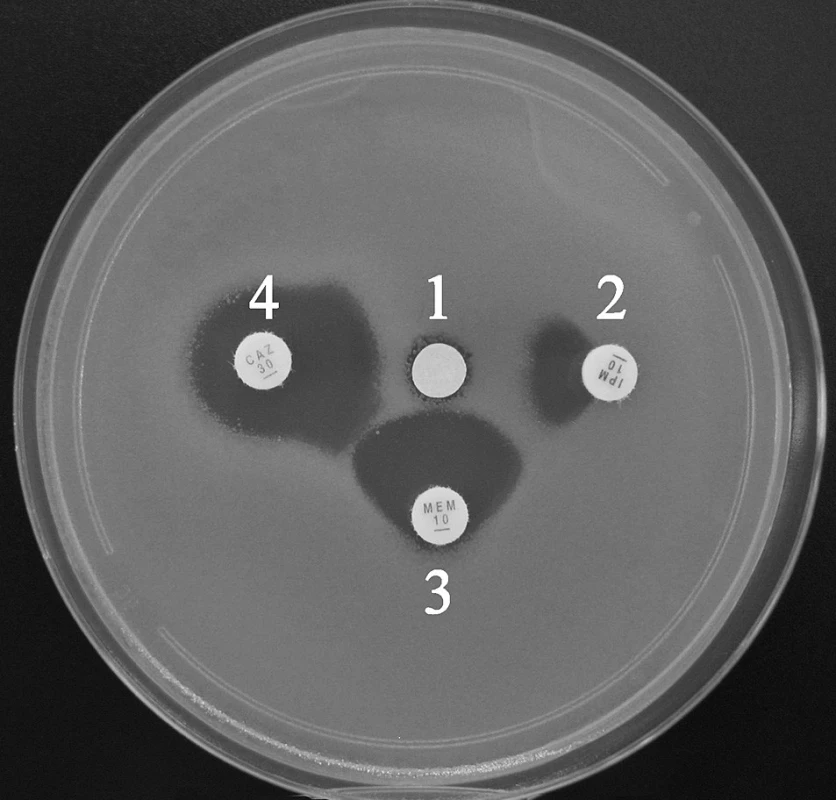
Pro laboratorně-diagnostické účely se k inhibici využívají především chelátory kovových iontů – ethylendiamintetraoctová kyselina (EDTA), 1,10-fenantrolin, a některé thiolové sloučeniny (např. kyselina 2-merkaptopropionová). Uspořádání testu je shodné s průkazem ESBL (DDST). Využívá průkazu synergie indikátorových β-laktamů (imipenem, meropenem, ceftazidim) s inhibitorem napuštěným v disku filtračního papíru na MH agaru [4, 29, 49]. Pro tuto metodu se vžilo označení SDT (Synergy Disk Test), ale je možné používat i označení DDST (Double Disk Synergy Test) jako v případě ESBL a AmpC. Při testování enterobakterií a pseudomonád lze s výhodou použít inhibici EDTA, kdežto u acinetobakterů lepší výsledky poskytuje kyselina 2-merkaptopropionová [4].
Stejně jako v případě ESBL lze i k detekci produkce MBL provádět E-testem nebo mikrodiluční metodou [18, 70]. V obou případech se využívá srovnání MIC imipenemu a MIC imipenemu s EDTA. Jestliže však kmen produkuje MBL s nízkou schopností hydrolyzovat imipenem, může dojít k falešné negativitě testu [18].
Jako referenční metoda biologického průkazu MBL slouží přímé spektrofotometrické měření hydrolýzy imipenemu při 299 nm a schopnost inhibice této aktivity pomocí EDTA. Při testu je použit celobuněčný bakteriální extrakt získaný sonikací 24hodinové kultury [4, 29].
Pro specializované molekulárně-epidemiologické analýzy je nutné provést bližší identifikaci β-laktamázy pomocí PCR s vhodnými primery a následnou sekvenací genu MBL [18, 90]. Rovněž bývá prováděna klasifikace integronu, na němž se gen bla nachází [21, 28, 33, 61, 83]. V případě popisu nového typu enzymu však mohou tyto metody selhat a je nutné použít další specializované metody [18, 90].
MBL lze velmi obtížně prokázat nitrocefinem, proto není v těchto případech optimální isoelektrická fokusace (IEF) s detekcí β-laktamáz tímto chromogenním β-laktamem [18, 90]. MBL lze ale detekovat biologickou metodou, kdy gel získaný po proběhlé IEF je převrstven agarem s karbapenemem a po vhodně dlouhé inkubaci agarem s resuspendovaným citlivým kmenem (obvykle E. coli) [6, 90]. Tam, kde se nachází karbapenemáza, lze pozorovat růst indikátorového kmene.
2.3. Karbapenemázy skupiny 2f
Karbapenemázy skupiny 2f jsou některými autory řazeny k širokospektrým β-laktamázám (ESBL) [15, 31]. Z hlediska definice ustavené K. Bush et al. splňují tyto enzymy všechny biochemické podmínky pro zařazení k ESBL (hydrolýza oxyimino-cefalosporinů, inhibice k. klavulanovou, atd.), avšak spadají do odlišné skupiny (mezi ESBL jsou řazeny enzymy skupiny 2be a část β-laktamáz skupiny 2d) [13, 14]. Proto pro ně není označení ESBL optimální.
První enzym z této skupiny, označený SME-1, byl poprvé identifikován ve Velké Británii v roce 1982 u druhu S. marcescens [90]. Další, IMI-1 a NMC-A, byly později (1984, 1990) nalezeny u druhu E. cloacae v USA, Francii a Argentině [90].
Získané β-laktamázy byly poté nalezeny u kmenů K. pneumoniae deponovaných v rámci projektu ICARE z roku 1996 v USA [90]. Podle svého původu byly označeny KPC – Klebsiella pneumoniae Carbapenemase [50]. Tyto β-laktamázy velmi silně hydrolyzují všechny peniciliny, cefalosporiny a aztreonam. Minimální inhibiční koncentrace karbapenemů u producentů KPC bývá rozdílná (0,5 – 32 g/ml) [24, 25]. U kmenů s MIC ke karbapenemům 0,5 g/ml může být detekce KPC závažný diagnostický problém [24, 25].
Enzymy typu GES, opět plazmidově přenositelné, byly nalezeny v roce 2000 v Řecku u E. cloacae a následně ve Francouzské Guianě u K. pneumoniae (odtud jejich název – Guiana Extended Spectrum) [50, 90].
2.3.1. Epidemiologie karbapenemáz skupiny 2f
U β-laktamáz skupiny 2f dochází k významnému šíření především skupiny KPC, méně pak skupiny GES. Proto bude následující text zaměřen hlavně na tyto dvě skupiny.
Kromě enterobakterií, byly β-laktamázy GES nalezeny u P. aeruginosa [15, 87, 108]. K jejich šíření dochází především v asijských zemích a zemích Jižní Ameriky [15, 108, 111]. V Evropě se jedná spíše o izolované nemocniční epidemie [23].
Enzymy KPC byly v Evropě popsány zatím pouze ve Francii [74], Skandinávii [101], Velké Británii [114], a Řecku [36]. Vždy se jednalo o import z Řecka, USA, či Izraele [114], kde je výskyt producentů KPC závažný klinicko-epidemiologický problém [25, 58, 96]. KPC enzymy byly kromě K. pneumoniae izolovány u K. oxytoca [91], C. freundii [91], Salmonella spp. [91], a P. aeruginosa [109].
V USA se vyskytují kmeny K. pneumoniae exprimující enzym KPC-3 a zároveň rezistentní k fluorochinolonům a aminoglykozidům [24, 25]. U těchto kmenů byly mimo genů ostatních β-laktamáz (blaTEM-1, blaSHV-11 - β-laktamázy s rozšířeným spektrem skupiny 2a; blaSHV-12 – ESBL) detekovány geny qnrB19 a qnrA1 kódující proteiny chránící gyrázu před účinkem fluorochinolonů a gen acetyltransferázy aac(6’)-Ib modifikující molekulu aminoglykosidů. Zmíněné geny byly v různých kombinacích neseny na stejných konjugativních plazmidech [24, 25]. Tyto práce opět demonstrují možnou selekci rezistence ke karbapenemům při používání fluorochinolonů a aminoglykosidů tak, jak bylo popsáno např. u producentů ESBL a AmpC [5, 90, 92] (viz stejná situace jako u producentů MBL - odstavec 2.1.1.).
2.3.2. Klinický význam karbapenemáz skupiny 2f
Vzhledem k tomu, že problematika karbapenemáz skupiny 2f začala být významnou teprve v minulých letech, neexistuje dosud žádný publikovaný konsenzus o podávání β-laktamových antibiotik u producentů těchto enzymů. Studie, které by se zabývaly klinickým, popřípadě in vitro hodnocením účinnosti těchto látek dosud chybí. U kmenů enterobakterií může kmen v případě některých β-laktamů spadat do citlivé kategorie [24, 25]. Ani v těchto případech však nelze léčbu takovým β-laktamem doporučit z důvodu rizika selhání léčby (doporučení z 10thβ-Lactamase Meeting, Eretria, Řecko, 2008). Podání kombinace β-laktam/inhibitor nelze použít z důvodu nízké schopnosti β-laktamových inhibitorů β-laktamáz (k. klavulanová, tazobaktam, sulbaktam) inhibovat tyto enzymy [79]. Možnosti léčby tak zůstávají velmi významně omezeny.
2.3.3. Laboratorní diagnostika karbapenemáz skupiny 2f
V laboratorní praxi je nutné vyhledávat kmeny enterobakterií s vysokým stupněm rezistence k penicilinům, cefalosporinům a aztreonamu, u nichž je MIC k některému z karbapenemů větší nebo rovna hodnotě 0,5 g/ml. Produkce karbapenemáz skupiny 2f může být kombinována s produkcí ESBL, AmpC, resp. ostatními β-laktamázami [73].
Vzhledem k velmi slabé inhibici β-laktamovými inhibitory β-laktamáz (kyselina klavulanová, tazobaktam, sulbaktam) nelze použít testy založené na synergii β-laktamů s kyselinou kalvulanovou (DDST, E-test, metody založené na srovnání MIC, atp.) [79, 90].
Někteří autoři doporučují pro průkaz enzymatické degradace karbapenemu provést tzv. 3D test [29] (viz obr. 2). MH agar je inokulován dobře citlivým kmenem E. coli, do středu plotny je umístěn disk napuštěný některým z karbapenemů. Od okrajů plotny směrem k disku je čárou inokulován vyšetřovaný kmen plnou kličkou (pro zajištění řádově vyšší koncentrace než jakým byla plotna inokulována). Další modifikací je vyříznutí žlábků od okraje plotny až k disku, do nichž je napipetován celobuněčný bakteriální extrakt získaný sonikací nebo opakovaným zamrazováním a rozmrazováním 24hodinové kultury [47]. Citlivý kmen, jímž je plotna inokulována, vytvoří okolo disku s karbapenemem inhibiční zónu. Pokud testovaný kmen produkuje karbapenemázu, dojde k deformaci této inhibiční zóny směrem k disku (viz obr. 2). Metoda neumožňuje rozlišení mezi jednotlivými skupinami karbapenemáz (MBL, 2f, OXA) a její interpretace bývá velmi obtížná v případě nízké produkce enzymu, resp. nízké aktivity extraktu [M.Gniadkowski, osobní sdělení].
Obr. 2. Průkaz karbapenemáz tzv. 3D metodou. Žlábky okolo disku s ertapenemem (umístěnemém ve středu plotny) jsou naplněny 150 μl bezbuněčného extraktu získaného sonikací. Všechny tři testované kmeny produkují karbapenemázu – dochází k deformaci původně kruhové inhibiční zóny Fig. 2. 3D test for the carbapenemase detection. 150 μl of cellfree extract is applied into groves around the disk with erthapenem. All three tested strains produced carbapenemase – deformation of inhibition zone can be observed 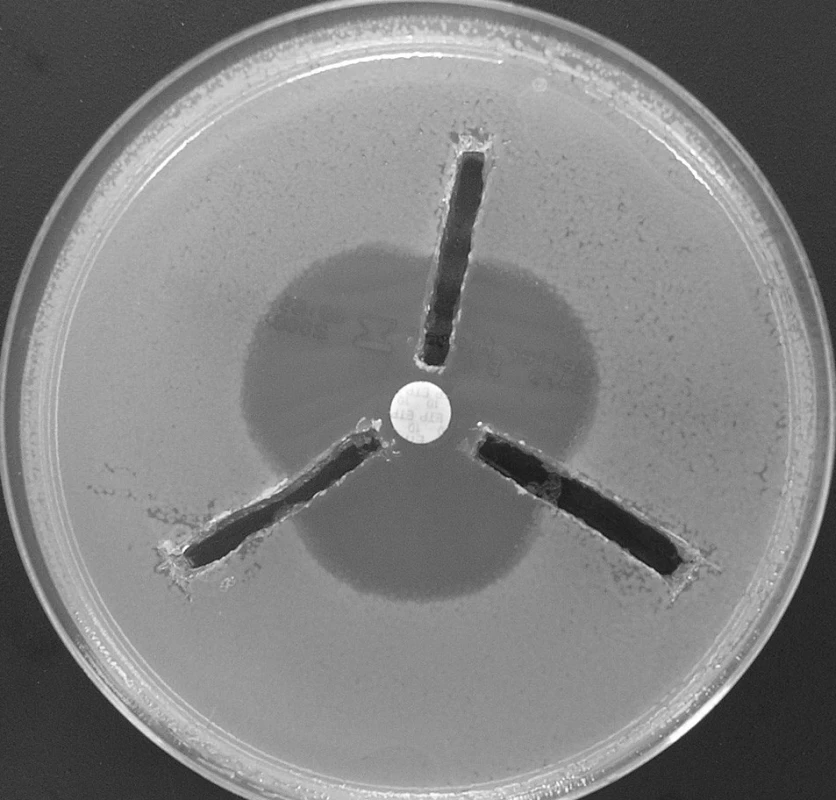
Zatím jedinou rutinně použitelnou metodou zůstává PCR identifikace genu karbapenemázy (optimálně doplněná sekvenací genu bla) [90]. Počet β-laktamáz s tímto spektrem účinku je dosud malý (viz http://www.lahey.org/studies), a proto lze mít k dispozici sadu primerů [90], které umožní detekovat všechny popsané enzymy. Pokud se však bude jednat o nový typ β-laktamázy, nebude PCR amplifikace a detekce úspěšná.
Specializovaná pracoviště opět mohou využít IEF se značením enzymové aktivity nitrocefinem a následným biologickým průkazem karbapenemázové aktivity [6].
2.4. Karbapenemázy skupiny OXA
Tato skupina β-laktamáz je velmi heterogenní β - sekvence aminokyselin jednotlivých enzymů se mohou od sebe významně lišit [63]. Karbapenemázy ze skupiny OXA jsou řazeny do devíti různých podskupin [90]. Většina z nich se nachází u acinetobakterů a pseudomonád [63, 90, 95], přičemž některé mohou být neseny na mobilních elementech. U enterobakterií byla dosud nalezena pouze jediná karbapenemáza skupiny OXA - OXA-48 u K. pneumoniae v Turecku. OXA-48, plazmidově přenositelná, velmi dobře hydrolyzuje imipenem [85].
Popsaný případ je však dosud ojedinělý, proto karbapenemázy této skupiny nejsou zatím u bakterií čeledi Enterobacteriaceae považovány za významné. To ovšem neplatí u nefermentujících gramnegativních tyčinek [90, 95].
3. Rezistence způsobená snížením permeability vnější buněčné stěny
β-laktamy zabraňují konečnému kroku při tvorbě peptidoglykanové vrstvy vazbou na aktivní místo transpeptidáz - PBPs (penicillin binding proteins). Aby molekula antibiotika dosáhla místa svého účinku na vnějším povrchu cytoplazmatické membrány, musí překonat bakteriální stěnu a periplazmový prostor. Prostup hydrofobní buněčnou stěnou je umožněn pomocí pasivních proteinových přenašečů – porinů [63].
Dojde-li u bakterie ke snížení permeability buněčné stěny změnou exprese porinů, antibiotikum proniká do buňky v omezené míře a dochází ke vzniku rezistence. V takovém případě i β-laktamázy s nízkou schopností hydrolyzovat karbapenemy mohou zamezit účinku pronikajícího antibiotika [7, 68]. Zároveň je ale snížena prostupnost daných porinů pro ostatní, pro bakteriální buňku potřebné, sloučeniny. Stav snížené permeability buněčné stěny je tedy pro bakterii výhodný z hlediska ochrany proti toxickému účinku antibiotika, ale nevýhodný z důvodu nedostatečné dostupnosti živin [76]. Vzniklá rezistence bývá tedy obvykle jen dočasná – adaptivní, kdy po vysazení antibiotika je často rezistentní subpopulace nahrazena citlivou.
Rezistence způsobená snížením permeability buněčné stěny může vznikat snížením exprese příslušného porinu, strukturální změnou tohoto porinu, nebo nahrazením daného porinu jiným typem [1].
3.1. Poriny
Vnější membrána gramnegativních bakterií je pro hydrofilní sloučeniny hůře prostupná oproti běžné fosfolipidové membráně (např. eukaryont), což je dáno kompaktní strukturou zprostředkovanou interakcí řetězců nenasycených mastných kyselin lipopolysacharidových molekul. Tato vlastnost chrání bakterii před potenciálně toxickým vnějším prostředím [76]. Potřebné hydrofilní sloučeniny pronikají do nitra buňky prostřednictvím pórů proteinové povahy, které je možno dělit na specifické kanály s vazebným místem pro určitý ligand a nespecifické poriny [76, 77, 78].
Poriny nemají žádné specifické vazebné místo, přesto některé látky jimi do buňky difundují snáze než jiné díky svým fyzikálně chemickým vlastnostem jako je molekulová hmotnost, náboj, lipofilita atp. [77]. To vyvolává jistou specifičnost některých porinů vůči určitému antibiotiku.
Obr. 3. SDS-PAGE (I.) a detekce porinů pomocí specifických protilátek (II.) u kmenů K. pneumoniae. M – standard molekulových hmotností, 1 – kmen citlivý ke karbapenemům exprimující oba hlavní poriny (OmpK35 – A, OmpK36 – B), 2 – kmen rezistentní ke karbapenemům velmi slabě exprimující pouze OmpK35 Fig. 3. SDS-PAGE and Western-blott detection of porins in K. pneumoniae strains. M – marker of molecular weight, 2 – strain susceptible to carbapenems expressed both main porins (OmpK35 – A, OmpK36 – B), 2 – strain resistant to carbapenems expressed only OmpK35 in very low level 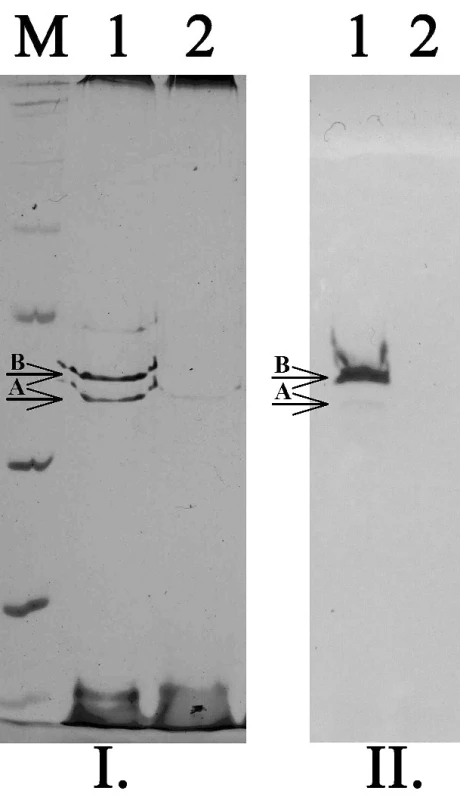
Nejvíce prostudované z hlediska změn exprese porinů ve vnější buněčné stěně jsou enterobakterie, z nich pak zejména E. coli (laboratorní kmen K-12), K. pneumoniae a Enterobacter spp. Rezistenci na podkladě snížení permeability buněčné stěny lze pozorovat i u jiných skupin bakterií, např. P. aeruginosa a A. baumannii [65].
U Escherichia coli (kmen K-12) byly popsány dva hlavní poriny – OmpF s větším průsvitem kanálku a preferencí kationů, a OmpC s menším průsvitem. Podobně je tomu u K. pneumoniae, kde se vyskytují také dva hlavní poriny - OmpK35 analogický s OmpF (E. coli) a OmpK36 analogický s OmpC [44, 65]. S. enterica a Enterobacter spp. mají kromě dvou genů obdobných s OmpF a OmpC ještě gen OmpD [44, 65]. O hlavních porinech ostatních členů čeledi Enterobacteriaceae nejsou prozatím dostupná data.
Zmíněné hlavní poriny jsou trimerní povahy a mají asi 100x větší propustnost než monomerní protein OmpA exprimovaný u E. coli. Ten je homologní s hlavním porinem P. aeruginosa OprF a OmpK34 u K. pneumoniae. [65, 76]
Některé další proteiny porinové povahy, „spící“ poriny, nejsou exprimovány za běžných laboratorních podmínek, jsou to například NmpC a OmpN (E.coli), OmpK37 (K. pneumoniae), a OmpS2 (Salmonella typhi) [22, 65].
3.2. Mechanismy vzniku rezistence
K mobilizaci klinicky významných β-laktamáz, především skupiny CTX-M, často dochází nedokonalou transpozicí inserčních sekvencí (IS) a následně jejím horizontálním šířením v bakteriálních populacích [39, 56, 84, 86]. V bakteriální buňce může poté dojít k inzerci IS do genu porinu a tím k jeho inaktivaci [52]. Takto změněné mutanty příslušný porin neexprimují. Tento mechanismus se uplatňuje především u producentů ESBL a AmpC [10, 12, 52, 69].
Represe produkce určitého porinu může být také vyvolána náhodnou mutací v daném genu. Ke vzniku rezistence však zřejmě dochází až kombinací mutací, které způsobí neprostupnost všech hlavních porinů [1, 44].
Další možností je regulace exprese porinů pomocí krátkých molekul RNA (sRNA) [41]. Tyto molekuly byly původně nalezeny na extrachromozomálních elementech, jako např. plazmidech a bakteriofázích. Jejich úloha není dosud dostatečně objasněna [41].
3.3. Klinicko-epidemiologický význam snížení permeability vnější buněčné stěny
Jsou-li porovnány MIC jednotlivých antibiotik u kmene K. pneumoniae produkujícího oba hlavní proteiny (OmpK35 a OmpK36) s izogenickými mutantami exprimujícími pouze jeden z těchto proteinů, pohybuje se změna MIC v rámci jednoho dilučního kroku. Chybí-li u zkoumané mutanty oba poriny, zvýšení MIC u některých β-laktamových antibiotik (ampicilin, cefoxitin, cefotaxim, ceftazidim) je již řádově vyšší. K nejvýraznějšímu vzestupu MIC dochází u mutant s β-laktamázovou aktivitou [44].
Z dalších studií vyplývá, že izolované změny permeability buněčné stěny nejsou rozhodující a ke vzniku klinicky významné rezistence dochází, je-li zároveň přítomna některá β-laktamáza typu ESBL, AmpC, resp. karbapenemáza [12, 20, 22, 44, 61, 64, 100].
Pokud není přítomen jiný typ rezistence, který by vyžadoval použití interpretačních pravidel pro hodnocení citlivosti kmene k antibiotikům [46, 47, 49, 59], lze jeho citlivost hodnotit podle hodnoty MIC, resp. průměrů inhibičních zón [17, 106]. Přesto je však nutné monitorování léčby, neboť snížením permeability mohou nabýt významu i jinak se neprojevující mechanismy rezistence [93].
Jak bylo zmíněno výše, v klinické praxi se lze s tímto typem nejčastěji setkat u kmenů K. pneumoniae produkujících β-laktamázu ESBL nebo AmpC [12, 20, 22, 44, 52, 60, 64]. V ČR lze u invazivních izolátů K. pneumoniae pozorovat kontinuální vzestup rezistence k cefalosporinům 3. generace [107]. Například v roce 2007 se již jednalo o 41,9 % (http://www.rivm.nl/EARSS). Vzhledem k tomu, že infekce způsobené těmito kmeny jsou často léčeny karbapenemy, představují tyto rizikovou skupinu pro vznik adaptivní rezistence ke karbapenemům.
3.4. Laboratorní detekce defektu permeability
Při záchytu kmene rezistentního ke karbapenemům je nejprve nutné vyloučit produkci metalo--β-laktamáz a jiných karbapenemáz (viz předchozí text).
Podrobná analýza permeability vnější buněčné stěny je možná pouze ve specializovaných laboratořích. Prostupnost antibiotik do periplazmového prostoru lze kvantifikovat měřením zbytkové aktivity β-laktamáz vně bakteriální buňky [65].
Nepřímé metody spočívají v detekci porinů pomocí SDS-PAGE [27] s následným western-blottem se specifickými protilátkami a PCR amplifikací příslušných genů. Tyto metody neumožňují detekci strukturálně odlišných porinů se změněnou prostupností [12, 60, 65].
4. Závěr
V České republice nebyl dosud u enterobakterií zjištěn enzymatický typ rezistence ke karbapenemům, ani produkce MBL u pseudomonád a acinetobakterů. I v ostatních zemích lze výskyt rezistence enterobakterií ke karbapenemům považovat za nízký. Přesto v některých státech, např. v Řecku, je prevalence karbapenem rezistentních kmenů enterobakterií velmi vysoká a jejich procentuální podíl stále narůstá (viz data EARSS – http://www.rivm.nl/earss, resp. [31, 34, 36, 71, 89, ]). U druhu K. pneumoniae se významně podílejí na infekcích krevního řečiště (viz data EARSS – http://www.rivm.nl/earss).
V ostatních zemích, včetně České republiky, naopak narůstá prevalence kmenů rezistentních ke karbapenemům díky snížení permeability vnější buněčné stěny v souvislosti s produkcí ESBL a AmpC [114; J. H., E. Ch., P. Urbášková, nepublikovaná data].
I když v řadě případů infekcí rezistentních ke karbapenemům může zůstat jedinou volbou léčby kolistin, i k tomuto antibiotiku začíná u druhu K. pneumoniae narůstat rezistence [67; P. Urbášková, osobní sdělení]. Ta je způsobená strukturální změnou lipopolysacharidu, která neumožní včlenění molekuly antibiotika do buněčné stěny [67].
Z uvedených příkladu je patrné, že stojíme na počátku doby, kdy karbapenemy začínají ztrácet své výsostné postavení při léčbě infekcí vyvolaných multirezistentními gramnegativními mikroby. Úkolem mikrobiologů a nemocničních epidemiologů by mělo být oddálení stavu, kdy kmeny enterobakterií budou k těmto látkám běžně rezistentní.
Poděkování
Autoři děkují prim. MUDr. Tamaře Bergerové a RNDr. Pavle Urbáškové, CSc. za kritické přečtení a cenné připomínky k rukopisu. Práce byla podpořena grantovým projektem výzkumu a vývoje MŠMT 2E08003.
Do redakce došlo 8. 8. 2008
Ing. Jaroslav Hrabák, Ph.D.
Ústav mikrobiologie LF UK v Plzni
Dr. E. Beneše 13
305 99 Plzeň
e-mail: Jaroslav.Hrabak@lfp.cuni.cz
Zdroje
1. Amaral, L. Response of regulatory, efflux pump transporter and Omp genes during prolonged antibiotic stress and development of MDR in Gram-negative bacteria, Clin Microbiol Infect, 2008, Suppl. ECCMID 2008 Abstracts, S388.
2. Ambler, R.P. The structure of β-lactamases. Phil Trans R Soc Lond Biol, 1980, 289, 321-331.
3. Anderson, K.F., Lonsway, D.R., Rasheed, J.K., Biddle, J. et al. Evaluation of methods to identify the Klebsiella pneumoniae carbapenemase in Enterobacteriaceae. J Clin Microb, 2007, 45, 2723-2725.
4. Arakawa, Y, Shibata, N, Shibayama, K, Kurokawa, H. et al. Convenient test for screening metallo-β-lactamase-producing Gram-negative bacteria by using thiol compounds. J Clin Microb, 2000, 38, 40-43.
5. Baudry, P.J., Nichol, K., DeCorby, M., Mataseje, L. et al. Comparison of antimicrobial resistance profiles among extended-spectrum-beta-lactamase-producing and acquired AmpC beta-lactamase-producing Escherichia coli isolates from Canadian intensive care units. Antimicrob Agents Chemother, 2008, 52, 1846-1849.
6. Bauernfeind, A., Grimm, H., Schweighart, S. A new plasmidic cefotaximase in a clinical isolate of Escherichia coli. Infection, 1990, 18, 294-298.
7. Bauvois, C., Ibuka, A.S., Celso, A., Alba, J. et al. Kinetic properties of four plasmid-mediated AmpCβ--lactamases, Antimicrob Agents Chemother, 2005, 49, 4240-4246.
8. Bebrone, C. Metallo-β-lactamases (classification, activity, genetic organization, structure, zinc coordination) and their superfamily. Biochem Pharmacol, 2007, 74, 1686-1701.
9. Bergerová, T, Hedlová, D, Jindrák, V, Urbášková, P. et al. Doporučený postup pro kontrolu výskytu kmenů Staphylococcus aureus rezistentních k oxacilinu (MRSA) a s jinou nebezpečnou antibiotickou rezistencí ve zdravotnických zařízeních. Prakt Lék, 2006, 86, 500–506. Dostupný také na WWW (http://www. cls.cz/dokumenty/dp_mrsa.doc).
10. Bidet, P., Burghoffer, B., Gautier, V., Brahimi, N. et al. In vivo transfer of plasmid-encoded ACC-1 AmpC from Klebsiella pneumoniae to Escherichia coli in an infant and selection of impermeability in K. pneumoniae. Antimicrob Agents Chemother, 2005, 49, 3562-3565.
11. Bradford, P. Extended-spectrum-β-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat. Clin Microbiol Rev, 2001, 14, 933-951.
12. Bradford, P., Urban, C., Mariano, N., Projan, S. et al. Imipenem resistance in Klebsiella pneumoniae is associated with the combination of ACT-1, a plasmid-mediated AmpC beta-lactamase, and loss of an outer memebrane protein. Antimicrob Agents Chemother, 1996, 41, 563-569.
13. Bush, K., Jacoby, G.A., Medeiros, A.A. A functional classification scheme for β-lactamases and its correlation with molecular structure. Antimicrob Agents Chemother, 1995, 39, 1211-1233.
14. Bush, K., Singer, S.B. Biochemical characteristics of extended broad spectrum β-lactamases. Infection, 1989, 17, 429-433.
15. Castanheira, M., Mendes, R.E., Walsh, T.R., Gales, A.C. et al. Emergence of the extended-spectrum beta-lactamase GES-1 in a Pseudomonas aeruginosa strain from Brazil: report from the SENTRY antimicrobial surveillance program. Antimicrob Agents Chemother, 2004, 48, 2344-2345.
16. Castanheira, M., Toleman, M.A., Jones, R.N., Schmidt, F.J. et al. Molecular characterization of a β-lactamase gene, blaGIM-1, encoding a new subclass of metallo-β-lactamase. Antimicrob Agents Chemother, 2004, 48, 4654-β-4661.
17. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: sixteenth informational supplement. CLSI Document M100-S-16, PA, USA, 2006.
18. Cornaglia, G., Akova, M., Amicosante, G., Cantón, R. et al. Metallo-β-lactamases as emerging resistance determinants in Gram-negative pathogens: open issues. Int J Antimicrob Agents, 2007, 29, 380-388.
19. Dissemination of clonally related Escherichia coli strains expressing extended-spectrum ß-lactamase CTX-M-15. Emerg Infect Dis, 2008, 14, 195-200.
20. Crowley, B., Benedí, J.V., Doménech-Sanchez, A. Expression of SHV-2 beta–lactamase and of reduced amounts of OmpK36 porin in Klebsiella pneumoniae results in increased resistance to cephalosporins and carbapenems. Antimicrob Agents Chemother, 2002, 46, 3679-3682.
21. Daikos, G.L., Kosmidis, C., Tassios, P.T., Petrikkos, G. et al. Enterobacteriaceae bloodstream infections: presence of integrons, risk factors, and outcome. Antimicrob Agents Chemother, 2007, 2366‑2372.
22. Doménech-Sanchez, A., Martínez-Martínez, L., Hernendéz-Allés, S., Carmen Conejo, M. et al. Role of Klebsiella pneumoniae OmpK35 porin in antimicrobial resistance. Antimicrob Agents Chemother, 2003, 47, 3332-3335.
23. Duarte, A., Boavida, F., Grosso, F., Correia, M. et al. Outbreak of GES-1 beta-lactamase-producing multidrug-resistant Klebsiella pneumoniae in a university hospital in Lisbon, Portugal. Antimicrob Agents Chemother, 2003, 47, 1481-1482.
24. Endiamini, A., Carias, L.L., Hujer, A.M., Bethel, C.R. et al. Presence of plasmid-mediated quinolone resistance in Klebsiella pneumoniae isolates possessing blaKPC in the United States. Antimicrob Agents Chemother, 2008, 52, 2680-2682.
25. Endiamini, A., Hujer, K.M., Carias, L.L., Perez, F. et al. Emergence of plasmid-mediated quinolone resistance in blaKPC – containing Klebsiella pneumoniae in the United States. 10th Beta-Lactamase Meeting Abstracts, Eretria, Řecko, 2008, 12.
26. Espedido, B.A., Thomas, L.C., Iredell, J.R. Metallo--β-lactamase or extended-spectrum β-lactamase: a wolf in sheep’s clothing. J Clin Microb, 2007, 45, 2034-2036.
27. Ferro-Luzzi, A.G. Resolution of bacterial proteins by polyacrylamide gel electrophoresis on slabs, membrane, soluble, and periplasmic fractions. J Biol Chem, 1973, 249, 634-644.
28. Fiett, J, Baraniak, A, Mrówka, A, Fleischer, M. et al. Molecular epidemiology of acquired-metallo-β--lactamase-producing bacteria in Poland. Antimicrob Agents Chemother, 2006, 50, 880-886.
29. Franklin, C, Liolios, L, Peleg, AY. Phenotypic detection of carbapenem-susceptible metallo-β--lactamase-producing Gram-negative bacilli in the clinical laboratory. J Clin Microb 2006; 44 : 3139-3144.
30. Fritsche, T.R., Sader, H.S., Toleman, M.A., Walsh, T.R. et al. Emerging metallo-beta-lactamase-mediated resistance: a summary report from the worldwide SENTRY antimicrobial surveillance program. Clin Infect Dis, 2005, 41(Suppl. 4), 276-278.
31. Galani, I., Souli, M., Koratzanis, E., Chryssouli, Z. Molecular characterization of an Escherichia coli clinical isolate that produces both metallo-β-lactamase VIM-2 and extended-spectrum β-lactamase GES-7: identification of the In8 integron carrying the blaVIM-2 gene. J Antimicrob Chemother, 2006, 58, 432-433.
32. Galani, I., Souli, M., Chryssouli, Z., Katsala, D. et al. First identification of an Escherichia coli clinical isolate producing both metallo-β-lactamase VIM-2 and extended-spectrum β-lactamase IBC-1. Clin Microb Infect, 2004, 10, 749-772.
33. Galani, I., Souli, M., Chryssouli, Z., Orlandou, K. et al. Characterization of a new integron containing blaVIM-1 and aac(6’)-IIc in an Enterobacter cloacae clinical isolate from Greece. J Antimicrob Chemother, 2005, 55, 634-638.
34. Galani, I., Souli, M., Koratzanis, E., Koratzanis, G. et al. Emerging bacterial pathogens: Escherichia coli, Enterobacter aerogenes and Proteus mirabilis clinical isolates harbouring the same transferable plasmid coding for metallo-β-lactamase VIM-1 in Greece. J Antimicrob Chemother, 2007, 59, 578-579.
35. Garau, G., Di Guilmi, A.M., Hall, B.G. Structure-based phylogeny of the metallo-β-lactamases. Antimicrob Agents Chemother, 2005, 49, 2778-2784.
36. Giakkoupi, P., Vourli, S., Polemis, M., Vatopoulos A. Emergence of KPC-producing Klebsiella pneumoniae in Greece. 10th Beta-Lactamase Meeting Abstracts, Eretria, Řecko, 2008, 14.
37. Giakkoupi, P., Xanthaki, A., Kanelopoulou, M., Vlahaki, A. et al. VIM-1 metallo-β-lactamase-producing Klebsiella pneumoniae strain in Greek hospitals. J Clin Microb, 2003, 41, 3893-3896.
38. Gibb, A.P., Tribuddharat, C., Moore, R.A., Louie, T.J. et al. Nosocomial outbreak of carbapenem-resistant Pseudomonas aeruginosa with a new blaIMP allele, blaIMP-7. Antimicrob Agents Chemother, 2002, 46, 255-258.
39. Gniadkowski, M. Evolution and epidemiology of extended-spectrum beta-lactamases (ESBLs) and ESBL-producing microorganisms. Clin Microb Infect, 2001, 7, 597-608.
40. Grespo, M.P., Woodford, N., Sinclair, A., Kaufmann, M.E. et al. Outbreak of carbapenem-resistant Pseudomonas aeruginosa producing VIM-8, a novel metallo-beta-lactamase, in a tertiary care center in Cali, Colombia J Clin Microb, 2004, 42, 5094-5101.
41. Guillier, M., Gottesman, S., Storz, G. Modulating the outer membrane with small RNAs, Genes Dev., 2006, 20, 2338-2348.
42. Hawkey, P., Finch, R. Tigecycline: in-vitro performance as a predictor of clinical efficacy. Clin Microbiol Infect, 2007, 13, 354-362.
43. Hensyl, W.R. Bergey’s manual of determinantive bacteriology., Williams and Wilkins, Baltimore, USA, 1994.
44. Hernandéz-Allés, S., Carmen-Conejo, M., Pascual, A., Tomás, J.M. et al. Relationship between outer membrane alterations and susceptibility to antimicrobial agents in isogenic strains of Klebsiella pneumoniae, Journal of Antimicrobial Chemotherapy, 2000, 46, 273-277.
45. Herbert, S., Halvorsen, D.S., Franklin, C., Spelman, D. Large outbreak of infection and colonization with Gram-negative pathogens carrying the metallo-β-lactamase gene blaIMP-4 at a 320-Bed tertiary hospital in Australia. Infect Control Hosp Infect, 2007, 28, 98-101.
46. Hrabák, J. Klinicky významné β-laktamázy gramnegativních bakterií: širokospektré β-laktamázy (ESBL). Epid mikrob imunol, 2007, 56, 103-111.
47. Hrabák, J. Klinicky významné β-laktamázy gramnegativních bakterií: AmpC. Epid mikrob imunol 2007, 56, 155-165.
48. Hrabák, J., Vaniš, V., Bergerová, T., Urbášková, P. Průkaz β-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií. Zprávy CEM, 2007, 16, 31-36.
49. Hrabák, J., Vaniš, V., Bergerová, T., Jindrák, V. et al. Průkaz metalo-β-laktamáz (MBL) u gramnegativních bakterií. Zprávy CEM, 2007, 16, 417-422.
50. Jacoby, G.A. ß-lactamase nomenclature. Antimicrob Agents Chemother, 2006, 50, 1123-1129.
51. Jones, R.N., Biedenbach, D.J., Sader, H.S., Fritsche, T.R. et al. Emerging epidemic of metallo-beta-lactamase-mediated resistance. Diagn Microbiol Infect Dis, 2005, 51, 77-84.
52. Kaczmarek, F.M., Dib-Hajj, F., Shang, W., Gootz, T.D. High-level carbapenem resistance in Klebsiella pneumoniae clinical isolate is due to the combination of bla ACT-1 beta-lactamase production, porin OmpK35/36 insertional inactivation, and down-regulation of the phosphate transport porin PhoE. Antimicrob Agents Chemother, 2006, 50, 3396-3406.
53. Kang, C.I., Kim, S.H., Park, W.B., Lee K.D. et al. Bloodstream infections due to extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae: risk factors for mortality and treatment outcome, with special emphasis on antimicrobial therapy. Antimicrob Agents Chemother, 2004, 48, 4574-4581.
54. Karabinis, A., Paramythiotou, E., Mylona-Petropoulou, D., Kalogeromitros, A. et al. Colistin for Klebsiella pneumoniae-associated sepsis. Clin Infect Dis, 2004, 38, 7-9.
55. Ktari, S., Arlet, G., Mnif, B., Gautier, V. et al. Emergence of multidrug-resistant Klebsiella pneumoniae isolates producing VIM-4 metallo-β--lactamase, CTX-M-15 extended-spectrum β-lactamase, and CMY-4 AmpC β-lactamase in a Tunisian university hospital. Antimicrob Agents Chemother, 2006, 4198‑4201.
56. Lartigue, M.F., Poirel, L., Aubert, D., Nordmann, P. In vitro analysis of ISEcp1B-mediated mobilization of naturally occuring beta-lactamase gene blaCTX-M of Kluyvera ascorbata, Antimicrob Agents Chemother, 2006, 50, 1282-1286.
57. Lauretti, L., Riccio, M.L., Mazzariol, A., Cornaglia, G. et al. Cloning and characterization of blaVIM, a new integron-borne metallo-β-lactamase gene from a Pseudomonas aeruginosa clinical isolate. Antimicrob Agents Chemother, 1999, 43, 1584-1590.
58. Leavitt, A., Navon-Venezia, S., Chmelnitsky, I., Schwaber, M.J. et al. Emergence of KPC-2 and KPC-3 in carbapenem-resistant Klebsiella pneumoniae strains in an Israeli hospital. Antimicrob Agents Chemother, 2007, 51, 3026 - 3029.
59. Leclercq, R., Cantón, R., Giske, C., Heisig, P. et al. Expert rules in antimicrobial susceptibility testing. European Committee on Antimicrobial Susceptibility Testing, 2008, http://www.srga.org/eucastwt/EUCAST %20Expert%20rules%20final%20April_20080407.pdf.
60. Lee, K., Yong, D., Choi, Y.S., Yum, J.H. et al. Reduced imipenem susceptibility in Klebsiella pneumoniae clinical isolates with plasmid-mediated CMY-2 and DHA-1 beta-lactamases co-mediated by porin loss. Int J Antimicrob Agents, 2006, 29, 201-206.
61. Lee, K., Yum, J.H., Yong, D., Lee, H.M. et al. Novel acquired metallo-β-lactamase gene, blaSIM-1, in a class 1 integron from Acinetobacter baumannii clinical isolates from Korea, Antimicrob Agents Chemother, 2005, 49, 4485-4491.
62. Livermore, D.M. Multiple mechanisms of antimicrobial resistance in Pseudomonas aeruginosa: our worst nightmare? Clin Infect Dis, 2002, 34, 634-640.
63. Livermore D.M., Woodford N. The beta-lactamase threat in Enterobacteriaceae, Pseudomonas and Acinetobacter, Trends Microbiol., 2006, 14, 413-420.
64. Martínez-Martínez, L., Pascual, A., Hernendéz-Allés, S., Alvarez-Díaz, D. et al. Roles of beta-lactamases and porins in activities of carbapenems and cephalosporins against Klebsiella pneumoniae. Antimicrob Agents Chemother, 1999, 43, 1669-1673.
65. Martínéz-Martínéz, L. Extended-spectrum beta-lactamases and the permeability barrier., Clin Microbiol Infect, 2008, 14(suppl.1), 82-89.
66. Massidda, O., Rossolini, G.M., Satta, G. The Aeromonas hydrophila cphA gene: molecular heterogenity among class B metallo-ß-lactamases. J Bacteriol, 1991, 173, 4611-4617.
67. Matthaiou, D.K., Michalopoulos, A., Rafailidis, P.I., Kirageorgopoulos, D.E. et al. Risk factors associated with the isolation of colistin-resistant gram-negative bacteria: a matched case-control study. Crit Care Med, 2008, 36, 807 - 811. Crit. Care Med.
68. Mazura, N., Sakagawa, E., Ohya, S. Outer membrane proteins responsible for multiple drug resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother, 1995, 39, 645-649.
69. Mena, A., Plasencia, V., García, L., Hidalgo, O. et al. Characterization of a large outbreak by CTX-M-1-producing Klebsiella pneumoniae and mechanisms leasing to in vivo carbapenem resistance development. J Clin Microb, 2006, 44, 2831 - 2837.
70. Migliavacca, R., Docquier, J.-D., Mugnaioli, C., Amicosante, G. et al. Simple microdilution test for detection of metallo-β-lactamase production in Pseudomonas aeruginosa. J Clin Microb, 2002, 40, 4388‑4390.
71. Miriagou, V., Tzelepi, E., Daikos, G.L., Tassios, P.T. et al. Panresistance in VIM-1-producing Klebsiella pneumoniae. J Antimicrob Chemother, 2005, 55, 810‑811.
72. Miriagou, V., Tzelepi, E., Giannele, D., Tzouvelekis, L.S. Escherichia coli with a self-transferable, multiresistant plasmid coding for metallo--β-lactamase VIM-1. Antimicrob Agents Chemother, 2003, 47, 395-397.
73. Moland, E.S., Hong, S.G., Thomson, K.S., Larone, D.H. et al. Klebsiella pneumoniae isolate producing at least eight different beta-lactamases, including AmpC and KPC beta-lactamases. Antimicrob Agents Chemother, 2007, 51, 800-801.
74. Naas, T., Cuzon, G., Villegas, M.V., Lartigue, M.F. et al. Genetic structures at the origin of aquisition of the beta-lactamase blaKPC gene. Antimicrob Agents Chemother, 2008, 52, 1257-1263.
75. Nicodemo, A.C., Garcia Paez, J.I. Antimicrobial therapy for Stenotrophomonas maltophilia infections. Eur J Clin Microbiol Infect Dis, 2007, 26, 229-237.
76. Nikaido, H. Molecular basis of bacterial outer membrane permeability revisited. Microbiol Mol Biol Rev, 2003, 67, 593-656.
77. Nikaido, H. Transport across the bacterial outer membrane., J Bioenerg Biomembr, 1993, 25, 581-9.
78. Nikaido, H. Proteins forming large channels from bacterial and mitochondrial outer membranes: porins and phage lambda receptor proteins. Methods Enyzmol 1983, 97, 85-100.
79. Nordmann, P. AmpCs, carbapenemases and carbapenem resistance, Clin Microbiol Infect, 2008, Suppl. ECCMID 2008 Abstracts, S127.
80. Osano, E., Arakawa, Y., Wacharotayankum, R., Ohta, M. et al. Molecular characterization of an enterobacterial metallo-beta-lactamase found in a clinical isolate of Serratia marcescens that shows imipenem resistance. Antimicrob Agents Chemother, 1994, 38, 71-78.
81. Panagiotakopoulou, A., Daikos, G.L., Miriagou, V., Loli, A. et al. Comparative in vitro killing of carbapenems and aztreonam against Klebsiella pneumoniae producing VIM-1 metallo-β-lactamase. Int J Antimicrob Agents, 2007, 29, 356-365.
82. Poeylaut, A.A., Tomatis, P.E., Karsisiotis, A.I., Damblon, C. et al. A minimalistic approach to identify substrate binding features in B1 metallo-β-lactamases. Bioorg Med Chem Lett, 2007, 17, 5171-5174.
83. Poirel, L., Cabanne, L., Collet, L., Nordmann, P. Clas II transposon-borne structure harboring metallo-β-lactamase gene blaVIM-2 in Pseudomonas putida. Antimicrob. Agents Chemother, 2006, 50, 2889‑2891.
84. Poirel, L., Decousser, J.W., Nordmann, P. Insertion sequence ISEcp1B is involved in expression and mobilization of blaCTX-M beta-lactamase gene. Antimicrob Agents Chemother, 2003, 47, 2938-2945.
85. Poirel, L., Hériter, C., Tolün, V., Nordmann, P. Emergence of oxacilinase-mediated resistance to imipenem in Klebsiella pneumoniae. Antimicrob Agents Chemother, 2004, 48, 15-22.
86. Poirel, L., Lartigue, M.F., Decousser, J.W., Nordmann, P. ISEcp1B-mediated transposition of blaCTX-M in Escherichia coli. Antimicrob Agents Chemother, 2004, 49, 447-550.
87. Poirel, L., Weldhagen, G.F., Naas, T., Champs, C.D. et al. GES-2, a class A β-lactamase from Pseudomonas aeruginosa with increased hydrolysis of imipenem. Antimicrob Agents Chemother, 2001, 45, 2598-2603.
88. Pournaras, S., Ikonomidis, A., Tzouvelekis, L.S., Tokatlidou, D. VIM-12, a novel plasmid-mediated metallo-β-lactamase from Klebsiella pneumoniae that resembles a VIM-1/VIM-2 hybrid. Antimicrob Agents Chemother, 2005, 49, 5153-5156.
89. Pournaras, S., Maniati, M., Spanakis, N., Ikonomidis, A., et al. Spread of efflux pump-overexpressing, non-metallo-β-lactamase-producing, meropenem-resistant but ceftazidime-susceptible Pseudomonas aeruginosa in a region with blaVIM endemicity. J Antimicrob Chemother, 2005, 56, 761-764.
90. Queenan, A.M., Bush, K. Carbapenemase: the versatile β-lactamases. Clin Microb Rev, 2007, 20, 440‑458.
91. Rasheed, J.K., Biddle, J.W., Anderson, K.F., Washer, L. et al. Detection of the Klebsiella pneumoniae carbapenemase type 2 Carbapenem-hydrolyzing enzyme in clinical isolates of Citrobacter freundii and K. oxytoca carrying a common plasmid. J Clin Microbiol, 2008, 46, 2066-2069.
92. Rodríguez-Martínez, J.-M., Pascual, A., García, I., Martínez-Martínez, L. Detection of plasmid-mediated quinolone resistance determinant qnr among clinical isolates of Klebsiella pneumoniae producing AmpC-type β-lactamase. J Antimicrob Chemother, 2003, 52, 703‑706.
93. Rodríguez-Martínez, J.M., Pichardo, C., García, I., Pachón-Ibanez, M.E. et al. Activity of ciprofloxacin and levofloxacin in experimental pneumonia caused by Klebsiella pneumoniae deficient in porins, expressing active efflux and producing QnrA1. Clin Microb Infect, 2008, 14, 691-697.
94. Rossoliny, G.M. Acquired metallo-β-lactamases: an increasing clinical threat. Clin Infect Dis, 2005, 41, 1557-1558.
95. Rossoliny, G.M., Mantengoli, E. Treatment and control of severe infections caused by multiresistant Pseudomonas aeruginosa Clin Microb Infect, 2005, 11(Suppl. 4), 17-32.
96. Samra, Z., Ofir, O., Lishtzinsky, Y., Madar-Shapiro, L. et al. Outbreak of carbapenem-resistant Klebsiella pneumoniae producing KPC-3 in a tertiary medical centre in Israel. Int J Antimicrob Agents, 2007, 30, 525-529.
97. Simona, F., Magistrato, A., Vera, D.M.A., Garau, G. et al. Protonation state and substrate binding to B2 metallo-β-lactamase CphA from Aeromonas hydrofila. Proteins, 2007, 69, 595-605.
98. Siu, L.K. Antibiotics: action and resistance in gram-negative bacteria. J Microbiol Immunol Infect, 2002, 35, 1-11.
99. Smith Moland, E., Hanson, N.D., Herrera, V.L., Black, J.A. et al. Plasmid-mediated, carbapenem-hydrolysing beta-lactamase, KPC-2, in Klebsiella pneumoniae isolates. J Antimicrob Chemother, 2003, 51, 711-714.
100. Stapleton, P.D., Shannon, K.P., French, G.L. Carbapenem resistance in Escherichia coli associated with plasmid-determined CMY-4 ß-lactamase production and loss of an outer membrane protein. Antimicrob Agents Chemother, 1999, 43, 1206-1210.
101. Samuelsen, O. Emergence of KPC and MBLs in Scandinavia. 10th Beta-Lactamase Meeting Abstracts, Eretria, Řecko, 2008, 15.
102. Sharma, N., Toney, J.H., Fitzgerald, P.M.D. Expression, purification, crystalization and preliminary X-ray analysis of Aeromonas hydrophilia metallo-β-lactamase. Acta Cryst, 2005, F61, 180-182.
103. Stoczko, M., Frére, J.-M., Rossoliny, G.M., Docquier, J.-D. Postgenomic scan of metallo-β-lactamase homologues in Rhizobacteria: identification and characterization of BJP-1, a subclass B3 ortholog from Bradyrhizobium japonicum. Antimicrob Agents Chemother, 2006, 50, 1973-1981.
104. Tascini, C., Urbani, L., Biancofiore, G., Rossoliny, G.M. et al. Colistin in combination with rifampin and imipenem for treating a blaVIM-1 metallo-β-lactamase producing Enterobacter cloacae disseminated infection in a liver transplant patient. Minerva Anestesiol, 2008, 74, 47-49.
105. Toleman, M.A., Simm, A.M., Murphy, T.A., Gales, A.C. et al. Molecular characterization of SPM-1, a novel metallo-β-lactamase isolated in Latin America: report from the SENTRY antimicrobial surveillance programme. J Antimicrob Chemother, 2002, 50, 673‑679.
106. Urbášková, P. Rezistence bakterií k antibiotikům. Vybrané metody. Praha: Trios, 1998.
107. Urbášková, P., Jakubů, V., Žemličková, H., Macková, B. a CZ-EARSS. Rezistence k antibiotikům u sedmi druhů invazivních bakterií, sledovaných v rámci EARSS v České republice v letech 2000-2006. Prakt Lék, 2007, 87, 32-39.
108. Vakulenko, S. GES β-lactamases: Evolution of resistance. 10th Beta-Lactamase Meeting Abstracts, Eretria, Řecko, 2008, 28.
109. Villegas, M.V., Lolans, K., Correa, A. Kattan, J.N. et al. First identification of Pseudomonas aeruginosa isolates producing a KPC-type carbapenem-hydrolyzing beta-lactamase. Antimicrob Agents Chemother, 2007, 51, 1553-1555.
110. Vourli, S., Tsorlini, H., Katsifa, H., Polemis, M. et al. Emergence of Proteus mirabilis carrying the blaVIM-1 metallo-β-lactamase gene. Clin Microb Infect, 2006, 12, 672-694.
111. Wachino, J., Doi, Y., Yamane, K., Shibata, N. et al. Nosocomial spread of ceftazidime-resistant Klebsiella pneumoniae strains producing a novel class a beta-lactamase, GES-3, in a neonatal intensive care unit in Japan, Antimicrob Agents Chemother, 2004, 48, 1960‑1967.
112. Walsh, T.R., Toleman, M.A., Poirel, L., Nordmann, P. Metalo-ß-lactamases: the quiet before the storm? Clin Microb Rev, 2005, 18, 306-325.
113. Wang, A., Yang, Y., Lu, Q., Wang, Y. et al. Presence of qnr gene in Escherichia coli and Klebsiella pneumoniae resistant to ciprofloxacin isolated from pediatric patients in China. BMC Infect Dis, 2008, 22, 8 : 68.
114. Woodford, N., Zhang, J.C., Warner, M., Kaufmann, M.E. et al. Arrival of KPC carbapenemase-producing Klebsiella pneumoniae in the United Kingdom: an Israel connection. 10th Beta-Lactamase Meeting Abstracts, Eretria, Řecko, 2008, 13.
115. Wu, J.-J., Ko, W.-C., Tsai, S.-H., Yan, J.-J. Prevalence of plasmid-mediated quinolone resistance determinants QnrA, QnrB, and QnrS among clinical isolates of Enterobacter cloacae in a Taiwanese Hospital. Antimicrob Agents Chemother, 2007, 51, 1223-1227.
116. Xu, D., Xie, D., Guo, H. Catalytic mechanism of class B2 metallo-β-lactamase. J Biol Chem 2006, 281, 8740-8747.
117. Yan, J.-J., Ko, W.-C., Tsai, S.-H., Wu, H.-M. et al. Outbreak of infection with multidrug-resistant Klebsiella pneumoniae carrying blaIMP-8 in a university medical center in Taiwan. J Clin Microbiol, 2001, 39, 4433-4439.
118. Zavascki, A. P., Barth, A. L., Fernandes, J. F., Moro, A. L. D. et al. Reappraisal of Pseudomonas aeruginosa hospital-acquired pneumonia mortality in the era of metallo-β-lactamase-mediated multidrug resistance: a prospective observational study. Crit Care, 2006, 10, R114.
119. Zavascki, A.P., Barth, A.L., Goncalves, A.L., Moro, A.L. et al. The influence of metallo-β-lactamase production on mortality in nosocomial Pseudomonas aeruginosa infections. J Antimicrob Chemother, 2006, 58, 387-392.
120. Zavascki, A.P., Gaspareto, P.B., Martins, A.F., Goncalves, A.L. Outbreak of carbapenem-resistant Pseudomonas aeruginosa producing SPM-1 metallo-β-lactamase in a teaching hospital in southern Brazil. J Antimicrob Chemother, 2005, 56, 1148-1151.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2008 Číslo 4- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Prokalcitonin: marker vhodný pro diagnostiku sepse i hodnocení antimikrobiální léčby
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
-
Všechny články tohoto čísla
- Ilja Iljič Mečnikov a Paul Ehrlich:laureáti Nobelovy ceny v r. 1908 za práce o imunitě
- Rezistence enterobakterií ke karbapenemům
- Charakteristika a prevalence klonů Listeria monocytogenes izolovaných od pacientů v letech 2001-2008 v České republice
- Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
- Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
- Životné jubileum prof. MUDr. Jána Štefanoviča, DrSc.
- Recenze
- TEST
- Mezinárodní sympozium k použití antivirotik u pacientů nemocných ptačí chřipkou H5N1
- Vakcinace proti sezónní chřipce – zvýšení protekce proti viru H5N1
- Import marburgské hemoragické horečky do Evropy
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rezistence enterobakterií ke karbapenemům
- Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
- Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
- Ilja Iljič Mečnikov a Paul Ehrlich:laureáti Nobelovy ceny v r. 1908 za práce o imunitě
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



