-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPoruchy funkce štítné žlázy
Autoři: J. Lebl; M. Šnajderová; S. Koloušková; Z. Šumník
Působiště autorů: Pediatrická klinika UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2012; 67 (4): 282-287.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
1. KONGENITÁLNÍ HYPOTYREÓZA
Kongenitální hypotyreóza je nejčastějším vrozeným endokrinním onemocněním (u nás je prevalence 1 : 4000 novorozených dětí). Hormony štítné žlázy hrají klíčovou roli při vývoji mozku, a to zejména v kritickém vývojovém období do 8 měsíců věku a v poněkud menší míře do věku 3 let. Proto vrozená hypotyreóza bez včasné substituční terapie vede k nezvratnému poškození neuropsychického vývoje a k mentální retardaci. Při neléčené vrozené hypotyreóze se opožďuje i somatický růst a vývoj (obr. 1).
Obr. 1. Chlapec s neléčenou kongenitální hypotyreózou (tehdy zvanou „sporadický kretenismus“) ve věku 15 let. Z knihy prof. Čížkové-Písařovicové „Klinická endokrinologie dětského věku“, vydalo Státní zdravotnické nakladatelství, Praha, 1954. Vydání této knihy se považuje za vznik oboru dětská endokrinologie v tehdejším Československu. 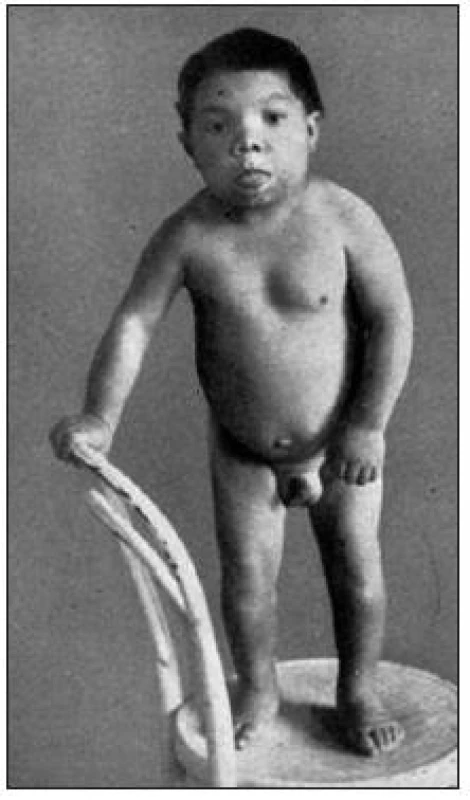
S cílem zajistit rychlou diagnostiku a včasnou substituční terapii byl ve vyspělých zemích od poslední čtvrtiny 20. století (v ČR od roku 1985 zásluhou prof. Olgy Hníkové) zaveden celoplošný novorozenecký screening kongenitální hypotyreózy. Děti diagnostikované a léčené včas díky novorozeneckému screeningu se vyvíjejí normálně z hlediska mentálního i somatického a jejich celoživotní prognóza je velmi příznivá.
1.1. Etiologie a patogeneze kongenitální hypotyreózy
Příčiny kongenitální hypotyreózy shrnuje tab. 1.
Tab. 1. Přehled příčin kongenitální hypotyreózy. 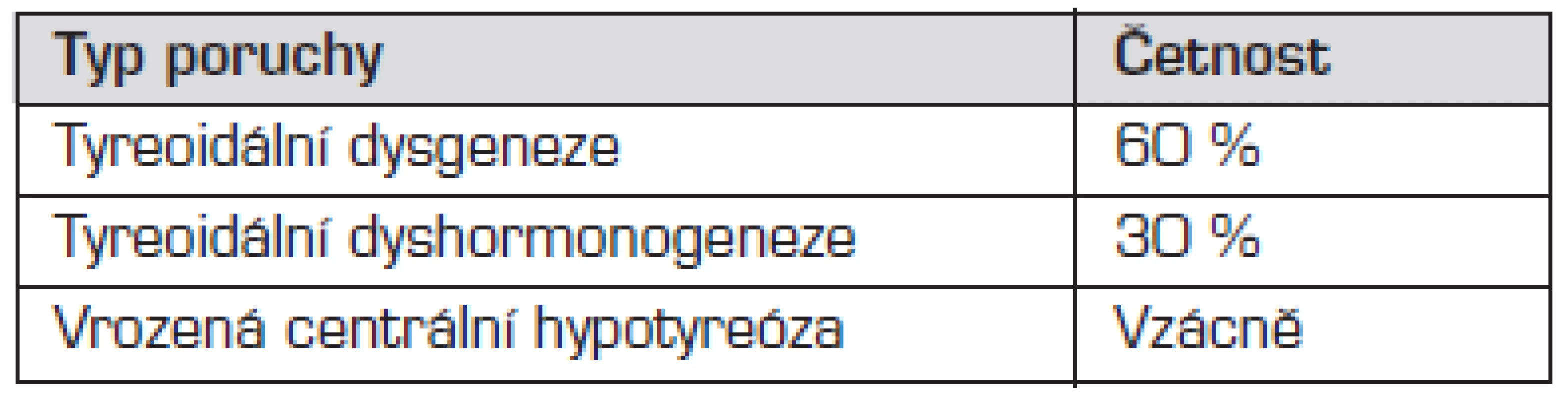
1.1.1. Tyreoidální dysgeneze – porucha vývoje žlázy
Dysgeneze vzniká jako důsledek porušeného embryonálního vývoje a/nebo fetálního růstu štítné žlázy. Jednotlivé fáze vývoje žlázy jsou řízeny souhrou transkripčních faktorů, z nichž byly dosud identifikovány faktory NKX2.1 (také zvaný TTF1, tyreoidální transkripční faktor-1), FOXE1 (také zvaný TTF2, tyreoidální transkripční faktor-2), PAX8 a NKX2.5. Pro fetální a postnatální růst štítné žlázy je nezbytná funkce TSHR (receptoru pro TSH) (obr. 2).
Obr. 2. Schéma embryonálního vývoje štítné žlázy a jeho regulace. V levém sloupci jsou uvedeny dny vývoje lidského embrya (E). Je naznačen vznik a vývoj ductus thyreoglossus a postupné formování struktury štítné žlázy. Pravé sloupce ukazují expresi jednotlivých řídicích genů v daných vývojových fázích. Defekty těchto genů mohou být příčinou dysgeneze štítné žlázy a kongenitální hypotyreózy (podle Evy Al Taji). 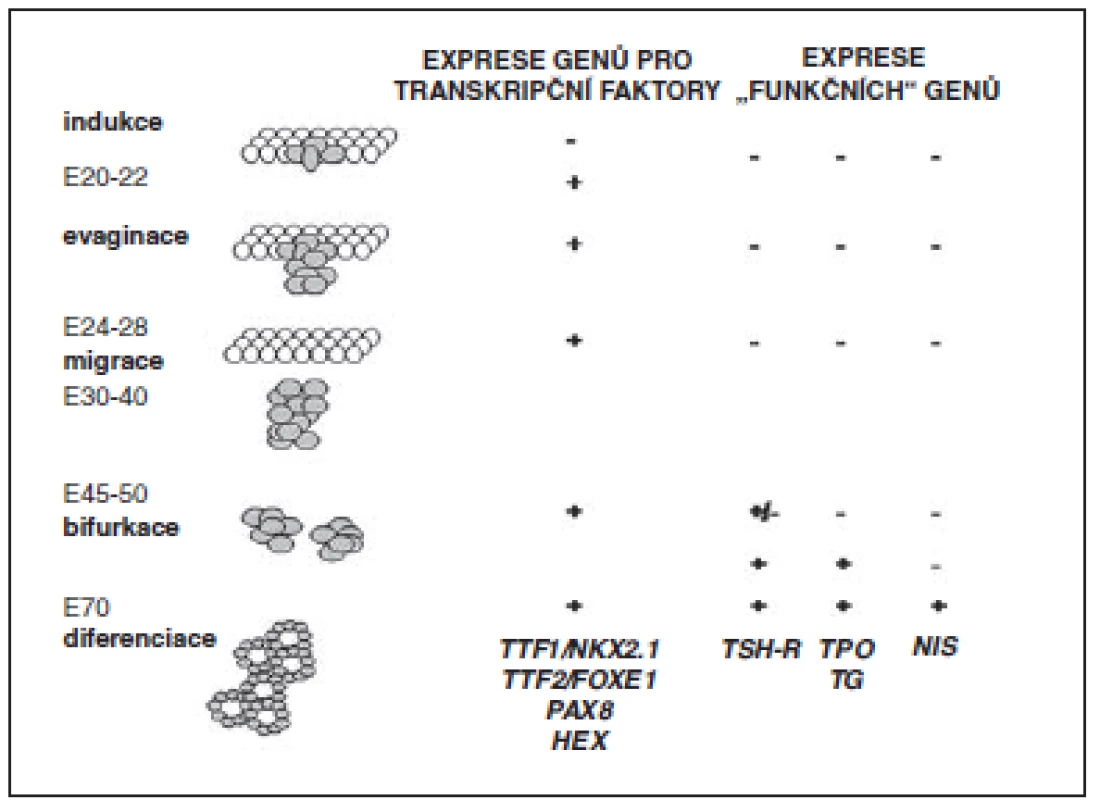
NIS – natrium-jodidový symportér, TG – tyreoglobulin, TPO – tyreoidální peroxidáza, TSH-R – receptor pro TSH Vrozené defekty transkripčních faktorů nebo TSHR vedou ke geneticky podmíněným formám dysgeneze štítné žlázy. Ty jsou v některých případech spojené s anomáliemi jiných orgánů (např. srdce, ledvin, plic, mozku). Většina případů tyreoidální dysgeneze je však izolovaná a sporadická.
U dětí s dysgenezí štítné žlázy nalézáme ultrazvukem a případně scintigraficky agenezi, aplazii, hypoplazii (obr. 3), hemityreoideu, cystickou malformaci a ektopii štítné žlázy (např. tzv. „struma lingualis“ zanořená v kořeni jazyka).
Obr. 3. Ultrazvukové znázornění hyperechogenního rudimentu štítné žlázy v transverzálním řezu u tříletého chlapce s hypotyreózou na podkladě poruchy genu PAX8 (celkový objem štítné žlázy 0,45 ml, norma pro daný věk a pohlaví 1,82 ± 0,53 ml). Z archivu Jaroslava Zikmunda a Evy Al Taji. 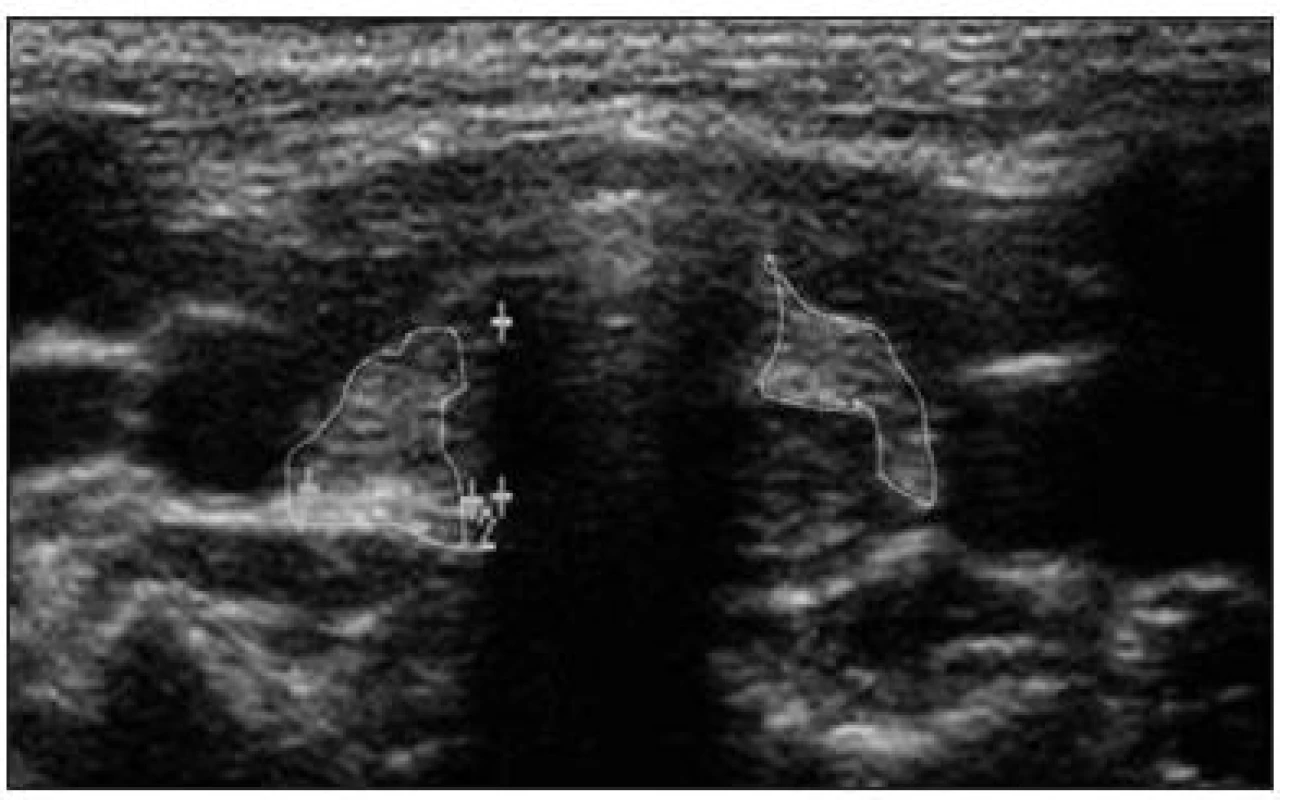
1.1.2. Tyreoidální dyshormonogeneze – porucha syntézy hormonů
Tyreoidální dyshormonogeneze je důsledkem vrozené poruchy biosyntézy tyreoidálních hormonů. Částečná nebo úplná porucha může postihovat kterýkoliv stupeň hormonální syntézy nebo sekrece. Mezi dobře známé poruchy, způsobené genovými mutacemi, patří defekt natrium-jodidového symportéru (NIS), pendrinu, tyreoidální peroxidázy (TPO), tyreoglobulinu (TG), tyreoidální peroxidázy 2 (THOX2) či dehalogenázy (DEHAL). Úlohu jednotlivých substancí při funkci tyreocytu znázorňuje obrázek 4.
Obr. 4. Důležité funkční součásti tyreocytu (folikulární buňky štítné žlázy) s naznačením možných poruch, které vedou k tyreoidální dyshormonogenezi. Dyshormonogeneze může být způsobena defektem jodidového transportního systému (NIS – transport z krve do tyreocytu, pendrinu a hAIT – transport z tyreocytu do lumen folikulu), enzymatických systémů (TPO – organifikace jodidu a spřažení, ThOX1, 2 – tvorba H2O2, dehalogenázy – dejodace MIT a DIT a recyklace jódu) a syntézy tyreoglobulinu. V levé části obrázku je schematicky naznačena regulace syntézy tyreoidálních hormonů (podle Karoliny Banghové a Evy Al Taji). 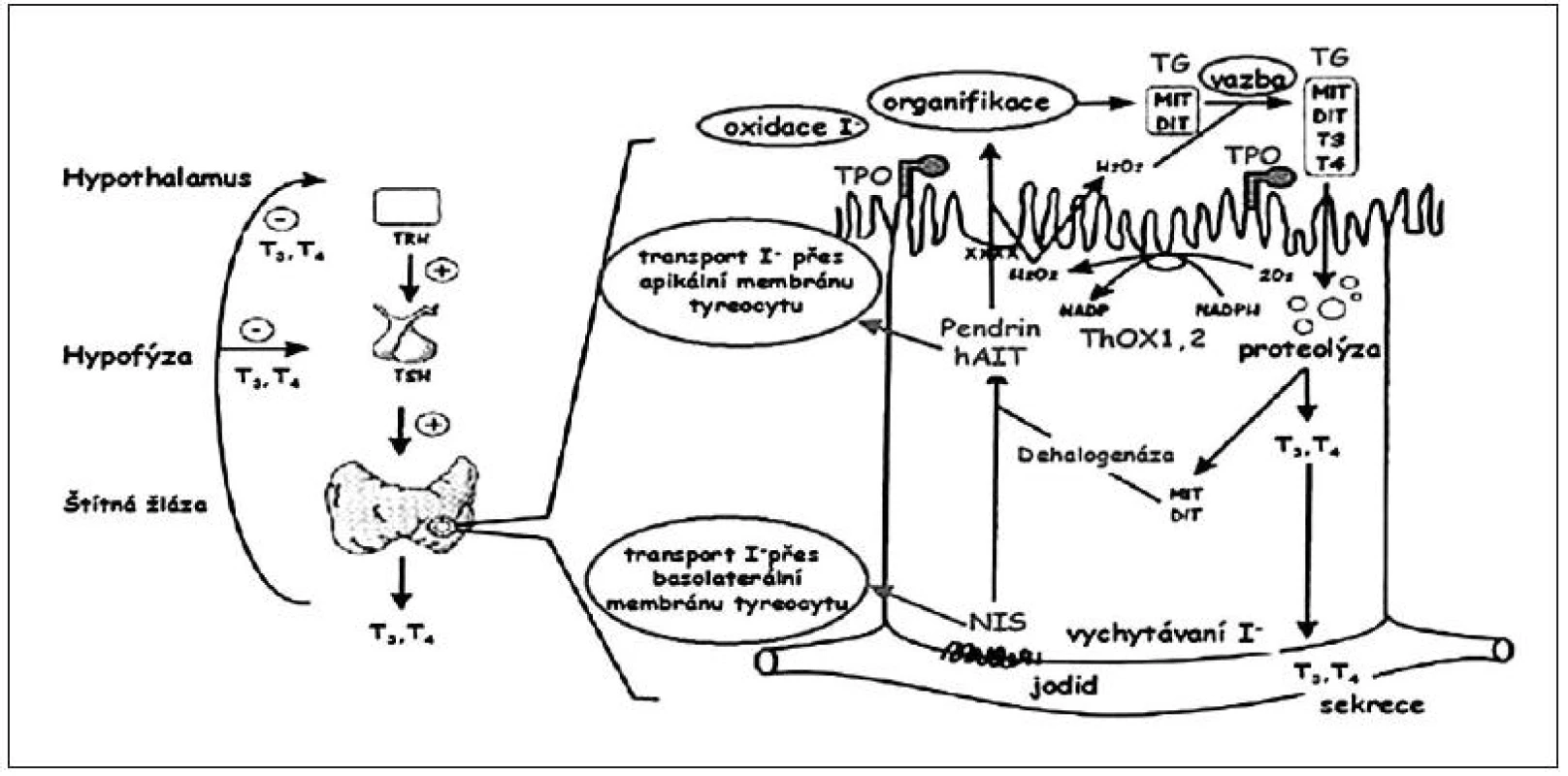
DEHAL – dehalogenáza; DIT – dijódtyronin; hAIT – lidský apikální jodidový transportér; MIT – monojódtyronin; NIS – natriumjodidový symportér; TG – tyreoglobulin; ThOX – tyreoidální oxidáza; TPO – tyreoidální peroxidáza Morfologicky je při tyreoidální dyshormonogenezi štítná žláza u novorozence zvětšená (novorozenecká struma) nebo normální. U pacientů s defektem pendrinu se v průběhu dětství zpravidla rozvine senzorineurální porucha sluchu (Pendredův syndrom – vrozená nebo časně nastupující hypotyreóza a porucha sluchu).
1.1.3. Vrozená centrální hypotyreóza
Izolovaná vrozená centrální hypotyreóza je způsobena vrozeným defektem beta-podjednotky TSH. Nezachytí se běžným novorozeneckým screeningem kongenitální hypotyreózy, který je založen na detekci vysokých hladin TSH. Důsledkem této poruchy může být někdy těžká forma vrozené hypotyreózy s rizikem poškození mozku, v jiných případech je porucha mírnější.
Vedle toho patří mírná forma centrální hypotyreózy k některým vrozeným formám kombinovaného deficitu hypofyzárních hormonů, často ve spojení s deficitem růstového hormonu, někdy spolu s centrálním hypokortikalismem a/nebo hypogonadotropním hypogonadismem. Tyto formy centrální hypotyreózy zpravidla nevedou k poškození vývoje mozku.
1.2. Klinický obraz a diagnostika vrozené hypotyreózy
Ke klinickému obrazu vrozené hypotyreózy před érou novorozeneckého screeningu patřil protrahovaný novorozenecký ikterus, neprospívání, opožděné růstové tempo, opožděné kostní zrání (např. otevřená malá fontanela při narození a pozdní uzávěr velké fontanely), opožděná erupce mléčné dentice, makroglosie, svalová hypotonie a omfalokéla, obstipace, u některých dětí nápadný chraplavý křik. V řadě rozvojových zemí není zatím screening vrozené hypotyreózy zaveden a tyto příznaky tam jsou stále běžné.
Při klinické diagnóze bývá již obvykle ireverzibilně poškozen vývoj mozku. Stupeň mentálního postižení souvisí s tíží hypotyreózy a s věkem při zahájení substituční léčby. Před érou substituční léčby končila kongenitální hypotyreóza idiocií („sporadický kretenismus“).
Z laboratorních nálezů je při dysgenezi nebo dyshormonogenezi příznačná vysoká hladina tyreostimulačního hormonu (TSH) a nízká hladina periferních hormonů štítné žlázy (volného tyroxinu, fT4). Při rezistenci periferních tkání k hormonům štítné žlázy jsou vysoké hladiny TSH i fT4.
U vzácné centrální formy kongenitální hypotyreózy jsou hladiny TSH i fT4 nízké.
V současnosti se kongenitální hypotyreóza (s výjimkou centrální formy) diagnostikuje celoplošným novorozeneckým screeningem ze suché kapky krve, odebírané každému novorozenci ve 48.–72. hodině života. Principem vyšetření je stanovení hladiny TSH metodou Delphia.
1.3. Léčba vrozené hypotyreózy
Substituční léčba L-thyroxinem je u kongenitální hypotyreózy emergentní. Musí být zahájena co nejdříve, nejdéle do 14. dne života. Počáteční dávka L-thyroxinu je 10–15 μg/kg/den v jedné perorální dávce ráno nalačno s kontrolou hladin TSH a fT4 v nejdéle týdenních intervalech během prvního měsíce od zahájení léčby. Cílem je dosažení optimální substituční dávky, tj. fT4 v pásmu u horní hranice normy a hladiny TSH do 3,0 mIU/l. Dlouhodobě nedostatečná substituční dávka má za následek klinické příznaky hypotyreózy, dlouhodobá nadměrná dávka vede k urychlení kostního zrání s předčasnou kraniální synostózou a k projevům hypertyreózy.
Při včasném zahájení a správném vedení substituční léčby je celoživotní prognóza velmi příznivá.
2. ZÍSKANÁ HYPOTYREÓZA
Nejčastější získanou tyreopatií u dětí a dospívajících je autoimunitní onemocnění štítné žlázy (autoimmune thyroid disease, AITD). Dívky onemocní 8–10krát častěji než chlapci. Převážná část pacientů má lymfocytární (Hashimotovu) tyreoiditidu. Prvním projevem je měkká difuzní struma, která je palpačně neodlišitelná od jodopenické strumy. Při sonografickém vyšetření je textura štítné žlázy difuzně nehomogenní – obraz bývá popisován jako „pepř a sůl“. Biochemicky lze prokázat vysoké titry autoprotilátek – protilátek proti tyreoidální peroxidáze (anti-TPO) a protilátek proti lidskému tyreoglobulinu (anti-hTG). Aspirační biopsie tenkou jehlou není pro diagnózu potřebná; pokud je provedena, zjišťuje se lymfocytární infiltrace žlázy. Indikací pro aspirační biopsii tenkou jehlou je v současné době jen uzlová struma.
Po fázi eutyreózy přechází lymfocytární tyreoiditida zpravidla do fáze permanentní hypotyreózy. U některých pacientů může být přechodně funkce štítné žlázy nadměrná („hashitoxikóza“), což může někdy i vyžadovat podávání antityreoidální medikace.
Správná diagnóza hypotyreózy někdy není stanovena po řadu let. V těchto případech se u dítěte rozvíjí růstová retardace, dyslipidemie a obezita, zhoršení školního prospěchu, anemie, může být předčasná pseudopuberta (zkřížená afinita vysokých hladin TSH s LH receptorem) nebo naopak opožděná puberta. Typickým klinickým příznakem hypotyreózy je myxedém.
V konečném stadiu (po opakovaně zjištěném vzestupu hladiny TSH nad horní hranici fyziologického rozmezí) je definitivní terapií celoživotní substituce L-thyroxinem. Podáváme jej v tabletě v jedné ranní dávce, jeho poločas je 48–72 hodin. Obvyklé substituční dávky L-thyroxinu při léčbě hypotyreózy u dětí shrnuje tabulka 2.
Tab. 2. Obvyklé substituční dávky L-thyroxinu při léčbě hypotyreózy u dětí. 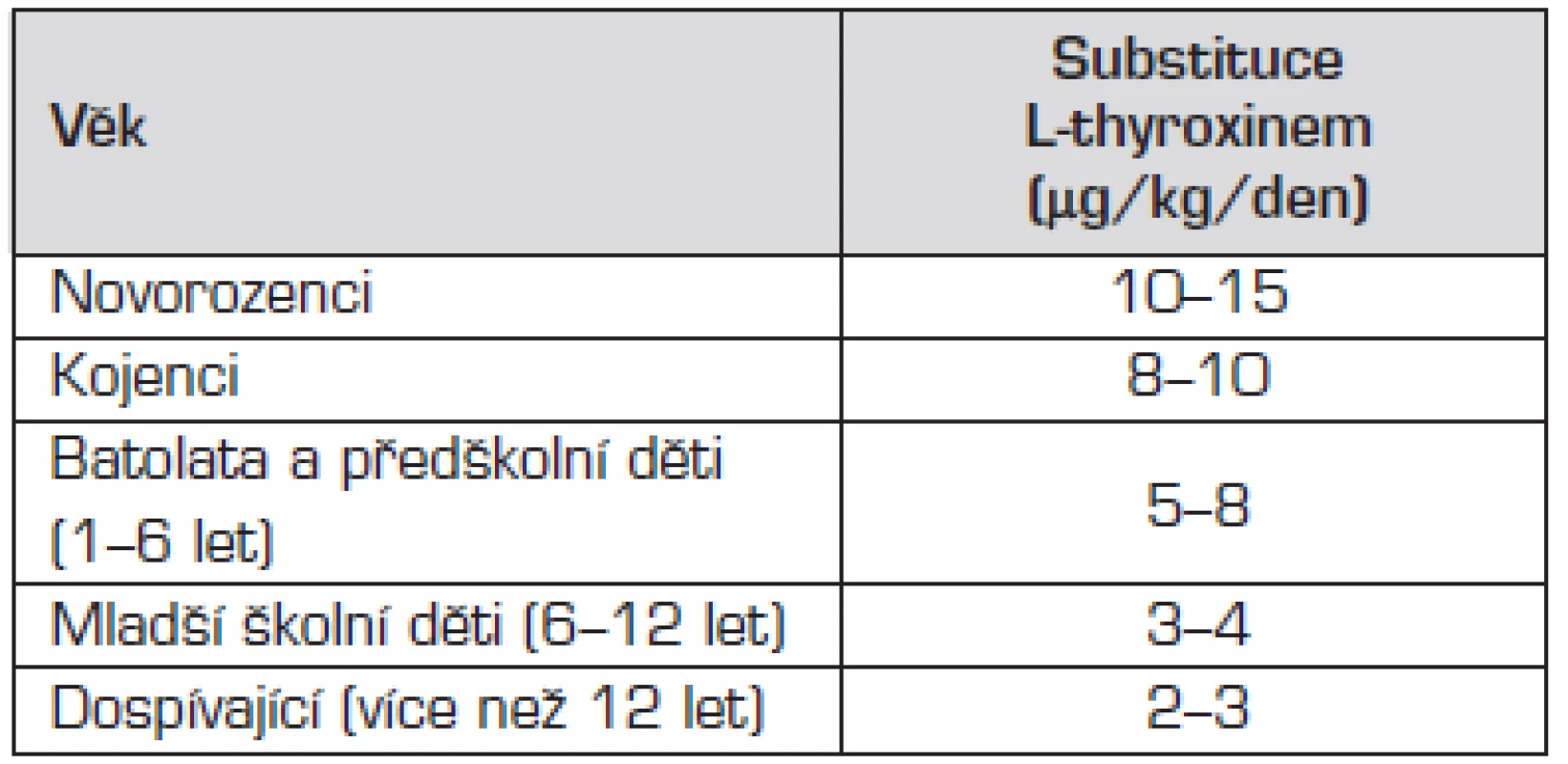
Lymfocytární tyreoiditida a jiné formy AITD jsou časté u dětí s jinými autoimunitními poruchami (nejčastěji při diabetes mellitus 1. typu a při celiakii) a při chromozomálních aberacích, zejména u Downova a Turnerova syndromu. U těchto skupin pacientů proto provádíme cílenou pravidelnou depistáž s cílem včas odhalit AITD. Pro detekci hypotyreózy slouží hladina TSH, pro detekci probíhajícího autoimunitního procesu stanovíme hladiny autoprotilátek.
3. NOVOROZENECKÁ HYPERTYREÓZA
Novorozenecká hypertyreóza (tyreotoxikóza) je vzácnou poruchou, která může ohrožovat novorozence na životě. Příčinou je transplacentární přenos mateřských protilátek proti TSH receptoru (TRAb, rTSH-ab) při známé nebo nerozpoznané mateřské tyreotoxikóze Gravesova-Basedowova typu. Tyto autoprotilátky mají stimulační účinek na nadprodukci tyreoidálních hormonů u fétu, novorozence a malého kojence, který je zprostředkován jejich vazbou na TSH receptory ve štítné žláze.
Již fétus má nadměrně stimulovaný metabolismus, což vede k intrauterinní růstové retardaci, fetální tachykardii, urychlení kostního zrání, zpravidla je přítomna struma a exoftalmus. Není-li brzy po narození stanovena diagnóza a zahájena konzervativní antityreoidální léčba, dojde u novorozence k metabolickému rozvratu a srdečnímu selhání. U léčených dětí se stav rychle upravuje a potřeba medikace klesá s postupným mizením mateřských autoprotilátek z cirkulace malého kojence, tj. během 2–3 měsíců života.
Vzácnou příčinou novorozenecké hypertyreózy je aktivační mutace genu pro TSHR.
4. TYREOTOXIKÓZA
Gravesova-Basedowova tyreotoxikóza je nejčastější příčinou hypertyreózy u dětí. Vyskytuje se nejčastěji v adolescenci, u dívek 8krát častěji než u chlapců. Patří mezi autoimunitní tyreopatie – je způsobena produkcí protilátek proti TSH-receptoru (TRAb, rTSH-ab), které mají na štítnou žlázu stimulační účinek.
Až 75 % nemocných má strumu, která může dosahovat značných rozměrů. Struma je silně prokrvená, na pohmat teplejší, lze palpovat i auskultovat vír. Typická je hyperkinetická cirkulace s tachykardií a systolickou hypertenzí se zvýšenou tlakovou amplitudou. V některých případech předcházejí před stanovením diagnózy hmotnostní úbytky. Pacientům se zpravidla zhoršuje školní prospěch, jsou dráždiví a nervózní, mají jemný třes rukou.
U 60 % dětí a adolescentů s Gravesovou-Basedowovou tyreotoxikózou jsou přítomny příznaky endokrinní orbitopatie s exoftalmem, který je způsoben zmnožením retrobulbární pojivové tkáně vlivem autoimunitní stimulace.
Pro laboratorní diagnózu hypertyreózy jsou příznačné vysoké hladiny volného tyroxinu (fT4) a snížené hladiny TSH, definitivní průkaz Gravesovy-Basedowovy tyreotoxikózy je založen na zvýšených hladinách TRAb.
Léčba Gravesovy-Basedowovy tyreotoxikózy se zahajuje tyreostatiky (methimazol, carbimazol, propithiouracyl). V případě výraznějších projevů hyperkinetické cirkulace se přidávají betablokátory na několik dní do rozvinutí účinků tyreostatik. Během 1–2 týdnů se zpravidla projevy hypertyreózy zmírňují, tyreostatickou léčbu ale ponecháváme na několik měsíců. Při opakovaných relapsech tyreotoxikózy se volí radikální řešení – v Evropě zpravidla chirurgický výkon (totální tyreoidektomie), v USA radioablace štítné žlázy radioaktivním jódem. Musí následovat celoživotní substituce L-thyroxinem.
5. JÓDOVÝ DEFICIT
Jód je základním mikronutrientem nutným pro syntézu hormonů štítné žlázy. Některé geografické oblasti včetně části území České republiky jsou na přirozené zdroje jódu ve stravě chudé a jejich obyvatelstvo je v případě příjmu neobohacené stravy z lokálních zdrojů v riziku jódového deficitu.
Deficit jódu v organismu vede ke snížení hormonální produkce, zpětnovazebným mechanismem stoupá hladina TSH, na což štítná žláza reaguje zvětšením svého objemu – rozvíjí se jodopenická struma. Pokud je těžké formě jódového deficitu vystavena těhotná žena, hrozí postižení plodu.
Program jódové suplementace byl v Československu zahájen již v 50. letech 20. století jodidací kuchyňské soli, čímž se podařilo odstranit nejzávažnější klinické formy deficitu jódu. Celosvětová eradikace jódového deficitu patří mezi základní cíle WHO. Podle kritérií WHO byl v ČR jódový deficit eradikován v roce 2000, příjem jódu na úrovni celé populace u nás v současné době odpovídá potřebám (tab. 3).
Tab. 3. Doporučený příjem jódu v jednotlivých věkových skupinách podle doporučení WHO, UNICEF a ICCIDD z roku 2001. 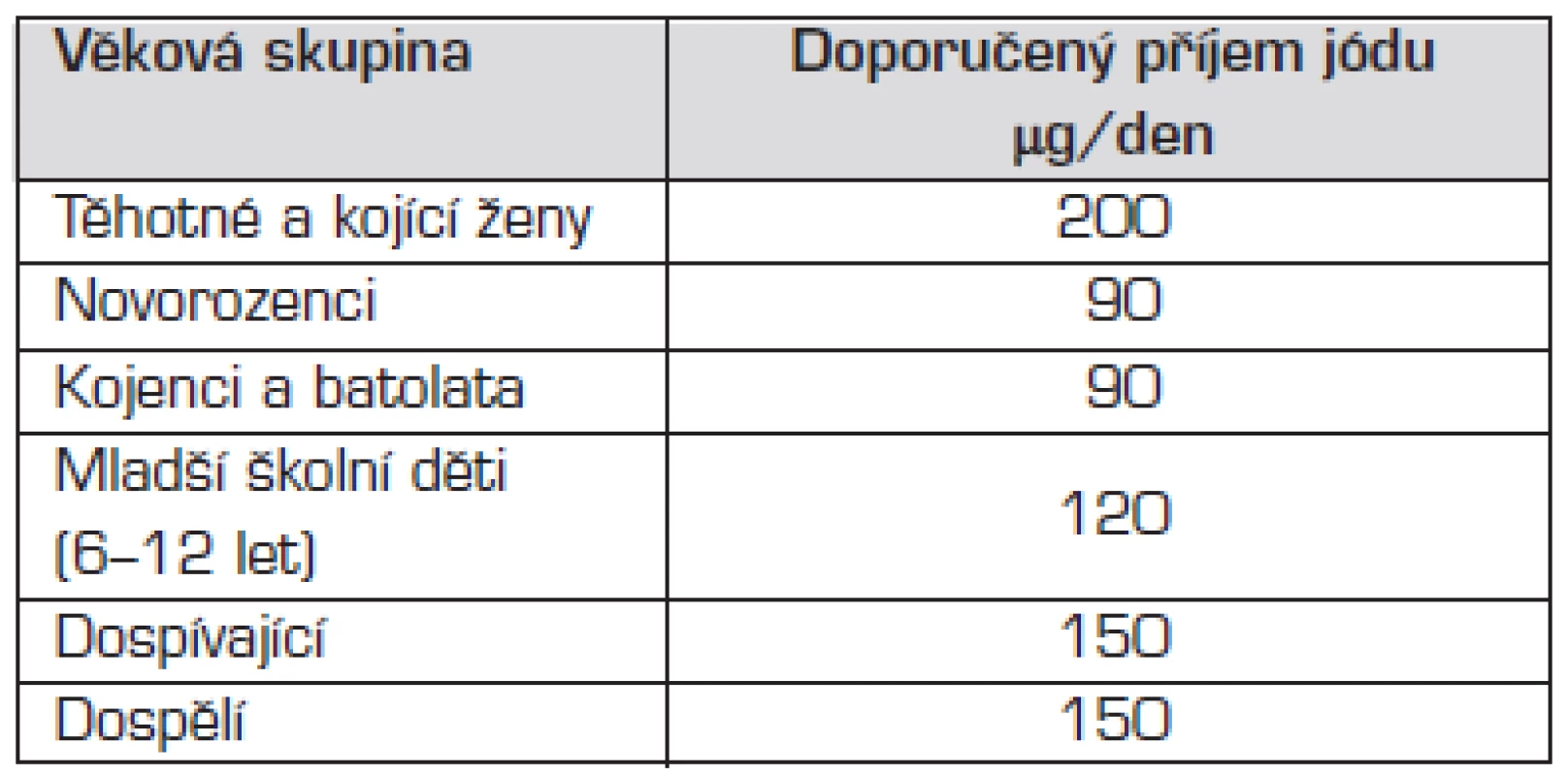
Difuzní struma (jodopenická) bývala v době endemického jódového deficitu nejčastější dětskou tyreopatií. V současné době jsou příčinou dětské difuzní strumy zpravidla autoimunitní tyreopatie.
Endemický kretenismus se díky celosvětovému úsilí o eradikaci jódového deficitu stal historickým pojmem. Jednalo se o děti s různě těžkým stupněm nezvratného poškození vývoje mozku následkem těžké jodopenie matky i plodu během těhotenství. Na našem území byl popisován ještě začátkem 20. století a dlouho byl směšován s kongenitální hypotyreózou, později označenou jako „sporadický kretenismus“ (viz také obr. 1). I v současné době se mohou vyskytovat mírnější poruchy kognitivních funkcí u dětí z regionů s mírnějším deficitem jódu, tzv. „kognitivní endemická dysfunkce“, která má za následek horší školní prospěch. Zvýšené dodávky jódu těhotným a kojícím matkám je třeba zajistit i při dostatku jódu v běžné populaci (viz tab. 3).
6. NÁDORY ŠTÍTNÉ ŽLÁZY A SYNDROMY MNOHOČETNÉ ENDOKRINNÍ NEOPLAZIE (MEN)
6.1. Uzlová struma a nádory štítné žlázy
Dětská uzlová struma má v 70 % příčinu benigní, ve 30 % se jedná o karcinom štítné žlázy.
U solitárních uzlů patří mezi benigní příčiny cysta nebo adenom, multinodózní struma je nejčastěji důsledkem déletrvající lymfocytární tyreoiditidy.
K odlišení benigní a maligní léze je po sonografickém vyšetření zpravidla indikována aspirační biopsie tenkou jehlou (FNAB, fine needle aspiration biopsy) s následným cytologickým vyšetřením. Při průkazu karcinomu, který je u dětí nejčastěji diferencovaný, papilární, se provádí totální tyreoidektomie s exstirpací regionálních lymfatických uzlin. V 50 % jsou již při stanovení diagnózy přítomny metastázy, většinou v uzlinách, v 5 % v plicích. Následuje léčba a trvalá péče v centru pro malignity štítné žlázy. Prognóza papilárního karcinomu štítné žlázy je poměrně příznivá.
Medulární karcinom z C-buněk má familiární výskyt s autozomálně dominantním přenosem. Může být součástí syndromu mnohočetné endokrinní neoplazie (MEN) typu 2. Jeho prognóza je méně příznivá, proto je v postižených rodinách indikováno molekulárně genetické vyšetření a v případě pozitivního nálezu preventivní totální tyreoidektomie.
6.2. Syndromy mnohočetné endokrinní neoplazie
Mnohočetné endokrinní neoplazie (MEN) jsou skupinou autozomálně dominantně dědičných chorob, při kterých je hyperplazií nebo nádorem postižena více než jedna endokrinní žláza. Přehled jednotlivých MEN syndromů uvádí tabulka 4.
Tab. 4. Klinické projevy jednotlivých syndromů mnohočetné endokrinní neoplazie (MEN). 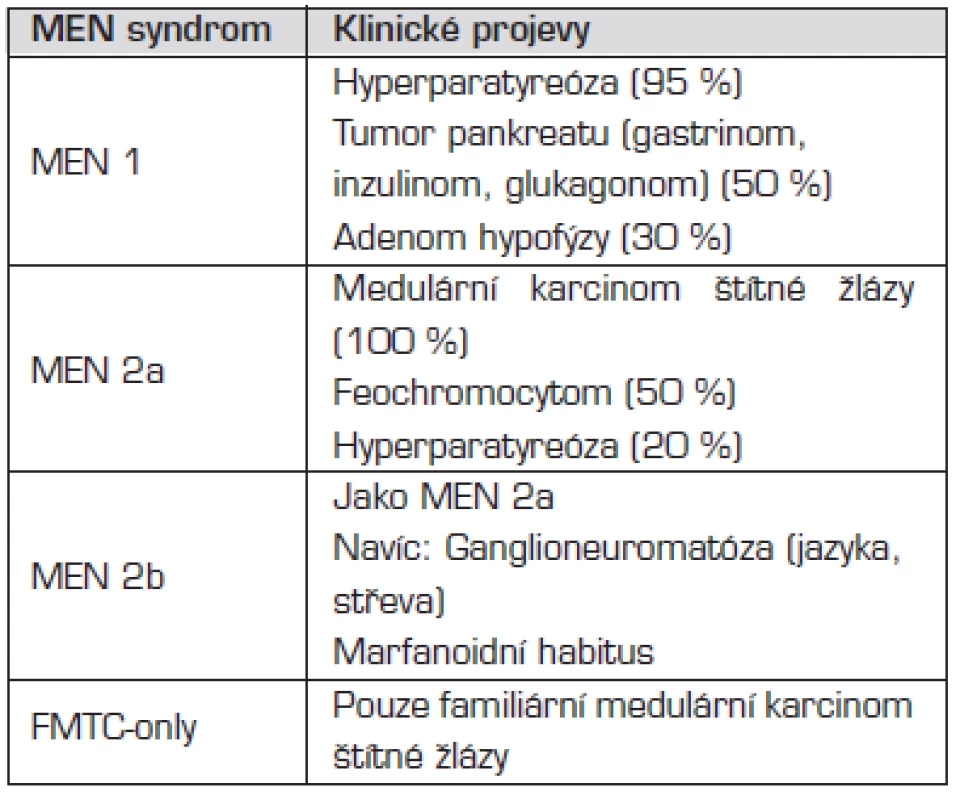
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2012 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Orální lichen planus v kostce: Jak v praxi na toto multifaktoriální onemocnění s různorodými symptomy?
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
-
Všechny články tohoto čísla
- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Využitie ultrasonografie pri diagnostike akútnej pyelonefritídy
- Hypothalamo-hypofyzární dysfunkce u dětí a dospívajících po mozkovém úrazu – prospektivní sledování
- Gangliozidóza GM1 asociovaná s mnohopočetnými mongolskými škvrnami
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
- Prenatálne a neonatálne prostredie a ich dôsledky na vývoj dieťaťa
- Čtení o logopedii – 2. část
- X. český pediatrický kongres s mezinárodní účastí
- Poruchy kalciofosfátového metabolismu
- Poruchy funkce nadledvin
- Poruchy funkce štítné žlázy
- Prevence návykových nemocí v rodině
- K článku „Cizí těleso v gastrointestinálním traktu a současná diagnostická a terapeutická doporučení“
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Poruchy funkce nadledvin
- Znamená postnatální záchyt dilatace ledvinové pánvičky větší riziko infekce močových cest?
- Poruchy kalciofosfátového metabolismu
- Totální anomální návrat plicních žil – méně obvyklá příčina neprospívání u kojence
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



