-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření
The autopsy of the brain and spinal cord in the diagnosis of neurodegenerative diseases - a practical approach to optimize the examination
Brain and spinal cord autopsies aimed at neuropathological diagnosis of the causes of dementia and motor abnormalities are of increasing importance. Neuropathological brain examination is often the only diagnostic modality capable of definitive diagnosis of a neurodegenerative disease and thus serves as invaluable feedback for clinicians and biochemical and imaging diagnostics. The brain and spinal cord autopsy is performed following a standardized protocol and its goal is to sample all diagnostically relevant structures. Subsequent diagnostics are then done using standard and special histologic stainings, however state-of-the-art diagnostics can be achieved only using immunohistochemical methods. The purpose of the article is to provide the pathologists with a brief and practical guideline for brain and spinal cord autopsy when diagnosis of a neurodegenerative disease is suspected.
Keywords:
dementia - neurodegenerative diseases - brain autopsy
Autoři: Zdeněk Rohan; Radoslav Matěj
Působiště autorů: Centrum pro výzkum, diagnostiku a léčbu neurodegenerativních onemocnění a Národní referenční laboratoř TSE-CJN, Thomayerova nemocnice, Praha ; Oddělení patologie a molekulární medicíny
Vyšlo v časopise: Čes.-slov. Patol., 51, 2015, No. 4, p. 199-204
Kategorie: Přehledový článek
K tomuto textu naleznete obrazové eSupplementum na www.CSpatologie.cz
Souhrn
Význam pitvy mozku a míchy u diagnózy neurodegenerativních onemocnění, která se projevují jako demence, poruchy chování či různě vyjádřené poruchy hybnosti, je zásadní formou zpětné vazby pro ošetřující lékaře, protože neuropatologické vyšetření mozku je pro většinu neurodegenerativních onemocnění jedinou diagnostickou modalitou schopnou poskytnout definitivní diagnózu. Vlastní pitva mozku a míchy probíhá podle standardizovaného protokolu založeného na odběru přesně definovaných struktur. Následná diagnostika se opírá o využití standardních, speciálních a zejména standardizovaných imunohistochemických metod, které umožní přesné zařazení neurodegenerativních onemocnění. Účelem tohoto sdělení je seznámit patology se základním postupem, jak přistupovat k pitvě mozku a míchy při klinické diagnóze neurodegenerativního onemocnění a zájmu ošetřujícího lékaře o podrobné neuropatologické vyšetření.
Klíčová slova:
demence - neurodegenerativní onemocnění - pitva mozku
Neuropatologická pitva mozku při klinické diagnóze neurodegenerativního onemocnění je často opomíjenou součástí diagnostiky těchto socioekonomicky závažných a v současné době stále nevyléčitelných onemocnění nejen v ČR ale i celosvětově. Podrobné histopatologické vyšetření mozku se stanovením definitivní diagnózy je nezbytnou podmínkou pro archivaci tkání k výzkumným účelům, které jsou zásadní pro poznání etiopatogeneze neurodegenerativních onemocnění a které jsou nezbytné pro vývoj nových diagnostických a terapeutických přístupů. Tak jako v dalších oblastech medicíny, je i u neurodegenerativních onemocnění snaha o zavádění lepších a spolehlivějších diagnostických metod, zejména přesnějších a výtěžnějších prediktivních a prognostických biomarkerů. Diagnostika většiny neurodegenerací se opírá o splnění definovaných klinických diagnostických kriterií podrobným neurologickým vyšetřením doplněných výsledky neuropsychologických, neuroradiologických, neurofyziologických, neurogenetických a biochemických vyšetření. Přestože jsou kvalitní klinická a neuropsychologická vyšetření často dostačující k dosažení klinické diagnózy, existuje stále nemalé procento případů, u kterých je klinická diagnóza odlišná od definitivní diagnózy stanovené post mortem. Navíc, u řady případů lze neuropatologickým vyšetřením odhalit kombinace více neurodegenerací či další faktory, které mohly modifikovat průběh onemocnění, výsledky vyšetřovacích metod a účinky léčby. Klinicky nediagnostikovaná či poddiagnostikovaná neurodegenerativní onemocnění se také mohou přímo či nepřímo podílet na průběhu léčby ve zdravotnickém zařízení či domácí léčbě (nespolehlivá anamnéza, prudké zhoršení kognitivního stavu po celkové anestezii, tzv. „delirantní stavy“, pády, noncompliance pacienta při léčbě chronických onemocnění či dokonce až fatální následky podávání neuroleptik u pacientů s demencí s Lewyho tělísky). V případě klinických studií zabývajících se léčbou neurodegenerací či zaváděním nových diagnostických kritérií a modalit je zpětná vazba v podobě definitivního potvrzení nutným předpokladem kvality těchto studií. V řadě případů je propitvanost velmi nízká a toto pak zcela zásadně oslabuje validitu jinak velmi kvalitně vedených studií. Neméně důležitým a eticky problematickým je také fakt, že nezanedbatelná část neurodegenerativních onemocnění s sebou nese riziko dědičného přenosu, navíc často s variabilní penetrancí a expresivitou. Pitva mozku je tak u vybraných případů zcela zásadní formou zpětné vazby pro diagnostikující kliniky, ať už na úrovni základní zdravotní péče, či z hlediska vědecko-výzkumných analýz. Navíc se v dnešní době bohužel stále více prosazuje potřeba upřesnit neustále populárnější medicínsko-právní aspekt pacientů stižených poruchami kognitivních funkcí.
OBECNÉ INDIKACE K PITVĚ MOZKU
Pitva mozku je žádoucí u každého pacienta s klinickým údajem o kognitivním deficitu či se symptomatologií silně naznačující možnost přítomnosti neurodegenerativního onemocnění a dále také u pacientů s klinicky „jistou“ diagnózou neurodegenerativního onemocnění. V ideálním případě tyto informace pocházejí od neurologů či psychiatrů, nicméně řada pacientů projde během pobytu ve zdravotnickém zařízení několika různými odbornostmi a v průvodních listech k pitvě se pak lze často dočíst o „Alzheimerově nemoci“ či „demenci Alzheimerova typu“, „senilní demenci“, „aterosklerotické demenci“, „amnestickém syndromu“, „poruše paměti“, „delirantních stavech“ „extrapyramidové“ či „mozečkové symptomatologii“ atd. Přesný význam těchto a dalších pojmů a úsloví je často nejasný a zavádějící. Důležitá je i skutečnost, že diagnóza většiny neurodegenerací (kromě např. Huntigtonovy nemoci, některých spinocerebelárních ataxií a za určitých okolností amyotrofické laterální sklerózy s definovanou genetickou abnormitou) se na klinické úrovni uvádí s mírou pravděpodobnosti. Při splnění definovaných klinických kritérií lze za života pacienta dospět k diagnóze buď „možné“, nebo „pravděpodobné“, definitivní diagnózu poskytne právě až pitva a specializované neuropatologické vyšetření mozku. V jasně definovaných případech lze intravitálně rovněž dospět k definitivní diagnóze vyšetřením mozkové biopsie.
Není-li žádost o pitvu mozku ze strany kliniků explicitně vyjádřena, je vhodné zvážit odběr mozku k neuropatologickému vyšetření u všech pacientů mladších 65 let s klinicky potvrzeným kognitivním deficitem, poruchami motorického neuronu či jinými poruchami hybnosti a nejasným neurologickým nálezem, u pacientů s náhle vzniklou a rychle progredující poruchou kognitivního stavu, kdy je nutno uvažovat i o možnosti prionového onemocnění, s cytologicky či biochemicky abnormálním nálezem v mozkomíšním moku a dále také s neurologickou symptomatologií při nádorovém onemocnění či při klinicky nejasných poruchách hybnosti bez vysvětlujícího nálezu na CT či magnetické rezonanci. Pitva mozku je rovněž zásadní u pacientů léčených kognitivy či levodopou, zejména pak v případě atypické či neočekávané reakci na léčbu. U pacientů vyššího věku (nad 65 let) pak přibývá smíšených patologií – většinou se jedná o kombinaci vaskulárních a primárních neurodegenerativních změn či kombinaci více primárních onemocnění (např. kombinace Alzheimerovy nemoci a nemocí s Lewyho tělísky) (1,2). V těchto případech je neuropatologicky často obtížné či nemožné s jistotou určit míru podílu jednotlivých složek na klinickém obrazu, přesto se však může na základě klinicko-patologické korelace objasnit např. atypický průběh onemocnění (3), příčinu neúspěchu podávané léčby či abnormálních biochemických nálezů v mozkomíšním moku či na zobrazovacích metodách (4,5).
PITVA MÍCHY
K pitvě míchy (spolu s pitvou mozku, viz níže) přistupujeme při klinické diagnóze onemocnění motorického neuronu (typickým, ne však jediným, příkladem je amyotrofická laterální skleróza – ALS), demyelinizujících onemocnění (roztroušená skleróza mozkomíšní, neuromyelitis optica, akutní diseminovaná encefatomyelitida – ADEM atd.), nejasných neuroinfekcí či polyneuropatií, spinální muskulární atrofie (SMA), spinocerebelárních ataxií (SCA) či dalších vzácných jednotek a metabolických vad (adrenoleukodystrofie, střádavá onemocnění atp). Odběr míchy je rovněž vhodný u pacientů s neurologickou symptomatologií naznačující postižení v rámci deficitu vitamínu B12 či folátu, ať už při selektivním deficitu nebo generalizované malnutrici. V neposlední řadě je třeba zvážit odběr míchy také u pacientů s neurodegenerativními onemocněními projevující se autonomní dysfunkcí (např. Parkinsonova nemoc, mnohotná systémová atrofie – MSA) či tzv. frontotemporální demencí (FTD), která může být ve významné části případů doprovázena klinicky méně nápadným postižením motorického neuronu.
Vlastní pitva míchy se provádí v rámci standardní pitvy, nejčastěji ventrálním přístupem. Míchu lze vyjmout z páteřního kanálu od kaudy až do cca poloviny krční míchy; kraniální segmenty krční míchy procházející oblastí mezi foramen magnum a segmenty C1 a C2 je lépe vyjmout spolu s mozkem (ideálně pomocí myelotomu, většinou postačí klíčkovací nůž, kterým z baze, skrz foramen magnum, přetneme krční míchu). Mícha se v nativním stavu nijak dále nevyšetřuje, ale vloží se spolu s mozkem do nádoby s fixativem a po 2–4 týdnech je přikrojena spolu s mozkem v jedné době.
Přikrajování míchy začíná podélným rozstřižením obalů a identifikací klíčových struktur – lumbální a cervikální intumescence, ve kterých jsou v předních rozích motorické neurony inervující svaly horních a dolních končetin. Vlastní odběr pak sestává z příčných, na dlouhou osu kolmých, řezů z lumbálních segmentů (většinou postačí dva, kaudální a kraniální segment), ze segmentů hrudní míchy (většinou tři, kaudální, střední a kraniální) a z krční míchy (opět tři, kaudální, střední a kraniální část). Sakrální a kostrční segmenty se standardně nevyšetřují, nicméně odběr sakrálních segmentů je možný a je vhodné jej zvážit např. u pacientů s dokumentovanou dysfunkcí svěračů či močového měchýře, např. při roztroušené skleróze či MSA. V případě podezření z onemocnění motorického neuronu je možno provést na cca 10 mm dlouhém úseku lumbální a krční míchy podélný řez přes přední rohy (rovnoběžně s canalis centralis), čímž se do plochy řezu dostane výrazně větší množství diagnosticky relevantních, jinak atrofických motorických neuronů. Přesné určení jednotlivých míšních segmentů je často náročnější, nicméně proveditelné. Nejlépe je začít identifikací posledního silného spinálního nervu krční míchy – ve většině případů se jedná o nerv C7, pod ním by pak měl být výrazněji tenčí průběh nervu Th1, od kterého pak lze odpočítat další kaudální i kraniální segmenty.
Zpětná orientace v již přikrojené míše může být komplikovaná, a proto je třeba při prvotním přikrajování zvážit zablokování reprezentativních úseků všech míšních segmentů (viz výše).
Tab. 1. Doporučený náběr u známé klinické symptomatologie. 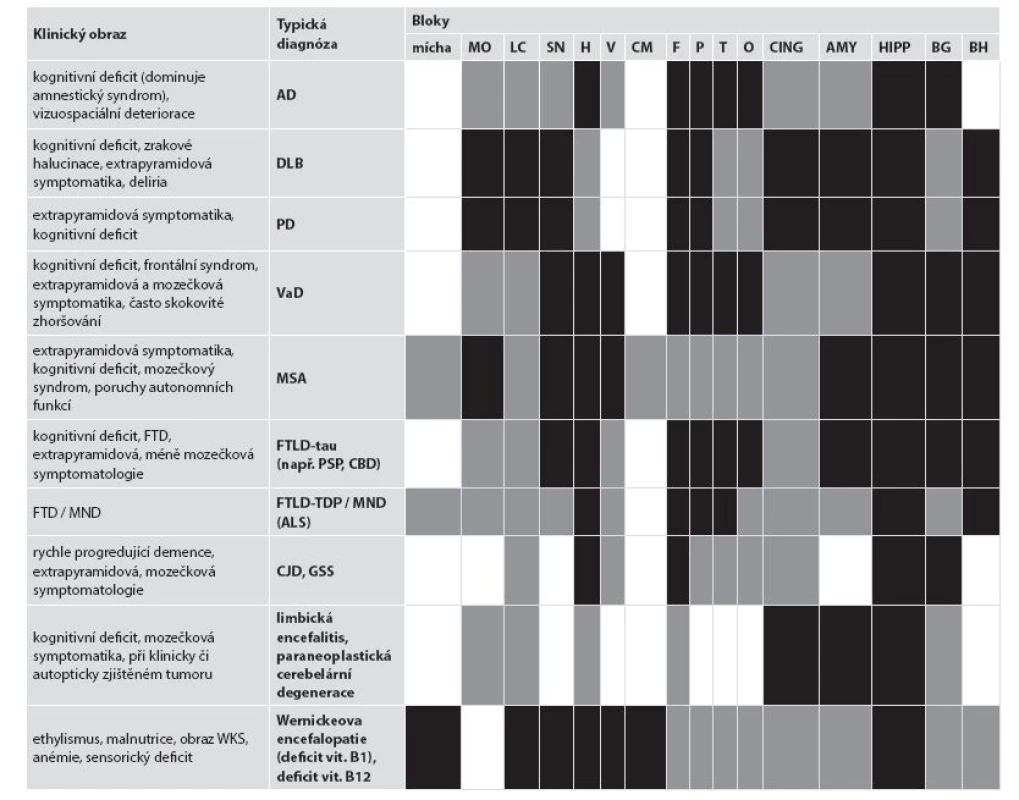
Černě - obligatorní pro diagnózu, šedě - obligatórní pro diferenciální diagnostiku, bíle - vhodné ke kompletnímu vyšetření AD Alzheimerova nemoc; ALS amyotrofická laterální skleróza; AMY amygdala; BG bazální ganglia; BH bílá hmota – centrum semiovale; CBD kortikobazální degenerace; CING přední gyrus cinguli; CJD Creutzfeldtova-Jakobova nemoc; CM corpora mammillaria; DLB demence s Lewyho tělísky; F frontální kortex; FTD frontotemporální demence; FTLD-tau/-TDP frontotemporální lobární degenerace s tau/TDP-43 pozitivními inkluzemi; GSS Gerstmannův-Sträusslerův-Scheinkerův syndrom; H hemisféra mozečku; HIPP hippocampus přední + zadní; LC locus coeruleus; MND onemocnění motorického neuronu; MO medulla oblongata; MSA multisystémová atrofie; O okcipitální kortex; P parietální kortex; PD Parkinsonova nemoc; PSP progresivní supranukleární obrna; SN substantia nigra; T temporální kortex; V vermis mozečku; VaD vaskulární demence; WKS Wernickeův-Korsakoffovův syndrom. Získané řezy barvíme luxolovou modří nebo dalšími metodami pro průkaz myelinu. V případě podezření na MND/ALS je vhodné nechat udělat z míchy 10 µm řezy, ve kterých je pak skleróza postranních míšních provazců lépe patrná. Stříbřící metody je možno využít pro orientační průkaz inkluzí, nicméně v současné době, kdy je potřeba dalšího imunohistochemického vyšetření, se nutnost zhotovení preparátů impregnačními metodami významně snižuje.
PITVA MOZKU
Základní indikací pro pitvu mozku jsou jakákoli neurodegenerativní onemocnění, event. léze spojené s potřebou vyhledat charakteristicky postižené struktury, např. hipokampy při hypoxicko-ischemických postiženích či epilepsii, corpora mammillaria a periakvaduktální šeď mesencefala při Wernickeově encefalopatii způsobené deficitem thiaminu.
Vyjmutí mozku z dutiny lební se provádí rutinním způsobem včetně jeho zvážení a standardního makroskopického popisu. U podezření na možnou genetickou zátěž (rodinná anamnéza kognitivního či motorického postižení u příbuzných nejen v přímé linii, onemocnění motoneuronu v rodině u pacienta s FTD či naopak nebo u pacienta s neurodegenerací, která se projevila před nebo těsně po dosažení 65. roku věku) je důležité odebrat tkáň vhodnou pro eventuální molekulárně-genetickou diagnostiku. V tomto případě postačí odebrat kostní dřeň z žebra (vymáčknout kleštěmi) do „eppendorfky“ či odebrat některý parenchymatózní orgán a zmrazit. Dále je možno před vlastní fixací odebrat nativní mozkovou tkáň ke zmražení (do –20 °C nebo –80 °C). Tento odběr postačí do 5,0 ml zkumavky (cca 1 cm3 tkáně) a jeho cílem je získat šedou hmotu, nejčastěji z pravého frontálního laloku či z hemisféry mozečku pro molekulárně-genetickou diagnostiku (standardně u podezření na prionová onemocnění, pro výzkumné účely u ostatních onemocnění). Odběr mozkomíšního moku (CSF) jehlou přes corpus callosum z mozku uloženého in situ se provádí spíše z výzkumných důvodů, z diagnostických důvodů je potřeba pouze při neprovedení lumbální punkce a vyšetření CSF intravitálně.
Před vložením do fixačního roztoku je třeba naříznout corpus callosum, aby mohlo fixativum proniknout i do centrálních částí mozku. Jako fixativum slouží 10 % neutrální pufrovaný formol, doba fixace je nejméně 2 týdny a neměla by přesáhnout 6 týdnů, optimum jsou 3 – 4 týdny. Mozek vkládáme do fixační nádoby bazí směřující vzhůru – deformaci ve fixační nádobě nelze většinou zabránit, nicméně mírná deformace konvexity hemisfér není zásadní překážkou pro následné přikrojení a diagnostiku, na rozdíl od deformace prodloužené míchy a mostomozečkové oblasti. Zavěšení mozku v nádobě za a. basilaris či přidání solutů (většinou kuchyňské soli) do fixativa za účelem zvýšení jeho hustoty a plování mozku v nádobě není třeba a může být někdy i kontraproduktivní.
Kromě mozku je vhodné se v některých případech zaměřit na odběr vzorků z dalších orgánů. Mezi typické patologie sekundárně postihující mozek a které mohou napodobovat primární neurodegenerace patří zejména kardiovaskulární nemoci a jaterní či renální insuficience. Méně časté jsou paraneoplastické syndromy (zejména u malobuněčného karcinomu plic, často i překvapivě malých rozměrů), mezi které patří hlavně limbická encefalitida projevující se kognitivním deficitem napodobujícím velmi přesvědčivě neurodegenerativní onemocnění a tzv. pareneoplastická cereberální degenerace s převažující mozečkovou symptomatologií a přítomností paraneoplastických protilátek v séru (např. anti-Yo, anti-Hu). U onemocnění motorického neuronu je potřeba odebrat příčně pruhované svaly končetin (např. bérce, předloktí), bránice, mezižeberní svaly a jazyka pro zdokumentování přítomnosti a míry neurogenní atrofie.
Diagnosticky relevantní struktury pro daný typ neurodegenerativního onemocnění kmene a mozečku jsou shrnuty v tabulce č. 1 a v přehledových článcích (6-9). Základní odběr zahrnující struktury mozku potřebné pro základní diferenciální diagnostiku neurodegenerací a jejich kombinací lze shrnout (obr. 1 + eSupplementum na www.CSpatologie.cz):
Obr. 1. Schéma základního odběru při pitvě mozku. 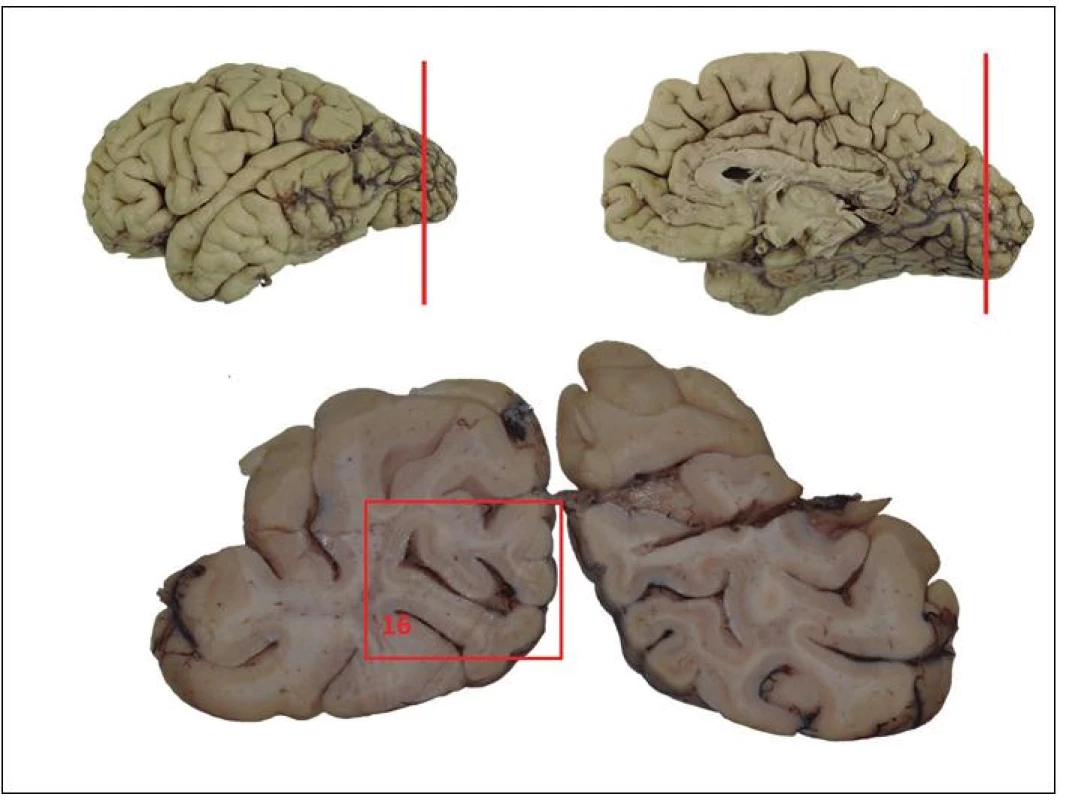
1 segment C1; 2 bulbus; 3 prodloužená mícha; 4 pons na úrovni locus coeruleus; 5 mesencephalon na úrovni odstupu n. III. se substantia nigra; 6 hemisféra mozečku; 7 vermis; 8 frontální kortex (střední frontální závit); 9 gyrus cinguli; 10 bazální ganglia – striatum; 11 somatomotorický kortex; 12 horní temporální závit (T1); 13 střední a dolní temporální závit (T2,3); 14 přední hippocampus; 15 zadní hippocampus; 16 primární zraková kůra - Segment C1
- Bulbus
- Prodloužená mícha
- Pons na úrovni locus coeruleus
- Mesencephalon na úrovni odstupu n. III. se substantia nigra
- Hemisféra mozečku
- Vermis
- Frontální kortex (střední frontální závit)
- Gyrus cinguli
- Bazální ganglia – striatum
- Somatomotorický kortex
- Horní temporální závit (T1)
- Střední a dolní temporální závit (T2, 3)
- Přední hippocampus
- Zadní hippocampus
- Primární zrakový kortex (V1)
Pitva mozku začíná jeho makroskopickým popisem, následně je oddělen kmen na úrovni mesencephala. Tento řez je veden cca 5 mm kaudálně od corpora mammillaria, na úrovni odstupu n. III. V tomto místě (úroveň odstupu n. III.) se standardně odebírají bloky obsahující pars compacta substantiae nigrae s periakakvaduktální šedí mesencephala a většinou také nucleus ruber patrné na řezu jako hnědočervené okrouhlé jádro dorsálně od substantia nigra. Dále je možno postupovat dvěma způsoby – oddělit mozeček řezem přes pedunkuly a přes velum medullare superior nebo mozeček spolu s kmenem nařezat příčnými řezy kolmými na dlouhou osu kmene. Hemisféry mozku lze poté krájet v koronární rovině buď obě najednou, nebo oddělit hemisféry od sebe řezem vedeným ve střední čáře v linii vedoucí přes fissura interhemisphaerica, mezi corpora mammillaria a přes Sylviův kanál a zpracovat každou hemisféru zvlášť (technicky snazší varianta). Ještě před prováděním koronárních řezů je vhodné odebrat kortikální oblasti, jejichž identifikace je z koronárních řezů mnohdy obtížnější. První řez hemisférou by měl být kolmý na rostrokaudální osu baze mozku a vést skrz nebo těsně za či před corpora mammillaria. Další řezy se pak provádějí rovnoběžně s řezem prvním, v 5 – 10 mm odstupech. Toto rozmezí zajistí, že většina relevantních struktur bude v řezech prakticky vždy zastižena, některé struktury (např. amygdala) ale mohou být v tloušťce řezu skryty, v těchto případech je možno cílovou oblast mozku jednoduše vytnout a řezem „zúžit“.
Při odebírání korových oblastí z povrchu hemisfér je třeba se pokusit provést odběr tak, aby byla linie řezu vedena kolmo na průběh gyrů, v případě okcipitálního kortexu pak kolmo na průběh sulcus collateralis. Tím bude zajištěna správná topografie kůry v mikroskopickém obraze umožňující přesnou lokalizaci patologických změn v rámci jednotlivých vrstev neokortexu.
Výše uvedené schéma odběru počítá s mozkem bez makroskopicky patrných změn (maximálně s drobnými dutinkami v oblasti bazálních ganglií). Samozřejmostí je odběr jakékoliv makroskopicky podezřelé léze s uvedením její co nejpřesnější lokalizace, charakteru a velikosti.
Neuropatologický odběr mozku je navržen a standardizován tak, aby byly odebírány neuroanatomicky i mikroskopicky jasně a přesně definovatelné struktury, které lze na sklíčku, po chvíli praxe, poměrně dobře identifikovat per fenestram či mikroskopicky. I přesto je třeba již během odběru každý blok identifikovat nebo alespoň přibližně popsat jeho lokalizaci, aby nedošlo k záměně zejména neokortikálních oblastí.
Přesná topografie patologických změn je totiž u řady neurodegenerací zásadní pro jejich správnou diagnózu a staging. Například specifická lokalizace jedné či dvou a více ischemických lézí (tzv. strategický infarkt) může být plně zodpovědná za klinický obraz věrně napodobující parkinsonský či amnestický syndrom bez přítomnosti specifické primární neurodegenerace (typicky nemoci s Lewyho tělísky či Alzheimerovy nemoci).
Velmi vhodná je proto také fotodokumentace, která umožní zachytit rozsah atrofie kůry či jiných struktur, v případě četnějších nejasných lézí pak umožní jejich přesnou lokalizaci, která napomůže interpretaci neuropatologického nálezu a optimální korelaci mezi neuropatologickým, neuroradiologickým a klinickým nálezem.
Standardní barvící metody zahrnují hematoxylin-eosin a barvení na myelin (luxolová modř). Ze speciálních metod lze k záchytu depozit či inkluzí využít stříbřící metody, z vlastní zkušenosti se nejlépe osvědčil AgNOR, složitější stříbřící metody (např. Bielschowsky či Gallyas) nejsou z hlediska „cost-benefit“ přínosné. Hodnota AgNOR spočívá zejména v určitém „screeningovém“ vyšetření specifických oblastí pro záchyt amyloidových plak u Alzheimerovy nemoci. Pro záchyt dalších neurodegenerativních onemocnění je stříbření zcela nedostačující metodou, v éře speciálních protilátek proti proteinovým depozitům téměř metodou obsolentní. Další speciální metody použitelné pro detekci amyloidových plak (zejména barvení kongo červení či thioflavinem S) se užívají výrazně méně a jsou rovněž nahrazovány imunohistochemickými metodami.
Současná neuropatologická diagnostika je postavena na širokém panelu imunohistochemických protilátek namířených proti proteinům, často patologicky modifikovaným, jejichž přítomnost je v řadě případů pro danou neurodegeneraci definující (10). Imunohistochemický panel (tabulka č. 2) zahrnuje protilátky namířené proti molekulám zapojenými v procesu degradace proteinů (ubikvitin, p62), které mohou u řady neurodegenerací tvořit nespecifickou součást inkluzí, či proti specifickým komponentám inkluzí a depozit: 1) hyperfosforylovaný protein tau a jeho 3R - a 4R-isoformy, 2) amyloid-beta, 3) alfa-synuklein, 4) fosforylovaný protein TDP-43, 5) prionový protein, 6) huntigtin (či méně specifický polyQ) a další protilátky (např. FUS, ubiquilin a nově zaváděné protilátky proti proteinům z dipeptidových repetic polyGA, polyGP a polyGR či genetických defektů jako C9orf72(11)). V případě pozitivity daného markeru je třeba vyhodnotit rozsah postižení v jednotlivých oblastech mozku a zároveň vyhodnotit morfologii inkluzí či depozit. V řadě případů je postižení neurodegenerativními nemocemi kombinované a lze tedy diagnostikovat kombinaci dvou „čistých“ neurodegenerací (např. Alzheimerovy nemoci a nemoci s Lewyho tělísky), časté jsou však i případy do různé míry vyjádřených, často nespecifických a multisystémových patologií daných patologicky konformovaných proteinů.
Tab. 2. Imunohistochemický panel potřebný pro diferenciální diagnostiku neurodegenerací. 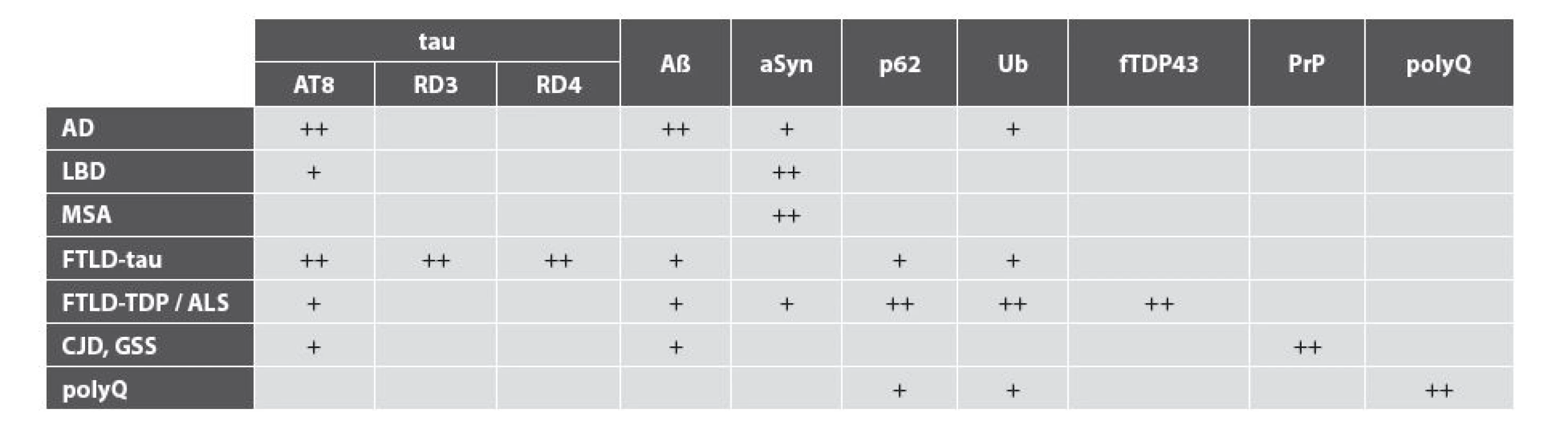
Aß amyloid beta; AD Alzheimerova nemoc;ALS amyotrofická laterální skleróza; aSyn alfa-synuklein; CJD Creutzfeldtova-Jakobova nemoc; fTDP-43 fosforylovaný TDP-43; LBD nemoci s Lewyho tělísky; FTLD-tau/-TDP frontotemporální lobární degenerace s tau/TDP-43 pozitivními inkluzemi; GSS Gerstmannův- Sträusslerův-Scheinkerův syndrom; MSA multisystémová atrofie; polyQ nemoci s polyglutaminovými expanzemi; PrP prionový protein;Ub ubiquitin; ++ obligatorní pro diagnózu; + vhodné PRAKTICKÉ ASPEKTY
Odběr mozku a míchy do nádoby s fixativem lze provést rutinním způsobem a materiál takto zaslat konzultujícímu pracovišti. Vlastní pitvu mozku lze však provést prakticky na jakémkoliv pracovišti a ke konzultačnímu vyšetření zaslat parafínové bloky spolu s podrobnou klinickou dokumentací. V tomto případě je důležité při odběru respektovat možnou diferenciální diagnostiku a do parafinových bloků odebrat dostatečný počet diagnosticky relevantních struktur.
ZÁVĚR
Pitva mozku a míchy je důležitou součástí autoptického vyšetření pacientů s klinickou diagnózou demence či pohybových abnormalit. Vlastní pitva mozku a míchy není v zásadě obtížná, je však potřeba ji provádět standardizovaně a zajistit navazující plnohodnotné neuropatologické vyšetření, které jediné může potvrdit či vyvrátit klinickou diagnózu neurodegenerativního onemocnění.
Současný stav poznání na poli neurodegenerací potvrzuje, že přesná diagnostika na morfologické a molekulárně-genetické úrovni je zásadní zpětnou vazbou pro zainteresované obory a zejména pro navazující klinické studie léčiv či biomarkerů. Bez přesně stanovené diagnózy neurodegenerativního onemocnění a následné retrospektivní klinicko-neuropatologické korelace nelze objektivně hodnotit účinky nových potenciálních kauzálních léčiv ani testovat nové klinicky významné biomarkery.
Úlohou každého patologa je zajistit cenný materiál mozkové tkáně pro vyšetření neurodegenerativních onemocnění ať už správnou fixací relevantních tkání či dostatečným a v první řadě standardizovaným odběrem relevantních struktur.
PODĚKOVÁNÍ
Práce byla částečně podpořena granty IGA MZ ČR NT 12094-5/2011 a IGA NT 14145-3/2013
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
doc. MUDr. Radoslav Matěj, Ph.D.
Oddělení patologie a molekulární medicíny
Thomayerova nemocnice
Vídeňská 800, 14059 Praha 4 – Krč
tel.: +420 261 083 141
e-mail: radoslav.matej@ftn.cz
Zdroje
1. Kovacs GG, Botond G, Budka H. Protein coding of neurodegenerative dementias: the neuropathological basis of biomarker diagnostics. Acta Neuropathol 2010; 119(4): 389-408.
2. Kovacs GG, Milenkovic I, Wohrer A, Hoftberger R, Gelpi E, Haberler C, et al. Non-Alzheimer neurodegenerative pathologies and their combinations are more frequent than commonly believed in the elderly brain: a community-based autopsy series. Acta Neuropathol 2013; 126(3): 365-384.
3. Janocko NJ, Brodersen KA, Soto-Ortolaza AI, Ross OA, Liesinger AM, Duara R, et al. Neuropathologically defined subtypes of Alzheimer’s disease differ significantly from neurofibrillary tangle-predominant dementia. Acta Neuropathol 2012; 124(5): 681-692.
4. Toledo JB, Brettschneider J, Grossman M, Arnold SE, Hu WT, Xie SX, et al. CSF biomarkers cutoffs: the importance of coincident neuropathological diseases. Acta Neuropathol 2012; 124(1): 23-35.
5. Murray ME, Graff-Radford NR, Ross OA, Petersen RC, Duara R, Dickson DW. Neuropathologically defined subtypes of Alzheimer’s disease with distinct clinical characteristics: a retrospective study. Lancet Neurol 2011; 10(9): 785-796.
6. Kovacs GG, Budka H. Current concepts of neuropathological diagnostics in practice: neurodegenerative diseases. Clin Neuropathol 2010; 29(5): 271-288.
7. Rohan Z, Matěj R. Current concepts in the classification and diagnosis of frontotemporal lobar degenerations: a practical approach. Arch Pathol Lab Med 2014; 138(1): 132-138.
8. Love S. Autopsy approach to stroke. Histopathology 2011; 58(3): 333-351.
9. Love S. Post mortem sampling of the brain and other tissues in neurodegenerative disease. Histopathology 2004; 44(4): 309-317.
10. Matěj R, Rusina R. Neurodegenerativní onemocnění: Přehled současné klasifikace a diagnostických neuropatologických kritérií. Cesk Patol 2012; 48(2): 83-90.
11. Mori K, Weng SM, Arzberger T, May S, Rentzsch K, Kremmer E, et al. The C9orf72 GGGGCC repeat is translated into aggregating dipeptide-repeat proteins in FTLD/ALS. Science 2013; 339(6125): 1335-1338.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2015 Číslo 4-
Všechny články tohoto čísla
- Transplantační patologie - II. díl
- Veškerá mizérie je v tom, že hlupákům je všechno jasné, zatímco moudří jsou samá pochybnost (Bertrand Russell)
- MONITOR aneb nemělo by vám uniknout, že ...
- MONITOR aneb nemělo by vám uniknout, že ...
- Transplantace jater z pohledu hepatologa
- Role patologa v programu transplantací jater
- MONITOR aneb nemělo by vám uniknout, že ...
- Morfologie chirurgických komplikací v biopsiích jater časně po transplantaci
- Karcinomy dutiny ústní a hltanu
- Diagnostika rejekce v transplantovaných játrech
- Rekurence primárních chorob po transplantaci jater
- MONITOR aneb nemělo by vám uniknout, že ...
- Transplantace plic v České republice – z pohledu patologa
- MONITOR aneb nemělo by vám uniknout, že ...
- Biopsie renálních štěpů: průvodce spletitými detaily pro získání nejlepších výsledků
- Chirurgické techniky orgánových transplantací
- MONITOR aneb nemělo by vám uniknout, že ...
- Periostální osteosarkom - osobní zkušenost s pěti případy
- MONITOR aneb nemělo by vám uniknout, že ...
- Pitva mozku a míchy při diagnóze neurodegenerativního onemocnění – praktický postup pro optimalizaci vyšetření
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Periostální osteosarkom - osobní zkušenost s pěti případy
- Transplantace plic v České republice – z pohledu patologa
- Diagnostika rejekce v transplantovaných játrech
- Chirurgické techniky orgánových transplantací
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání








