-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaCo je nového v cytodiagnostice cervikálních prekanceróz?
What is new in cervical precanceroses cytodiagnostics?
Cytopathology investigation of the uterine cervix transformation zone smear (Pap test) has been accepted during the last 80 years worldwide as a potent tool in lowering the incidence of squamous cell cervical cancer; it can reveal a proportion of adenocarcinomas as well and contributes to the diagnostics of cervicovaginal infections.
The technique itself and diagnostic criteria have been internationally unified in the systems Bethesda I (1988) and Bethesda II (2002). Nevertheless, the cytodiagnostics of cervical precanceroses continues to develop vividly in the following fields of interest.In processing the cervical sample:
- Unified polychrome staining has been accepted as compulsory
- Processing of the sample acquired has split into two branches - conventional preparation - CP and liquid based preparation – LBP.
- In both types of processing (mainly in LBP) additional tests are employed.
- Differences of the petrified diagnostic features formulated formerly for CP in the LBP have been described.
- Differentially-diagnostic pitfalls (look-alikes) are studied.
- Sensitivity of precanceroses detection in a screening routine with the prevalence of negative findings has been improved with compulsory rescreening of 10-20% random selected negative cases as well as rapid pre - or postscreening of the whole material or involvement of automated pre - or postscreening using image analysis systems.
- Some cytomorphology findings are followed with additional tests – especially HR HPV detection.
- Cyto-bioptic correlations are constantly studied.
- Opportune screening is substituted with nationwide programs aimed at:
- Involvement of as many women of the target group as possible.
- Standardized investigation (CP or LBP) in an accredited laboratory with functioning systems of external and internal quality control.
- Selective additional investigation with non-morphological tests.
- Appropriate treatment of women with pathology findings.
- Some newly designed nationwide screening models start with a non-morphological test (HPV) followed by a pap test and colposcopy.
Keywords:
cervical cytology – Pap test – precanceroses – National programme of cervical cancer screening
Autoři: J. Dušková
Působiště autorů: Autorka je členkou Komise pro screening karcinomu děložního hrdla Ministerstva zdravotnictví ČR. ; Ústav patologie 1. LF UK a VFN a Katedra patologie IPVZ, Vysoká škola zdravotní, CGOP, s. r. o., Praha, Česká republika.
Vyšlo v časopise: Čes.-slov. Patol., 48, 2012, No. 1, p. 22-29
Kategorie: Přehledový článek
Souhrn
Cytologické vyšetření stěru z transformační zóny děložního hrdla (Pap test) se v průběhu minulých 80 let prosadilo v mnoha zemích světa jako vysoce účinný nástroj ve snížení incidence dlaždicového karcinomu hrdla; pomáhá odhalit i část adenokarcinomů a přispívá k diagnostice cervikovaginálních zánětlivých stavů.
Vlastní metodika a diagnostická kriteria byla rozsáhle celosvětově unifikována v systémech Bethesda I (1988) a Bethesda II (2002); cytodiagnostika cervikálních prekanceróz je však i v posledních letech živě se vyvíjející oblastí, v níž rozvoj nastává v následujících oblastech:V úrovni zpracování vzorku:
- došlo k přijetí jednotného typu barvení některou z modifikací Papanicolauova polychromu
- způsob vlastního zpracování stěru se naopak rozdělil do dvou větví „konvenční“ cytologie nátěru (conventional preparation – CP) a cytologie z tekutého media (liquid based preparation – LBP)
- v obou typech zpracování (větší měrou v LBP) jsou uplatňovány doplňující testy
- na bázi formulovaných standardních diagnostických znaků byly popsány odlišnosti v LBP obrazech jednotlivých diagnostických kategorií formulovaných původně pro CP.
- trvalá pozornost je věnována morfologickým diferenciálně diagnostickým úskalím (tzv. look-alikes).
- citlivost záchytu přednádorových stavů ve screeningu s převažujícími negativními nálezy byla zvyšována zavedením povinných rescreeningů 10–20 % náhodně vybraných negativních vzorků, rychlého pre - nebo postscreeningu celého objemu diagnostikovaného materiálu, popř. vřazením automatizovaného pre - nebo postscreeningu pomocí obrazově analytických systémů.
- některé morfologické nálezy jsou preferenčně doplňovány dalšími testy – zejména průkazem papilomavirů vysokého rizika – HR HPV.
- pozornost je trvale věnována cyto-bioptickým korelacím.
- oportunní screening je nahrazován celonárodními programy; jejich hlavními požadovanými znaky jsou:
- vřazení co nejvyššího procenta cílové skupiny
- vyšetření standardizovaným způsobem (CP nebo LBP) v akreditované laboratoři s fungujícími systémy vnitřní a vnější kontroly kvality
- výběrové doplnění nemorfologickými testy
- odpovídající ošetření žen se zjištěnými patologickými nálezy
- nově jsou koncipovány modely programů, v nichž morfologie je až druhým a třetím krokem: screening začíná testem HPV, pokračuje pap testem a kolposkopií; po ní následuje případné bioptické ověření a ošetření pacientky.
Klíčová slova:
cervikální cytologie – Pap test – prekancerózy – Národní program screeningu cervikálního karcinomuÚvod a historická poznámka
Cytologické vyšetření se ve světě i u nás jako metoda pro diagnostiku nádorových procesů prosazovalo poměrně zvolna. Můžeme být hrdi na jedno z prvních publikovaných využití v oblasti urologické cytologie z pera Viléma Dušana Lambla (1). S vývojem cytodiagnostiky nádorových procesů děložního hrdla je však pevně spojena osobnost řeckého lékaře George Nicolase Papanicolaoua – a to do té míry, že je zejména v zahraniční literatuře nazýváno krátkým a výstižným termínem obsahujícím zkratku jeho jména – Pap-test.
(Slovo „test“ se nyní v názvu objevuje častěji než dříve užívané Pap smear, a to nejen z důvodu narůstajícího podílu cytologických vyšetření provedených metodou tenké vrstvy z tekutého vzorku – Liquid Based Cytology – LBC postupy, Thin Prep nebo SurePath - ale také proto, že ze soudního hlediska se prosazuje pohled na toto vyšetření jako na test, který je nutno posoudit v kontextu s ostatními výsledky vyšetření, nikoli jako na diagnózu. Vedle základní i expertní kolposkopie se jedná při stanovení výsledné diagnózy zejména o stav infekce lidským papilomavirem, jehož onkogenní účinek na vznik karcinomu děložního hrdla obou hlavních histologických typů je prokázán.)
První Papanicolaouova publikace (2) o nyní celosvětově přijaté metodě byla stižena téměř úplným nezájmem. Teprve řada dalších publikací v průběhu více než třiceti dalších let jeho profesního života dokázala o významu cytologického vyšetření stěru děložního hrdla v detekci časných stádií dlaždicobuněčného karcinomu cervixu přesvědčit. Pomáhá odhalit i část adenokarcinomů a přispívá k diagnostice cervikovaginálních zánětlivých stavů.
V zemích, které Pap test dokázaly uplatnit v širokém populačním měřítku (Velká Británie a skandinávské země), poklesla incidence karcinomu děložního hrdla na zlomky původních hodnot a je oproti současné české přibližně čtvrtinová.
Vlastní metodika a diagnostická kriteria byla rozsáhle celosvětově unifikována v systémech Bethesda I z r. 1988 (3) a Bethesda II z r. 2002 (4). Cytodiagnostika cervikálních prekanceróz je však i v posledních letech živě se vyvíjející oblastí, v níž rozvoj nastává v úrovni metodické, interpretační i implementační.
Následující text si klade za cíl podat přehled současně uznaných možností, ale zároveň i limitů cytodiagnostiky patologických (zejména přednádorových) stavů děložního hrdla – Pap testu, a to z pohledu cytopatologa prosazujícího těsnou klinicko-morfologickou spolupráci. Klinickým spolupracovníkům byl pohled cytopatologa na tuto problematiku, vzájemnou spolupráci a reálné možnosti metody rovněž podán (5).
Technologické modifikace Pap testu
Odběr cytologického materiálu z děložního hrdla
V našem uspořádání zdravotnického systému je realizován v naprosté většině lékařem - gynekologem za kolposkopické kontroly. Prosadilo se většinově užití komerčně vyráběných odběrových nástrojů. Volba odběrového nástroje a celá technologie odběru mají za cíl co nejreprezentativnější zastoupení buněčné populace transformační zóny – místa nejcitlivějšího pro onkogenní působení papilomavirů – v případě kolposkopicky viditelné léze pak se zacílením na odběr z ní.
Možné limity pro zisk buněk z případné přítomné léze jsou následující:
- a) anatomické :
- zanořená transformační zóna (TZ) u žen postmenopauzálního období
- přítomnost léze v odběru nedostupném prostoru žlázek s metaplazií – zejména u ektopie nebo ektropia
- b) technologické:
- nízká buněčnost stěru – suboptimální kontakt odběrového nástroje s povrchem TZ.
Ustálený požadavek přítomnosti buněk TZ v podobě minimálně 10 dobře zachovalých cylindrických buněk, popř. metaplastických buněk pro výpovědní hodnotu Pap testu, tak jak je uveden v normativní publikaci Bethesda 2001 (4) je poněkud zpochybněn recentní publikací italských autorů (6), kterou jsme přiblížili v Monitoru (7).
V kontraindikacích pro screeningový odběr buněk z hrdla je v mezinárodních i národních standardech vyšetření uváděno období pravidelného krvácení a floridní zánět, poměrně málo je však zmiňována optimální doba pro screeningové vyšetření z hlediska kolísajících hormonálních hladin v menstruačním cyklu. Jakkoli je hormonální cytologie odebírána lege artis z vaginálního fornixu, nikoli z transformační zóny, jsou samozřejmě i cervikální epitelie výrazně hormonálními hladinami ovlivňovány. Materiál získaný na vrcholu proliferační fáze s vysokou estrogenizací a nízkou gestagenní opozicí poskytuje nejlepší předpoklady pro přehlednost nátěru. Časná proliferační fáze může být ovlivněna významnější účastí exodu – odchodu zbytků regresivně změněného korporálního endometria. Sekreční fáze pak může nepříznivě ovlivnit přehlednost stěru vyšší účastí hlenu, neutrofilních granulocytů a buněčných shluků.
Cytologický preparát
Polychromatické barvení bylo postupně přijato jako závazný standard pro cervikální cytologii celosvětově. Je užíváno široce i v cytologických vyšetřeních materiálů získaných z jiných lokalit, nikde však takto obligatorně.
Existuje ve více modifikacích a jsou vyvíjeny další (8) se zacílením na rychlost a ekonomičnost; tyto aspekty jsou důležité obecně, zejména pak naléhavě v rozvojových zemích s incidencí cervikálního karcinomu ještě vyšší, než je v ČR. S přechodem na polychromatické barvení byl vyvinut i postup rehydratace zaschnutím fixovaných nátěrů ponořením na 30 sekund do fyziologického roztoku a následnou fixací 95% etanolem (9). Představuje použitelnou alternativu, nicméně okamžitá a kvalitní fixace tence provedeného nátěru je postupem optimálním. (Právě vysoká kvalita fixace je jednou ze zdůrazňovaných předností odběru do tekutého média a LBP).
Montování pod sklo nebo krycí lak zlepšuje optické vlastnosti preparátu a zároveň představuje ochranu buněčného obsahu nátěru pro standardy stanovenou archivační dobu (5 let pro stěry) .
Komplementární a následné metody
S poznanou etiologickou rolí lidských papilomavirů ve vzniku cervikálního karcinomu do jeho diagnostiky vstupuje testování infekce lidskými papillomaviry vysokého rizika (HR HPV). To je v případě LBC proveditelné ze základního vzorku materiálu, v případě konvenčního vyšetření z nátěru je nutno odebrat materiál zvlášť. Jiným následným vyšetřením, které může zvýšit výpovědní hodnotu cervikálního stěru, je využití proliferačního testu (Ki-67, MIB1), zejména u žen perimenopauzálního období s obrazem částečné atrofie cervikálního epitelu, popř. užití detekce onkogenu p16. Oba uvedené imunocytochemické postupy jsou však lépe interpretovatelné v histopatologickém (imunohistochemickém) provedení, kde zachovalá architektonika epitelu (případně i v pouze minibioptickém vzorku) umožňuje lepší topickou interpretaci výsledku. Použití dodatečného imunocytochemického došetření je navíc podmíněno montováním stěru pod podložní sklo, které lze v indikovaném případě sejmout a imunocytochemický postup provést na polychromaticky obarveném preparátu (10). Před touto procedurou není třeba preparát odbarvovat. Vzorek v tekutém mediu nabízí možnost cytobloku ze zbytkového materiálu s průkazem p 16 (11).
Hodnocení cervikálních stěrů – výstupy, úskalí, limity
Po desetiletích užívání Papanicolaouovy pětistupňové klasifikace došlo s posilováním mezinárodních standardizačních postupů v průběhu posledních 20 let spolu s přijetím jednotného barvicího postupu také k přijetí jednotné klasifikace cervikálních cytologických nálezů – poprvé v systému Bethesda 1988 (3), po revizi pak vznikl současně používaný systém Bethesda 2001(4). Je sice podrobován kritickým analýzám na podkladě rozsáhlých studií, až dosud však pozitiva převážila a další revize zatím nevznikla. Limitovaná výpovědní hodnota některých nálezů je kompenzována vestavěním testace HPV statusu do rozhodovacích schémat a již v současné době se množí argumenty pro to, aby byl cervikální screening v populaci postaven primárně na testaci HPV a teprve sekundárně doplňován cytologickým vyšetřením (12). V našich podmínkách došlo k mezioborovému konsenzu doporučených postupů ve screeningu karcinomu děložního hrdla. Výsledky jsou k dispozici v tiskové podobě (13,14).
Interpretační problémy a nejistoty v TBS2001
Normativní publikaci s popisy charakteristických i diferenciálně diagnostických znaků (tzv. „look-alikes“) zde představuje druhé vydání atlasu s vysvětlivkami (4), na jehož tvorbě se podílel tým mezinárodně respektovaných specialistů pod editací Diane Salomon a Ritu Nayar. Aktuální informace lze nalézt i na webových stránkách (15).
Kvalita stěru
„Uspokojivý stěr“ může být sledován řadou vyjmenovaných limitů. Je na společném uvážení cytopatologa i gynekologa, nakolik konkretizovaný limit interferuje se spolehlivostí hodnocení – podle tohoto vyhodnocení pak zpravidla zkrácení kontrolního intervalu. Při zjištěné lézi pak může limit znamenat riziko podhodnocení, ale i nadhodnocení. Kvantitativní limit představuje 8–12 tisíc dobře přehledných dlaždicových buněk (vč. metaplastických) - celularita se určuje odhadem. Z hodnocení se vylučují nepřehledné trsy a krví či zánětem překryté buňky. Neuspokojivý stěr je za těchto podmínek sice zpracován, ale hodnocení je omezeno.
Stěry s nedostatečným značením jsou odmítnuty před zpracováním.
Přítomnost transformační zóny
S vědomím, že jde o místo nejvnímavější k působení papilomaviru, je k účasti cylindrických nebo metaplastických buněk (viz výše) zaměřena pozornost. Stěr však bude vyhodnocen i při jejich absenci; existují studie dokládající nezvýšené riziko dysplazií u takových stěrů (6).
Stěr s jakýmkoli limitem (kvantitativním či kvalitativním), v němž byly identifikovány abnormální buňky, nesmí být zcela odmítnut pro hodnocení.
Nenádorové nálezy
Mikroorganismy
Bakterioskopická vyšetření i mikroskopické průkazy ostatních mikroorganismů (prvoků, kvasinek, plísní, virových projevů) mají orientační charakter. Nemusí se nutně jednat o klinicky významnou infekci. Morfologicky zjištěné mikroorganismy skoro vždy potřebují bližší specifikaci. Populace se ve výskytu samozřejmě velmi liší, v naší realitě je podstatně častěji vyslovováno podezření na infekci chlamydiemi (které z výčtu TBS2001 vypadly), než na infekci trichomonádami. Reaktivní změny buněk v souvislosti s mikroskopickým nálezem mikroorganismů mohou sdílet morfologické znaky se skvamózními intraepiteliálními lézemi. Dlouho panovala představa, že jde o pouhou nápodobu (např. v případě chlamydií; nyní je o nich prokázáno, že blokují proapoptotické mechanismy buňky a jsou tedy v kategorii proonkogenů (16)). Jsou však známy i tendence podhodnotit dysplazie ve prospěch reaktivních změn (17). Od určitého stupně mohou zánětlivé změny posunout nález z kategorie NILM - mikroorganismy do úrovně neuspokojivého stěru limitovaného doprovodným zánětem ve spolehlivém vyhodnocení SIL. V široce koncipovaných úspěšně administrovaných programech představují zjištěné posuny mikrobních a dalších poševních infekcí nepřímou výpověď o pohlavním chování a pohlavní hygieně v populaci (18).
Jiné nenádorové změny
Reaktivní – je třeba si uvědomit, že morfologie buněk je ovlivňována i řadou faktorů, jakými jsou mechanické, IUD, instilace chemických látek, iradiace a pod. Znalost těchto spolupůsobících faktorů v denní vyhodnocovací praxi není zdaleka vždy úplná.
Nejběžnější reaktivní změnu představuje metaplazie – nezralá i postupně vyzrávající je naprosto běžným nálezem. Pokud se v ní však objeví atypie, zejména pak na úrovni nezralé metaplazie, jde o nález spolehlivě v tomto stacionárním pohledu neinterpretovatelný, hodnocený nejčastěji v kategorii ASC H s nutností sledovat vývoj této změny v racionálně stanoveném intervalu (viz ASC H).
Samostatnou kapitolu představují v jiných nenádorových změnách stavy atrofie epitelu, zejm. částečné. Určitým řešením v překlenutí překryvu morfologických diagnostických znaků mezi atrofií a SIL (a také mezi regresivními změnami buněk v atrofických stěrech často přítomných a SIL) je krátkodobá lokální aplikace estrogenů „vyzrávací test“, která odstraní z obrazu regresivně změněné buňky alarmujícího vzhledu (obr. 1a–d); morfologii dysplastických buněk neovlivní a zviditelní je na vyzrálém a vlivem estrogenů i vyčištěném pozadí použít lze i průkaz buněčné proliferace v trsech sporné morfologie s protilátkou Ki-67 (MIB1).
Obr. 1. ASC H v atrofii: v záběrech A a B atypické buňky s hyperchromními jádry jednotlivě i v trsech – suspektní HG léze. V záběrech C a D kontrolní odběr po maturačním testu – normální nález intermediárních buněk. 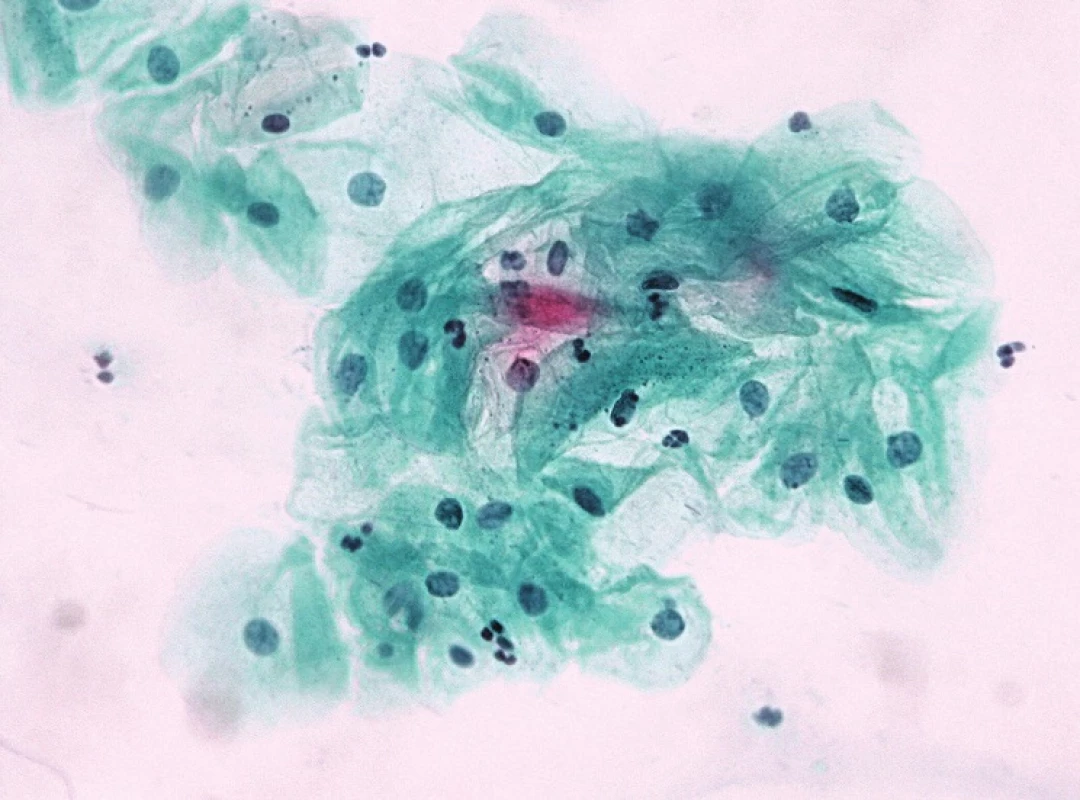
Nález spontánně odloučených endometrálních buněk u žen nad 40 let není častý. Zaměří pozornost na vyloučení endometrální patologie, na kterou jinak Pap test cílen není. Méně významná je přítomnost buněk dolního děložního segmentu, která se ve stěrech z endocervixu objevuje zejména v odběrech od pacientek po konizaci nebo trachelektomii.
Nad rámec aktuální verze Bethesda klasifikace TBS2001 se v nálezech mohou objevit kategorie, které byly vymezeny dříve a cytopatologové si je zvykli používat. Patří sem např. parakeratóza a hyperkeratóza, ale i dyskeratocyty. Byť nejsou v nové klasifikaci explicitně uvedeny, mohou představovat užitečnou přídatnou informaci - podstatné ovšem zůstává plné zařazení nálezu v aktuálně platném systému, a to i s ohledem na centralizovaný sběr dat v rámci Národního programu screeningu karcinomu děložního hrdla.
Intraepitelové léze
ASC
Tato skupinová kategorie (Atypical Squamous Cells) vyžaduje zvlášť dobře sehranou spolupráci cytopatologa a klinika. V TBS2001 se rozpadá na dvě menší skupiny:
- ASC-US (Atypical Squamous Cells of Undetermined Significance) a
- ASC-H (Atypical Squamous Cells – cannot exclude H SIL).
I když první z obou zmíněných indikuje změny s převažující dif. dg. low grade léze nebo reaktivní změny, i u těchto pacientek se může (s udávanou frekvencí 5–15 %) následně prokázat histologicky high grade léze. Proto zkrácený interval kontroly a zapojení testace HR HPV. S ohledem na etiologickou roli papilomavirů by bylo logické předpokládat (a některé studie to i doložily statisticky), že pokud jsou HR HPV negativní, není riziko karcinomu zvýšeno. Nově se však objevily jiné studie, které hodnotu negativity HR HPV zpochybňují (viz níže – testace HPV).
ASC-US se týká zralých buněk intermediárního typu s neúplně vyjádřenými znaky L SIL. Přístup je konzervativní se zkrácením kontrolního intervalu na 6 měsíců. V nálezech méně typické a méně zralé metaplazie se těsně stýkají kategorie ASC-US a ASC-H. Vedle zkrácených kontrolních intervalů se i v případě ASC - H velmi výrazně uplatní testování HR HPV. Vlastní cytologická kontrola však musí dodržet doporučovaný časový odstup 3 měsíců (resp. 100 dnů), které dovolí atypické nezralé metaplazii vyzrát (s případným spolupůsobením protizánětlivé léčby). Časný odběr v krátkém intervalu naopak znovu poraní TZ a poskytne velmi obtížně hodnotitelný vzorek s větším stupněm iritačních změn. Alternativní postup zpřesnění diagnózy zde v případě kolposkopicky viditelné léze představuje odběr malého bioptického vzorku – tzv. punch biopsie.
L SIL a H SIL
Představují dvoustupňovou klasifikaci intraepitelových lézí se zřejmými znaky HPV infekce a různým stupněm rizika pro vývoj směrem k invazivnímu karcinomu, který se odráží v doporučených postupech návazných na tuto diagnózu. Jestliže L SIL znamená zkrácení kontrolní doby z obvyklého 1 roku (v ČR) na 6 měsíců, je H SIL signálem k neodkladnému dalšímu vyšetřování bioptickému ( i když i část H SIL lézí regreduje). S ohledem na skutečnost, že cytologicky prokázaná L SIL může být poměrně často doprovázena H SIL v místech uvnitř žlázek, méně dostupných odběrovému nástroji , je někdy perzistence L SIL spolu s přetrvávající pozitivitou HR HPV důvodem k chirurgickému řešení.
V čem jsou úskalí diagnózy L SIL a H SIL?
Jde o diagnostické kategorie vymezené řadou znaků a charakterizované vcelku vysokou reproducibilitou, nicméně i zde mohou vznikat problémy, a to v zásadě
- kvantitativní a
- kvalitativní.
Počtem minimální přítomnost diagnostických buněk ve vyšetřovaném stěru může interferovat s pozorností screenera (pověstné hledání jehly v kupce sena, kde v laboratoři vyšetřující nepředtříděnou populaci pacientek je naprostá většina stěrů negativních). Nález těchto ojedinělých „litigation cells“ ve zpětném hodnocení vyžaduje standardizované postupy popsané a přijaté mezinárodně i u nás (19).
Kvalitativní úskalí představuje intra - a interobservační variabilita v hodnocení obrazů ASC-H a H SIL. Pokud H SIL není v konizátu následně biopticky prokázána, je vždy na místě revidovat cytologický stěr, zda obraz hodnocený jako H SIL není spíše charakteru ASC-H. Pak je nepochybně vhodné znát stav infekce HR HPV; nezávisle na výsledku těchto revizí je třeba mít na mysli, že:
a) H SIL léze může v malém procentu regredovat ( u L SIL se to většinově očekává a proto konzervativní postup), zvláště, je-li mezi vyšetřením cytologickým a bioptickým delší interval, ale také že
b) „ v celém rozsahu zpracovaný“ konus je ve skutečnosti v celém rozsahu blokován, nikoli histologicky vyšetřen, a při nepochybném nálezu v revidované cytologii a pozitivitě HR HPV stojí za to po korelující CIN pátrat prokrajováním bloků. V buněčných skupinách metaplastického původu, případně u dyskeratocytů, může být určení stupně dysplazie obtížné, pro tuto výjimečně se vyskytující situaci lze použít kategorii SIL bez bližšího zařazení. Z histopatologických obrazů velmi dobře známé postižení žlázek dysplastickým dlaždicovým epitelem může v cytologickém stěru být podkladem klasifikace takto formovaných dysplastických skupin jako žlázových. Je-li však dysplazie rozpoznána, pak následuje bioptická verifikace a tento omyl není pro pacientku zásadní.
K otázce tzv. „nádorové diatézy“ a cytologicky vysloveného podezření z invazivního karcinomu
Termínem nádorová diatéza je označováno v cytologickém stěru nečisté pozadí tvořené bílkoviny obsahující sekrecí obnaženého cervikálního stromatu a příměsí nekrotických struktur buněk s (reziduálními) dysplastickými morfologickými rysy. Cytopatolog s bioptickou zkušeností je k tomuto nálezu zákonitě rezervovaný, a to nejen proto, že ho může napodobit např. ložisková intraglandulární nekróza neinvadujícího dysplastického dlaždicového epitelu – toto „naddiagnostikování“ ale nebude mít zásadní význam pro další postup. Závažnější omyl může vzniknout, bude-li takový obraz nadhodnocen nebo podhodnocen v diferenciální diagnóze s hojící se erozí, u níž je sekrece obnažené spodiny rovněž ve hře, a alternativní regresivní změny buněk a změny regeneratorní mohou věrně napodobit změny dysplastické. Do těsné blízkosti se tak morfologickými znaky dostává obraz nenádorový (a nedysplastický – „atypická reparace“ s potencí vyhojit se spontánně) a obraz invazivního karcinomu ( pro podhodnocení jsou v tomto kontextu zejména nebezpečné jeho méně vyzrálé nerohovějící histologické varianty), kde nelze v upřesnění diagnózy a terapeuticky vyčkávat. Tak jako jinde, i zde může pomoci mapování stavu HR HPV a úzká spolupráce klinika a cytopatologa s případným opatrným (málo radikálním) bioptickým došetřováním nálezu.
Žlázové léze
Opakovaně bývá zdůrazňováno, že PAP test nepředstavuje ideální metodu pro detekci glandulárních lézí, a to z důvodů sporné reprezentativnosti odběru i problémů ve vyhodnocení cytologických obrazů (20).
Přítomnost endocervikálních buněk je indikátorem odběru z transformační zóny a tím potenciální reprezentativnosti pro záchyt dlaždicových lézí (viz výše).
Atypické endocervikální buňky jsou v TBS2001 klasifikovány na AGC NOS (Not Otherwise Specified – blíže nespecifikované) a AGC FN (Favour Neoplasia – spíše neoplastické). V bioptickém ověření navíc část těchto nálezů obsahuje dlaždicobuněčné léze CIN (obr. 2a–c).
Obr. 2. Atypické buňky z pohledu screenera. A,B: Vyřazeno s pracovní diagnózou AGC NOS. Cytopatolog hodnotí jako H SIL. C: Minibiopsie s nálezem dlaždicové metaplazie a úsekÛ CIN III. 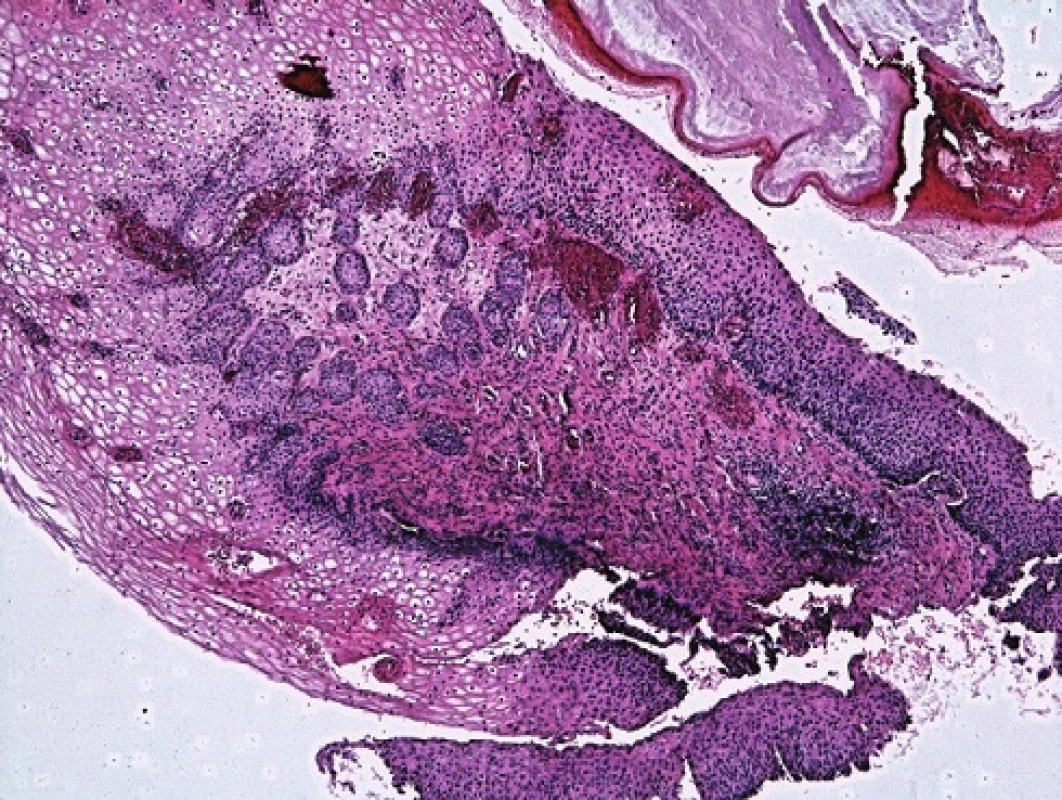
Definované morfologické znaky AGC NOS neumožňují vymezení low grade žlázových lézí analogických dlaždicobuněčným. Je zde přílišný překryv s reaktivními změnami.
Pro AGC FN představuje vcelku dobře známé úskalí, na které je diferenciálně diagnosticky třeba aktivně myslet, tubární metaplazie. Vyskytuje se poměrně často jak na cervixu, tak v endometriu. O záměně intraglandulárně distendujícího metaplastického a dysplastického dlaždicového epitelu byla učiněna zmínka v předchozím textu.
Cervikální adenokarcinom sdílí cytologické znaky (a jejich variace – např. intestinální typ) s adenokarcinomy jiných orgánových lokalizací. Při diagnóze adenokarcinomu je třeba aktivně pomýšlet skvamózní intraepitelovou lézi, která může nález adenokarcinomu doprovázet až v polovině případů (21) a vyloučit ji.
Atypické žlázové buňky endometrálního a jiného původu mohou být zjištěny buď v situaci s negativní, nebo pozitivní anamnézou předchozí neoplazie. V prvním případě bude nález iniciovat další vyšetřování, ve druhém musí zkušený cytopatolog porovnat morfologii a pravděpodobnost, že jde o projev dříve prokázaného procesu. Nepochybně nejobtížnější diagnostickou úlohou v úrovni žlazových lézí je hodnocení posttrachelektomických nálezů u pacientek s pozitivní anamnézou invazivního adenokarcinomu a fertilitu zachovávajícím operačním výkonem. Riziko recidivy je zde reálné, cytologický obraz s kombinací reaktivních a případně i dysplastických buněk jak endocervikálního, tak endometrálního původu – buněk dolního děložního segmentu - vede k možnosti nadhodnocení obrazu (22,23). Podobné riziko nadhodnocení existuje i pro pacientky po operaci karcinomu prsu s dlouhodobou léčbou tamoxifenem (24)
Citlivost záchytu přednádorových stavů ve screeningu s převažujícími negativními nálezy
Hodnocení velkého počtu preparátů s vysoce převažujícími normálními nálezy realizované v prvním kroku nelékaři – cytotechnology – nese reálné statisticky zdůvodněné (a eticky nepřijaté) riziko přehlédnutí, případně podhodnocení přítomné léze. Minimalizace těchto rizik zavedením povinných rescreeningů 10–20 % náhodně vybraných negativních vzorků, rychlého pre - nebo postscreeningu celého objemu diagnostikovaného materiálu, popř. vřazením automatizovaného pre - nebo postscreeningu pomocí obrazově analytických systémů se stala součástí screeningových programů – viz níže.
Doplňující testace na perzistující přítomnost papilomavirů vysokého rizika – HR HPV
Na základě známé skutečnosti, že většina pohlavně aktivních žen je promořena různými typy lidských papilomavirů a infekci postupně svou imunitní odpovědí potlačí, je v modelech detekce bez primární kolposkopie uplatňován tento test primárně s cytologií u žen nad 30 let věku, v naší realitě pak zpravidla s indikací, která se (pro odlišení od právě zmíněného) v literatuře označuje jako „reflex high risk HPV testing“ a znamená zařazení testu u nejasných cytologických nálezů – ASC US, ASC H, ale i přetrvávající L SIL. Důvěru v negativní predikční hodnotu však nově poměrně výrazně oslabuje kalifornská studie E. Galiano a spolupracovníků (25), která překvapivě zjistila zejména pro kategorii ASC H riziko následné CIN2+ u 68,3 % HR HPV +, ale také u 58,3 % pacientek s negativním HR HPV (!). To zásadně posiluje pozici ověřujícího bioptického vyšetření pro ASC H nález.
Cytologicko - bioptické korelace
Bioptický nález představuje tradiční „zlatý standard“ cytologického vyšetření. Rozdílné nálezy a jejich příčiny již byly zmíněny v souvislosti s ověřováním závažných spinocelulárních i žlázových lézí. Přehled možných příčin cytologicko-bioptických neshod podává recentně studie brazilských autorů (26).
Úkoly cytodiagnostiky cervikálních lézí v české populaci
I když dle české legislativy mají ženy (bez omezení věku) již od roku 1966 nárok na preventivní cytologické vyšetření, zůstává ČR po desetiletích oportunního screeningu karcinomu děložního hrdla s incidencí 19.1/100 000 na 10. a mortalitou 8.2/100 000 na 16. místě mezi evropskými státy. Je tedy více než zřejmé, že vyšetřování menší subpopulace často i méně rizikových pacientek (a to často nad rámec rozumného intervalu) sice znamená pro ně samotné významné snížení rizika onemocnění karcinomem děložního hrdla (byť ne na nulu, jak byla tendence mediálně předkládat), není však schopno vynecháním významné kohorty více i méně rizikových žen národní incidenci pozitivně ovlivnit. Proto byl po několikaleté přípravě v komisi MZd v roce 2009 spuštěn Národní program screeningu cervikálního karcinomu.
Jakožto neinvazivní vyšetření je cytologický stěr indikován i u pacientek s klinickými příznaky možné cervikální patologie, protože však časná (low grade – LG) i pokročilá (high grade – HG) stadia přednádorových stavů děložního hrdla (skvamozních intraepitelových neoplázií – SIL i žlazových atypií AGUS a adenocarcinoma in situ AIS) zůstávají dlouho bezpříznaková, je hlavním úkolem tohoto testu právě screening – tedy vyhledání bezpříznakových pacientek. Úlohu aktivního zvaní s cílem pokrýt co nejvyšší procento screenované populační skupiny žen (20–59 let) zajišťují především zdravotní pojišťovny – v návaznosti na další celonárodní screeningové programy detekce časných stádií mamárního a kolorektálního karcinomu. Byla formulována pravidla pro akreditované laboratoře (13), v nichž je cytopatologické vyšetření nejen realizováno ale akreditované laboratoře jsou odpovědné i za shromažďování údajů o cytobioptických korelacích a odesílání anonymizovaných a zabezpečených dat do centrálního registru Institutu biostatistiky a analýz. Pro podporu programu je vytvořena webová stránka s informacemi pro odbornou i laickou veřejnost a se seznamem akreditovaných laboratoří (27).
Screening a rescreening, kontrola kvality
Primární cytologické hodnocení cervikálních stěrů (screening) provádí cytotechnolog – tedy dle českých norem: „Zdravotnický pracovník, který získal odbornou způsobilost zdravotního laboranta podle zvláštního právního předpisu a specializovanou způsobilost v oboru cytodiagnostika, nebo zvláštní odbornou způsobilost pro úzce vymezené činnosti. Na činnosti se mohou dále podílet i jiní odborní pracovníci, a to pod odborným dohledem lékaře nebo zdravotnického pracovníka se způsobilostí k výkonu povolání bez odborného dohledu a specializovanou způsobilostí v oboru“ (5). Termín cytotechnolog bude nadále v textu užíván v souladu s tímto vymezením. Z povahy své uznané kvalifikace je cytotechnolog kompetentní uvolňovat v akreditovaných systémech nálezy v kategorii NILM (původně anglická zkratka Negative for Intraepithelial Lesion or Malignancy je použitelná v doslovném překladu Negativní pro Intraepitelovou Lézi nebo Malignitu i v českých textech). Nálezy nejisté (ASC US, ASC H, AGUS) a nálezy lézí vyřazuje pro následné hodnocení kvalifikovaným cytopatologem. Kontrola kvality je zatím v systému předdefinována jako vnitřní kontrola – a to dvěma systémy považovanými v zásadě za rovnocenné – náhodný 10% rescreening negativních nálezů plně kvalifikovaným cytopatologem, popř. „rychlý“(= 1 min. trvající) rescreening 100 % preparátů plně kvalifikovaným cytopatologem. Obvyklá denní náplň práce cytotechnologa je v našem mezinárodně kompatibilním standardu stanovena na 60–90 preparátů v průběhu plné pracovní doby, případně poměrného množství, vykonává-li cytotechnolog i jiné práce.
Hodnocení vyřazených preparátů s jiným než NILM nálezem patří kvalifikovanému cytopatologovi. Jedná se o patology s atestační zkouškou a v našem systému i atestované gynekology, kteří se podrobili zkoušce z cytodiagnostiky a získali licenční osvědčení (13). V odbornosti gynekologů již postgraduální příprava a zkoušky pro cytodiagnostiku po řadu let neprobíhají, tato činnost postupně přejde zcela do kompetence oboru patologie.
Odborná komise pro screening karcinomu děložního hrdla při MZ ČR spolupůsobí v koordinaci Národního programu screeningu cervikálního karcinomu. Snaha převzít největší možnou měrou prvky úspěšně realizovaných zahraničních modelů je konfrontována s odlišnou u nás ustálenou praxí vyšetřování:
- kolposkopie – pap test – příp. HR HPV – příp. biopsie
- oproti v zahraničí častému
- pap test (nebo HR HPV) – HR HPV (nebo pap test) – kolposkopie – příp. biopsie.
V úsilí o zavedení světově srovnatelných parametrů jsme přistoupili jak k sjednocené terminologii, tak akreditačním pravidlům, a kontroly laboratoří ukazují zřetelně se zlepšující standard.
Vnější (mezilaboratorní) formy kontroly kvality jsou zatím realizovány i v zahraničí pouze v omezeném měřítku, rovněž v ČR jednotný systém mezilaboratorní kontroly zatím nastaven není. Srovnání záchytu lézí nebo procenta nejistých nálezů nepředstavují použitelný nástroj kontroly kvality laboratoří, a to zejména s ohledem na rozdíly ve screenované populaci, intervalech screeningu, ale i nižší reproducibility některých definovaných kategorií mezinárodně přijaté klasifikace Bethesda 2001 (28).
I zde chceme využít zahraničních modelů, jakkoli jsou i v zemích s dlouholetou tradicí úspěšných screeningových programů sjednocovány až recentně. Materiály dokumentující letité úsilí i recentní výsledky jsou však dostupné na webových stránkách (29–31).
ZÁVĚR
Přínos cervikálního cytologického vyšetření pro diagnózu přednádorových stavů děložního hrdla je nesporný. V souladu s kategoriemi současně závazné klasifikace cytologických vyšetření cervikální patologie Bethesda 2001 je podán přehled nejčastějších problematických nálezů a diferenciálně diagnostických úskalí vyžadujících úzkou spolupráci klinika a cytopatologa, případně komplementární došetření. Zveřejnění určitých limitů tohoto screeningového vyšetření by mělo doprovázet i propagaci Pap testu s cílem navodit realistická očekávání a ukázněnou (každoroční nebo specialistou doporučenou) účast ve startujícím Národním screeningovém programu.
Neúprosnou kontrolou úspěšnosti implementace výše uvedených pokrokových prvků v jednotlivých populačních skupinách je incidence karcinomu děložního hrdla.
Seznam použitých zkratek
AIS adenocarcinoma in situ
AGC atypical glandular cells – atypické žlázové buňky
ASC atypical squamous cells – atypické skvamózní buňky
ASC-H atypical squamous cells, cannot exclude high-grade squamous intraepithelial lesion – atypické skvamózní buňky, nelze vyloučit intraepitelovou lézi vysokého stupně
ASC-US atypické skvamózní buňky neurčitého významu
CIN cervical intraepithelial lesion – cervikální intraepitelová léze
CP conventional preparation – konvenční preparát (nátěr)
HSIL high-grade squamous intraepithelial lesion – skvamózní intraepitelová léze vysokého stupně
HPV human papillomavirus – lidský papilomavirus
HR HPV high risk human papillomavirus – lidské papilomaviry vysokého rizika
LSIL low-grade squamous intraepithelial lesion – skvamózní intraepitelová léze nízkého stupně
LBC liquid based cytology – cytologie z tekutého media
LBP liquid based preparation – preparát z tekutého media
NILM negative for intraepithelial lesion or malignancy – negativní pro intraepitelovou lézi nebo malignitu
SIL squamous intraepithelial lesion – skvamózní intraepitelová léze
TBS The Bethesda System – Bethesda systém
TZ transformation zone – transformační zóna
Adresa pro korespondenci:
Doc. MUDr. Jaroslava Dušková, CSc., FIAC,
Ústav patologie 1. LF UK
Studničkova 2,
128 00 Praha 2
tel:+420224968688
e-mail: jaroslava.duskova@lf1.cuni.cz
Zdroje
1. Lambl VD. Über Harnblasekrebs. Ein Beitrag zur mikroskopischen Diagnostik am Krankenbette. Vierteljahrschr Prakt Heilk 1856; 49 : 1–32.
2. Papanicolaou GN. New cancer diagnosis. Proceedings of the Third Race Betterment Conference. Michigan: Battle Creek; 1928 : 528–534.
3. [Autoři neuvedeni]. The 1988 Bethesda System for reporting cervical/vaginal cytologic diagnoses. developed and approved at the National Cancer Institute workshop in Bethesda, MD, December 12-13, 1988. Diagn Cytopathol 1989; 5(3): 331–334.
4. Salomon D, Nayar R. The Bethesda system for reporting cervical cytology. Definitions, kriteria, and explanatory notes. 2nd ed. Springer; 2004 : 191 pages.
5. Dušková J. Cytologické vyšetření v diagnostice patologických stavů děložního hrdla a jeho limity. Moderní gynekologie a porodnictví 2010; 19(3): 266–275.
6. Giorgi Rossi P et al. Risk of CIN2 in women with a pap test without endocervical cells vs. those with a negative pap test with endocervical cells: a cohort study with 4.5 years of follow-up. Acta Cytol 2010; 54(3): 265–271.
7. Dušková J. MONITOR aneb nemělo by vám uniknout, že riziko CIN2 u žen, jejichž Pap test neobsahoval endocervikální buňky, není v porovnání s těmi, které endocervikální buňky ve stěru měly, větší a není tedy třeba krátit doporučovaný kontrolní interval vyšetření. Cesk Patol 2011; 47(2): 72.
8. Kamal MM, Kulkarni MM, Wahane RN. Ultrafast Papanicolaou stain modified for developing countries: efficacy and pitfalls. Acta Cytol 2011; 55(2): 205–212.
9. Sivartaman G, Iyengar RK. Rehydrated air-dried Pap smears as an alternative to wet – fixed smears. Acta Cytol 2002; 46(4): 713–717.
10. Dušková J, Drozenová J, Hajná R. ASCUS v atrofii. Cesk Patol 2008, 44 : 9–14.
11. Shidham VB, Mehrotra R, Varsegi G, et al. p16 immunocytochemistry on cell blocks as an adjunct to cervical cytology: Potential reflex testing on specially prepared cell blocks from residual liquid-based cytology specimens. Cytojournal 2011; 8 : 1.
12. Meijer CJ. Berkhof J, Castle PE, et al. Guidelines for human papillomavirus DNA test requirements for primary cervical cancer screening in women 30 years and older. Int J Cancer 2009; 124(3): 516–520.
13. Kritéria a podmínky programu pro screening karcinomu děložního hrdla v ČR. Věstník MZČR, částka 7, září 2007 : 147–151.
14. Konsensus pro řešení abnormálních nálezů ve screeningu cervikálních karcinomů. Členové panelu: Dvořák V, Freitag P, Ondruš J, Rob L, Svoboda B, Rokyta Z, Dušková J., Michal M, Dvořáčková J. Gynekologie po promoci 2009; (2): 53–58.
15. http://nih.techriver.net/
16. Xiao Y, Zhong Y, Greene W, Dong F, Zhong G. Chlamydia trachomatis infection inhibits both Bax and Bak activation induced by staurosporine. Infect Immun 2004; 72(9): 5470–5474.
17. Nasser H, Hayek S. Balasubramaniam M, Kuntzman TJ. Infectious organisms on Papanicolaou smears should not influence the diagnosis of atypical squamous cells of undetermined significance. Acta Cytol 2011; 55(3): 251–254.
18. Klomp JM, Boon ME, Dorman MZ, et al. Trends in inflammatory status of the vaginal flora as established in the Dutch national screening program for cervical cancer over the last decade. Acta Cytol 2010; 54(1): 43–49.
19. Dušková J. Falešně negativní PAP test? Cytopatolog v roli člena skupiny znalců při pozdní diagnóze cervikálního karcinomu. Cesk Patol 2010; 46(3): 62–64.
20. Wilbur DC. The cytology of the endocervix, endometrium, and upper female genital tract. In: Bonfiglio TA, Drozan YS, eds. Gynecologic Cytopathology. Philadelphia. Lippincott-Raven; 1997 : 107–156.
21. Moriarty AT, Wilbur DC. Those gland problems in cervical cytology: faith or fact? Observation of the Bethesda 2001 terminology conference. Diagn Cytopathol 2003; 28 : 171–174.
22. Singh N, Titmuss E, Chin Aleong J, et al. A review of post-trachelectomy isthmic and vaginal smear cytology. Cytopathology 2004; 15(2): 97–103.
23. Ghorab Z, Ismiil N, Covens A, et al. Postradical vaginal trachelectomy follow-up by isthmic-vaginal smear cytology: a 13-year audit. Diagn Cytopathol 2009; 37(9): 641–646.
24. Ajit D, Gavas S, Jagtap S, Chinoy RF. Cytodiagnostic problems in cervicovaginal smears from symptomatic breast cancer patients on tamoxifen therapy. Acta Cytol 2009; 53(4): 383–388.
25. Galliano GE, Moatamed NA, Lee S, et al. Reflex high risk HPV testing in atypical squamous cells, cannot exclude high grade intraepithelial lesion: a large institution’s experience with the significance of this often ordered test. Acta Cytol 2011; 55(2): 167–172.
26. Anschau F, Guimarčes Gonćalves MA. Discordance between cytology and biopsy histology of the cervix: what to consider and what to do. Acta Cytol 2011; 55(2): 158–162.
27. http://www.cervix.cz/
28. Bergeron C. With the same terminology: where and why will there still be differences in rates? 35th European Congress of Cytology, Lisboa 2009. Cytopathology 2009; Suppl.1 : 1.
29. https://www.cms.gov/CLIA/downloads/CMS-2252-P.pdf
30. https://www.cms.gov/CLIA/downloads/Informational_Supplement.pdf
31. http://www.cancerscreening.nhs.uk/cervical/publications/nhscsp15-version4.pdf
Štítky
Patologie Soudní lékařství Toxikologie
Článek Prekancerózní léze vulvyČlánek Gynekologické prekancerózyČlánek PULMOPATOLOGIEČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek UROPATOLOGIEČlánek NEUROPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie

2012 Číslo 1-
Všechny články tohoto čísla
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Gynekologické prekancerózy
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
- PULMOPATOLOGIE
- JAKÁ JE VAŠE DIAGNÓZA?
- Neuroendokrinní adenom středouší s prorůstáním do zevního zvukovodu
- UROPATOLOGIE
- JAKÁ JE VAŠE DIAGNÓZA? - ODPOVĚĎ
- Některé endoskopické biopsie se dnes od cytoblokových vzorků zase tolik neliší
- Vaginálny myofibroblastóm so žliazkami exprimujúcimi mamárne a prostatické antigeny
- Recidivujúci multifokálny leiomyosarkóm močového mechúra 22 rokov po liečbe bilaterálneho (hereditárneho) retinoblastómu: popis prípadu a prehľad literatúry
- NEUROPATOLOGIE
- Primární neuroendokrinní karcinom jater
- PATOLOGIE ORL OBLASTI, ORTOPEDICKÁ PATOLOGIE, PATOLOGIE GIT...
- PATOLOGIE ORL OBLASTI, ORTOPEDICKÁ PATOLOGIE, PATOLOGIE GIT...
- IN MEMORIAM MUDr. Zdeňku Madákovi
- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Gynekologické prekancerózy z pohledu klinika dnes a zítra
- Prekancerózní léze vulvy
- Co je nového v cytodiagnostice cervikálních prekanceróz?
- Prekancerózy endometria, děložní tuby a ovaria: přehled současné problematiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Revma Focus: Spondyloartritidy
nový kurz
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání








